Beschermende kleding (schorten)
Uitgangsvraag
Wanneer dragen schorten, gedragen als arbo- en/of infectiepreventiemaatregel, bij aan het verkleinen van de kans op de transmissie van micro-organismen via en/of naar medewerkers en (zorggerelateerde) infecties?
Aanbeveling
Draag tenminste een halterschort wanneer kans is op contact met lichaamsvloeistoffen ter bescherming van dienstkleding.
Draag een schort als onderdeel van isolatiemaatregelen. Volg hierbij de richtlijn Isolatie en de pathogeenspecifieke richtlijnen BRMO*, Clostridioides difficile, COVID-19, MRSA, Norovirus*, Scabiës (crustosa)*, Tuberculose- en Virale hemorragische koortsen*.
(* ten tijde van publicatie van de richtlijn PBM zijn deze richtlijnen nog in ontwikkeling).
Overwegingen
Voor- en nadelen van de aanbeveling
In deze uitgangsvraag werd de effectiviteit van het dragen van schorten vergeleken met het niet dragen van schorten op het voorkomen van zorggerelateerde infecties en op de overdracht van micro-organismen.
Hiervoor werden zes studies geïncludeerd (3 meta-analyses, 1 RCT en 2 observationele studies). De studies waren erg heterogeen waardoor het niet mogelijk was om een meta-analyse uit te voeren waarin de resultaten van de zes studies gecombineerd werden. Zo werd onder andere in één meta-analyse een studie geïncludeerd waarin het halterschort werd vergeleken met 2 verschillende schorten met lange mouw. De literatuursamenvatting laat niet duidelijk een toegevoegde waarde zien van het gebruik van schorten om transmissie van micro-organismen te voorkomen. In de geïncludeerde studies die in de kliniek werden uitgevoerd - waarin het ontstaan van kolonisatie of (systemische of lokale) infectie werden beoordeeld - werd het gebruik van schorten (eventueel in combinatie met handschoenen) vergeleken met normale zorg, en niet met het niet gebruiken van schorten. Daarnaast werd ook vaak een bundel van interventies beschreven, waardoor het lastig is om het effect van één individuele interventie te bepalen. Ook kon er geen blindering worden toegepast in de studies. Hierdoor was de overall kwaliteit van het bewijs zeer laag. De uitkomstmaat draagcomfort werd niet beschreven in de geïncludeerde studies.
Voor het dragen van schorten worden weinig tot geen gerandomiseerde studies uitgevoerd waarin het dragen van de beschermingsmiddelen wordt vergeleken met het niet dragen ervan. Hierdoor is het gevonden effect van het dragen van schorten waarschijnlijk kleiner dan het in werkelijkheid is. Waarschijnlijk zullen dit soort studies ook in de toekomst niet uitgevoerd worden i.v.m. de diepgewortelde manier van gebruik om schorten te dragen in situaties waarin contact met lichaamsvloeistof erg aannemelijk is en omdat het onethisch is om onderzoeken zonder schort uit te voeren in situaties die potentieel gevaarlijk zijn voor de zorgmedewerker.
Er zijn verschillende schorten, onder andere katoenen schorten maar ook (spat)waterresistente schorten. De verschillen hiertussen en de normen en eisen waaraan deze schorten moeten voldoen, worden in de module wet en regelgeving beschreven.
De halterschorten zijn vaak van plastic en nemen geen water op. Dat is één van de redenen waarom het halterschort in de gevonden literatuur zorgt voor meer verspreiding van grote druppels (Guo, 2014); deze druipen van het halterschort af. Opgemerkt moet worden dat wanneer grote hoeveelheden vloeistof van het halterschort afdruipt, mogelijk het schoeisel en de vloer bevuilt.
In de neonatale setting heeft het dragen van schorten met lange mouw geen effect op het verminderen van bacteriële kolonisatie van pasgeborenen (Webster, 2003). Echter, er werd vergeleken met ‘de normale situatie’ waarin ook zeer frequent schorten werden gedragen. Ook kon niet worden aangetoond dat het dragen van schorten met lange mouw een effect had op het voorkomen van systemische nosocomiale infecties bij kinderen. Op het ontstaan van gelokaliseerde nosocomiale infecties werd ook geen significant effect gezien. Bij al deze gegevens moet worden aangemerkt dat in de controle-arm toch vaak schorten werden gedragen.
Op de intensive care wordt het dragen van een schort vaak gecombineerd met het dragen van handschoenen (onder andere in contactisolatie). De studie van Harris (2021) vergelijkt het dragen van schorten en handschoenen (S&H) bij alle IC-patiënten met het dragen van S&H alleen bij IC-patiënten met antibioticaresistente bacteriën (patiënten in contactisolatie). De uitkomst was verspreiding van resistente Gram-negatieve bacteriën. Er werd minder verspreiding van deze bacteriën in de S&H-groep gevonden, maar dit was niet significant. Het dragen van schorten en handschoenen bij alle patiënten op de IC geeft daarom geen significante vermindering van verspreiding van resistente Gram-negatieve bacteriën. Echter, er kan niet geconcludeerd worden dat het dragen van S&H bij de risicopatiënten niet effectief is, daar in beide studie-armen bij de risicopatiënten S&H werden gedragen.
Er zijn geen studies verricht bij patiënten op een hematologie- of transplantatieafdeling.
Kosten en middelen
Het dragen van schorten brengt kosten met zich mee. Het is aannemelijk dat personeelsuitval door ziekte wordt verminderd door het dragen van persoonlijke beschermingsmiddelen zoals een schort bij het verzorgen/behandelen van infectieuze patiënten zal opwegen tegen de aanschafkosten van schorten.
Waarden en voorkeuren van patiënten en/ of zorgmedewerkers
Schorten worden voornamelijk gedragen door de zorgmedewerkers waarbij er een kans is op contact met lichaamsvloeistof. Hiermee kan contaminatie van kleding worden voorkomen. Voor de geldende normen en regelgeving wordt verwezen naar de module wet en regelgeving.
Aanvaardbaarheid, haalbaarheid en implementatie van de aanbeveling
Een belangrijke reden voor de zorgmedewerker om een schort te dragen is het beschermen van de kleding tegen lichaamsvloeistof of spetten/spatten. Daarnaast worden schorten gedragen als onderdeel van maatregelen bij patiënten die in isolatie worden verpleegd. Het dragen van schorten brengt meer werk voor de zorgmedewerker met zich mee maar draagt mogelijk bij aan het verlagen van de kans op verspreiding van micro-organismen. Het dragen van schorten bij de genoemde indicaties is reeds algemeen geïmplementeerd in de instellingen. Aandacht voor training en juist gebruik blijft altijd belangrijk.
Randvoorwaarden voor gebruik
- Trek, na gebruik of bij verwisselen, het schort uit door deze voorzichtig binnenste buiten te keren en gelijktijdig op te rollen. Zorg daarbij dat de buitenkant van het schort niet in contact komt met de huid of de omgeving.
- Gebruik een schort taakgebonden, of patiëntgebonden of ruimte gebonden, afhankelijk van de zorgsituatie.
- Verwissel een schort als deze verontreinigd is.
- Pas direct na het uittrekken van het schort handhygiëne toe (zie SRI-richtlijn Handhygiëne).
- Voer wegwerpschorten na gebruik af als afval conform het afvalstoffenbeleid van de instelling, tenzij anders wordt voorgeschreven.
- Verwissel het herbruikbare stoffen schort na gebruik en was deze zo snel mogelijk (richtlijn SRI-richtlijn Linnengoed).
Duurzaamheidsaspecten
Er zijn reeds praktijkvoorbeelden waarbij disposable schorten worden hergebruikt voor isolatiezorg in ziekenhuizen vanuit het oogpunt van duurzaamheid. Zij worden na gebruik machinaal gereinigd. Nadat een schort een vastgesteld aantal keer hergebruikt en gereinigd is, wordt het weggegooid. Het is van belang dat de zorginstelling en de producent van schorten afspraken maken over hergebruik en reinigingsproces (Groene IC, 2022).
Ten tijde van de COVID-19-pandemie zijn persoonlijke beschermingsmiddelen veelvuldig gebruikt. Uit een Engels onderzoek naar de impact van PBM op het milieu blijkt dat de impact groot is geweest. De CO2-voetafdruk van een persoonlijk beschermingsmiddel is vooral afhankelijk van de gebruikte grondstoffen, het productieproces inclusief verpakkingsmaterialen, transport en het afvalverwerkingsproces. Voor schorten gemaakt van polyethyleen geldt dat zij de grootste CO2-voetafdruk geven van alle PBM (905 g CO2e). Dit werd met name veroorzaakt in het productieproces en afvalverwerkingsproces (Rizan 2021).
Rationale van de aanbeveling
Door een gebrek aan goede studies kan niet worden geconcludeerd dat het dragen van schorten bijdraagt aan een vermindering van transmissie van (resistente) micro-organismen. Tevens werd er geen effect gevonden van het dragen van schorten op het ontstaan van systemische infecties. Ook de analyse met betrekking tot kolonisatie met (resistente) micro-organismen en het dragen van schorten op neonatale afdelingen liet geen significant voordeel zien. Wel lijkt de meta-analyse naar het effect van het dragen van schorten op het ontstaan van infecties mogelijk gunstig in het verminderen van gelokaliseerde infectie. De gevonden literatuur beperkt zich tot een vergelijking tussen schorten met lange mouw en halterschorten. Ter voorkoming van overdracht van micro-organismen via kleding is een schort met korte mouw in combinatie met goede handhygiëne mogelijk ook voldoende. Schorten met korte mouw of halterschorten kunnen enkel worden gebruikt ter bescherming van micro-organismen die niet gevaarlijk zijn voor de medewerker. Als het schort gedragen wordt om de medewerker zelf te beschermen is een schort met lange mouw noodzakelijk. De classificatie van schorten is afhankelijk van de handeling en het type micro-organismen (zie module wet en regelgeving, tabel 1.1 en 1.2).
Onderbouwing
Achtergrond
Schorten worden gedragen ter bescherming van de eigen kleding tegen spetten en spatten, en bij diverse isolatievormen waarbij het risico bestaat op verspreiding van micro-organismen via lichaamsvocht. Er bestaan diverse soorten schorten; in de literatuur wordt naast overjassen met lange mouwen (gown) ook gesproken over halterschorten (aprons).
Het doel van deze module is het beschrijven wanneer het gebruik van schorten bijdraagt aan het (doelmatig en kosteneffectief) verkleinen van de kans op transmissie van micro-organismen via en/of naar zorgmedewerkers. Hierbij wordt o.a. aandacht besteed aan indicaties voor gebruik van schorten op basis van de eigenschappen van deze middelen conform wet- en regelgeving.
Er bestaan veel verschillende schorten: deze kunnen worden ingedeeld in halterschorten (aprons), schorten met korte mouw en schorten met lange mouw (gowns). Er zijn verschillende schorten die worden ingezet als PBM. Voor de normen en eisen van schorten wordt verwezen naar de module Wet- en regelgeving.
Het dragen van beschermende kleding op het OK-complex evenals het dragen van deze persoonlijke beschermingsmiddelen om de besmetting met radioactieve of toxische stoffen te voorkomen valt buiten de scope van deze module.
Voor het dragen van persoonlijke beschermingsmiddelen, waaronder schorten, bij de verzorging van een patiënt met virale hemorragische koorts verwijst de werkgroep naar de richtlijn Virale hemorragische koorts. Voor het dragen van beschermende kleding op het OK-complex wordt verwezen naar de richtlijn Infectiepreventie op het OK-complex.
Conclusies / Summary of Findings
|
Very low GRADE |
Transmission of microorganisms
The evidence is very uncertain about the effect of gloves and gowns on transmission of microorganisms when compared no gloves and gowns.
Sources: Alhmidi & Cadnum (2021), Alhmidi & Li (2021), Harris (2021) |
|
Very low GRADE |
The evidence is very uncertain about the effect of gowns on transmission of microorganisms when compared no gowns.
Sources: Webster (2003) |
|
Very low GRADE |
The evidence is very uncertain about the effect of gowns on transmission of microorganisms when compared with aprons.
Sources: Verbeek (2020) |
|
Very low GRADE |
Healthcare-related infections
The evidence is very uncertain about the effect of gowns on healthcare-related infections when compared no gowns.
Sources: Webster (2003); Chang (2019) |
|
No GRADE |
Wearing comfort
There were no studies included that described the outcome measure wearing comfort. |
Samenvatting literatuur
Description of studies
Alhmidi & Cadnum (2021) conducted an observational study and aimed to determine whether the use of gowns adds a substantial benefit over gloves alone in preventing patient-to-patient transfer of a viral DNA surrogate marker. In total, 30 source patients had 1 cauliflower mosaic virus surrogate marker applied to their skin and clothing and a second to their bed rail and bedside table. Personnel caring for the source patients were randomized to wear gloves, gloves plus cover gowns, or no barrier. Interactions with up to 7 subsequent patients were observed, and the percentages of transfer of the DNA markers from patient-to-patient were compared among the 3 groups.
Alhmidi & Li (2021) conducted an observational study in which simulated patient care interactions were performed to evaluate the efficacy of different types of barrier precautions and to identify routes of transmission. In randomly ordered sequence, 30 personnel each performed 3 standardized examinations of mannequins contaminated with pathogen surrogate markers (cauliflower mosaic virus DNA, bacteriophage MS2, nontoxigenic Clostridioides difficile spores, and fluorescent tracer) while wearing no barriers, gloves, or gloves plus gowns followed by examination of a noncontaminated mannequin. The percentages of transfer of the DNA markers from patient-to-patient were compared among the 3 groups.
Harris (2021) conducted a randomized trial to study the effect of universal glove and gown use on the acquisition of antibiotic-resistant gram-negative bacteria. This was a secondary analysis of a randomized trial in 20 hospital intensive care units (BUGG study). ICUs were randomized to either the intervention or control arm. During the baseline period, all ICUs followed their usual standard of care, which consisted of healthcare workers following CDC contact precautions guidelines (gloves and gowns) for patients known to have antibiotic-resistant bacteria such as VRE and MRSA. After the baseline period, ICUs were randomized, and during the study period, all healthcare workers (nurses, physicians, respiratory therapists, etc.) in the 10 ICUs assigned to the intervention arm were required to wear gloves and gowns for all patient contact and when entering any patient room. The 10 control ICUs followed their usual standard of care during the study period. All patients had ICU admission and ICU discharge perianal cultures. The primary outcome was acquisition of either carbapenem-resistant Pseudomonas aeruginosa, carbapenem resistant A. baumannii, ESBL-producing Enterobacteriaceae, or CPE as a composite of any antibiotic-resistant gram-negative bacteria based on surveillance cultures. A total of 40 492 admission and discharge perianal swabs from 20 246 individual patient admissions were included. Compliance with wearing gloves in the intervention ICUs was 86.18% (2787 of 3234), and compliance with gowns was 85.14% (2750 of 3230). In the control group, 10.52% of patients were on contact precautions. In the control ICUs, for patients on contact precautions, compliance with wearing gloves was 84.11% (556 of 661) and compliance with gowns was 81.21% (536 of 660).
Verbeek (2020) conducted a Cochrane review to evaluate which type of full-body PPE and which method of donning or doffing PPE have the least risk of contamination or infection for healthcare workers, and which training methods increase compliance with PPE protocols CENTRAL, MEDLINE, Embase and CINAHL were searched until 20 March 2020. All controlled studies that evaluated the effect of full-body PPE used by health care workers exposed to highly infectious diseases, on the risk of infection, contamination, or noncompliance with protocols were included. Earlier versions of this review were published in 2016 and 2019. In this update, the authors included 24 studies with 2278 participants, of which 14 were randomised controlled trials (RCT), one was a quasi-RCT and nine had a non-randomised design. Eight studies compared types of PPE. Six studies evaluated adapted PPE. Eighteen studies used simulated exposure with fluorescent markers or harmless microbes. In simulation studies, median contamination rates were 25% for the intervention and 67% for the control groups.
Chang (2019) conducted a systematic review and meta-analysis to study the effect of universal gloving on healthcare-associated infections (HAIs). A systematic search of Ovid MEDLINE, Cochrane Library, Web of Science, EMBASE, and ClinicalTrials.gov was conducted in July 2018. Studies were included if they met the following criteria: (1) healthcare-associated infection was the reported outcome (including but not limited to MRSA, VRE, C. difficile), (2) the intervention being studied included universal gloving during patient care for all patients on that unit regardless of colonization or infection, (3) the study was either a randomized controlled trial, a nonrandomized quasi-experimental study, or an observational study. Studies were excluded if the investigators did not distinguish between universal gloving in the intervention group versus the control group (e.g, having universal gloving in both groups), and all studies concerning interventions implemented because of outbreaks were excluded. Eight studies were included in review (4 RCTs, 4 before-and-after quasi-experimental studies). Four studies described the use of gloves only as an intervention, two studies gloves and gown combined and two studies a larger bundle of interventions. Three studies reported the incidence of MRSA and vancomycin-resistant enterococci (VRE) only, two reported the incidence of MRSA, VRE, and an additional infection type, and the remaining 3 studies reported the incidence of all HAIs.
Webster (2003) conducted a Cochrane review to assess the effects of the wearing of an overgown by attendants and visitors on the incidence of infection and death in infants in newborn nurseries. (CENTRAL, The Cochrane Library, Issue 1, 2009), MEDLINE (1950 – January 2009), Embase (1950 – January 2009) and CINAHL (1982 – January 2009) were searched until December 2010. The review includes all published trials using random or quasi-random patient allocation, in which overgowns worn by attendants or visitors were compared with no overgowns worn by attendants or visitors. Eight trials were included, reporting outcomes for 3,811 infants. No trials of visitor gowning were found. The included studies vary in definition of ‘no gown’, however, in most studies’ healthcare workers (and visitors) wore gowns for handling the infant or for performing high risk procedures in the no gown group. It is unclear if gowns were implemented as a stand-alone intervention or if they were combined with other interventions such as gloves. Trial quality varied, with only two assessed as being of good quality.
Results
Because of large heterogeneity (comparisons, settings, definition of outcome measures), between the included studies a meta-analysis could not be performed, and the results of the included studies are described separately.
Transmission of microorganism
Comparison gloves and gowns versus no gloves and gowns
Alhmidi & Cadnum (2021) compared the use of gloves and gowns combined with no barrier in preventing patient-to-patient transfer of a viral DNA surrogate marker. In comparison to the no-barrier group (57.8% transfer), transfer of 1 or both markers occurred less often in the gloves-plus-gown group (25.9%; OR=0.10; P = 0.002).
The frequency of contamination of personnel hands and clothing was higher in the no-barrier group (19 of 29 personnel assessed, 65.5%) than in the gloves plus-gown group (13 of 27 personnel assessed, 48.1%), but the differences were not statistically significant (P > 0.05).
Alhmidi & Li (2021) compared the use of gloves-plus-gown with no barrier to detect routes of transmission of a surrogate marker performing examinations on mannequins. Transfer by hands occurred in a smaller proportion of observations in the gloves-plus-gown group (OR=0.06; P = 0.002) versus the no-barriers group. In comparison to the no-barriers group, transfer by stethoscopes was significantly lower in the gloves-plus-gown group (OR=0.14; P = .005). Stethoscope transfer occurred very frequently when no barriers were worn (30% for C. difficile spores, 47% for MS2, and 66% for fluorescent marker), stethoscope transfer also occurred ≥17% of the time for C. difficile spores and MS2 and ≥33% for fluorescent marker when gloves plus gowns were worn.
Two of 30 participants (6.7%) transferred at least 1 marker to the environment in the glove-plus-gown group versus 19 of 30 subjects (63.3%) in the no-barrier group (significantly lower).
Harris (2021) compared universal gloving and gowning as an intervention bundle to standard care on the acquisition of any antibiotic-resistant gram-negative bacteria in a randomized controlled trial. Universal gloving and gowning showed a decrease in acquisition of any antibiotic-resistant gram-negative bacteria (RR= 0.90; 95% CI 0.71 to 1.12; P = 0.34) and a rate difference (RD) of −2.1 (95% CI –5.9 to 1.7; P = 0.34).
Effects on each individual bacteria acquisition were: carbapenem-resistant Enterobacteriaceae (RR,=0.86; 95% CI, 0.60 to 1.24; P = 0.43), carbapenem resistant Acinetobacter (RR, 0.81; 95% CI 0.52 to 1.27; P = 0.36), carbapenem-resistant Pseudomonas (RR, 0.88; 95% CI 0.55 to 1.42; P = 0.62), and extended-spectrum β-lactamase–producing bacteria (RR, 0.94; 95% CI 0.71 to1.24); P = 0.67).
Comparison gowns versus aprons
Verbeek (2020) compared the use of gowns versus aprons. One study including 50 participants compared the use of gowns vs aprons using a marker virus and measured the number of contamination spots after doffing. For CDC-recommended doffing, the mean contamination with marker in the apron group was 1.88 small patches (<1cm2) and 0.62 lower (1.75 lower to 0.51 higher) in the gown group (figure 1). For large patches, the mean contamination with the marker in the apron group was 5 and in the gown group 0.14 (mean difference (MD)= -4.86; 95%CI -6.51 to -3.21). Figure 3.1 and shows the results of this study for the individual contamination spots.
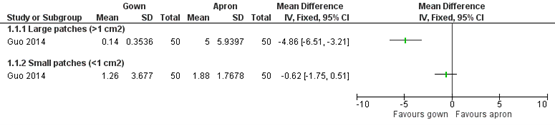
Figure 3.1: CDC-recommended doffing gown versus apron
Healthcare-related infections
Comparison gowns vs no gowns
Webster (2003) conducted a meta-analysis to compare wearing gowns versus no gown on the occurrence of nosocomial colonization infants in new-born nurseries. Two of the trials limited their investigation to staphylococcal carriage and one to methicillin resistant Staphylococcus aureus carriage (MRSA).
Nasal colonisation: Five studies were included in the meta-analysis. 264 Patients in the no gown group (47.40%) acquired nasal colonization and 275 (48.33%) in the gown group. There was no significant difference between both groups. The RR was 0.98 (95% CI 0.88 to 1.09) in favour of no gown. No heterogeneity was found (I2= 0%).
Umbilical colonization: Five studies were included in the meta-analysis. 341 Patients in the no gown group (61.78%) acquired umbilical colonization and 339 (60.11%) in the gown group. No significant difference was found between the no gown and gown group. The RR was 1.01 (95% CI 0.93 to 1.10) in favour of gown.
Eye colonisation: One study collected data on eye colonisation. Seventy-three patients in the no gown group (92.41%) acquired eye colonization and 76 (95%) in the gown group. No significant difference was found between the no gown and gown group. The RR was 0.97 (95% CI 0.90 to 1.05) in favour of no gowns.
Groin colonization: One collected data on groin colonisation. Thirty patients in the no gown group (32.26%) acquired groin colonization and 33 (30.84%) in the gown group. No significant difference was found between the no gown and gown group. The RR was 1.05 (95% CI 0.69 to 1.5) in favour of gowns.
Comparison gowns vs no gowns
Webster (2003) conducted a meta-analysis to compare wearing gowns versus no gown on the occurrence of systemic nosocomial infections and localized nosocomial infections in infants. The included studies vary in definition of ‘no gown’, however in most studies’ healthcare workers (and visitors) wore gowns for handling the infant or high-risk procedures in the no gown group.
Systemic nosocomial infection
Four studies were included in the meta-analysis on systemic infection (septicaemia, meningitis, necrotizing enterocolitis, pneumonia). Twenty-nine patients (1.46%) in the no gown group acquired a systemic nosocomial infection and 31 (1.56%) in the gown group. The meta-analysis found no significant effect on systemic nosocomial infection. The RR was 0.95 (95% CI 0.40 to 2.23) in favour of no gown (Figure 3.2). Substantial heterogeneity was found (I2= 57.1%).
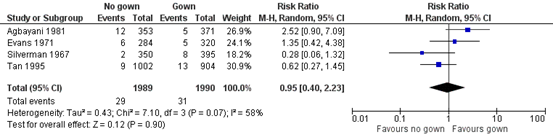
Figure 3.2: Meta-analysis gown versus no gown systematic nosocomial infection. Pooled risk ratio, random effects model.
Localised nosocomial infection
Four trials reported information on localised nosocomial infection. Seventy patients (7.42%) in the no gown group acquired a localised nosocomial infection and 59 (5.88%) in the gown group. The overall estimate for the four studies showed no significant effect. The RR was 1.24 (95% CI 0.90 to 1.71) in favour of gown (Figure 3.3).
No heterogeneity was found (I2= 0%).
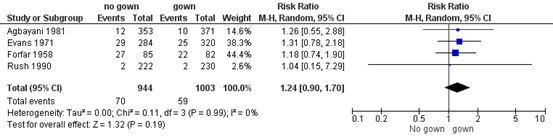
Figure 3.3: Meta-analysis gown versus no gown localised nosocomial infection. systematic nosocomial infection. Pooled risk ratio, random effects model.
Comparison gloves and gowns versus no gloves and gowns
Chang (2019) conducted a meta-analysis including four studies to compare an intervention bundle (including universal gloving and gowns) with standard care on healthcare-associated infections. The pooled results of the 4 studies did not show a statistically significant effect on the incidence of healthcare-associated infections. The Incidence rate ratio (IRR) was 0.95 (95% CI 0.86 to 1.05) in favour of the intervention bundle. The results of the individual studies or a forest plot were not available.
Wearing comfort
There were no studies included that described the outcome measure wearing comfort.
Level of evidence of the literature
Transmission of microorganisms
Comparison gloves and gowns versus no gloves and gowns
The level of evidence regarding the outcome measure transmission of microorganisms started at low (observational studies) and was downgraded by 2 levels because applicability (-1; bias due to indirectness: marker virus and/or mannequin) and number of included patients (-1: imprecision) to very low.
Comparison gowns versus no gowns
The level of evidence regarding the outcome measure transmission of microorganisms was downgraded by 3 levels because of study limitations (-1; risk of bias: no blinding) applicability (-1; bias due to indirectness: in the no gown group gowns were worn for high-risk procedures or handling the infant); number of included patients (-1; imprecision) to very low.
Comparison gowns versus apron
The level of evidence regarding the outcome measure transmission of microorganisms for the comparison gowns versus aprons started at high and was downgraded by 3 levels because of study limitations (risk of bias); applicability (bias due to indirectness because a marker virus was used); number of included patients (imprecision; only one study included) to very low.
Healthcare-related infections
Comparison gowns versus no gowns
The level of evidence regarding the outcome measure transmission of microorganisms was downgraded by 3 levels because of study limitations (-1; risk of bias: no blinding) applicability (-1; bias due to indirectness: in the no gown group gowns were worn for high-risk procedures or handling the infant); number of included patients (-1; imprecision) to very low.
Wearing comfort
There were no studies included that described the outcome measure wearing comfort.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
When does wearing gloves or gowns provide added value in limiting the chance of transmitting health care related infections via and/or to health care workers?
P: Healthcare workers, or visitors
I: Gown (gown or apron)
C: No gown (standard care, or gown A vs gown B)
O: Transmission of microorganisms (transmission to healthcare worker, transmission from patient to patient, contamination of clothing with microorganisms) healthcare-related infections, wearing comfort.
Relevant outcome measures
The guideline development group considered prevention of transmission of microorganisms and healthcare-related infections as a critical outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the GRADE-standard limit of 25% difference for dichotomous outcomes (RR < 0.8 or > 1.25), and 10% for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (methods)
The databases Embase, Ovid/Medline and Cinahl were searched with relevant search terms from 2014 until 18-5-2022. For this guideline, all PICOs for different types of PPE were taken together in one search. For gowns, the Cochrane review of Verbeek (2020) was used as the basis and observational studies on gowns were added from 2019 onwards. The detailed search strategy is available on request (info@sri-richtlijnen.nl). The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 671 hits. Studies were selected based on the following criteria: reporting on personal protective equipment (PPE) and its role in transmission of microorganisms. Studies regarding the operating room were excluded since these issues are addressed in the SRI guideline “Infectiepreventie op het OK complex”. For gloves and gowns, nine studies were initially selected based on title and abstract screening. After reading the full text four studies were excluded (see the table with reasons for exclusion under the tab Methods) and five studies were included. Together with the Cochrane review of Verbeek, six studies were included in the analysis of the literature (Alhmidi & Cadnum 2021; Alhmidi & Li, 2021; Harris, 2021; Verbeek 2020; Chang, 2019; Webster, 2003).
Results
Six studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables. The summary of literature, results and evidence tables are included below.
Referenties
- Alhmidi H, Cadnum JL, Ng-Wong YK, Jencson AL, Wilson BM, Donskey CJ. Effectiveness of barrier precautions for prevention of patient-to-patient transfer of a viral DNA surrogate marker. Infect Control Hosp Epidemiol. 2021 Sep;42(9):1031-1036. doi: 10.1017/ice.2020.1363. Epub 2020 Dec 17. PMID: 33327985.
- Alhmidi H, Li DF, Cadnum JL, Haq MF, Pinto-Herrera NC, Wilson BM, Donskey CJ. Use of simulations to evaluate the effectiveness of barrier precautions to prevent patient-to-patient transfer of healthcare-associated pathogens. Infect Control Hosp Epidemiol. 2021 Apr;42(4):425-430. doi: 10.1017/ice.2020.1215. Epub 2020 Oct 12. PMID: 33040741.
- Chang NN, Kates AE, Ward MA, Kiscaden EJ, Reisinger HS, Perencevich EN, Schweizer ML; CDC Prevention Epicenters Program. Association between universal gloving and healthcare-associated infections: A systematic literature review and meta-analysis. Infect Control Hosp Epidemiol. 2019 Jul;40(7):755-760. doi: 10.1017/ice.2019.123. Epub 2019 May 17. PMID: 31099327.
- Guo YP, Li Y, Wong PL. Environment and body contamination: a comparison of two different removal methods in three types of personal protective clothing. Am J Infect Control. 2014 Apr;42(4):e39-45. doi: 10.1016/j.ajic.2013.12.021. PMID: 24679582; PMCID: PMC7115291.
- Harris AD, Morgan DJ, Pineles L, Magder L, O'Hara LM, Johnson JK. Acquisition of Antibiotic-Resistant Gram-negative Bacteria in the Benefits of Universal Glove and Gown (BUGG) Cluster Randomized Trial. Clin Infect Dis. 2021 Feb 1;72(3):431-437. doi: 10.1093/cid/ciaa071. PMID: 31970393; PMCID: PMC7850534.
- Rizan C, Reed M, Bhutta MF. Environmental impact of personal protective equipment distributed for use by health and social care services in England in the first six months of the COVID-19 pandemic. J R Soc Med. 2021 May;114(5):250-263. doi: 10.1177/01410768211001583. Epub 2021 Mar 16. PMID: 33726611; PMCID: PMC8150566.
- Verbeek JH, Rajamaki B, Ijaz S, Sauni R, Toomey E, Blackwood B, Tikka C, Ruotsalainen JH, Kilinc Balci FS. Personal protective equipment for preventing highly infectious diseases due to exposure to contaminated body fluids in healthcare staff. Cochrane Database Syst Rev. 2020 Apr 15;4(4):CD011621. doi: 10.1002/14651858.CD011621.pub4. Update in: Cochrane Database Syst Rev. 2020 May 15;5:CD011621. PMID: 32293717; PMCID: PMC7158881.
- Webster J, Pritchard MA. Gowning by attendants and visitors in newborn nurseries for prevention of neonatal morbidity and mortality. Cochrane Database Syst Rev. 2003;2003(3):CD003670. doi: 10.1002/14651858.CD003670. PMID: 12917980; PMCID: PMC7026773.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Alhmidi & Cadnum (2021) |
Type of study: observational Setting and country: medical-surgical ward, USA Funding and conflicts of interest: funded by Centers for Disease Control and Prevention Conflicts of interest: no |
Inclusion criteria: Exclusion criteria: N total at baseline: Important prognostic factors: Groups comparable at baseline? |
Describe intervention (treatment / procedure / test): In total, 30 source patients had 1 cauliflower mosaic virus surrogate marker applied to their skin and clothing and a second to their bed rail and bedside table. Personnel caring for the source patients were randomized to wear: |
Describe control (treatment / procedure / test): No barrier |
Length of follow-up: |
Outcome measures and effect size (include 95%CI and p-value if available): No barrier Gloves Gloves plus gown |
|
|
Alhmidi & Li (2021) |
Type of study: observational Setting and country: Funding and conflicts of interest: |
Inclusion criteria: Exclusion criteria: N total at baseline: |
Describe intervention (treatment / procedure / test): personnel each performed 3 standardized examinations of mannequins contaminated with pathogen surrogate markers while wearing: |
Describe control (treatment / procedure / test): personnel each performed 3 standardized examinations of mannequins contaminated with pathogen surrogate markers while wearing no barriers |
Length of follow-up: Loss-to-follow-up: Incomplete outcome data: |
Outcome measures and effect size (include 95%CI and p-value if available): Transfer by hands Transfer by stethoscope: To environment |
|
|
Harris (2021) |
Type of study: RCT (cluster randomized) Setting and country: intensive care unit, USA Funding and conflicts of interest: AHRQ |
Inclusion criteria: Exclusion criteria: N total at baseline: Important prognostic factors: |
Describe intervention (treatment / procedure / test): All healthcare workers were required to wear gloves and gowns for all patient contact and when entering any patient room |
Describe control (treatment / procedure / test): Usual care |
Length of follow-up: Loss-to-follow-up: Incomplete outcome data: |
Outcome measures and effect size (include 95%CI and p-value if available): acquisition of any antibiotic-resistant gram-negative bacteria: RR 0.90 (95% CI, .71–1.12; P = .34) carbapenem-resistant Enterobacteriaceae RR, 0.86 [95% CI, .60–1.24; P = .43 carbapenemresistant Acinetobacter RR, 0.81 [95% CI, .52–1.27; P = .36 carbapenem-resistant Pseudomonas RR, 0.88 [95% CI, .55–1.42]; P = .62 extended-spectrum β-lactamase–producing bacteria (RR, 0.94 [95% CI, .71–1.24]; P = 0.67). |
|
|
Chang (2019) |
See paper |
|
|
|
|
|
|
|
Webster (2015) |
See paper |
|
|
|
|
|
|
Exclusie-tabel
|
Author and year |
Reason for exclusion |
|
Williams Williams C, McGraw P, Schneck EE, LaFae A, Jacob JT, Moreno D, Reyes K, Cubillos GF, Kett DH, Estrella R, Morgan DJ, Harris AD, Drees M. Impact of universal gowning and gloving on health care worker clothing contamination. Infect Control Hosp Epidemiol. 2015 Apr;36(4):431-7. doi: 10.1017/ice.2014.75. PMID: 25782898. |
Wrong design (survey study), self-reported |
|
Tian C, Lovrics O, Vaisman A, Chin KJ, Tomlinson G, Lee Y, Englesakis M, Parotto M, Singh M. Risk factors and protective measures for healthcare worker infection during highly infectious viral respiratory epidemics: A systematic review and meta-analysis. Infect Control Hosp Epidemiol. 2022 May;43(5):639-650. doi: 10.1017/ice.2021.18. Epub 2021 Jan 25. PMID: 33487203; PMCID: PMC8564050. |
I and C does not meet PICO |
|
Picheansanthian W, Chotibang J. Glove utilization in the prevention of cross transmission: a systematic review. JBI Database System Rev Implement Rep. 2015 May 15;13(4):188-230. doi: 10.11124/jbisrir-2015-1817. PMID: 26447080. |
Wrong study type (Narrative review) |
|
Lydecker AD, Osei PA, Pineles L, Johnson JK, Meisel J, Stine OC, Magder L, Gurses AP, Hebden J, Oruc C, Mody L, Jacobs Slifka K, Stone ND, Roghmann MC. Targeted gown and glove use to prevent Staphylococcus aureus acquisition in community-based nursing homes: A pilot study. Infect Control Hosp Epidemiol. 2021 Apr;42(4):448-454. doi: 10.1017/ice.2020.1219. Epub 2020 Oct 20. PMID: 33077004; PMCID: PMC8515480. |
I and C does not meet PICO |
Risk-of-bias-tabel
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference (first author, publication year) |
Was the allocation sequence adequately generated? Definitely yes |
Was the allocation adequately concealed? Definitely yes |
Blinding: Was knowledge of the allocated interventions adequately prevented? Were patients blinded? Definitely yes |
Was loss to follow-up (missing outcome data) infrequent? Definitely yes |
Are reports of the study free of selective outcome reporting? Definitely yes |
Was the study apparently free of other problems that could put it at a risk of bias? Definitely yes |
Overall risk of bias If applicable/necessary, per outcome measure LOW |
|
Harris (2021) |
Definitely yes Reason: Computer-generated sequence was used |
No information |
Definitely no Reason: healthcare workers and patients were not blinded |
No information |
Definitely yes Reason: All relevant outcomes were reported |
Definitely yes Reason: No other problems noted |
LOW (transmission of microorganisms) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-11-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule is ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en is gefinancierd door het ministerie van VWS. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep samengesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep).
De werkgroep bestaat uit:
- Dr. M.S.L. Liem (voorzitter), chirurg, Nederlandse Vereniging voor Heelkunde (NVvH)
- Dr. S.J. Vainio, arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dr. H.F. Wunderink, arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dr. K.E. Veldkamp, arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dr. J.M.T. Klein Gunnewiek, klinisch chemicus, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC)
- Dr. A.M.L. Oude Lashof, internist-infectioloog, Nederlandse Vereniging van Internist-Infectiologen (NIV/NVII)
- Dr. J. Honings, KNO-arts/Hoofd-hals chirurg, Nederlandse Vereniging voor KNO-heelkunde (NVKNO)
- Dr. L.A.M. Bruijstens, anesthesioloog, Nederlandse Vereniging voor Anesthesiologen (NVA)
- M. den Otter, Verpleegkundig specialist, Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Drs. A. Harteloh-Schepers, Specialist Ouderengeneeskunde, Verenso(t/m juli 2022)
- Drs. D.C.M. aan de Stegge. Specialist Ouderengeneeskunde, Verenso(vanaf oktober 2022)
- Drs. K. Weijdema, deskundige infectiepreventie, Rijksinstituut voor Volksgezondheid en Milieu (RIVM)
- Dr. H. Ruijs, arts maatschappij en gezondheid, Rijksinstituut voor Volksgezondheid en Milieu (RIVM)
- G. Stoffer BSc, deskundige infectiepreventie, Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg (VHIG)
- Ing. E. de Bruijne, deskundige infectiepreventie, Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg (VHIG)
- Drs. R.J. Naber, bedrijfsarts, Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- J. Luijten, arbeidshygiënist, Nederlandse Vereniging voor Arbeidshygiëne (NVvA)
Met ondersteuning van:
- Dr. I. van Dusseldorp, literatuurspecialist, Kennisinstituut van Federatie Medisch Specialisten
- Dr. E. Belfroid, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A.E. Sussenbach, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- A. Eikelenboom-Boskamp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.J. Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. H. Graveland, senior adviseur, Kennisinstituut van Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard dat zij in de laatste drie jaar wel/geen directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. M.S.L. Liem |
chirurg, Medisch manager operatie-kamers, MST - Enschede |
SKMS beoordelingen kwaliteitsprojecten (vacatie-gelden). Penningmeester DLSG (onbetaald). Richtlijn commissie NVvH (tot 1 jan. 2022 – onbetaald). Wetenschappelijke cie, DHBA (onbetaald; soms vacatiegelden) |
geen |
Geen actie vereist |
|
Dr. S.J. Vainio |
arts-microbioloog (medisch specialist niet in loondienst), St Antonius Ziekenhuis |
geen |
geen |
Geen actie vereist |
|
Dr. H.F. Wunderink |
arts-microbioloog, UMCU |
geen |
geen |
Geen actie vereist |
|
Dr. K.E. Veldkamp |
arts-microbioloog, hoofd eenheid Infectiepreventie en voorzitter Infectie-commissie LUMC |
Voorzitter werkgroep Hygiëne en Infectiepreventie van de NVMM – onbetaald. Lid algemene visitatiecommissie Medische Microbiologie van de NVMM – onbetaald (m.u.v. vacatiegelden voor visitaties). OMT COVID-19, RIVM –vacatiegelden. |
geen |
Geen actie vereist |
|
Dr. J.M.T. Klein Gunnewiek |
senior adviseur bij Zorgverzekeraars Nederland |
Extern auditor bij de Raad van Accreditatie (ISO 15189). |
geen |
Geen actie vereist |
|
Dr. A.M.L. Oude Lashof |
internist-infectioloog Maastricht UMC+ |
geen |
geen |
Geen actie vereist |
|
Dr. J. Honnigs |
KNO-arts / hoofd-hals chirurg Radboud UMC |
geen |
geen |
Geen actie vereist |
|
Dr. L.A.M. Bruijstens |
anesthesioloog, Radboud UMC |
geen |
geen |
Geen actie vereist |
|
M. den Otter |
verpleegkundig specialist AGZ, St Jansdal ziekenhuis |
V&VN VS bestuur, vacatieregeling |
geen |
Geen actie vereist |
|
Drs. A. Harteloh-Schepers |
Specialist ouderengeneeskunde bij Archipelzorggroep |
RCT lid Rezisto |
geen |
Geen actie vereist |
|
Drs. D.C.M. aan de Stegge |
Werkgever: Beweging 3.0 te Amersfoort. Specialist Ouderengeneeskunde |
geen |
geen |
Geen actie vereist |
|
Drs. K. Weijdema |
deskundige infectiepreventie SRI namens RIVM en LCI |
Lid Green Team infectiepreventie NL |
geen |
Geen actie vereist |
|
Dr. H. Ruijs |
arts maatschappij en gezondheid/Infectieziektebestrijding RIVM, Centrum Infectieziektebestrijding |
geen |
geen |
Geen actie vereist |
|
G. Stoffer BSc |
Deskundige infectiepreventie |
Lid KRIZ commissie |
geen |
Geen actie vereist |
|
Ing. E. de Bruijne |
Deskundige infectiepreventie |
geen |
geen |
Geen actie vereist |
|
Drs. R.J. Naber |
Bedrijfsarts, arbodienst Amsterdam UMC |
Secretaris NVAB werkgroep BaZ. Lid NVAB commissie richtlijnontwikkeling en wetenschap. Lid NVAB commissie Intercollegiale toetsing en deskundigheidsbevordering. |
geen |
Geen actie vereist |
|
J. Luijten |
Arbeidshygiënist en Veiligheidskundige. Werkgever: Isala Zwolle
|
Werkzaam als Arbeidshygiënist en Veiligheidskundige bij de interne arbodienst van Isala in Zwolle. Dit betreft mijn hoofdwerkzaamheden (fulltime) en is een betaalde functie. |
geen |
Geen actie vereist |
Inbreng patiëntenperspectief
Met het uitnodigen van Patiëntfederatie Nederland (PFNL) voor de invitational conference is aandacht besteed aan het patiëntenperspectief. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan PFNL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz en kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wet kwaliteit, klachten en geschillen zorg (Wkkgz). Bij de richtlijn is conform de Wkkgz een kwalitatieve raming uitgevoerd van mogelijke substantiële gevolgen van de aanbevelingen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module wet- en regelgeving |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar is (zijn) (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module handschoenen |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar is (zijn) (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module beschermende kleding (schorten) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module (chirurgische) mondneusmaskers en ademhalingsbeschermingsmaskers |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module pasvormtest (fittest) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module oogbescherming |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module beschermende hoofdbedekking |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module overschoenen en laarzen |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er wordt geen toename in voltijdsequivalenten dan wel opleidingsniveau verwacht. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg met betrekking tot persoonlijke beschermingsmiddelen. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnen ‘Persoonlijke beschermingsmiddelen ziekenhuizen’, ‘Persoonlijke beschermingsmiddelen revalidatiecentra’ en ‘Persoonlijke beschermingsmiddelen verpleeghuizen, woonzorgcentra en voorzieningen voor kleinschalig wonen’ op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door SVN, NVP, ActiZ, NOG, IGJ, NVAVG, VGN, NVDV, NVIC en NVR via de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep conceptuitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid waarin de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
er is hoge zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; het is zeer onwaarschijnlijk dat de literatuurconclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Redelijk |
er is redelijke zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; het is mogelijk dat de conclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Laag |
er is lage zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; er is een reële kans dat de conclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Zeer laag |
er is zeer lage zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; de literatuurconclusie is zeer onzeker. |
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet een-op-een vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert-opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van de aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zou de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Formuleren van kennislacunes
Tijdens de ontwikkeling van de richtlijn Persoonlijke beschermingsmiddelen is systematisch gezocht naar onderzoeksbevindingen die nuttig kunnen zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat er nog kennislacunes bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk. Om deze reden heeft de werkgroep per module aangegeven waar wetenschappelijke kennis beperkt is en dus op welke vlakken nader onderzoek gewenst is.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule is aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S,Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
