Mesh voor behandeling rectumprolaps door LVR
Uitgangsvraag
Welk materiaal (type mesh) dient gebruikt te worden bij een laparoscopische ventrale rectopexie?
Aanbeveling
Plaats bij voorkeur een polypropyleen mesh.
Overwegingen
Tijdens de literatuuranalyse om deze uitgangsvraag te beantwoorden bleek er weinig kwalitatief goed vergelijkend onderzoek beschikbaar voor de materiaalkeuze. Ten aanzien van de kans op inkapseling en krimpen van het materiaal zijn er overwegend dierexperimentele onderzoeken gedaan. Er zijn zeer weinig onderzoeken bekend waar specifiek de materiaalkeuze onderzocht wordt bij een LVR en littekenbreuken.
Op dit moment zijn er meer dan 70 verschillende soorten meshes op de markt. zij kunnen onderverdeeld worden in de grootte van de mazen, soort materiaal, hoeveelheid materiaal/gewicht en compositie van de materialen (Eriksen, 2007).
Soort materiaal
Een biologisch mesh is opgebouwd uit acellulair materiaal van dierlijk of menselijk collageen. Er worden 3 basis synthetische materialen gebruikt: polypropyleen(PP), polyester(PE) en expanded polytetrafluoroethyleen (ePTFE). Het matje kan ook opgebouwd zijn uit deels oplosbaar materiaal en deels onoplosbaar materiaal (meestal PP).
Composities
Composities met geoxideerd atelocollageen type 1, glycerol, glycerol ethyleen en titanium coated polypropyleen worden in principe intra peritoneaal gebruikt tegen viscerale adhesies. Het is niet gebruikelijk dat deze bij een LVR wordt toegepast aangezien het peritoneum bij deze operatie gesloten wordt.
Grootte van mazen
Het wordt over het algemeen aangenomen vanuit dierexperimenteel onderzoek dat meshes met grote mazen (>75µ) beter zouden ingroeien en minder ingekapseld zouden worden. Daarentegen zouden meshes met kleinere mazen minder adhesies geven.
Hoeveelheid van materiaal/gewicht
Een standaard mesh van PP of PE heeft normaal gesproken een veel sterkere trekkracht dat fysiologisch gezien nodig is. Om meer flexibiliteit van de mesh en minder reactie van het weefsel te bewerkstelligen is in 1998 de lichtgewicht mesh geïntroduceerd. Lichtgewicht meshes kunnen absoluut gezien uit minder materiaal opgebouwd zijn (tot 30%) maar de winst in verlies van gewicht wordt bij de meeste lichtgewicht meshes voornamelijk dan wel alleen veroorzaakt door grotere mazen.
De ideale mesh voor de LVR bestaat uit materiaal dat niet carcinogeen is, chemisch inactief, een lage infectiekans heeft, geen overgevoeligheid of allergische reactie geeft en niet te veel verandert als hij in contact komt met weefsel en bijvoorbeeld gaat krimpen. Er is niet of nauwelijks bewijskracht uit de literatuur wat betreft veiligheid en effectiviteit voor een bepaalde materiaalkeuze zoals PP, PE, ePTFE of biologisch. Uit experimentele studies is gebleken dat PP superieur is als het gaat om ingroei in het weefsel.
Mede door het gemis aan bewijskracht is in 2013 de consensus of panel of experts (Mercer-Jones, 2014) opgesteld. Zij hebben ook uitspraken gedaan over de mesh-keuze en zich uitgelaten over de keuze voor een biologische mesh. Er zijn op dit moment voornamelijk korte termijn resultaten in de literatuur bekend van de resultaten na een LVR met biologische mesh. Het panel of experts (Mercer-Jones, 2014) adviseert in sommige gevallen (zoals bijvoorbeeld bij patiënten met een jonge leeftijd, rokers, diabetes, bestraling in de voorgeschiedenis) een biologisch mesh te gebruiken. De werkgroep heeft de ervaring dat biologisch meshes tot recidieven leidt, hiervoor zijn ook summier aanwijzingen in de literatuur (Sileri, 2012; Badrek-Amoundi, 2012).
Het panel of experts gaf een Titaniumcoated lichtgewicht mesh de voorkeur voor een LVR.
Ze baseren zich naast hun expert opinion naar alle waarschijnlijkheid hoofdzakelijk op de studie van Evans die kort na de consensus via een posterpresentatie in 2014 in Birmingham voor het eerst openbaar gemaakt is door enkelen van hen als coauteur (Evans, 2015), waarbij het lijkt dat deze mesh de minste kans op erosie geeft. 6,4% Erosie na een LVR met PE mesh in plaats van 1,7% erosie na een LVR met PP mesh en 0,6% erosie na een LVR met titanium coated lichtgewicht PP mesh. Deze studie heeft echter te weinig bewijskracht.
(Gedeeltelijk) oplosbare meshes worden door de werkgroep evenals het panel of experts (Mercer-Jones, 2014) niet aangeraden bij een LVR in verband met te verwachten uitrekken en recidieven. Voornamelijk uit dierexperimenteel onderzoek is gebleken dat ePTFE en in mindere mate zwaargewicht meshes een grote kans op krimpen van de mat geeft. Conze (2006) onderzocht retrospectief 77 patiënten na een re-operatie voor een ventrale hernia, de mate van krimpen van de meshes. 85% van de PP meshes met kleine mazen en 57% van de PTFE waren erg gekrompen in tegenstelling tot de PP meshes met grote mazen. PE wordt wel vaker geassocieerd met erosie van de mesh. Het panel of experts (Mercer-Jones, 2014) adviseert geen PE te gebruiken in verband met een grotere kans op erosie, beschreven in de studie van Evans (Evans, 2015). In deze studie was PE weliswaar gebruikt in één van de vijf ziekenhuizen maar na exclusie van de PE meshes was er geen verschil in percentage erosie tussen de deelnemende ziekenhuizen. De werkgroep is van mening dat de bewijskracht te zwak is om een standaard PP (in plaats van een lichtgewicht PP mat) en PE af te raden. Bovendien is het nog onduidelijk wat voor een effect het krimpen van de mat op het uiteindelijke resultaat van een LVR heeft.
Op dit moment is de keuze voor PP het meest verantwoord om te gebruiken bij een LVR omdat deze het meest onderzocht is in grote patiëntseries. In de kennislacunes is opgenomen dat vergelijkend onderzoek naar het juiste materiaal van meshes gewenst is.
Onderbouwing
Achtergrond
Evenals het aantal behandelingen voor een rectale prolaps door middel van een laparoscopische ventrale rectopexie (LVR) is ook het aantal behandelingen met verscheidene implantaten in het algemeen de laatste jaren sterk toegenomen. Deze implantaten verschillen vooral door het materiaal waaruit zij bestaan maar ook in dikte, gewicht en grote van de mazen. De werkgroep focust zich op het wetenschappelijk bewijs over het verschil in veiligheid en effectiviteit van deze implantaten. Omdat er weinig kwalitatief goed vergelijkend onderzoek beschikbaar is voor de materiaalkeuze specifiek voor LVR is gekozen om ook te zoeken naar indirect bewijs. Er is besloten aanvullend literatuuronderzoek te doen naar materiaalkeuze bij littekenbreuken, aangezien deze in tegenstelling tot bijvoorbeeld liesbreuken het meest neutraal zijn ten aanzien van de anatomie en dus uitkomst parameters als pijn, erosie en vreemd lichaam sensatie zo weinig mogelijk door andere factoren beïnvloed zouden kunnen worden. Uiteraard is de werkgroep er zich van bewust dat de reactie van lichaamsvreemd materiaal wel degelijk afhangt van de anatomie waar deze geplaatst wordt, met andere woorden de reactie van het materiaal van het weefsel bij een LVR zou anders kunnen zijn dan bij een littekenbreukcorrectie.
Conclusies / Summary of Findings
Littekenbreuken
|
Laag GRADE |
Er zijn voorzichtige aanwijzingen dat er een verschil is in chronische pijn tussen lichtgewichtmeshes en standaard meshes na een littekenbreukcorrectie. Patiënten met lichtgewicht meshes ervaren minder chronische pijn.
Bronnen (Li, 2015; Conze, 2014; Ladurner, 2011; Schmidbauer; 2005; Ricket, 2012) |
Littekenbreuken
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in complicaties tussen gedeeltelijk oplosbare meshes en onoplosbare meshes bij een littekenbreukcorrectie.
Bronnen (Li, 2015; Rickert, 2012) |
LVR
|
Zeer laag GRADE |
Er zijn voorzichtige aanwijzingen dat er geen verschil is in erosie tussen biologische en synthetische meshes na een LVR.
Bronnen (Evans, 2015) |
Samenvatting literatuur
Beschrijving studies
Drie studies zijn opgenomen in de literatuuranalyse: één systematische review (Li, 2015) waarin vijf observationele studies zijn opgenomen: drie prospectieve observationele cohortstudies (Berrevoet, 2010; Schmidbauer, 2005; Welty, 2001), één RCT (Conze, 2014) en één retrospectieve case-controlstudie (Ladurner, 2011). Naar aanleiding van de literatuurlijst uit de zoekactie zijn er nog twee observationele studies hier aan toegevoegd (Evans, 2015; Ricket, 2012).
In de studies zijn patiënten geïncludeerd waarbij een LVR (Evans, 2015) of een littekenbreukcorrectie (Li,2015; Ricket, 2012) is uitgevoerd. Daarbij is het gebruik van verschillende soorten meshes is: lichtgewicht meshes versus standaard meshes (Li, 2015) biologische meshes versus synthetische meshes (Evans, 2015); gedeeltelijk oplosbare meshes versus onoplosbare meshes (Ricket, 2012). De volgende uitkomsten werden beschreven pijn, erosie en complicaties (wondinfectie, bloedingen seroom, hematoom, vreemd lichaam sensatie, recidief littekenbreuk). De gemiddelde totale leeftijd was in de interventiegroepen 67,4 ± 17,4 jaar en in de controlegroepen 61,4 ± 4,9 jaar. Het gemiddelde percentage mannen in de interventiegroep was 59± 27 en in de controlegroep 54±28.
Resultaten littekenbreukcorrectie
Resultaten pijn (littekenbreuken)
Drie studies (Li, 2015) (N=978) onderzochten het effect op chronische pijn na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat chronische pijn na een littekenbreukcorrectie significant verschillend is bij gebruik van lichtgewicht meshes ten opzichte van standaard meshes waarbij patiënten met lichtgewicht meshes minder chronische pijn ervaarden (relatief risico=0,27; 95%-BI: 0,12 tot 0,60; I2=0%) (zie figuur 1).
De studie van Ricket, 2012 heeft pijn door middel van SF-36 onderzocht, 21- en 60 dagen na de littekenbreukcorrectie. Pijn was significant hoger op beide meetmomenten in de groep met synthetische meshes ten opzichte van de groep met biologische meshes (21 dagen: P=0,04; 60 dagen: P=0,04). Spreidingsmaten waren niet gepresenteerd.
Figuur 1 Pijn
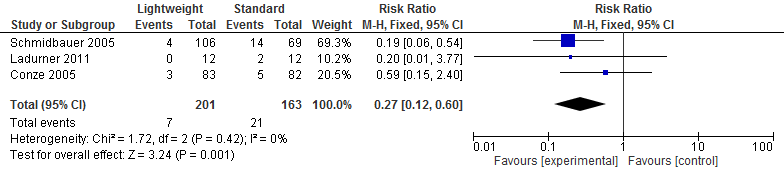
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijn is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (geen blindering van de toewijzing van de behandeling, en de behandeling zelf).
Resultaten complicaties bij littekenbreuken: wondinfectie, bloedingen, seroom, hematoom, recidief littekenbreuk, vreemd lichaam sensatie.
Wondinfectie
Vier studies in de review van Li (2015) onderzochten het effect op wondinfecties na een littekenbreukcorrectie (N=978). Een meta-analyse van deze resultaten laat zien dat wondinfecties na een littekenbreukcorrectie vrijwel gelijk is voor lichtgewicht meshes en standaard meshes (relatief risico=0,96; 95%-BI: 0,63 tot 1,48; I2=46%) (zie figuur 2).
Figuur 2 Wondinfectie
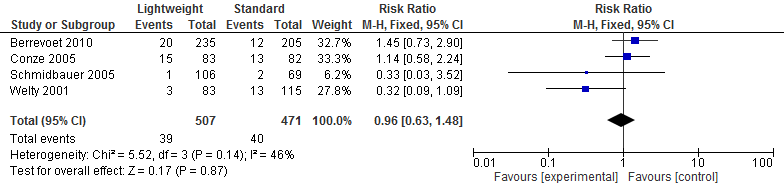
Seroom
Vier studies in de review van Li (2015) (N=978) onderzochten het effect op seroomvorming na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat seroom vorming na een littekenbreukcorrectie vrijwel gelijk is voor lichtgewicht meshes en standaard meshes. (Risk Ratio=0,86; 95%-BI: 0,60 tot 1,24; I2=12%) (zie figuur 3).
Figuur 3 Seroom
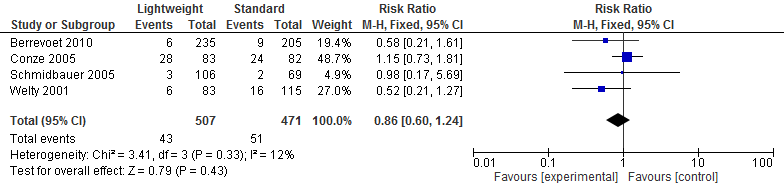
Hematoom
Vier studies in de review van Li (2015) (N=978) onderzochten het effect op hematoomvorming na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat hematoomvorming na een littekenbreukcorrectie gelijk is voor lichtgewicht meshes en standaard meshes. (Risk Ratio=1,00; 95%-BI: 0,59 tot 1,70; I2=0%) (zie figuur 4).
Figuur 4 Hematoom
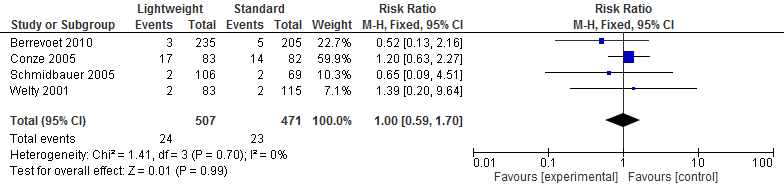
Recidief littekenbreuk
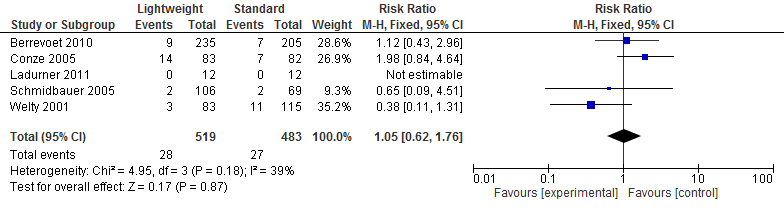
Vijf studies in de review van Li (2015) (N=1002) onderzochten het effect op terugkeer van littekenbreuk na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat het terugkeren van een littekenbreuk na een littekenbreukcorrectie gelijk is voor lichtgewicht meshes en standaard meshes. (Risk Ratio=1,05; 95%-BI: 0,62 tot 1,76; I2=39%) (zie figuur 5).
Figuur 5 Recidief littekenbreuk
Vreemd lichaamssensatie
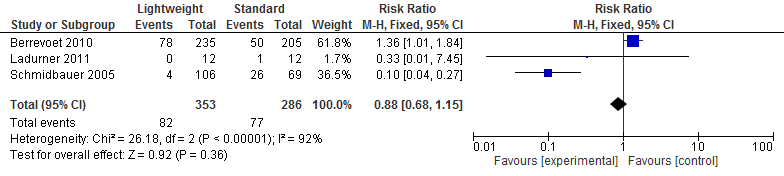
Drie studies in de review van Li (2015) (N=639) onderzochten het effect op vreemd lichaamssensatie na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat een vreemd lichaamssensatie na een littekenbreukcorrectie vrijwel gelijk is voor lichtgewicht meshes en standaard meshes (relatief risico=0,88; 95%-BI: 0,68 tot 1,15; I2=92%) (zie figuur 6).
Figuur 6 Vreemd lichaam sensatie
De studie van Rickert (2012) onderzocht bij 80 personen na een littekenbreukcorrectie of er significante verschillen in complicaties waren tussen biologische meshes en synthetische meshes. Deze studie vond ook geen significante verschillen op de uitkomsten wondinfectie, bloedingen, hematoom, seroom en recidief littekenbreuk. Spreidingsmaten en p-waardes waren niet gepresenteerd in deze studie.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (geen blindering van de toewijzing van de behandeling, en de behandeling zelf); en twee niveaus gezien het feit dat het betrouwbaarheidsinterval zowel een klinische relevant effect omvat in het voordeel van de interventie- als de controlegroep (imprecisie).
Resultaten LVR
Resultaten erosie
Eén studie (Evans, 2015) onderzocht het effect op erosie na een LVR (N=2203). Deze studie laat zien dat er geen significant verschil is in incidentie van erosie bij synthetische meshes ten opzichte van biologische meshes. Hazard ratio en spreidingsmaten zijn niet gerapporteerd. (N.B. Er waren maar drie cases bij biologische meshes en 42 cases bij synthetische meshes waarbij erosie heeft plaatsgevonden).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat erosie is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het geringe aantal incidenten (imprecisie).
Bewijskracht erosies bij rectum prolaps
Er is geen bewijs gevonden over erosies van meshes bij rectum prolaps, er zijn hier geen conclusies over geformuleerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstellingen:
Wat zijn de (on)gunstige effecten van verschillende typen meshes bij een laparoscopische ventrale rectopexie ter behandeling van een rectum prolaps?
P patiënten die een laparoscopische ventrale rectopexie ondergaan ter behandeling van een rectum prolaps;
I kunststof, biologische of oplosbare meshes;
C andersoortige behandeling;
O functionele uitkomsten, pijn/dyspareunia, recidief van de prolaps en complicaties inclusief infecties en/of erosie van de mesh.
Wat zijn de (on)gunstige effecten van verschillende typen meshes bij liesbreukcorrectie?
P patiënten die een liesbreukcorrectie ondergaan;
I kunststof, biologische of oplosbare meshes;
C andersoortige behandeling;
O functionele uitkomsten, pijn/dyspareunia, recidief van de prolaps en complicaties inclusief infecties en/of erosie van de mesh.
Relevante uitkomstmaten
De werkgroep achtte recidief en complicaties een voor de besluitvorming kritieke uitkomstmaten; en functionele uitkomsten (fecale incontinentie en residuale obstipatie) en pijn/dyspareunia een voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Elsevier) is op 18 februari 2016 met relevante zoektermen gezocht naar materiaal (diverse kunststoffen, biologische en oplosbare mat) dat dient gebruikt te worden bij een laparoscopische ventrale rectopexie (LVR) of bij littekenbreukcorrecties. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 679 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews, RCTs of vergelijkend observationeel onderzoek, patiënten met functionele klachten en interne of externe rectumprolaps of littekenbreuken. Op basis van titel en abstract werden in eerste instantie 16 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 13 studies geëxcludeerd (zie exclusietabel), en 3 studies definitief geselecteerd, waarvan twee observationeel vergelijkend onderzoek en een systematische review. De referenties van de review zijn bekeken en gecontroleerd op de inclusiecriteria. Op basis hiervan werden 5 studies opgenomen (Berrevoet, 2010; Conze, 2014; Ladurner, 2011; Schmidbauer, 2005; Welty, 2001).
Drie onderzoeken zijn opgenomen in de literatuuranalyse. De evidence-tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in onder het tabblad Onderbouwing vinden.
Referenties
- Berrevoet F, Maes L, De Baerdemaeker L, et al. Comparable results with 3-year follow-up for large-pore versus small-pore meshes in open incisional hernia repair. Surgery. 2010;148(5):969-75. doi: 10.1016/j.surg.2010.02.011. Epub 2010 Apr 8. PubMed PMID: 20381107.
- Conze J, Krones CJ, Schumpelick V, et al. Incisional hernia: challenge of re-operations after mesh repair.) Langenbecks arch surg. 2007;392(4):453-7. Epub 2006 Sep 2.
- Evans C, Stevenson AR, Sileri P, et al. A Multicenter Collaboration to Assess the Safety of Laparoscopic Ventral Rectopexy. Diseases of the Colon & Rectum. 2015;58(8):799-807.
- Ladurner R, Chiapponi C, Linhuber Q, et al. Long term outcome and quality of life after open incisional hernia repair--light versus heavy weight meshes. BMC Surgery. 2011;11:25.
- Li J, Ji Z, Zhang W, et al. The comparison of lightweight mesh and standard mesh in incisional hernia repair with the open sublay technique: the results of a meta-analysis. Surgical Laparoscopy, Endoscopy & Percutaneous Techniques. 2015;25(3):238-44.
- Rickert A, Kienle P, Kuthe A, et al. A randomised, multi-centre, prospective, observer and patient blind study to evaluate a non-absorbable polypropylene mesh versus a partly absorbable mesh in incisional hernia repair. Langenbecks Archives of Surgery. 2012;397(8):1225-34.
- Schmidbauer S, Ladurner R, Hallfeldt KK, et al. Heavy-weight versus low-weight polypropylene meshes for open sublay mesh repair of incisional hernia. European Journal of Medical Research. 2005;10(6):247-53.
- Sileri P, Franceschilli L, de Luca E et al. Laparoscopic ventral rectopexy for internal prolapse using biological mesh: postoperative and short-term functional results. J Gastrointest Surg. 2012;16:6228.
- Badrek-Amoundi AH, Roe T, Mabey K, et al. Laparosopic ventral mesh rectopexy in the management of solitary rectal ulcer syndrome: a cause for optimism? Colorectal Dis 2012;15:57581.
- Eriksen JR, Gogenur I, Rosenberg J. Choice of mesh for laparoscopic ventral hernia repair. Hernia. 2007;11(6):481-92.
- Mercer-Jones MA, D'Hoore A, Dixon AR, et al. Consensus on ventral rectopexy: report of a panel of experts. Colorectal dis. 2014;16(2):82-8. doi: 10.1111/codi.12415.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Li, 2015 |
SR and meta-analysis of RCTs, cohort and case-control studies
Literature search up to 2014
A: Berrevoet, 2010 B: Conze, 2014 C Ladurner, 2011 D: Schmidbauer, 2005 E: Welty, 2001
Study design:
A: prospective observational cohort B: RCT parallel C: Retrospective case-control study D: Prospective cohort E: Prospective cohort
Setting and Country: Zhong-Da hospital Nanjing China
Source of funding:
|
Inclusion criteria SR:
Patients treated with a incisional hernia repair.
Studies on incisional hernia repairs performed with lightweight versus standard mesh Full-length articles in peer-reviewed journal
Exclusion criteria SR: Not mentioned
5 studies included
Important patient characteristics at baseline:
N, mean ± SD age (yrs)
A: I: 235, 63.4 ± 17.4 C: 205, 66.9 ± 10.2 B: I: 83, 58.2 ± 12.7 C: 82 57.7 ±11.7 C: I: 12, 58.3 ± 11.1 C: 12, 57.3 ± 11.8 D: I: 106, 60 ± 14 C: 69, 56 ± 13 E: I: 83, 63 ± 10 C: 115, 58 ± 12
Sex (% male): A: not specified in article B: I:47; C: 56 C: I: 95; C: 84 D: I: 59; C: 52 E: I: 67; C: 33
Groups were comparable at baseline |
Lightweight mesh
A: Light-weight polypropylene larger pore mesh
B: Light- weight composite mesh (multi filaments of polypropylene with additional absorbable Polyglactin; 25 g/m2; pore-size 4-5 mm)
C: Light-weight polypropylene mesh (54 g/m2; pore-size 4-5 mm)
D: Light-weight polypropylene mesh (non-absorbable multi filaments; weight 55 g/m2; pore-size 3 – 5mm; of 6.7 tex)
E: Light-weight, large-pore Vypro/mesh Ethicon
|
Standard mesh
A: Heavy-weight polypropylene small pore mesh
B: Heavy-weight polypropylene and polyester meshes (33-95 g/m2; pore-size 1 mm)
C: Heavy-weight polypropylene mesh (108.5 g/m2; pore-size 1.6 mm)
D: Heavy-weight polypropylene mesh (Monofilament; pore-size 1.6 mm; 21 tex; weight 109 g/m2)
E: Heavy-weight polypropylene mesh (monofilament; 95g/m2; pore-size 600µm)
|
End-point of follow-up (months mean ± SD)
A: I: 36 C: 36
B: I: 24 C: 24
C: I: 75 ± 16 C: 112 ± 22
D: I: 46 ± 14 C: 92 ± 20
E: I: 8 ± 7 C:
Loss to follow-up
B: 7 % withdrew consent, ten (6 6% were lost to follow-up N=1 died from pulmonary embolin samenwerking met 4 days after surgery, and 6 % withdrew for other reasons
|
Outcome measure-1 Defined as recurrence
Effect measure: Risk Ratio [95% CI]:
A: 1.13 [0.41 to 3.08] B: 2.17 [0.83 to 5.70] C: Not estimable; no recurrence events D: 0.64 [0.09 to 4.68] E: 0.35 [0.10 to 1.31]
Pooled effect (fixed effects model): 1.05 [95% CI 0.62 to 1.76] favoring standard mesh Heterogeneity (I2): 39% P=0.87
Outcome measure-2 Defined as seroma
Effect measure: Risk Ratio [95% CI]: A: 00.58 [0.21 to 1.61] B: 1.15 [0.73 to 1.81] C: 0.98 [0.17 to 5.69] E: 00.52 [0.21 to 1.27]
Pooled effect (fixed effects model): 0.86 [95% CI 0.60 to 1.24] favoring standard mesh Heterogeneity (I2): 12 % P=0.43
Outcome measure-3 Defined as chronic pain
Effect measure: Risk Ratio [95% CI]: B: 0.59 [0.15 to 2.40] C: 0.20 [0.01 to 3.77] D: 0.19 [0.06 to 0.54]
Pooled effect (fixed effects model): Risk Ratio=0.27; 95%-BI: 0.12 to 0.60; I2=0% favoring standard mesh Heterogeneity (I2): 0% P=0.001
Outcome measure-4 Defined as hematoma
Effect measure: Risk ratio [95% CI]: A: 0.52 [0.13, 2.16] B: 1.20 [0.63, 2.27] D: 0.65 [0.09, 4.51] E: 1.39 [0.20, 9.64]
Pooled effect (fixed effects model): 1.00 [95% CI 0.59 to 1.70] favoring standard mesh Heterogeneity (I2): 0% P=0.99
Outcome measure-5 Defined as wound infection
Effect measure: Risk ratio [95% CI]:
A: 1.45 [0.73 to 2.90] B: 1.14 [0.58 to 2.24] D: 0.33 [0.03 to 3.52]
E: 0.32 [0.09 to 1.09]
Pooled effect (fixed effects model): 0.96 [95% CI 0.63 to 1.48] favoring standard mesh Heterogeneity (I2): 47% P=0.87
Outcome measure-6 Defined as stiff abdomen and foreign body sensation.
Effect measure: Risk ratio [95% CI]:
A: 1.36 [1.01 to 1.84] C: 0.33 [0.01 to 7.45] D: 0.10 [0.04 to 0.27]
Pooled effect (fixed effects model): 0.88 [95% CI 0.68to 1.15] favoring standard mesh Heterogeneity (I2): 92% P=0.36 |
|
Evidence table for intervention studies
(randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient character Inclusion criteria: istics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Evans, 2015 |
Type of study:
A retrospective review
Setting:
Prospective pelvic floor databases from 5 institutions (3 in the United Kingdom: Oxford Pelvic Floor Centre, North Bristol National Health Service Trust Frenchay Hospital, and Queen Elizabeth Hospital; 1 from Australia: Royal Brisbane and Women’s Hospital; and 1 from Italy: University of Rome Tor Vergata).
Country: United Kingdom, Australia, Italy
|
Inclusion
Patients undergoing laparoscopic ventral rectopexy
Exclusion criteria:
Not mentioned
N total at baseline: Intervention: 439 (19.9%) Control: 1764 (80.1%)
Important prognostic factors2:
93 % women
Median patient age mean ± SD
59 ± 16 years (range, 15–82 years) |
Biological meshes
Material of the used biological meshes: - Porcine dermal collagen (14.0%) - Porcine small intestinal submucosa (5.9%) |
Synthetic meshes
Material of the used synthetic meshes - Polypropylene (60.1%) - Titanium-coated polypropylene (7.2%) - Polyester (12.7%) |
Median length of follow-up within the registry
Biological Meshes 26 months (range 0–68 months)
Synthetic Meshes 38 months (range 0–162 months) |
Synthetic mesh erosions N=42 (93%)
Biological mesh erosions N=3 (7%)
Hazard ratio for the risk of erosion
Synthetic meshes were not significantly associated with an increased incidence of erosion compared with biological meshes
|
Prognostische factoren zijn over de hele groep beschreven.
Er zijn geen effect- en spreidingmaten gepresenteerd |
|
Rickert, 2012 |
Type of study: Prospective, randomised, double-blinded multicentre study
Setting: Six hospitals throughout Germany participated in the study (DRK Hospital Clementinenhaus, Hannover; Helios Clinic, Northeim; Clinical Centre Aschaffenburg; University of Heidelberg; Hospital Salem, Heidelberg; and University Clinical Centre Mannheim).
Country: Germany
Source of funding: The trial was initiated and sponsored by Aesculap AG, Tuttlingen, Germany and conducted in cooperation with the contract research organisation (CRO) Dr. Med Lenhard & Partner GmbH, Overath. Germany. |
Inclusion criteria: Patients with an elective incisional hernia repair in sublay technique were included. Only patients over 18 years with vertical aponeurotic incision and an incisional hernia size of 3 cm or more were suitable for the study.
Exclusion criteria: Previous mesh repair at the same site, acute incarcerated hernia, additional surgical treatment at the same time and anticoagulation therapy.
N total at baseline: Intervention: 39 Control: 41
Important prognostic factors2: For example age ± SD: I: 63.26 ±9.54 C: 61.65 ± 12.2
Sex: Not mentioned
Size of hernia >grade III
I: 70% C: 85 %
Groups were comparable at baseline on the main outcome measures |
Intervention
Partly absorbable mesh (PP-PG)
Treatment procedure:
Ultrapro Mesh (30×30 cm) manufactured by Johnson & Johnson. This mesh is made of polypropylene plus polyglecaprone (PP-PG) (~1:1), weight 65 g/m2, after absorption of PG weight 28 g/m2, pore size 1.9–2.2 mm.
Surgical procedure: The control group received the same surgical procedure as the intervention group
|
Control
Non-absorbable mesh (PP)
Treatment procedure:
Optilene Mesh Elastic (30×30 cm) manufactured by B. Braun Aesculap. This mesh is made of pure polypropylene (PP) and is not absorbable, weight 48 g/m2, pore size 2.9– 3.2 mm.
|
Length of follow-up: Baseline, at discharge, 21 days after baseline, 6 months after baseline
Loss-to-follow-up: Intervention: N 8 (21 %) Reasons (describe) Consent withdrawn, death and loss to follow-up
Control: N 7 (17 %) Reasons (describe) Consent withdrawn, death, loss to follow-up and other reasons
Incomplete outcome data: Intention to treat principles were used in the analyses
|
Outcome measures and effect size (include 95%CI and p-value if available):
Complications:
There were no significant differences in complication rates (including bleeding, hernia recurrence, wound infection/haematoma, seroma formation) in both groups at all measurement points.
Bodily pain (SF-36):
Baseline to 21 days Difference in pain was significant higher in de the PP group P=0.04
Baseline to 60 days Difference in pain was significant higher in de the PP group P=0.04
|
Aantal man/vrouw wordt niet beschreven
Spreidingsmaten zijn niet gepresenteerd |
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Evans, 215 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Ricket, 2012 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has soft (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Li, 2015 |
Yes |
Yes |
Yes |
No |
Unclear |
Unclear |
Yes |
Yes |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score no. Score yes if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a yes, source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-11-2017
Beoordeeld op geldigheid : 01-07-2017
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven, zie de tabel hieronder. Het bestuur van de Nederlandse Vereniging voor Heelkunde (NVvH) bepaalt of de modules nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Eerstvolgende beoordeling actualiteit richtlijn |
|
ARFO |
2021 |
|
Diagnostiek |
2021 |
|
Scoringssystemen FI |
2021 |
|
Scoringssystemen OD |
2021 |
|
Work-up |
2021 |
|
Conservatieve therapie OD |
2021 |
|
Conservatieve therapie FI |
2021 |
|
Indicatiestelling |
2021 |
|
Chirurgische behandeling IRP |
2019 |
|
Chirurgische behandeling ERP |
2019 |
|
Materiaalkeuze |
2021 |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Er bestaat behoefte aan uniformiteit met betrekking tot de indicatiestelling voor conservatief- of operatief beleid alsmede de inhoud van het beleid, in het bijzonder in geval van operatief beleid (operatietechnieken en materiaalkeuze). De indicatistelling dient optimaal recht te doen aan de patiënt. Dat wil zeggen dat de indicatiestelling zo gekozen wordt dat patiënten niet onnodig een operatie ondergaan maar ook andersom er niet te veel patiënten, die veel baat bij een operatie zouden hebben, een operatie ontzegd worden. De patiënteninformatie bijhorende deze richtlijn kan ertoe bijdragen dat een patiënt beter geïnformeerd is over de behandelopties en de mogelijke risico’s. Dit stelt de patiënt in staat om een goede afwezging te maken en mee te beslissen over de keuze tussen conservatief en operatiefbeleid.
Doelgroep
De op te stellen richtlijn is in wezen een professioneel technische standaard op de eerste plaats bedoeld voor de doelgroep gevormd door chirurgen, MDL-artsen, gynaecologen, bekkenfysiotherapeuten, urologen en radiologen. In tweede plaats is de richtlijn bedoeld om zorgverleners die te maken hebben met patiënten met RP zoals huisartsen, continentieverpleegkundigen, verpleegkundig specialisten en physician assistant te informeren. Er zijn geen aanbevelingen voor de eerste lijn opgenomen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met (verdenking op) een rectum prolaps (zie hieronder).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. N.A.T. Wijffels, chirurg, Antonius ziekenhuis, NVvH (voorzitter)
- Dr. E. Consten, chirurg, Meander MC, Amersfoort, NVvH
- Dr. S.J. van der Hagen, chirurg, Treant Zorggroep Stadskanaal, Emmen en Hoogeveen, NVvH
- Dr. A. Pronk, chirurg, Diakonessenhuis, Utrecht, NVvH
- Dr. R.J.F. Felt-Bersma, Maag-, darm- en leverarts, VU medisch centrum, Amsterdam, NVMDL
- Drs. M. Stegeman, gynaecoloog,Elisabeth-TweeSteden Ziekenhuis, Tilburg, NVOG
- Drs. E.J.L. Bosboom, radioloog, ZiekenhuisGroep Twente, Almelo, NVvR
- J.A.J. Kalkdijk MSc., bekkenfysiotherapeut, Bekken en Bekkenbodem Zorgcentrum, Leeuwarden, NVFB
- Drs. D.A van Reijn, bekkenfysiotherapeut, Bekkenfysiotherapie Baarn, Proctos Kliniek Bilthoven, NVFB
- Drs. A.H.P. Meier, uroloog, VieCuri, Venlo, NVU
- T.J.C. Paulides MSc., arts in opleiding tot chirurg (aios chirurgie), Meander MC, Amersfoort, NVvH
Klankbordgroep
- Drs. G.G.A. (Alec) Malmberg, patiëntvertegenwoordiger/gynaecoloog, Universitair Medisch Centrum Groningen, Bekkenbodem4All
- T. (Thea) Boele, patiëntvertegenwoordiger, Bekkenbodem4All, Brandwijk
- Prof. Dr. W.A. Bemelman, chirurg, Academisch Medisch Centrum, Amsterdam, NVvH
- Dr. S. Festen, chirurg, OLVG, Amsterdam, NVvH
- Dr. D.D.E. Zimmerman, colorectaal chirurg, Elisabeth-TweeSteden Ziekenhuis, Tilburg, NVvH
Met ondersteuning van
- E.A. Rake MSc., junior adviseur, Kennisinstituut van Medisch Specialisten (vanaf januari 2016)
- H.L. Vreeken MSc., adviseur, Kennisinstituut van Medisch Specialisten (tot december 2015)
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Getekend |
|
Stegeman |
Gynaecoloog |
Medisch Manager |
geen |
geen |
geen |
geen |
geen |
geen |
ja, 27-05-2015 |
|
Wijffels |
Gastro-intestinaal chirurg, regiomaatschap Chirurgie Midden-Nederland |
Lid bestuur werkgroep coloproctologie (WCP) |
geen |
geen |
WCP |
geen |
geen |
Gedeelten van de NVvH en WCP worden door diverse partijen gesponsord |
ja, 09-06-2015 |
|
Felt-Bersma |
MDL arts |
MDL arts VuMC consultant MDL arts MCV de Veluwe, Apeldoorn consultant MDL arts Proctoskliniek Bilthoven |
geen |
geen |
geen |
geen |
geen |
geen |
ja, 09-06-2015 |
|
Consten |
Gastro-intestinaal chirurg. |
Voorzitter NVEL opleiding Heelkunde, Meander MC |
geen |
geen |
geen |
geen |
geen |
geen |
ja, 09-06-2015 |
|
Pronk |
gastro-intestinaal chirurg, Diakonessenhuis Utrecht en Zeist |
|
werkzaam colorectaal chirurg in ziekenhuis (Diakonessenhuis) |
geen |
2002-2008 lid beroepsbelangen vereniging heelkunde |
geen |
geen |
geen |
ja, 12-06-2015 |
|
Bosboom |
Fellow radioloog ZGT almelo |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
ja, 15-06-2015 |
|
Van der Hagen |
gastro-intestinaal chirurg in TREANT Zorggroep |
Bestuurslid stafbestuur MSN NON (betaald) Bestuurslid stafbestuur TREANT zorggroep (betaald) |
geen |
geen |
geen |
geen |
geen |
geen |
ja, 13-06-2015 |
|
Huisman |
gynaecoloog Haga Bekkenbodem Centrum |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
15-7-2015 |
|
Kalkdijk |
Bekkenfysiotherapeut Promovendus Heelkunde Onderzoeker Anorectaal Functiecentrum UMCG |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
ja, 13-07-2015 |
|
Meier |
Uroloog |
geen |
geen financiele belangen |
Geen persoonlijke relaties die baat kunnen hebben bij een bepaalde uitkomst of advies |
geen belangen, geen deelname |
Geen extern gefinancieerd onderzoek |
Expertise op gebied van colpopromontoriopexie voor urogenitale prolaps Expertise centrum voor de ALTIS SIS tape voor stress-urine-incontinentie van de Fa.Coloplast |
geen |
ja, 16-10-2015 |
|
Van Reijn |
Bekkenfysiotherapeut |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
ja, 01-12-2015 |
|
Malmberg |
Gynaecoloog en sectie voorzitter algemene gynaecologie Bestuurslid Bekkenbodem4All (voormalig SBP) |
Ambassadeur compassion for care onbetaald ontwikkelen en onderzoeken e health mogelijkheden, #PCiCare BIJVOORBEELDonbetaald |
geen lidmaatschap van adviescommissie (s) aandeelhouder in #PCiCare BV |
directe collega F. Hoogenboom colorectaal chiruge umcg vriendenkring bekkenfysiotherapeut |
Bestuurslid Bekkenbodem4All Ambassadeur Compassion for care, car for sustainable health, noorden duurzaam. Biotoop bijeenkomstenGroningen |
geen |
geen |
niet dat ik weet |
ja, 27-11-2015 |
|
Boele |
Bestuurslid Patiëntenorganisatie Bekkenbodem4All |
Telefoniste informatie-advieslijn Bekkenbodem4All |
geen |
geen |
Wij nemen deel aan deze commissie om de belangen van patiënten te behartigen en de goede communicatie tussen arts en patiënt te bewerkstellingen. |
Wij schrijven voor sommige onderzoeken brieven waarin wij het onderzoek aanbevelen, uitsluitend als wij daar ook als bestuur geheel achter staan. Voor het schrijven van deze brieven vragen wij een kleine vergoeding, nogmaals uitsluitend om als patiënten geen vereniging onszelf staande te houden. |
geen |
geen |
ja, 22-03-2016 |
|
Paulides |
Promovendus Heelkunde |
Literatuuronderzoek en meeschrijven aanbeveling (onbetaald). |
geen |
geen |
geen |
geen |
geen |
nee |
ja, 22-03-2016 |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de focusgroep die bij de richtlijn prolaps werd gehouden, te gebruiken. Een verslag van de patientenfocusgroep uit de richtlijn Prolaps (bijlage Notulen patiëntenfocusgroep) is besproken in de werkgroep. De knelpunten die betrekking hadden op deze richtlijn zijn verwerkt. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Bekkenbodem4All (een fusie van Patiëntvereniging Gynaecologie en Stichting Bekkenbodem Patiënten) en de Patiëntenfederatie Nederland. Gedurende de commentaarfase is patiënteninformatie ontwikkeld (Patiënteninformatietool) in samenwerking met de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten (Implementatieplan). De werkgroep heeft tevens een interne kwaliteitsindicator ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling en Indicatoren).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden de volgende stakeholders schriftelijk uitgenodigd te reageren op het concept-raamwerk van de richtlijn rectum prolaps: IGZ, NVZ, NFU, STZ, ZKN, Lareb, Nefarma, NVvH, NVMDL, NVOG, NVvR, KNGF-NVFB, NVU, PGN, SBP, (tegenwoordig zijn PGN en SBP gefuseerd tot Bekkenbodem4All) NVA, V&VN, Patiëntenfederatie Nederland, Zorginstituut Nederland, ZN, NGH. De invitational conference van de Richtlijn Prolaps werd hierbij als uitgangspunt genomen. Een overzicht van de binnengekomen suggesties en de reactie van de werkgroep hierop is opgenomen onder aanverwante producten (Knelpuntanalyse).
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in een aparte module over Organisatie van Zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de richtlijn werd er een interne kwaliteitsindicator ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (Indicatoren). Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten; Kennislacunes).
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Kennisinstituut van Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1995 – februari 2016
|
(exp Rectal Prolapse/ or ((rectal or anal or uterus or vaginal or vault) adj3 prolaps*).ti. or rectocele*.ti. or enterocele*.ti. or proctocele*.ti. or sigmoidocele*.ti. or exp Incisional Hernia/ or exp Hernia, Ventral/ or exp Hernia, Umbilical/ or (hernia* adj2 (incision* or cicatrical or ventral or umbilical or epigastrica)).ti. or proctopex*.ab,ti. or rectopex*.ab,ti.)
AND (exp Surgical Mesh/ or mesh.ti. or xenograft*.ti. or ((xenogenic* or polypropyl* or synthetic*) adj2 graft*).ti.)
limit to (yr=1995 -Current and (dutch or english)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/))
Gebruikte filters: Systematische reviews: (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp Review Literature as Topic/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and review/))
RCTs: (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/)
=341 (340 uniek) |
679 |
|
Embase (Elsevier) |
('rectum prolapse'/exp/mj OR ((rectal OR anal OR uterus OR vaginal OR vault) NEAR/3 prolaps*):ti OR rectocele*:ti OR enterocele*:ti OR proctocele*:ti OR sigmoidocele*:ti OR 'incisional hernia'/exp/mj OR 'abdominal wall hernia'/exp/mj OR 'umbilical hernia'/exp/mj OR ((incisional OR cicatrical OR ventral OR umbilical OR epigastrica) NEAR/2 hernia*):ti OR 'proctopexy'/exp OR proctopex*:ti OR rectopex*:ti)
AND ('surgical mesh'/exp/mj OR mesh:ti OR xenograft*:ti OR ((xenogenic OR polypropyl* OR synthetic*) NEAR/2 graft*):ti)
AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [1995-2016]/py NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: 'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de
RCTs: 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it
=490 (485 uniek) |
