Minimaliseren van risico’s
Uitgangsvraag
Wat zijn de risico’s van radiotherapie bij patiënten met een niet-cardiaal actief implantaat en hoe minimaliseer je deze?
Aanbeveling
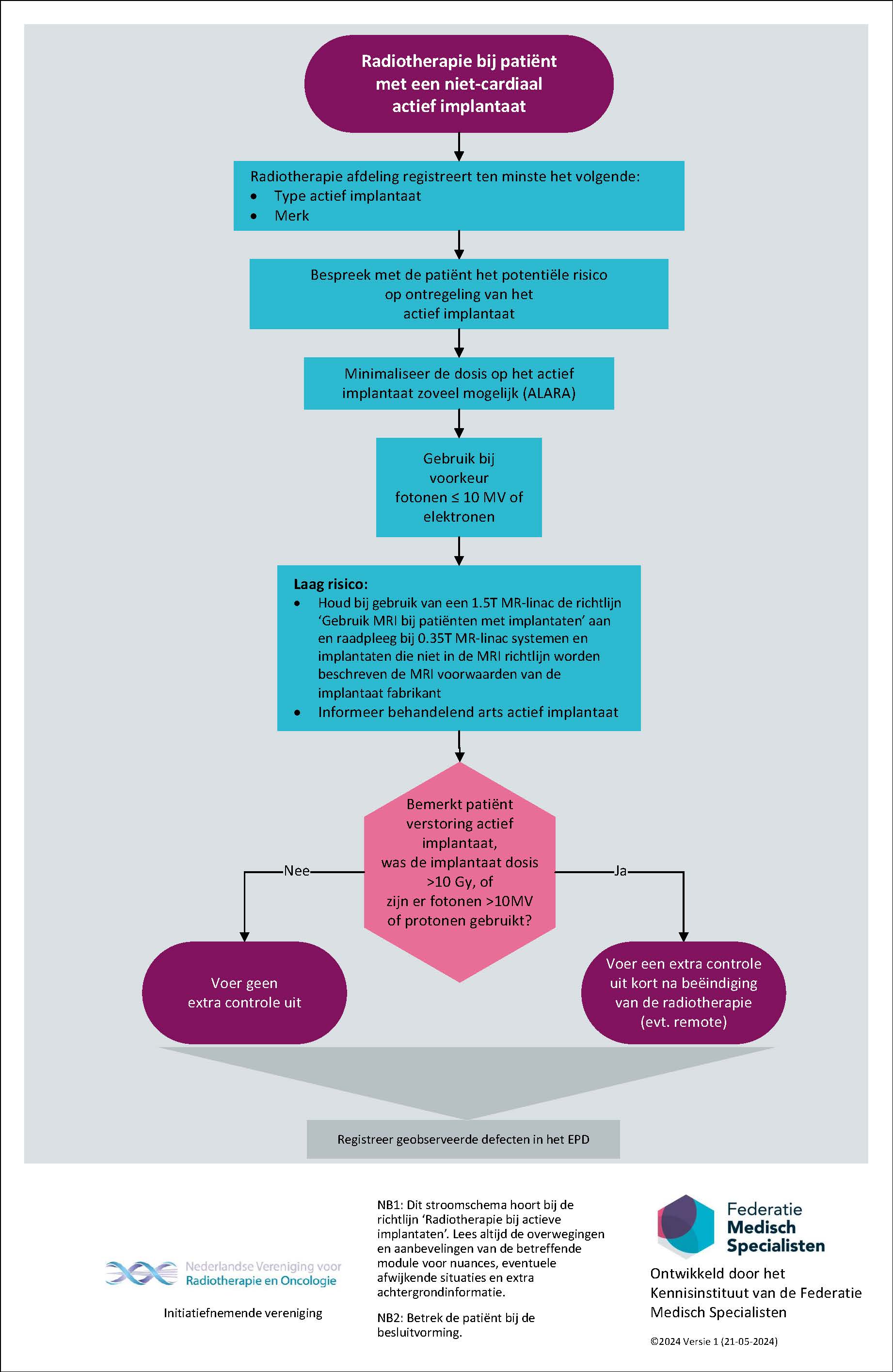
- Gebruik bij patiënten met een niet-cardiaal actief implantaat of een insuline pomp bij voorkeur bundelenergieën die geen of nauwelijks neutronen produceren (fotonen ≤ 10 MV of elektronen) bij patiënten met een niet-cardiaal actief implantaat.
- Gebruik in principe geen hogere fotonen energieën (> 10 MV) en geen protonen bij patiënten met een niet-cardiaal actief implantaat.
- Bij het gebruik van energieën die relatief veel neutronen produceren (fotonen >10 MV of protonen) is er een verhoogd risico op defecten van niet-cardiaal actieve implantaten, weeg dit extra risico af tegen het voordeel van de inzet ervan.
- Houd bij gebruik van een 1.5T MR-linac tevens de richtlijn “Gebruik MRI bij patiënten met implantaten” aan; raadpleeg voor 0.35T MR-linac systemen en implantaten die buiten de MRI richtlijn vallen, de MRI voorwaarden van de implantaat fabrikant.
- Beschouw een niet-cardiaal actief implantaat als een Organ At Risk en minimaliseer de implantaat dosis zoveel mogelijk (ALARA).
- Houd het implantaat zoveel mogelijk buiten in- en uittredende bundels (ALARA).
- Koppel, als er een uitwendig deel is (bijv. insulinepompen en CI) dat op < 5 cm van de veldgrens zit, indien mogelijk, af tijdens de radiotherapie.
Flowchart ‘Radiotherapie bij patiënten met een niet-cardiaal’ actief implantaat'
Overwegingen
De ervaring en literatuur met radiotherapie bij patiënten met niet-cardiale actieve implantaten is tot nu toe nog beperkt. De meest beschikbare artikelen zijn case-reports. Een review van Chan (2021) biedt meer algemene inzichten en stelt een strategie voor radiotherapie bij niet-cardiale actieve implantaten voor. Volgens deze review is de technologie in niet-cardiale actieve implantaten vergelijkbaar met die in CIEDs (beide CMOS), en het wordt aangenomen dat de kans op defecten vergelijkbaar is.
Uit Module 'Werkwijze radiotherapie bij patiënten met een cardiac implantable electronic device (CIED)', de enquête [zie ‘Enquêteresultaten’], en literatuur blijkt dat de incidentie van door radiotherapie geïnduceerde defecten in CIEDs zeer laag is. Op basis hiervan wordt verwacht dat de kans op defecten in niet-cardiale actieve implantaten ook zeer laag is. Aanbevelingen worden gedaan om risico’s te beheersen, waarbij de kans op defect en de gevolgen ervan afgewogen dienen te worden. Belangrijk hierbij is dat eventuele defecten bij niet-cardiale actieve implantaten geen (direct) dodelijke gevolgen zouden hebben (Chan, 2021).
Doordat de technologie van niet-cardiale actieve implantaten vergelijkbaar is met die van CIEDs, kan ervan uit gegaan worden dat, net als bij CIEDs, met name de neutronendosis het risico op defecten bepaalt. Zoals beschreven in Module 'Werkwijze radiotherapie bij patiënten met een cardiac implantable electronic device (CIED)' en de uitleg over de invloed van modaliteit en bundelenergieën bij radiotherapie , neemt de neutronendosis toe bij fotonen met energieën > 10 MV en protonen, terwijl deze bij 6 MV fotonen nul is. Daarom wordt aanbevolen om voor radiotherapie bij patiënten met een niet-cardiale actieve implantaten voornamelijk bundelenergieën te gebruiken die geen of nauwelijks neutronen produceren (fotonenergieën ≤ 10 MV en elektronen).
Wat betreft de gevoeligheid voor EMI van niet-cardiale actieve implantaten kunnen geen algemene conclusies worden getrokken. Zoals beschreven bij CIEDs, zijn specifieke factoren zoals filtering belangrijk. Bij CIEDs zijn verstoringen als gevolg van EMI tijdens radiotherapie zeldzaam en transient (voorbijgaand) van aard.
Case reports over bestralingen en in vitro studies van niet-cardiaal actieve implantaten, zoals cochleaire implantaten en neurostimulatoren suggereren dat radiotherapie bij deze implantaten doorgaans zonder problemen kan worden toegepast (Smilowska, 2020; Guevara, 2015; Klenzner, 2005). Mocht er wel een defect optreden, dan is er herstel mogelijk. Bijvoorbeeld middels vervanging van het implantaat.
As low as reasonably achievable (ALARA)
Analoog aan de situatie bij CIEDs is de verwachting dat zowel ioniserende straling als EMI de werking van een niet-cardiale actieve implantaten kan verstoren en in zeldzame gevallen defecten kan veroorzaken. Daarom is het verstandig om de dosis te minimaliseren en actieve implantaten zoveel mogelijk buiten de in- en uittredende bundels te houden. In tegenstelling tot CIEDs is er bij niet-cardiale actieve implantaten en insuline pompen soms sprake van een inwendig en uitwendig deel. Indien het uitwendige deel in of op < 5 cm van de veldgrens ligt verdient het vanuit het ALARA standpunt aanbeveling om deze af te koppelen tijdens radiotherapie. Mits dit niet te veel overlast voor de patiënt veroorzaakt en in overleg met behandelend arts en patiënt.
Voor vragen met betrekking tot MRI(-linac) veiligheid bij actieve implantaten wordt voor 1.5T en 3T systemen verwezen naar de NVKF Richtlijn ‘Gebruik MRI bij patiënten met implantaten’, MRI Safety Home (website) en MRI Safety Book (Shellock, 2023). Deze referenties gelden echter niet voor 0.35T MR-linac systemen en ook niet voor alle implantaten, raadpleeg in die gevallen de MRI voorwaarden van de implantaat fabrikant.
Zie voor slotoverwegingen module Controle van niet-cardiaal actieve implantaten.
Onderbouwing
Achtergrond
In Module 'Werkwijze radiotherapie bij patiënten met een cardiac implantable electronic device (CIED)' werd bovenstaande vraag behandeld met betrekking tot CIEDs. In deze module worden aanbevelingen en achtergronden gepresenteerd voor patiënten met niet-cardiale actieve implantaten, zoals intrathecale pompen, neurostimulatoren, cochleaire implantaten en ook insulinepompen.
Referenties
- Chan MF, Young C, Gelblum D, Shi C, Rincon C, Hipp E, Li J, Wang D. A Review and Analysis of Managing Commonly Seen Implanted Devices for Patients Undergoing Radiation Therapy. Adv Radiat Oncol. 2021 Aug 6;6(4):100732. doi: 10.1016/j.adro.2021.100732. PMID: 34409216; PMCID: PMC8361059.
- MRI Safety Home. Geraadpleegd op 20-12-2023 via: https://www.mrisafety.com/
- Guevara N, Gérard A, Dupré J, Goursonnet D, Hoen M, Gnansia D, Angellier G, Thariat J. Influence of Ionizing Radiation on Two Generations of Cochlear Implants. Biomed Res Int. 2015;2015:609607. doi: 10.1155/2015/609607. Epub 2015 Sep 28. PMID: 26491679; PMCID: PMC4600872.
- Klenzner T, Knapp F, Röhner F, von Wallenberg E, Mauch H, Pedersen P, Aschendorff A, Laszig R, Lutterbach J. Influence of ionizing radiation on nucleus 24 cochlear implants. Otol Neurotol. 2005 Jul;26(4):661-7. doi: 10.1097/01.mao.0000178134.96977.f5. PMID: 16015164.
- Nederlandse Vereniging voor Klinische Fysica. NVKF-Richtlijn 'Gebruik MRI bij patiënten met implantaten. 2019. Geraadpleegd op 22-01-2024 via: https://richtlijnendatabase.nl/richtlijn/gebruik_mri_bij_patienten_met_implantaten/startpagina_-_mri_bij_patienten_met_implantaten.html
- Shellock FG, Crues JV, Karacozoff AM. MRI Safety Book. ISBN-13: 978-0-9891632-8-6. 2022.
- Smilowska K, Bloem BR, Esselink RAJ, Chaudhuri KR, van Wamelen DJ. Keep calm and beam on? Unmet needs in radiotherapy and deep brain stimulation. Parkinsonism Relat Disord. 2020 Feb;71:15-16. doi: 10.1016/j.parkreldis.2020.01.005. Epub 2020 Jan 11. PMID: 31955127.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 03-07-2024
De geldigheid van de richtlijnmodule komt te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die radiotherapie ondergaan en een actief implantaat hebben.
Werkgroep
- Dr.ir. W.P.A (Wim) Jansen, Klinisch fysicus, Radiotherapiegroep, (voorzitter), NVRO en NVKF
- Prof.dr.ing. C.W. (Coen) Hurkmans, Klinisch fysicus, Catharina ziekenhuis, Eindhoven, en Faculteiten Electrical Engineering en Applied Physics, Technische Universiteit Eindhoven, NVRO en NVKF
- Dr. Ph.W. (Phil) Koken, Klinisch fysicus, Amsterdam UMC , NVRO en NVKF
- Dr. R.A. (Renske) de Jong, Radiotherapeut-oncoloog, Antoni van Leeuwenhoek/Nederlands Kanker Instituut, NVRO
- Dr. L. (Lieselot) van Erven, Cardioloog, Leids Universitair Medisch Centrum, NVVC
- A. (Alia) Veenstra, Technisch stimulatie specialist, Jeroen Bosch Ziekenhuis, ‘s-Hertogenbosch, VITHaS
Met speciale dank aan
- De radiotherapie afdelingen en instituten voor het invullen van de enquête
Met ondersteuning van
- Dr. D. Nieboer, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De 'Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling’ is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar geen directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Jansen (vz) |
Klinisch fysicus, Radiotherapiegroep |
Gastdocent Boerhaave Nascholing; Gastdocent Erasmus MC Academie |
Geen |
Voorstel: geen |
|
Hurkmans |
Klinisch fysicus, Catharina ziekenhuis
|
Geen |
Geen |
Voorstel: geen |
|
Koken |
Klinisch fysicus, Amsterdam UMC
|
Gastdocent InHolland; docent MNW aan de VU; Voorzitter/oprichter van VaBeNe, de Varian-gebruikersgroep in België en Nederland sinds 1997 |
Geen |
Voorstel: geen |
|
De Jong |
Radiotherapeut-oncoloog, Antoni van Leeuwenhoek/Nederlands Kanker Instituut
|
Geen |
Geen |
Voorstel: geen |
|
Erven |
Cardioloog, LUMC
|
Boerhave ECG-cursus (betaald), voorzitter van de Device commissie NHRA, bestuurslid NHRA |
Geen |
Voorstel: geen |
|
Veenstra |
Technisch stimulatie specialist |
Penningmeester en algemeen bestuurslid bij beroepsvereniging VITHaS, organiseert daar jaarlijks de praktijktraining |
Geen |
Voorstel: geen |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) om deel te nemen in de werkgroep en aan de schriftelijke knelpuntenanalyse. Wegens het technische karakter van de richtlijn heeft de NFK aangegeven geen zitting te nemen in de werkgroep.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de radiotherapiezorg voor patiënten met een actief implantaat. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodules (NVRO, 2011) op noodzaak tot revisie. Er is tevens ook aandacht geschonken aan andere typen implantaten (voorheen enkel CIED).
Tevens zijn er knelpunten aangedragen door de patiëntenvereniging en genodigde partijen tijdens de schriftelijke knelpuntenanalyse. Een verslag hiervan is te vinden in de bijlage ‘Verslag schriftelijke invitational’.
Enquête
Er is door de werkgroep een enquête uitgestuurd naar alle radiotherapie-afdelingen in Nederland. Met deze enquête zijn begin 2023 de ervaringen en praktijkvariatie in kaart gebracht bij patiënten met cardiac implantable electronic devices (CIEDs) en andere actieve implantaten. De concept-uitgangsvragen zijn door de werkgroep opgesteld en definitief vastgesteld op basis van de uitkomsten van de knelpuntenanalyse.
Fabrikanten
Er is contact opgenomen met fabrikanten van CIEDs evenals met de fabrikanten van bestralingsapparatuur. Een verslag hiervan is te vinden in de bijlage ‘Terugkoppeling fabrikanten’.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle randvoorwaarden voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur) zijn geadresseerd. Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449.
Medisch Specialistische Richtlijnen 2.0 (2022, 17 maart). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.