Minimaliseren van risico’s
Uitgangsvraag
Wat zijn de risico’s van radiotherapie bij patiënten met een CIED en hoe
minimaliseer je deze?
Aanbeveling
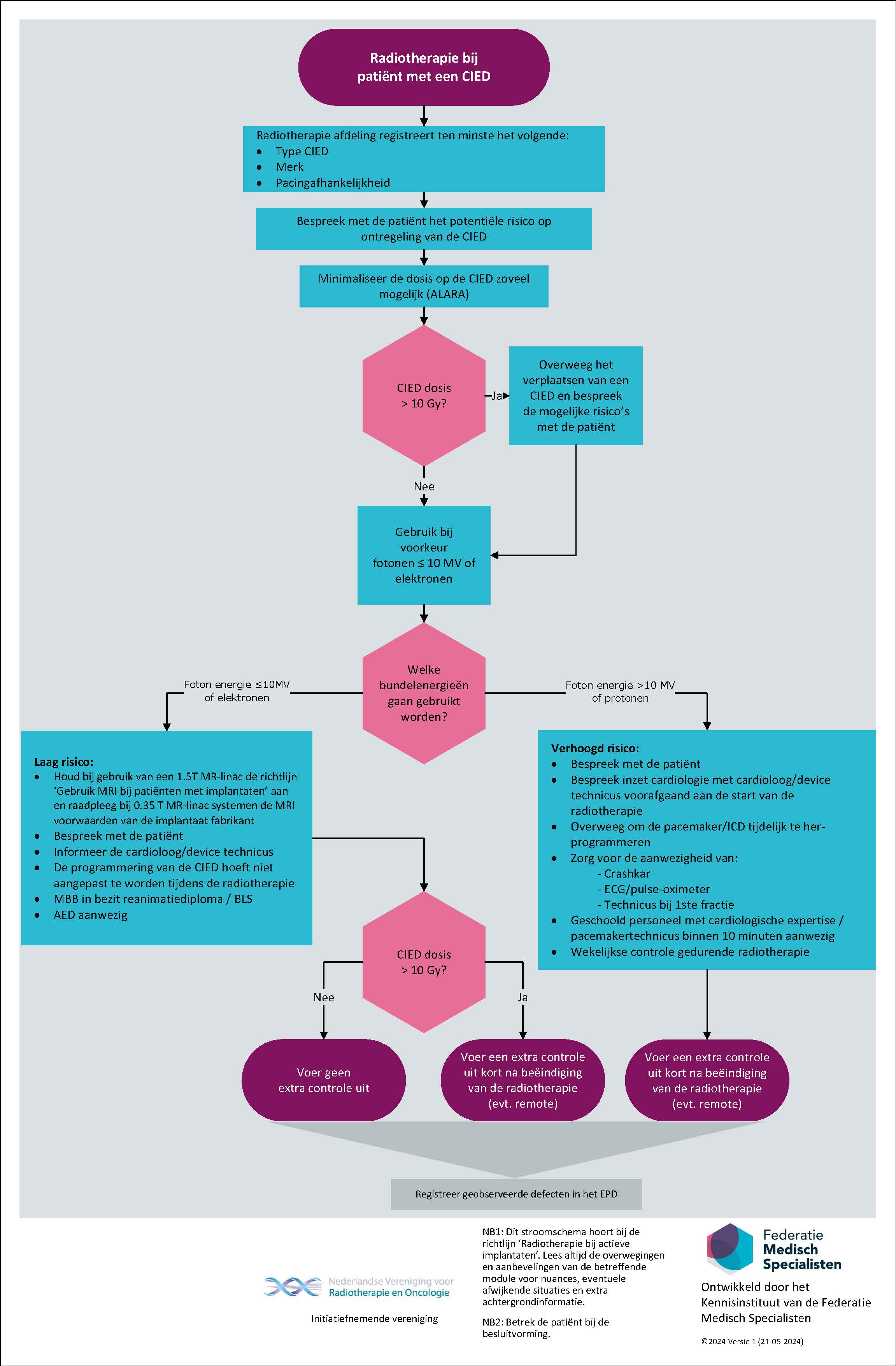
- Gebruik bij voorkeur bundel energieën die geen of nauwelijks neutronen produceren (fotonen ≤ 10 MV of elektronen) bij patiënten met een CIED.
- Gebruik in principe geen hogere fotonen energieën (> 10 MV) en geen protonen bij patiënten met een CIED.
- Bij het gebruik van energieën die relatief veel neutronen produceren (fotonen >10 MV of protonen) is er een verhoogd risico op defecten van CIEDs. Weeg dit extra risico af tegen het voordeel van de inzet ervan.
- De programmering van CIEDs hoeft niet aangepast te worden tijdens radiotherapie wanneer niet of nauwelijks neutronen producerende bundelenergieën (fotonen ≤ 10 MV of elektronen) worden toegepast.
- Houd bij gebruik van een 1.5T MR-linac systeem tevens de richtlijn “Gebruik MRI bij patiënten met implantaten” aan. Raadpleeg voor 0.35T MR-linac systemen de MRI voorwaarden van de CIED fabrikant.
- Overweeg bij gebruik van neutronen producerende bundelenergieën (fotonen > 10 MV of protonen) om de pacemaker/ICD te her-programmeren.
- Beschouw een CIED als een Organ At Risk en minimaliseer de dosis op CIEDs zoveel mogelijk (ALARA).
- Houd CIEDs zoveel mogelijk buiten in- en uittredende bundels (ALARA).
Overwegingen
In de literatuur worden ioniserende straling en EMI als twee mogelijke factoren genoemd die verantwoordelijk kunnen zijn voor verstoringen of defecten in CIEDs.
Ioniserende straling en CIEDs
Ioniserende straling kan defecten aan het CIED veroorzaken. Bij radiotherapie worden kankercellen bestreden met een hoge dosis ioniserende straling terwijl de dosis op het omliggende gezonde weefsel zo laag mogelijk wordt gehouden om schade van deze weefsels te voorkomen. Om dit te bereiken worden verschillende modaliteiten (fotonen, elektronen of protonen) ingezet afhankelijk van de ligging van de tumor in het lichaam. Zo zijn elektronen, die maar tot enkele centimeters in het lichaam doordringen, ideaal voor de behandeling van oppervlakkige tumoren. Alle dieper gelegen weefsels worden dan namelijk optimaal gespaard. Meer centraal gelegen tumoren worden meestal bestraald met fotonen. Als een tumor centraal ligt en het gebied achter de tumor gespaard moet worden kunnen protonen hierbij helpen. Protonen hebben namelijk de eigenschap om abrupt te stoppen op een bepaalde diepte in het lichaam.
Naast de modaliteit of bundeltype is ook de bundelenergie van invloed op de diepte waar de dosis wordt afgegeven. Daarom wordt er bijvoorbeeld gekozen voor 6 MV of 10 MV fotonen afhankelijk van de ligging van de tumor.
Naast een verschil in dosisverdeling tussen de modaliteiten en bundelenergieën is er ook nog verschil in de bijkomende hoeveelheid neutronen in de bundel. Bij de opwekking van elektronen en 6 MV fotonen is er geen neutronenproductie en bij 10 MV fotonen is er nauwelijks neutronenproductie. Bij fotonenergieën boven de 10 MV en bij protonen is er daarentegen sprake van een relatief hoge neutronenproductie.
Niet de door fotonen, elektronen of protonen afgegeven dosis maar de bijkomende dosis afgegeven door neutronen is de dominante factor ten aanzien van de incidentie van CIED defecten tijdens radiotherapie (Lucà, 2019; Malavasi, 2023; Matsubara, 2020; Zagzoog, 2021). Defecten zouden worden veroorzaakt door een 10B(n,a)7Li reactie (Matsubara, 2020). Het relatieve risico op defecten neemt daarom toe met de neutronenproductie (X6 0, X10 0.02, X15 0.30 en X18 0.65 (Matsubara, 2020)). Bij protonen is de neutronenproductie afhankelijk van de manier waarop de bundel energie wordt gemoduleerd, dit kan middels scanning of door passieve verstrooiing (Mishra 2020; Yoo 2020). In Nederland gebruiken alle protoneninstituten scanning protonen en is de neutronendosis is per gray protonen in de buurt van het veld vergelijkbaar met die bij 18 MV fotonen en verder verwijderd van het veld vergelijkbaar met 10 MV fotonen (Indik, 2017; Bjerre, 2021). Bij passive scattered protons komen meer neutronen vrij en is het relatieve risico 0.88 (Matsubara, 2020).
Vanwege de verschillen in vrijkomende neutronendosis verschillen de aanbevelingen voor radiotherapie bij patiënten met een CIED afhankelijk van de gebruikte modaliteit en energie. Elektronen en fotonen energieën tot 8 MV produceren geen neutronen. De hoeveelheid neutronen die bij 10 MV fotonen vrijkomt is gering. Daarom bevelen we voor hoge fotonen energieën (gedefinieerd als > 10 MV volgens bijvoorbeeld ESC guideline, HRS guideline, AAPM guideline en AHA guideline (Lyon, 2022; Indik, 2017; Miften, 2019, Wilkoff, 2009)) en protonen extra maatregelen aan [zie flowchart ‘Radiotherapie bij patiënten met een CIED’]. Overigens hoeven defecten van CIED niet tot klinische klachten te leiden (Indik, 2017; Matsubaru, 2020; Zagzoog, 2021; Azraai, 2022b)
EMI en CIEDs
EMI is een fenomeen waarbij elektromagnetische velden van het ene apparaat (in dit geval versneller) een ander apparaat (in ons geval de CIED) verstoren. Theoretisch gezien zou EMI door een CIED kunnen worden opgepikt als een verstoorde hartactiviteit die kan leiden tot een onterechte shock door een ICD, het inhiberen van de pacemaker of onterechte opgeslagen ritmestoornissen op een ILR.
Een onterechte shock van een ICD kan worden voorkomen door de antitachycardie therapie tijdens radiotherapie te blokkeren met een magneet of deze tijdelijk te herprogrammeren. Wereldwijd wordt dit echter niet frequent toegepast (Zaremba, 2016; Lyon, 2022). Desondanks is nooit een onterechte shock bij een patiënt gerapporteerd in de literatuur (Azraai, 2022a; Lyon, 2022; Zaremba, 2016). Slechts in één geval werd tijdens radiotherapie onterecht ventriculaire fibrillatie geregistreerd die had kunnen leiden tot een onterechte shock als deze niet geblokkeerd was geweest (Elders, 2013). Hierbij moet worden opgemerkt dat in voorgenoemde casus gebruik werd gemaakt van een neutronen producerende energie op een type versneller dat momenteel niet meer klinisch wordt gebruikt. Versnellerfabrikant Elekta heeft sinds de SL serie bijvoorbeeld maatregelen genomen om EMI te minimaliseren (o.a. afscherming rondom bronnen met geschikte cover materialen, PCB ontwerp, kabel routing, compliant sub-systemen (Elekta, 2023)). Tevens is er op CIEDs sinds 2009 steeds meer filtering aangebracht om niet-fysiologische signalen te kunnen onderscheiden van fysiologische signalen en alleen te reageren op de laatste (Zaremba, 2015).
Op basis van bovenstaande kan geconcludeerd worden dat CIED verstoringen ten gevolge van EMI bij bestraling op linacs met fotonen en elektronen energieën zonder MR zeldzaam zijn en als ze optreden in het algemeen transient van aard (Lucà, 2019; Indik, 2017) (ofwel alleen aanwezig tijdens de bestraling). Met MR-linacs en protonenversnellers bestaat te weinig ervaring en hierover is onvoldoende literatuur bekend om een conclusie te kunnen trekken. Relevant is dat de snout van een scanning proton systeem een relatief sterk magneetveld rond de patiënt creëert wat mogelijk tot EMI zou kunnen leiden (Chan, 2021).
Over CIED veiligheid voor 1.5T en 3T MRI scanners is veel bekend. Hiervoor wordt verwezen naar de Richtlijn ‘Gebruik MRI bij patiënten met implantaten’, MRI Safety Home (website) en MRI Safety Book (Shellock, 2023). Met 0.35T MR-linac systemen is minder ervaring opgebouwd en hiervoor wordt verwezen naar de MRI voorwaarden van de CIED fabrikant. Veelal hebben cardiologie en radiologie afdelingen van ziekenhuizen protocollen beschikbaar, welke grotendeels ook toepasbaar zijn voor de MR-linacs van Viewray en Elekta die nu op de markt zijn. Echter, de toegepaste pulssequenties kunnen van invloed zijn op de CIED gedrag en deze sequenties kunnen anders zijn op de MR-linacs. Er zijn tot op heden nog geen studies verricht naar EMI effecten bij MR-linacs.
As low as reasonably achievable (ALARA)
Zoals in de vorige paragraaf aangegeven kan zowel ioniserende straling als EMI de werking van een CIED verstoren en in zeldzame gevallen defecten veroorzaken. Daarom is het verstandig om de dosis te minimaliseren en CIEDs zoveel mogelijk buiten de in- en uittredende bundels te houden. Met name bij rotatiebestralingen dient naast intredende ook aandacht te worden besteed aan uittredende bundels die anders onnodig door de CIED kunnen gaan en extra CIED dosis veroorzaken.
Zie voor slotoverwegingen module CIED Controle.
Onderbouwing
Achtergrond
Het is bekend dat radiotherapie het functioneren van CIEDs kan beïnvloeden. De literatuur beschrijft twee mogelijke oorzaken voor radiotherapie gerelateerde CIED verstoring/ defecten. Namelijk EMI, ofwel elektromagnetische interferentie, en stralingsschade (Miften 2019; Indik 2017).
Het falen van een beschadigde CIED kan zich manifesteren door het niet of niet juist elektrisch stimuleren van het hart. De facetten waarop het mis kan gaan, kunnen worden ingedeeld in de volgende drie categorieën: 1) tijdelijk reversibel defect, 2) permanent reversibel defect en 3) irreversibel defect. In het geval van reversibele defecten zal het probleem “vanzelf” voorbij gaan (tijdelijk reversibel) of zal het door een extra handeling, bijvoorbeeld een reset van de CIED, verholpen moeten worden (permanent reversibel). De irreversibele fout vereist in de meeste gevallen vervanging van de CIED.
Zowel ioniserende straling als EMI kan de werking van een CIED verstoren en in zeldzame gevallen defecten veroorzaken. Daarom is het verstandig om de dosis te minimaliseren en de CIED zoveel mogelijk buiten de in- en uittredende bundels te houden.
Referenties
- Azraai M, D'Souza D, Lin YH, Nadurata V. Current clinical practice in patients with cardiac implantable electronic devices undergoing radiotherapy: a literature review. Europace. 2022 Mar 2;24(3):362-374. doi: 10.1093/europace/euab241. PMID: 34516616.
- Azraai M, Miura D, Lin Y-H, Rodrigues TS, Nadurata V. Incidence and Predictors of Cardiac Implantable Electronic Devices Malfunction with Radiotherapy Treatment J. Clin. Med. 2022b; 11(21):6329.
- Bjerre, HL, Kronborg, MB, Nielsen, JC, Høyer, M, Jensen, MF, Zaremba, T, Laegdsmand PMT, Sondergaard CS, Nyström H, Kronborg, CJS. Risk of Cardiac Implantable Electronic Device Malfunctioning During Pencil Beam Proton Scanning in an In Vitro Setting. Int J Radiation Oncol Biol Phys. 2021 Mar;111(1):186195. doi:10.1016/j.ijrobp.2021
- Chan MF, Young C, Gelblum D, Shi C, Rincon C, Hipp E, Li J, Wang D. A Review and Analysis of Managing Commonly Seen Implanted Devices for Patients Undergoing Radiation Therapy. Adv Radiat Oncol. 2021 Aug 6;6(4):100732. doi: 10.1016/j.adro.2021.100732. PMID: 34409216; PMCID: PMC8361059.
- Elders J, Kunze-Busch M, Smeenk RJ, Smeets JL. High incidence of implantable cardioverter defibrillator malfunctions during radiation therapy: neutrons as a probable cause of soft errors. Europace. 2013 Jan;15(1):60-5. doi: 10.1093/europace/eus197. Epub 2012 Jul 29. PMID: 22848077.
- Elekta (private communication) 2023
- Indik JH, Gimbel JR, Abe H, Alkmim-Teixeira R, Birgersdotter-Green U, Clarke GD, Dickfeld TL, Froelich JW, Grant J, Hayes DL, Heidbuchel H, Idriss SF, Kanal E, Lampert R, Machado CE, Mandrola JM, Nazarian S, Patton KK, Rozner MA, Russo RJ, Shen WK, Shinbane JS, Teo WS, Uribe W, Verma A, Wilkoff BL, Woodard PK. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm. 2017 Jul;14(7):e97-e153. doi: 10.1016/j.hrthm.2017.04.025. Epub 2017 May 11. PMID: 28502708.
- Luca F, Parrini I, Cipolletta L, Di Fusco S, Rao CM, Iorio A, Pozzi A, Gelsomino S, Gabrielli D, Ingianni N, Zecchin M, Gulizia MM. Radiotherapy and devices in cancer patients: What is new in clinical practice? Int J Heart Rhythm. 2019 Jan-Jun;4(1):4-13. doi: 10.4103/IJHR.IJHR_2_19.
- Lyon AR, López-Fernández T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J, Boriani G, Cardinale D, Cordoba R, Cosyns B, Cutter DJ, de Azambuja E, de Boer RA, Dent SF, Farmakis D, Gevaert SA, Gorog DA, Herrmann J, Lenihan D, Moslehi J, Moura B, Salinger SS, Stephens R, Suter TM, Szmit S, Tamargo J, Thavendiranathan P, Tocchetti CG, van der Meer P, van der Pal HJH; ESC Scientific Document Group. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022 Nov 1;43(41):4229-4361. doi: 10.1093/eurheartj/ehac244. Erratum in: Eur Heart J. 2023 May 7;44(18):1621. PMID: 36017568.
- Malavasi VL, Imberti JF, Tosetti A, Romiti GF, Vitolo M, Zecchin M, Mazzeo E, Giuseppina M, Lohr F, Lopez-Fernandez T, Boriani G. A systematic review and meta-analysis on oncological radiotherapy in patients with a cardiac implantable electronic device: Prevalence and predictors of device malfunction in 3121 patients. Eur J Clin Invest. 2023 Jan;53(1):e13862. doi: 10.1111/eci.13862. Epub 2022 Sep 7. PMID: 36004486; PMCID: PMC10078179.
- Matsubara H, Ezura T, Hashimoto Y, Karasawa K, Nishio T, Tsuneda M. Prediction of radiation-induced malfunction for cardiac implantable electronic devices (CIEDs). Med Phys. 2020 Apr;47(4):1489-1498. doi: 10.1002/mp.14057. Epub 2020 Feb 21. PMID: 32003864.
- Miften M, Mihailidis D, Kry SF, Reft C, Esquivel C, Farr J, Followill D, Hurkmans C, Liu A, Gayou O, Gossman M, Mahesh M, Popple R, Prisciandaro J, Wilkinson J. Management of radiotherapy patients with implanted cardiac pacemakers and defibrillators: A Report of the AAPM TG-203†. Med Phys. 2019 Dec;46(12):e757-e788. doi: 10.1002/mp.13838. Epub 2019 Nov 1. PMID: 31571229.
- Mishra MV, Khairnar R, Bentzen SM, Larson G, Tsai H, Sinesi C, Vargas C, Laramore G, Rossi C, Rosen L, Sun K, Hartsell W. Patient reported outcomes following proton pencil beam scanning vs. passive scatter/uniform scanning for localized prostate cancer: Secondary analysis of PCG 001-09. Clin Transl Radiat Oncol. 2020 Mar 7;22:50-54. doi: 10.1016/j.ctro.2020.03.003. PMID: 32258443; PMCID: PMC7125313.
- MRI Safety Home. Geraadpleegd op 20-12-2023 via: https://www.mrisafety.com/
- Nederlandse Vereniging voor Klinische Fysica. NVKF-Richtlijn 'Gebruik MRI bij patiënten met implantaten. 2019. Geraadpleegd op 22-01-2024 via: https://richtlijnendatabase.nl/richtlijn/gebruik_mri_bij_patienten_met_implantaten/startpagina_-_mri_bij_patienten_met_implantaten.html
- Shellock FG, Crues JV, Karacozoff AM. MRI Safety Book. ISBN-13: 978-0-9891632-8-6. 2022.
- Wilkoff BL, Love CJ, Byrd CL, Bongiorni MG, Carrillo RG, Crossley GH 3rd, Epstein LM, Friedman RA, Kennergren CE, Mitkowski P, Schaerf RH, Wazni OM; Heart Rhythm Society; American Heart Association. Transvenous lead extraction: Heart Rhythm Society expert consensus on facilities, training, indications, and patient management: this document was endorsed by the American Heart Association (AHA). Heart Rhythm. 2009 Jul;6(7):1085-104. doi: 10.1016/j.hrthm.2009.05.020. Epub 2009 May 22. PMID: 19560098.
- Yoo GS, Yu JI, Cho S, Jung SH, Han Y, Park S, Oh Y, Lee B, Park HC, Lim DH, Choi MS, Won H. Comparison of clinical outcomes between passive scattering versus pencil-beam scanning proton beam therapy for hepatocellular carcinoma. Radiother Oncol. 2020 May;146:187-193. doi: 10.1016/j.radonc.2020.02.019. Epub 2020 Mar 14. PMID: 32179362.
- Zagzoog A, Wronski M, Birnie DH, Yeung C, Baranchuk A, Healey JS, Golian M, Boles U, Carrizo AG, Turner S, Hassan A, Ali E, Kumar SK, Russell S, Shurrab M, Crystal E. Assessment of Radiation-Induced Malfunction in Cardiac Implantable Electronic Devices. CJC Open. 2021 Jul 11;3(12):1438-1443. doi: 10.1016/j.cjco.2021.07.005. PMID: 34993455; PMCID: PMC8712607.
- Zaremba T, Jakobsen AR, Søgaard M, Thøgersen AM, Riahi S. Radiotherapy in patients with pacemakers and implantable cardioverter defibrillators: a literature review. Europace. 2016 Apr;18(4):479-91. doi: 10.1093/europace/euv135. Epub 2015 Jun 3. PMID: 26041870.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 03-07-2024
Laatst geautoriseerd : 03-07-2024
Geplande herbeoordeling : 03-07-2028
De geldigheid van de richtlijnmodule komt te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die radiotherapie ondergaan en een actief implantaat hebben.
Werkgroep
- Dr.ir. W.P.A (Wim) Jansen, Klinisch fysicus, Radiotherapiegroep, (voorzitter), NVRO en NVKF
- Prof.dr.ing. C.W. (Coen) Hurkmans, Klinisch fysicus, Catharina ziekenhuis, Eindhoven, en Faculteiten Electrical Engineering en Applied Physics, Technische Universiteit Eindhoven, NVRO en NVKF
- Dr. Ph.W. (Phil) Koken, Klinisch fysicus, Amsterdam UMC , NVRO en NVKF
- Dr. R.A. (Renske) de Jong, Radiotherapeut-oncoloog, Antoni van Leeuwenhoek/Nederlands Kanker Instituut, NVRO
- Dr. L. (Lieselot) van Erven, Cardioloog, Leids Universitair Medisch Centrum, NVVC
- A. (Alia) Veenstra, Technisch stimulatie specialist, Jeroen Bosch Ziekenhuis, ‘s-Hertogenbosch, VITHaS
Met speciale dank aan
- De radiotherapie afdelingen en instituten voor het invullen van de enquête
Met ondersteuning van
- Dr. D. Nieboer, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De 'Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling’ is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar geen directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Jansen (vz) |
Klinisch fysicus, Radiotherapiegroep |
Gastdocent Boerhaave Nascholing; Gastdocent Erasmus MC Academie |
Geen |
Voorstel: geen |
|
Hurkmans |
Klinisch fysicus, Catharina ziekenhuis
|
Geen |
Geen |
Voorstel: geen |
|
Koken |
Klinisch fysicus, Amsterdam UMC
|
Gastdocent InHolland; docent MNW aan de VU; Voorzitter/oprichter van VaBeNe, de Varian-gebruikersgroep in België en Nederland sinds 1997 |
Geen |
Voorstel: geen |
|
De Jong |
Radiotherapeut-oncoloog, Antoni van Leeuwenhoek/Nederlands Kanker Instituut
|
Geen |
Geen |
Voorstel: geen |
|
Erven |
Cardioloog, LUMC
|
Boerhave ECG-cursus (betaald), voorzitter van de Device commissie NHRA, bestuurslid NHRA |
Geen |
Voorstel: geen |
|
Veenstra |
Technisch stimulatie specialist |
Penningmeester en algemeen bestuurslid bij beroepsvereniging VITHaS, organiseert daar jaarlijks de praktijktraining |
Geen |
Voorstel: geen |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) om deel te nemen in de werkgroep en aan de schriftelijke knelpuntenanalyse. Wegens het technische karakter van de richtlijn heeft de NFK aangegeven geen zitting te nemen in de werkgroep.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de radiotherapiezorg voor patiënten met een actief implantaat. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodules (NVRO, 2011) op noodzaak tot revisie. Er is tevens ook aandacht geschonken aan andere typen implantaten (voorheen enkel CIED).
Tevens zijn er knelpunten aangedragen door de patiëntenvereniging en genodigde partijen tijdens de schriftelijke knelpuntenanalyse. Een verslag hiervan is te vinden in de bijlage ‘Verslag schriftelijke invitational’.
Enquête
Er is door de werkgroep een enquête uitgestuurd naar alle radiotherapie-afdelingen in Nederland. Met deze enquête zijn begin 2023 de ervaringen en praktijkvariatie in kaart gebracht bij patiënten met cardiac implantable electronic devices (CIEDs) en andere actieve implantaten. De concept-uitgangsvragen zijn door de werkgroep opgesteld en definitief vastgesteld op basis van de uitkomsten van de knelpuntenanalyse.
Fabrikanten
Er is contact opgenomen met fabrikanten van CIEDs evenals met de fabrikanten van bestralingsapparatuur. Een verslag hiervan is te vinden in de bijlage ‘Terugkoppeling fabrikanten’.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle randvoorwaarden voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur) zijn geadresseerd. Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449.
Medisch Specialistische Richtlijnen 2.0 (2022, 17 maart). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.