Indicaties voor CT-thorax
Uitgangsvraag
Wat is een indicatie voor een CT-thorax bij kinderen met potentieel meervoudig of levensbedreigend letsel?
Aanbeveling
Overweeg het maken van een CT-thorax alleen indien het vervaardigen van een CT-thorax behandelconsequenties heeft en er sprake is van:
- Hematothorax / pneumothorax (op de X-thorax).
- Subcutaan emfyseem.
- Afwijkend mediastinum (op de X-thorax).
- Decelererend trauma (met afwijkende X-thorax).
- Penetrerend trauma.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Omdat ernstig thoracaal letsel weinig voorkomt, maar wel een hoge mortaliteit kent, is het van belang dat er duidelijkheid is wanneer de indicatie bestaat voor het vervaardigen van een CT-thorax. Dit om te voorkomen dat kinderen onnodig een CT-thorax krijgen, die niet bijdragend is in de identificatie van letsels of letsels identificeert die geen behandeling vereisen. Dit zou dan alleen maar stralingsbelasting opleveren.
De studie van Holmes (2002) beschrijft een model met risicofactoren voor thoracale letsels. De risicofactoren die deel uit maken van dit model zijn: lage systolische bloeddruk, verhoogde ademhalingsfrequentie (op basis van de leeftijd), afwijkingen bij onderzoek van de thorax, afwijkende auscultatie van de thorax, femurfractuur en een GCS-score lager dan 15. De bewijskracht van deze studie is echter zeer laag vanwege een gebrek aan externe validatie en daarnaast is de impact van het model niet onderzocht. Het blijft daarom onduidelijk of deze risicofactoren daadwerkelijk gebruikt kunnen worden als indicatie voor het vervaardigen van een CT-thorax. Er ligt hier een kennislacune en aanvullend onderzoek is nodig om een goed antwoord te krijgen op deze vraag.
Bovenstaand artikel beschrijft niet expliciet de indicaties voor het maken van een CT-thorax. Daarom zijn onderstaande artikelen bijgevoegd om ook antwoord te kunnen geven op de vraag wanneer er een indicatie is voor het maken van een CT-thorax. Uit de literatuur blijkt dat een CT-thorax vooral longcontusie, pneumothorax en fracturen (van rib of sternum) aan het licht brengt in vergelijking met de X-thorax, waarvan de noodzaak tot verandering in behandeling over het algemeen laag ligt (Golden, 2016; Stephens, 2017). Zowel de studie van Golden (2016) als de studie van Stephens (2017) toont aan dat een CT-thorax in 42% en respectievelijk 32% van de patiënten meer diagnoses oplevert in vergelijking met de X-thorax, maar in beide studies levert dit slechts in 3% van de patiënten een verandering in de behandeling op. In het merendeel van de patiënten gaat het om een thoraxdrain plaatsing bij een gevonden pneumothorax of hematothorax bij een patiënt met positieve druk beademing. De vraag wanneer een CT-thorax daadwerkelijk bijdraagt in de diagnostiek is lastiger te beantwoorden. De artikelen van zowel Golden (2016) als Stephens (2017) benadrukken dat het hierbij vooral gaat om vasculair letsel na decelererend trauma. In al deze gevallen zijn er reeds afwijkingen op de X-thorax te zien, bijvoorbeeld een afwijkend mediastinum, welke, in combinatie met het traumamechanisme aanleiding geven tot het maken van een CT-thorax. Yanchar (2013) beschrijft de volgende significante afwijkingen op de X-thorax als indicaties voor CT-thorax: hematothorax of pneumothorax, subcutaan emfyseem en een afwijkend mediastinum. De werkgroep beveelt daarom aan om in het geval van een van deze afwijkingen op X-thorax, een CT-thorax te maken om vasculair letsel uit te sluiten. Op basis van eigen ervaring is de werkgroep van mening dat ook specifieke traumata, zoals penetrerend letsel, een indicatie zou kunnen zijn voor CT-thorax indien het vervaardigen van CT-thorax behandelconsequenties heeft. Bij twijfel over aanwezige afwijkingen op de X-thorax én een decelererend traumamechanisme kan overwogen worden laagdrempelig een CT-thorax te maken.
Kosten (middelenbeslag)
Het vervaardigen van een CT-thorax brengt extra kosten met zich mee.
Aanvaardbaarheid, haalbaarheid en implementatie
Het vervaardigen van een CT-thorax is alleen gerechtvaardigd indien aangenomen wordt dat het potentieel leidt tot een verandering van beleid, bijvoorbeeld een interventie, ingreep of extra observatie van de patiënt. Dit komt doordat een CT-thorax extra stralingsbelasting met zich meebrengt (zie hiervoor het kopje gebruik van ioniserende straling in de algemene inleiding). Er worden geen problemen verwacht wat betreft de aanvaardbaarheid, haalbaarheid en/of implementatie. Er zal een werkprotocol beschikbaar moeten zijn voor het vervaardigen van een CT-thorax bij kinderen.
Rationale van de aanbeveling
In het artikel van Yanchar (2013) wordt beschreven dat er bij significante afwijkingen op de X-thorax; hemato-/pneumothorax of subcutaan emfyseem, er een indicatie is voor het maken van een CT-thorax. Hierbij is het van belang om te laten meewegen of het vervaardigen van een CT-thorax de behandeling van de patiënt gaat veranderen. In de artikelen van Golden (2016) en Stephens (2017) bleek namelijk dat in slechts een klein deel van de patiënten (< 3%) extra behandeling nodig was naar aanleiding van de CT-thorax. Verder is het van belang om bij twijfel over afwijkingen op de X-thorax én een decelererend traumamechanisme wel een CT-thorax te maken om vasculair letsel uit te sluiten. Daarnaast kunnen specifieke traumata, zoals penetrerend letsel, een indicatie zijn voor CT-thorax indien het vervaardigen van CT-thorax behandelconsequenties heeft.
Het plaatsen van een thoraxdrain voor de CT-thorax is afhankelijk van de kliniek. Bij slechte oxygenatie/ hemodynamiek gaat het plaatsen van de thoraxdrain voor het vervaardigen van de CT-thorax.
Onderbouwing
Achtergrond
Er is momenteel geen praktische landelijke richtlijn met betrekking tot het verrichten van aanvullend onderzoek bij kinderen met potentieel meervoudig of levensbedreigend trauma. Volgens de ATLS en APLS krijgen alle kinderen met een hoog energetische trauma (HET) een X-thorax en een X-bekken. Echter is de sensitiviteit voor een kleine (anterieure) pneumothorax, longcontusie en een ribfractuur beperkt. Om de stralingsbelasting zo laag mogelijk te houden, hanteren we het ALARA-principe. Om te voorkomen dat veel kinderen onnodig een CT-thorax krijgen, die niet bijdragend is in het identificeren van de letsels die een behandelconsequentie hebben, maar wel stralingsbelasting oplevert, kijken we wat indicaties zijn om CT-thorax van de thorax uit te voeren.
Conclusies / Summary of Findings
|
Very low GRADE |
Risk on thoracic injuries It is unclear whether the clinical decision rule developed by Holmes (2002) has sufficient model performance to identify patients who are at risk of thoracic injuries.
Sources: (Holmes, 2002) |
Samenvatting literatuur
Description of studies
The study of Holmes (2002) developed a clinical prediction rule to identify thoracic injuries in children who sustained blunt torso trauma. Patients were prospectively enrolled when they were < 16 years old, presented at the emergency department (ED) of a Level I trauma center with blunt torso trauma, if they underwent chest radiography, and when they had any of the following: blunt torso trauma from a significant mechanism of injury (motor vehicle crash, automobile versus pedestrian, falls of > 10 feet), a decreased level of consciousness (Glasgow Coma Scale (GCS) < 15) in association with blunt torso trauma, blunt traumatic event with extremity paralysis, multiple bone fractures, a CRAMS score (measuring circulation, respiration, abdomen, motor responses, and speech) of 8 or less, a physical examination suggestive of torso injury after blunt trauma, or a pediatric trauma score of 8 of less after blunt trauma. Thoracic injuries were defined as: pulmonary contusion, hemothorax, pneumothorax, pneumomediastinum, tracheal-bronchial disruption, aortic injury, hemopericardium, pneumopericardium, cardiac contusion, rib fracture, sternal fracture, or any injury to the diaphragm. In total, 986 patients with a mean age of 8.3 (+/- 4.8 years) were included, of which 80 patients sustained thoracic injuries. A multiple logistic regression and recursive portioning analysis identified several predictors of thoracic injury: low systolic blood pressure, elevated age-adjusted respiratory rate, abnormal results on examination of the thorax, abnormal chest auscultation findings, femur fracture, and a Glasgow Coma Scale (GCS) score of less than 15. The obtained model was internally validated using bootstrap resampling procedures with 1000 iterations each.
Results
Risk on thoracic injuries (crucial)
The study of Holmes (2002) identified a clinical prediction rule using multivariable logistic regression consisting of: low systolic blood pressure, elevated age-adjusted respiratory rate, abnormal results on examination of the thorax, abnormal chest auscultation findings, and a Glasgow Coma Scale (GCS) score of less than 15. The area under de model receiver operating characteristic curve was 0.82 and the model demonstrated satisfactory goodness-of-fit, as measured with the Hosmer-Lemeshow test (p=0.70). The bootstrap analysis identified all 5 variables as independent predictors of thoracic injury in more than 50% of the 1000 bootstrap iterations. The recursive partitioning analysis (see Figure 2.1) identified the same 5 variables as the multivariate logistic regression analysis but added femur fracture to the model as an important variable.
Figure 2.1 Clinical decision rule
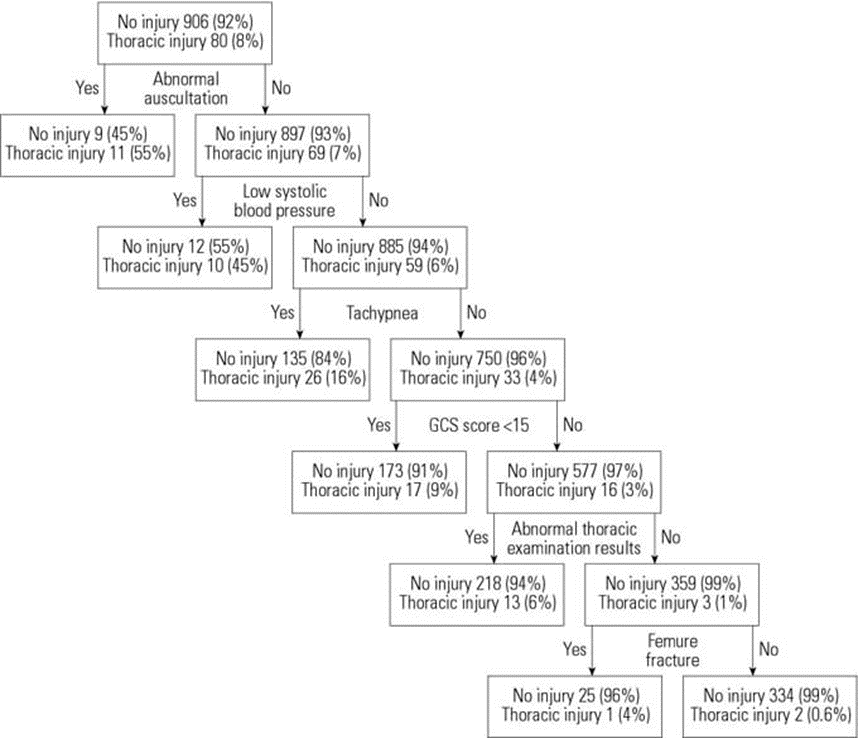
Results from the recursive partitioning analysis. Each box represents the number of patients with and without thoracic injury given the particular combination of variables. Source: Holmes (2002)
In total, 650 children (66%) had at least one of the predictive factors of thoracic injury. Included in this group were 78 of the 80 children (98% sensitivity). On the other hand, 336 (34%) had none of these predictive factors during the ED evaluation, including 2 patients with thoracic injuries. These two patients, however, did not require any intervention. In summary, 12% of the children with any one of these factors had thoracic injury versus 0.6% of the patients without any of these risk factors. This difference is clinically relevant.
Level of evidence of the literature
Risk on thoracic injuries (crucial)
Because we included prognostic studies, the level of evidence started high. The level of evidence was downgraded by three levels because the study lacked external validation (phase of research), the model impact was not evaluated (phase of research), and because of a low number of events (imprecision). The level of evidence was therefore very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
Which factors predict the occurrence of thoracic injury in children with potential multiple trauma or life threatening injuries?
P: patients children with potential multiple trauma or life threatening injury (< 16 years);
I: intervention prognostic factors for predicting thoracic injury;
C: comparison absence of prognostic factors for predicting thoracic injury;
O: outcome measure risk on thoracic injury;
T: timing Initial trauma admission;
S: setting (pediatric) emergency department.
Ideally, we would include studies investigating the clinical impact of a prognostic model. Because we did not find such studies, we decided to include studies with at least internal validation of a multivariable model. Studies investigating the prognostic value of factors using multivariate analysis without validation were excluded, because they are inferior to the studies described above. If relevant, these studies are described elsewhere.
Relevant outcome measures
The guideline development group considered the risk on intra-thoracic injury as critical outcome measures for decision making.
Thoracic injuries were defined as: traumatic aorta injury (dissection, laesion), rib fractures, sternal fractures, pulmonary contusion, vascular injury, pneumothorax, pneumomediastinum, cor contusion and haemathorax.
A priori, the guideline committee did not define the outcome measures listed above but used the definitions used in the studies.
The guideline committee considered an increased risk on thoracic injury of 10% as clinically important.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 22nd of April 2020. The detailed search strategy can be found under the tab Methods. The systematic literature search resulted in 959 hits. Studies were selected based on the following criteria: primary research on the performance of a multivariable model for predicting thoracic injury in children with potential multiple trauma or life threatening injuries. As these studies were not available, studies on risk factors for thoracic injury were included when they used a multivariable analyses and performed validation of their model. In total, 14 studies were initially selected based on title and abstract screening. After reading the full text, 13 studies were excluded (see the table with reasons for exclusion under the tab Methods) and 1 study was included.
Results
In total, 1 observational study was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Golden, J., Isani, M., Bowling, J., Zagory, J., Goodhue, C. J., Burke, R. V., Upperman, J. S., & Gayer, C. P. (2016). Limiting chest computed tomography in the evaluation of pediatric thoracic trauma. The journal of trauma and acute care surgery, 81(2), 271–277. https://doi.org/10.1097/TA.0000000000001110.
- Holmes, J. F., Sokolove, P. E., Brant, W. E., & Kuppermann, N. (2002). A clinical decision rule for identifying children with thoracic injuries after blunt torso trauma. Annals of emergency medicine, 39(5), 492–499. https://doi.org/10.1067/mem.2002.122901.
- Stephens, C. Q., Boulos, M. C., Connelly, C. R., Gee, A., Jafri, M., & Krishnaswami, S. (2017). Limiting thoracic CT: a rule for use during initial pediatric trauma evaluation. Journal of pediatric surgery, 52(12), 2031–2037. https://doi.org/10.1016/j.jpedsurg.2017.08.039.
- Yanchar, N. L., Woo, K., Brennan, M., Palmer, C. S., Zs Ee, M., Sweeney, B., & Crameri, J. (2013). Chest x-ray as a screening tool for blunt thoracic trauma in children. The journal of trauma and acute care surgery, 75(4), 613–619. https://doi.org/10.1097/TA.0b013e31829bb7fe.
Evidence tabellen
Evidence table for prognostic factor studies
Research question: Which factors predict the occurrence of thoracic injury in children with potential multiple trauma or life threatening injuries?
Pre-defined core set of confounders:
- age
- BMI
- severity of the trauma
| Study reference | Study characteristics | Patient characteristics | Prognostic factor(s) | Follow-up | Estimates of prognostic effect | Comments |
| Holmes, 2002 |
Type of study: observational study
Setting and country: prospective, USA
Funding and conflicts of interest: not reported. |
Inclusion criteria: >10 feet); decreased level of consciousness (Glasgow Coma Scale (GCS) <15) in association with blunt torso trauma; blunt traumatic event with extremity paralysis; multiple bone fractures; a CRAMS score (measuring circulation, respiration, abdomen, motor responses, and speech) of 8 or less3; a physical examination suggestive of torso injury after blunt trauma; or a Pediatric Trauma Score of 8 or less after blunt trauma.
Exclusion criteria:
N= 986 patients.
Mean age ± SD: 8.3 +/- 4.8 years.
Sex: not reported.
Potential confounders or effect modifiers: all other prognostic factors were considered potential confounders when they were not the factor of interest. |
Describe prognostic factor(s) and method of measurement:
Independent predictors were: low systolic blood pressure, elevated respiratory rate, abnormal thoracic examination results, abnormal thoracic auscultation findings, abdominal tender
Multiple logistic regression and binary recursive partitioning were performed to develop a model that maximized sensitivity for identifying children with thoracic injuries, while also maximizing specificity. The authors planned to use those variables identified in either the recursive partitioning or logistic regression analyses for inclusion in the decision rule. |
Duration or endpoint of follow-up: patients were followed through their hospital courses for identification of thoracic injuries and therapy for those injuries. Patients discharged to home after ED evaluations were contacted by telephone 1 week after discharge to determine clinical status. Patients without symptoms of thoracic injury at the telephone follow-up were considered not to have thoracic injury.
For how many participants were no complete outcome data available?
Reasons for incomplete outcome data described? Telephone follow-up was obtained for 329 (90%) of the 365 patients discharged to home. |
(Adjusted) Factor-outcome associations (include SEs or 95%CI and p-value if available):
Incremental predictive value1: |
The bootstrap analysis identified all 5 variables as independent predictors of thoracic injury in more than 50% of the 1,000 bootstrap iterations.
The recursive partitioning analysis identified the same 5 predictor variables, but added femur fracture as an important variable in the model.
All patients underwent chest radiographs, but these are not perfectly sensitive for identification of all patients with thoracic injuries. As many patients did not undergo further evaluation beyond chest radiography, and thus some chest injuries may have gone undetected. |
1 Incremental predictive value is the predictive value beyond standard demographic factors and the established risk factors (e.g. smoking, blood pressure, lipid levels, diabetes, cancer stage, etc.), for example change in c-statistic.
Table of quality assessment - prognostic factor (PF) studies
Based on: QUIPSA (Haydn, 2006; Haydn, 2013)
Research question: Which factors predict the occurrence of thoracic injury in children with potential multiple trauma or life threatening injuries?
|
Study reference
(first author, year of publication) |
Study participation1
Study sample represents the population of interest on key characteristics?
(high/moderate/low risk of selection bias) |
Study Attrition2
Loss to follow-up not associated with key characteristics (i.e., the study data adequately represent the sample)?
(high/moderate/low risk of attrition bias) |
Prognostic factor measurement3
Was the PF of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to PF) |
Outcome measurement3
Was the outcome of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to outcome) |
Study confounding4
Important potential confounders are appropriately accounted for?
(high/moderate/low risk of bias due to confounding) |
Statistical Analysis and Reporting5
Statistical analysis appropriate for the design of the study?
(high/moderate/low risk of bias due to statistical analysis) |
| Holmes, 2002 | Low risk of selection bias. | Low risk of selection bias. | Low risk of measured bias related to PFs. | Low risk of measurement bias related to the outcome. | Low risk of bias due to confounding. | Low risk of bias due to statistical analysis. |
A https://methods.cochrane.org/sites/methods.cochrane.org.prognosis/files/public/uploads/QUIPS%20tool.pdf.
1 Adequate description of: source population or population of interest, sampling and recruitment, period and place of recruitment, in- and exclusion criteria, study participation, baseline characteristics.
2 Adequate response rate, information on drop-outs and loss to follow-up, no differences between participants who completed the study and those lost to follow-up.
3 Method of measurement is valid, reliable, setting of measurement is the same for all participants.
4 Important confounders are listed (including treatments), method of measurement is valid, reliable, setting of measurement is the same for all participants, important confounders are accounted for in the design (matching, stratification, initial assembly of comparable groups), or analysis (appropriate adjustment).
5 Enough data are presented to assess adequacy of the analysis, strategy of model building is appropriate and based on conceptual framework, no selective reporting.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-05-2022
Beoordeeld op geldigheid : 01-03-2022
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de radiologische diagnostiek bij de acute trauma-opvang van kinderen.
Werkgroep
- Drs. J. (Joost) van Schuppen, radioloog, Amsterdam UMC te Amsterdam, NVvR (voorzitter)
- Drs. M.H.G. (Marjolein) Dremmen, radioloog, Erasmus MC te Rotterdam, NVvR (voorzitter)
- Dr. R. (Roel) Bakx, kinderchirurg, Amsterdam UMC te Amsterdam, NVvH
- Drs. L.G.J. (Linda) Bel, SEH-arts, Noordwest Ziekenhuisgroep te Alkmaar, NVSHA
- Drs. I.G.J.M. (Ivar) de Bruin, traumachirurg, UMC Utrecht te Utrecht, NVvH (voorzitter)
- Ir. D.J.W. (Dennis) Hulsen, klinisch fysicus, Jeroen Bosch Ziekenhuis te Den Bosch, NVKF
- Drs. M. (Maayke) Hunfeld, kinderneuroloog, Erasmus MC te Rotterdam, NVN
- Drs. D.R.J. (Dagmar) Kempink, orthopeed, LUMC te Leiden en Erasmus MC te Rotterdam, NOV
- Drs. M.J. (Maeke) Scheerder, radioloog, Amsterdam UMC te Amsterdam, NVvR
- Dr. A. (Annelie) Slaar, radioloog, Dijklander Ziekenhuis te Hoorn, NVvR
- Drs. L. (Linda) van Wagenberg, anesthesioloog-kinderintensivist, UMC Utrecht te Utrecht – onder volledig mandaat van Prof. dr. J.B.M. (Job) van Woensel, kinderintensivist, Emma Kinderziekenhuis Amsterdam UMC, NVK
klankbordgroep:
- Dr. L.N.A. (Leon) van Adrichem, plastisch chirurg, Velthuis kliniek te Rotterdam en Den Haag, NVPC
- Dr. D.R. (Dennis) Buis, neurochirurg, Amsterdam UMC te Amsterdam, NVvN
- Drs. M.M.A.C. (Martine) van Doorn, interventieradioloog, NVvR
- Dr. L. Dubois, (Leander) MKA-chirurg, Amsterdam UMC te Amsterdam, NVMKA
- Dr. M.J.W. (Marcel) Greuter, klinisch fysicus, UMCG te Groningen, NVKF
- Dr. L.A. (Luitzen) Groen, kinderuroloog, Amsterdam UMC te Amsterdam, NVU
- Drs. M. (Miranda) Prins, anesthesioloog-intensivist, Isala te Zwolle, NVA
Met ondersteuning van
- Drs. K. (Kristie) Venhorst, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. (Romy) Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Miriam) van der Maten, junior literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schuppen |
Radioloog, Amsterdam UMC, locatie AMC |
- Lid bestuur sectie kinderradiologie NVvR - Lid bestuur Stichting Bevordering Kinderradiologie (SBKR) |
Geen 6-5-2019 |
Geen actie vereist, geen relevante belangen |
|
Dremmen |
Radioloog, Erasmus MC (kinderradiologie) |
- 2 dagen cursus gegeven over kindertrauma (betaald) |
Geen 26-4-2019 |
Geen |
|
Bruin, de |
Traumachirurg, UMC Utrecht |
- ATLS instructeur - Lid diverse beroepsverenigingen: NVvH, NVT, AO-trauma, ESTES, OTA |
Geen 24-5-2019 |
Geen |
|
Slaar |
Radioloog, Dijklander ziekenhuis, locatie Hoorn |
- Eigenaar Diagnose in beeld: 3-wekelijkse radiologische casuïstiek per app of per e-mail (onbetaald) |
Geen 24-4-2019 |
Geen |
|
Scheerder |
Radioloog, Amsterdam UMC, locatie AMC |
- Voorzitter sectie Acute Radiologie Nederland (onbetaald) - Voorzitter Richtlijn initiële radiodiagnostiek bij volwassen traumapatiënten (betaald) |
Geen 1-5-2019 |
Geen |
|
Bakx |
Kinderchirurg, Amsterdam UMC |
- Bestuurslid SHK (onbetaald) - Voorzitter richtlijnencommissie NVvH (onbetaald) |
Geen 4-6-2019 |
Geen |
|
Hunfeld |
Neuroloog – kinderneuroloog, Erasmus MC – Sophia kinderziekenhuis |
- |
Geen 1-5-2019 |
Geen |
|
Kempink |
Kinder-orthopaedisch chirurg – traumatoloog werkzaam in: Erasmus MC - Sophia Kinderziekenhuis (70%) en LUMC (30%) |
- |
Geen 9-5-2019 |
Geen |
|
Wagenberg, van |
Anesthesioloog- kinderintensivist , Wilhelmina kinderziekenhuis |
- |
Geen 23-7-2019 |
Geen |
|
Bel |
SEH-arts, Noordwest Ziekenhuisgroep |
- |
Geen 8-7-2019 |
Geen |
|
Hulsen |
Klinisch Fysicus, Jeroen Bosch Ziekenhuis |
- Externe promovendus, MUMC+ (onbetaald) - Secretaris commissie stralingshygiëne, NVKF (onbetaald) |
Geen 6-10-2019 |
Geen |
|
Woensel, van |
Hoofd PICU Amsterdam UMC |
- |
Geen |
Geen |
Inbreng patiëntenperspectief
Stichting Kind en Ziekenhuis heeft input gegeven in de schriftelijke Invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop Waarden en voorkeuren van patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten bij de radiologische diagnostiek bij de acute trauma-opvang van kinderen. Tevens zijn er knelpunten aangedragen door: LNAZ, NAPA, NHG, NOV, NVK, NVKMA, NVN, NVNN, NVZ, NVvH, NVvR, Stichting Kind en Ziekenhuis, V&VN, ZiNL en ZN via een schriftelijke knelpuntenanalyse. De aangedragen knelpunten (zie bijlage 1) is besproken in de werkgroep. Op basis van de verkregen input zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de aan de werkgroep deelnemende (wetenschappelijke) verenigingen en aan Stichting Kind en Ziekenhuis voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Radiologische diagnostiek bij de acute trauma-opvang van kinderen |
|
|
Uitgangsvraag 3: Bij welke traumamechanismen en welke bevindingen van aanvullend onderzoek is er sprake van een verhoogd risico op aortaletsel (dissectie, laesie), letsel aan de grote vaten, rib-/sternumfracturen, longcontusie, pneumothorax, hematomediastinum? |
|
|
Database(s): Medline, Embase |
Datum: 22-4-2020 |
|
Periode: 2000 - april 2020 |
Talen: Engels |
|
Literatuurspecialist: Miriam van der Maten |
|
|
Toelichting en opmerkingen: Na afstemming met de adviseur is voor deze vraag gezocht op de P en de O van de PICO in combinatie met een prognostisch blok. De sleutelartikelen van Holscher en Golden worden NIET gevonden met de search. Ze vallen uit het prognostische stuk. Verder zouden ze wel uit de zoekopdracht komen. De overige artikelen worden gevonden met de zoekopdracht. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
30 |
38 |
54 |
|
RCTs |
87 |
85 |
151 |
|
Observationele studies |
276 |
585 |
754 |
|
Totaal |
393 |
708 |
959 |
Zoekverantwoording
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 ((exp "Wounds and Injuries"/ or exp Life Support Care/) and (exp Pediatrics/ or exp Child/)) or ('paediatric advanced life support' or 'pediatric advanced life support').ti,ab,kf. or ((child* or paediatric or pediatric or adolescent* or infant* or newborn* or "new born*" or neonat* or baby* or babies) adj4 (trauma* or injur* or polytrauma)).ti,ab,kf. (143386) 2 exp Aortic Rupture/ or (aort* adj3 (trauma* or injur* or dissection)).ti,ab,kf. or exp Rib Fractures/ or ((costal or rib* or sternal) adj3 fracture*).ti,ab,kf. or (exp Contusions/ and (lung* or pulmonary).ti,ab,kf.) or ((contusion or bruis*) adj3 (lung* or pulmonary)).ti,ab,kf. or (('blood vessel*' or vascular or subclavian) adj3 (damage or lesion* or trauma* or injur* or accident*)).ti,ab,kf. or exp Pneumothorax/ or pneumothorax.ti,ab,kf. or exp Hemothorax/ or (haematothorax or haemothorax or hemathorax or hemothorax).ti,ab,kf. or exp Thoracic Injuries/ or ((chest or thora*) adj3 (trauma* or injur*)).ti,ab,kf. (129187) 3 exp Decision Support Systems, Clinical/ or exp Decision Support Techniques/ or exp Risk Factors/ or exp Risk Assessment/ or exp Risk/ or exp Models, Statistical/ or exp Prognosis/ or exp Decision Making/ or exp Clinical Decision-Making/ or exp Delayed Diagnosis/ or exp Diagnostic Errors/ or indicat*.ti,ab,kf. or precipitat*.ti,ab,kf. or symptom*.ti,ab,kf. or predict*.ti,ab,kf. or correlate*.ti,ab,kf. or multivariate.ti,ab,kf. or algorithm.ti,ab,kf. or pathway.ti,ab,kf. or (miss* adj3 diagnos*).ti,ab,kf. or ((risk* or prognos*) adj3 factor*).ti,ab,kf. or (risk adj3 assess*).ti,ab,kf. or validat*.ti,ab,kf. or 'adjusted risk ratio'.ti,ab,kf. or 'adjusted odds ratio'.ti,ab,kf. or 'adjusted risk estimate'.ti,ab,kf. (9192818) 4 1 and 2 and 3 (1901) 5 limit 4 to (english language and yr="2000 -Current") (1156) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (442170) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1973109) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3414104) 9 5 and 6 (38) 10 (5 and 7) not 9 (85) 11 (5 and 8) not (9 or 10) (585) 12 9 or 10 or 11 (708) |
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
| Auteur en jaartal | Redenen van exclusie |
| Shannon, 2019 | Geen correctie voor mogelijke confounders. |
| Weerdenburg, 2019 | De studie bevat een model, maar is niet intern gevalideerd. |
| Abd El-Shafy, 2018 | Geen correctie voor mogelijke confounders |
| McNamara, 2017 | Geen correctie voor mogelijke confounders. |
| Stephens, 2017 | Geen correctie voor mogelijke confounders. |
| Fatihoglu, 2016 | Voldoet niet aan PICO: studiepopulatie omvat ook volwassenen. |
| Lee, 2014 | Voldoet niet aan PICO: studie beschrijft geen risicofactoren voor thoracaal trauma. |
| Yanchar, 2013 | De studie bevat geen model, maar er wordt wel naar individuele factoren gekeken waarbij wordt gecorrigeerd voor mogelijke confounders. |
| Wylie, 2009 | Geen correctie voor mogelijke confounders. |
| Deng, 2008 | Voldoet niet aan PICO: geen risicofactoren voor thoracaal trauma. |
| Inan, 2007 | Voldoet niet aan PICO: studie beschrijft geen risicofactoren voor thoracaal trauma. |
| Gittelman, 2003 | De studie bevat een model, maar is niet intern gevalideerd. |
| Holmes, 2001 | Voldoet niet aan PICO: beschrijvende studie. |
