CTA-halsvaten
Uitgangsvraag
Wanneer dient er een CTA-halsvaten in de initiële diagnostiek van kinderen jonger dan 16 jaar met potentieel meervoudig letsel na trauma verricht te worden?
Aanbeveling
Overweeg een (aanvullende) CTA-halsvaten bij kinderen met traumatisch letsel met één van de volgende risicofactoren op het ontstaan van blunt cerebrovascular injury*:
- Focale afwijkingen (inclusief syndroom van Horner) bij neurologisch onderzoek die niet verklaard wordt door het vastgestelde radiologisch traumatisch letsel (blanco CT-hersenen of CT-CWK).
- Bloeding uit nek/mond of keel verdacht van arterieel letsel.
- Uitgebreid hematoom/letsel hals of souffle hoorbaar.
- Herseninfarct op CT-hersenen.
- Le Fort aangezichtsfracturen type 2 of 3.
- Schedelbasisfractuur met betrokkenheid van canalis caroticum en/of os petrosum.
- Fractuur van de cervicale wervelkolom volgens volgende patroon:
- Fracturen C1, C2, of C3.
- Fractuur met betrokkenheid van foramen transversarium.
- Fractuur met subluxatie CWK.
- Eye Motor Verbal (EMV) score < 8 met aanwezigheid van diffuus axonaal letsel en/of mandibulafractuur en/of geen cerebrale oorzaak voor de lage EMV.
- Thoracaal vasculair letsel.
- Directe indicatie: Verhanging, letsel door autogordel of stomp halsletsel.
*Een (aanvullende) CTA-halsvaten dient alleen overwogen te worden indien de klinische situatie van de patiënt dit toelaat
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De studie van Cook (2018) laat zien dat het gebruik van de Denver criteria ten opzichte van de EAST guidelines en de Utah Score leidt tot het minste aantal fout negatieven en dus het minste aantal gemiste BCVI. Na de Denver criteria lijkt screening op basis van EAST guidelines het meest veilig. De bewijskracht is echter zeer laag, aangezien het maar één retrospectieve studie betreft die een directe vergelijking maakt tussen verschillende screeningsmethoden en het aantal patiënten met een BCVI beperkt is (n=96). Het is dus goed mogelijk dat een nieuwe studie de conclusies doen veranderen.
In de studie van Cook (2018) is alleen gekeken naar het percentage fout-negatieven. Op basis van de uitgebreidheid van de Denver criteria kan verwacht worden dat met het gebruik van deze screeningsmethode meer patiënten (onnodig) scans zullen ondergaan en er dus sprake is van een groter percentage fout-positieven.
Van de drie screeningsmethoden die in de geanalyseerde literatuur zijn onderzocht, is alleen de Utah Score speciaal aangepast voor de pediatrische populatie. De Denver criteria en EAST guidelines zijn tot stand gekomen op basis van gegevens van een volwassen populatie. Hierdoor is het mogelijk dat er risicofactor(en) missen die alleen relevant zijn voor de pediatrische populatie of dat er factoren worden meegenomen die alleen bij volwassenen geassocieerd zijn met een verhoogd risico. Dit kan leiden tot suboptimale screening of tot onnodige blootstelling aan straling. In de EAST guideline wordt wel geadviseerd om dezelfde criteria zowel voor volwassen als kinderen te gebruiken (Bromberg, 2010).
Met de literatuursearch zijn een aantal recente studies gevonden die door middel van multivariaat analyse onderzoek hebben gedaan naar de risicofactoren voor een BCVI in een pediatrische populatie. De studie van Rossidis (2018) vindt naast risicofactoren die reeds beschreven zijn voor de volwassen populatie, ook een associatie met het mannelijk geslacht en een hogere Injury Severity Score (ISS). In Harris (2019) worden alleen risicofactoren gevonden die reeds bekend zijn bij de volwassen populatie. Aanvullend wordt gekeken naar type ongeluk, waarbij een BCVI wordt geassocieerd met een botsing met een motorvoertuig of aanrijding als voetganger. In Marenco (2019) worden alleen risicofactoren onderzocht die reeds bekend zijn van een volwassen populatie. Daarbij wordt geen associatie gevonden met een mandibulafractuur, aangezichtsfractuur of epistaxis. Bij kinderen onder de 11 jaar wordt geen enkele associatie gevonden met een van de onderzochte risicofactoren. Door de variatie in onderzochte factoren zijn deze studies onderling niet goed vergelijkbaar. Het effect van toevoegen of weglaten van de genoemde factoren bij de screening voor een BCVI is niet onderzocht en daarom erg onzeker.
Kosten (middelenbeslag)
Het vervaardigen van een CTA-halsvaten zal extra kosten met zich meebrengen. Eventuele scholing van de radiodiagnostisch laboranten zal tevens extra kosten met zich meebrengen. Echter elk herseninfarct wat wordt voorkomen leidt potentieel tot beperken van extra zorg en invaliditeit.
Aanvaardbaarheid, haalbaarheid en implementatie
Een CTA-halsvaten bij kinderen vereist andere kennis dan een blanco CT-scan of een CTA-halsvaten bij volwassenen. Centra die daar nog niet mee werken zullen hun laboranten moeten trainen op uitvoering, werkprotocollen moeten opstellen en instellingen van apparatuur erop moeten afstemmen.
Rationale
Een traumatische dissectie van de halsslagaders kan leiden tot een herseninfarct. Hoe hoog dit percentage bij kinderen is, is tot op heden niet bekend. Ook is niet aangetoond welke behandeling (trombocytenaggregatieremmers of antistolling) er gestart moet worden ter voorkoming van een herseninfarct. Echter, indien er vastgesteld is dat er sprake is van vasculair letsel, dan creëert dit alertheid op het ontstaan van eventuele uitvalsverschijnselen welke kunnen wijzen op een herseninfarct. Tevens kan er worden afgewogen of er wel of niet gestart moet worden met trombocytenaggregatieremmers of antistolling, afhankelijk van de medische situatie van de individuele patiënt. Om bovenstaande redenen is het (ondanks de lage bewijskracht) niet wenselijk een traumatische dissectie te missen en dient een CTA halsvaten overwogen te worden indien er potentiële risicofactoren zijn op het ontstaan van een traumatische dissectie van de halsslagaders. Dit met de wetenschap dat dit zal betekenen dat er CTA’s gemaakt gaan worden die geen afwijkingen laten zien. De potentiële risicofactoren zijn afgeleid van de Denver criteria en East guidelines, omdat deze modellen de hoogste sensitiviteit lieten zien.
Onderbouwing
Achtergrond
Bij kinderen met traumatisch hoofd-/hersenletsel bestaat een verhoogd risico op letsel van de halsvaten (dissecties). Dit is aan te tonen door middel van een CTA-halsvaten. Voor de indicatie van een CT-hersenen zijn duidelijke richtlijnen. Het is echter niet duidelijk wanneer er naast een CT-hersenen tevens een CTA-halsvaten geïndiceerd is. Met CTA-halsvaten wordt bedoeld CT-Angiografie van zowel de extracraniële carotiden en vertebrales, als het intracraniële verloop tot aan ten minste de cirkel van Willis. Een CTA betekent echter meer stralingsbelasting. Om te voorkomen dat veel kinderen onnodig een CTA krijgen, wat extra stralingsbelasting met zich meebrengt, kijken we wat indicaties zijn om een CTA uit te voeren. In deze module wordt voor (stomp) traumatisch letsel van de halsvaten de term ‘blunt cerebrovascular injuries’ (BCVI) gebruikt.
Conclusies / Summary of Findings
|
Very low GRADE |
Sensitivity It is unclear whether the Denver criteria are more sensitive compared to EAST guidelines and Utah Score for identifying pediatric blunt cerebrovascular injuries.
Sources: (Cook, 2018) |
|
- GRADE |
Negative predictive value, positive predictive value and specificity It was not possible to draw a conclusion for these outcomes. |
Samenvatting literatuur
Description of studies
In the study of Cook (2018) three different screening models are compared for identifying pediatric blunt cerebrovascular injuries (BCVI): Denver Criteria, EAST guidelines and Utah Score. These models and their scoring systems are presented in Figure 4.1. The study included 96 trauma patients (≤18 years old), diagnosed with a BCVI confirmed by CTA or magnetic resonance angiogram (MRA) of the neck, admitted between 2005 and 2015. Patients were included when they survived at least 24 hours. Patients with a penetrating mechanism as well as patients with burn injuries were excluded. The three screening models were retrospectively applied to the radiographic and clinical data available for each subject. Primary outcome was a false negative screen, defined as a patient with a BCVI who would not have triggered screening.
The study of Kopelman (2011) determined whether adult criteria for evaluation of BCVI, as stated in the EAST guidelines, could be used in a pediatric population. Adult risk factors which are evaluated are Glasgow coma scale ≤8, skull base fracture, cervical spine fracture, complex facial fractures (LeFort II/III facial fracture), soft tissue injury to the neck, and neurologic signs or symptoms concerning for BCVI. The study included 1209 blunt trauma patients < 15 years old, admitted over a 5-year period to a Level I adult and pediatric trauma center. Of those, 127 patients retrospectively met adult BCVI screening criteria, 52 underwent evaluation of cerebrovasculature with CTA or DSA, and 11 were diagnosed with BCVI. The number of patients diagnosed with injury in whom adult risk factors were present is reported.
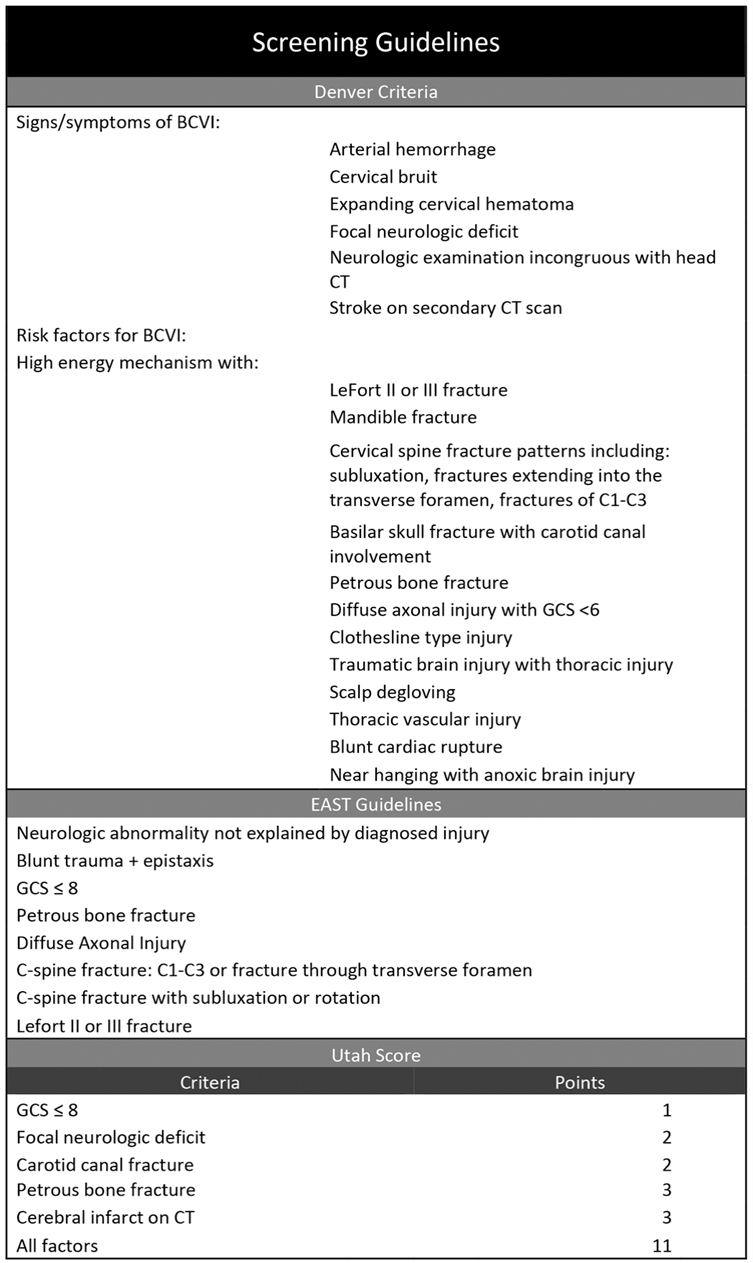
Figure 4.1 Screening models which are compared in Cook (2018)
Source: Cook (2018). NOTE: Within the pediatric specific Utah Score system, a score of 3 is the suggested threshold for obtaining imaging. Within Denver criteria and EAST guidelines, imaging is suggested after identification of one risk factor
Results
Sensitivity (crucial)
Of 96 children diagnosed with BCVI in the study of Cook (2018), respectively 16, 35, and 2 patients are missed when EAST guidelines, Utah Score, and Denver Criteria are applied. This difference in missed injuries when using Denver Criteria compared to EAST guidelines or Utah Score is significant (p<0.01). Sensitivity of EAST guidelines, Utah Score, and Denver Criteria for identifying pediatric BCVI is respectively 83%, 64%, and 98%.
Of 11 children diagnosed with BCVI in the study of Kopelman (2011), there was only one child in who no adult risk factors were present, resulting in a sensitivity of 91%.
Negative predictive value, positive predictive value and specificity (crucial)
The data in the included studies was insufficient to present results on negative predictive value, positive predictive value or specificity.
Level of evidence of the literature
Sensitivity (crucial)
The level of evidence regarding the sensitivity was downgraded by 3 levels because of study limitations as retrospective observational studies were included (risk of bias), small population size (imprecision), and because the model impact was not evaluated (phase of research).
Negative predictive value, positive predictive value and specificity (crucial)
The level of evidence could not be graded, as these outcomes were not reported in the included studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
Which factors best predict the occurrence of blunt cerebrovascular injuries (BCVI) in children with potential multiple trauma or life threatening injuries?
Ideally, we would include studies investigating clinical impact of a prognostic model. Because we did not find such studies, we decided to include studies with a less direct approach:
P: patients children with potential multiple trauma or life threatening injury (< 16 years);
I: intervention prognostic model for predicting BCVI;
C: comparison No use of prognostic model or different prognostic model for predicting BCVI;
O: outcome measure model performance (positive predicting value, negative predicting value, sensitivity, specificity):
Studies investigating the prognostic value of factors using multivariate analysis were excluded, because they are inferior to the studies described above. If relevant, these studies are described elsewhere.
Relevant outcome measures
The guideline development group considered positive predictive value, negative predictive value, sensitivity and specificity as critical outcome measures for decision making.
A priori, the guideline committee did not define the outcome measures listed above but used the definitions used in the studies.
The guideline committee considered a difference of 10% as clinically important.
Search and select (Methods)
The databases Medline (via OVID) and Embase via Embase.com were searched with relevant search terms until 10th of March 2020. The detailed search strategy can be found under the tab Methods. The systematic literature search resulted in 1610 hits. Studies were selected based on the following criteria: primary research on the performance of a multivariable model for predicting BCVI in children with potential multiple trauma or life threatening injuries. In total, 31 studies were initially selected based on title and abstract screening. After reading the full text, 29 studies were excluded (see the table with reasons for exclusion under the tab Methods) and 2 studies were included.
In total, 2 observational studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the isk of bias is summarized in the risk of bias tables.
Evidence tabellen
Evidencetabellen
Evidence table for prediction modelling studies (based on CHARMS checklist)
Research question: Which factors best predict the occurrence of blunt cerebrovascular injuries (BCVI) in children with potential multiple trauma or life threatening injuries?
|
Study reference |
Study characteristics |
Patient characteristics |
Candidate predictors |
Model development, performance and evaluation |
Outcome measures and results |
Comments Interpretation of model |
|
Cook, 2018 |
Source of data1 and date: retrospective cohort study, 2005-2015
Setting/number of centres and country: High volume, Level-1 adult and pediatric trauma center, VERSUS.
Funding and conflicts of interest: funding not reported, authors declare that they have no conflicts of interest as it regards this study. |
Recruitment method2: All admitted participants fulfilling criteria.
Inclusion criteria: admitted trauma patients ≤18 years old who suffered a blunt injury or strangulation, survived at least 24 hours and who either underwent CTA or magnetic resonance angiogram (MRA) neck during their initial trauma evaluation and were diagnosed with a BCVI confirmed by CTA or MRA.
Exclusion criteria: Patients with a penetrating mechanism as well as burn patients.
Participants: N= 96
Median age: 16 (1st quartile 13, 3rd quartile 17)
Sex: 59% M / 61% F
Other important characteristics: most (60%) were injured following a motor vehicle crash.
|
Describe candidate predictors3 and method and timing of measurement:
Data regarding patient demographics, injuries and clinical course were obtained from the institutional trauma registry and manual review of medical records.
Denver criteria Predictor 1: Arterial haemorrhage Predictor 2: Cervical bruit Predictor 3: Expanding cervical hematoma Predictor 4: Focal neurologic deficit* Predictor 5: Neurologic examination incongruous with head CT* Predictor 6: Stroke on secondary CT scan Predictor 7: High energy mechanism with: - LeFort II or III fracture - mandible fracture - cervical spine fracture patterns* - basilar skull fracture with carotid canal involvement - petrous bone fracture, - diffuse axonal injury with GCS <6* - Clothesline type injury - Traumatic brain injury with thoracic injury - Scalp degloving* - Thoracic vascular injury - Blunt cardiac rupture - Near hanging with anoxic brain injury
EAST guidelines Predictor 1: Neurologic abnormality not explained by diagnosed injury* Predictor 2: Blunt trauma + epistaxis Predictor 3: GCS ≤8 Predictor 4: Petrous bone fracture Predictor 5: Diffuse axonal injury* Predictor 6: C-spine fracture: C1-C3 or fracture through transverse foramen* Predictor 7: C-spine fracture with subluxation or rotation* Predictor 8: Lefort II or III fracture
Utah Score Predictor 1: GCS ≤8 (1 point) Predictor 2: Focal neurologic deficit* (2 points) Predictor 3: Carotid canal fracture (2 points) Predictor 4: Petrous bone fracture (3 points) Predictor 5: Cerebral infarct on CT (3 points)
* focal neurologic findings: positive if there was either an abnormal Glasgow Coma Score (GCS) or a localizing motor/sensory finding on admission.
Cervical spine injuries: positive if any injury was identified.
Neurologic status incongruous with the severity of brain injury: accurately scoring this criterion was not possible with the available charting.
diffuse axonal injury (DAI):not well captured in registry data and difficult to identify on admission CT imaging. Therefore admission GCS ≤ 6 was used as a surrogate for DAI.
scalp degloving: positive if a laceration requiring more than a single staple was identified.
Number of participants with any missing value4? Not reported
How were missing data handled5? Not reported |
Development
Modelling method6: Not applicable (study of existing models)
Performance
Calibration measures7 and 95%CI: Not applicable
Discrimination measures8 and 95%CI: Not applicable
Classification measures9: False negatives
Evaluation
Method for testing model performance10: External
|
Type of outcome: single
Definition and method for measurement of outcome: a patient with a BCVI who would not have triggered screening based on model/screening guidelines.
We used a single positive item in the EAST guidelines and Denver criteria and a Utah Score ≥ 3 points as a screening threshold that warranted CTA confirmation.
Endpoint or duration of follow-up: Until death (>24 hrs) or hospital discharge
Number of events/outcomes: 96
RESULTS EAST guidelines: missed 16/96 (17%) of patients Utah Score missed 35/96 (36%) Denver Criteria missed 2/96 (2%).
Clinically significant screening failures (i.e. patients who did not meet clinical screening criteria and developed a CVA) EAST guidelines: 2/17 (11%) Utah Score: 1/17 (6%) Denver Criteria: would have indicated screening in all patients with neurologic sequelae of their injury.
Significantly fewer injuries would be missed using Denver Criteria than either EAST guidelines or Utah Score: p<0.01. |
Interpretation: Least BCVIs will be missed by screening with Denver criteria. However data on false positives are missing. Considering the number of predictors, it is assumable the Denver Criteria would result in more false positives and therefore more scans being performed.
Comparison with other studies? Utah Score was developed and validated in children with younger age. However, within the youngest quartile of the cohort, 7/24 (29%) patients with BCVI would still be missed.
EAST guidelines were also validated in a pediatric population in Kopelman (2011) with 9% false negatives. However used predictors are not the same? No other comparable studies were found
Generalizability? Good? |
|
Kopelman, 2011 |
Source of data1 and date: Retrospective cohort study over a 5 year period
Setting/number of centres and country: Single level I adult and pediatric trauma center, VS
Funding and conflicts of interest: Not reported |
Recruitment method2: all patients admitted to the trauma service after standard evaluation of blunt trauma were enrolled.
Inclusion criteria: pediatric blunt trauma patients (age <15 years) admitted over a 5-year period to a Level I adult and pediatric trauma center.
Exclusion criteria: -
Participants: N= 1209 > 127 patients retrospectively met adult BCVI screening criteria > 52 underwent evaluation of cerebrovasculature (CTA (n=49), DSA (n=1) or both (n-2) > 11/52 (21%) were diagnosed with BCVI
patients diagnosed with BCVI were predominantly male (64%) with an average age of 8 years (range, 0–14 years)
|
Describe candidate predictors3 and method and timing of measurement: The data were retrospectively analyzed for the presence of adult risk factors as outlined by the current EAST recommendations (2010) or the presence of signs or symptoms of BCVI.
EAST guidelines Predictor 1: Neurologic signs or symptoms concerning for BCVI Predictor 2: Basilar skull fracture Predictor 3: GCS ≤8 Predictor 4: Soft tissue neck injury Predictor 5: C-spine fracture Predictor 6: Lefort II or III facial fracture
Number of participants with any missing value4? Not reported
How were missing data handled5? Not reported
|
Development
Modelling method6: Not applicable (study of existing model)
Performance
Calibration measures7 and 95%CI: Not applicable
Discrimination measures8 and 95%CI: Not applicable
Classification measures9: False negatives
Evaluation
Method for testing model performance10: External
|
Type of outcome:
Definition and method for measurement of outcome: appropriate screening modalities for BCVI included computed tomographic arteriography (CTA) and/or digital subtraction cerebral angiography (DSA).
A board-certified neuroradiologist reviewed all CTA and DSA images without having knowledge of the prior diagnoses or treatment outcomes.
Endpoint or duration of follow-up: Death or hospital discharge
Number of events/outcomes: 11
RESULTS 1/11 (9%) false negative (no adult risk factor identified) |
Interpretation:
Comparison with other studies? See Cook (2018)
Generalizability? Good? |
1 Cohort, case-control, randomised trial participants, registry data
2 Consecutive participants?
3 Or describe number and type of candidate predictors, for example demographics, patient history, physical examination, additional testing, disease characteristics.
4 Include predictors and outcome
5 Complete-case analysis, imputation, other method
6 Logistic, survival, neural networks, machine learning technique
7 Calibration plot, calibration slope, Hosmer-Lemeshow test
8 C-statistic, D-statistic, log-rank
9 Sensitivity, specificity, predictive values, net reclassification improvement and a priori cut points
10 Development dataset only (internal) or separate external validation
Table of quality assessment - prediction modelling studies
(The criteria used in this checklist are based on PROBASTA version 15/05/2019)
Research question: Which factors best predict the occurrence of blunt cerebrovascular injuries (BCVI) in children with potential multiple trauma or life threatening injuries?
|
Study reference (first author, year of publication)
Classification1
|
Participant selection 1) Appropriate data sources?2 2) Appropriate in- and exclusion?
Risk of bias: low/high/unclear |
Predictors 1) Assessed similar for all participants? 2) Assessed without knowledge of outcome? 3) Available at time the model is intended to be used?
Risk of bias: low/high/unclear |
Outcome 1) Pre-specified or standard outcome definition? 2) Predictors excluded from definition? 3) Assessed similar for all participants? 4) Assessed without knowledge of predictors? 5) Time interval between predictor and outcome measurement appropriate?
Risk of bias: low/high/unclear |
Analysis 1) Reasonable number of participants with event/outcome? 2) All enrolled participants included in analysis? 3) Missing data handled appropriately? 4) No selection of predictors based on univariate analysis? 5) Relevant model performance measures evaluated appropriately?3 6) Accounted for model overfitting4 and optimism? 7) Predictors and weights correspond to results from multivariate analysis?
Risk of bias: low/high/unclear |
Overall judgment
High risk of bias: at least one domain judged to be at high risk of bias.
Model development only: high risk of bias.
Risk of bias: low/high/unclear |
|
Cook, 2018 |
Low |
Low |
Low |
Unclear |
Unclear |
|
Kopelman, 2011 |
Low |
Low |
Low |
High |
High |
A Wolff RF, Moons KGM, Riley RD, Whiting PF, Westwood M, Collins GS, Reitsma JB, Kleijnen J, Mallett S; PROBAST Group. PROBAST: A Tool to Assess the Risk of Bias and Applicability of Prediction Model Studies. Ann Intern Med. 20191;170(1):51-58. doi: 10.7326/M18-1376. PubMed PMID: 30596875.
1 Development of model only / Development and external validation of model / External validation of model
2 Cohort, RCT or nested case-control study
3 For example calibration (total O:E ratio; expected outcome probabilities versus observed outcome frequencies) and discrimination (range 0.5 (no discriminative ability) to 1.0 (perfect discriminative ability)
4 Overfitting: for low ORs the predicted probability is too low, for high ORs the predicted probability is too high. Correcting is possible with shrinkage.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-03-2022
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de radiologische diagnostiek bij de acute trauma-opvang van kinderen.
Werkgroep
- Drs. J. (Joost) van Schuppen, radioloog, Amsterdam UMC te Amsterdam, NVvR (voorzitter)
- Drs. M.H.G. (Marjolein) Dremmen, radioloog, Erasmus MC te Rotterdam, NVvR (voorzitter)
- Dr. R. (Roel) Bakx, kinderchirurg, Amsterdam UMC te Amsterdam, NVvH
- Drs. L.G.J. (Linda) Bel, SEH-arts, Noordwest Ziekenhuisgroep te Alkmaar, NVSHA
- Drs. I.G.J.M. (Ivar) de Bruin, traumachirurg, UMC Utrecht te Utrecht, NVvH (voorzitter)
- Ir. D.J.W. (Dennis) Hulsen, klinisch fysicus, Jeroen Bosch Ziekenhuis te Den Bosch, NVKF
- Drs. M. (Maayke) Hunfeld, kinderneuroloog, Erasmus MC te Rotterdam, NVN
- Drs. D.R.J. (Dagmar) Kempink, orthopeed, LUMC te Leiden en Erasmus MC te Rotterdam, NOV
- Drs. M.J. (Maeke) Scheerder, radioloog, Amsterdam UMC te Amsterdam, NVvR
- Dr. A. (Annelie) Slaar, radioloog, Dijklander Ziekenhuis te Hoorn, NVvR
- Drs. L. (Linda) van Wagenberg, anesthesioloog-kinderintensivist, UMC Utrecht te Utrecht – onder volledig mandaat van Prof. dr. J.B.M. (Job) van Woensel, kinderintensivist, Emma Kinderziekenhuis Amsterdam UMC, NVK
klankbordgroep:
- Dr. L.N.A. (Leon) van Adrichem, plastisch chirurg, Velthuis kliniek te Rotterdam en Den Haag, NVPC
- Dr. D.R. (Dennis) Buis, neurochirurg, Amsterdam UMC te Amsterdam, NVvN
- Drs. M.M.A.C. (Martine) van Doorn, interventieradioloog, NVvR
- Dr. L. Dubois, (Leander) MKA-chirurg, Amsterdam UMC te Amsterdam, NVMKA
- Dr. M.J.W. (Marcel) Greuter, klinisch fysicus, UMCG te Groningen, NVKF
- Dr. L.A. (Luitzen) Groen, kinderuroloog, Amsterdam UMC te Amsterdam, NVU
- Drs. M. (Miranda) Prins, anesthesioloog-intensivist, Isala te Zwolle, NVA
Met ondersteuning van
- Drs. K. (Kristie) Venhorst, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. (Romy) Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Miriam) van der Maten, junior literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schuppen |
Radioloog, Amsterdam UMC, locatie AMC |
- Lid bestuur sectie kinderradiologie NVvR - Lid bestuur Stichting Bevordering Kinderradiologie (SBKR) |
Geen 6-5-2019 |
Geen actie vereist, geen relevante belangen |
|
Dremmen |
Radioloog, Erasmus MC (kinderradiologie) |
- 2 dagen cursus gegeven over kindertrauma (betaald) |
Geen 26-4-2019 |
Geen |
|
Bruin, de |
Traumachirurg, UMC Utrecht |
- ATLS instructeur - Lid diverse beroepsverenigingen: NVvH, NVT, AO-trauma, ESTES, OTA |
Geen 24-5-2019 |
Geen |
|
Slaar |
Radioloog, Dijklander ziekenhuis, locatie Hoorn |
- Eigenaar Diagnose in beeld: 3-wekelijkse radiologische casuïstiek per app of per e-mail (onbetaald) |
Geen 24-4-2019 |
Geen |
|
Scheerder |
Radioloog, Amsterdam UMC, locatie AMC |
- Voorzitter sectie Acute Radiologie Nederland (onbetaald) - Voorzitter Richtlijn initiële radiodiagnostiek bij volwassen traumapatiënten (betaald) |
Geen 1-5-2019 |
Geen |
|
Bakx |
Kinderchirurg, Amsterdam UMC |
- Bestuurslid SHK (onbetaald) - Voorzitter richtlijnencommissie NVvH (onbetaald) |
Geen 4-6-2019 |
Geen |
|
Hunfeld |
Neuroloog – kinderneuroloog, Erasmus MC – Sophia kinderziekenhuis |
- |
Geen 1-5-2019 |
Geen |
|
Kempink |
Kinder-orthopaedisch chirurg – traumatoloog werkzaam in: Erasmus MC - Sophia Kinderziekenhuis (70%) en LUMC (30%) |
- |
Geen 9-5-2019 |
Geen |
|
Wagenberg, van |
Anesthesioloog- kinderintensivist , Wilhelmina kinderziekenhuis |
- |
Geen 23-7-2019 |
Geen |
|
Bel |
SEH-arts, Noordwest Ziekenhuisgroep |
- |
Geen 8-7-2019 |
Geen |
|
Hulsen |
Klinisch Fysicus, Jeroen Bosch Ziekenhuis |
- Externe promovendus, MUMC+ (onbetaald) - Secretaris commissie stralingshygiëne, NVKF (onbetaald) |
Geen 6-10-2019 |
Geen |
|
Woensel, van |
Hoofd PICU Amsterdam UMC |
- |
Geen |
Geen |
Inbreng patiëntenperspectief
Stichting Kind en Ziekenhuis heeft input gegeven in de schriftelijke Invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop Waarden en voorkeuren van patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten bij de radiologische diagnostiek bij de acute trauma-opvang van kinderen. Tevens zijn er knelpunten aangedragen door: LNAZ, NAPA, NHG, NOV, NVK, NVKMA, NVN, NVNN, NVZ, NVvH, NVvR, Stichting Kind en Ziekenhuis, V&VN, ZiNL en ZN via een schriftelijke knelpuntenanalyse. De aangedragen knelpunten (zie bijlage 1) is besproken in de werkgroep. Op basis van de verkregen input zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de aan de werkgroep deelnemende (wetenschappelijke) verenigingen en aan Stichting Kind en Ziekenhuis voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekverantwoording
Algemene informatie
Zoekopbrengst
|
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zoekverantwoording
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
|
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Harris, 2019 |
Multivariaat analyse van individuele risicofactoren. Geen validatie. |
|
Marenco, 2019 |
Multivariaat analyse van individuele risicofactoren. Geen validatie. |
|
Orman, 2014 |
case report. |
|
Ravindra, 2015 |
Multivariaat analyse van individuele risicofactoren. Geen validatie. |
|
Rossidis,2018 |
Multivariaat analyse van individuele risicofactoren. Geen validatie. |
|
Biffl, 2006 |
Andere vraagstelling, bij volwassen patiënten. |
|
Dhillon, 2013 |
Univariaat analyse, alleen volwassen patiënten. |
|
Hersh, 2018 |
Case serie met andere vraagstelling. |
|
Mueller, 2011 |
Andere vraagstelling, alleen volwassen patiënten. |
|
Pierrot, 2006 |
case report. |
|
Abujamra, 2003 |
Andere vraagstelling. |
|
Bell, 2007 |
Andere vraagstelling, alleen volwassen patiënten. |
|
Corneille, 2011 |
Andere vraagstelling. |
|
Davies, 2011 |
Andere vraagstelling. |
|
Dewan, 2016 |
Andere vraagstelling. |
|
Fox, 2017 |
Alleen volwassen patiënten |
|
Geddes, 2016 |
Alleen volwassen patiënten |
|
Kieslich, 2002 |
case report. |
|
Kobata, 2017 |
Andere vraagstelling, alleen volwassen patiënten. |
|
Maillard, 2010 |
Case series. Andere vraagstelling en ook volwassenen. |
|
Meoded, 2011 |
Case series. Andere vraagstelling. |
|
Pandey, 2015 |
Andere vraagstelling. |
|
Rafay, 2006 |
Andere vraagstelling. |
|
Ravindra,2017 |
Case series. Andere vraagstelling. |
|
Soose, 2006 |
Andere vraagstelling. |
|
Tawil, 2008 |
Case series. Andere vraagstelling. |
|
Torina, 2005 |
Andere vraagstelling. Betreft volwassen patiënten. |
|
Windfuhr, 2001 |
case report. |
|
Yang, 2013 |
Andere vraagstelling. |
