Farmacotherapie
Uitgangsvraag
Wat is de plaats van farmacotherapie bij PTSS?
De uitgangsvraag omvat de volgende deelvragen:
- What are the benefits and risks of anti-depressants (SNRIs, SSRIs, NaSSaS, RIMAs, TCAs, MAIOs), compared with placebo for patients with PTSS?
- What are the benefits and risks of hypnotics (benzodiazepines and benzodiazepine-agonists) compared with placebo for patients with PTSS?
- What are the benefits and risks of anticonvulsants compared with placebo for patients with PTSS?
- What are the benefits and risks of alfa blockers compared with a placebo for patients with PTSS?
- What are the benefits and risks of antipsychotics compared with placebo for patients with PTSS?
- What are the benefits and risks of dopamine beta-hydroxylase inhibitors compared with placebo for patients with PTSS?
- What are the benefits and risks of ganaxalone compared with placebo for patients with PTSS?
Aanbeveling
Start een behandeling voor PTSS niet met farmacotherapie.
Overweeg farmacotherapie alleen voor een symptoomgerichte aanpak
- bij ernstige PTSS klachten,
- bij onvoldoende respons op psychologische behandeling als er geen directe toegang tot psychologische behandeling is.
Wees te allen tijde zeer terughoudend met het voorschrijven van benzodiazepines.
Hanteer altijd het principe van gezamenlijke besluitvorming (‘shared decision making’) bij het indiceren, voorschrijven en het al dan niet continueren van farmacotherapie.
Voorzie de patiënt van adequate informatie over de medicatie, zoals dosering, instructies, voorlichting, waarschuwingen, effecten, bijwerkingen en afbouwschema.
Monitor de respons en overweeg een andere vorm van (symptoomgerichte) farmacotherapie bij onvoldoende respons
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De wetenschappelijke onderbouwing voor de effectiviteit van de meeste farmacotherapeutische middelen bij de behandeling van PTSS is overwegend zwak. De huidige onderzoeken slagen er niet in overtuigend aan te tonen dat deze middelen daadwerkelijk effectief zijn in het verlichten van PTSS-symptomen (Williams et al., 2022).
Hoewel er soms enig bewijs voor effectiviteit bestaat, is dit vaak onvoldoende om tot duidelijke conclusies te komen, grotendeels vanwege de beperkingen in de studieopzet, zoals korte behandelperioden, gebrekkige randomisatie, kleine steekproeven en inconsistente resultaten. Zo zijn de behandelperioden vaak te kort om een volledig beeld te krijgen van de effectiviteit van de middelen op lange termijn. Daarnaast is er sprake van onduidelijkheid en problemen met betrekking tot de randomisatie en de toewijzing van behandelingen, wat kan leiden tot vertekeningen in de resultaten. Ook zijn de onderzoeksgroepen vaak te klein, wat de statistische kracht van de bevindingen vermindert en de betrouwbaarheid van de resultaten in twijfel trekt. De brede betrouwbaarheidsintervallen wijzen op een aanzienlijke mate van onzekerheid, en de onderzoeksresultaten zijn vaak heterogeen, wat betekent dat er veel variatie is tussen de bevindingen van verschillende studies. Bovendien lijkt het percentage uitvallers tijdens de behandeling vergelijkbaar te zijn tussen de verschillende onderzochte middelen en placebo, wat de bewijskracht voor effectiviteit verder ondermijnt.
Er werden geen resultaten gerapporteerd voor de uitkomstmaat ‘loss of diagnosis’. De gevolgen voor de kwaliteit van leven werden slechts beperkt gerapporteerd en alleen voor de alfablokker prazosine, waarbij geen effect op de vermindering van PTSS symptomen werd gevonden in vergelijking met placebo. Uit onze analyse blijkt dat er geen overtuigend bewijs is dat farmacotherapie een klinisch effectieve behandelmethode is voor PTSS-patiënten.
Deze bevindingen suggereren dat de positie van farmacotherapie ten opzichte van de eerdere richtlijn heroverwogen moet worden. Benzodiazepinen nemen hierin een opmerkelijke positie in, aangezien ze nog steeds veelvuldig worden voorgeschreven. Er zijn echter aanwijzingen uit studies dat het gebruik van benzodiazepinen het risico op het ontwikkelen van PTSS kan verhogen (Campos, 2022). Bovendien bieden benzodiazepinen geen langdurige of effectieve oplossing voor de behandeling van PTSS (Guina, 2015).
Vanwege de risico's op afhankelijkheid en het gebrek aan substantiële ondersteuning voor de effectiviteit ervan, wordt geadviseerd uiterst terughoudend te zijn bij het gebruik van benzodiazepines als onderdeel van de behandeling van PTSS. Het terugdringen van het voorschrijven van benzodiazepinen kan effectief worden gerealiseerd door het bevorderen van alternatieve behandelingsopties die bewezen effectief zijn. Bovendien kan ondersteuning worden geboden voor het stoppen met benzodiazepinen door verschillende afbouwstrategieën aan te bieden.
Kwaliteit van het bewijs
I Vergelijking van Farmacotherapie en Placebo
Placebo-gecontroleerde gerandomiseerde gecontroleerde onderzoeken (RCT's) spelen een belangrijke rol in het klinisch onderzoek naar de behandeling van PTSS. Dit komt vooral door de noodzaak om objectief bewijs te verzamelen over de effectiviteit van nieuwe therapieën. RCTs zijn essentieel voor het verkrijgen van regelgevende goedkeuring voor nieuwe medicijnen. Bovendien bieden ze een consistente vergelijkingsbasis om de werkzaamheid van verschillende behandelingen te beoordelen.
Echter, uit de studies blijkt dat RCT’s in het onderzoek naar farmacotherapie voor PTSS ook nadelen hebben. Een van deze nadelen is de vaak korte duur van de behandeling in vergelijking met placebo in de meeste studies. Daarnaast richt farmacotherapie zich mogelijk niet altijd op de achterliggende biologische mechanismen die een rol spelen bij PTSS. PTSS is een complexe aandoening met biologische, psychologische en sociale componenten, waardoor een enkele farmacologische interventie niet alle onderliggende mechanismen en de diversiteit aan symptomen effectief kan aanpakken.
II Voortschrijdend inzicht vergelijking tussen Farmacotherapie en Psychotherapie
In recente jaren heeft er een opmerkelijke verschuiving plaatsgevonden in de opzet van verschillende nieuwe studies naar de behandeling van PTSS. De traditionele RCT's met placebo worden aangevuld of vervangen door directe vergelijkingen tussen farmacotherapie en psychotherapie. Deze benadering erkent de noodzaak om de effectiviteit van medicatie in relatie tot niet-farmacologische behandelingen te beoordelen.
Recent gepubliceerde onderzoeken, waaronder een meta-analyse door Sonis en Cook (2019), hebben geprobeerd deze twee behandelmodaliteiten te vergelijken, maar vonden onvoldoende bewijs om een duidelijk verschil in effectiviteit tussen SSRI's en traumagerichte psychotherapieën voor het verminderen van PTSS-symptomen aan te tonen. Ondanks enige kritiek op de gebruikte studies vanwege potentiële bias en bovengenoemde beperkingen, bieden ze waardevolle inzichten en richtingen voor toekomstig onderzoek.
Bijvoorbeeld, het werk van Rauch (2019), dat juist geen significante verschillen vond tussen behandeling met sertraline en 'prolonged exposure' therapie na 24 weken, en Zoellner (2019), die de invloed van patiëntvoorkeur op behandeluitkomsten belichtte, tonen aan dat zowel medicatie als psychotherapie effectief kunnen zijn voor PTSS. Deze bevindingen benadrukken het belang van het betrekken van patiënten bij de keuze van hun behandeling om therapietrouw en uiteindelijk de effectiviteit van de behandeling te bevorderen.
Onderzoek naar toevoeging van farmacotherapie bij psychotherapie is schaars. De huidige resultaten van farmacologische augmentatie zijn over het algemeen gemengd en heterogeen voor de farmacologische middelen die in meer dan één studie zijn getest. Aanvullende studies en replicaties zijn nodig om te identificeren welke farmacologische middelen effectief zijn, in welke combinaties, en om patiëntgroepen te identificeren die het meeste baat hebben bij een op maat gemaakte behandeling van PTSS (Meister, 2023). Recent onderzoek naar de toevoeging van MDMA bij de psychotherapeutische behandeling van PTSS is veelbelovend maar nog niet voldoende implementeerbaar in de klinische praktijk (Hoskins, 2021).
III Benadering voor inzet farmacotherapie
Het is van belang te erkennen dat, hoewel volgens onze vastgestelde criteria de medicijnen die we hebben onderzocht geen klinisch significante voordelen vertoonden ten opzichte van placebo, het toch belangrijk is om de waarde van farmacotherapie voor PTSS vanuit een andere invalshoek te beschouwen (Friedman en Bernardi, 2017). De behandeling van PTSS vormt namelijk een uitdaging voor clinici vanwege de complexe en heterogene aard van de stoornis (Brady, 2000; Galatzer-Levy & Bryant, 2013). PTSS omvat uit een breed scala aan symptomen, gegroepeerd in vier hoofdclusters, die zich zeer divers kunnen manifesteren. Deze diversiteit van de symptomen van PTSS heeft een aanzienlijke nadelige impact op de ontwikkeling van effectieve farmacotherapieën. Deze stoornis omvat een breed scala aan symptomen, waaronder angst, depressie, slaapproblemen, hyperarousal, nachtmerries, dissociatie, en stemmingswisselingen. Deze variatie in symptomen maakt het lastig om één enkele farmacologische behandeling te ontwikkelen die effectief is voor alle patiënten. Deze diversiteit benadrukt daarentegen juist wel de mogelijkheid van een symptoomgerichte benadering, die zich niet richt op de stoornis als geheel maar op de individuele symptoomclusters, zoals de symptomen waar de patient het meeste last heeft (Birkeland, 2020).
Zo ondersteunt de betrokkenheid van diverse neurobiologische systemen in de pathofysiologie van PTSS, zoals het serotonerge, GABA, glutamaat, dopamine, en noradrenaline systemen (Singewald, 2023), rationale voor een dergelijke gerichte farmacotherapeutische interventie. Een hierop gebaseerde meer symptoom/systeemgerichte aanpak kan richting geven aan interventies gericht op specifieke pathofysiologische mechanismen, en biedt daarmee mogelijke behandelopties die nauw aansluiten bij de individuele symptomatologie van PTSS-patiënten.
Een symptoomgerichte farmacotherapeutische benadering kan helpen om de intensiteit en frequentie van symptomen te verminderen. SSRI's kunnen effectief zijn in het verminderen van angst- en depressieve symptomen, terwijl andere medicijnen, zoals prazosine, nuttig zijn bij de behandeling van slaapstoornissen en nachtmerries (Boschloo, 2023; Reist, 2021; Zhang, 2020). Hoewel bijvoorbeeld een symptoomgerichte aanpak voor slaapproblemen bij PTSS de slaapkwaliteit aanzienlijk kan verbeteren, leidt dit niet altijd tot een volledige verlichting van het gehele klachtenbeeld of een vermindering van PTSS als geheel. Andere symptomen, zoals angst en hyperarousal, kunnen blijven bestaan en vereisen aanvullende behandelingen om het algehele herstel te bevorderen. Ofschoon onderzoek naar deze symptoomgerichte behandelaanpak ontbreekt, en terughoudenheid in het voorschrijven van deze medicatie op zijn plaats is, kan er in individuele gevallen voor gekozen worden op deze wijze de meest invaliderende en meest verstorende symptomen gericht aan te pakken.
Op deze manier kan het ook een mogelijkheid geven om patiënten in staat te stellen om deel te nemen aan andere vormen van behandeling, zoals psychotherapie. Voor sommige patiënten kunnen de symptomen van PTSS immers zo overweldigend zijn dat ze niet in staat zijn om te profiteren van therapieën zoals cognitieve gedragstherapie (CGT) of eye movement desensitization and reprocessing (EMDR). Door gericht deze symptomen te verminderen, kan medicatie patiënten ook helpen om meer betrokken en ontvankelijk te zijn voor deze behandelingen.
Het is belangrijk te benadrukken dat terwijl farmacotherapie niet de benadeling van voorkeur is, de klinische indruk bestaat dat er verschillende symptoomclusters zijn waarvoor medicamenteuze interventies ingezet kunnen worden:
- Angst en paniek: SSRI's zoals sertraline en paroxetine zijn effectief in het verminderen van algemene angstsymptomen;
- Depressieve symptomen: SSRI's en SNRI's, inclusief venlafaxine, bieden ondersteuning bij depressieve symptomen;
- Slaapproblemen en nachtmerries: alfa1-adrenerge antagonisten zijn effectief voor PTSS-gerelateerde nachtmerries, zoals bijvoorbeeld prazosine of doxazosine, of lage dosis quetiapine;
- Hyperarousal en hypervigilantie, en psychotische symptomen: antipsychotica zoals quetiapine en olanzapine, risperidon of kort gebruik van propanolol kunnen deze symptomen verminderen;
- Stemmingswisselingen: stemmingsstabilisatoren zoals lamotrigine, valproaat of topiramaat kunnen ingezet worden;
- Dissociatieve symptomen: lamotrigine of antipsychotica, of naltrexon kunnen in sommige gevallen overwogen worden.
Sommige van de genoemde symptomen reagren vrij snel, en kunnen kortdurend zijn, zolas angst en paniek en interventie voor slaap, interventie gerricht op andere klachten vereisen en wat lager durende behnadeling (zolas stemming of depressieve symptomen). Het is belangrijk te benoemen dat er nog slechts weinig bekend is over de risico's op terugval, recidive van PTSS en de duurzaamheid van interventies. In het kader van gezamenlijke besluitvorming kunnen patiënten samen met hun zorgverlener beslissen om interventies af te bouwen, ondanks de onzekerheden die hieromtrent bestaan.
Waarden en voorkeuren van patiënten (geschreven door MIND)
Communicatie en bejegening bij farmacotherapie
Patiënten met PTSS ervaren vaak klachten zoals angst, nachtmerries, slaapproblemen, prikkelbaarheid, dissociatie en vermijdingsgedrag, die voortkomen uit onverwerkte trauma's. Psychotherapie speelt een centrale rol in de verwerking van trauma's, soms ondersteund door medicatie. Deze klachten, die zowel bio-psycho-sociale oorzaken en gevolgen hebben als variëren in ernst, vereisen een empathische en patiëntgerichte benadering in de behandeling.
Hoewel er geen medicatie tegen PTSS bestaat kan symptoomgerichte medicatie als verlichtend ervaren worden in het geval wanneer klachten als te heftig en/of te intrusief zijn. Hierbij is het belangrijk dat de zorgverlener(s) en de patiënt gezamenlijk tot een integraal behandelplan komen.
Bij het overwegen van farmacotherapie gericht op symptoomreductie bij (te) heftige PTSS-klachten:
- Overweeg de inzet van psychofarmaca voor symptoomclusters als de ernst van de symptomen de traumabehandeling en de traumaverwerking in de weg zitten indien er geen alternatieven zijn voor ondersteuning.
- Patiënten zijn gebaat bij een grondige voorlichting over effectiviteit (klinische relevantie) en over de specifieke werkzaamheid van medicatie, inclusief bijwerkingen en (klachten bij) afbouw van de medicatie.
- Het is belangrijk om de langetermijneffecten van medicatie te erkennen en te communiceren, aangezien deze vaak niet uitgebreid in studies worden onderzocht.
- Medicatie zo kort mogelijk, met een zo laag mogelijke dosering voorschrijven, inclusief een duidelijk afbouwplan. Tussendoor monitoren via regelmatige evaluaties en gezondheidschecks om het welzijn van de cliënt te waarborgen vanwege mogelijke bijwerkingen.
- Alternatieve ondersteuningsopties, zoals WRAP-cursussen en lotgenotencontact, bieden aanvullende hulpbronnen.
- Gebruik de beschikbare begeleidingsmogelijkheden binnen de GGZ en huisartspraktijken, zoals ondersteuning door POH-GGZ en herstelcoaches.
- Versterk het netwerk van de patiënt, inclusief netwerkpsychiatrie, om een ondersteunende omgeving te creëren.
In crisissituaties:
Beperk medicatie tot noodzakelijke gevallen. Patiëntervaringen tonen aan dat menselijk contact en ondersteuning essentieel zijn bij het overwinnen van een crisis.
Kosten (middelenbeslag)
Veel van de farmacotherapeutische opties voor PTSS worden off-label voorgeschreven, wat betekent dat ze worden gebruikt voor doeleinden buiten de indicaties waarvoor ze oorspronkelijk zijn goedgekeurd door regelgevende instanties. Bovendien zijn veel van deze medicijnen generiek, wat betekent dat ze geen patentbescherming meer hebben en over het algemeen tegen lagere kosten beschikbaar zijn. Deze factoren kunnen leiden tot aanzienlijke kostenbesparingen in de gezondheidszorg, vooral in situaties waar de budgetten beperkt zijn. Daarnaast vergroten lagere kosten de toegankelijkheid van behandelingen, waardoor een breder scala aan patiënten betaalbare toegang heeft tot noodzakelijke medicatie.
Desalniettemin vereist het off-label gebruik van medicatie zorgvuldige overweging en monitoring. Hoewel deze praktijk het potentieel heeft om de behandelingsmogelijkheden voor PTSS te verbreden, is de effectiviteit en veiligheid van het medicijn voor de specifieke off-label toepassing niet altijd even grondig onderzocht als tijdens het initiële registratieproces. Dit betekent dat zorgverleners zich goed bewust moeten zijn van het bestaande bewijs voor de effectiviteit van een medicijn voor een bepaalde off-label indicatie, evenals van mogelijke risico's en bijwerkingen.
Daarnaast moeten voorschrijvers zich bewust zijn van de juridische implicaties en aansprakelijkheidskwesties die gepaard gaan met het off-label voorschrijven van medicijnen. Het is van belang dat artsen hun beslissingen om medicijnen off-label voor te schrijven baseren op solide wetenschappelijk bewijs en “best practices” en dat zij deze beslissingen zorgvuldig documenteren, rekening houdend met zowel de potentiële voordelen voor de patiënt als de mogelijke risico's.
Aanvaardbaarheid, haalbaarheid en implementatie
Over het algemeen wordt farmacotherapie gezien als een acceptabele behandeloptie (Watts, 2015; Simiola, 2015; Swift, 2017; Zoellner, 2019), mits de medicatie wordt voorgeschreven door een deskundige arts met ervaring op het gebied van PTSS-behandeling. Eén van de belangrijkste overwegingen bij het voorschrijven van deze medicatie betreft de potentiële bijwerkingen, die kunnen variëren afhankelijk van het specifieke medicament en de individuele reactie van de patiënt.
Voor een gedetailleerd inzicht in de mogelijke bijwerkingen van verschillende psychofarmaca verwijzen we naar het Farmacotherapeutisch Kompas. Deze bijwerkingen moeten zorgvuldig worden gemonitord door de behandelend arts om de veiligheid van de patiënt te waarborgen en het behandelproces zo effectief mogelijk te maken. Dit vereist een actieve en continue opvolging van de patiënt, waarbij eventuele bijwerkingen nauwgezet worden geobserveerd en behandeld. Het is van groot belang dat zorgverleners alert zijn op mogelijke bijwerkingen en deze bespreken met de patiënt, zodat zij goed geïnformeerd zijn en de juiste ondersteuning ontvangen tijdens hun behandeling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het ontbreekt aan wetenschappelijk bewijs voor de superioriteit van farmacotherapie ten opzichte van placebo in de behandeling van PTSS. Daarom wordt geadviseerd om de initiële behandeling van PTSS niet met farmacotherapie te beginnen. Deze aanpak erkent de waarde van psychologische interventies als eerstelijnsbehandeling voor PTSS, wat in lijn is met een brede consensus over hun effectiviteit. Daarnaast wordt sterk afgeraden om benzodiazepines voor te schrijven, gezien de potentiële risico's en beperkte effectiviteit in de behandeling van PTSS.
Farmacotherapie kan worden overwogen als een symptoomgerichte benadering, vooral in situaties van ernstige klachten, het ontbreken van een effectieve respons op psychologische interventies, of wanneer de inzet van psychotherapeutische behandelingen niet op korte termijn beschikbaar is. Hoewel het off-label gebruik van medicatie nieuwe behandelopties kan openen, blijft het gebrek aan specifiek onderzoek naar de effectiviteit en veiligheid bij PTSS een punt van zorg. Dit vraagt om een kritische wetenschappelijke attitude, een algemeen beleid van terughoudendheid en extra deskundigheid van de voorschrijver.
Het belang van gezamenlijke besluitvorming ('shared decision making') staat centraal bij het indiceren, voorschrijven en al dan niet continueren van farmacotherapeutische interventies, waarbij de patiënt een actieve rol speelt in het behandelproces. Dit respecteert de autonomie en voorkeur van de patiënt, wat bijdraagt aan een meer persoonlijke en effectieve behandelervaring. Hoewel dit principe ideaal is, kan de praktische uitvoering complex zijn, vooral wanneer patiënten aangeven moeite te hebben met het begrijpen van de nuances van hun behandelopties.
Patiënten dienen gedetailleerde en begrijpelijke informatie te ontvangen over de voorgeschreven medicatie, inclusief dosering, gebruiksinstructies, mogelijke bijwerkingen en een duidelijk afbouwschema. Deze informatieverstrekking dient als basis voor geïnformeerde toestemming en stelt patiënten in staat om weloverwogen keuzes te maken over hun behandeling.
De respons op farmacotherapie dient goed te worden gemonitord en, indien nodig, de behandelstrategie dient aangepast door eventueel over te stappen op een alternatieve vorm van (symptoomgerichte) farmacotherapie bij een onvoldoende respons. Deze aanpak waarborgt een adaptieve en responsieve behandeling die is afgestemd op de individuele behoeften en vooruitgang van de patiënt. De noodzaak voor continue monitoring en potentieel aanpassen van de behandeling kan echter ook als belastend worden ervaren door zowel patiënten als zorgverleners, en vereist aanzienlijke middelen.
Onderbouwing
Achtergrond
De behandeling van PTSS blijft een uitdaging binnen de GGZ. Een belangrijk knelpunt in de huidige behandelingsstrategieën is de gangbare neiging om medicatie voor te schrijven. Hoewel medicijnen breed worden ingezet, ontbreekt het vaak aan een wetenschappelijke onderbouwing wat betreft de behandeling van PTSS. Recente wetenschappelijke inzichten tonen aan dat therapeutische behandelingen doorgaans effectiever zijn dan farmacotherapie. Dit heeft ertoe geleid dat de rol van medicatie in de behandeling van PTSS steeds vaker ter discussie wordt gesteld.
Het doel van deze richtlijn voor farmacotherapie bij PTSS is het beschrijven van de huidige situatie, het identificeren van specifieke knelpunten en het bepalen van de mate waarin en de manier waarop farmacotherapie een gerichte aanvulling kan zijn op de psychologische behandeling van PTSS. Het is daarbij van belang om de effectiviteit van farmacotherapie zo goed mogelijk te begrijpen en te beschrijven, zodat rekening gehouden kan worden met de diverse behandelopties en met de individuele behoeften en voorkeuren van de patiënt.
Sinds 2001 zijn sertraline en paroxetine de enige voor PTSS geregistreerde medicijnen. In de praktijk worden echter verschillende andere farmaceutische middelen off-label toegepast. Er blijkt sprake van een afname in het aantal patiënten dat medicatie voor PTSS ontvangt. Dit kan wijzen op twijfel over de effectiviteit en bijwerkingen van deze medicijnen, of mogelijk op een verbeterde toegang tot evidence-based psychotherapie voor PTSS, waardoor medicatie minder vaak geïndiceerd en noodzakelijk wordt (Holder, 2021). Ondanks deze trends en ontwikkelingen blijven selectieve serotonineheropnameremmers (Selective Serotonin Reuptake Inhibitors, SSRI) en serotonine-noradrenalineheropnameremmer (Serotonin-Norepinephrine Reuptake Inhibitor, SNRIs), als Fluoxetine, Sertraline, Citalopram, Paroxetine, Venlafaxine en Duloxetine de meest voorgeschreven medicijnen voor PTSS. Tegelijkertijd is er een toename in het gebruik van tweede generatie antipsychotica en een sterkte afname in gebruik van benzodiazepinen (Reinhard, 2021). Deze trend van frequent en grootschalig off-label voorschrijven van psychofarmaca voor PTSS benadrukt de noodzaak aan duidelijke behandelrichtlijnen.
Deze module richt zich op de vraagstukken betreffende farmacotherapeutische opties voor PTSS-behandeling, gebaseerd op strikt gedefinieerde zoekcriteria.
Conclusies / Summary of Findings
1.1.1 TCAs versus placebo
|
Very low GRADE |
It is unclear whether amitriptyline and imipramine result in a decrease in PTSS symptoms compared to placebo.
Source: Davidson 1990, Kosten 1991 |
1.1.1 TCAs versus placebo
|
Very low GRADE |
Amitriptyline and imipramine may result in more study drop-out compared to placebo, but the evidence is very uncertain.
Source: Davidson 1990, Kosten 1991 |
1.1.2 MAOIs beta-hydroxylase inhibitors versus placebo
|
Very low GRADE |
It is unclear whether MAOIs beta-hydroxylase inhibitors result in a decrease in PTSS symptoms compared to placebo.
Source: Kosten 1991 |
1.1.2 MAOIs beta-hydroxylase inhibitors versus placebo
|
Very low GRADE |
It is unclear whether phenelzine results in more study drop-out compared to placebo.
Source: Kosten, 1991 |
1.1.3 NaSSas versus placebo
|
Low GRADE |
Mirtazapine may result in little to no difference in decrease in PTSS symptoms compared to placebo.
Source: Davis 2020 |
|
Low GRADE |
Mirtazapine may result in little to no difference in study drop-out compared to placebo.
Source: (Davidson 2003; Davis 2020; Chung 2004) |
1.1.4 RIMAs versus placebo
|
Very low GRADE |
Brofaromine may result in little to no difference in decrease in PTSS symptoms compared to placebo, but the evidence is very uncertain.
Source: Baker, 1995; Katz 1994 |
|
Very low GRADE |
Brofaromine may result in little to no difference in study drop-out compared to placebo, but the evidence is very uncertain.
Source: (Katz, 1994) |
1.1.4 SNRIs versus placebo
|
Low GRADE |
Venlafaxine may decrease in PTSS symptoms compared to placebo, but this is not clinically relevant.
Source: Davidson 2006a; Davidson 2006b |
|
Low GRADE |
Venlafaxine may result in little to no difference in study drop-out compared to placebo.
Source: Davidson 2006a |
1.1.5 SSRIs versus placebo
|
Very low GRADE |
It is unclear whether SSRIs result in a decrease in PTSS symptoms as compared to placebo.
Source: Brady 2000, Davidson 2001a, Davidson 2006b, GSK 29060 627, Marshall 2001, Marshall 2007, NCT01681849, Pfizer 588, Pfizer 589, SKB627, SKB650, Tucker 1001, Tucker 2003, Van Der Kolk 2007, Zohar 2002 |
|
Very Low GRADE |
SSRIs may result in little to no difference in study drop-out compared to placebo.
Source: Brady 2000, Connor 1999a, Davidson 2005, GSK 29060 627, Hertzberg 2000, Li 2017, Marshall 2001, Marshall 2007, Martenyi 2002a, Martenyi 2002b, NCT01681849, Panahi 2011, Pfizer 588, Pfizer 589, SKB627, Tucker 1001, Tucker 2003, Van Der Kolk 1994, Van Der Kolk 2007, Zohar 2002 |
1.2.1 Benzodiazepines versus placebo
|
Low GRADE |
Benzodiazepines may result in no difference in study drop-out compared to placebo.
Source: Braun, 1990 |
1.2.2 benzodiazepine-agonists versus placebo
|
Low GRADE |
Eszopiclone use may result in no difference in decrease in PTSS symptoms compared to placebo.
Source: Dowd 2020 |
|
Low GRADE |
Eszopiclone use may result in a difference in drop-out due to any reason compared to placebo.
Source: Dowd 2020 |
1.3 Anticonvulsants versus placebo
|
Very Low GRADE |
It is unclear whether topiramate, lamotrigine, tiagabine and topiramate may decrease PTSD symptoms compared to placebo.
Source: (Davidson 2007; Davis 2008, Hamner 2008; Tucker 2007; Yeh 2011) |
|
Very low GRADE |
It is unclear whether divalproex, lamotrigine, tiagabine and topiramate results in a difference in study drop-out compared to placebo.
Source: Connor 2006; Davidson 2007; Davis 2008; Hamner 2008; Hertzberg 1999; Tucker 2007; Yeh 2011 |
1.4 Alpha-blockers versus placebo
|
Low GRADE |
Prazosine may result in a decrease in PTSD symptoms compared to placebo.
Source: Raskind, 2018 |
|
Low GRADE |
Prazosine may result in difference in study drop-out compared to placebo.
Source: Raskind, 2018 |
|
Low GRADE |
Prazosine may result in little to no difference in quality of life compared to placebo.
Source: Raskind, 2018 |
1.5 Antipsychotics versus placebo
|
Very low GRADE |
It is unclear whether antipsychotics may result in more reduction of PTSD symptoms as measured by CAPS compared to placebo.
Source: (Carey 2012; Reich 2004; Villarreal 2016) |
|
Low GRADE |
Antipsychotics may result in more study drop-out due to any reason compared to placebo.
Source: (Butterfield 2001; Padala 2006; Reich 2004; Villarreal 2016) |
1.6 Dopamine beta-hydroxylase inhibitors versus placebo
|
Low GRADE |
Nepiscastat may result in little to no difference in decrease in PTSS symptoms as compared to placebo.
Source: NCT00659230 |
|
Low GRADE |
Nepiscastat may result in little to no difference in study drop-out compared to placebo. .
Source: NCT00659230 |
1.7 Ganaxalone versus placebo
|
Low GRADE |
Ganaxalone may result in in a decrease in PTSS symptoms as compared to placebo.
Source: Rasmusson, 2017 |
|
Low GRADE |
Ganaxalone may result in little to no difference in study drop-out compared to placebo.
Source: Rasmusson, 2017 |
Samenvatting literatuur
Description of studies
Williams (2022) is a Cochrane systematic review and meta-analysis of double-blind randomised controlled trials that compared pharmacotherapies with placebo in adults with PTSD. In this review a systematic search was performed in Cochrane, Medline, Embase and Psychinfo till November 13 2022. The review included a total of 66 RCTs (ranging from 13 days to 28 weeks, totaling 7442 participants, ages of participants ranging from 18 to 85 years), of which 54 RCTs were included in a meta-analysis.
Outcomes that were used in the guideline were reduction of PTSD symptoms as determined from the total score on the CAPS, treatment tolerability by dropout due to any cause, and quality of life. The results are summarized below.
Results
1.1 Anti-depressants
1.1.1 TCAs versus placebo
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous)
There was no evidence of a benefit for amitriptyline and imipramine compared to placebo for reducing total IES symptom severity (SMD −0.54 points, 95% CI −1.18 to 0.10; 2 trials, 74 participants; (Davidson 1990; Kosten 1991), There was moderate heterogeneity for the total IES symptom severity outcome (Chi 2 = 1.83, df = 1 (P = 0.18); I2 = 45%).
Drop-out
More participants dropped out of the amitriptyline and imipramine groups (34%) due to any cause when compared to placebo RR 0.79 (95%CI 0.62 to 0.99) (Davidson 1990; Kosten 1991).
Quality of life
Data on quality of life were not reported.
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was very low; it was downgraded by two levels because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-2) as minimal information size was not reached.
Drop-out
The level of evidence regarding the outcome measure drop-out was very low downgraded because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-2) as minimal information size was not reached.
1.1.2 MAIOs versus placebo
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
There was evidence of a benefit of the MAOI phenelzine compared to placebo for reducing total PTSD symptoms on the IES (SMD −1.06 points, 95% CI −1.75 to −0.36) for 1 trial with 37 participants (Kosten 1991).
Drop-out
Drop-out due to any cause was comparable between the phenelzine group (21%) and placebo group (11%), RR 0.89 (95% CI 0.67 to 1.1.8) (Kosten 1991).
Quality of life
Data on quality of life were not reported.
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was very low; it was downgraded by because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-2) as minimal information size was not reached.
Drop-out
The level of evidence regarding the outcome measure drop-out was very low; downgraded by because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-2) as minimal information size was not reached.
1.1.3 NaSSa versus placebo
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
There was no evidence of beneficial effect of mirtazapine for reducing PTSD symptoms on the CAPS total symptom scale (MD −3.20 points, (95% CI −14.74 to 8.34); 1 trial, 61 participants; (Davis 2020. Similarly, we found no evidence of a benefit of an effect for reducing PTSD symptoms on the self-rated DTS (SMD −0.31 points, 95% CI −1.02 to 0.41; 2 trials, 87 participants; Davidson 2003; Davis 2020).
Drop-out
There was no evidence of a difference in the number of participants who withdrew due to any cause for the mirtazapine (17%) and placebo (19%) groups, RR 0.86 (95% CI 0.48 to 1.52) (Davidson 2003; Davis 2020; Chung 2004).
Quality of life
Data on quality of life were not reported.
Level of evidence of the literature
Decrease in PTSS symptoms.
The level of evidence regarding the outcome measure decrease in PTSS symptoms was low; downgraded by because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) as confidence intervals were very broad.
Drop-out
The level of evidence regarding the outcome measure drop-out due to any cause was low downgraded because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) as confidence interval crossed the borders of no effect.
1.1.4 RIMAs versus placebo
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
There was no evidence of a benefit of a reduction in PTSD symptoms following treatment with brofaromine compared to placebo for CAPS total (MD −5.06 points, 95% CI −15.93 to 5.81, 2 trials, 178 participants; Baker 1995; Katz 1994).
Drop-out
There was also no evidence of a difference for the number of participants who withdrew due to any cause from the brofaromine (30%) and placebo groups (29%), RR 1.04 (95% CI 0.49 tot 2.22) (Katz 1994).
Quality of life
Data on quality of life were not reported.
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was downgraded to very low because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-2) as confidence intervals were very broad and overlapped with the borders of clinical relevance.
Drop-out
The level of evidence regarding the outcome measure drop-out due to any cause was downgraded to very low because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-2) as confidence interval crossed the borders of no effect and clinical relevance.
1.1.4 SNRIs versus placebo
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
There was evidence of a benefit of the SNRI venlafaxine compared to placebo for reducing total PTSD symptoms on the CAPS total (MD −8.11 points, 95% CI −12.29 to −3.92; 2 trials, 687 participants; Davidson 2006a; Davidson 2006b).
We also found evidence of a benefit of venlafaxine compared to placebo for reducing PTSD symptoms on the CGI-S (SMD −0.31 points, 95% CI −0.46 to −0.16; 2 trials, 687 participants; Davidson 2006a; Davidson 2006b). Moreover, we found evidence of a benefit of venlafaxine on total DTS symptom severity (SMD −0.26 points, 95% CI −0.47 to −0.05; 1 trial, 358 participants; Davidson 2006b.
Drop-out
There was also no evidence of a difference for the number of participants who withdrew due to any cause from the venlafaxine (30%) and placebo groups (33%), RR 1.04 (95% CI 0.90 to 1.21) (Davidson 2006a).
Quality of life
Data on quality of life were not reported.
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was low; downgraded by two levels because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) as confidence intervals overlapped with the borders of clinical relevance.
Drop-out
The level of evidence regarding the outcome measure drop-out due to any cause was low; downgraded because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1).
1.1.5 SSRIs versus placebo
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
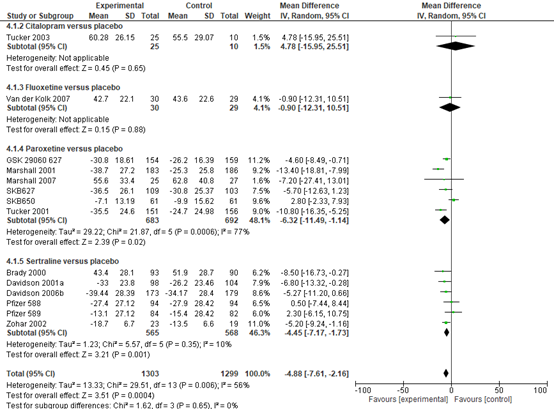
There was evidence of a benefit of the SSRIs compared to placebo for reducing total PTSD symptoms on the CAPS (MD −4.91 points, 95% CI −7.48 to −2.34), 15 trials, 2615 participants.
The pattern of symptom severity on the CAPS for the separate SSRI medications was similar to all SSRIs, see Figure 1, with both paroxetine MD −6.32 points, 95% CI −11.49 to −1.14; 6 trials, 1375 participants; and sertraline (MD −4.45 points, 95% CI −7.17 to −1.73; 6 trials, 1133 participants, demonstrating evidence of a benefit of a reduction in PTSD symptoms. There was insufficient evidence to determine whether fluoxetine was effective in reducing total PTSD (MD −0.90 points, 95% CI −12.31 to 10.51; 1 trial, 59 participants, as well as citalopram (MD 4.78 points, 95% CI −15.95 to 25.51; 1 trial, 35 participants), compared to placebo.
There was evidence of a benefit of the SSRIs fluoxetine, paroxetine and sertraline compared to placebo for the reduction of PTSD symptoms on the CGI-S (SMD −0.32 points, 95% CI −0.55 to −0.09; 6 trials, 862 participants; Connor 1999a; Davidson 2006b; GSK 29060 627; Hertzberg 2000; Li 2017; Panahi 2011). There was considerable heterogeneity in effect size estimates for this outcome (Chi2 = 10.24, df = 5 (P = 0.07); I2 = 51%). There was no evidence of a benefit of the SSRIs compared to placebo for a reduction in total PTSD symptoms on the DTS (SMD 0.11, 95% CI −0.50 to 0.72; 10 trials, 1698 participants; Brady 2000; Connor 1999a; Davidson 2005; Davidson 2006b; GSK 29060 627; Hertzberg 2000; Li 2017; Panahi 2011; SKB650; Tucker 2003), and this is confirmed by the substantial heterogeneity found between trials (Chi2 = 295.12, df = 9 (P < 0.001); I2 = 97%).
Figure 1 Separate SSRI medications SSRIs: citalopram, fluoxetine, paroxetine and setraline versus placebo, reduction of PTSD symptoms as measured by CAPS
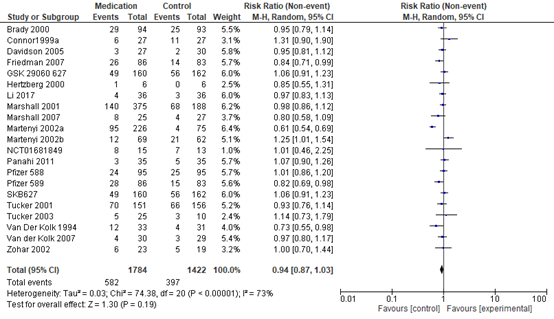
Drop-out
We observed similar dropout rates in the medication (33%) and placebo arms (28%); see Figure 2 RR 0.94 (95% CI 0.87 to 1.03).
Figure 2 SSRIs versus placebo, dropout due to any cause
Quality of life
Data on quality of life were not reported.
1.1.5 SSRIs versus placebo
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was downgraded to very low; by two levels because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and as results were heterogeneous (inconsistency) (-1) and imprecision (as confidence intervals overlapped with clinically relevant effect).
Drop-out
The level of evidence regarding the outcome measure drop-out symptoms was downgraded to very low; because of study limitations (-1) (many details about randomization and treatment allocation were unclear) by one level as results were very heterogeneous (inconsistency) (-1) and imprecision (-1) as minimal information size was not reached (<300 patients).
1.2 Hypnotics versus placebo
1.2.1 Benzodiazepines versus placebo (Braun, 1990)
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
This was not reported.
Drop-out
The overall dropout rate was similar for the alprazolam (43%) and placebo groups (33%); 16 participants in 1 trial, RR 0.86 (95%CI 0.39 to 1.89) (Braun 1990).
Quality of life
Data on quality of life were not reported.
1.2.1 Benzodiazepines versus placebo
Level of evidence of the literature
Drop-out
The level of evidence regarding the outcome measure drop-out was very low; it was downgraded by two levels because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) as minimal information size was not reached.
1.2.2 benzodiazepine-agonists: eszopiclone
1.2.2 benzodiazepine-agonists versus placebo
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
There was no evidence of a benefit of eszopiclone in reducing PTSD symptoms on the CAPS total (MD −1.00 points, 95% CI −19.57 to 17.57; 1 trial, 16 participants; or on the CGI-S (SMD −0.09 points, 95% CI −1.08 to 0.90; 1 trial, 16 participants. (Dowd 2020).
Drop-out
We found no evidence of a difference for dropouts due to any cause for the eszopiclone (46%) and placebo (25%) group, even though dropouts were higher in the medication arm RR -2.67 (95%CI -12.68 to 7.34) (Dowd 2020).
Quality of life
Data on quality of life were not reported.
1.2.2 benzodiazepine-agonists versus placebo
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was low; it was downgraded by two levels because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) as minimal information size was not reached.
Drop-out
The level of evidence regarding the outcome measure drop-out was low; it was downgraded by two levels because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) as confidence intervals were very broad.
1.3 Anticonvulsants versus placebo
Loss of diagnosis PTSS
This was not reported.
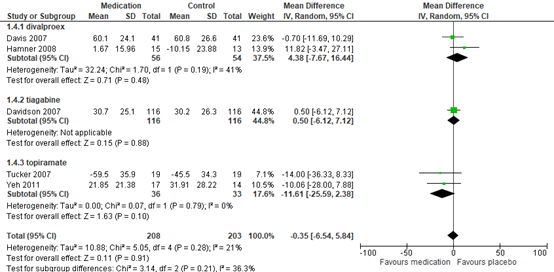
Decrease in PTSS symptoms (continuous)
Data on the reduction of PTSD symptoms, measured by the CAPS (total score), in five studies (411 participants) was measured comparing divalproex, tiagabine and topiramate to placebo (MD−0.35 points, 95% CI −6.54 to 5.84); see figure 3. There was no evidence of a beneficial effect. When looking into subgroups (figure 3) divalproex (MD 4.38, 95% CI -7.67; 16.44), tiagabine (MD 0.50, 95% CI -6.12 to 7.12) and topiramate (MD-11.61, 95% CI -25.59 to 2.38) were compared to placebo (total MD−0.35 points, 95% CI −6.54 to 5.84) these differences were also not clinically relevant.
Figure 3 Anticonvulsants presented in subgroups of divalproex, tiagabine and topiramate versus placebo, reduction of PTSD symptoms as measured by Clinically Administered PTSD Scale (CAPS)
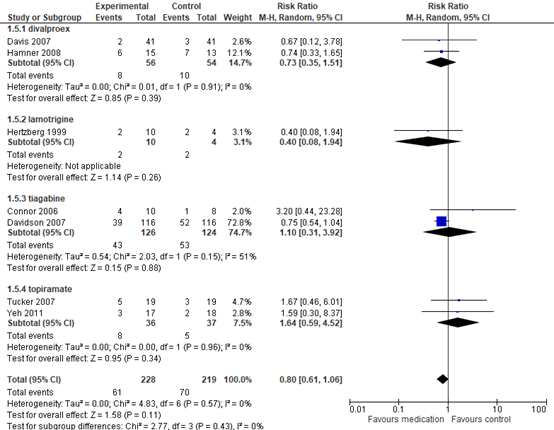
Drop-out
Drop-out rates due to adverse events were low in RCTs of divalproex (MD 0.73 95%CI 0.35 to 1.51), lamotrigine (MD 0.40, 95% CI 0.08 to 1.94), tiagabine (MD 1.10 95% CI 0.31 to 3.92) and topiramate (MD 1.64, 95% CI 0.59 to 4.52), and were comparable to those observed in the placebo arms (11% versus 9%, respectively) (RR 0.98, 95% CI 0.92 to 1.06). For all anticonvulsants these were comparable to those observed in the placebo arms (11% versus 9%, respectively) (RR 0.98, 95% CI 0.92 to 1.06); see Figure 4. These differences were not clinically relevant.
Figure 4 Anticonvulsants presented in subgroups of divalproex, tiagabine and topiramate versus placebo versus placebo, dropout due to any cause
Quality of life
Data on quality of life were not reported.
Level of evidence of the literature
1.3 Anticonvulsants versus placebo
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was downgraded by three levels to very low because of study limitations (-1) (details about randomization and treatment allocation were unclear) and imprecision (-2) (broad confidence intervals that overlap with no effect and borders of clinical relevance).
Drop-out
The level of evidence regarding the outcome measure drop-out was very low; downgraded by three levels to very low because of study limitations (-1) (details about randomization and treatment allocation were unclear) and downgraded for imprecision (-2) as results crossed border of clinical relevance and no effect.
1.4 Alpha-blockers versus placebo (RCT Raskind 2018)
Loss of diagnosis
This was not reported.
Decrease in PTSS symptoms (continuous)
One RCT in the review made this comparison on a multi-site study in 271 veterans using the CAPS (Raskind 2018). In this RCT, there was no evidence of a benefit of prazosin compared to placebo for the reduction of PTSD symptoms on the CAPS total (Prazosine 68.9 (SD 19.9) N=135, placebo 68.8 (SD 23.9, N=136) mean difference (MD) 0.10 points, (95% CI −5.13 to 5.33).
Drop-out
A similar proportion of participants withdrew from the prazosin group (20%) compared to the placebo group (19%), RR 1.03 (95% CI 0.65 to 1.62) (Raskind 2018).
Quality of life
Alpha-blockers versus placebo
Quality of life was measured using the Quality of life inventory (QOLI). It was 0.1 ± 1.6 for prazosine at week 10 and 0.1 ±1.8 at week 10 for placebo. A change from baseline between groups of 0.1 (-0.3 to 0.4), p= 0.68 (Raskind 2018). This difference was not clinically relevant.
Level of evidence of the literature
1.4 Alpha-blockers versus placebo
Loss of diagnosis
This was not reported.
Decrease in PTSD symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was downgraded by two levels to low because of study limitations (risk of bias (-1) due to unclear randomization and treatment allocation) and broad confidence intervals (imprecision (-1), due to not meeting border of clinical relevance).
Drop-out
The level of evidence regarding the outcome measure drop-out was downgraded by two levels to low because of study limitations (risk of bias (-1) due to unclear randomization and treatment allocation) and low number of included patients (imprecision (-1), due to not meeting border of clinical relevance).
Quality of life
The level of evidence regarding the outcome measure quality of life was downgraded by two levels to low because of study limitations (risk of bias (-1) due to unclear randomization and treatment allocation) and low number of included patients imprecision (-1), due to not meeting border of clinical relevance).
1.5 Antipsychotics versus placebo
Loss of diagnosis PTSD
This was not reported.
Decrease in PTSD symptoms (continuous)
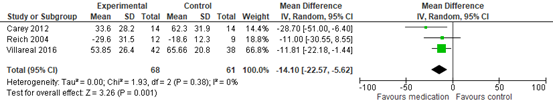
There was evidence of a benefit for the reduction of PTSD symptoms following treatment with olanzapine, risperidone or quetiapine compared to placebo for the CAPS total (MD −14.10 points, 95% CI −22.57 to −5.62); see Figure 5. The substantial heterogeneity for this outcome is partially reflected in the large medication effect observed in Carey 2012 (MD −15.10 points, 95% CI −24.47 to −5.73). Removing this trial resulted in a substantially reduced and statistically non-significant treatment effect (MD −2.50 points, 95% CI −6.93 to 1.93), with no heterogeneity observed across the effects for the remaining trials (Chi2 = 0.05, df = 1 (P = 0.82); I2 = 0%).
Furthermore, there was evidence of a beneficial effect of olanzapine and quetiapine compared to placebo in the reduction of PTSD symptoms on the symptom severity CGI-S scale (SMD −0.55 points, 95% CI −0.94 to −0.17; 2 trials, 108 participants; Carey 2012; Villarreal 2016), with no evidence of a benefit on the self-rated DTS (SMD −0.47 points, 95% CI −1.06 to 0.11; 3 trials, 119 participants; Butterfield 2001; Carey 2012; Villarreal 2016). There was moderate heterogeneity for the total score on the self-rated measures (Chi2 = 3.75, df = 2 (P = 0.15); I2 = 47%).
Figure 5 Antipsychotics versus placebo, reduction of PTSD symptoms as measured by CAPS
Drop-out
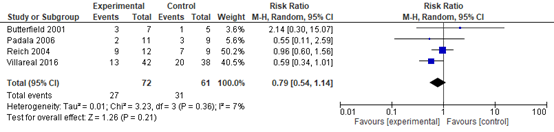
Although differences in dropout rates due to any cause in the medication (38%) and placebo (51%) arms were evident, no evidence of a difference was found across the four trials with 133 participants, RR 0.79 (95% CI 0.54 to 1.14) see Figure 6.
Figure 6 Antipsychotics versus placebo, dropout due to any cause
Quality of life
Data on quality of life were not reported.
1.5 Antipsychotics versus placebo
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was downgraded by three levels to very low because of study limitations (-2) (many details about randomization and treatment allocation were unclear and one trial had a large impact on results) and imprecision (-2) due to crossing borders of clinical relevance and no effect.
Drop-out
The level of evidence regarding the outcome measure drop-out was low; it was downgraded by two levels because of study limitations (-1) (many details about randomization and treatment allocation were unclear). It was also downgraded for imprecision (-1) as the estimate overlapped the border of clinical relevance.
1.6 Dopamine beta-hydroxylase inhibitors versus placebo (NCT00659230)
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
We found no evidence of a benefit of nepicastat on CAPS total symptom severity (MD −5.27 points, 95% CI −16.72 to 6.18), in one trial with 86 participants (NCT00659230).
Drop-out
Overall there were 12 (24%) dropouts in the nepicastat group and nine (18%) dropouts in the placebo group, (RR 1.39, 95% CI 0.64 to 3.00); 1 trial, 100 participants (NCT00659230).
Quality of life
Data on quality of life were not reported.
1.6 Dopamine beta-hydroxylase inhibitors versus placebo
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was downgraded by two levels to low because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) due to crossing borders of clinical relevance.
Drop-out
The level of evidence regarding the outcome measure drop-out was downgraded by two levels to low because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) due to crossing borders of clinical relevance.
1.7 Ganaxalone versus placebo (NCT00659230)
Loss of diagnosis PTSS
This was not reported.
Decrease in PTSS symptoms (continuous),
No evidence of a benefit was observed for ganaxolone medication on CAPS total symptom severity MD −2.50 points, (95% CI −10.92 to 5.92; 1 trial, 99 participants); (Rasmusson 2017); Similarly, no evidence of a benefit of ganaxolone versus placebo was observed for the reduction in PTSD symptoms on the PCL scale (self-rated measure) (SMD −0.17 points, 95% CI −0.59 to 0.25; 1 trial, 86 participants; see Rasmusson 2017).
Drop-out
There was no difference in dropouts due to any cause for the ganaxolone intervention arm (33%) compared to the placebo arm (17%), RR 1.93 (95% CI 0.94 to 3.92), even though more dropouts were observed in the medication arm (Rasmusson 2017).
Quality of life
Data on quality of life were not reported.
1.7 Ganaxalone versus placebo
Level of evidence of the literature
Decrease in PTSS symptoms
The level of evidence regarding the outcome measure decrease in PTSS symptoms was downgraded by two levels to low because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) as confidence intervals were very broad.
Drop-out
The level of evidence regarding the outcome measure drop-out was downgraded by two levels to low because of study limitations (-1) (many details about randomization and treatment allocation were unclear) and imprecision (-1) as confidence intervals were very broad.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the benefits and risks of pharmacotherapy compared with placebo for patients with PTSS?
| P: | Patients with PTSS confirmed diagnosis of PTSS by a professional (using CAPS) |
| I: |
SSRI (citalopram, dapoxetine, escitalopram, fluoxetine, fluvoxamine paroxetine, sertraline); anticonvulsants (carbamazepine, divalproex, lamotrigine, tiagabine, topiramate); benzodiazepines (alprazolam, bromazepam, brotizolam, clobazam, clorazepinezuur, diazepam, flunitrazepam, flurazepam, loprazolam, lorazepam, lormetazepam, midazolam, nitrazepam, oxazepam, prazepam, remimazolam, temazepam, zolpidem, zopiclon); antipsychotica (amisulpride, aripiprazole, brexpiprazol, cariprazine, clozapine, lurasidone, olanzapine, paliperidone, quetiapine, risperidone, sertindol, sulpiride, broomperidol, chloorprotixeen, flupentixol, fluspirileen, haloperidol, penfluridol, pimozide, pipamperone, zuclopentixol); antidepressiva (bupropion, esketamine, vortioxetine, amitriptyline, clomipramine, dosulepine, doxepine, imipramine, maprotiline, nortriptyline, mianserine, mirtazapine); alfablokkers (alfuzosine, doxazosine, fentolamine, silodosine, tamsulosine, terazosine, urapidil) overig (promethazine) |
| C: | Placebo |
| O: |
Outcome measure: Critical: Loss of diagnosis PTSS, Decrease in PTSS symptoms (continuous), Drop-out, Quality of life |
Relevant outcome measures
The guideline development group considered loss of diagnosis PTSD and PTSD symptom decrease and as a critical outcome measure for decision making; and drop-out and quality of life as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
Loss of diagnosis: using CAPS interview; no longer fulfilling diagnostic criteria (or using another clinical interview)
PTSD symptom decrease: decrease in CAPS score compared to baseline or another validated self-report instrument.
Drop-out: drop-out due to any reason
For quality of life, the working group did not define the outcome measure a priori but used the definition used in the studies.
The working group defined loss of diagnosis of 10% as clinically relevant.
- PTSD symptom decrease: the working group defined >12 points on CAPS4 or 6 points on CAPS5 decrease as clinically relevant, which was similar or an SMD of 0.5 (Stefanovics, 2018).
- Drop-out: The working group defined >20% drop-out as clinically relevant.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 05-09-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 463 hits. Studies were selected based on the following criteria: systematic reviews, pharmacotherapy, about adults, PTSS (not anxiety disorders) and fulfilling the PICO. Studies were initially selected based on title and abstract screening. After reading the full text one study was used for the summary of literature.
Results
One systematic review was included in the analysis of the literature as it was most recent, complete and fulfilled the PICO (Williams, (2022). Study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bajor, L. A., Balsara, C., & Osser, D. N. (2022). An evidence-based approach to psychopharmacology for posttraumatic stress disorder (PTSD)-2022 update. Psychiatry Research, 114840.
- Bedard-Gilligan, M., Lehinger, E., Cornell-Maier, S., Holloway, A., & Zoellner, L. (2022). Effects of cannabis on PTSD recovery: review of the literature and clinical insights. Current addiction reports, 9(3), 203-216.
- Blake D,Weathers F, Nagy L, Kaloupek D, Klauminzer G, Charney D,Keane T, Buckley TC: Clinician-Administered PTSD Scale (CAPS) Instructional Manual. West Haven, Conn, National Center for Posttraumatic Stress Disorder, Behavioral Science DivisionBoston Neurosciences Division, 2000
- Bredemeier, K., Larsen, S., Shivakumar, G., Grubbs, K., McLean, C., Tress, C., & Thase, M. (2022). A comparison of prolonged exposure therapy, pharmacotherapy, and their combination for PTSD: What works best and for whom; study protocol for a randomized trial. Contemporary Clinical Trials, 119, 106850.
- Birkeland, M. S., Greene, T., & Spiller, T. R. (2020). The network approach to posttraumatic stress disorder: A systematic review. European Journal of Psychotraumatology, 11(1), 1700614. doi:10.1080/20008198.2019.1700614
- Britnell, S. R., Jackson, A. D., Brown, J. N., & Capehart, B. P. (2017). Aripiprazole for post-traumatic stress disorder: a systematic review. Clinical Neuropharmacology, 40(6), 273-278.
- Boschloo L, Hieronymus F, Lisinski A, Cuijpers P, Eriksson E. The complex clinical response to selective serotonin reuptake inhibitors in depression: a network perspective. Transl Psychiatry. 2023 Jan 21;13(1):19. Doi: 10.1038/s41398-022-02285-2. PMID: 36681669; PMCID: PMC9867733.
- Burback, L., Brémault-Phillips, S., Nijdam, M. J., McFarlane, A., & Vermetten, E. (2023). Treatment of Posttraumatic Stress Disorder: A State-of-the-art Review. Curr. Neuropharmacol.
- Campos, B., Vinder, V., Passos, R. B. F., Coutinho, E. S. F., Vieira, N. C. P., Leal, K. B., & Berger, W. (2022). To BDZ or not to BDZ? That is the question! Is there reliable scientific evidence for or against using benzodiazepines in the aftermath of potentially traumatic events for the prevention of PTSD? A systematic review and meta-analysis. Journal of Psychopharmacology, 36(4), 449-459.
- Davis, A. K., Xin, Y., Sepeda, N., & Averill, L. A. (2023). Open-label study of consecutive ibogaine and 5-MeO-DMT assisted-therapy for trauma-exposed male Special Operations Forces Veterans: prospective data from a clinical program in Mexico. The American Journal of Drug and Alcohol Abuse, 49(5), 587-596.
- Du, R., Han, R., Niu, K., Xu, J., Zhao, Z., Lu, G., & Shang, Y. (2022). The multivariate effect of ketamine on PTSD: Systematic review and meta-analysis. Frontiers in psychiatry, 13, 813103.
- Feder, A., Rutter, S. B., Schiller, D., & Charney, D. S. (2020). The emergence of ketamine as a novel treatment for posttraumatic stress disorder. Advances in Pharmacology, 89, 261-286.
- Feder, A., Costi, S., Rutter, S. B., Collins, A. B., Govindarajulu, U., Jha, M. K., & Charney, D. S. (2021). A randomized controlled trial of repeated ketamine administration for chronic posttraumatic stress disorder. American Journal of Psychiatry, 178(2), 193-202.
- Friedman, M. J., & Bernardy, N. C. (2017). Considering future pharmacotherapy for PTSD. Neuroscience letters, 649, 181-185.
- Friedman, M. J., & Sonis, J. H. (2020). Pharmacotherapy for PTSD: What psychologists need to know.
- Galatzer-Levy, I.R., & Bryant, R.A. (2013). 636,120 ways to have posttraumatic stress disorder. Perspectives on Psychological Science, 8(6), 651-662. doi.org/10.1177/1745691613504115
- Giovanna, G., Damiani, S., Fusar-Poli, L., Rocchetti, M., Brondino, N., de Cagna, F., & Politi, P. (2020). Intranasal oxytocin as a potential therapeutic strategy in post-traumatic stress disorder: a systematic review. Psychoneuroendocrinology, 115, 104605.
- Guina, J., Rossetter, S. R., DeRhodes, B. J., Nahhas, R. W., & Welton, R. S. (2015). Benzodiazepines for PTSD: a systematic review and meta-analysis. Journal of Psychiatric Practice®, 21(4), 281-303.
- Hadlandsmyth, K., Bernardy, N. C., & Lund, B. C. (2022). Gender differences in medication prescribing patterns for veterans with posttraumatic stress disorder: A 10?year follow?up study. Journal of Traumatic Stress, 35(6), 1586-1597.
- Holder, N., Woods, A., Neylan, T. C., Maguen, S., Seal, K. H., Bernardy, N., & Cohen, B. E. (2021). Trends in medication prescribing in patients with PTSD from 2009 to 2018: a National Veterans Administration Study. The Journal of clinical psychiatry, 82(3), 32806.
- Hoskins, M. D., Sinnerton, R., Nakamura, A., Underwood, J. F., Slater, A., Lewis, C., & Clarke, L. (2021). Pharmacological-assisted Psychotherapy for Post Traumatic Stress Disorder: a systematic review and meta-analysis. European Journal of Psychotraumatology, 12(1), 1853379.
- Inslicht, S. S., Niles, A. N., Metzler, T. J., Lipshitz, S. A. L., Otte, C., Milad, M. R., & Neylan, T. C. (2022). Randomized controlled experimental study of hydrocortisone and D-cycloserine effects on fear extinction in PTSD. Neuropsychopharmacology, 47(11), 1945-1952.
- Khan, A. J., Bradley, E., O’Donovan, A., & Woolley, J. (2022). Psilocybin for trauma-related disorders. Disruptive Psychopharmacology, 319-332.
- Kindt, M., & Soeter, M. (2023). A brief treatment for veterans with PTSD: an open-label case-series study. Frontiers in Psychiatry, 14.
- Kitchiner, N. J., Lewis, C., Roberts, N. P., & Bisson, J. I. (2019). Active duty and ex-serving military personnel with post-traumatic stress disorder treated with psychological therapies: systematic review and meta-analysis. European journal of psychotraumatology, 10(1), 1684226.
- Krediet, E., Janssen, D. G., Heerdink, E. R., Egberts, T. C., & Vermetten, E. (2020). Experiences with medical cannabis in the treatment of veterans with PTSD: Results from a focus group discussion. European Neuropsychopharmacology, 36, 244-254.
- Krediet, E., Bostoen, T., Breeksema, J., van Schagen, A., Passie, T., & Vermetten, E. (2020). Reviewing the potential of psychedelics for the treatment of PTSD. International Journal of Neuropsychopharmacology, 23(6), 385-400.
- Kothgassner, O. D., Pellegrini, M., Goreis, A., Giordano, V., Edobor, J., Fischer, S., & Huscsava, M. M. (2021). Hydrocortisone administration for reducing post-traumatic stress symptoms: a systematic review and meta-analysis. Psychoneuroendocrinology, 126, 105168.
- Lehrner, A., Hildebrandt, T., Bierer, L. M., Flory, J. D., Bader, H. N., Makotkine, I., & Yehuda, R. (2021). A randomized, double-blind, placebo-controlled trial of hydrocortisone augmentation of Prolonged Exposure for PTSD in US combat veterans. Behaviour research and therapy, 144, 103924.
- Martin, A., Naunton, M., Kosari, S., Peterson, G., Thomas, J., & Christenson, J. K. (2021). Treatment guidelines for PTSD: a systematic review. Journal of Clinical Medicine, 10(18), 4175.
- Marx, B. P., Lee, D. J., Norman, S. B., Bovin, M. J., Sloan, D. M., Weathers, F. W., & Schnurr, P. P. (2022). Reliable and clinically significant change in the clinician-administered PTSD Scale for DSM-5 and PTSD Checklist for DSM-5 among male veterans. Psychological assessment, 34(2), 197.
- Meister, L., Dietrich, A. C., Stefanovic, M., Bavato, F., Rosi-Andersen, A., Rohde, J., & Kleim, B. (2023). Pharmacological memory modulation to augment trauma-focused psychotherapy for PTSD: a systematic review of randomised controlled trials. Translational psychiatry, 13(1), 207.
- de Moraes Costa, G., Zanatta, F. B., Ziegelmann, P. K., Barros, A. J. S., & Mello, C. F. (2020). Pharmacological treatments for adults with post-traumatic stress disorder: A network meta-analysis of comparative efficacy and acceptability. Journal of psychiatric research, 130, 412-420.
- Mitchell, J. M., Otalora G, M., van der Kolk, B., Shannon, S., Bogenschutz, M., Gelfand, Y., & MAPP2 Study Collaborator Group. (2023). MDMA-assisted therapy for moderate to severe PTSD: a randomized, placebo-controlled phase 3 trial. Nature Medicine, 29(10), 2473-2480.
- Nijdam, M. J., Vermetten, E., & McFarlane, A. C. (2023). Toward staging differentiation for posttraumatic stress disorder treatment. Acta Psychiatrica Scandinavica, 147(1), 65-80.
- Oehen, P., & Gasser, P. (2022). Using a MDMA-and LSD-group therapy model in clinical practice in Switzerland and highlighting the treatment of trauma-related disorders. Frontiers in Psychiatry, 13, 863552.
- Raskind, M. A., Peskind, E. R., Chow, B., Harris, C., Davis-Karim, A., Holmes, H. A., Hart, K. L., McFall, M., Mellman, T. A., Reist, C., Romesser, J., Rosenheck, R., Shih, M. C., Stein, M. B., Swift, R., Gleason, T., Lu, Y., & Huang, G. D. (2018). Trial of Prazosin for Post-Traumatic Stress Disorder in Military Veterans. The New England journal of medicine, 378(6), 507-517.
- Petersen, M., Koller, K., Straley, C., & Reed, E. (2021). Effect of cannabis use on PTSD treatment outcomes in veterans. Mental Health Clinician, 11(4), 238-242.
- Rauch, S. A., Kim, H. M., Powell, C., Tuerk, P. W., Simon, N. M., Acierno, R., & Hoge, C. W. (2019). Efficacy of prolonged exposure therapy, sertraline hydrochloride, and their combination among combat veterans with posttraumatic stress disorder: a randomized clinical trial. JAMA psychiatry, 76(2), 117-126.
- Raut, S. B., Canales, J. J., Ravindran, M., Eri, R., Benedek, D. M., Ursano, R. J., & Johnson, L. R. (2022). Effects of propranolol on the modification of trauma memory reconsolidation in PTSD patients: a systematic review and meta-analysis. Journal of Psychiatric Research, 150, 246-256.
- Reist, C., Streja, E., Tang, C. C., Shapiro, B., Mintz, J., & Hollifield, M. (2021). Prazosin for treatment of post-traumatic stress disorder: a systematic review and meta-analysis. CNS spectrums, 26(4), 338-344. https://doi.org/10.1017/S1092852920001121
- Reinhard, M. A., Seifert, J., Greiner, T., Toto, S., Bleich, S., & Grohmann, R. (2021). Pharmacotherapy of 1,044 inpatients with posttraumatic stress disorder: current status and trends in German-speaking countries. European archives of psychiatry and clinical neuroscience, 271(6), 1065-1076.
- Watts, B.V., Schnurr, P.P., Zayed, M., Young-Xu, Y., Stender, P., Llewellyn-Thomas, H. (2015). A randomized controlled clinical trial of a patient decision aid for posttraumatic stress disorder. Psychiatric Services, 66(2, 149-54.
- Williams, T., Phillips, N. J., Stein, D. J., & Ipser, J. C. (2022). Pharmacotherapy for post-traumatic stress disorder (PTSD). The Cochrane database of systematic reviews, 3(3), CD002795.
- Schmidt, U. (2015). A plea for symptom-based research in psychiatry. European Journal of Psychotraumatology, 6(1), 27660. doi:10.3402/ejpt.v6.27660
- Singewald, N., Sartori, S. B., Reif, A., & Holmes, A. (2023). Alleviating anxiety and taming trauma: Novel pharmacotherapeutics for anxiety disorders and posttraumatic stress disorder. Neuropharmacology, 109418.
- Starke, J. A., & Stein, D. J. (2017). Management of treatment-resistant posttraumatic stress disorder. Current Treatment Options in Psychiatry, 4, 387-403.
- Schottenbauer, M. A., Glass, C. R., Arnkoff, D. B., Tendick, V., & Gray, S. H. (2008). Nonresponse and dropout rates in outcome studies on PTSD: Review and methodological considerations. Psychiatry: Interpersonal and biological processes, 71(2), 134-168.
- Simiola, V., Neilson, E.C., Thompson, R., Cook, J.M. (2015). Preferences for trauma treatment: A systematic review of the empirical literature. Psychological Trauma: Theory, Research, Practice, and Policy, 7, 516-24.
- Stefanovics, E. A., Rosenheck, R. A., Jones, K. M., Huang, G., & Krystal, J. H. (2018). Minimal Clinically Important Differences (MCID) in Assessing Outcomes of Post-Traumatic Stress Disorder. The Psychiatric quarterly, 89(1), 141-155. https://doi.org/10.1007/s11126-017-9522-y
- Sippel, L. M., Holtzheimer, P. E., Friedman, M. J., & Schnurr, P. P. (2018). Defining treatment-resistant posttraumatic stress disorder: a framework for future research. Biological psychiatry, 84(5), e37-e41.
- Sonis, J., & Cook, J. M. (2019). Medication versus trauma-focused psychotherapy for adults with posttraumatic stress disorder: A systematic review and meta-analysis. Psychiatry Research, 282, 112637.
- Sutar, R., & Sahu, S. (2019). Pharmacotherapy for dissociative disorders: A systematic review. Psychiatry research, 281, 112529.
- Swift, J.K., Greenberg, R.P., Tompkins, K.A., Parkin, S.R. (2017). Treatment refusal and premature termination in psychotherapy, pharmacotherapy, and their combination: A meta-analysis of head-to-head comparisons. Psychotherapy (Chic)., 54(1), 47-57.
- Thomaes, K., Dorrepaal, E., Draijer, N., Jansma, E. P., Veltman, D. J., & van Balkom, A. J. (2014). Can pharmacological and psychological treatment change brain structure and function in PTSD? A systematic review. Journal of Psychiatric Research, 50, 1-15.
- Vermetten, E., & Yehuda, R. (2020). MDMA-assisted psychotherapy for posttraumatic stress disorder: A promising novel approach to treatment. Neuropsychopharmacology, 45(1), 231-232.
- Vermetten, E., Vythilingam, M., Southwick, S. M., Charney, D. S., & Bremner, J. D. (2003). Long-term treatment with paroxetine increases verbal declarative memory and hippocampal volume in posttraumatic stress disorder. Biological psychiatry, 54(7), 693-702.
- Van der Kolk, B. A., Spinazzola, J., Blaustein, M. E., Hopper, J. W., Hopper, E. K., Korn, D. L., & Simpson, W. B. (2007). A randomized clinical trial of eye movement desensitization and reprocessing (EMDR), fluoxetine, and pill placebo in the treatment of posttraumatic stress disorder: treatment effects and long-term maintenance. Journal of clinical psychiatry, 68(1), 37.
- Van Zuiden, M., Frijling, J. L., Nawijn, L., Koch, S. B., Goslings, J. C., Luitse, J. S., & Olff, M. (2017). Intranasal oxytocin to prevent posttraumatic stress disorder symptoms: a randomized controlled trial in emergency department patients. Biological psychiatry, 81(12), 1030-1040.
- Weiss, B., Dinh-Williams, L. A. L., Beller, N., Raugh, I. M., Strauss, G. P., & Campbell, W. K. (2023). Ayahuasca in the treatment of posttraumatic stress disorder: Mixed-methods case series evaluation in military combat veterans. Psychological Trauma: Theory, Research, Practice, and Policy.
- Williams, T., Phillips, N. J., Stein, D. J., & Ipser, J. C. (2022). Pharmacotherapy for post traumatic stress disorder (PTSD). The Cochrane database of systematic reviews, 3(3), CD002795. https://doi.org/10.1002/14651858.CD002795.pub3
- Zhang Y, Ren R, Sanford LD, Yang L, Ni Y, Zhou J, Zhang J, Wing YK, Shi J, Lu L, Tang X. The effects of prazosin on sleep disturbances in post-traumatic stress disorder: a systematic review and meta-analysis. Sleep Med. 2020 Mar;67:225-231. doi: 10.1016/j.sleep.2019.06.010. Epub 2019 Jun 22. PMID: 31972510; PMCID: PMC6986268.
- Zhang, Z. X., Liu, R. B., Zhang, J., Xian-Yu, C. Y., Liu, J. L., Li, X. Z., & Zhang, C. (2023). Clinical outcomes of recommended active pharmacotherapy agents from NICE guideline for post-traumatic stress disorder: Network meta-analysis. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 125, 110754.
- Zoellner, L. A., Roy-Byrne, P. P., Mavissakalian, M., & Feeny, N. C. (2019). Doubly randomized preference trial of prolonged exposure versus sertraline for treatment of PTSD. American Journal of Psychiatry, 176(4), 287-296.
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Germain, 2012 |
Also used cognitive behavioral therapy |
|
Hoskins, 2021 |
Broader inclusion criteria than conform PICO |
|
Petrakis, 2016 |
Comorbid alcohol abuse |
|
Raskind 2003 |
Trial classified as an augmentation trial for treatment-resistant PTSD. |
|
Raskind, 2007 |
concurrent psychotherapy |
|
Raskind, 2013 |
Secondary publication |
|
Reist, 2021 |
Broader inclusion criteria than conform PICO |
|
Simpson, 2015 |
Comorbid alcohol |
|
Taylor, 2008 |
N=13 |
|
|
|
|
Zhang, 2020 |
Broader inclusion criteria than conform PICO |
|
Zhao, 2020 |
Broader inclusion criteria than conform PICO |
|
|
|
|
|
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-03-2025
Beoordeeld op geldigheid : 06-03-2025
V&VN autoriseert de richtlijn, maar niet Module – Farmacotherapie, omdat de rol en bevoegdheden van de Verpleegkundig Specialist hierin niet correct worden weergegeven.
Algemene gegevens
De herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met PTSS.
Werkgroep
- prof. dr. E. (Eric) Vermetten, psychiater en voorzitter van de werkgroep, staflid Afdeling Psychiatrie, Leids Universitair Medisch Centrum, namens de Nederlandse Vereniging voor Psychiatrie (NVvP)
- prof. dr. M. (Maartje) Schoorl, klinisch psycholoog en vice-voorzitter van de werkgroep, werkzaam bij Universiteit Leiden en Leids Universitair Behandel en Expertise Centrum (LUBEC), namens de Nederlandse Vereniging voor Psychotherapie (NVP)
- dr. R.A. (Rianne) de Kleine, GZ psycholoog en vice-voorzitter, werkzaam bij Universiteit Leiden en Leids Universitair Behandel en Expertise Centrum (LUBEC), namens Nederlands Insitutuut van Psychologen (NIP)
- dr. R.A. (Ruud) Jongedijk, psychiater, werkzaam bij ARQ, namens de NVvP
- dr. A. (Anja) Lok, psychiater, werkzaam bij Amsterdam Universitair Medisch Centrum, namens de NVvP
- J.P. (Joop) de Jong, psychiater, werkzaam bij Psyq, namens de NVvP
- prof. dr. G.T.M. (Trudy) Mooren, klinisch psycholoog, werkzaam bij ARQ Centrum’45 en verbonden aan de Universiteit Utrecht, namens de Nederlandse Vereniging voor Psychotrauma (NTVP)
- dr. S. (Samrad) Ghane, klinisch psycholoog, werkzaam bij Parnassiagroep, namens de NTVP
- H. (Henriëtte) Markink, MSc, verpleegkundig specialist, werkzaam bij Argo GGZ, namens V&VN Vakcommissie GGZ en Verpleegkundig Specialisten
- Prof. dr. A. (Ad) de Jongh, gz-psycholoog, werkzaam bij PSYTREC, namens P3NL
- dr. N. (Nathan) Bachrach, klinisch psycholoog/associate professor, werkzaam bij GGZ Oost-Brabant en RINO Zuid/Universiteit van Tilburg, namens NIP
- dr. W.J. (Mia) Scheffers, psychomotorisch therapeut werkzaam bij Hogeschool Windesheim Zwolle, namens de Federatie voor vaktherapeutische beroepen (FVB)
- dr. J.T. (Jooske) van Busschbach, pedagoog therapeut, werkzaam bij Hogeschool Windesheim Zwolle, tevens Universitair Centrum Psychiatrie/UMCG Groningen, namens de FVB
- drs. S.U.M. (Stefanie) Terpstra, ervaringsdeskundige, namens MIND, tot 21 februari 2024
- drs. K.Q.M. (Katharina) Ka, ervaringsdeskundige, namens MIND, tot 16-10-2024
- P.G. (Paul) Ulrich, ervaringsdeskundige, namens MIND, tot 16-10-2024
- M.H. (Marijke) Delsing, ervaringsdeskundige, namens MIND, tot 21 februari 2024
Adviesgroep
- prof. dr. mr. C.H. (Christiaan) Vinkers, psychiater, werkzaam bij Amsterdam UMC, namens de NVvP
- prof. dr. B.P.F. (Bart) Rutten, psychiater, werkzaam bij Maastricht Universitair Medisch Centrum, namens de NVvP
- dr. K. (Kathleen) Thomaes, psychiater, werkzaam bij Sinai, namens de NVvP
- drs. S. (Sjef) Berendsen, klinisch psycholoog, werkzaam bij Psytrec, namens P3NL
Met ondersteuning van
- Dr. M.L. (Marja) Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. B. (Beatrix) Vogelaar, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. Dr. E. Vermetten |
Psychiater en voorzitter |
hoogleraar en staflid afdeling psychiatrie bij LUMC Leiden, Kolonel b.d, adjunct professor New York Universirty, School of medicine, consultant bij internationaal strafhof, VN, Adviesgroep PTSS Politie, Nederlands Veteraneninstituut, |
geen |
geen restricties |
|
Prof. Dr.M. Schoorl |
Bijzonder hoogleraar klinische psychologie, LUBEC, vice-voorzitter |
Consulent hoogleraar TOPGGZ eetstoornissen, vz landelijke opleidingsraad psychologische BIG-beroepen |
geen |
geen restricties |
|
Dr. R.A. De Kleine |
Universitair docent klinisch psychologie en vice-vice voorzitter |
GZ-Psycholoog in opleiding tot specialist LUBEC |
geen |
geen restricties |
|
Dr. R.A. Jongedijk |
Psychiater |
Senior strategisch adviseur bij ARQ |
geen |
geen restricties |
|
Dr. A. Lok |
Psychiater |
|
geen |
geen restricties |
|
Drs. J.P. de Jong |
Psychiater |
Redacteur psychiatrienet – trauma- en stressor gerelateerde stoornissen |
geen |
geen restricties |
|
Prof. Dr. G.T.M. Mooren |
Bijzonder hoogleraar afdeling klinische psychologie FSW/UU, klinisch psycholoog ARQ Centrum 45 |
Bestuurslid NtVP, lid wetenschappelijke adviescommissie NVRG, Centraal tuchtcollege voor de gezondheidszorg |
geen |
geen restricties |
|
Dr. S. Ghane |
Klinisch Psycholoog onderzoeker en specialismeleider bij Parnassiagroep, |
adviseur Antares Foundation i.v.m. psychosociale ondersteuning van humanitair werkers, world association of cultural psychiatry, local organizing committee member wereld congress |
geen |
geen restricties |
|
H. Markink |
Verpleegkundig specialist GGZ met specialisme psychotrauma |
Geen |
geen |
geen restricties |
|
Prof. Dr. A. De Jongh |
Bijzonder hoogleraar angst en gedragsstoornissen, hoofd onderzoek psychotrauma expertisecentrum |
Geeft betaalde trainingen in EMDR therapie en andere cursussen op het gebied van psychotrauma |
Boeken geschreven over EMDR en boegbeeld PSYTREC |
geen restricties |
|
Dr. N. Bachrach |
Klinisch psycholoog persoonlijkheid en trauma, programmaleider persoonlijkheidsstoornissen |
Geen |
SFT bij DIS, Cluster- C studie, IREM freq study board member |
geen restricties |
|
Dr. W.J. Scheffers |
Associate lector Windesheim |
Docent RINO Amsterdam, Docent PAO Trauma academie |
ZonMW, lichaamsgerichte behandeling, arousalregulatiem RAAK-SIA |
geen restricties |
|
Dr. J. T. van Busschbach |
Senioronderzoeker Rob Giel onderzoekdscentrum, UCP, UMCG, zorggerelateerd onderzoek binnen (langdurige psychiatrie), coordinatie netwerk stemming en angst |
Lector bewegen, gezondheid en welzijn hogeschool Windesheim; onderzoek naar bewegings- en lichaamsgerichte interventies initiëren, uitvoeren en begeleiden, tevens terugkoppeling naar onderzoek en beroepenvelden |
NWO en ZonMW subsidie, RAAk-SIA |
geen restricties |
|
Drs. S. U. M. Terpstra |
ervaringsdeskundige |
Vz stichting revief spotlight, expertcommissie kwaliteit van zorg en werkgroep wachttijden, MIND, Docent trauma academie CELEVT, Lid raad van toezicht Ixta Noa, werkgroep zorgstandaard Psychotrauma akwa GGZ, referentenpanel MIND, gezondheid projectvoorstellen ZonMW |
geen |
geen restricties |
|
Drs. K.Q.M. Ka |
ervaringsdeskundige |
Ervaringsdeskundige bij team ED, bestuurslid Stichting Weerklank |
geen |
geen restricties |
|
P.G. Ulrich |
ervaringsdeskundige |
Freelancer cliënten/naastenperspectief GGZ |
geen |
geen restricties |
|
Adviesgroep |
|
|
|
|
|
Dr. Mr C.H. Vinkers |
psychiater |
Oprichter RCT alert |
geen |
geen restricties |
|
Prof. Dr. B.P.F. Rutten |
Hoofd afdeling psychiatrie, psychiater en hoogleraar psychiatrie |
Geen |
geen |
geen restricties |
|
K. Thomaes |
Psychiater/manager behandelzaken VIBU (Veteranen Intensieve Behandelunit) Sinai Centrum (betaald), hoofdonderzoeker Sinai centrum, senior onderzoeker Amsterdam UMC |
Docent Amsterdam UMC |
Honorarium boek ‘vroeger en verder’, Pearson |
geen restricties |
|
S. Berendsen |
Algemeen directeur Psytrec |
EMDR trainingen betaald |
geen |
geen restricties |
|
Met ondersteuning van |
|
|
|
|
|
Dr. M. L. Molag |
Advsieur kennisinstituut |
Geen |
geen |
Geen restricties |
|
Drs. B. Vogelaar |
Adviseur Kennisinstituut |
Geen |
geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door inbreng van ervaringsdeskundingen afgevaardigd door MIND in de werkgroep en een uitgebreide achterbanraadpleging via door MIND Landelijk Platform Psychische Gezondheid naar haar leden toe. Vanwege weinig respons is een tweede mailing uitgegaan direct naar bij MIND aangesloten patiënten- en cliëntenorganisaties. Daarnaast is deze uitvraag ook gedaan naar een aantal verenigingen en stichtingen voor LVB en Autisme die niet aangesloten zijn bij MIND. Een aantal doelgroepen die met trauma te maken hebben, zoals huiselijk geweld, vrouwenopvang, maatschappelijke opvang en RIBW’s zijn verenigd in een aparte koepel Valente. Zij hebben de uitvraag doorgezet naar een aantal relevante afdelingen. Dat leverde in totaal 46 reacties op die zijn verwerkt in een rapport. Het rapport hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan MIND en de eventueel aangeleverde commentaren zijn bekeken en verwerkt. Aan het einde van het proces hebben de patiëntvertegenwoordigers namens MIND, zich teruggetrokken uit de werkgroep omdat ze zich onvoldoende konden vinden in de inhoud van de richtlijn met name met betrekking tot:
- het uitsluiten van mensen die niet volledig aan de criteria van PTSS voldoen en derhalve als anders gespecificieerde / ongespecificieerde trauma – of stressorgerelateerde stoornis geclassificeerd moeten worden,
- het ontbreken van specifieke aandacht voor complex trauma (inclusief het beperken van complex trauma tot de drie additionele ICD 11 kenmerken).
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase). Uit deze kwalitatieve raming bleek dat er geen grote financiële gevolgen te verwachten zijn.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met PTSS. Er werd een schriftelijke knelpuntenanalyse gedaan bij de vereniging die iemand hadden afgevaardigd en bij de stakeholders. Daarnaast werd het rapport ‘Zinnige Zorg – Verbetersignalement PTSS’ van het Zorginstituut gebruikt. Tevens zijn er knelpunten aangedragen door MIND via een achterbanraadpleging, zie verder onder kopje ‘inbreng patiëntenperspectief’.
De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodules over PTSS (Onderdeel van de richtlijn Angststoornissen, Nederlandse Vereniging voor Psychiatrie 2013) op noodzaak tot revisie. Deze waren zo verouderd dat deze vervallen met het verschijnen van de huidige richtlijn.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
De belangrijkste patiënt relevante uitkomstmaten die werden meegenomen zijn het verlies van de diagnose PTSS, PTSS symptoom afname (beide kritiek voor de besluitvoming) en drop-out en kwaliteit van leven (beide belangrijk). Voor enkele vragen werd dit nog aangevuld met andere uitkomstmaten.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd een goede kwaliteit systematische review gebruikt die de data uit verschillende studies gepoold presenteerde in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht. De literatuursamenvatting werd in het Engels geschreven ten behoeve van mogelijke internationale uitwisseling van gegevens.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVvP PTSS |
|
|
Uitgangsvraag: UV3 Wat is de plaats van farmacotherapie bij de behandeling van patiënten met de diagnose PTSS |
|
|
Database(s): Embase.com, Medline (Ovid), Psycinfo (Ebsco) |
Datum: 05-09-2022 |
|
Periode: 2017-heden |
Talen: geen limitering |
|
Literatuurspecialist: Alies van der Wal |
|
|
Toelichting en opmerkingen: De sleutelartikelen worden met deze strategie gevonden. Searchdate van de cochrane review was 13 November 2020, daarom RCTs vanaf invoerdatum nov 2020 in de zoekopbrengst meegenomen. |
|
Zoekopbrengst
|
|
Embase |
Medline |
Psycinfo |
Ontdubbeld |
|
MA/ SR |
316 |
253 |
225 |
463 |
|
RCT (vanaf invoerdatum 01/11/2020) |
207 |
83 |
88 |
266 |
|
Totaal |
523 |
336 |
313 |
729 |
Zoekverantwoording
Embase.com
Medline (Ovid)
|
Search |
Query |
Items found |
|
1 |
Stress Disorders, Post-Traumatic/ or Combat Disorders/ or exp Stress Disorders, Traumatic/dt or (ptsd or ptss or combat disorder* or war neuros* or combat neuros* or combat stress disorder* or shell shock* or combat fatigue or battle fatigue).ti,ab,kf. or ((post trauma* or posttrauma*) adj3 (stress* or disorder* or syndrome* or symptom* or neuros*)).ti,ab,kf. |
58092 |
|
2 |
exp "Serotonin and Noradrenaline Reuptake Inhibitors"/ or exp Serotonin Uptake Inhibitors/ or ((seroton* or norepinephrin* or noradrenalin* or dopamin* or neurotransmitter or monoamine) adj2 (uptake or reuptake or re-uptake)).ti,ab,kf. or (SSRI*OR SRI or SNRI* or SSNRI* or amfebutamone or Wellbutrin or Zyban or ampreloxetine or cericlamine or chlorphentermine or citalopram or Celexa or dapoxetine or escitalopram or Lexapro or femoxetine or fenfluramine or fluoxetine or Prozac or Sarafem or fluvoxamine or hydroxynefazodone or hyperforin or ifoxetine or litoxetine or lubazodone or medifoxamine or moxifetin or nefazodone or nefopam or nomelidine or norcitalopram or norfenfluramine or norfluoxetine or norsertraline or omiloxetine or paroxetine or Paxil or sertraline or Zoloft or tedatioxetine or trazodone or Desyrel or vilazodone or vortioxetine or zimeldine or amitriptylin* or Elavil or clomipramin* or Anafranil or desvenlafaxin* or Pristiq or deudextromethorphan or dosulepin* or doxepin* or Prudoxin or Sinequan or Zonalon or duloxetine or Cymbalta or imipramine or Tofranil or liafensine or milnacipran or sibutramine or Meridia or tramadol or Ultram or venlafaxine or Effexor).ti,ab,kf. |
93127 |
|
3 |
exp Anticonvulsants/ or Valproic Acid/ or (anticonvuls* or anti-convuls* or antiepilepti* or anti-epilipti* or abecarnil or acetazolamide or Diamox or albutoin or allomethadione or alprazolam or Niravam or Xanax or ameltolide or antiepilepsirine or 'ascorbate magnesium' or avizafone or barbexaclone or beclamide or belnacasan or benzobarbital or brexanolone or brivaracetam or brosuximide or 'calcium bromide' or cannabidiol or cannabidivarin or carabersat or caramiphen or carbamazepine or Carbatrol or Tegretol or carisbamate or cenobamate or cinromide or clobazam or clomethiazole or clonazepam or Klonopin or cpp-115 or cyheptamide or darigabat or denzimol or dextromethorphan or dezinamide or diazepam or Diastat or Valium or diclofenamide or Daranide or dimethadione or doxenitoin or elpetrigine or encukalner or endixaprine or eslicarbazepine or etazepine or eterobarb or ethosuximide or Zarontin or ethotoin or Peganone or etiracetam or levetiracetam or Keppra or 'fali lepsin' or falilepsin or felbamate or Felbatol or fenfluramine or fluoresone or fluzinamide or 'fosphenytoin sodium' or Cerebyx or gabapentin or Neurontin or ganaxolone or guaifenesin or Allfen or Fenesin or Humibid or Organidin or Pneumomist or Robitussin or hexapneumine or ica-105665 or ica105665 or imepitoin or imidazenil or ion283 or lacosamide or ladoxaprine or lamotrigine or Lamictal or lanicemine or licarbazepine or lorcaserin or loreclezole or losigamone or mephebarbital or mephenytoin or Mesantoin or mesuximide or Celontin or metharbital or methylphenobarbital or Mebaral or midazolam or Versed or milacemide or nafimidone or nitrazepam or normephenytoin or normesuximide or oxcarbazepine or Trileptal or padsevonil or paramethadione or pazinaclone or pentoxyverine or perampanel or phenacemide or Phenurone or phenylacetylurea or pheneturide or phenobarbital or phenobarbitone or phensuximide or phenytoin or Dilantin or diphenylhydantoin or 'potassium bromide' or pregabalin or Lyrica or primidone or Mysoline or progabide or ralitoline or remacemide or retigabine or riluzole or Rilutek or ropizine or rufinamide or safinamide or sc-1001a or seletracetam or 'shosaikoto go keishikashakuyakuto' or 'sodium bromide' or soretolide or soticlestat or stiripentol or sultiame or suvecaltamide or talampanel or taltrimide or tiagabine or Gabitril or topiramate or Topamax or trimethadione or troxidone or troriluzole or tsha-105 or 'valproic acid' or Depacon or Depakene or valpromide or valrocemide or vigabatrin or Sabril or vixotrigine or zaleplon or Sonata or zoniclezole or zonisamide or Zonegran or divalproex or Depakote).ti,ab,kf. |
221856 |
|
4 |
exp Benzodiazepines/ or (afizagabar or alprazolam or Niravam or Xanax or arfendazam or benzodiazepin* or bromazepam or camazepam or ceclazepide or chlordiazepoxide or Librium or cinolazepam or clobazam or clonazepam or Klonopin or clorazep* or dealkylflurazepam or delorazepam or demoxepam or devazepide or diazepam or Diastat or Valium or doxefazepam or estazolam or ProSom or fludiazepam or flunitrazepam or Rohypnol or flurazepam or Dalmane or flutoprazepam or fosazepam or gidazepam or girisopam or halazepam or loflazepate or loprazolam or lorazepam or Ativan or lormetazepam or lotrafiban or meclonazepam or medazepam or metaclazepam or midazolam or Versed or 'n nitrosochlordiazepoxide' or nastorazepide or nerisopam or netazepide or nimetazepam or nitrazepam or norchlordiazepoxide or norclobazam or nordazepam or norfludiazepam or norflunitrazepam or osugacestat or oxazepam or Serax or pamozirine or phenazepam or pinazepam or prazepam or quazepam or Doral or remimazolam or talampanel or talirine or tampramine or tarazepide or temazepam or Restoril or tetrazepam or 'tibezonium iodide' or tifluadom or tofisopam or tomaymycin or tuclazepam or uxepam or adinazolam or 'alpha hydroxymidazolam' or alpidem or bretazenil or brotizolam or chlorazepam or Librax or clotiazepam or cloxazolam or divaplon or emapunil or eszopiclone or Lunesta or fasiplon or gedocarnil or haloxazolam or ketazolam or lirequinil or mexazolam or necopidem or pagoclone or persumbran or premazepam or saripidem or suproclone or suriclone or taniplon or triazolam or zapizolam or zolazepam or zolpidem or Ambien or zopiclon*).ti,ab,kf. |
102149 |
|
5 |
exp Antipsychotic Agents/ or exp Dopamine Antagonists/ or (antipsychotic* or neuroleptic* or tranquiliz* or aceperone or acepromazine or aceprometazine or acetophenazine or adoprazine or alimemazine or Triavil or aplindore or azaperone or balipodect or benperidol or berupipam or bitopertin or blonanserin or brofoxine or bromospiperone or bromospiroperidol or bromperidol or butaclamol or butaperazine or carfenazine or cariprazine or carpipramine or carvotroline or centbutindole or chlorphenethazine or chlorproethazine or chlorpromazine or Thorazine or chlorprothixene or cinuperone or clocapramine or 'cloflumide mesilate' or clofluperol or clopenthixol or clopimozide or clopipazan or clospipramine or clotiapine or cyamemazine or deutetrabenazine or dimetotiazine or dixyrazine or 'dolasetron mesilate' or Anzemet or droperidol or Inapsine or Innovar or duoperone or etymemazine or evenamide or farampator or fluanisone or flupentixol or fluphenazine or Prolixin or fluspirilene or flutroline or 'gamma endorphin' or gevetroline or haloperidol or Haldol or Hydropres or iclepertin or isofloxythepin or isomolpan or landipirdine or lenperone or levomepromazine or methotrimeprazine or loxapine or luvadaxistat or mardepodect or maroxepin* or mazapertine or mepiprazole or mesoridazine or methopromazine or 'Diutensen-R' or metofenazate or molindone or Moban or moperone or neboglamine or noctran or norchlorpromazine or oxiperomide or oxypertine or oxyprothepine or pecazine or penfluridol or perazine or periciazine or perimetazine or perphenazine or Trilafon or pf-217830 or pf-2400013 or pf-3463275 or picobenzide or piflutixol or pimavanserin or pimethixene or pimozide or pipamperone or piperacetazine or pipotiazine or pirenperone or 'pomaglumetad methionil' or prochlorperazine or Compro or profenamine or promazine or propiomazine or propionylpromazine or prothipendyl or raclopride or ralmitaront or reserpine or Rauwiloid or rimcazole or roluperidone or romergoline or savoxepine or seridopidine or setoperone or spiperone or sulforidazine or suvecaltamide or tefludazine or tepirindole or tetrabenazine or Xenazine or thiopropazate or thioproperazine or thioridazine or tilapertin or timiperone or tiotixene or Navane or triethylperazine or trifluoperazine or Stelazine or trifluperidol or triflupromazine or tulrampator or ulotaront or umespirone or vabicaserin or zetidoline or zicronapine or zoloperone or zuclopenthixol or abaperidone or alentamol or amisulpride or amperozide or aramisulpride or aripiprazole or Abilify or asenapine or batelapine or belaperidone or bifeprunox or brexpiprazol* or clozapine or Clozaril or deutarserine or elopiprazole or emonapride or esamisulpride or flumezapine or fluperlapine or iloperidone or lumateperone or lurasidone or melperone or norclozapine or ocaperidone or olanzapine or Zyprexa or paliperidone or panamesine or pentiapine or perlapine or perospirone or pridopidine or quetiapine or Seroquel or remoxipride or rilapine or risperidone or Risperdal or sertindol* or sulpiride or sultopride or tenilapine or tiapride or tiospirone or volinanserin or ziprasidone or Geodon or zotepine or Flupenthixol or Thiethylperazine or Thiothixene).ti,ab,kf. |
185891 |
|
6 |
exp Antidepressive Agents/ or exp Antidepressive Agents, Second-Generation/ or exp Antidepressive Agents, Tricyclic/ or exp Monoamine Oxidase Inhibitors/ or ('anti depressant*' or antidepressant* or antidepression or antidepressive or neurothymoleptic* or thymoleptic* or psychoenergizer* or thymolytic or '5 hydroxytryptophan' or '5 HTP' or oxitriptan or 'abio 0801' or adatanserin or afalanine or agomelatine or alaproclate or amibegron or anpirtoline or apimostinel or aprepitant or Emend or aripiprazole or Abilify or asenapine or aticaprant or basimglurant or befetupitant or befuraline or benmoxin or binedaline or 'botulinum toxin A' or brexanolone or ciclazindol or cilobamine or clemeprol or clorotepine or clovoxamine or cotinine or crinecerfont or 'deanol acetamidobenzoate' or decoglurant or delfaprazine or dexmecamylamine or dilopetine or eclanamine or elzasonan or emicerfont or esketamine or esmethadone or etoperidone or etrabamine or farampator or fengabine or fezolamine or flerobuterol or flibanserin or fluparoxan or gamfexine or gepirone or imnopitant or indalpine or ipsapirone or itruvone or 'l 759274' or lensiprazine or 'lithium acetate' or 'lithium carbonate' or Eskalith or Lithane or Lithobid or Lithonate or Lithotabs or 'lithium compound*' or 'lithium chloride' or 'lithium citrate' or 'lithium gluconate' or 'lithium hydroxybutyrate' or 'lithium salt' or 'lithium sulfate' or lortalamine or lusaperidone or metralindole or mifepristone or Mifeprex or minaprine or 'monoamine oxidase inhibit*' or 'amine oxidase inhibit*' or 'monoamineoxidase inhibit*' or 'MAO inhibit*' or maoi* or 'adrenaline oxidase inhibit*' or 'tyraminase inhibit*' or 'tyramine oxidase inhibit*' or moxiraprine or nafenodone or naluzotan or nelivaptan or netamiftide or nomifensine or 'noradrenalin uptake inhibit*' or 'noradrenaline uptake inhibit*' or 'noradrenalin reuptake inhibit*' or 'noradrenaline reuptake inhibit*' or 'norepinephrine reuptake inhibit*' or 'norepinephrine uptake inhibit*' or onfasprodil or optimax or orvepitant or osemozotan or oxaflozane or panuramine or pexacerfont or piberaline or pirandamine or posovolone or progabide or prosulpride or psilocybine or rapastinel or rislenemdaz or rolipram or sifaprazine or siramesine or sunepitron or talsupram or teniloxazine or sufoxazine or sulfoxazine or tiflucarbine or timirdine or tofisopam or 'trazium esilate' or verucerfont or vestipitant or viqualine or zelquistinel or zometapine or zuranolone or aaptamine or adarigiline or almoxatone or amiflamine or atibeprone or bazinaprine or befloxatone or 'beta fluoromethylene meta tyrosine' or bifemelane or brofaromine or cimoxatone or clorgyline or eprobemide or etryptamine or harmaline or harmalol or harmine or banisterine or hydralazine or Apresoline or indantadol or iproclozide or iproniazid or isocarboxazid or Marplan or ladostigil or lazabemide or milacemide or moclobemide or mofegiline or 'monoamine oxidase A inhibitor*' or 'monoamine oxidase B inhibitor*' or nialamide or norselegiline or pargyline or phenelzine or Nardil or pheniprazine or pirlindole or rasagiline or Azilect or safinamide or safrazine or selegiline or Deprenyl or Deprenil or Eldepryl or Emsam or sembragiline or sercloremine or 'tak 418' or tetrindol* or toloxatone or tranylcypromine or Parnate or tribulin or vafidemstat or vixotrigine or amezinium or amfebutamone or Wellbutrin or Zyban or bupropion or amoxapine or Asendin or ampreloxetine or atomoxetin* or Strattera or tomoxetin* or beloxepin or benzphetamine or Didrex or desipramine or Norpramin or dexmethylphenidate or Focalin or dopexamine or edivoxetine or manifaxine or maprotiline or mazindol or Sanorex or methylphenidate or Concerta or Metadate or Methylin or Ritalin or netarsudil or nisoxetine or nortriptyline or Aventyl or Pamelor or protriptyline or Vivactil or radafaxine or reboxetine or serdexmethylphenidate or solriamfetol or tametraline or tapentadol or thionisoxetine or viloxazine or beloxepin or levoprotiline or maprotiline or mianserin* or mirtazapine or Remeron or oxaprotiline or teciptiline or setiptiline or '10 hydroxynortriptyline' or '2 hydroxydesipramine' or 'adinazolam mesilate' or amineptine or amitriptylin* or Elavil or amoxapine or Asendin or butriptyline or cianopramine or clomipramin* or Anafranil or danitracen or demexiptiline or desipramine or Norpramin or dibenzepin or Noveril or dimetacrin or dosulepin* or doxepin or Prudoxin or Sinequan or Zonalon or etizolam or imipramin* or Tofranil or iprindole or lofepramine or melitracen or metapramine or nitroxazepine or norclomipramine or nordoxepin or nortrimipramine or nortriptyline or Aventyl or Pamelor or noxiptiline or opipramol or propizepine or protriptyline or Vivactil or quinupramine or 's 3344' or tampramine or tandamine or tianeptine or tricyclic* or trimipramine or Surmontil).ti,ab,kf. |
254653 |
|
7 |
exp Adrenergic alpha-Antagonists/ or exp Adrenergic alpha-1 Receptor Antagonists/ or exp Adrenergic alpha-2 Receptor Antagonists/ or ('alpha block*' or 'alphablock*' or 'alpha receptor block*' or 'alpha adrenoceptor block*' or 'alpha adrenergic block*' or 'adrenergic alpha antagonist*' or 'alpha adrenergic antagonist*' or 'alpha adrenergic receptor antagonist*' or 'alpha adrenergic receptor block*' or 'alpha adrenoceptor antagonist*' or 'alpha adrenolytic agent*' or antiadrenergic* or 'anti adrenergic*' or 'adrenergic alpha 1' or 'alpha 1 adrenergic' or 'alpha 1 adrenoceptor' or 'alpha 1 block*' or 'adrenergic alpha 2' or 'alpha 2 adrenergic' or 'alpha 2 adrenoceptor' or 'alpha 2 block*' or asenapine or azapetine or bellergal or benextramine or buflomedil or Cafergot or Migergot or Wigraine or cervilan or defluina or dibenamine or dihydrobenzoperidol or dihydroergocornine or dihydroergocristine or dihydroergotamine or dihydroergotoxine or Gerimal or embolex or ergocornine or ergocristine or 'ergot alkaloid' or 'ergot derivative' or ergotamine or ergotoxine or fenspiride or lurasidone or metazosin or mianserin* or neldazosin or paliperidone or phenoxybenzamine or Dibenzyline or phentolamin* or fentalomin* or piperoxan or pontuc or proroxan or risperidone or Risperdal or spiperone or tiamenidine or tolazoline or Priscoline or tonopan or trazodone or Desyrel or trimazosin or yohimbine or Aphrodyne or ziprasidone or Geodon or zolertine or zotepine or abanoquil or acepromazine or ajmalicine or alfuzosin* or Uroxatral or fumarate or amitriptyline or Elavil or amoxapine or Asendin or anisodamine or aripiprazole or arotinolol or bendacalol or benoxathian or brexpiprazol* or bunazosin or carvedilol or Coreg or centhaquine or chloroethylclonidine or chlorpromazine or Thorazine or clozapine or Clozaril or corynanthine or dapiprazole or 'Rev Eyes' or dilevalol or domesticine or dosulepin* or dothiepin or doxazosin* or Cardura or doxepin* or Prudoxin or Sinequan or Zonalon or etoperidone or fiduxosin or 'haloperidol decanoate' or ifenprodil or indoramin or labetalol or Normodyne or Trandate or loxapine or Loxitane or maprotiline or mepiprazole or monatepil or moxisylyte or naftopidil or nantenine or nefazodone or niaprazine or nicergoline or niguldipine or pelanserin or Minizide or prazosin or Minipress or proxodolol or quetiapine or Seroquel or saterinone or sertindol* or silodosin* or tamsulosin* or Flomax or taprizosin or terazosin* or Hytrin or thioridazine or tiodazosin or tiotixene or Navane or trimipramine or Surmontil or upidosin or urapidil or 'wb 4104' or aptazapine or atipamezole or benalfocin or brexpiprazol* or celiprolol or chlorpromazine or Thorazine or clozapine or Clozaril or delequamine or deriglidole or dosulepin or dothiepin or efaroxan or esmirtazapine or fadaltran or fipamezole or fluparoxan or idazoxan or imiloxan or isaglidole or midaglizole or mirtazapine or Remeron or methylethanesulfonamide or napamezole or napitane or nemazoline or pirepemat or piribedil or quetiapine or Seroquel or 'Rauwolfia alkaloid' or alseroxylon or rauwolscine or spiroxatrine or sunepitron or teciptiline or setiptiline or vatinoxan).ti,ab,kf. |
153541 |
|
8 |
Anti-Anxiety Agents/ or (anxiolytic* or tranquiliz* or antianxiety or 'anti anxiety' or 'ataractic agent*' or 'ataractic drug*' or 'antipanic agent*' or 'antipanic drug*' or adipiplon or alnespirone or azacyclonol or batoprazine or benactyzine or Suavitil or Phebex or Phobex or Cedad or Cevanol or Deprol or Lucidil or Nutinal or Parasan or Parazan or bentazepam or benzoctamine or binospirone or brilaroxazine or buspirone or BuSpar or captodiamine or cartazolate or chlormezanone or deramciclane or eglumetad or elcubragistat or eltoprazine or emylcamate or enciprazine or etazolate or etifoxine or fabomotizole or fasedienol or fenobam or fluprazine or galdansetron or geriforte or homofenazine or hydroxyzine or Atarax or imagabalin or indorenate or isamoltane or kawain or lesopitron or lorediplon or lorpiprazole or mafoprazine or marax or menrium or mephenoxalone or meprobamate or Miltown or mirisetron or nabilone or naluzotan or ocinaplon or oxanamide or oxazafone or oxazolam or panadiplon or pancopride or 'pf 572778' or phenaglycodol or pipequaline or pivagabine or psyton or revospirone or ricasetron or serazapine or 'serenic agent*' or 'serenic drug*' or talaglumetad or tandospirone or tasipimidine or teflutixol or temgicoluril or tracazolate or trimetozine or zalospirone).ti,ab,kf. |
42829 |
|
9 |
Promethazine/ or Acetylcarnitine/ or Deanol/ or Chlorphenamidine/ or Clonidine/ or Cyproheptadine/ or Cycloserine/ or Dopamine/ or Furazolidone/ or Hydrocortisone/ or Inositol/ or Metyrapone/ or N-Methyl-3,4-methylenedioxyamphetamine/ or Naloxone/ or Naltrexone/ or Pizotyline/ or Procaine/ or Propranolol/ or Quipazine/ or Ritanserin/ or exp Tryptophan/ or (promethazin* or Phenergan or acetylcarnitine or amesergide or caroxazone or deanol or diclofensine or 'drug therap*' or fluotracen or thiazesim or Thozalinone or Stimsen or cck-4 or tetragastrin or chlorphenamidine or Chlordimeform or clonidine or cyproheptadine or Periactin or cycloserine or Seromycin or dopamin* or Intropin or flumazenil or Romazicon or furazolidone or Furoxone or Tricofuron or hydrocortisone or Aeroseb-HC or Colocort or Cort-Dome or Cortef or Cortenema or Cortifoam or Cortril or Hydrocortone or Hytone or LactiCare-HC or Nutracort or Penecort or Proctocort or Synacort or inositol or inosite or cyclohexanehexol or metyrapone or mepyrapone or metapyrone or Metopirone or midomafetamine or naloxone or Narcan or naltrexone or ReVia or noradrenerg* or pharmacotherap* or 'pharmacological intervention*' or 'pharmacological treatment*' or psychopharmac* or pizotifen or pizotyline or procaine or Novocain or Polocaine or propranolol or Inderal or psychotropic* or quipazine or ritanserin or seroto* or tryptophan).ti,ab,kf. |
723189 |
|
10 |
2 or 3 or 4 or 5 or 6 or 7 or 8 or 9 |
1263165 |
|
11 |
1 and 10 |
5690 |
|
12 |
11 not ((exp animals/ or exp models, animal/) not humans/) not ((Adolescent/ OR Child/ OR Infant/) not Adult/) NOT (comment/ or editorial/ or letter/) |
4491 |
|
13 |
limit 12 to (yr="2017-Current") |
1469 |
|
14 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) |
597632 |
|
15 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) |
1383559 |
|
16 |
13 and 14 |
253 |
|
17 |
(13 and 15) not 16 |
243 |
|
18 |
17 and 20201101:20220905.(dt). |
83 |
Psycinfo (Ebsco)
|
Search |
Query |
Items found |
|
S1 |
DE "Posttraumatic Stress Disorder" OR DE "Complex PTSD" OR AB ( ptsd OR ptss OR “combat disorder*” OR “war neuros*”' OR “combat neuros*” OR “combat stress disorder*” OR “shell shock*” OR “combat fatigue” OR “battle fatigue” ) OR TI ( ptsd OR ptss OR “combat disorder*” OR “war neuros*”' OR “combat neuros*” OR “combat stress disorder*” OR “shell shock*” OR “combat fatigue” OR “battle fatigue” ) OR AB ( (“post trauma*“ OR posttrauma*) N3 (stress* OR disorder* OR syndrome* OR symptom* OR neuros*) ) OR TI ( (“post trauma*“ OR posttrauma*) N3 (stress* OR disorder* OR syndrome* OR symptom* OR neuros*) ) |
55,901 |
|
S2 |
DE "Serotonin Norepinephrine Reuptake Inhibitors" OR DE "Venlafaxine" OR DE "Serotonin Reuptake Inhibitors" OR DE "Chlorimipramine" OR DE "Citalopram" OR DE "Fluoxetine" OR DE "Fluvoxamine" OR DE "Paroxetine" OR DE "Sertraline" OR DE "Zimeldine" OR AB ( (seroton* OR norepinephrin* OR noradrenalin* OR dopamin* OR neurotransmitter OR monoamine) N2 (uptake OR reuptake OR re-uptake) ) OR TI ( (seroton* OR norepinephrin* OR noradrenalin* OR dopamin* OR neurotransmitter OR monoamine) N2 (uptake OR reuptake OR re-uptake) ) OR AB ( SSRI*OR SRI OR SNRI* OR SSNRI* OR amfebutamone OR Wellbutrin OR Zyban OR ampreloxetine OR cericlamine OR chlorphentermine OR citalopram OR Celexa OR dapoxetine OR escitalopram OR Lexapro OR femoxetine OR fenfluramine OR fluoxetine OR Prozac OR Sarafem OR fluvoxamine OR hydroxynefazodone OR hyperforin OR ifoxetine OR litoxetine OR lubazodone OR medifoxamine OR moxifetin OR nefazodone OR nefopam OR nomelidine OR norcitalopram OR norfenfluramine OR norfluoxetine OR norsertraline OR omiloxetine OR paroxetine OR Paxil OR sertraline OR Zoloft OR tedatioxetine OR trazodone OR Desyrel OR vilazodone OR vortioxetine OR zimeldine OR amitriptylin* OR Elavil OR clomipramin* OR Anafranil OR desvenlafaxin* OR Pristiq OR deudextromethorphan OR dosulepin* OR doxepin* OR Prudoxin OR Sinequan OR Zonalon OR duloxetine OR Cymbalta OR imipramine OR Tofranil OR liafensine OR milnacipran OR sibutramine OR Meridia OR tramadol OR Ultram OR venlafaxine OR Effexor ) OR TI ( SSRI*OR SRI OR SNRI* OR SSNRI* OR amfebutamone OR Wellbutrin OR Zyban OR ampreloxetine OR cericlamine OR chlorphentermine OR citalopram OR Celexa OR dapoxetine OR escitalopram OR Lexapro OR femoxetine OR fenfluramine OR fluoxetine OR Prozac OR Sarafem OR fluvoxamine OR hydroxynefazodone OR hyperforin OR ifoxetine OR litoxetine OR lubazodone OR medifoxamine OR moxifetin OR nefazodone OR nefopam OR nomelidine OR norcitalopram OR norfenfluramine OR norfluoxetine OR norsertraline OR omiloxetine OR paroxetine OR Paxil OR sertraline OR Zoloft OR tedatioxetine OR trazodone OR Desyrel OR vilazodone OR vortioxetine OR zimeldine OR amitriptylin* OR Elavil OR clomipramin* OR Anafranil OR desvenlafaxin* OR Pristiq OR deudextromethorphan OR dosulepin* OR doxepin* OR Prudoxin OR Sinequan OR Zonalon OR duloxetine OR Cymbalta OR imipramine OR Tofranil OR liafensine OR milnacipran OR sibutramine OR Meridia OR tramadol OR Ultram OR venlafaxine OR Effexor ) |
36,186 |
|
S3 |
DE "Anticonvulsive Drugs" OR DE "Carbamazepine" OR DE "Chloral Hydrate" OR DE "Clonazepam" OR DE "Diphenylhydantoin" OR DE "Gabapentin" OR DE "Nitrazepam" OR DE "Oxazepam" OR DE "Pentobarbital" OR DE "Phenobarbital" OR DE "Pregabalin" OR DE "Primidone" OR DE "Valproic Acid" OR AB ( anticonvuls* OR anti-convuls* OR antiepilepti* OR anti-epilipti* OR abecarnil OR acetazolamide OR Diamox OR albutoin OR allomethadione OR alprazolam OR Niravam OR Xanax OR ameltolide OR antiepilepsirine OR “ascorbate magnesium” OR avizafone OR barbexaclone OR beclamide OR belnacasan OR benzobarbital OR brexanolone OR brivaracetam OR brosuximide OR “calcium bromide” OR cannabidiol OR cannabidivarin OR carabersat OR caramiphen OR carbamazepine OR Carbatrol OR Tegretol OR carisbamate OR cenobamate OR cinromide OR clobazam OR clomethiazole OR clonazepam OR Klonopin OR cpp-115 OR cyheptamide OR darigabat OR denzimol OR dextromethorphan OR dezinamide OR diazepam OR Diastat OR Valium OR diclofenamide OR Daranide OR dimethadione OR doxenitoin OR elpetrigine OR encukalner OR endixaprine OR eslicarbazepine OR etazepine OR eterobarb OR ethosuximide OR Zarontin OR ethotoin OR Peganone OR etiracetam OR levetiracetam OR Keppra OR “fali lepsin” OR falilepsin OR felbamate OR Felbatol OR fenfluramine OR fluoresone OR fluzinamide OR “fosphenytoin sodium” OR Cerebyx OR gabapentin OR Neurontin OR ganaxolone OR guaifenesin OR Allfen OR Fenesin OR Humibid OR Organidin OR Pneumomist OR Robitussin OR hexapneumine OR ica-105665 OR ica105665 OR imepitoin OR imidazenil OR ion283 OR lacosamide OR ladoxaprine OR lamotrigine OR Lamictal OR lanicemine OR licarbazepine OR lorcaserin OR loreclezole OR losigamone OR mephebarbital OR mephenytoin OR Mesantoin OR mesuximide OR Celontin OR metharbital OR methylphenobarbital OR Mebaral OR midazolam OR Versed OR milacemide OR nafimidone OR nitrazepam OR normephenytoin OR normesuximide OR oxcarbazepine OR Trileptal OR padsevonil OR paramethadione OR pazinaclone OR pentoxyverine OR perampanel OR phenacemide OR Phenurone OR phenylacetylurea OR pheneturide OR phenobarbital OR phenobarbitone OR phensuximide OR phenytoin OR Dilantin OR diphenylhydantoin OR “potassium bromide” OR pregabalin OR Lyrica OR primidone OR Mysoline OR progabide OR ralitoline OR remacemide OR retigabine OR riluzole OR Rilutek OR ropizine OR rufinamide OR safinamide OR sc-1001a OR seletracetam OR “shosaikoto go keishikashakuyakuto” OR “sodium bromide” OR soretolide OR soticlestat OR stiripentol OR sultiame OR suvecaltamide OR talampanel OR taltrimide OR tiagabine OR Gabitril OR topiramate OR Topamax OR trimethadione OR troxidone OR troriluzole OR tsha-105 OR “valproic acid” OR Depacon OR Depakene OR valpromide OR valrocemide OR vigabatrin OR Sabril OR vixotrigine OR zaleplon OR Sonata OR zoniclezole OR zonisamide OR Zonegran OR divalproex OR Depakote ) OR TI ( anticonvuls* OR anti-convuls* OR antiepilepti* OR anti-epilipti* OR abecarnil OR acetazolamide OR Diamox OR albutoin OR allomethadione OR alprazolam OR Niravam OR Xanax OR ameltolide OR antiepilepsirine OR “ascorbate magnesium” OR avizafone OR barbexaclone OR beclamide OR belnacasan OR benzobarbital OR brexanolone OR brivaracetam OR brosuximide OR “calcium bromide” OR cannabidiol OR cannabidivarin OR carabersat OR caramiphen OR carbamazepine OR Carbatrol OR Tegretol OR carisbamate OR cenobamate OR cinromide OR clobazam OR clomethiazole OR clonazepam OR Klonopin OR cpp-115 OR cyheptamide OR darigabat OR denzimol OR dextromethorphan OR dezinamide OR diazepam OR Diastat OR Valium OR diclofenamide OR Daranide OR dimethadione OR doxenitoin OR elpetrigine OR encukalner OR endixaprine OR eslicarbazepine OR etazepine OR eterobarb OR ethosuximide OR Zarontin OR ethotoin OR Peganone OR etiracetam OR levetiracetam OR Keppra OR “fali lepsin” OR falilepsin OR felbamate OR Felbatol OR fenfluramine OR fluoresone OR fluzinamide OR “fosphenytoin sodium” OR Cerebyx OR gabapentin OR Neurontin OR ganaxolone OR guaifenesin OR Allfen OR Fenesin OR Humibid OR Organidin OR Pneumomist OR Robitussin OR hexapneumine OR ica-105665 OR ica105665 OR imepitoin OR imidazenil OR ion283 OR lacosamide OR ladoxaprine OR lamotrigine OR Lamictal OR lanicemine OR licarbazepine OR lorcaserin OR loreclezole OR losigamone OR mephebarbital OR mephenytoin OR Mesantoin OR mesuximide OR Celontin OR metharbital OR methylphenobarbital OR Mebaral OR midazolam OR Versed OR milacemide OR nafimidone OR nitrazepam OR normephenytoin OR normesuximide OR oxcarbazepine OR Trileptal OR padsevonil OR paramethadione OR pazinaclone OR pentoxyverine OR perampanel OR phenacemide OR Phenurone OR phenylacetylurea OR pheneturide OR phenobarbital OR phenobarbitone OR phensuximide OR phenytoin OR Dilantin OR diphenylhydantoin OR “potassium bromide” OR pregabalin OR Lyrica OR primidone OR Mysoline OR progabide OR ralitoline OR remacemide OR retigabine OR riluzole OR Rilutek OR ropizine OR rufinamide OR safinamide OR sc-1001a OR seletracetam OR “shosaikoto go keishikashakuyakuto” OR “sodium bromide” OR soretolide OR soticlestat OR stiripentol OR sultiame OR suvecaltamide OR talampanel OR taltrimide OR tiagabine OR Gabitril OR topiramate OR Topamax OR trimethadione OR troxidone OR troriluzole OR tsha-105 OR “valproic acid” OR Depacon OR Depakene OR valpromide OR valrocemide OR vigabatrin OR Sabril OR vixotrigine OR zaleplon OR Sonata OR zoniclezole OR zonisamide OR Zonegran OR divalproex OR Depakote ) |
35,385 |
|
S4 |
DE "Benzodiazepines" OR DE "Alprazolam" OR DE "Benzodiazepine Agonists" OR DE "Benzodiazepine Antagonists" OR DE "Chlordiazepoxide" OR DE "Clonazepam" OR DE "Diazepam" OR DE "Flunitrazepam" OR DE "Flurazepam" OR DE "Lorazepam" OR DE "Midazolam" OR DE "Nitrazepam" OR DE "Oxazepam" OR AB ( afizagabar OR alprazolam OR Niravam OR Xanax OR arfendazam OR benzodiazepin* OR bromazepam OR camazepam OR ceclazepide OR chlordiazepoxide OR Librium OR cinolazepam OR clobazam OR clonazepam OR Klonopin OR clorazep* OR dealkylflurazepam OR delorazepam OR demoxepam OR devazepide OR diazepam OR Diastat OR Valium OR doxefazepam OR estazolam OR ProSom OR fludiazepam OR flunitrazepam OR Rohypnol OR flurazepam OR Dalmane OR flutoprazepam OR fosazepam OR gidazepam OR girisopam OR halazepam OR loflazepate OR loprazolam OR lorazepam OR Ativan OR lormetazepam OR lotrafiban OR meclonazepam OR medazepam OR metaclazepam OR midazolam OR Versed OR “n nitrosochlordiazepoxide” OR nastorazepide OR nerisopam OR netazepide OR nimetazepam OR nitrazepam OR norchlordiazepoxide OR norclobazam OR nordazepam OR norfludiazepam OR norflunitrazepam OR osugacestat OR oxazepam OR Serax OR pamozirine OR phenazepam OR pinazepam OR prazepam OR quazepam OR Doral OR remimazolam OR talampanel OR talirine OR tampramine OR tarazepide OR temazepam OR Restoril OR tetrazepam OR “tibezonium iodide” OR tifluadom OR tofisopam OR tomaymycin OR tuclazepam OR uxepam OR adinazolam OR “alpha hydroxymidazolam” OR alpidem OR bretazenil OR brotizolam OR chlorazepam OR Librax OR clotiazepam OR cloxazolam OR divaplon OR emapunil OR eszopiclone OR Lunesta OR fasiplon OR gedocarnil OR haloxazolam OR ketazolam OR lirequinil OR mexazolam OR necopidem OR pagoclone OR persumbran OR premazepam OR saripidem OR suproclone OR suriclone OR taniplon OR triazolam OR zapizolam OR zolazepam OR zolpidem OR Ambien OR zopiclon* ) OR TI ( afizagabar OR alprazolam OR Niravam OR Xanax OR arfendazam OR benzodiazepin* OR bromazepam OR camazepam OR ceclazepide OR chlordiazepoxide OR Librium OR cinolazepam OR clobazam OR clonazepam OR Klonopin OR clorazep* OR dealkylflurazepam OR delorazepam OR demoxepam OR devazepide OR diazepam OR Diastat OR Valium OR doxefazepam OR estazolam OR ProSom OR fludiazepam OR flunitrazepam OR Rohypnol OR flurazepam OR Dalmane OR flutoprazepam OR fosazepam OR gidazepam OR girisopam OR halazepam OR loflazepate OR loprazolam OR lorazepam OR Ativan OR lormetazepam OR lotrafiban OR meclonazepam OR medazepam OR metaclazepam OR midazolam OR Versed OR “n nitrosochlordiazepoxide” OR nastorazepide OR nerisopam OR netazepide OR nimetazepam OR nitrazepam OR norchlordiazepoxide OR norclobazam OR nordazepam OR norfludiazepam OR norflunitrazepam OR osugacestat OR oxazepam OR Serax OR pamozirine OR phenazepam OR pinazepam OR prazepam OR quazepam OR Doral OR remimazolam OR talampanel OR talirine OR tampramine OR tarazepide OR temazepam OR Restoril OR tetrazepam OR “tibezonium iodide” OR tifluadom OR tofisopam OR tomaymycin OR tuclazepam OR uxepam OR adinazolam OR “alpha hydroxymidazolam” OR alpidem OR bretazenil OR brotizolam OR chlorazepam OR Librax OR clotiazepam OR cloxazolam OR divaplon OR emapunil OR eszopiclone OR Lunesta OR fasiplon OR gedocarnil OR haloxazolam OR ketazolam OR lirequinil OR mexazolam OR necopidem OR pagoclone OR persumbran OR premazepam OR saripidem OR suproclone OR suriclone OR taniplon OR triazolam OR zapizolam OR zolazepam OR zolpidem OR Ambien OR zopiclon* ) |
26,945 |
|
S5 |
DE "Neuroleptic Drugs" OR DE "Aripiprazole" OR DE "Clozapine" OR DE "Molindone" OR DE "Nialamide" OR DE "Olanzapine" OR DE "Quetiapine" OR DE "Reserpine" OR DE "Risperidone" OR DE "Spiroperidol" OR DE "Sulpiride" OR DE "Tetrabenazine" OR DE "Dopamine Antagonists" OR DE "Sulpiride" OR AB ( antipsychotic* OR neuroleptic* OR tranquiliz* OR aceperone OR acepromazine OR aceprometazine OR acetophenazine OR adoprazine OR alimemazine OR Triavil OR aplindore OR azaperone OR balipodect OR benperidol OR berupipam OR bitopertin OR blonanserin OR brofoxine OR bromospiperone OR bromospiroperidol OR bromperidol OR butaclamol OR butaperazine OR carfenazine OR cariprazine OR carpipramine OR carvotroline OR centbutindole OR chlorphenethazine OR chlorproethazine OR chlorpromazine OR Thorazine OR chlorprothixene OR cinuperone OR clocapramine OR “cloflumide mesilate” OR clofluperol OR clopenthixol OR clopimozide OR clopipazan OR clospipramine OR clotiapine OR cyamemazine OR deutetrabenazine OR dimetotiazine OR dixyrazine OR “dolasetron mesilate” OR Anzemet OR droperidol OR Inapsine OR Innovar OR duoperone OR etymemazine OR evenamide OR farampator OR fluanisone OR flupentixol OR fluphenazine OR Prolixin OR fluspirilene OR flutroline OR “gamma endorphin” OR gevetroline OR haloperidol OR Haldol OR Hydropres OR iclepertin OR isofloxythepin OR isomolpan OR landipirdine OR lenperone OR levomepromazine OR methotrimeprazine OR loxapine OR luvadaxistat OR mardepodect OR maroxepin* OR mazapertine OR mepiprazole OR mesoridazine OR methopromazine OR “Diutensen-R” OR metofenazate OR molindone OR Moban OR moperone OR neboglamine OR noctran OR norchlorpromazine OR oxiperomide OR oxypertine OR oxyprothepine OR pecazine OR penfluridol OR perazine OR periciazine OR perimetazine OR perphenazine OR Trilafon OR pf-217830 OR pf-2400013 OR pf-3463275 OR picobenzide OR piflutixol OR pimavanserin OR pimethixene OR pimozide OR pipamperone OR piperacetazine OR pipotiazine OR pirenperone OR “pomaglumetad methionil” OR prochlorperazine OR Compro OR profenamine OR promazine OR propiomazine OR propionylpromazine OR prothipendyl OR raclopride OR ralmitaront OR reserpine OR Rauwiloid OR rimcazole OR roluperidone OR romergoline OR savoxepine OR seridopidine OR setoperone OR spiperone OR sulforidazine OR suvecaltamide OR tefludazine OR tepirindole OR tetrabenazine OR Xenazine OR thiopropazate OR thioproperazine OR thioridazine OR tilapertin OR timiperone OR tiotixene OR Navane OR triethylperazine OR trifluoperazine OR Stelazine OR trifluperidol OR triflupromazine OR tulrampator OR ulotaront OR umespirone OR vabicaserin OR zetidoline OR zicronapine OR zoloperone OR zuclopenthixol OR abaperidone OR alentamol OR amisulpride OR amperozide OR aramisulpride OR aripiprazole OR Abilify OR asenapine OR batelapine OR belaperidone OR bifeprunox OR brexpiprazol* OR clozapine OR Clozaril OR deutarserine OR elopiprazole OR emonapride OR esamisulpride OR flumezapine OR fluperlapine OR iloperidone OR lumateperone OR lurasidone OR melperone OR norclozapine OR ocaperidone OR olanzapine OR Zyprexa OR paliperidone OR panamesine OR pentiapine OR perlapine OR perospirone OR pridopidine OR quetiapine OR Seroquel OR remoxipride OR rilapine OR risperidone OR Risperdal OR sertindol* OR sulpiride OR sultopride OR tenilapine OR tiapride OR tiospirone OR volinanserin OR ziprasidone OR Geodon OR zotepine OR Flupenthixol OR Thiethylperazine OR Thiothixene ) OR TI ( antipsychotic* OR neuroleptic* OR tranquiliz* OR aceperone OR acepromazine OR aceprometazine OR acetophenazine OR adoprazine OR alimemazine OR Triavil OR aplindore OR azaperone OR balipodect OR benperidol OR berupipam OR bitopertin OR blonanserin OR brofoxine OR bromospiperone OR bromospiroperidol OR bromperidol OR butaclamol OR butaperazine OR carfenazine OR cariprazine OR carpipramine OR carvotroline OR centbutindole OR chlorphenethazine OR chlorproethazine OR chlorpromazine OR Thorazine OR chlorprothixene OR cinuperone OR clocapramine OR “cloflumide mesilate” OR clofluperol OR clopenthixol OR clopimozide OR clopipazan OR clospipramine OR clotiapine OR cyamemazine OR deutetrabenazine OR dimetotiazine OR dixyrazine OR “dolasetron mesilate” OR Anzemet OR droperidol OR Inapsine OR Innovar OR duoperone OR etymemazine OR evenamide OR farampator OR fluanisone OR flupentixol OR fluphenazine OR Prolixin OR fluspirilene OR flutroline OR “gamma endorphin” OR gevetroline OR haloperidol OR Haldol OR Hydropres OR iclepertin OR isofloxythepin OR isomolpan OR landipirdine OR lenperone OR levomepromazine OR methotrimeprazine OR loxapine OR luvadaxistat OR mardepodect OR maroxepin* OR mazapertine OR mepiprazole OR mesoridazine OR methopromazine OR “Diutensen-R” OR metofenazate OR molindone OR Moban OR moperone OR neboglamine OR noctran OR norchlorpromazine OR oxiperomide OR oxypertine OR oxyprothepine OR pecazine OR penfluridol OR perazine OR periciazine OR perimetazine OR perphenazine OR Trilafon OR pf-217830 OR pf-2400013 OR pf-3463275 OR picobenzide OR piflutixol OR pimavanserin OR pimethixene OR pimozide OR pipamperone OR piperacetazine OR pipotiazine OR pirenperone OR “pomaglumetad methionil” OR prochlorperazine OR Compro OR profenamine OR promazine OR propiomazine OR propionylpromazine OR prothipendyl OR raclopride OR ralmitaront OR reserpine OR Rauwiloid OR rimcazole OR roluperidone OR romergoline OR savoxepine OR seridopidine OR setoperone OR spiperone OR sulforidazine OR suvecaltamide OR tefludazine OR tepirindole OR tetrabenazine OR Xenazine OR thiopropazate OR thioproperazine OR thioridazine OR tilapertin OR timiperone OR tiotixene OR Navane OR triethylperazine OR trifluoperazine OR Stelazine OR trifluperidol OR triflupromazine OR tulrampator OR ulotaront OR umespirone OR vabicaserin OR zetidoline OR zicronapine OR zoloperone OR zuclopenthixol OR abaperidone OR alentamol OR amisulpride OR amperozide OR aramisulpride OR aripiprazole OR Abilify OR asenapine OR batelapine OR belaperidone OR bifeprunox OR brexpiprazol* OR clozapine OR Clozaril OR deutarserine OR elopiprazole OR emonapride OR esamisulpride OR flumezapine OR fluperlapine OR iloperidone OR lumateperone OR lurasidone OR melperone OR norclozapine OR ocaperidone OR olanzapine OR Zyprexa OR paliperidone OR panamesine OR pentiapine OR perlapine OR perospirone OR pridopidine OR quetiapine OR Seroquel OR remoxipride OR rilapine OR risperidone OR Risperdal OR sertindol* OR sulpiride OR sultopride OR tenilapine OR tiapride OR tiospirone OR volinanserin OR ziprasidone OR Geodon OR zotepine OR Flupenthixol OR Thiethylperazine OR Thiothixene ) |
(66,359 |
|
S6 |
DE "Antidepressant Drugs" OR DE "Bupropion" OR DE "Lithium Carbonate" OR DE "Mianserin" OR DE "Nefazodone" OR DE "Nomifensine" OR DE "Sulpiride" OR DE "Trazodone" OR DE "Tricyclic Antidepressant Drugs" OR DE "Amitriptyline" OR DE "Chlorimipramine" OR DE "Desipramine" OR DE "Doxepin" OR DE "Imipramine" OR DE "Maprotiline" OR DE "Nortriptyline" OR DE "Monoamine Oxidase Inhibitors" OR DE "Iproniazid" OR DE "Isocarboxazid" OR DE "Moclobemide" OR DE "Nialamide" OR DE "Pargyline" OR DE "Phenelzine" OR DE "Tranylcypromine" OR AB ( “anti depressant*” OR antidepressant* OR antidepression OR antidepressive OR neurothymoleptic* OR thymoleptic* OR psychoenergizer* OR thymolytic OR “5 hydroxytryptophan” OR “5 HTP” OR 5-hydroxytryptophan OR 5-HTP OR oxitriptan OR “abio 0801” OR abio-0801 OR adatanserin OR afalanine OR agomelatine OR alaproclate OR amibegron OR anpirtoline OR apimostinel OR aprepitant OR Emend OR aripiprazole OR Abilify OR asenapine OR aticaprant OR basimglurant OR befetupitant OR befuraline OR benmoxin OR binedaline OR “botulinum toxin A” OR brexanolone OR ciclazindol OR cilobamine OR clemeprol OR clorotepine OR clovoxamine OR cotinine OR crinecerfont OR “deanol acetamidobenzoate” OR decoglurant OR delfaprazine OR dexmecamylamine OR dilopetine OR eclanamine OR elzasonan OR emicerfont OR esketamine OR esmethadone OR etoperidone OR etrabamine OR farampator OR fengabine OR fezolamine OR flerobuterol OR flibanserin OR fluparoxan OR gamfexine OR gepirone OR imnopitant OR indalpine OR ipsapirone OR itruvone OR “l 759274” OR l-759274 OR lensiprazine OR “lithium acetate” OR “lithium carbonate” OR Eskalith OR Lithane OR Lithobid OR Lithonate OR Lithotabs OR “lithium compound*” OR “lithium chloride” OR “lithium citrate” OR “lithium gluconate” OR “lithium hydroxybutyrate” OR “lithium salt” OR “lithium sulfate” OR lortalamine OR lusaperidone OR metralindole OR mifepristone OR Mifeprex OR minaprine OR “monoamine oxidase inhibit*” OR “amine oxidase inhibit*” OR “monoamineoxidase inhibit*” OR “MAO inhibit*” OR maoi* OR “adrenaline oxidase inhibit*” OR “tyraminase inhibit*” OR “tyramine oxidase inhibit*” OR moxiraprine OR nafenodone OR naluzotan OR nelivaptan OR netamiftide OR nomifensine OR “noradrenalin uptake inhibit*” OR “noradrenaline uptake inhibit*” OR “noradrenalin reuptake inhibit*” OR “noradrenaline reuptake inhibit*” OR “norepinephrine reuptake inhibit*” OR “norepinephrine uptake inhibit*” OR onfasprodil OR optimax OR orvepitant OR osemozotan OR oxaflozane OR panuramine OR pexacerfont OR piberaline OR pirandamine OR posovolone OR progabide OR prosulpride OR psilocybine OR rapastinel OR rislenemdaz OR rolipram OR sifaprazine OR siramesine OR sunepitron OR talsupram OR teniloxazine OR sufoxazine OR sulfoxazine OR tiflucarbine OR timirdine OR tofisopam OR “trazium esilate” OR verucerfont OR vestipitant OR viqualine OR zelquistinel OR zometapine OR zuranolone OR aaptamine OR adarigiline OR almoxatone OR amiflamine OR atibeprone OR bazinaprine OR befloxatone OR “beta fluoromethylene meta tyrosine” OR bifemelane OR brofaromine OR cimoxatone OR clorgyline OR eprobemide OR etryptamine OR harmaline OR harmalol OR harmine OR banisterine OR hydralazine OR Apresoline OR indantadol OR iproclozide OR iproniazid OR isocarboxazid OR Marplan OR ladostigil OR lazabemide OR milacemide OR moclobemide OR mofegiline OR “monoamine oxidase A inhibitor*” OR “monoamine oxidase B inhibitor*” OR nialamide OR norselegiline OR pargyline OR phenelzine OR Nardil OR pheniprazine OR pirlindole OR rasagiline OR Azilect OR safinamide OR safrazine OR selegiline OR Deprenyl OR Deprenil OR Eldepryl OR Emsam OR sembragiline OR sercloremine OR “tak 418” OR tetrindol* OR toloxatone OR tranylcypromine OR Parnate OR tribulin OR vafidemstat OR vixotrigine OR amezinium OR amfebutamone OR Wellbutrin OR Zyban OR bupropion OR amoxapine OR Asendin OR ampreloxetine OR atomoxetin* OR Strattera OR tomoxetin* OR beloxepin OR benzphetamine OR Didrex OR desipramine OR Norpramin OR dexmethylphenidate OR Focalin OR dopexamine OR edivoxetine OR manifaxine OR maprotiline OR mazindol OR Sanorex OR methylphenidate OR Concerta OR Metadate OR Methylin OR Ritalin OR netarsudil OR nisoxetine OR nortriptyline OR Aventyl OR Pamelor OR protriptyline OR Vivactil OR radafaxine OR reboxetine OR serdexmethylphenidate OR solriamfetol OR tametraline OR tapentadol OR thionisoxetine OR viloxazine OR beloxepin OR levoprotiline OR maprotiline OR mianserin* OR mirtazapine OR Remeron OR oxaprotiline OR teciptiline OR setiptiline OR “10 hydroxynortriptyline” OR 10-hydroxynortriptyline OR “2 hydroxydesipramine” OR 2-hydroxydesipramine OR “adinazolam mesilate” OR amineptine OR amitriptylin* OR Elavil OR amoxapine OR Asendin OR butriptyline OR cianopramine OR clomipramin* OR Anafranil OR danitracen OR demexiptiline OR desipramine OR Norpramin OR dibenzepin OR Noveril OR dimetacrin OR dosulepin* OR doxepin OR Prudoxin OR Sinequan OR Zonalon OR etizolam OR imipramin* OR Tofranil OR iprindole OR lofepramine OR melitracen OR metapramine OR nitroxazepine OR norclomipramine OR nordoxepin OR nortrimipramine OR nortriptyline OR Aventyl OR Pamelor OR noxiptiline OR opipramol OR propizepine OR protriptyline OR Vivactil OR quinupramine OR “s 3344” OR s-3344 OR s3344 OR tampramine OR tandamine OR tianeptine OR tricyclic* OR trimipramine OR Surmontil ) OR TI ( “anti depressant*” OR antidepressant* OR antidepression OR antidepressive OR neurothymoleptic* OR thymoleptic* OR psychoenergizer* OR thymolytic OR “5 hydroxytryptophan” OR “5 HTP” OR 5-hydroxytryptophan OR 5-HTP OR oxitriptan OR “abio 0801” OR abio-0801 OR adatanserin OR afalanine OR agomelatine OR alaproclate OR amibegron OR anpirtoline OR apimostinel OR aprepitant OR Emend OR aripiprazole OR Abilify OR asenapine OR aticaprant OR basimglurant OR befetupitant OR befuraline OR benmoxin OR binedaline OR “botulinum toxin A” OR brexanolone OR ciclazindol OR cilobamine OR clemeprol OR clorotepine OR clovoxamine OR cotinine OR crinecerfont OR “deanol acetamidobenzoate” OR decoglurant OR delfaprazine OR dexmecamylamine OR dilopetine OR eclanamine OR elzasonan OR emicerfont OR esketamine OR esmethadone OR etoperidone OR etrabamine OR farampator OR fengabine OR fezolamine OR flerobuterol OR flibanserin OR fluparoxan OR gamfexine OR gepirone OR imnopitant OR indalpine OR ipsapirone OR itruvone OR “l 759274” OR l-759274 OR lensiprazine OR “lithium acetate” OR “lithium carbonate” OR Eskalith OR Lithane OR Lithobid OR Lithonate OR Lithotabs OR “lithium compound*” OR “lithium chloride” OR “lithium citrate” OR “lithium gluconate” OR “lithium hydroxybutyrate” OR “lithium salt” OR “lithium sulfate” OR lortalamine OR lusaperidone OR metralindole OR mifepristone OR Mifeprex OR minaprine OR “monoamine oxidase inhibit*” OR “amine oxidase inhibit*” OR “monoamineoxidase inhibit*” OR “MAO inhibit*” OR maoi* OR “adrenaline oxidase inhibit*” OR “tyraminase inhibit*” OR “tyramine oxidase inhibit*” OR moxiraprine OR nafenodone OR naluzotan OR nelivaptan OR netamiftide OR nomifensine OR “noradrenalin uptake inhibit*” OR “noradrenaline uptake inhibit*” OR “noradrenalin reuptake inhibit*” OR “noradrenaline reuptake inhibit*” OR “norepinephrine reuptake inhibit*” OR “norepinephrine uptake inhibit*” OR onfasprodil OR optimax OR orvepitant OR osemozotan OR oxaflozane OR panuramine OR pexacerfont OR piberaline OR pirandamine OR posovolone OR progabide OR prosulpride OR psilocybine OR rapastinel OR rislenemdaz OR rolipram OR sifaprazine OR siramesine OR sunepitron OR talsupram OR teniloxazine OR sufoxazine OR sulfoxazine OR tiflucarbine OR timirdine OR tofisopam OR “trazium esilate” OR verucerfont OR vestipitant OR viqualine OR zelquistinel OR zometapine OR zuranolone OR aaptamine OR adarigiline OR almoxatone OR amiflamine OR atibeprone OR bazinaprine OR befloxatone OR “beta fluoromethylene meta tyrosine” OR bifemelane OR brofaromine OR cimoxatone OR clorgyline OR eprobemide OR etryptamine OR harmaline OR harmalol OR harmine OR banisterine OR hydralazine OR Apresoline OR indantadol OR iproclozide OR iproniazid OR isocarboxazid OR Marplan OR ladostigil OR lazabemide OR milacemide OR moclobemide OR mofegiline OR “monoamine oxidase A inhibitor*” OR “monoamine oxidase B inhibitor*” OR nialamide OR norselegiline OR pargyline OR phenelzine OR Nardil OR pheniprazine OR pirlindole OR rasagiline OR Azilect OR safinamide OR safrazine OR selegiline OR Deprenyl OR Deprenil OR Eldepryl OR Emsam OR sembragiline OR sercloremine OR “tak 418” OR tetrindol* OR toloxatone OR tranylcypromine OR Parnate OR tribulin OR vafidemstat OR vixotrigine OR amezinium OR amfebutamone OR Wellbutrin OR Zyban OR bupropion OR amoxapine OR Asendin OR ampreloxetine OR atomoxetin* OR Strattera OR tomoxetin* OR beloxepin OR benzphetamine OR Didrex OR desipramine OR Norpramin OR dexmethylphenidate OR Focalin OR dopexamine OR edivoxetine OR manifaxine OR maprotiline OR mazindol OR Sanorex OR methylphenidate OR Concerta OR Metadate OR Methylin OR Ritalin OR netarsudil OR nisoxetine OR nortriptyline OR Aventyl OR Pamelor OR protriptyline OR Vivactil OR radafaxine OR reboxetine OR serdexmethylphenidate OR solriamfetol OR tametraline OR tapentadol OR thionisoxetine OR viloxazine OR beloxepin OR levoprotiline OR maprotiline OR mianserin* OR mirtazapine OR Remeron OR oxaprotiline OR teciptiline OR setiptiline OR “10 hydroxynortriptyline” OR 10-hydroxynortriptyline OR “2 hydroxydesipramine” OR 2-hydroxydesipramine OR “adinazolam mesilate” OR amineptine OR amitriptylin* OR Elavil OR amoxapine OR Asendin OR butriptyline OR cianopramine OR clomipramin* OR Anafranil OR danitracen OR demexiptiline OR desipramine OR Norpramin OR dibenzepin OR Noveril OR dimetacrin OR dosulepin* OR doxepin OR Prudoxin OR Sinequan OR Zonalon OR etizolam OR imipramin* OR Tofranil OR iprindole OR lofepramine OR melitracen OR metapramine OR nitroxazepine OR norclomipramine OR nordoxepin OR nortrimipramine OR nortriptyline OR Aventyl OR Pamelor OR noxiptiline OR opipramol OR propizepine OR protriptyline OR Vivactil OR quinupramine OR “s 3344” OR s-3344 OR s3344 OR tampramine OR tandamine OR tianeptine OR tricyclic* OR trimipramine OR Surmontil ) |
74,133 |
|
S7 |
AB ( “alpha block*” OR alphablock* OR “alpha receptor block*” OR “alpha adrenoceptor block*” OR “alpha adrenergic block*” OR “adrenergic alpha antagonist*” OR “alpha adrenergic antagonist*” OR “alpha adrenergic receptor antagonist*” OR “alpha adrenergic receptor block*” OR “alpha adrenoceptor antagonist*” OR “alpha adrenolytic agent*” OR antiadrenergic* OR “anti adrenergic*” OR “adrenergic alpha 1” OR “alpha 1 adrenergic” OR “alpha-1 adrenergic” OR “alpha 1 adrenoceptor” OR “alpha-1 adrenoceptor” OR “alpha 1 block*” OR “alpha-1 block*” OR “adrenergic alpha 2” OR “alpha 2 adrenergic” OR “alpha-2 adrenergic” OR “alpha 2 adrenoceptor” OR “alpha-2 adrenoceptor” OR “alpha 2 block*” OR “alpha-2 block*” OR asenapine OR azapetine OR bellergal OR benextramine OR buflomedil OR Cafergot OR Migergot OR Wigraine OR cervilan OR defluina OR dibenamine OR dihydrobenzoperidol OR dihydroergocornine OR dihydroergocristine OR dihydroergotamine OR dihydroergotoxine OR Gerimal OR embolex OR ergocornine OR ergocristine OR “ergot alkaloid” OR “ergot derivative“ OR ergotamine OR ergotoxine OR fenspiride OR lurasidone OR metazosin OR mianserin* OR neldazosin OR paliperidone OR phenoxybenzamine OR Dibenzyline OR phentolamin* OR fentalomin* OR piperoxan OR pontuc OR proroxan OR risperidone OR Risperdal OR spiperone OR tiamenidine OR tolazoline OR Priscoline OR tonopan OR trazodone OR Desyrel OR trimazosin OR yohimbine OR Aphrodyne OR ziprasidone OR Geodon OR zolertine OR zotepine OR abanoquil OR acepromazine OR ajmalicine OR alfuzosin* OR Uroxatral OR fumarate OR amitriptyline OR Elavil OR amoxapine OR Asendin OR anisodamine OR aripiprazole OR arotinolol OR bendacalol OR benoxathian OR brexpiprazol* OR bunazosin OR carvedilol OR Coreg OR centhaquine OR chloroethylclonidine OR chlorpromazine OR Thorazine OR clozapine OR Clozaril OR corynanthine OR dapiprazole OR “Rev Eyes” OR dilevalol OR domesticine OR dosulepin* OR dothiepin OR doxazosin* OR Cardura OR doxepin* OR Prudoxin OR Sinequan OR Zonalon OR etoperidone OR fiduxosin OR “haloperidol decanoate” OR ifenprodil OR indoramin OR labetalol OR Normodyne OR Trandate OR loxapine OR Loxitane OR maprotiline OR mepiprazole OR monatepil OR moxisylyte OR naftopidil OR nantenine OR nefazodone OR niaprazine OR nicergoline OR niguldipine OR pelanserin OR Minizide OR prazosin OR Minipress OR proxodolol OR quetiapine OR Seroquel OR saterinone OR sertindol* OR silodosin* OR tamsulosin* OR Flomax OR taprizosin OR terazosin* OR Hytrin OR thioridazine OR tiodazosin OR tiotixene OR Navane OR trimipramine OR Surmontil OR upidosin OR urapidil OR “wb 4104” OR wb-4104 OR aptazapine OR atipamezole OR benalfocin OR brexpiprazol* OR celiprolol OR chlorpromazine OR Thorazine OR clozapine OR Clozaril OR delequamine OR deriglidole OR dosulepin OR dothiepin OR efaroxan OR esmirtazapine OR fadaltran OR fipamezole OR fluparoxan OR idazoxan OR imiloxan OR isaglidole OR midaglizole OR mirtazapine OR Remeron OR methylethanesulfonamide OR napamezole OR napitane OR nemazoline OR pirepemat OR piribedil OR quetiapine OR Seroquel OR “Rauwolfia alkaloid” OR alseroxylon OR rauwolscine OR spiroxatrine OR sunepitron OR teciptiline OR setiptiline OR vatinoxan ) OR TI ( “alpha block*” OR alphablock* OR “alpha receptor block*” OR “alpha adrenoceptor block*” OR “alpha adrenergic block*” OR “adrenergic alpha antagonist*” OR “alpha adrenergic antagonist*” OR “alpha adrenergic receptor antagonist*” OR “alpha adrenergic receptor block*” OR “alpha adrenoceptor antagonist*” OR “alpha adrenolytic agent*” OR antiadrenergic* OR “anti adrenergic*” OR “adrenergic alpha 1” OR “alpha 1 adrenergic” OR “alpha-1 adrenergic” OR “alpha 1 adrenoceptor” OR “alpha-1 adrenoceptor” OR “alpha 1 block*” OR “alpha-1 block*” OR “adrenergic alpha 2” OR “alpha 2 adrenergic” OR “alpha-2 adrenergic” OR “alpha 2 adrenoceptor” OR “alpha-2 adrenoceptor” OR “alpha 2 block*” OR “alpha-2 block*” OR asenapine OR azapetine OR bellergal OR benextramine OR buflomedil OR Cafergot OR Migergot OR Wigraine OR cervilan OR defluina OR dibenamine OR dihydrobenzoperidol OR dihydroergocornine OR dihydroergocristine OR dihydroergotamine OR dihydroergotoxine OR Gerimal OR embolex OR ergocornine OR ergocristine OR “ergot alkaloid” OR “ergot derivative” OR ergotamine OR ergotoxine OR fenspiride OR lurasidone OR metazosin OR mianserin* OR neldazosin OR paliperidone OR phenoxybenzamine OR Dibenzyline OR phentolamin* OR fentalomin* OR piperoxan OR pontuc OR proroxan OR risperidone OR Risperdal OR spiperone OR tiamenidine OR tolazoline OR Priscoline OR tonopan OR trazodone OR Desyrel OR trimazosin OR yohimbine OR Aphrodyne OR ziprasidone OR Geodon OR zolertine OR zotepine OR abanoquil OR acepromazine OR ajmalicine OR alfuzosin* OR Uroxatral OR fumarate OR amitriptyline OR Elavil OR amoxapine OR Asendin OR anisodamine OR aripiprazole OR arotinolol OR bendacalol OR benoxathian OR brexpiprazol* OR bunazosin OR carvedilol OR Coreg OR centhaquine OR chloroethylclonidine OR chlorpromazine OR Thorazine OR clozapine OR Clozaril OR corynanthine OR dapiprazole OR “Rev Eyes” OR dilevalol OR domesticine OR dosulepin* OR dothiepin OR doxazosin* OR Cardura OR doxepin* OR Prudoxin OR Sinequan OR Zonalon OR etoperidone OR fiduxosin OR “haloperidol decanoate” OR ifenprodil OR indoramin OR labetalol OR Normodyne OR Trandate OR loxapine OR Loxitane OR maprotiline OR mepiprazole OR monatepil OR moxisylyte OR naftopidil OR nantenine OR nefazodone OR niaprazine OR nicergoline OR niguldipine OR pelanserin OR Minizide OR prazosin OR Minipress OR proxodolol OR quetiapine OR Seroquel OR saterinone OR sertindol* OR silodosin* OR tamsulosin* OR Flomax OR taprizosin OR terazosin* OR Hytrin OR thioridazine OR tiodazosin OR tiotixene OR Navane OR trimipramine OR Surmontil OR upidosin OR urapidil OR “wb 4104” OR wb-4104 OR aptazapine OR atipamezole OR benalfocin OR brexpiprazol* OR celiprolol OR chlorpromazine OR Thorazine OR clozapine OR Clozaril OR delequamine OR deriglidole OR dosulepin OR dothiepin OR efaroxan OR esmirtazapine OR fadaltran OR fipamezole OR fluparoxan OR idazoxan OR imiloxan OR isaglidole OR midaglizole OR mirtazapine OR Remeron OR methylethanesulfonamide OR napamezole OR napitane OR nemazoline OR pirepemat OR piribedil OR quetiapine OR Seroquel OR “Rauwolfia alkaloid” OR alseroxylon OR rauwolscine OR spiroxatrine OR sunepitron OR teciptiline OR setiptiline OR vatinoxan ) |
32,916 |
|
S8 |
DE "Tranquilizing Drugs" OR DE "Benactyzine" OR DE "Doxepin" OR DE "Haloperidol" OR DE "Meprobamate" OR DE "Minor Tranquilizers" OR DE "Mood Stabilizers" OR DE "Neuroleptic Drugs" OR DE "Phenothiazine Derivatives" OR DE "Pimozide" OR DE "Thiothixene" OR DE "Alprazolam" OR DE "Buspirone" OR DE "Chlordiazepoxide" OR DE "Chlorprothixene" OR DE "Clonazepam" OR DE "Diazepam" OR DE "Hydroxyzine" OR DE "Lorazepam" OR DE "Loxapine" OR DE "Midazolam" OR DE "Oxazepam" OR DE "Chlorpromazine" OR DE "Chlorprothixene" OR DE "Fluphenazine" OR DE "Mesoridazine" OR DE "Perphenazine" OR DE "Prochlorperazine" OR DE "Promazine" OR DE "Thioridazine" OR DE "Trifluoperazine" OR AB ( anxiolytic* OR tranquiliz* OR antianxiety OR “anti anxiety” OR “ataractic agent*” OR “ataractic drug*” OR “ataraxic drug*” OR “ataraxic agent*” OR “antipanic agent*” OR “antipanic drug*” OR “anxiety reducing drug*” OR adipiplon OR alnespirone OR azacyclonol OR batoprazine OR benactyzine OR Suavitil OR Phebex OR Phobex OR Cedad OR Cevanol OR Deprol OR Lucidil OR Nutinal OR Parasan OR Parazan OR bentazepam OR benzoctamine OR binospirone OR brilaroxazine OR buspirone OR BuSpar OR captodiamine OR cartazolate OR chlormezanone OR deramciclane OR eglumetad OR elcubragistat OR eltoprazine OR emylcamate OR enciprazine OR etazolate OR etifoxine OR fabomotizole OR fasedienol OR fenobam OR fluprazine OR galdansetron OR geriforte OR homofenazine OR hydroxyzine OR Atarax OR imagabalin OR indorenate OR isamoltane OR kawain OR lesopitron OR lorediplon OR lorpiprazole OR mafoprazine OR marax OR menrium OR mephenoxalone OR meprobamate OR Miltown OR mirisetron OR nabilone OR naluzotan OR ocinaplon OR oxanamide OR oxazafone OR oxazolam OR panadiplon OR pancopride OR “pf 572778” OR phenaglycodol OR pipequaline OR pivagabine OR psyton OR revospirone OR ricasetron OR serazapine OR “serenic agent*” OR “serenic drug*” OR talaglumetad OR tandospirone OR tasipimidine OR teflutixol OR temgicoluril OR tracazolate OR trimetozine OR zalospirone ) OR TI ( anxiolytic* OR tranquiliz* OR antianxiety OR “anti anxiety” OR “ataractic agent*” OR “ataractic drug*” OR “ataraxic drug*” OR “ataraxic agent*” OR “antipanic agent*” OR “antipanic drug*” OR “anxiety reducing drug*” OR adipiplon OR alnespirone OR azacyclonol OR batoprazine OR benactyzine OR Suavitil OR Phebex OR Phobex OR Cedad OR Cevanol OR Deprol OR Lucidil OR Nutinal OR Parasan OR Parazan OR bentazepam OR benzoctamine OR binospirone OR brilaroxazine OR buspirone OR BuSpar OR captodiamine OR cartazolate OR chlormezanone OR deramciclane OR eglumetad OR elcubragistat OR eltoprazine OR emylcamate OR enciprazine OR etazolate OR etifoxine OR fabomotizole OR fasedienol OR fenobam OR fluprazine OR galdansetron OR geriforte OR homofenazine OR hydroxyzine OR Atarax OR imagabalin OR indorenate OR isamoltane OR kawain OR lesopitron OR lorediplon OR lorpiprazole OR mafoprazine OR marax OR menrium OR mephenoxalone OR meprobamate OR Miltown OR mirisetron OR nabilone OR naluzotan OR ocinaplon OR oxanamide OR oxazafone OR oxazolam OR panadiplon OR pancopride OR “pf 572778” OR phenaglycodol OR pipequaline OR pivagabine OR psyton OR revospirone OR ricasetron OR serazapine OR “serenic agent*” OR “serenic drug*” OR talaglumetad OR tandospirone OR tasipimidine OR teflutixol OR temgicoluril OR tracazolate OR trimetozine OR zalospirone ) |
51,384 |
|
S9 |
DE "Promethazine" OR DE "Clonidine" OR DE "Dopamine" OR DE "Hydrocortisone" OR DE "Naloxone" OR DE "Naltrexone" OR DE "Procaine" OR DE "Propranolol" OR DE "Ritanserin" OR DE "Tryptophan" OR DE "Hydroxytryptophan (5-)" OR AB ( promethazin* OR Phenergan OR acetylcarnitine OR amesergide OR caroxazone OR deanol OR diclofensine OR “drug therap*” OR fluotracen OR thiazesim OR Thozalinone OR Stimsen OR cck-4 OR tetragastrin OR chlorphenamidine OR Chlordimeform OR clonidine OR cyproheptadine OR Periactin OR cycloserine OR Seromycin OR dopamin* OR Intropin OR flumazenil OR Romazicon OR furazolidone OR Furoxone OR Tricofuron OR hydrocortisone OR Aeroseb-HC OR Colocort OR Cort-Dome OR Cortef OR Cortenema OR Cortifoam OR Cortril OR Hydrocortone OR Hytone OR LactiCare-HC OR Nutracort OR Penecort OR Proctocort OR Synacort OR inositol OR inosite OR cyclohexanehexol OR metyrapone OR mepyrapone OR metapyrone OR Metopirone OR midomafetamine OR naloxone OR Narcan OR naltrexone OR ReVia OR noradrenerg* OR pharmacotherap* OR “pharmacological intervention*” OR “pharmacological treatment*” OR psychopharmac* OR pizotifen OR pizotyline OR procaine OR Novocain OR Polocaine OR propranolol OR Inderal OR psychotropic* OR quipazine OR ritanserin OR seroto* OR tryptophan ) OR TI ( promethazin* OR Phenergan OR acetylcarnitine OR amesergide OR caroxazone OR deanol OR diclofensine OR “drug therap*” OR fluotracen OR thiazesim OR Thozalinone OR Stimsen OR cck-4 OR tetragastrin OR chlorphenamidine OR Chlordimeform OR clonidine OR cyproheptadine OR Periactin OR cycloserine OR Seromycin OR dopamin* OR Intropin OR flumazenil OR Romazicon OR furazolidone OR Furoxone OR Tricofuron OR hydrocortisone OR Aeroseb-HC OR Colocort OR Cort-Dome OR Cortef OR Cortenema OR Cortifoam OR Cortril OR Hydrocortone OR Hytone OR LactiCare-HC OR Nutracort OR Penecort OR Proctocort OR Synacort OR inositol OR inosite OR cyclohexanehexol OR metyrapone OR mepyrapone OR metapyrone OR Metopirone OR midomafetamine OR naloxone OR Narcan OR naltrexone OR ReVia OR noradrenerg* OR pharmacotherap* OR “pharmacological intervention*” OR “pharmacological treatment*” OR psychopharmac* OR pizotifen OR pizotyline OR procaine OR Novocain OR Polocaine OR propranolol OR Inderal OR psychotropic* OR quipazine OR ritanserin OR seroto* OR tryptophan ) |
164,422 |
|
S10 |
S2 OR S3 OR S4 OR S5 OR S6 OR S7 OR S8 OR S9 |
286,184 |
|
S11 |
S1 AND S10 |
4,394 |
|
S12 |
S11 NOT ((ZG ("adolescence (13-17 yrs)" OR "childhood (birth-12 yrs)" OR "infancy (2-23 mo)” OR "neonatal (birth-1 mo)" OR "preschool age (2-5 yrs)" OR "school age (6-12 yrs)")) NOT (ZG ("adulthood (18 yrs & older)" OR "aged (65 yrs & older)" OR "middle age (40-64 yrs)" OR "thirties (30-39 yrs)" OR "very old (85 yrs & older)"))) NOT (PO Animal NOT PO Human) |
3,662 |
|
S13 |
S12 AND (PY 2017 OR PY 2018 OR PY 2019 OR PY 2020 OR PY 2021 OR PY 2022) |
882 |
|
S14 |
MR ("literature review" OR "systematic review" OR "meta analysis") OR DE ("Literature Review" OR "Systematic Review" OR "Meta Analysis") OR TI (review* OR overview) OR AB (bibliograph* OR relevant journals OR ((review* OR overview*) N9 (systematic* OR methodologic* OR quantitativ* OR research* OR literature* OR studies OR trial* OR effective*))) OR AB ((meta N2 analy*) OR metaanaly* OR (synthes* N2 (literature* OR research* OR studies OR data)) OR (pooled AND analys*) OR ((data N1 pool*) AND studies) OR ((hand OR manual OR database* OR computer*) N1 search*) OR (electronic N1 (database* OR data base OR data bases))) OR TI ((meta N2 analy*) OR metaanaly* OR (synthes* N2 (literature* OR research* OR studies OR data)) OR (pooled AND analys*) OR ((data N1 pool*) AND studies) OR ((hand OR manual OR database* OR computer*) N1 search*) OR (electronic N1 (database* OR data base OR data bases))) OR KW ((meta N2 analy*) OR metaanaly* OR (synthes* N2 (literature* OR research* OR studies OR data)) OR (pooled AND analys*) OR ((data N1 pool*) AND studies) OR ((hand OR manual OR database* OR computer*) N1 search*) OR (electronic N1 (database* OR data base OR data bases))) |
475,835 |
|
DE "Randomized Controlled Trials" OR DE "Randomized Clinical Trials" OR DE "Clinical Trials" OR DE "Treatment Effectiveness Evaluation" OR DE "Mental Health Program Evaluation" OR DE "Placebo" OR DE "Random Sampling" OR TI placebo* OR AB placebo* OR AB randomly OR TX randomi* OR TI trial OR AB trial OR TX ((singl* OR doubl* OR trebl* OR tripl*) N3 (blind* OR mask* OR dummy)) OR TI (control* N3 (trial* OR study OR studies OR group*)) OR AB (control* N3 (trial* OR study OR studies OR group*)) OR TI factorial* OR AB factorial* OR TI allocat* OR AB allocat* OR TI assign* OR AB assign* OR TI volunteer* OR AB volunteer* OR TI (crossover* OR "cross over*") OR AB (crossover* OR "cross over*") OR TX (quasi N5 (experimental OR random*)) |
582,120 |
|
|
S16 |
S13 and S14 |
225 |
|
S17 |
(S13 and S15) not S16 |
224 |
|
S18 |
S17 AND RD 202011-202209 |
88 |