Behandeling pertrochantere fracturen
Uitgangsvraag
Wat is de beste behandeling bij de pertrochantere fractuur 31-A.1, 31-A.2 31-A.3?
Aanbeveling
Gebruik bij een 31-A.1 type pertrochantere fractuur een extramedullaire GHS.
Gebruik bij een 31-A.2 fractuur een extramedullaire GHS of een intramedullair implantaat. Vanwege de kosteneffectiviteit gaat de voorkeur van de richtlijnwerkgroep uit naar een extramedullaire GHS.
Gebruik bij een 31-A.3 type fractuur een intramedullair implantaat of een extramedullaire GHS met laterale afsteun. De werkgroep heeft een voorkeur voor een intramedullair implantaat bij dit type fractuur.
Overwegingen
Naast de Cochrane review, zijn ook de NICE- en AAOS-richtlijnen bestudeerd. Deze richtlijnen includeren echter geen studies die gepubliceerd zijn nadat de search in de Cochrane review is uitgevoerd.
Pertrochantere fracturen kunnen behandeld worden met een extramedullair of intramedullair implantaat. Een sluitend bewijs voor superioriteit van een van beide ontbreekt voor de uitkomstmaten vroege en laattijdige mortaliteit, postoperatieve complicaties, heroperatierisico, iatrogene of postoperatieve fracturen rondom het implantaat, opnameduur en mobiliteit. De consistentie van deze bevindingen in alle individuele vergelijkende studies is hoog. In de beschikbare literatuur wordt alleen het aantal heroperaties voor intramedullaire implantaten groter dan voor extramedullaire implantaten vanwege een hogere kans op iatrogene en implantaat gerelateerde fracturen. Dit verschil zou kunnen worden veroorzaakt door inclusie van studies met intramedullaire implantaten die niet langer verkrijgbaar zijn. Maar ook bij subanalyse van studies die gepubliceerd zijn na 2000 blijft dit verschil bestaan ten nadele van de intramedullaire implantaten.
Gegeven het ontbreken van een kwalitatief verschil tussen beide implantaten, dient de kostprijs in overweging genomen te worden. Een intramedullair implantaat is ongeveer drie tot vijf keer duurder dan een extramedullair implantaat.
De richtlijnwerkgroep is van mening dat een adequate repositie van de fractuur essentieel is voor een goed herstel van beenlengte, asstand en rotatie. Hiervoor dienen varus en externe rotatie gecorrigeerd te worden. Dit kan vaak gesloten op bijvoorbeeld een tractietafel, maar indien daarmee geen adequate fractuurrepositie kan worden verkregen, dient open repositie plaats te vinden. De essentie is dat de repositie (valgushoek) peroperatief én postoperatief behouden blijft. Open repositie, behoud van repositie met cerclagedraden en medialisatie van het entreepunt van de mergpen kunnen waardevolle hulpmiddelen zijn.
Voor een reverse type fractuur (AO 31-A.3) dient een anatomische positie van de apex van de fractuur nagestreefd te worden alvorens het implantaat wordt ingebracht. Die repositie kan met een cerclagedraad behouden blijven. Aangezien een 31-A.3 type ook uitbreiding in de subtrochantere regio, zie de module 'Behandeling subtrochantere fracturen', kan hebben is het onderscheid tussen een 31-A.3 en subtrochantere fractuur vaak moeilijk te maken. Om deze reden geeft de werkgroep bij een 31-A.3 type fractuur de voorkeur aan een intramedullair implantaat boven een extramedullair implantaat.
Een extramedullair implantaat moet voorzien zijn van een laterale afsteunplaat ter voorkoming van lateralisatie van de trochantere fragmenten bij een 31-A.3 fractuur. Deze additionele techniek bij een extramedullair implantaat vergt ervaring en meer technisch inzicht en een extra implantaat.
Onderbouwing
Achtergrond
Het is onduidelijk of alle implantaten even geschikt zijn voor ieder type pertrochantere fractuur. De ‘body’ van een implantaat ligt óf intramedullair (i.e. mergpen of cephalocondylic nail) of extramedullair (plaat). Beide implantaatsystemen hebben een vorm van glijdende heupschroef aan de bovenzijde van het implantaat die tot in de heupkop reikt (Glijdende Heup Schroef, GHS). Daardoor kan compressie op de fractuur ontstaan. Intramedullaire implantaten zijn er in veel verschillende vormen, en zijn de afgelopen twintig jaar veranderd in maat en vorm. Het ontwerp van de GHS is de afgelopen dertig jaar niet veranderd en over het algemeen niet verschillend tussen fabrikanten.
Voor de plaatsing van een plaat is een open chirurgische benadering naar het proximale femur nodig. Dit biedt voor sommige fractuurtypen het voordeel dat een anatomische repositie van de fractuur beter mogelijk is. Een mergpen wordt in opzet via meerdere kleinere incisies ingebracht. De patiënt krijgt dus niet één grote incisie, maar meerdere kleinere incisies. Bovendien kan de repositie van de fractuur lastiger zijn. Zo zijn er nog meer verschillen tussen beide implantaatsystemen. Onduidelijk is echter hoe die diverse eigenschappen meewegen in de uiteindelijke (functionele) uitkomst.
Leidend voor de keuze van het implantaat dienen uitkomstmaten te zijn, waarbij het resultaat voor de patiënt centraal staat. Daarnaast is succes of falen van een implantaat in sterke mate afhankelijk van de wijze waarop het is ingebracht: een goed implantaat dat technisch verkeerd is gebruikt, leidt tot een slecht resultaat. De richtlijn beoogt ordening aan te brengen in alle argumenten en de operateur te helpen bij het maken van de juiste keuzes.
Conclusies / Summary of Findings
Mortaliteit
|
Hoog GRADE |
Er is geen verschil in de kans op overlijden tussen een intramedullair implantaat of extramedullair implantaat bij patiënten met een pertrochantere 31-A.1, 31-A.2, 31-A.3 fractuur.
Bronnen (Parker, 2010) |
Peroperatieve iatrogene fractuur van het femur
|
Matig GRADE |
Er treden mogelijk meer peroperatieve iatrogene fracturen op bij gebruik van een intramedullair implantaat ter behandeling van pertrochantere 31-A.1, 31-A.2, 31-A.3 fractuur.
Bronnen (Parker, 2010; Guo, 2013; Xu, 2010) |
|
Matig GRADE |
Er zijn mogelijk ook meer peroperatieve iatrogene fracturen bij gebruik van een intramedullair implantaat ter behandeling van een instabiele fractuur.
Bronnen (Parker, 2010; Xu, 2010) |
Postoperatieve implantaat-gerelateerde fractuur
|
Matig GRADE |
Er zijn aanwijzingen dat het risico op latere femurfracturen hoger is na gebruik van een intramedullair implantaat, dan na een extramedullair implantaat bij patiënten met een pertrochantere 31-A.1, 31-A.2, 31-A.3 fractuur.
Bronnen (Parker, 2010; Matre, 2013; Parker, 2012; Xu, 2010) |
|
Laag GRADE |
Het is onduidelijk of het risico op een latere femurfractuur na intra- of extramedullaire fixatie verschillend is bij patiënten met een instabiele femurfractuur.
Bronnen (Parker, 2010; Xu, 2010) |
Heroperatie
|
Hoog GRADE |
Er zijn aanwijzingen dat het risico op een heroperatie bij patiënten met een pertrochantere 31-A.1, 31-A.2, 31-A.3 fractuur licht is verhoogd bij gebruik van een intramedullair implantaat in vergelijking tot een extramedullair implantaat.
Bronnen (Parker, 2010; Matre, 2013; Xu, 2010) |
|
Laag GRADE |
Het risico op een heroperatie bij patiënten met een instabiele pertrochantere fractuur na behandeling met een intramedullair implantaat verschilt mogelijk niet van het risico na behandeling met een extramedullair implantaat.
Bronnen (Parker, 2010; Xu, 2010) |
Diepe wondinfectie
|
Matig GRADE |
Het is waarschijnlijk dat er geen verschil bestaat in het risico op diepe wondinfecties tussen intra- of extramedullaire fixatie bij een pertrochantere 31-A.1, 31-A.2, 31-A.3 fractuur.
Bronnen (Parker, 2010; Parker 2012) |
|
Laag GRADE |
Het is onduidelijk of er een verschil is in het risico op diepe wondinfecties tussen intra- en extramedullaire fixatie bij instabiele pertrochantere femurfracturen.
Bronnen (Parker, 2010) |
Nonunion
|
Matig GRADE |
Het is waarschijnlijk dat er geen verschil is in het risico op nonunion tussen intra- en extramedullaire fixatie bij pertrochantere 31-A.1, 31-A.2, 31-A.3 fractuur.
Bronnen (Parker, 2010; Guo, 2013; Matre, 2013; Parker, 2012; Xu, 2010) |
|
Laag GRADE |
Het is mogelijk dat er geen verschil is in het risico op nonunion tussen intra- en extramedullaire fixatie bij instabiele pertrochantere fracturen.
Bronnen (Parker, 2010; Xu, 2010) |
Mobiliteit
|
Matig GRADE |
Er is waarschijnlijk geen verschil in de mobiliteit na pertrochantere 31-A.1, 31-A.2, 31-A.3 fractuur behandeld met een intramedullair implantaat in vergelijking met een extramedullair implantaat.
Bronnen (Parker, 2010; Guo, 2013; Matre, 2013; Xu, 2010, Parker, 2012) |
|
Laag GRADE |
Het is onduidelijk of er een verschil is in de mobiliteit na een instabiele pertrochantere fractuur met een intramedullair implantaat in vergelijking met een extramedullair implantaat.
Bronnen (Parker, 2002; Xu, 2010) |
Pijn
|
Matig GRADE |
Er is waarschijnlijk geen verschil in pijn tussen intra- en extramedullaire fixatie van een pertrochantere 31-A.1, 31-A.2, 31-A.3 fractuur.
Bronnen (Parker, 2010) |
|
Matig GRADE |
Er is mogelijk geen verschil in pijn tussen intra- en extramedullaire fixatie van een instabiele pertrochantere fractuur.
Bronnen (Parker, 2010; Xu, 2010) |
Samenvatting literatuur
In de Cochrane review worden verschillende vergelijkingen beschreven:
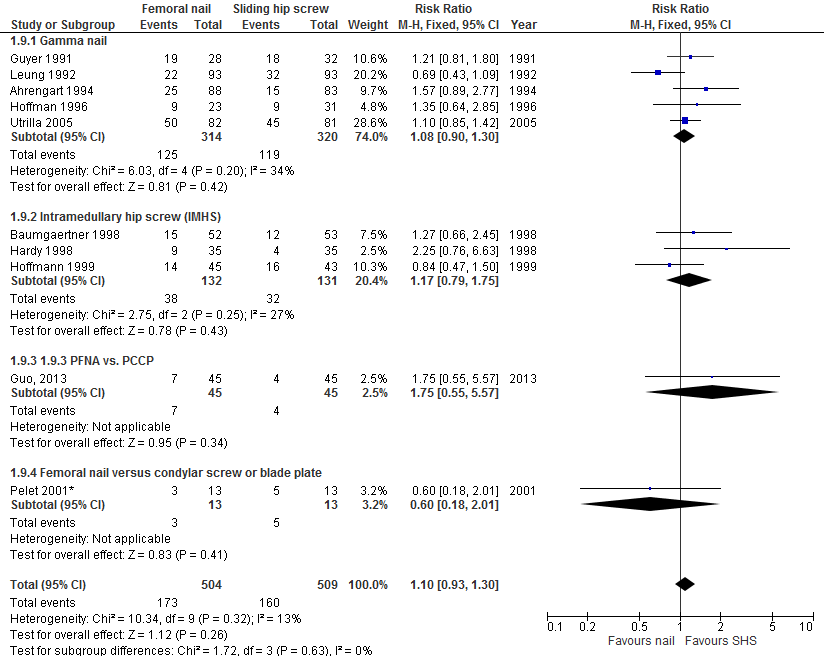
- intramedullary hip screw (IMHS) versus GHS (Baumgaertner, 1998; Hardy, 1998; Harrington, 2002; Hoffmann, 1999, Mehdi, 2000);
- proximal femoral nail (PFN) versus GHS (Pajarinen, 2005; Papasimos, 2005; Saudan, 2002);
- proximal femoral nail antirotation (PFNA) versus GHS (Zou, 2009);
- targon PF (proximal femoral) nail versus GHS (Giraud, 2005);
- long Holland nail versus GHS (Little, 2008);
- long Gamma nail versus GHS (Barton, 2010);
- intramedullary nail (two types) versus the GHS (Verettas, 2010);
- intramedullary nails (various types) versus Medoff sliding plate (Miedel, 2005; Ekstrom, 2007);
- gamma nail versus the percutaneous compression plate (PCCP) (Varela-Egocheaga, 2009);
- intramedullary nails (various types) versus fixed (static) extramedullary plates for lower trochanteric fractures (Pelet, 2001; Muller, 1991; Sadowski, 2002);
- intramedullary nails (various types) versus fixed (static) extramedullary plates for subtrochanteric fractures (Lee, 2007).
De resultaten van 41 trials met voornamelijk oudere patiënten uit de Cochrane review zijn meegenomen. De studiegrootte varieerde van 40 tot 684 patiënten. In alle studies zijn patiënten met stabiele en instabiele pertrochantere fracturen meegenomen, maar in een aantal zijn ook resultaten bij subtrochantere fracturen beschreven.
Aanvullend op de Cochrane review werden vijf meer recente RCTs geïncludeerd:
- In de studie van Guo (2013) werden patiënten ouder dan 60 jaar met een pertrochantere fractuur (31A1 en 31A2), met een ASA-score 1-4 geïncludeerd. Patiënten met subtrochantere fracturen, oude fracturen in een van de heupen of andere verwondingen of aandoeningen die de uitkomsten kunnen beïnvloeden, werden geëxcludeerd. In totaal ondergingen 90 patiënten na randomisatie een minimaal invasieve ingreep met een PFNA (n=45) of PCCP (n=45). Patiënten werden gestimuleerd de eerste dag na operatie te bewegen en zo mogelijk belast te mobiliseren (eventueel met loophulp). De follow-up in deze studie was minimaal een jaar, hoewel de meetmomenten voor de verschillende uitkomstmaten niet helder beschreven zijn.
- In de multicenter RCT van Matre (2013) werden 684 patiënten oudere dan 60 jaar met een pertrochantere of subtrochantere fractuur gerandomiseerd voor een Trigen Intertan intramedullary nail (n=341) of GHS (compression hip screw of dynamic hip screw) (n=343). Ook patiënten met een cognitieve beperking werden geïncludeerd in deze studie. Patiënten met een pathologische fractuur werden geëxcludeerd. De follow-up duur was twaalf maanden.
- In de RCT van Parker (2012) werden 600 patiënten met een stabiele of instabiele pertrochantere fractuur gerandomiseerd voor Targon PF nail (n=300) of GHS (n=300), geplaatst met minimaal invasieve benadering. Exclusiecriteria waren subtrochantere fracturen of pertrochantere fracturen met subtrochantere uitbreiding waarvoor een plaat met meer dan vijf gaten nodig was om distaal met 4 bicorticale schroeven te kunnen fixeren, pathologische fracturen, eerder geopereerde proximale femurfracturen, dementie (waarbij toestemming door naasten niet werd gegeven) en patiënten met significante artrose van de heup waarvoor een totale heupprothese geïndiceerd was. De follow-up was twaalf maanden.
- In de RCT van Xu (2010) werden patiënten met een instabiele proximale femurfractuur (AO 31-A.2) gerandomiseerd voor een PFNA (n=51) met open (n=9) of gesloten (n=42) repositie of DHS (n=55) met open repositie. Patiënten jonger dan 65 jaar of met een ASA-status 5-6, een pathologische fractuur, een fractuur in het kader van een polytrauma of eerdere heupchirurgie werden geëxcludeerd. De follow-up duur was twaalf maanden.
Bij de analyse van de literatuur over de pertrochantere fracturen is zoveel als mogelijk onderscheid gemaakt tussen stabiele fracturen (AO/OTA-type 31-A.1) en instabiele fracturen (31-A.2 en 31-A.3). In de studies en bestaande meta-analyses en reviews zijn de verschillende types echter niet altijd duidelijk te onderscheiden. Het is daardoor niet mogelijk separate analyses voor de drie afzonderlijke types te verrichten. Wel kon een subgroep analyse worden gedaan met de studies die alleen patiënten met een instabiele fractuur includeerden. Er waren acht studies in de Cochrane die alleen patiënten met instabiele fracturen includeerden (Papasimos, 2005; Harrington, 2002; Barton, 2010; Verettas, 2010; Miedel, 2005; Pelet, 2001; Lee, 2007; Ekstrom, 2007). Daarnaast includeerde de RCT van Xu ook alleen instabiele fracturen (Xu, 2010).
Mortaliteit
Alle fracturen 31-A.1, 31-A.2, 31- A.3
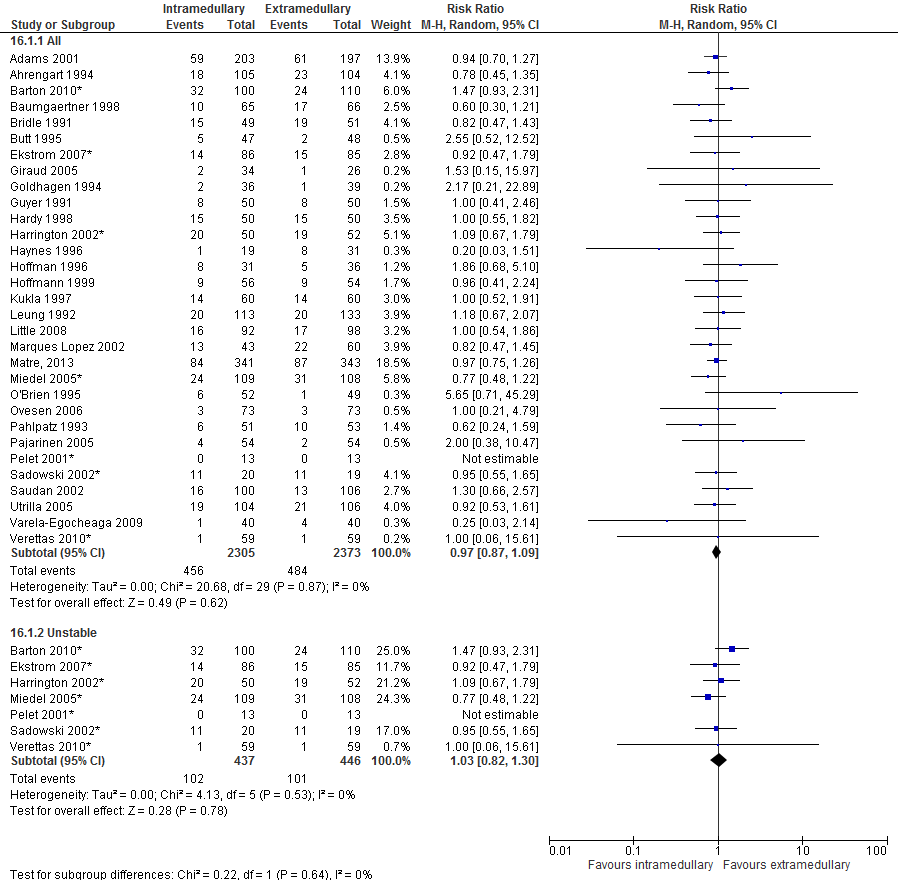
In totaal rapporteerden 31 studies (4678 patiënten) mortaliteit. De gepoolde resultaten (figuur 1) van alle studies laten geen significant verschil zien in mortaliteit na intra- of extramedullaire implantaten (456 van 2305 patiënten versus 484 van 2373 patiënten, RR 0,97 [0,87, 1,09]).
Instabiele fracturen 31-A.2, 31- A.3.
Zeven studies (883 patiënten) rapporteerden de mortaliteit na intra- en extramedullaire implantaten bij patiënten met een instabiele fractuur. De gepoolde (figuur 1) resultaten laten geen significant verschil zien in het risico op overlijden na intra- of extramedullaire implantaten (102 van 437 patiënten versus 101 van 446 patiënten, RR 1,03 [0,82, 1,30]).
Bewijskracht
Na beoordeling middels de GRADE-methodiek is het niveau van de bewijskracht voor de uitkomstmaat ‘mortaliteit’ is bij zowel de stabiele als instabiele fractuur niet verlaagd. Er waren enkele beperkingen in opzet van sommige studies, maar gezien het grote aantal studies is het echter niet waarschijnlijk dat dit enige invloed heeft op de conclusie. Vanwege het studie design is de uitgangspositie van de bewijskracht ‘hoog’. De bewijskracht komt uit op ‘hoog’.
Figuur 1 Forest plot van vergelijking intramedullair vs. extramedullair implantaat, uitkomst: Mortaliteit (laatste follow up).
Peroperatieve iatrogene fractuur van het femur
(Intra)operatieve fractuur van de femur werd in de Cochrane review gedefinieerd als fracturen rond of onder het implantaat, maar exclusief vergruizing van het fractuurgebied. Er staat niet beschreven hoe deze uitkomstmaat in de verschillende studies werd beoordeeld.
Alle fracturen 31-A.1, 31-A.2, 31- A.3.
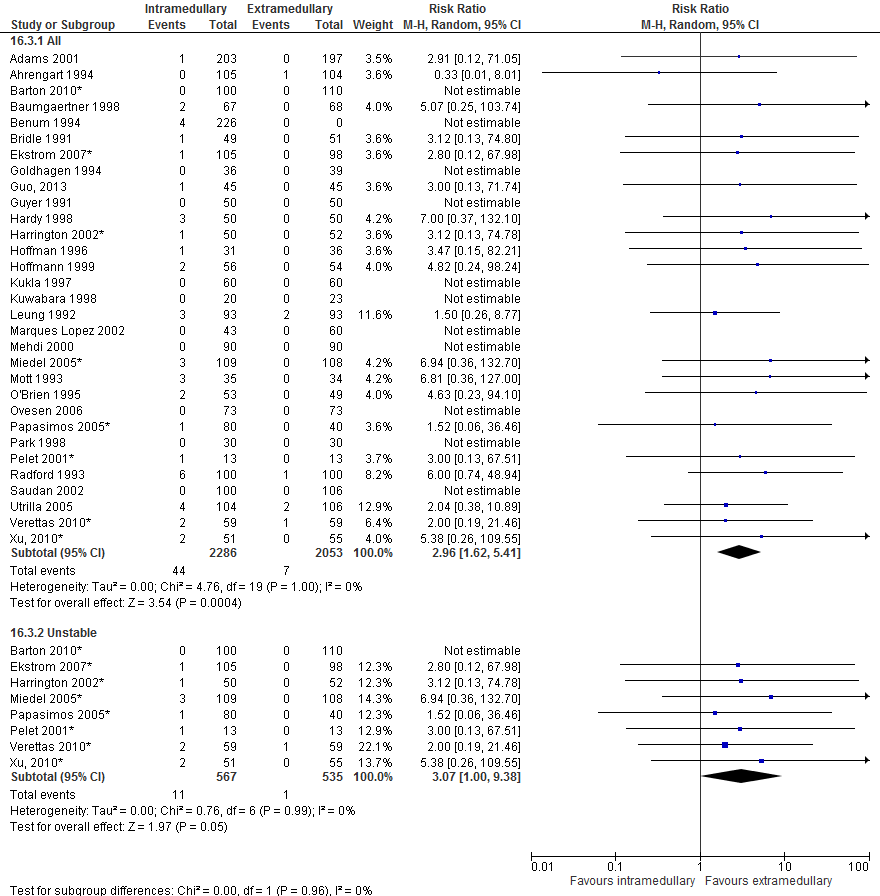
In totaal rapporteerden 31 studies (4339 patiënten) de uitkomstmaat peroperatieve iatrogene fractuur. De gepoolde resultaten (figuur 2) van alle studies laten een significant hoger risico zien met intramedullaire implantaten in vergelijking met extramedullaire implantaten (22 van 2286 patiënten versus zeven van 2053 patiënten, RR 2,96 [1,62 tot 5,41]).
Instabiele fracturen 31-A.2, 31- A.3.
In totaal rapporteerden acht studies (1102 patiënten) de uitkomstmaat peroperatieve iatrogene fractuur bij patiënten met een instabiele fractuur. De gepoolde resultaten (figuur 2) tonen een hoger risico op een iatrogene fractuur bij een intramedullair implantaat dan na een extramedullair implantaat (11 van 567 patiënten versus één van 535 patiënten, RR 3,07 [1,00 tot 9,38]). Dit verschil is echter niet statistisch significant.
Bewijskracht
De bewijskracht voor de uitkomstmaat ‘peroperatieve iatrogene fractuur’ is met één niveau verlaagd, gezien onduidelijkheden in de definitie van de uitkomstmaat, betrouwbaarheid van beoordeling van de uitkomstmaat en beperkingen in de studieopzet (ervaring chirurg met de beide implantaten kan van invloed zijn op de uitkomstmaat). Vanwege het studie design is de uitgangspositie van de bewijskracht ‘hoog’. De bewijskracht komt uit op ‘matig’.
Figuur 2 Forest plot van vergelijking intramedullair vs. extramedullair implantaat, uitkomst: intra-operatieve fractuur
Postoperatieve implantaat gerelateerde fractuur
Latere fractuur van het femur werd in de Cochrane review gedefinieerd als een postoperatieve implantaat gerelateerde fractuur rond of onder het implantaat. Er wordt niet beschreven hoe deze uitkomstmaat in de diverse studies werd beoordeeld.
In de studie van Martre wordt niet beschreven hoe postoperatieve fracturen werden beoordeeld. Er wordt echter wel vermeld: Five postoperative femoral fractures occurred in the INTERTAN-group, all during the first three months; one fracture was at the distal tip of a long nail, and the other fractures appeared around the tips of short nails. One fracture occurred through the distal screw hole in a four-hole sliding hip screw-plate (see Appendix).
Alle fracturen 31-A.1, 31-A.2, 31- A.3.
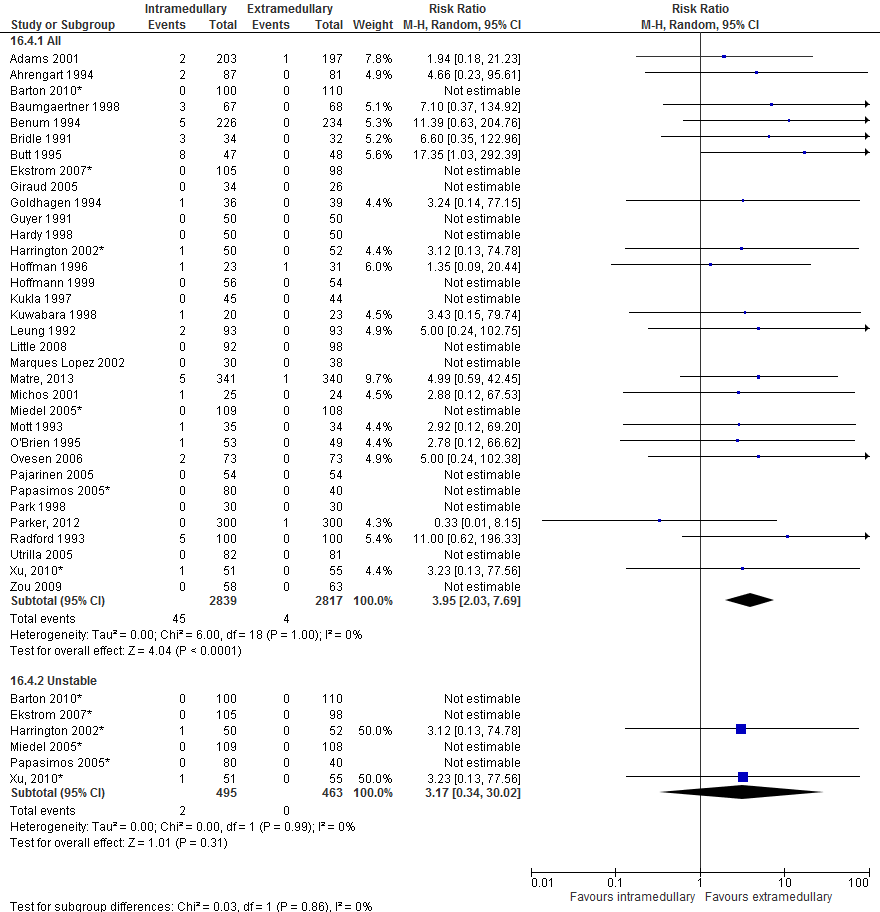
In totaal rapporteerden 34 studies (5656 patiënten) de uitkomstmaat postoperatieve (latere) fractuur. De gepoolde resultaten (figuur 3) van alle studies laten een significant hoger risico zien met intramedullaire implantaten in vergelijking met extramedullaire implantaten (56 van 2839 patiënten versus vier van 2817 patiënten, RR 3,95 [2,03 tot 7,69]).
Instabiele fracturen 31-A.2, 31- A.3.
In totaal rapporteerden zes studies (958 patiënten) de uitkomstmaat postoperatieve (latere) fractuur bij patiënten met een instabiele fractuur. De gepoolde resultaten (figuur 3) tonen geen significant hoger risico na intramedullaire implantaten dan na extramedullaire implantaten (twee van 495 patiënten versus nul van 463 patiënten, RR 3,17 [0,34 tot 30,02], I2=0%).
Bewijskracht
De bewijskracht voor de uitkomstmaat ‘postoperatieve implantaat gerelateerde fractuur’ is voor de stabiele fracturen met één niveau verlaagd, gezien imprecisie (weinig casus). Er waren ook enkele beperkingen in de studie opzet (ervaring chirurg), maar gezien de beperkte kans op bias ten aanzien van deze uitkomstmaat wordt hiervoor niet extra voor afgewaardeerd. Vanwege het studie design is de uitgangspositie van de bewijskracht ‘hoog’. De bewijskracht komt uit op ‘matig’. De bewijskracht voor de instabiele fracturen is met twee niveaus verlaagd in verband met imprecisie (weinig casus, betrouwbaarheidsinterval omvat zowel een mogelijk positief als negatief effect). De bewijskracht voor de instabiele fracturen komt uit op ‘laag’.
Figuur 3 Forest plot van vergelijking intramedullair vs. extramedullair implantaat, uitkomst: postoperatieve fractuur
Heroperatie
Maar weinig studies rapporteren binnen welke termijn een heroperatie plaatsvond, in een aantal studies wordt gemeld het gaat om heroperaties binnen een jaar. De definitie van heroperatie verschilde per studie en omvat een variatie aan ingrepen.
Alle fracturen 31-A.1, 31-A.2, 31-A.3.
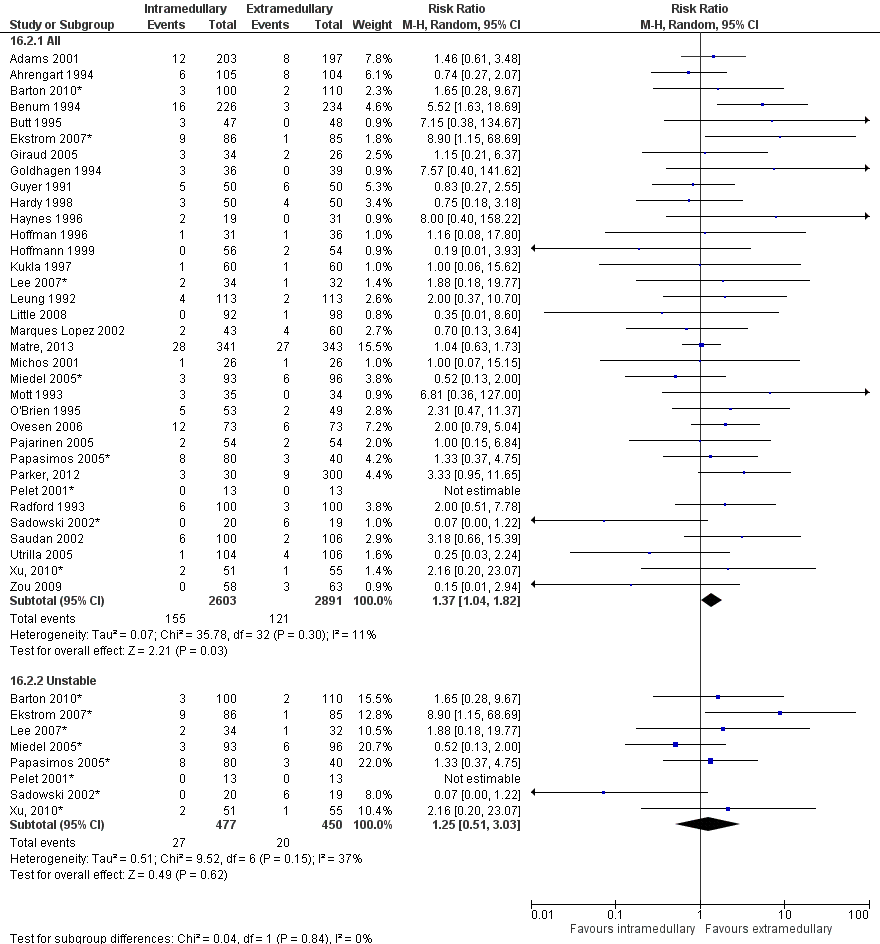
In totaal rapporteerden 34 studies (5494 patiënten) de uitkomstmaat heroperatie. De gepoolde resultaten (figuur 4) van alle studies laten een significant hoger risico zien voor intramedullaire implantaten in vergelijking met extramedullaire implantaten (155 van 2603 patiënten versus 121 van 2891 patiënten, RR 1,37 [1,04, 1,82], I2=11%).
Instabiele fracturen 31-A.2, 31- A.3.
In totaal rapporteerden negen studies (967 patiënten) de uitkomstmaat heroperatie bij patiënten met een instabiele fractuur. De gepoolde resultaten (figuur 4) tonen geen significant hoger risico na intramedullaire implantaten dan na extramedullaire implantaten (27 van 477 patiënten versus 20 van 450 patiënten, RR 1,25 [0,51 tot 3,03], I2=37%).
Bewijskracht
De bewijskracht voor de uitkomstmaat ‘heroperatie’ is voor de stabiele fracturen niet verlaagd. Er is sprake van heterogeniteit (I2=17%, p=0,17), maar deze is niet significant. Daarnaast zijn er voldoende casus. Vanwege het studie design is de uitgangspositie van de bewijskracht ‘hoog’, de bewijskracht komt uit op ‘hoog’. De bewijskracht voor de instabiele fracturen is met twee niveaus verlaagd in verband met imprecisie (weinig casus, breed betrouwbaarheidsinterval) en heterogeniteit (I2=46%, p=0,08) van de resultaten De bewijskracht voor de instabiele fracturen komt uit op ‘laag’.
Figuur 4 Forest plot van vergelijking intramedullair vs. extramedullair implantaat, uitkomst: heroperatie
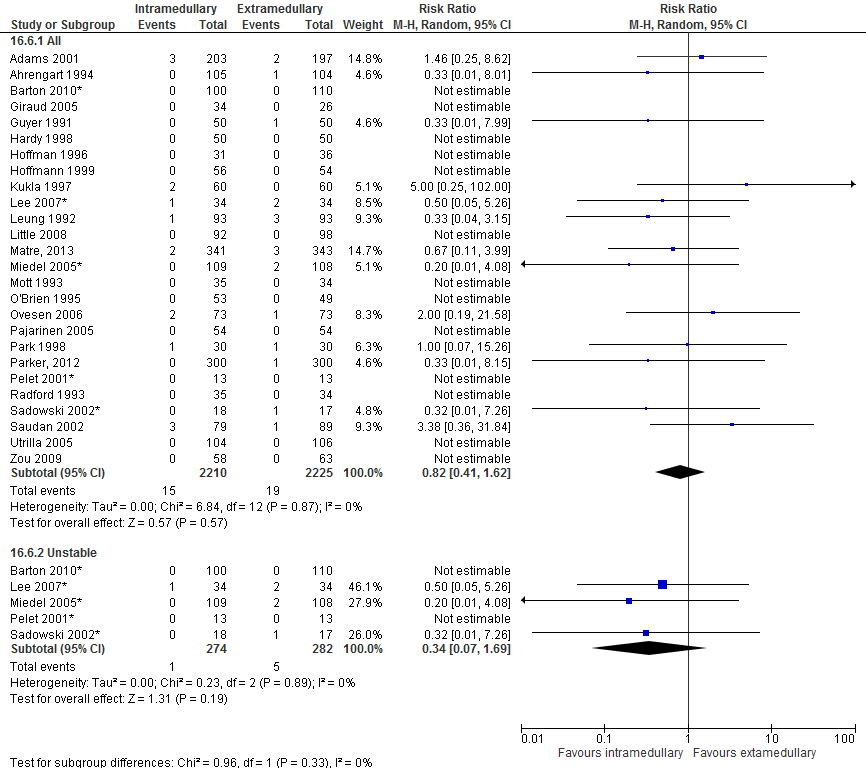
Diepe wondinfectie
Alle fracturen 31-A.1, 31-A.2, 31-A.3.
In totaal rapporteerden 26 studies (4435 patiënten) de uitkomstmaat diepe wondinfectie. De uitkomsten “wondinfectie” en diepe wondinfectie zijn meegenomen, echter wanneer expliciet werd gesproken van oppervlakkige wondinfectie zijn de resultaten niet meegenomen in deze analyse. De gepoolde resultaten (figuur 5) van alle studies laten geen significant hoger risico zien met intramedullaire implantaten in vergelijking met extramedullaire implantaten (15 van 2210 patiënten versus 19 van 2225 patiënten, RR 0,82 [0,41, 1,62], I2=0%).
Instabiele fracturen 31-A.2, 31-A.3.
In totaal rapporteerden vijf studies (556 patiënten) de uitkomstmaat diepe wondinfectie bij patiënten met een instabiele fractuur. De gepoolde resultaten (figuur 5) tonen geen significant hoger risico na intramedullaire implantaten dan na extramedullaire implantaten (één van 274 patiënten versus vijf van 282 patiënten, RR 0,34 [0,07 tot 1,69], I2=0%).
Bewijskracht
De bewijskracht voor de uitkomstmaat ‘diepe wondinfectie’ is voor de stabiele fracturen met één niveau verlaagd in verband met imprecisie (weinig casus en breed betrouwbaarheidsinterval). Vanwege het studie design is de uitgangspositie van de bewijskracht ‘hoog’, de bewijskracht komt uit op ‘matig’. De bewijskracht voor de instabiele fracturen is met twee niveaus verlaagd in verband met imprecisie (zeer weinig casus). De bewijskracht voor de instabiele fracturen komt uit op ‘laag’.
Figuur 5 Forest plot van vergelijking intramedullair vs. extramedullair implantaat, uitkomst: diepe wondinfectie
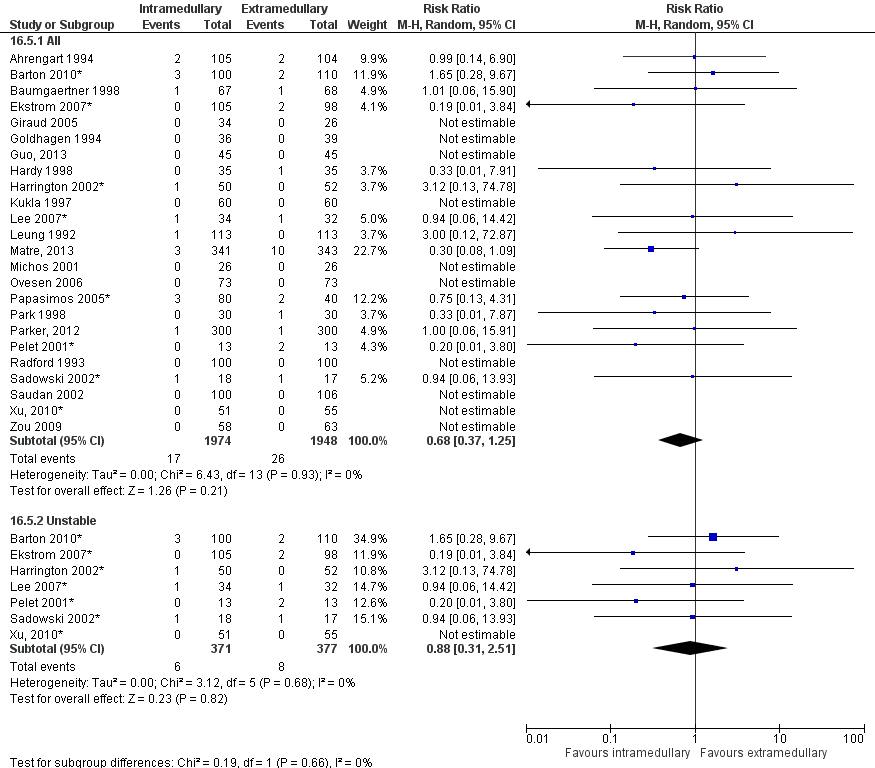
Nonunion
Alle fracturen 31-A.1, 31-A.2, 31-A.3.
In totaal rapporteerden 24 studies (3922 patiënten) de uitkomstmaat nonunion. De gepoolde resultaten (figuur 6) van alle studies laten geen significant verschillend risico zien met intramedullaire implantaten in vergelijking met extramedullaire implantaten (17 van 1974 patiënten versus 26 van 1948 patiënten, RR 0,68 [0,37, 1,25], I2=0%).
Instabiele fracturen 31-A.2, 31-A.3.
In totaal rapporteerden zeven studies (748 patiënten) de uitkomstmaat nonunion bij patiënten met een instabiele fractuur. De gepoolde resultaten (figuur 6) tonen geen significant hoger risico na intramedullaire implantaten dan na extramedullaire implantaten (zes van 371 patiënten versus acht van 377 patiënten, RR 0,88 [0,31 tot 2,51]).
Bewijskracht
De bewijskracht voor de uitkomstmaat ‘nonunion’ is voor de stabiele fracturen met één niveau verlaagd in verband met imprecisie (weinig casus). Vanwege het studie design is de uitgangspositie van de bewijskracht ‘hoog’, de bewijskracht komt uit op ‘matig’. De bewijskracht voor de instabiele fracturen is met twee niveaus verlaagd in verband met imprecisie (zeer weinig casus). De bewijskracht voor de instabiele fracturen komt uit op ‘laag’.
Figuur 6 Forest plot van vergelijking intramedullair vs. extramedullair implantaat, uitkomst: nonunion
Mobiliteit
De meetmethode en manier van rapporteren van mobiliteit varieert tussen studies. Grofweg kan men onderscheid maken tussen rapportage van het aantal mensen dat zelfstandig kan lopen, loopondersteuning nodig heeft, of die bed of stoel gebonden zijn. Waar gerapporteerd, was pre-fractuur mobiliteit vergelijkbaar tussen de implantaatgroepen, met uitzondering van de studie van Hoffman, waar de pre-fractuur status beter was in de extramedullaire implantaatgroep.
Alle fracturen 31-A.1, 31-A.2, 31-A.3.
Elf van de studies die in de Cochrane review worden beschreven, vonden geen verschil in postoperatieve mobiliteit of veranderingen in mobiliteit tussen intramedullair en een extramedullair implantaat (Ahrengart, 1994; Benum, 1994; Bridle, 1991; Goldhagen, 1994; Kukla, 1997; Kuwabara, 1998; Marques Lopez, 2002; O’Brien, 1995; Ovesen, 2006; Radford, 1993; Utrilla, 2005). In de studie van Hoffman, de enige studie waar de beoordeling van mobiliteit geblindeerd werd gemeten, was de mobiliteit beter in de GHS groep in de eerste periode na de operatie (pre-fractuur was de mobiliteit in deze groep echter ook hoger). Na 12 weken was er geen verschil meer. De studie van Adams vond geen verschil tussen de groepen in de Harris Hip Score na een jaar (Adams, 2001). In de studie van Papasimos was de Salvati and Wilson score (gebaseerd op pijn, loopvaardigheid, spierkracht, beweging, functie (0 slechtst tot 40 best)) na een jaar beter in de interventie (intramedullair implantaat) groep (gemiddeld 33 versus 27, p waarde niet gerapporteerd).
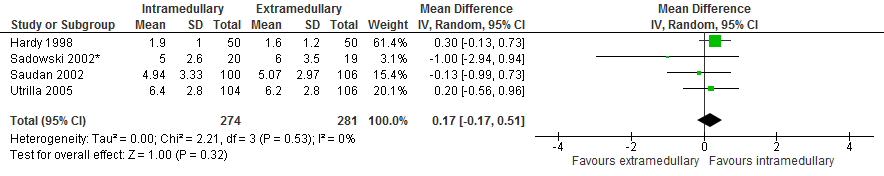
De Palmer-Parker score wordt in vier studies gerapporteerd, meta-analyse (figuur 7) toont geen verschil in de score tussen de twee groepen (mean diff 0,17 [-0,17, 0,51]).
Figuur 7 Forest plot van vergelijking intramedullair vs. extramedullair implantaat, uitkomst: mobiliteit
In de studies die na het verschijnen van de Cochrane review zijn gepubliceerd wordt de mobiliteit ook gerapporteerd. In de studie van Guo wordt de mobiliteit gemeten aan de hand van de walking ability score. Er werd geen significant verschil gevonden tussen de interventie en controlegroep (6,7±2,8 vs. 6,9±1,5, p=0,67) (Guo, 2013). In de studie van Matre wordt mobiliteit gemeten aan de hand van de timed up&go test. Zowel postoperatief (74 (n=132) vs. 69 (n=126), Mean diff: 5,1 (-3,5 tot 14,3), p=0,20), na drie maanden (29 (n=132) vs. 29 (n=126), Mean diff: 0,04 (-4,3 tot 4,4) P=0,99), als na 12 maanden (27 (n=154) vs. 25 (n=160) mean diff: 1,3 (-3,6 to 6,2), p=0,60) werden er geen verschillen gevonden tussen de groepen (Matre, 2013). De studie van Parker vond vergelijkbare resultaten (geen getallen gegeven): “patiënten behandeld met GHS hadden een slechtere mobiliteit op ieder meetpunt, dat statistisch significant werd na negen maanden en een jaar” (Parker, 2012). In de studie van Xu werd wel een verschil gevonden in mobiliteit (herstel van loopvaardigheid tot peroperatieve status): patiënten met een intramedullair implantaat bereikten na drie maanden (19/48 (39,6%) vs. 8/50 (16,0%), p=0.009) en 1 jaar (27/40 (67,5%) vs. 19/43 (44,2%), p=0,033) vaker de peroperatieve loopvaardigheid dan patiënten met extramedullair implantaat (Xu, 2010).
Instabiele fracturen 31-A.2, 31- A.3.
Er waren twee studies die de mobiliteit voor patiënten met een instabiele fractuur rapporteerden (Sadowski, 2002; Xu, 2010). Deze resultaten zijn niet geschikt om te poolen. In de studie van Sadowski was de Parker Palmer score na een intramedullair implantaat gemiddeld 5±2.6 (n=2) in vergelijking met 6±3.5 na een extramedullair implantaat, dit verschil was niet statistisch significant. In de studie van Xu (hierboven beschreven) was de mobiliteit beter met een intramedullair implantaat dan met een extramedullair implantaat.
Bewijskracht
De bewijskracht voor de uitkomstmaat ‘mobiliteit’ is voor de stabiele fracturen met één niveau verlaagd, gezien beperkingen in de studie opzet (geen blindering en subjectieve uitkomstmaat is gevoelig voor bias, en wisselende methode van meten en rapportage). Vanwege het studie design is de uitgangspositie van de bewijskracht ‘hoog’, de bewijskracht komt uit op ‘matig’. De bewijskracht voor de instabiele fracturen is met twee niveaus verlaagd in verband met imprecisie gezien dezelfde beperkingen in studie opzet, laag aantal patiënten (imprecisie) en tegenstrijdige resultaten van de twee studies (inconsistentie). De bewijskracht voor de instabiele fracturen komt uit op ‘laag’.
Pijn
In de meta-analyse zijn alleen studies meegenomen die pijn dichotoom rapporteerden. Omdat er ten opzichte van de Cochrane review geen nieuwe studies zijn gevonden die pijn dichotoom rapporteren is de meta-analyse van de Cochrane review overgenomen.
Alle fracturen 31-A.1, 31-A.2, 31-A.3.
Er waren 10 studies (1013 patiënten) die pijn als dichotome uitkomstmaat rapporteerden. De gepoolde resultaten (figuur 8) tonen geen verschil tussen patiënten met een intramedullair of extramedullair implantaat (RR 1,10 [0,93 tot 1,30]).
Figuur 8 Forest plot van vergelijking intramedullair vs. extramedullair implantaat, uitkomst: pijn
Instabiele fracturen 31-A.2, 31- A.3
Er was een studie met in totaal 26 patiënten met instabiele fracturen die pijn als dichotome uitkomstmaat rapporteerde (Pelet, 2001). Er was geen significant verschil tussen de groepen (RR 0,60 [0,18 tot 2,01]. In de studie van Xu werd pijn gemeten aan de hand van de Charnley schaal (1=geen pijn, 6=constante ernstige pijn). Na één jaar was de gemiddelde score met een intramedullair implantaat 1,6 (range 1 tot 6) versus 1,8 (range 1 tot 6) met een extramedullair implantaat. Ook de VAS score na zes weken in deze studie was niet significant verschillend tussen de twee implantaten (2,7 (1 tot 8) vs. 2,9 (1 tot 8), p=0,3) (Xu, 2010).
Bewijskracht
De bewijskracht voor de uitkomstmaat ‘mobiliteit’ is voor de stabiele fracturen met één niveau verlaagd, gezien beperkingen in de studie opzet (geen blindering, en wisselende methode van meten en rapportage). Vanwege het studie design is de uitgangspositie van de bewijskracht ‘hoog’, de bewijskracht komt uit op ‘matig’. De bewijskracht voor de instabiele fracturen is met twee niveaus verlaagd in verband met imprecisie gezien dezelfde beperkingen in studie opzet en een laag aantal patiënten (imprecisie). De bewijskracht voor de instabiele fracturen komt uit op ‘laag’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is een systematische literatuuranalyse verricht naar de volgende vraagstelling:
Wat is de effectiviteit van intramedullaire proximale femurpennen (Engels: cephalocondylic nails) vergeleken met extramedullaire implantaten voor de behandeling van pertrochantere fractuur bij volwassenen?
Relevante uitkomstmaten
De werkgroep achtte iatrogene fracturen, diepe wondinfecties, heroperaties, non-union en mortaliteit, voor de besluitvorming kritieke uitkomstmaten. De mechanische stabiliteit, ADL-onafhankelijkheid, mate van invaliditeit en terugkeer naar de leefomgeving voor de fractuur, vond de werkgroep voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet à priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
De huidige literatuuranalyse is een update van de Cochrane review (Parker, 2010), welke is beoordeeld middels GRADE. De zoektermen van het Cochrane review waarin verschillende intramedullaire en extramedullaire opties vergeleken zijn, werden overgenomen. Er is gezocht naar studies die verschenen na de zoekdatum in de Cochrane review (2010) en in de databases Medline (OVID), Embase en Cochrane naar RCTs en quasi-gerandomiseerde studies in het Engels. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Twee studies met implantaten die niet (meer) commercieel verkrijgbaar zijn in Nederland, zouden uit het bestaande Cochrane review geëxcludeerd worden (Dujardin 2001: mini-invasive static intramedullary nail versus GHS. Davis 1988: Küntscher-Y nail zonder distale vergrendeling versus GHS).
Deze zoekactie leverde 609 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerde of quasi-gerandomiseerde (bijvoorbeeld alternatie-) trials waarin intramedullaire implantaten worden vergeleken met extramedullaire implantaten bij volwassen patiënten met een stabiele of instabiele, extracapsulaire proximale femurfractuur waarbij ten minste een van de benoemde uitkomstmaten werd gehanteerd. Verder werden alleen studies geselecteerd met een minimale follow-up duur van zes maanden.
Op basis van titel en abstract werden in eerste instantie 18 studies voorgeselecteerd. Daarvan werden na raadpleging van de volledige tekst dertien studies geëxcludeerd (zie exclusietabel). Uiteindelijk bleven vijf studies, verschenen na april 2010 over voor definitieve beoordeling.
Resultaten
In totaal zijn de 41 studies uit de Cochrane review (Parker, 2010; 43 studies minus de twee naar interventies die niet relevant zijn voor de huidige Nederlandse situatie) aangevuld met de 5 meer recente RCTs meegenomen in de literatuuranalyse en meta-analyse. De evidence tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in onder het tabblad Onderbouwing vinden.
Waar mogelijk zijn de resultaten van de studies gepoold met random effecten model. Voor dichotome uitkomstmaten wordt de risk ratio (RR) met 95%-betrouwbaarheidsinterval gerapporteerd en voor continue uitkomstmaten de mean difference (MD) met 95%-betrouwbaarheidsintervallen.
Referenties
- Barton TM, Gleeson R, Topliss C, et al. A comparison of the long gamma nail with the sliding hip screw for the treatment of AO/OTA 31-A2 fractures of the proximal part of the femur: a prospective randomized trial. J Bone Joint Surg Am. 2010;92(4):792-8.
- Ekström W, Karlsson-Thur C, Larsson S, et al. Functional outcome in treatment of unstable trochanteric and subtrochanteric fractures with the proximal femoral nail and the Medoff sliding plate. J Orthop Trauma. 2007;21(1):18-25.
- Guo Q, Shen Y, Zong Z, et al. Percutaneous compression plate versus proximal femoral nail anti-rotation in treating elderly patients with intertrochanteric fractures: a prospective randomized study. J Orthop Sci. 2013;18(6):977-86.
- Haq RU, Manhas V, Pankaj A, et al. Proximal femoral nails compared with reverse distal femoral locking plates in intertrochanteric fractures with a compromised lateral wall; a randomised controlled trial. Int Orthop. 2014;38(7):1443-9.
- Harrington P, Nihal A, Singhania AK, et al. Intramedullary hip screw versus sliding hip screw for unstable intertrochanteric femoral fractures in the elderly. Injury. 2002;33(1):23-8.
- Matre K, Vinje T, Havelin LI, et al. TRIGEN INTERTAN intramedullary nail versus sliding hip screw: a prospective, randomized multicenter study on pain, function, and complications in 684 patients with an intertrochanteric or subtrochanteric fracture and one year of follow-up. J Bone Joint Surg Am. 2013;95(3):200-8.
- Miedel R, Ponzer S, Törnkvist H, et al. The standard Gamma nail or the Medoff sliding plate for unstable trochanteric and subtrochanteric fractures. A randomised, controlled trial. J Bone Joint Surg Br. 2005;87(1):68-75.
- Papasimos S, Koutsojannis CM, Panagopoulos A, et al. A randomised comparison of AMBI, TGN and PFN for treatment of unstable trochanteric fractures. Arch Orthop Trauma Surg. 2005;125(7):462-8.
- Parker MJ, Bowers TR, Pryor GA. Sliding hip screw versus the Targon PF nail in the treatment of trochanteric fractures of the hip: a randomised trial of 600 fractures. J Bone Joint Surg Br. 2012;94(3):391-7.
- Pelet S, Arlettaz Y, Chevalley F. [Osteosynthesis of per- and subtrochanteric fractures by blade plate versus gamma nail. A randomized prospective study]. Swiss Surg. 2001;7(3):126-33.
- Sadowski C, Lübbeke A, Saudan M, et al. Treatment of reverse oblique and transverse intertrochanteric fractures with use of an intramedullary nail or a 95 degrees screw-plate: a prospective, randomized study. J Bone Joint Surg Am. 2002;84-A(3):372-81.
- Verettas DA, Ifantidis P, Chatzipapas CN, et al. Systematic effects of surgical treatment of hip fractures: gliding screw-plating vs intramedullary nailing. Injury. 2010 Mar;41(3):279-84.
- Xu YZ, Geng DC, Mao HQ, et al. A comparison of the proximal femoral nail antirotation device and dynamic hip screw in the treatment of unstable pertrochanteric fracture. J Int Med Res. 2010;38(4):1266-75.
Evidence tabellen
SR Parker, 2010
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Parker, 2010
individual study characteristics deduced from Parker, 2010
|
SR and meta-analysis of RCTs.
Literature search up to April 2010
A: Adams 2001 B:Ahrengart 1994 C: Benum 1994 D: Bridle 1991 E: Butt 1995 F: Goldhagen 1994 G: Guyer 1991 H: Haynes 1996 I: Hoffman 1996 J: Kukla 1997 K: Kuwabara 1998 L: Leung 1992 M: Marques Lopez 2002 N: Michos 2001 O: Mott 1993 P: O’Brien 1995 Q: Ovesen 2006 R: Pahlpatz 1993 S: Papasimos 2005 T: Park 1998 U: Radford 1993 V: Utrilla 2005
W: Baumgaertner 1998 X: Hardy 1998 Y: Harrington 2002 Z: Hoffmann 1999 A2: Mehdi 2000
B2: Pajarinen 2005 C2: Papasimos 2005 D2: Saudan 2002
E2: Zou 2009
F2: Giraud 2005
G2: Little 2008
H2: Barton, 2010
I2: Dujardin 2001
J2: Davis 1988
K2: Verettas 2010 L2: Miedel 2005 M2: Varela-Egocheaga 2009 N2: Pelet 2001 O2: Lee 2007
P2: Ekstrom 2007
Study design: RCT
Source of funding: [commercial / non-commercial / industrial co-authorship]
|
Inclusion criteria SR: comparison of intramedullary nail with extramedullary fixation implant, skeletally mature adults with extracapsular proximal femoral fracture whether stable or unstable
Exclusion criteria SR: follow-up < 6 months
43 studies included
Important patient characteristics at baseline: Type of fracture: Trochanteric, unless stated otherwise: B: subtrochanteric & trochanteric C: subtrochanteric & trochanteric E: subtrochanteric & trochanteric F: subtrochanteric & trochanteric G: subtrochanteric & trochanteric H N: subtrochanteric & trochanteric O: subtrochanteric & trochanteric S: Unstable trochanteric proximal femoral fracture Y: Unstable trochanteric proximal femoral fractures. A2: Extracapsular proximal femoral fractures D2: Trochanteric proximal femoral fractures, types A1 and A2 H2: Unstable trochanteric proximal femoral fractures K2: Unstable trochanteric proximal femoral fractures L2: Unstable trochanteric and subtrochanteric proximal femoral fractures. N2: classified by the systemof Kyle as type IV.These are equivalent to type A3 (AO classification): reversed and transverse fracture lines at the level of the lesser trochanter. O2:Subtrochanteric proximal femoral fractures (all unstable fracture pattern with comminution, Seinsheimer classification type III, IV and V) P2: Unstable intertrochanteric proximal femoral fractures (172) and subtrochanteric fractures (31).
See study details in Cochrane review. |
A to V: Gamma Nail W to A2: IMHS B2 to D2: PFN E2: PFNA F2: Targon PF G2: Long Holland nail H2: Long Gamma Nail I2: mini-invasive static intramedullary nail J2: Kutschner Y nail K2:Intramedullary nail (2 types) L2: Intramedullary nails (various types) M2: Gamma nail N2: Intramedullary nails O2: intramedullary nails
|
A to V: SHS W to A2: SHS B2 to D2: SHS E2: SHS F2: SHS G2: SHS H2: SHS I2: SHS J2: SHS K2: SHS L2: Medoff sliding plate M2: PCCP N2: fixed (static) extramedullary plates O2: fixed (static) extramedullary plates
|
Not described
|
N/A
|
Risk of bias assessment included in the review, based on three aspects: Sequence generation Allocation concealment Surgeons experience surgical technique.
Dujardin 2001 and Davis 1988 are excluded from the meta-analysis intramedullary vs. extramedullary.
|
Additional studies
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) = intramedullary |
Comparison / control (C) 3 = extramedullary
|
Follow-up |
Outcome measures and effect size 4 postoperative complications, wound infection: reoperation (<60 days) mortality mobility at discharge functioning daily life dependence: invalidity mechanical stability pain function participation operative fracture of femur |
Comments |
|
Guo, 2013 |
Type of study: RCT
Setting: Hospital
Country: China
Source of funding: none. |
Inclusion criteria: >60 years, intertrochanteric fractures type 31A1 and 31A2 (OTA classification), ASA score I-!V.
Exclusion criteria: subtrochantric fractures (31A3), existing or previous fractures in the same or contralateral hip, injuries that could affect the outcome measures, abnormalities that could affect the outcome measures.
N total at baseline: 90 Intervention: 45 Control: 45
Important prognostic factors2: age ± SD: I: 74.2±8.8 C: 71.6±7.5, p=0.1350
Sex: I: 52% M C: 36% M, p=0.67
OTA classification: I: 49 % 31A1 C: 40% 31A1 P=0.52
Fracture type: I: 40% stable C: 51% stable P=0.40
Groups comparable at baseline? Yes |
PFNA (Synthes Inc, USA) insterted using percutaneous technique.
Regional anaesthesia. Preoperative antibiotics IV. Patients were encourages to exercise hip, knee, ankle joints from the first day post-surgery. Full weight bearing with walking aid as soon as possible. Rivaroxaban for 5 weeks.
|
PCCP implant (Orthofix Orthopedics, Italy) inserted using percutaneous technique.
Regional anaesthesia. Preoperative antibiotics IV. Patients were encourages to exercise hip, knee, ankle joints from the first day post-surgery. Full weight bearing with walking aid as soon as possible. Rivaroxaban for 5 weeks.
|
Length of follow-up: Median: 16.9 months
Loss-to-follow-up: 0
Incomplete outcome data: 0
|
I vs. C
Postoperative complications: fat embolism syndrome: 2 vs. 0, p=0.49 femoral shaft fracture: 1 vs. 0, p=1.0 Hematoma: 1 vs. 0, p=1.0
superficial wound infection: 0 vs. 1, p=0.48
non-union 0 vs. 0
Hip pain: 7 (15.5%) vs. 4 (11.1%), p=0.76 Thigh pain 6 (13.3%) vs. 4 (8.9%), p=0.74
Mobility (walking ability score) 6.7±2.8 vs. 6.9±1.5, p=0.67
Not reported: functioning daily life, dependance, invalidity, mechanical stability, function participation, operative fracture of femur, mortality, reoperation (<60 days)
|
All operations were performed by expert surgeons who had equal levels of experience with PCCP and PFNA.
Significant differences were seen in: operation time (I>C), intraoperative blood loss (I>C). perioperative blood loss (I>C) |
|
Matre, 2013 |
Type of study: RCT
Setting: Multi-centre
Country: Norway
Source of funding: supported by manufacturer of Intertan |
Inclusion criteria: >60 years, trochanteric or subtrochanteric fracture.
Exclusion criteria: pathologic fracture.
N total at baseline: 684 Intervention: 341 Control: 343
Important prognostic factors2: age ± SD: I: 84.1 C: 84.1 P=0.98
Sex: I: 83 (24.3%) M C: 88 (25.7%) M P=0.69
ASA Class 1: 6.6% vs. 4.5% 2: 41.2% vs. 42.7% 3: 49.0% vs. 48.4% 4: 3.3% vs. 4.5%
Fracture OTA type: A1: 43.0% vs. 40.8% A2: 33.1% vs. 35.6% A3: 20.8% vs. 19.8% Subtroch: 2.1% vs. 3.8% P=0.22
Groups comparable at baseline? Yes
|
Intertan
|
SHS (Compression Hip Screw, Dynamic Hip screw).
A trochanteric stabilizing plate, was used when indicated.
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 53 (15.5%) Reasons:
Control: 54 (15.7%) Reasons:
Incomplete outcome data: Intervention: 84 (24.6%) Reasons : deceased
Control: 87 (25.4%) Reasons : deceased
|
I vs. C
Mobility (timed up&go test): Postoperative: 74 (n=132) vs. 69 (n=126) Mean diff: 5.1 (-3.5 to 14.3), p=0.20
3 months: 29 (n=132) vs. 29 (n=126) Mean diff: 0.04 (-4.3 to 4.4) P=0.99
12 months: 27 (n=154) vs. 25 (n=160) mean diff: 1.3 (-3.6 to 6.2), p=0.60
Pain (mean VAS score (0-100):
At postoperative immobilization: 48 vs. 52 Mean diff: -3.7 (-7.4 to 0.04) P=0.042
3 months: 25 vs. 25 Mean diff: -0.5 (-4.6 to 3.6) P=0.82
Pain 12 months: VAS 17 vs. 17 Mean diff: 0.05 (-4.0 to 4.1) p=0.98
Postoperative complications postoperative fracture of femur: 5 vs. 1, p=0.10 cutouts of implants: 13 vs. 11, p=0.67 postoperative femoral neck-shaft angle: 131° vs. 138°, p<0.001 non-union: 3 vs 10 infection: 2 vs. 3
Reoperation (at 12 months days): 28 (8.2%) vs. 27 (7.9%), p=0.87
Mortality(1 year): 24.6% vs. 25.4%, p=0.83
Not reported: functioning daily life dependence: mechanical stability |
Surgeon experience: the surgeons participated in at least 5 operations involving INTERTAN nail before participating in the study.
Data not provided, stated: “we found no significant difference in the HHS or QOL scores (EQ5D). these results were also reflected by similar rates of patients regaining their prefracture mobility and residential status.
Intraoperative technical or implant related problems: occurred more in Intertan group (62 (19%) of 328 vs. 21 (7%) of 315, p<0.001). however the majority were minor complications without consequence for the patients. |
|
Xu, 2010 |
Type of study: RCT
Setting: Hospital
Country: China
Source of funding: None |
Inclusion criteria: Unstable proximal femoral fracture (AO cat 31A2)
Exclusion criteria: <65 years, pathological fractures, fractures associated with polytrauma, previous surgery on the ipsilateral hip or femur, inability to work before the injury and severe concomitant medical condition (ASA≥V)
N total at baseline: 106 Intervention: 51 Control: 55
Important prognostic factors2: age ± SD: I: 78.5±7.97 C: 77.9±7.82 NS
Sex: I: 16 (31.4%) M C: 16 (29.1%) M NS
ASA score: 1: 23.5% vs. 25.5% 2: 43.1% vs. 38.2% 3: 19.6% vs. 20.0%) 4: 13.7% vs. 16.4% NS
Groups comparable at baseline? Yes
|
PFNA (standard protocol) with an open (n=9) or closed (n=42) approach.
Pre-operative IV of antibiotic (ceftriaxone). General or spinal anaesthesia. After operation: suction tdrains for 24-48h, prophylactic antibiotics 3-5 days.
Encouraged to move hup, knee and ankle joints on first postoperative day. Full weight bearing as soon as possible.
|
DHS (standard protocol) with open approach (n=55).
Pre-operative IV of antibiotic (ceftriaxone). General or spinal anaesthesia. After operation: suction tdrains for 24-48h, prophylactic antibiotics 3-5 days.
Encouraged to move hup, knee and ankle joints on first postoperative day. Full weight bearing as soon as possible.
|
Length of follow-up: 12 months
Loss-to-follow-up: 3 months: I: 3 (5.9%) Reasons: 1 deceased, 2 lost C: 5 (9%): Reasons: 2 deceased, 2 lost, 1 excluded
1 year: I: (15.6%) Reasons: 2 deceased, 4 lost, 2 excluded
C: 7 (12.8%) Reasons: 3 deceased, 3 lost, 1 excluded
Lost: move to unknown location, refusal for further participation. Excluded: revision surgery
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Postoperative complications Femoral shaft fracture Intraoperative: 2 (3,9%) vs. 0 Postoperative: 1 (2.0%) vs. 0 Superficial wound infection: 1 (2.0%) vs. 3 (5.5%) Chest infection: 2 (4%) vs. 5 (9.1%) Decubital ulcer: 2 (4%) vs. 3 (5.5%) UTI: 4 (7.8%) vs. 9 (16.4%) Cerebral infarction: 1 (2%) vs. 0 Cut-out: 0 vs. 0 Non-union: 0 vs. 0
Mobility (recovery of walking ability to pre-operative status): 3 months: 19/48 (39.6%) vs. 8/50 (16.0%), p=0.009
1 year: 27/40 (67.5%) vs. 19/43 (44.2%), p=0.033
Mobility score at final follow up: 5.6±1.4 vs. 4.4±1.8, p<0.0001
Mean time to mobilization with a frame (days): 3.6±1.5 vs. 5.9±1.3, p<0.0001
Shortening of the femur(mean mm): 2.6±2.5 vs. 4.8±4.0, p=0.0041
Reoperation (<1 year) 2 vs. 1 Due to poor fracture reduction
Not reported: Mortality functioning daily life dependence: invalidity mechanical stability pain |
Surgeon experience: all operations were performed by surgeons who had performed at least three procedures with both PFNA and DHS.
However: The intra-operative femoral shaft fractures observed in the present study were related to an immature learning curve, and were treated successfully with the conservative method of delaying full weight-bearing for 6 – 8 weeks.
! patients who had revision operations were excluded from the study. |
|
Parker, 2012 |
Type of study: RCT
Setting: Hospital
Country: UK
Source of funding: internal: petersborough hospital hip fracture fund. |
Inclusion criteria: trochanteric fracture
Exclusion criteria: subtrochanteric fractures, trochanteric fractures with a subtrochanteric extension that required a plate longer than five holes to achieve satisfactory distal fixation of eight cortices, pathological fractures from tumour or localised bone weakness such as Paget’s disease of bone cysts, fractures previously treated surgically, fractures treated conservatively, senile dementia for whom permission of their next of kin was not obtained, significant arthritis of the hip who were to be treated with a total hip replacement (THR) and patients treated when the chief investigator (MJP) was not available to supervise the surgical procedure.
N total at baseline: 600 hips (in 598 participants) Intervention: 300 Control: 300
Important prognostic factors2: age (range): I: 81.4 (27-104) C: 82.4 (26-104)
Sex: I: 69 (23%) M C: 52 (17%) M
ASA score 1 or 2: I: 107 (36%) C: 99 (33%)
Stable trochanteric: I: 56 (19%) C: 48 (16%) Unstable: I: 207 (69%) C: 211 (70%)
Groups comparable at baseline? Yes
|
Targon PF fixation using minimally invasive techniques.
Mobilized as soon as possible without any restrictions on hip movements or weight bearing
|
SHS using minimally invasive techniques.
Mobilized as soon as possible without any restrictions on hip movements or weight bearing
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 2 (0.7%) Reasons (describe)
Control: 4 (1.3%) Reasons (describe)
Incomplete outcome data: Intervention: 83 27.7%) Reasons: deceased
Control: 81 (27%) Reasons: deceased
|
I vs. C
Postoperative complications: Superficial wound infection: 4 (1.3%)vs. 3 (1%), p=1.0 Deep wound infection: 0 vs. 1 (0.3%), p=1.0 Implant cut-out: 2 (0.7%) vs. 3 (1%), p=1.0 revision fixation or arthroplasty: 3 vs. 9, p=0.14 non-union 1 vs. 1 later fracture: 1 vs. 0
Mortality Kaplan Maier survival curve shows there is no statistically significant difference in mortality between the two groups at any time during the one year follow up period (no data).
Mobility “the patients treated with SHS had a lower mobility score at every interval, which became statistically significant at nine months and one year” (figure, nog data provided).
Dependence (number of patients who were living in same residence as before admittance) :
At discharge: 248 (83%) vs. 251 (84%), p=1.0 1 year: 174/212 (82%) vs. 178/213 (84%), p=1.0
Pain: Charnley scale (1=no pain, 6: constant and severe pain).
At 1 year: 1.6 (1 to 6) vs. 1.8 (1 to 6), NS.
VAS-score at 6 weeks: 2.7 (1 to 8) vs. 2.9 (1 to 8), p=0.3
Not reported: operative fracture of femur invalidity mechanical stability functioning daily life |
Surgeon experience: all operations being undertaken, or directly supervised by a single surgeon |
Risk of bias
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Guo, 2013 |
Not described |
Unlikely (sealed envelope) |
Unlikely (not described, however not likely to cause bias) |
Unclear (not described) |
Unclear (not described) |
Unlikely |
Unlikely (no loss to follow-up) |
Unlikely (patients treated according to randomisation). |
|
Matre, 2013 |
Block randomisation with varying block sizes. |
Unlikely (sealed, opaque, consecutively numbered envelopes |
Unlikely (not blinded, however not likely to cause bias) |
Unclear (not blinded) |
Unclear (not blinded) |
Unlikely |
Unlikely |
Unlikely (some people switched groups, but ITT analysis was performed). |
|
Xu, 201 |
Computer generated list |
Unlikely (consecutively numbered and sealed envelopes) |
Unlikely (not blinded, however not likely to cause bias) |
Unclear (not blinded) |
Unclear (not blinded) |
Unlikely |
Unlikely (some loss to follow-up, however comparable in both groups). |
Unlikely |
|
Parker, 2012 |
“envelopes were prepared by a person independent to the study” |
Sealed opaque numbered envelopes |
Unlikely (not blinded, however not likely to cause bias) |
Unclear (not blinded) |
Unlikely (blinded) |
Likely (no numbers, SD’s are given) |
Unlikely (some loss to follow-up, however comparable in both groups). |
Unlikely (ITT) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-11-2016
Beoordeeld op geldigheid : 01-11-2016
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2021 bepaalt het bestuur van de NVvH in overleg met de NOV of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVvH en de NOV zijn regiehouder van deze richtlijn en zijn de verantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft tijdens het ontwikkelproces op geen enkele wijze invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Reduceren van praktijkvariatie in de zorg rondom proximale femurfracturen.
Doelgroep
Zorgverleners die met de betreffende patiëntengroep in aanraking komen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met proximale femurfracturen te maken hebben. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dhr. dr. M.J. Heetveld, traumachirurg, werkzaam in het Kennemer Gasthuis, Haarlem, Nederlandse Vereniging voor Heelkunde, (voorzitter).
- Dhr. prof. dr. M.H.J. Verhofstad, traumachirurg, werkzaam in het Erasmus MC, Rotterdam, Nederlandse Vereniging voor Heelkunde.
- Dhr. dr. J.H. Hegeman, traumachirurg, werkzaam bij Ziekenhuisgroep Twente, Almelo-Hengelo, Nederlandse Vereniging voor Heelkunde.
- Dhr. drs. M. Holla, orthopedisch chirurg, werkzaam in het Radboudumc, Nijmegen, Nederlandse Orthopaedische Vereniging.
- Dhr. dr. J.B.A. van Mourik, orthopedisch chirurg, werkzaam in het Máxima Medisch Centrum, Veldhoven, Nederlandse Orthopaedische Vereniging.
- Mw. dr. M.C. Willems, klinisch geriater, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Klinische Geriatrie.
- Dhr. dr. T.J. Hoogeboom, fysiotherapeut, werkzaam in het Radboudumc, Nijmegen, Koninklijk Nederlands Genootschap voor Fysiotherapie.
- Dhr. dr. R. van Balen, specialist ouderengeneeskunde, werkzaam bij Laurens, Rotterdam, Verenso.
- Mw. E.C. Folbert MANP, verpleegkundig specialist, werkzaam bij Ziekenhuisgroep Twente, Almelo-Hengelo, Verpleegkundigen & Verzorgenden Nederland (V&VN).
- Mw. dr. M.C.O. van den Nieuwenhuyzen, anesthesioloog, werkzaam in het Ikazia ziekenhuis, Rotterdam, Nederlandse Vereniging voor Anesthesiologie.
- Mw. R. Lammers MSc, patiëntvertegenwoordiger, Patiëntenfederatie Nederland, Utrecht.
Met ondersteuning van:
- Mw. dr. M.A. Pols, senior-adviseur Kennisinstituut van Medisch Specialisten, Utrecht.
- Dhr. A.A. Lamberts MSc, junior-adviseur Kennisinstituut van Medisch Specialisten, Utrecht.
- Mw. M.E. Wessels MSc, literatuurspecialiste, Kennisinstituut van Medisch Specialisten, Utrecht.
Met dank aan:
- Mw. C.S. Scherphof MSc, patiëntvertegenwoordiger, Patiëntenfederatie Nederland, Utrecht.
Belangenverklaringen
De “Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf directe financiële (betrekking commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Folbert |
verpleegkundig specialist traumatologie |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Heetveld |
Plaatsvervangend opleider SEG |
penningmeester OTC Nederland sponsor betaalt alleen cursus (educatie) uren. Bestuursleden OTC participeren en educatie cursus. |
geen |
geen |
OTC Nederland Penningmeester |
FAITH trial - geen belang bij richtlijn |
geen |
geen |
|
Hegeman |
Chirurg-traumachirurg ziekenhuisgroep Twente (ZGT) |
vz stichting Netwerk v Geriatrische Traumalogie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
lezingen over traumatologische onderwerpen, geriatrische traumatologie en osteoporose waarvoor sprekervergoedingen worden ontvangen van de DePuy Synthes en Eli Lily in de afgelopen 2 jaar. De Stichting Netwerk voor Geriatrische traumatologie wordt ondersteund door DePuy Synthes dmv een educational grant |
|
Holla |
orthopedisch chirurg-traumatoloog Radboud MUC |
voorzitter OTC educatiecommissie Nederland |
geen |
geen |
geen |
geen |
Auteur van Holla's medische statusvoering en Holla's orthopaedic pocketcards. |
geen |
|
Hoogeboom |
postdoc aan MUMC+ |
Gastdocent Fysiotherapie |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lamberts |
Junior adviseur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lammers |
beleidsadviseur Patiëntenfederatie Nederland |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Pols |
Senior adviseur Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Balen |
specialist ouderengeneeskunde Laurens Rotterdam |
senior onderzoeker afdeling public health en eerste lijnsgeneeskunde LUMC, onbetaald |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van den Nieuwenhuyzen |
anesthesioloog ikazia ziekenhuis, opleider |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Mourik |
orthopedisch chirurg 50%.Hoofd zorggroep Klinische chemie, Apotheek en Radiologie 50%. |
bestuurslid STZ, onbetaald Spreker voor DePuySynthes: Medical Education voor operatiekamerpersoneel, Trauma Basis Principes (2016) (betaald), spreker voor de AO cursus Principes van Operatieve Fractuur Behandeling (2015) (betaald). |
geen |
geen |
geen |
geen |
geen |
geen |
|
Verhofstad |
hoogleraar traumachirurg erasmus MC |
onafhankelijk deskundige bij aansprakelijkheidsstellingen en rechtzaken (incidenteel betaald) |
geen |
geen |
beoogd voorzitter ongevalstichting Ned. Sept 2014. |
geen |
geen |
geen |
|
Willems |
klinisch geriater |
NVKG, voorzitter, vacatievergoeding |
geen |
geen |
NVKG, voorzitter |
geen |
expertise op het gebied van fractuurrisico en osteoporose bij ouderen. Geen specifieke producten die zich lenen voor vermarkting. |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afvaardiging van de Patiëntenfederatie Nederland zitting te laten nemen in de werkgroep. Tijdens de ontwikkelfase van de richtlijn heeft de Patiëntenfederatie Nederland interviews met patiënten gehouden, deze uitkomsten zijn meegenomen bij het schrijven van de richtlijntekst. Het verslag van deze interviews staat onder 'aanverwant'. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Zie ook het implementatieplan onder 'aanverwant'.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijn voor richtlijnen’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseurs de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende veldpartijen via de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (Schünemann; 2013).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
De GRADE-methodiek is door de Nederlandse werkgroep GRADE-NL (nog) niet vastgesteld voor dit type vraagstelling. De bewijskracht van de conclusie is bepaald volgens de EBRO-methode (Van Everdingen, 2004).
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, over schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in één of meerdere conclusie(s), waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals criteria die van invloed zijn op de aanbeveling, de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatoren
De werkgroep heeft besloten om niet specifiek voor deze richtlijn indicatoren te ontwikkelen. In het kader van de DHFA worden er al reeds indicatoren ontwikkeld. Tijdens het schrijven van de richtlijn is expliciet met deze indicatoren rekening gehouden. De indicatoren die in het kader van de DHFA ontwikkeld worden kan men gebruiken om de implementatie van de richtlijn te meten.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als researchaanbeveling in de Kennislacunes beschreven onder 'aanverwant'.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers M, Kho M, Browman GP, et al. for the AGREE Next Steps Consortium. AGREE II: Advancing guideline development, reporting and evaluation in healthcare. Can Med Assoc J. 2010;182:E839-842.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from www.guidelinedevelopment.org/handbook.
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
Zoekverantwoording
|
Database |
Zoektermen Update Cochrane review van Parker & Handoll 2010, CD000093 |
Totaal |
|
Medline (OVID)
Nederlands, 2010-mrt 2015 |
1 (exp Hip Fractures/ or ((hip$ or femur$ or femoral$ or trochant$ or pertrochant$ or intertrochant$ or subtrochant$ or intracapsular$ or extracapsular$) adj4 fracture$).tw.) and ((pin$1 or nail$ or screw$1 or plate$1 or arthroplast$ or fix$ or prosthes$).tw. or (Internal Fixators/ or Bone Screws/ or Fracture Fixation, Internal/ or Bone Plates/ or Bone Nails/) or (Arthroplasty/ or Arthroplasty, Replacement, Hip/)) (13674) 2 limit 1 to (yr="2010 - 2015" and (dutch or english)) (3128) 3 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (229168) 4 2 and 3 (150) 144 uniek 5 (randomized controlled trial/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or ((randomized controlled trial or multicenter study.pt. or (single$ or doubl$ or treb$ or tripl$)) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo$.tw. or randomly allocated.tw. or (allocated adj2 random$).tw.) not (animals/ not humans/) (585538) 6 2 and 5 (175) 9 6 not 4 (141) – 130 uniek |
609 |
|
Embase (Elsevier) |
'hip fracture'/mj OR ((hip* OR femur* OR femoral* OR trochant* OR pertrochant* OR intertrochant* OR subtrochant* OR intracapsular* OR extracapsular*) NEAR/4 fracture*):ab,ti AND (pin? OR nail? OR screw? OR plate? OR arthroplast* OR fix* OR prosthes* OR 'bone screw'/de OR 'fracture fixation'/de OR 'bone plate'/de OR 'bone nail'/de OR 'intramedullary nailing'/de OR 'arthroplasty'/de OR 'hip arthroplasty'/de) AND [embase]/lim AND [2010-2015]/py AND ([dutch]/lim OR [english]/lim)
'hip fracture'/mj OR ((hip* OR femur* OR femoral* OR trochant* OR pertrochant* OR intertrochant* OR subtrochant* OR intracapsular* OR extracapsular*) NEAR/4 fracture*):ab,ti AND (pin? OR nail? OR screw? OR plate? OR arthroplast* OR fix* OR prosthes* OR 'bone screw'/de OR 'fracture fixation'/de OR 'bone plate'/de OR 'bone nail'/de OR 'intramedullary nailing'/de OR 'arthroplasty'/de OR 'hip arthroplasty'/de) AND [embase]/lim AND [2010-2015]/py AND ([dutch]/lim OR [english]/lim) (133) - 51 uniel
'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it (247) – 148 uniek |
|
|
Cochrane Library (Wiley) |
#1 MeSH descriptor: [Hip Fractures] explode all trees 1150 #2 ((hip* or femur* or femoral* or trochant* or pertrochant* or intertrochant* or subtrochant* or intracapsular* or extracapsular*) near fracture*):ti,ab,kw (Word variations have been searched) 3231 #3 #1 or #2 3231 #4 (pin* or nail* or screw* or plate* or arthroplasty* or fix* or prosthes*):ti,ab,kw (Word variations have been searched) 45466 #5 MeSH descriptor: [Internal Fixators] this term only 155 #6 MeSH descriptor: [Bone Screws] this term only 587 #7 MeSH descriptor: [Fracture Fixation, Internal] explode all trees 963 #8 MeSH descriptor: [Bone Plates] this term only 376 #9 MeSH descriptor: [Bone Nails] this term only 361 #10 MeSH descriptor: [Arthroplasty] 1 tree(s) exploded 3662 #11 #4 or #5 or #6 or #7 or #8 or #9 or #10 45617 #12 #3 and #11 Publication Year from 2010 to 2015 366
17 SR, 52 DARE, 276 Trials, 18 EE |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Uit Cochrane review geëxcludeerd (Parker, 2010) |
|
|
Davis TR, Sher JL, Checketts RG, Porter BB. Intertrochanteric fractures of the femur: a prospective study comparing the use of the Kuntscher-Y nail and a sliding hip screw. Injury 1988;19(6):421–6. |
Vergelijking tussen Küntscher-Y nail versus GHS: geen “distal locking”
|
|
Dujardin FH, Benez C, Polle G, Alain J, Biga N, Thomine JM. Prospective randomized comparison between a dynamic hip screw and a mini-invasive statis nail in fractures of the trochanateric area: preliminary results. Journal of Orthopaedic Trauma 2001;15(6):401–6. |
Exclusie: wordt ook in de Cochrane voor meta-analyse geëxcludeerd omdat het om een experimenteel en niet verkrijgbaar implantaat gaat. |
|
SR |
|
|
Huang X, Leung F, Xiang Z, Tan PY, Yang J, Wei DQ, et al. Proximal femoral nail versus dynamic hip screw fixation for trochanteric fractures: a meta-analysis of randomized controlled trials. ScientificWorldJournal. 2013;2013:805805. |
Geen additionele studies ten opzichte van de Cochrane review. |
|
Zhang K, Zhang S, Yang J, Dong W, Wang S, Cheng Y, et al. Proximal femoral nail vs. dynamic hip screw in treatment of intertrochanteric fractures: a meta-analysis. Med Sci Monit. 2014;20:1628-33 |
Geen additionele studies ten opzichte van de Cochrane review. |
|
Ma KL, Wang X, Luan FJ, Xu HT, Fang Y, Min J, et al. Proximal femoral nails antirotation, Gamma nails, and dynamic hip screws for fixation of intertrochanteric fractures of femur: A meta-analysis. Orthop Traumatol Surg Res. 2014;100(8):859- |
Geen additionele studies ten opzichte van de Cochrane review |
|
Shen L, Zhang Y, Shen Y, Cui Z. Antirotation proximal femoral nail versus dynamic hip screw for intertrochanteric fractures: a meta-analysis of randomized controlled studies. Orthop Traumatol Surg Res. 2013;99(4):377-83 |
Geen additionele studies ten opzichte van de Cochrane review, daarnaast is 1 RCT geïncludeerd die later is teruggetrokken i.v.m. ethische overtredingen. |
|
Zeng C, Wang YR, Wei J, Gao SG, Zhang FJ, Sun ZQ, et al. Treatment of trochanteric fractures with proximal femoral nail antirotation or dynamic hip screw systems: a meta-analysis. J Int Med Res. 2012 |
Geen additionele studies ten opzichte van de Cochrane review |
|
Wang B, Ge ZX, Yang GY, Zhang DZ, Zhang YG, Tian W, et al. Intramedullary nails versus extramedullary fixation in the repair of intertrochanteric fractures: a meta-analysis (Provisional abstract). |
Geen additionele studies ten opzichte van de Cochrane review |
|
Yuan X, Yao Q, Ni J, Peng L, Yu D. Proximal femoral nail antirotation versus dynamic hip screw for intertrochanteric fracture in elders: a meta-analysis (Provisional abstract). Database of Abstracts of Reviews of Effects [Internet]. 2014; (1):[836-9 pp |
Artikel alleen in Chinees beschikbaar |
|
RCT |
|
|
Dhamangaonkar AC, Joshi D, Goregaonkar AB, Tawari AA. Proximal femoral locking plate versus dynamic hip screw for unstable intertrochanteric femoral fractures. Journal of Orthopaedic Surgery. 2013;21(3):317-22. |
Is een vergelijking van extramedullair vs. extramedullair. |
|
Stern R, Lubbeke A, Suva D, Miozzari H, Hoffmeyer P. Prospective randomised study comparing screw versus helical blade in the treatment of low-energy trochanteric fractures. Int Orthop. 2011;35(12):1855-61. |
Er worden twee groepen gemaakt: “screw group”: DHS en Gamma nail (extra en intra) versus “blade group”: DHS blade en PFNA (extra en intra). Data niet bruikbaar voor vraag: intra vs. extra. |
|
Syed NH, Malik NI, Saeed FUR. Role of external fixator in the management of trochanteric fractures of the femur - Damage control orthopaedics. Medical Forum Monthly. 2011;22(12):58-61. |
Exclusie: external fixator valt buiten uitgangsvraag. |
|
Yang E, Qureshi S, Trokhan S, Joseph D. Gotfried percutaneous compression plating compared with sliding hip screw fixation of intertrochanteric hip fractures: a prospective randomized study. J Bone Joint Surg Am. 2011 |
Exclusie: extra vs. extramedullair |
|
Garg B, Marimuthu K, Kumar V, Malhotra R, Kotwal PP. Outcome of short proximal femoral nail antirotation and dynamic hip screw for fixation of unstable trochanteric fractures. A randomised prospective comparative trial.[Retraction in Spencer RF. Hip Int. 2012 Jul-Aug;22(4):487; PMID: 22956374]. Hip int. 2011;21(5):531-6.A |
Artikel is teruggetrokken artikel ivm schending ethische codes auteur en incorrecte data |
|
Tao R, Lu Y, Xu H, Zhou ZY, Wang YH, Liu F. Internal fixation of intertrochanteric hip fractures: a clinical comparison of two implant designs. ScientificWorldJournal. 2013;2013:834825.OBJECTIVE: To compare two internal fixation devices clinically in stabilisation of intertrochanteric femur fractures. |
Exclusie: geen voor de Nederlandse situatie relevante vergelijking (LISS) |
