Prostaatcarcinoom - Abirateron ADT versus Docetaxel ADT
Uitgangsvraag
Wat is de plaats van gecombineerde hormonale- en tweede lijns hormonale of chemotherapie in vergelijking met alleen hormonale therapie in de behandeling van nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom?
Subvragen:
- Wat is de plaats van gecombineerde hormonale- en chemotherapie met docetaxel in vergelijking met alleen hormonale therapie in de behandeling van nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom?
- Wat is de plaats van gecombineerde hormonale- en tweede lijns hormonale therapie met abirateron en prednison in vergelijking met alleen hormonale therapie in de behandeling van nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom?
- Wat is de plaats van abirateron met prednison in vergelijking met docetaxel in de gecombineerde hormonale- en tweede lijns hormonale of chemotherapie voor de behandeling van nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom?
Aanbeveling
Bespreek in het multidisciplinair overleg de voor- en nadelen van docetaxel en abirateron met prednison in combinatie met ADT voor de specifieke patiënt met een nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom, en kies, rekening houdend met comorbiditeit, volume van de ziekte en bovenstaande overwegingen, voor één van deze twee opties samen met ADT, of ADT alleen.
De werkgroep is van mening dat bij een nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom de toevoeging van of 6 kuren docetaxel of 2 jaar abirateron met prednison aan ADT een duidelijk overlevingsvoordeel biedt boven ADT alleen.
Overweeg behandeling met of docetaxel of abirateron met prednison als aanvulling op ADT bij patiënten met een nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom volgens de volgende doseringen:
- docetaxel: 6 kuren 75 mg/m2 iedere 3 weken
- abirateron: 1000 mg/dag in combinatie met prednison 5 mg/dg gedurende twee jaar.
Overwegingen
Patiënten met een nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom kunnen behandeld worden met androgeen deprivatie therapie in combinatie met 6 kuren docetaxel 75 mg/m2 per 3 weken of met abirateron 1000 mg plus prednison 5 mg/dag gedurende twee jaar of tot progressie. Beide schema’s leiden tot een significante verbetering in de algehele overleving en progressievrije overleving. De volgende punten moeten echter wel in de overwegingen worden meegenomen in het besluit voor een van beide behandelschema’s:
- Er zijn nog maar beperkte lange termijn follow-up gegevens van abirateron + prednison in deze situatie;
- Er is geen selectiemethode om de groep prostaatkankerpatiënten te selecteren die het meest baat hebben bij de “upfront” abirateron+prednison plus ADT of docetaxel plus ADT;
- Upfront behandeling met abirateron + prednisolon duurt 2 jaar; upfront docetaxel + prednison duurt 18 weken.
- De kosten van upfront docetaxel zijn aanmerkelijk lager dan van upfront abirateron+prednison, hetgeen van invloed is op het verantwoord gebruik van medicatie. De kosten van abirateron uitgaand van een dosis 1000 mg per dag (4 tabletten van 250 mg of 2 tabletten van 500 mg) bedragen € 3264,80 per 28 dagen (bron: www.medicijnkosten.nl, 11/12/2017). De mediane behandelduur in de hier besproken studies met abirateron varieerde van 23.7 tot 33.2 maanden. De kosten van docetaxel 75 mg/m2 gedurende 6 kuren zullen per ziekenhuis wisselen door inkoopverschillen. Een bedrag van rond de 3000,- euro voor de totale behandeling, inclusief toedieningssystemen en arbeid verpleegkundigen, lijkt reëel.
Wat betreft het kostenaspect moet wel meegewogen worden dat patiënten die progressief zijn op docetaxel+ADT in tweede lijn waarschijnlijk abirateron of enzalutamide zullen gaan gebruiken.
Bij patiënten met nieuw gediagnostiseerd gemetastaseerd hormoongevoelig prostaatcarcinoom kan, met het oog op verantwoord medicatie gebruik, de voorkeur gegeven worden aan docetaxel, tenzij er redenen zijn dat een patiënt niet geschikt is voor docetaxel therapie.
Vergelijkende studies naar verschil in kwaliteit van leven tussen de twee behandelingen zijn niet gedaan. De publicatie van Chi et al, 2018, liet zien dat de toevoeging van abirateron aan ADT een verbetering gaf in pijnprogressie, functionele achteruitgang en algehele HRQOL. Morgans et al (2018) toonden aan dat de toevoeging van docetaxel aan ADT in de eerste 3 maanden leidde tot een slechtere kwaliteit van leven in vergelijking met ADT alleen, maar na 12 maanden was de gemeten levenskwaliteit beter in vergelijking met ADT behandelde patiënten.
De CHAAARTED and GETUG-AFU15 studies lieten met name een voordeel van docetaxel zien voor de hoog-volume gemetastaseerde prostaatkanker patiënten (Gravis, 2018). Hoog-volume ziekte was gediagniosticeerd middels botscintigrafie (conventionele beeldvroming). Patiënten met een laag-volume gemetastaseerde ziekte hebben een langere overleving met androgeen deprivatie alleen en de toxiciteit van docetaxel zou de voordelen negatief kunnen beïnvloeden. Recent werden twee studies gepubliceerd naar het effect van de behandeling van de primaire tumor bij nieuw gediagnosticeerd gemetastaseerde ziekte. In de HORRAD studie werd er geen voordeel gezien van androgeen deprivatie therapie in combinatie met bestraling van de primaire tumor ten opzichte van androgeen deprivatie therapie alleen. Bijna 70% van de studiepopulatie bestond uit mannen met meer dan 5 ossale metastasen (Boevé, 2018). In een studie in het kader van de STAMPEDE, waarbij patiënten met een laag-, en hoog-volume gemetastaseerde ziekte werden geïncludeerd werd in een vooraf gedefinieerde subgroep analyse voor het eerst een significant voordeel aangetoond voor de gecombineerde behandeling voor de patiënten met een laag-volume ziekte (HR 0.68. 95%BI 0.52-0.90; p=0.007; 3-jaars overleving 73% versus 81% in het voordeel van de gecombineerde behandeling) (Parker, 2018). Dit resultaat maakt dat deze behandeling laagdrempelig overwogen moet worden bij patiënten met laagvolume gemetastaseerde ziekte conform de CHAARTED-criteria. Wel is het goed mogelijk dat de overlevingswinst gering is. Er wordt momenteel een meta-analyse uitgevoerd voor patienten met hoog-volume ziekte, maar de resultaten hiervan zijn nog niet bekend. Ook data over lokale controle van bestraling (of door lokale bestraling geïnduceerde morbiditeit) zijn niet bekend. De STAMPEDE onderzocht niet of alleen de prostaat bestraald moet worden of dat er ook een bestraling van de oligometastasen geïndiceerd is of dat een radicale prostatectomie in combinatie met een uitgebreide klierdissectie verricht moet worden. Deze punten blijven onderwerp van verder onderzoek.
Alles in achtnemend is de werkgroep van mening dat patiënten met nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom, indien mogelijk zowel hormonale- als chemotherapiebehandeling dienen te krijgen. Er dient op individuele basis een afweging gemaakt te worden van de voor- en nadelen tussen docetaxel en abirateron met prednison. Het is wenselijk om deze afweging te bespreken in een multidisciplinair overleg en de beslissing te nemen in samenspraak met de patiënt. Indien er bij de afweging geen voorkeur is voor een behandeling met docetaxel of abirateron met prednison, dan is een keuze voor docetaxel verdedigbaar gezien het kostenaspect. Bij laag volume gemetastaseerde ziekte (gediagnosticeerd middels botscintigrafie) dient behandeling van de primaire tumor ook te worden overwogen.
Onderbouwing
Achtergrond
De volgende tekst heeft betrekking op gecombineerde therapie bij nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom. De plaats van gecombineerde hormonale- en chemotherapie, met name de toevoeging van docetaxel, dan wel abirateron aan androgeendeprivatie therapie (ADT) wordt besproken in deze module. De volgende vergelijkingen worden uitgewerkt: (I) de toegevoegde waarde van docetaxel aan ADT, (II) de toegevoegde waarde van abirateron aan ADT en (III) de waarde van docetaxel versus abirateron in de combinatiebehandeling met ADT bij patiënten met nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom.
Conclusies / Summary of Findings
1. ADT plus docetaxel versus ADT
|
Hoog GRADE |
Er is bewijs van hoge kwaliteit dat ADT plus docetaxel bij een nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom bij hoog-volume patiënten leidt tot een langere algehele overleving dan een ADT-behandeling alleen, gemeten in een continue uitkomstmaat.
Bronnen (Gravis, 2016; James, 2016; Sweeney, 2015) |
|
GRADE Laag |
Er is bewijs van lage kwaliteit dat er geen verschil is in de kwaliteit van leven bij een nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom tussen een ADT + docetaxel of ADT behandeling.
Bronnen (Gravis, 2013) |
2. ADT plus abirateron versus ADT
|
Hoog GRADE |
Er is bewijs van hoge kwaliteit dat ADT plus abirateron met prednison bij een nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom leidt tot een langere algehele overleving dan een ADT-behandeling alleen, gemeten in een continue uitkomstmaat.
Bronnen (Fizazi, 2017; James, 2017) |
3. ADT plus abiraterone versus ADT plus docetaxel
|
Redelijk GRADE |
Het effect van Abirateron-ADT op overleving lijkt niet te verschillen van dat van Docetaxel-ADT in de behandeling van patiënten met hoog-volume nieuw gemetastaseerd hormoon-sensitief prostaatcarcinoom.
Bronnen (Wallis, 2017) |
|
Geen GRADE |
Er werden geen studies gevonden die bestudeerden of er verschil is in Abirateron-prednison-ADT versus Docetaxel-ADT wat betreft de volgende uitkomstmaten: progressievrije overleving, radiologische progressievrije overleving, toxiciteit, tijd tot de volgende behandeling en kosten.
Bronnen (Wallis, 2017) |
Samenvatting literatuur
1. ADT plus docetaxel versus ADT
In totaal zijn drie studies geïncludeerd die de combinatie van ADT plus docetaxel onderzochten in vergelijking met alleen ADT in de behandeling van nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom (GETUG AFU 15, CHAARTED, STAMPEDE). Gravis et al (2016) randomiseerden, in de GETUG AFU 15-studie, 385 patiënten in de ADT plus docetaxel-groep (n=193) en de ADT-groep (n=192). De CHAARTED-studie van Sweeney et al (2015) includeerde 790 patiënten en vergeleek ADT plus docetaxel (n=397) versus ADT (n=393). De STAMPEDE-studie vergeleek de standaardbehandeling (=ADT) plus docetaxel (n=592) versus de standaardbehandeling (n=1184) (James, 2016). Alle studies rapporteerde algehele overleving als nieuw eindpunt.
2. ADT plus abirateron met prednisone versus ADT
Twee studies zijn geïncludeerd die de combinatie van ADT plus abirateron onderzochten in vergelijking met alleen ADT in de behandeling van nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom (LATITUDE, STAMPEDE). De LATITUDE-studie includeerde 1199 patiënten en vergeleek ADT plus abirateron (n=597) versus ADT (n=602) (Fizazi, 2017). James et al (2017) randomiseerden, in de STAMPEDE-studie, 1917 patiënten in de ADT plus abirateron-groep (n=960) en de ADT-groep (n=957). Beide studies rapporteerden algehele overleving als primair eindpunt.
3. ADT plus abirateron en prednison versus ADT plus docetaxel
In de literatuur worden géén directe (head-to-head) vergelijkingen gevonden waarin de effecten van abirateron versus docetaxel worden onderzocht in de gecombineerde behandeling van nieuw gemetastaseerd hormoon-sensitief prostaatcarcinoom. De systematische literatuurzoekactie levert één recente SR waarin een netwerk meta-analyse wordt beschreven om op een indirecte manier de vergelijking tussen abirateron-ADT en docetaxel-ADT te analyseren (Wallis, 2017). Wallis et al (2017) includeerden 5 RCT’s waarin de toegevoegde waarde van abirateron (Fizazi, 2017 (LATITUDE) en James, 2017 (STAMPEDE)) en docetaxel (Gravis, 2016 (GETUG-AFU 15); James, 2016 (STAMPEDE) en Sweeney, 2015 (CHAARTED)) aan androgeen deprivatie therapie (ADT) wordt onderzocht in de behandeling van patiënten met hoog-volume gemetastaseerd hormoon-sensitief prostaatcarcinoom. De SR is van goede kwaliteit (zie kwaliteitsbeoordeling onder het tabblad Verantwoording).
De SR van Wallis et al (2017) selecteerde algehele overleving als primaire uitkomstmaat. Deze primaire uitkomstmaat werd consistent gerapporteerd door de studies en kon worden gepoold in een meta-analyse. De secundaire uitkomstmaten radiografische progressievrije overleving, biochemische progressievrije overleving, klinische progressievrije overleving, castratie-resistent prostaatcarcinoom-vrije overleving en skelet-gerelateerde-vrije overleving werden niet consistent gerapporteerd in de studies en ook niet meegenomen in de meta-analyse.
De geïncludeerde RCT’s zijn van goede kwaliteit en hebben een overwegend lage ‘risk of bias’. De belangrijkste studie-karakteristieken van de geïncludeerde RCT’s zijn opgenomen in de evidence tabel (zie tabblad Verantwoording). In de docetaxel RCT’s kregen patiënten in de experimentele groep docetaxel (75 mg/m2), zonder toevoeging van prednison of prednisolon, voor een aantal van maximaal zes (Sweeney, 2015 en James, 2016) of negen cycli (Gravis, 2016). De meeste patiënten startten met docetaxel-ADT therapie binnen één maand na randomisatie. In de RCT’s die abirateron onderzochten kregen patiënten in de experimentele groep abirateronacecaat (1000 mg/d) met prednison in een dosering van 5 mg/dag (Fizazi, 2017) of prednisolon 5 mg/dag (James, 2017). De abirateron-ADT behandeling duurde 2 jaar of tot het moment van radiologische-, klinische-, of PSA-progressie.
In totaal werden 6067 patiënten geïncludeerd; 1181 patiënten werden behandeld met docetaxel-ADT (19.5%), 1557 patiënten met abirateron-ADT (25.7%) en 3329 patiënten kregen alleen ADT (54.9%). Patiënten werden geïncludeerd tussen 2004 en 2014. De mediaan van de leeftijd varieerde tussen 63 en 68 jaar. Drie studies includeerden alleen patiënten met gemetastaseerd prostaatcarcinoom (Gravis, 2016; Sweeney, 2015 en Fizazi, 2017); dit was respectievelijk 61% en 52% voor de studies van James (2016) en James (2017). In de GETUG-AFU 15 studie (Gravis, 2016) had 47% van de patiënten in de docetaxel-ADT groep een ‘hoog-volume’ gemetastaseerde ziekte in vergelijking met 48% van de patiënten die behandeld werd met alleen ADT. Patiënten in de CHAARTED-studie hadden vaker een ‘hoog volume’ gemetastaseerde ziekte (docetaxel-ADT: 66%; ADT: 64%) (Sweeney, 2015). De meeste patiënten in de LATITUDE-studie hadden een ‘hoog volume’ gemetastaseerde ziekte, ˃95% van de patiënten had een Gleason-score van ˃8 en ˃3 botlaesies.
Resultaten
1. ADT plus docetaxel versus ADT
Algehele overleving
De studie van Gravis et al (2016) [GETUG AFU 15] heeft een mediane follow-up tijd van 83,9 maanden. De mediane algehele overleving in de ADT plus docetaxel-groep was 62,1 maanden (95%BI= [49,5 tot 73,7]) en in de ADT-groep 48,6 maanden (95%BI= [40,9 tot 60,6]) (hazard ratio (HR)= 0,88; 95%BI= [0,68 tot 1,14]; p=0,3), geen statistisch significant verschil tussen beide groepen. De STAMPEDE-studie (James, 2016) heeft een mediane algehele overleving van 81 maanden (IQR: 41- niet bereikt) in de standaardbehandeling plus docetaxel-groep en 71 maanden (IQR: 32-niet bereikt) in de standaardbehandeling groep (HR= 0,78; 95%BI= [0,66 tot 0,93]; p=0,006), statistisch significant ten gunste van de standaardbehandeling plus docetaxel-groep. De studie van Sweeney et al (2015) [CHAARTED] heeft een mediane algehele overleving van 57,6 maanden in de ADT plus docetaxel-groep en 44,0 maanden in de ADT-groep (HR= 0,61; 95%BI= [0,47 tot 0,80]; p< 0,001), ten gunste van de ADT plus docetaxel-groep. Dit geeft een gepoolde HR van 0,75 (95%BI= [0,63 tot 0,91]; p=0,003), ten gunste van de ADT plus docetaxel-groep (Figuur 1).
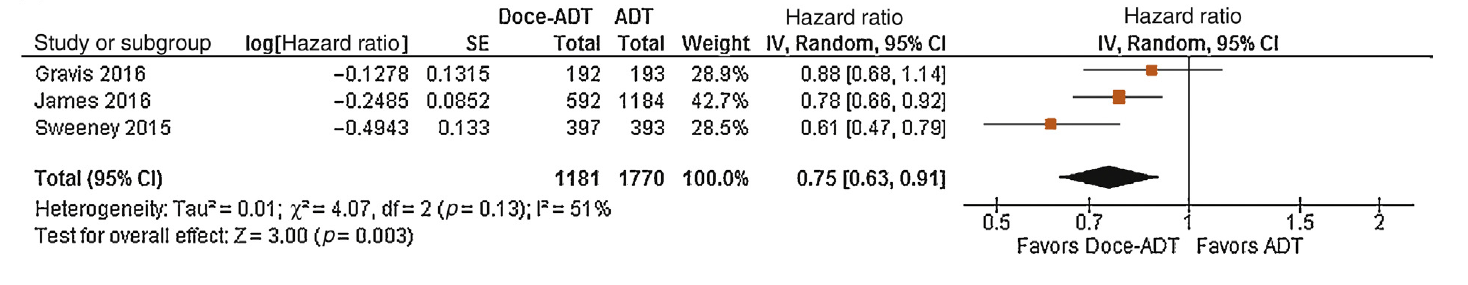
Figuur 1. Forest plot met meta-analyse van de combinatietherapie ADT plus docetaxel versus alleen ADT (Wallis, 2017).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat overleving is ‘hoog’.
Kwaliteit van leven
Twee studies hebben de kwaliteit van leven, gemeten met EORTC QLQ-C30 vragenlijst, gerapporteerd (Gravis, 2013; Rajan, 2015). Hierbij is geen statistisch significant verschil gevonden tussen de interventie en de controle groep. (absoluut verschil: 1.03 punten hoger, 95%BI: 2.63 punten lager tot 4.69 punten hoger).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveau’s verlaagd gezien het risico op bias (bias ten gevolge van van allocation concealment), en subjectieve rapportage van de uitkomstaat (measurement bias). De bewijskracht is ‘Laag’.
2. ADT plus abirateron met prednison versus ADT
Algehele overleving
De LATITUDE-studie (Fizazi, 2017) liet na een geplande mediane follow-up tijd van 30,4 maanden zien dat de mediane algehele overleving significant langer was in de ADT plus abirateron-groep dan in de ADT-groep (HR= 0,62; 95%BI= [0,51 tot 0,75]; p<0,001). De STAMPEDE-studie (James, 2017) liet na een mediane follow-up tijd van 40 maanden zien dat de algehele overleving significant langer was in de ADT plus abirateron-groep dan in de ADT-groep (HR= 0,63; 95%BI= [0,52 tot 0,76]; p<0,001) (Figuur 2).
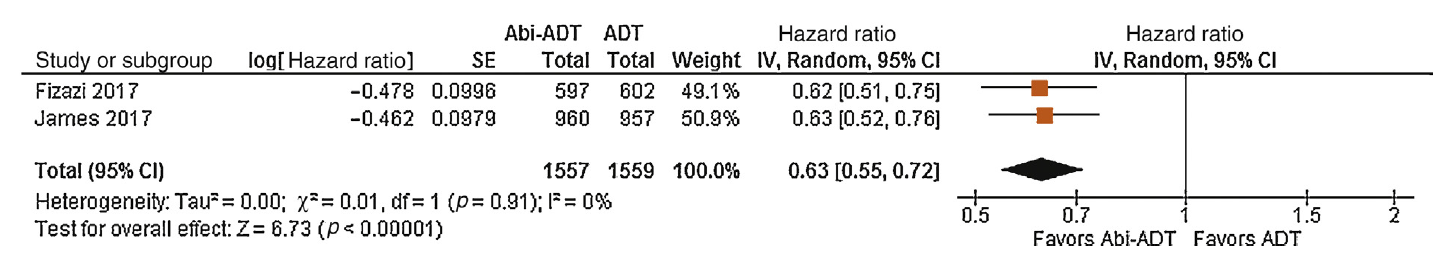
Figuur 2. Forest plot met meta-analyse van de combinatietherapie ADT plus abirateron versus alleen ADT (Wallis, 2017).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat overleving is ‘hoog’.
3. ADT plus abirateron met prednison versus ADT plus docetaxel
Algehele overleving
In totaal overleden 1921 patiënten; 714 hiervan waren gerandomiseerd in één van de experimentele groepen (391 patiënten die werden behandeld met docetaxel-ADT en 353 patiënten die werden behandeld met abirateron-ADT) en 1177 in de ADT-groep. Het gepoolde effect werd berekend met een random effect model. De exploratief opgezette en uitgevoerde indirecte vergelijking tussen abirateron-ADT en docetaxel-ADT liet geen significant verschil zien in overleving tussen de twee therapieën (HR=0,84; 95% CI:0,67 tot 1,06) (zie figuur 3) (Wallis, 2017).
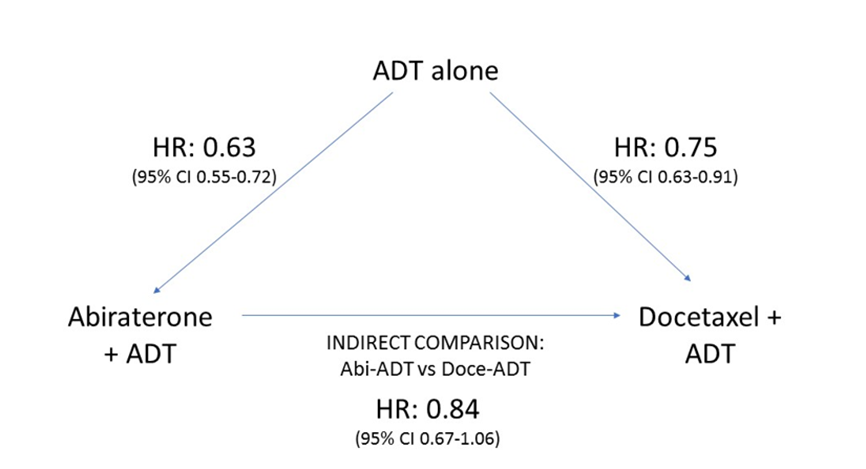
Figuur 3. Schematische weergave van de indirecte vergelijking tussen Docetaxel-ADT versus Abirateron-ADT in de behandeling van nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom (Wallis, 2017).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat overleving is met 1 niveau verlaagd gezien extrapoleerbaarheid van de resultaten (bias ten gevolge van indirectheid, verschil in toedieningsschema docetaxel, verschil in follow-up duur). De bewijskracht is ‘redelijk’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
- Wat zijn de gunstige en ongunstige effecten, bij behandeling van patiënten met hormoon-sensitief (of hoog-volume) prostaatcarcinoom, van de toevoeging van docetaxel aan ADT, in vergelijking tot ADT alleen?
- Wat zijn de gunstige en ongunstige effecten, bij behandeling van patiënten met hormoon-sensitief (of hoog-volume) prostaatcarcinoom, van de toevoeging van abirateron en prednison aan ADT, in vergelijking tot ADT alleen?
- Wat zijn de gunstige en ongunstige effecten, bij behandeling van patiënten met hormoon-sensitief (of hoog-volume) prostaatcarcinoom, van de toevoeging van abirateron met prednison aan ADT, in vergelijking tot toevoeging van docetaxel aan ADT?
PICO zoekvraag 1
P: Volwassen patiënten (≥18 jaar) met een nieuw gediagnosticeerd gemetastaseerd hormoon-sensitief prostaatcarcinoom;
I: Docetaxel + Androgeendeprivatie Therapie (ADT);
C: Androgeendeprivatie Therapie (ADT);
O: Totale overleving, failure free survival, radiologische progressie, klinische progressie, PSA progressie, overlijden als gevolg van prostaatcarcinoom, toxiciteit, behandeling, kosten.
PICO zoekvraag 2
P: Volwassen patiënten (≥18 jaar) met een nieuw gediagnosticeerd gemetastaseerd hormoon-sensitief prostaatcarcinoom;
I: Abirateron + prednison + Androgeendeprivatie Therapie (ADT);
C: Androgeendeprivatie Therapie (ADT);
O: Totale overleving, failure free survival, radiologische progressie, klinische progressie, PSA progressie, overlijden als gevolg van prostaatcarcinoom, toxiciteit, behandeling, kosten.
PICO zoekvraag 3
P: Volwassen patiënten (≥18 jaar) met een nieuw gediagnosticeerd gemetastaseerd hormoon-sensitief prostaatcarcinoom;
I: Abirateron + prednison + Androgeendeprivatie Therapie (ADT);
C: Docetaxel + Androgeendeprivatie Therapie (ADT);
O: totale overleving, failure free survival, radiologische progressie, klinische progressie, PSA progressie, overlijden als gevolg van prostaatcarcinoom, toxiciteit, behandeling, kosten.
Relevante uitkomstmaten
De werkgroep achtte overleving een voor de besluitvorming cruciale uitkomstmaat; progressievrije overleving, radiologische progressievrije overleving, toxiciteit, tijd tot de volgende behandeling en kosten voor de besluitvorming zijn daarnaast ook belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID, Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 21 februari 2018 met relevante zoektermen gezocht vanaf het jaar 2014 naar systematische reviews (SR’s) en RCT’s die de toegevoegde waarde van abirateron plus prednison vergelijken met de toegevoegde waarde van docetaxel aan ADT in de behandeling van personen met nieuw gediagnosticeerd gemetastaseerd of hoog-volue prostaatcarcinoom. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuur zoekactie leverde 306 treffers op. Wanneer meerdere publicaties eenzelfde studie beschrijven wordt de meest recente publicatie geselecteerd voor inclusie. Studies werden verder geselecteerd op grond van de volgende selectiecriteria: volwassenen met hormoon-sensitief prostaatcarcinoom, behandeld met abirateron of docetaxel in aanvulling op androgeen deprivatie therapie, vergelijkend onderzoek, evaluatie van een door de werkgroep als relevant benoemde uitkomstmaat.
Op basis van titel en abstract werden in eerste instantie 65 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 64 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en één studie definitief geselecteerd. De literatuuranalyse is gebaseerd op één recente systematic review (SR) (Wallis, 2017). De SR beschrijft een netwerk meta-analyse. In deze SR wordt zowel de toegevoegde waarde van docetaxel (Gravis, 2016; James, 2016 en Sweeney, 2015) als abirateron (Fizazi, 2017 en James, 2017) in aanvulling op androgene deprivatietherapie bepaald (ADT), alsmede een indirecte vergelijking opgesteld waarin de effectiviteit van Abirateron-ADT versus Docetaxel-ADT wordt bepaald bij volwassenen met hoog-volume of nieuw gediagnosticeerd gemetastaseerd prostaatcarcinoom (Wallis, 2017). De SR is van goede kwaliteit en dekt de literatuur tot september 2017 (zie kwaliteitsbeoordeling onder het tabblad Verantwoording). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- 1 - Boevé LMS, Hulshof MCCM, Vis AN, Zwinderman AH, Twisk JWR, Witjes WPJ, Delaere KPJ, Moorselaar RJAV, Verhagen PCMS, van Andel G. Effect on Survival of Androgen Deprivation Therapy Alone Compared to Androgen Deprivation Therapy Combined with Concurrent Radiation Therapy to the Prostate in Patients with Primary Bone Metastatic Prostate Cancer in a Prospective Randomised Clinical Trial: Data from the HORRAD Trial. Eur Urol. 2018 Sep 25 epub ahead of print
- 2 - Chi KN, Protheroe A, Rodríguez-Antolín A, et al. Patient-reported outcomes following abiraterone acetate plus prednisone added to androgen deprivation therapy in patients with newly diagnosed metastatic castration-naive prostate cancer (LATITUDE): an international, randomised phase 3 trial. Lancet Oncol. 2018;19(2):194-206. doi: 10.1016/S1470-2045(17)30911-7. Epub 2018 Jan 8. PubMed PMID: 29326030.
- 3 - Fizazi K, Tran N, Fein L, Matsubara N, Rodriguez-Antolin A, Alekseev BY, Özgüroglu M, Ye D, Feyerabend S, Protheroe A, De Porre P, Kheoh T, Park YC, Todd MB, Chi KN; LATITUDE Investigators. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med. 2017 Jul 27;377(4):352-360.doi: 10.1056/NEJMoa1704174. Epub 2017 Jun 4. PubMed PMID: 28578607.
- 4 - Gravis G, Boher JM, Joly F, Soulié M, Albiges L, Priou F, Latorzeff I, Delva R, Krakowski I, Laguerre B, Rolland F, Théodore C, Deplanque G, Ferrero JM, Culine S, Mourey L, Beuzeboc P, Habibian M, Oudard S, Fizazi K; GETUG. Androgen Deprivation Therapy (ADT) Plus Docetaxel Versus ADT Alone in Metastatic Non castrate Prostate Cancer: Impact of Metastatic Burden and Long-term Survival Analysis of the Randomized Phase 3 GETUG-AFU15 Trial. Eur Urol. 2016 Aug;70(2):256-62. doi: 10.1016/j.eururo.2015.11.005. Epub 2015 Nov 21. PubMed PMID: 26610858.
- 5 - Gravis G1, Boher JM2, Chen YH3, Liu G4, Fizazi K5, Carducci MA6, Oudard S7, Joly F8, Jarrard DM4, Soulie M9, Eisenberger MJ6, Habibian M10, Dreicer R11, Garcia JA12, Hussain MHM13, Kohli M14, Vogelzang NJ15, Picus J16, DiPaola R17, Sweeney C18 Burden of Metastatic Castrate Naive Prostate Cancer Patients, to Identify Men More Likely to Benefit from Early Docetaxel: Further Analyses of CHAARTED and GETUG-AFU15 Studies. Eur Urol. 2018 Jun;73(6):847-855
- 6 - James ND, de Bono JS, Spears MR, Clarke NW, Mason MD, Dearnaley DP, Ritchie AWS, Amos CL, Gilson C, Jones RJ, Matheson D, Millman R, Attard G, Chowdhury S, Cross WR, Gillessen S, Parker CC, Russell JM, Berthold DR, Brawley C, Adab F, Aung S, Birtle AJ, Bowen J, Brock S, Chakraborti P, Ferguson C, Gale J, Gray E, Hingorani M, Hoskin PJ, Lester JF, Malik ZI, McKinna F, McPhail N, Money-Kyrle J, O'Sullivan J, Parikh O, Protheroe A, Robinson A, Srihari NN, Thomas C, Wagstaff J, Wylie J, Zarkar A, Parmar MKB, Sydes MR; STAMPEDE Investigators. Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med. 2017 Jul 27;377(4):338-351. doi: 10.1056/NEJMoa1702900. Epub 2017 Jun 3. PubMed PMID: 28578639; PubMed Central PMCID: PMC5533216.
- 7 - James ND, Sydes MR, Clarke NW, Mason MD, Dearnaley DP, Spears MR, Ritchie AW, Parker CC, Russell JM, Attard G, de Bono J, Cross W, Jones RJ, Thalmann G, Amos C, Matheson D, Millman R, Alzouebi M, Beesley S, Birtle AJ, Brock S, Cathomas R, Chakraborti P, Chowdhury S, Cook A, Elliott T, Gale J, Gibbs S, Graham JD, Hetherington J, Hughes R, Laing R, McKinna F, McLaren DB, O'Sullivan JM, Parikh O, Peedell C, Protheroe A, Robinson AJ, Srihari N, Srinivasan R, Staffurth J, Sundar S, Tolan S, Tsang D, Wagstaff J, Parmar MK; STAMPEDE investigators. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet. 2016 Mar 19;387(10024):1163-77. doi: 10.1016/S0140-6736(15)01037-5. Epub 2015 Dec 21. PubMed PMID: 26719232; PubMed Central PMCID: PMC4800035.
- 8 - Parker CC, James ND, Brawley CD, Clarke NW, Hoyle AP, Ali A, Ritchie AWS, Attard G, Chowdhury S, Cross W, Dearnaley DP, Gillessen S, Gilson C, Jones RJ, Langley RE, Malik ZI, Mason MD, Matheson D, Millman R, Russell JM, Thalmann GN, Amos CL, Alonzi R, Bahl A, Birtle A, Din O, Douis H, Eswar C, Gale J, Gannon MR, Jonnada S, Khaksar S, Lester JF, O'Sullivan JM, Parikh OA, Pedley ID, Pudney DM, Sheehan DJ, Srihari NN, Tran ATH, Parmar MKB, Sydes MR. Systemic Therapy for Advanced or Metastatic Prostate cancer: Evaluation of Drug Efficacy (STAMPEDE) investigators (Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet. 2018 Oct 18 Epub ahead of print
- 9 - Sweeney CJ, Chen YH, Carducci M, Liu G, Jarrard DF, Eisenberger M, Wong YN, Hahn N, Kohli M, Cooney MM, Dreicer R, Vogelzang NJ, Picus J, Shevrin D, Hussain M, Garcia JA, DiPaola RS. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. N Engl J Med. 2015 Aug 20;373(8):737-46. doi: 10.1056/NEJMoa1503747. Epub 2015 Aug 5. PubMed PMID: 26244877; PubMed Central PMCID: PMC4562797.
- 10 - Wallis CJD, Klaassen Z, Bhindi B, et al. Comparison of Abiraterone Acetate and Docetaxel with Androgen Deprivation Therapy in High-risk and Metastatic Hormone-naïve Prostate Cancer: A Systematic Review and Network Meta-analysis. Eur Urol. 2017;pii:S0302-2838(17)30849-7. doi: 10.1016/j.eururo.2017.10.002. (Epub ahead of print) Review. PubMed PMID: 29037513.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Wallis, 2017
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of (RCT’s)
Literature search up to August 2017
A: Gravis, 2016 B: Sweeney, 2015 C: James, 2016 D: James, 2017 E: Fizazi, 2017
Study design: RCT (parallel), A: RCT (parallel) B: RCT (parallel) C: RCT (parallel) D: RCT (parallel) E: RCT (parallel)
Setting and Country: USA
Source of funding: None
|
Inclusion criteria SR: Only phase 3 RCT’s
Exclusion criteria SR:
5 studies included
Important patient characteristics at baseline:
N, mean age A: 385 patients, 64 yrs B: 790 patients, 63 yrs C: 1779 patients, 65 yrs D: 1199 patients, 67 yrs E: 1917 patients, 67 yrs
Gleason score: A: ADT alone: Gleason 2–6: 7% Gleason 7: 34% Gleason 8–10: 59% ADT and docetaxel: Gleason 2-6: 10% Gleason 7: 35% Gleason 8–10: 55% B: ADT alone: Gleason 4–6: 6% Gleason 7: 24% Gleason 8–10: 70% ADT and docetaxel: Gleason 4–6: 6% Gleason 7: 27% Gleason 8–10: 67% C: NA D: ADT alone: Gleason <7: 23% Gleason 8–10: 75% Unknown: 1% ADT and abiraterone: Gleason <7: 23% Gleason 8–10: 74% Unknown: 2% E: ADT alone: Gleason <7: 0.2% Gleason 7: 2% Gleason >8: 97% ADT and abiraterone: Gleason <7: 0.7% Gleason 7: 2% Gleason >8: 98%
Groups comparable at baseline? YES |
Describe intervention:
A: Docetaxel (75 mg/m2) for a maximum of six cycles B: Docetaxel (75 mg/m2) for a maximum of six cycles C: Docetaxel (75 mg/m2) for a maximum of nine cycles D: Abiraterone acetate 1000 mg/d with predni- sone 5 mg/d E: Abiraterone acetate 1000 mg/d with prednisolone 5 mg/d
|
Describe control:
A: ADT-alone B: ADT-alone C: ADT-alone D: ADT-alone E: ADT-alone
|
End-point of follow-up:
A: 82.9 months B: 28.9 months C: Na D: 30.4 months E: 40.0 months
For how many participants were no complete outcome data available? (intervention/control) A: NR B: NR C: NR D: NR E: NR
|
Outcome measure-1 Defined as overall survival
Effect measure: HR (95% CI): A: 0.9 (0.7-1.2) B: 0.61 (0.47-0.80) C: 0.76 (0.63-0.91) D: 0.62 (0.51-0.76) E: 0.63 (0.52-0.76)
Outcome measure OS: Pooled effect indirect comparison HR=0.84 (0.67-1.06)
|
Facultative:
Brief description of author’s conclusion In patients with hormone-naïve high-risk or metastatic PCa, there was no statistically significant difference in OS between patients treated with Abi-ADT and those treated with Doce-ADT based on an indirect comparison of data from meta-analysis of phase 3 trials.
Only bases on indirect comparison no head-to-head comparisons between Doce-ADT versus Abi-ADT.
|
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Wallis, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example, funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Vale, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Sathianathen, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Rydzewska, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Gravis, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Feyerabend, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
De Santis, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Zekri, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Vale, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Tucci, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Tassinari, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Ramos-Esquivel, 2016a |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Ramos-Esquivel, 2016b |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Miller, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Lei, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Davis, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Botrel, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Abdel-Rahman, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Vale, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Todenhöfer, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Davis, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Sfoungaristos , 2014 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Alva, 2014 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Rulach, 2018 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Kyriakopoulos, 2018 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Harshman, 2018 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Chi, 2018 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Caffo, 2018 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Shore, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Scott, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Rimar, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
McNamara, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Marino, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Lavaud, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Kalina, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
James, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Garcia de Paredes Esteban, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Flaig, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Dorff, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Damodaran |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Clement, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Broughman, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Bernard, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Aguiar, 2017 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Stevens, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Kim, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Joensuu, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Gravis, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Davda, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Carthon, 2016 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Zurita, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
van Soest, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
van Doodewaard-de Jong |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Sweeney, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Moul, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Lam, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Kim, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Jones, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Hernandez-Aya, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Gravis, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Gernone, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Ceresoli, 2015 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Saylor, 2014 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Li, 2014 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Gravis, 2014 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Beer, 2014 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
|
Attard, 2014 |
Komt niet overeen met PICO: geen vergelijking Abi versus Doce |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-04-2019
Beoordeeld op geldigheid : 01-01-2018
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Abirateron en docetaxel bij ADT |
NVU |
2018 |
2020 |
2 jaar |
NVU |
Verandering in wetenschappelijke inzichten, bijvoorbeeld over het effect van ENZA en ADT |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Een richtlijn is een aanbeveling ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Deze richtlijn bevat aanbevelingen gericht op het verbeteren van de kwaliteit van zorg en kwaliteit van leven voor mannen met (verdenking op) prostaatcarcinoom. Ongeveer 1 op de 9 mannen in Nederland krijgt ooit in zijn leven de diagnose prostaatcarcinoom. Dit zijn meer dan 10.000 patiënten per jaar en dit aantal neemt naar verwachting toe tot meer dan 17.000 patiënten in 2020. Bijna de helft (48%) van alle patiënten is 70 jaar of ouder.
De aanbevelingen betreffen zowel diagnostiek (inclusief lokaal recidief), behandeling als begeleiding. Het onderwerp behandeling is opgesplitst in modules met betrekking tot de stadia T1-2 Nx-0 Mx-0, T3-4 Nx-1 M0, M1a-c, castratie-resistent prostaatcarcinoom (CRPC), lokaal recidief.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van mannen met (verdenking op) prostaatcarcinoom, zoals urologen, radiologen, nucleair geneeskundigen, pathologen, radiotherapeuten, internist-oncologen, oncologieverpleegkundigen, verpleegkundig specialisten, huisartsen, maatschappelijk werkers en psychologen.
Deze richtlijn is primair geschreven voor bovenstaande (groepen) professionals en daardoor mogelijk minder makkelijk leesbaar voor patiënten. Zoals onder het kopje ‘Inbreng patiëntenperspectief’ beschreven, is het patiëntenperspectief uiteraard wel meegenomen bij de revisie van deze richtlijn.
KWF Kankerbestrijding geeft makkelijker leesbare patiëntenbrochures uit, die gebaseerd zijn op door IKNL gepubliceerde richtlijnen. Naar aanleiding van het verschijnen van een geheel of gedeeltelijk gereviseerde richtlijn bepaalt KWF of de bestaande patiëntenbrochure herzien wordt.
Samenstelling werkgroep
- Dr. T.M. de Reijke, uroloog, werkzaam in het Amsterdam Universitair Medische Centra, locatie AMC, NVU, voorzitter
- Prof. dr. J.O. Barentsz, radioloog, werkzaam in het RadboudUMC, NVvR
- Drs. J.L.L.M. Coenen, internist-oncoloog, werkzaam bij Isala, NIV
- Dhr. R. van der Giessen, patiënten vertegenwoordiger, Prostaatkankerstichting
- Prof. dr. J.A. Gietema, internist-oncoloog, werkzaam in het Universitair Medisch Centrum Groningen, NIV
- Prof. dr. L. Incrocci, radiotherapeut-oncoloog, werkzaam in het Erasmus Medisch centrum, NVRO
- Dr. M.J.R. Janssen, nucleair geneeskundige, werkzaam in het RadboudUMC, NVvN
- Dr. G.J.L.H. van Leenders, patholoog, werkzaam in het Erasmus Medisch Centrum, NVvP
- Prof. dr. R.J.A. van Moorselaar, uroloog, werkzaam in het Amsterdam Universitair Medische Centra, locatie VUmc, NVU
- Drs. H. Niekus, patiënten vertegenwoordiger, Prostaatkankerstichting
- Dr. I. van Oort, uroloog, werkzaam bij het RadboudUMC, NVU
- Dr. I. Schoots, radioloog, werkzaam bij het Erasmus MC, NVvR
- C. Tillier, verpleegkundig specialist urologie, V&VN
- Drs. H.A.M. Vanhauten, werkzaam bij het UMCG, radiotherapeut-oncoloog. NVRO
- Dr. E. Vegt, nucleair geneeskundige, werkzaam in het Antoni van Leeuwenhoek ziekenhuis, NVvN
Met ondersteuning van:
- Dr. I. Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
de Reijke |
Uroloog, Amsterdam UMC, locatie AMC |
Geen |
AMGEN, Ferring, Astellas, Janssen |
Geen actie |
|
van Leenders |
patholoog, Erasmus MC, Rotterdam |
Geen |
Consulent Roche (betaald) |
Geen actie |
|
Van Oort |
Uroloog, RadboudUMC Nijmegen |
Geen |
Astellas, Janssen, Bayer, Sanofi, Mdxhealth |
Geen actie |
|
Vegt |
Nucleair geneeskundige NKI-AVL, Amsterdam |
Geen |
geen |
Geen actie |
|
Coenen |
Internist, medisch oncoloog Isala, Zwolle |
Lid adviesraad cabazitaxel; Sanofi (betaald 1x / jaar) |
- |
Geen actie |
|
Tillier |
Verpleegkundig Specialist Urologie, NKI-AVL, Amsterdam |
Geen |
geen |
Geen actie |
|
van Moorselaar |
uroloog, Amsterdam UMC, locatie VUmc |
Geen |
adviescommissie: |
Geen actie |
|
Barentsz |
radioloog, RadboudUMC Nijmegen |
Geen |
- |
Geen actie |
|
Gietema |
Internist-oncoloog |
Geen |
geen |
Geen actie |
|
Niekus |
Patiënt/Donateur PKS/lid kwaliteitscommissie PKS |
Geen |
Kapitaal in belegginsdossier in allerlei regio's. |
Geen actie |
|
Schoots |
Radioloog ErasmusMC, Rotterdam |
Geen |
geen |
Geen actie |
|
Incrocci |
Radiotherapeut, |
Geen |
geen |
Geen actie |
|
Vanhauten |
Radiotherapeut, UMC Groningen. |
Geen |
2017 spreker diversen nascholing < 10 uur op jaarbasis, vergoeding en onkostenvergoeding |
Geen actie |
|
Giessen |
Gepensioneerd. Geen bestaand dienstverband. |
Als vrijwilliger lid van: |
Uitkomst richtlijnen kan geen financieel voordeel opleveren. |
Geen actie |
|
Janssen |
Nucleair geneeskundige, RadboudUMC Nijmegen |
- Voorzitter onderwijscommissie NVNG, onbetaald |
geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van een patiëntenvereniging, de ProstaatKankerStichting, in de werkgroep te laten participeren.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door werkgroep/commissie Prostaatcarcinoom van de NVU (2017) bleek dat er een noodzaak was voor (revisie) van deze richtlijnmodule.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad Zoekverantwoording voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR – voor systematische reviews.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor: Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die een randvoorwaarde zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes, te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2014 – februari 2018
|
1 exp Prostatic Neoplasms/ or (prostat* adj2 (cancer* or carcinoma* or tumor* or tumour* or neoplasm*)).ab,ti. or (PCa or mPCa or mHSPC).ab,ti. (165461) 2 exp Neoplasm Metastasis/ or metastas*.ab,ti. or metastatic.ab,ti. or (hormone adj2 (sensitiv* or naive)).ab,ti. (492601) 3 1 and 2 (30317) 4 ('androgen deprivation therapy' or 'androgen-deprivation therapy' or ADT or 'androgen ablation therapy'.ab,ti.).ab,ti. and ((abirateron* or docetaxel).ab,ti. or Abiraterone Acetate/) (392) 5 3 and 4 (287) 6 limit 5 to (english language and yr="2014 -Current") (180) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (344086) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1727610) 9 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2916436) 10 6 and 7 (13) 11 6 and 8 (78) 12 6 and 9 (44) 13 10 or 11 or 12 (108)
= 108 |
306 |
|
Embase (Elsevier) |
('prostate cancer'/exp OR ((prostat* NEAR/2 (cancer* OR carcinoma* OR tumor* OR tumour* OR neoplasm*)):ti) OR pca:ab,ti OR mpca:ab,ti OR mhspc:ab,ti) AND ('metastasis'/exp OR metastas*:ab,ti OR metastatic:ab,ti OR ((hormone NEAR/2 (sensitiv* OR naive)):ab,ti))
AND (('androgen deprivation therapy'/exp OR 'androgen deprivation therapy':ab,ti OR 'androgen ablation therapy':ab,ti) AND ('abiraterone'/exp OR abirateron*:ab,ti OR 'docetaxel'/exp OR docetaxel:ab,ti))
AND [2014-2018]/py AND [english]/lim
Gebruikte filters:
Systematische reviews (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)))
RCT’s (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it))
Observationele studies ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)))
= 280 |
