Neurologische biomarkers postanoxisch coma
Uitgangsvraag
Wat is de rol van neurologische biomarkers bij de prognosebepaling van patiënten met een postanoxisch coma?
Aanbeveling
Gebruik NSE-waardes bepaald op 48 uur en 72 uur na de reanimatie als additionele methode voor het voorspellen van een slechte neurologische uitkomst. Hanteer een grenswaarde van >65 µg/L, 48 tot 72 uur na de reanimatie.
Gebruik geen S100B voor het voorspellen van de neurologische uitkomst.
Overwegingen
Het overgrote deel van de literatuur laat zien dat een verhoogd NSE een sterke associatie heeft met een slechte neurologische uitkomst. Gezien de case reports waarin patiënten met sterk verhoogde waardes en toch een goede uitkomst zijn beschreven en het feit dat de studies verschillende afkapwaardes adviseren concludeert de werkgroep dat NSE op zichzelf niet als voorspellende test toegepast kan worden. Wel kan het aanvullende informatie geven als andere onderzoeken geen duidelijkheid geven. NSE bepaling dient plaats te vinden op 24, 48 en 72 uur na de reanimatie waarbij de waardes gemeten op 48 uur de meeste voorspellende waarde hebben. (Stammet et al 2015 en Wiberg 2017) Men dient bij het gebruik van NSE bedacht te zijn op NSE productie buiten het zenuwstelsel, zoals bij sommige tumoren voor kan komen. Tevens gaat het gebruik van een afkapwaarde met een lage FPR ten koste van de sensitiviteit.
Bovenstaande geldt ook en misschien in sterkere mate voor S100B. Bovendien hebben Stammet et al recent laten zien dat het bepalen van S100B naast NSE geen toevoegde klinische waarde heeft (Stammet, 2017). De werkgroep adviseert om deze reden om S100B niet te gebruiken.
Onderbouwing
Achtergrond
Bij het vaststellen van de prognose van patiënten met een postanoxisch coma wordt gebruik gemaakt van biomarkers die vrijkomen in het plasma als uiting van hersenschade. Neuron Specifiek Enolase (NSE) en S110B zijn het meest beschreven. Biomarkers kennen verschillende voordelen: de uitslag is kwantitatief en gecorreleerd aan de mate van hersenschade en de plasmaconcentratie is onafhankelijk van sedativa. Het vaststellen van een consistente drempelwaarde bleek tot nu toe moeilijk.
Voor deze uitgangsvraag heeft de werkgroep gekeken naar de prognostische waarde van NSE en S100B voor het voorspellen van een slechte neurologische uitkomst. Daarbij is rekening gehouden met het meetmoment en verstorende factoren.
Literatuur en aanbeveling ERC/ESICM (2014)
De aanbeveling van de ERC/ESICM uit 2014 was gebaseerd op drie systematische literatuurstudies (Sandroni 2013a, Sandroni 2013b, Kamps, 2013) waarin de waarde van prognostische tests bij patienten met een postanoxisch coma behandeld met of zonder TTM werden samengevat. In totaal werden 94 studies meegenomen in de aanbeveling. De kwaliteit van bewijs van de individuele studies werd beoordeeld en varieerde van laag tot zeer laag.
Met betrekking tot het gebruik van biomarkers komt de aanbeveling van de ERC/ESICM (Sandroni et al. 2014) tot de aanbevelingen:
- De variatie tussen de studies in gevonden afkapwaarden voor de biomarkers wordt mogelijk verklaard door het gebruik van verschillende meettechnieken, extraneuronale bronnen van biomarkers (zoals hemolyse en neuro-endocrine tumoren voor NSE en spier- en vetweefsel afbraak voor S100B) en onvoldoende kennis over de bloedconcentratie in de eerste dagen na reanimatie.
- Een aantal studies suggereert dat veranderingen in biomarker concentraties gemeten over een bepaalde tijdsperiode een goede prognostische waarde kunnen hebben.
- Voor patiënten die niet behandeld zijn met TTM wordt voor het voorspellen van slechte neurologische uitkomt op basis van de bloedwaarde NSE een percentage fout-positieven van 0% gevonden voor afkapwaarden variërend van 33 – 85 µg/L gemeten één tot vijf dagen na reanimatie.
- Voor patiënten die wel behandeld zijn met TTM wordt voor het voorspellen van slechte neurologische uitkomt op basis van de bloedwaarde NSE een percentage fout-positieven van 0% gevonden voor afkapwaarden variërend van 38.1 – 80.8 µg/L gemeten één dag na reanimatie; 25 – 151.5 µg/L gemeten twee dagen na reanimatie; en 27.3 – 78.9 µg/L gemeten drie dagen na reanimatie.
- Een goede neurologische uitkomst bij patiënten wel behandeld met TTM en NSE waarden boven 60 µg/L gemeten twee tot drie dagen na reanimatie lijkt zelden voor te komen.
- Er zijn beperkte aanwijzingen dat de prognostische waarde van NSE voor het voorspellen van slechte neurologische uitkomst bij patiënten behandeld met TTM groter is wanneer deze gemeten wordt twee tot drie dagen na reanimatie vergeleken met één dag na reanimatie.
- Voor patiënten die niet behandeld zijn met TTM wordt voor het voorspellen van slechte neurologische uitkomt op basis van de bloedwaarde S100B een percentage fout-positieven van 0% gevonden voor afkapwaarden variërend van 0,19 – 5,2 µg/L gemeten één dag na reanimatie en 0,12 – 1,25 µg/L gemeten twee dagen na reanimatie.
- Voor patiënten die wel behandeld zijn met TTM wordt voor het voorspellen van slechte neurologische uitkomt op basis van de bloedwaarde S100B een percentage fout-positieven van 0% gevonden voor afkapwaarden variërend van 0,18 – 1,15 µg/L gemeten één dag na reanimatie; 0,30 – 2,15 µg/L gemeten twee dagen na reanimatie; en, volgens één studie, 0,92 µg/L gemeten drie dagen na reanimatie.
Conclusies / Summary of Findings
|
Laag |
Er zijn beperkte aanwijzingen dat een verhoogd S100B gehalte van waarde kan zijn voor het voorspellen van een slechte neurologische uitkomst.
Bronnen: Stammet et al., 2013; Zellner et al., 2013 |
|
Zeer laag |
Er zijn zeer beperkte aanwijzingen dat een S100B gehalte van 0,38 µg/L of meer, gemeten op de derde dag na de reanimatie, een slechte neurologische uitkomst voorspelt met een specificiteit van 100%.
Bronnen: Larsson et al., 2014 |
|
Laag |
Er zijn beperkte aanwijzingen dat de prognostische waarde van S100B gehalte het hoogste is wanneer deze 72 uur na reanimatie wordt gemeten.
Bronnen: Larsson et al., 2014; Pfeifer et al., 2014 |
|
Laag |
Er zijn beperkte aanwijzingen dat een verhoogd NSE-gehalte van waarde kan zijn voor het voorspellen van een slechte neurologische uitkomst.
Bronnen: Leao et al., 2015; Lee et al., 2013; Roger et al., 2015; Stammet et al., 2013; Zellner et al., 2013; Choi et al., 2016 |
|
Zeer laag |
Er zijn zeer beperkte aanwijzingen dat het NSE gehalte gemeten 48 tot 96 uur na reanimatie een slechte neurologische uitkomst kan voorspellen met een specificiteit van 100% wanneer een afkapwaarde wordt gehanteerd ergens tussen 18-151 µg/L, waarbij een sensitiviteit wordt bereikt tussen 23 en 85%.
Bronnen: Larsson et al., 2014; Leao et al., 2015; Lee et al., 2013; Roger et al., 2015; Zellner et al., 2013 |
|
Laag |
Er zijn beperkte aanwijzingen dat de prognostische waarde van NSE-gehalte het hoogste is wanneer deze 48 tot 72 uur na reanimatie wordt gemeten of wanneer er gebruik wordt gemaakt van een combinatie van metingen over meerdere dagen, danwel het verschil in metingen tussen één dag en twee dagen na reanimatie.
Bronnen: Huntgeburth et al., 2014; Lee et al., 2013; Pfeifer et al., 2014; Zellner et al., 2013 |
|
Zeer laag |
Er zijn zeer beperkte aanwijzingen dat een miR-124 gehalte ≥12 gemeten 48 uur na opname een specificiteit van 100% heeft voor het voorspellen van een slechte neurologische uitkomst.
Bronnen: Gilje et al., 2014 |
|
Zeer laag |
Er zijn zeer beperkte aanwijzingen dat een SN gehalte >65 fmol/ml gemeten 0 tot 48 uur na opname een specificiteit van 95% heeft voor het voorspellen van een slechte neurologische uitkomst. Bronnen: Hasslacher et al., 2014 |
|
Zeer laag |
Er zijn zeer beperkte aanwijzingen dat een GFAP-gehalte van ≥0,04 ng/mL gemeten 96 uur na reanimatiereanimatie een specificiteit van 100% heeft voor het voorspellen van een slechte neurologische uitkomst (FPR = 0%).
Bronnen: Larsson et al., 2014 |
Samenvatting literatuur
Recente literatuur
Beschrijving studies
In totaal werden 17 recente studies gevonden die een antwoord geven op de zoekvraag. Van deze studies kijken er zes naar de biomarker S100B (Calderon et al., 2014; Choi et al., 2016; Larsson et al., 2014; Pfeifer et al., 2014; Stammet et al., 2013; Zellner et al., 2013). Vier van deze zes studies betreffen prospectief onderzoek (Calderon et al., 2014; Choi et al., 2016; Larsson et al., 2014; Stammet et al., 2013). In de studie van Calderon et al. (2014) wordt bepaald wat de serum concentratie van S100B is in groepen patiënten waarvan de prognose op basis van klinisch onderzoek is bepaald volgens de Post Cardiac Arrest Category (PCAC) systematiek. De andere studies hanteren de CPC-score als uitkomstmaat. In de studie van Pfeifer et al. (2014) is slechte neurologische uitkomst gedefinieerd als een CPC score van 4-5; in de andere vier studies betreft dit een CPC-score van 3-5. Het moment van bepaling van het serumgehalte S100B varieert in de studies van direct tot vijf dagen na reanimatie. De studies van Larsson en Zellner laten data zien over de waarde van het combineren van S100B met andere biomarkers.
Van de geïncludeerde studies kijken er 14 naar de biomarker NSE (Calderon et al., 2014; Choi et al., 2016; Dragancea et al., 2015; Hasslacher et al., 2014, Huntgeburth et al., 2014; Larsson et al., 2014; Leao et al., 2015; Lee et al., 2013; Oddo et al. 2014; Pfeifer et al., 2014; Roger et al., 2015; Ruivo et al., 2016; Scheel et al., 2013; Stammet et al., 2013; Stammet et al. 2015; Zellner et al., 2013). Van deze studies zijn er zes prospespectief (Calderon et al., 2014; Choi et al., 2016; Hasslacher et al., 2014, Larsson et al., 2014; Leao et al., 2015; Stammet et al., 2013) en één studies betreffen een retrospectieve analyse van een prospectief verzameld dataregister (Scheel et al., 2013). In de studies van Calderon et al. (2014), en Ruivo et al. (2016) wordt de prognostische waarde van NSE alleen beschreven voor het voorspellen van de uitkomst overlijden. In de andere studies wordt de prognostische waarde voor het voorspellen van een slechte neurologische uitkomst, gedefinieerd als een CPC score van 3-5 bekeken, alleen in de studies van Huntgeburth et al. (2014) en Pfeifer et al. (2014) wordt een definitie van CPC score van 4-5 gehanteerd. Het moment van bepaling van het serumgehalte NSE varieert in de studies van direct tot een week na reanimatie. In 4 studies wordt een uitspraak gedaan over de zin van het in serie bepalen van NSE (Calderon, Choi, Huntgeburth, Pfeiffer). In 9 van de 16 studies wordt NSE bestudeerd in combinatie met een andere prognostische test om de beoordelen of NSE de totale prognosestelling beïnvloedt. Het gaat om een veelheid van combinaties: andere biomarkers (Hasslacher et al. 2014; Larsson et al. 2014; Stammet et al. 2013; Zellner et al. 2013), klinisch neurologisch onderzoek (Roger et al. 2015; Zellner et al. 2013), electroencephalografie (Dragancea et al. 2015), somatosensory evoked potential (Dragancea et al. 2015; Scheel et al. 2013), computer tomography en grey-to-white matter ratio (Lee et al. 2013; Scheel et al. 2013), magnetic resonance imaging (Leao et al. 2015) en BIS monitoring (Stammet et al. 2013).
Naast S100B en NSE worden er in de gevonden literatuur nog drie andere neurologische biomarkers onderzocht, iedere biomarker door één studie. Dit betreffen weefselspecifiek microRNA gemeten binnen 6 uur en rond 24 en 48 uur na opname (Gilje et al., 2014), neuropeptide secretoneurin (SN) dagelijks gemeten tot een week na opname (Hasslacher et al., 2014) en GFAP glial fibrillary acidic protein (GFAP) dagelijks gemeten tot en met de 5e dag na reanimatie (Larsson et al., 2014). Alle drie de studies betreffen prospectief onderzoek waarin de prognostische waarde van de biomarkers wordt onderzocht voor het voorspellen van een slechte neurologische uitkomst, gedefinieerd als een CPC score 3-5.
Resultaten studies
S100B
In de studie van Calderon et al. (2014) blijkt het S-100B gehalte op t= 0, 24 en 48 uur, gestratificeerd met behulp van klinische prognose bepaling (PCAC), onvoldoende betrouwbaar voor het voorspellen van overlijden bij volwassen comateuze patiënten na een reanimatie. In de groep met de slechtste prognose op basis van klinisch onderzoek (PCAC IV) waren de S-100B concentraties op t= 72 uur wel significant hoger dan in de andere groepen. Alle patiënten in de groep PCAC IV, met een S100B concentratie >0,414 ng/ml op t= 72 uur, overleden. (FPR 0%; 95%CI 0-80%) In een multivariabele regressie analyse was de S100B concentratie onafhankelijk geassocieerd met overleving. De auteurs concluderen dat de combinatie van S-100B met klinisch onderzoek van aanvullende waarde zou kunnen zijn. Ook wordt er een associatie gevonden tussen aanhoudend verhoogde waardes van S100B na 2 of 3 dagen en overlijden. Vier studies nemen ook aanhoudend hoge serumconcentraties waar bij mensen met een slechte uitkomst (Choi et al., 2016; Larsson et al., 2014; Pfeifer et al., 2014; Zellner et al., 2013). Dit in tegenstelling tot patiënten met een goede uitkomst, waarbij de serumconcentratie snel daalt.
S100B gehaltes gevonden bij patiënten met een slechte neurologische uitkomst zijn significant hoger dan bij patiënten die een goede uitkomst hadden. (Choi, Larsson, Pfeiffer et al., 2014; Stammet et al., 2013; Zellner et a., 2013). In de studie van Larsson et al. (2014) wordt de sensitiviteit van S100B berekend bij een specificiteit van 100%. Deze betreft 30%. Hiervoor wordt een afkapwaarde voor S100B gevonden van 0,38 ng/ml gemeten 72 uur na de reanimatie. In de studie van Stammet wordt een vergelijkbare specificiteit van tussen de 20-30% gevonden, bij een specificiteit van 100%, bij een cut-off waarde van 0.30 ng/ml. Dezelfde studie laat ook zien dat de combinatie van S100b met een andere test (BIS) de accuraatheid van de prognosticatie verbeterde. De andere studies variëren sterk in meetmoment, optimale afkapwaarde en prognostische waarden die gevonden worden. Gevonden afkapwaardes van de geïncludeerde studies variëren tussen 0.12 ng/ml en 1,03 ng/ml
In de studie van Zellner et al. (2013) levert de meting 1 dag na opname betere prognostische waarden op vergeleken met de meting direct na opname. De auteurs concluderen dat in de literatuur aangehouden cut-off waardes onvoldoende nauwkeurige resultaten opleveren, aangezien zij hogere waardes vinden. In de studies van Calderon et al. (2014), Larsson et al. (2014) en Pfeifer et al. (2014) worden dagelijks metingen afgenomen, waarbij de meting van de tweede en derde dag de beste prognostische waarden opleveren.
In de studie van Pfeifer et al. (2014) geen significant verschil waargenomen in de serumlevels van S100B bij patiënten die hypothermie ondergingen vergeleken met patiënten die geen hypothermie ondergingen, waarbij enkel op de 5e dag na reanimatie een significant verschil wordt gevonden. Binnen beide patiëntengroepen worden significante verschillen gevonden in S100B waarde tussen patiënten met een goede neurologische uitkomst en patiënten met een slechte neurologische uitkomst.
NSE
Oddo et al. (2014) beschrijven dat een NSE waarde >75 µg/L niet voorkomt bij patiënten met een goede uitkomst.
De studie van Calderon (2014) laat zien dat patiënten die er klinisch slecht aan toe zijn, en de kans op overlijden hoog is, significant hogere waardes van NSE hebben. Een NSE waarde van >49,5 µg/L en >10,59 µg/L, respectievelijk 48 uur en 72 uur na CPR, waren geassocieerd met overlijden, net als persisterend hoge waardes na 48 en 72 uur. In de studie van Ruivo et al. (2016) waren de NSE waardes significant verschillend tussen de groep overlevenden in vergelijking met de groep van overledenen. Er kon geen significant belangrijke cut-off waarde worden gegeven.
Er wordt consequent een significante verhoging van NSE gehalte gevonden voor patiënten met een slechte neurologische uitkomst vergeleken met de patiënten met een goede neurologische uitkomst (Leao et al., 2015; Lee et al., 2013; Roger et al., 2015; Stammet et al., 2013; Zellner et al., 2013).
Choi et al. (2016) concluderen dat de gemeten NSE waarde 48 uur na de reanimatie voorspellend is voor neurologische uitkomst. Hierbij werd een cut-off waarde gevonden van 31,03 µg/L (specificiteit 96,9%; sensitiviteit 83,9%).
Uit de studie van Lee et al. (2013) en Zellner et al. (2013) blijkt dat NSE gemeten 48 uur na reanimatie betere prognostische waarden oplevert dan wanneer gemeten direct of 24 uur na reanimatie. De studies van Huntgeburth et al. (2014) en Pfeifer et al. (2014) laten nog betere waarden zien wanneer NSE gemeten wordt 72 uur na reanimatie.
Huntgeburth et al. (2014) concluderen een toename van NSE van >4,3 µg/L tussen dag 1 en 2 post-CPR de beste voorspellende waarde had voor slechte neurologische uitkomst (sens 80%, spec 100%, pos voorspellende waarde 100%, neg. voorspellende waarde 86%). Absolute waarden van NSE waren minder betrouwbaar met de hoogste sens (88%) en spec (95%) >36.3 µg/L op dag 3. De auteurs concluderen dat een stijging van NSE tussen dag 1 en 2 voldoet aan de eisen die worden gesteld aan voorspellingstools, namelijk de hoogste positief voorspellende waarde en specificiteit.
Pfeiffer et al. (2014) vinden dat de NSE waarden van patiënten met een goede neurologische prognose pieken na 24 uur post-ROSC, en vervolgens snel dalen naar normaalwaarden. Echter, NSE blijft in de groep met een slechte prognose door stijgen, om te pieken op dag 3 post-ROSC. Op dag 3 voorspelden NSE waardes >40 µg/L een slechte neurologische uitkomst. (sens 74,1%, spec 95,2%, PPV 95,2%, FPR 4,8%)
In de studie van Stammet et al. (2015) wordt een optimale cut-off waarde van 50 µg/L gevonden 72 uur na ROSC, met een specificiteit van 100% en sensitiviteit van 52%. Tevens vinden zij dat een toename van plasma NSE van >6 µg/L van 24 tot 48 uur (spec 94% sens 64%) en 48-72 uur (spec 93% sens 39%) voorspellend is voor neurologische uitkomst.
In de studie van Zellner et al. (2013) geeft een stijging van NSE waarde tussen één dag en twee dagen na reanimatie een sensitiviteit van 89% en een specificiteit van 85% voor het voorspellen van een slechte neurologische uitkomst. In de studie van Huntgeburth et al. (2014) geeft een stijging van NSE-waarde van 4,3 µg/L of meer tussen één dag en twee dagen na reanimatie een sensitiviteit van 80% en een specificiteit van 100%.
Bewijskracht van de literatuur
De bewijskracht van de conclusies die volgen uit bovenstaande literatuur is laag. De individuele studies tonen beperkingen in onderzoeksopzet (zoals retrospectief onderzoek en geen blindering) en zijn daarom van beperkte kwaliteit.
Voor de studies naar de biomarkers S100B en NSE zijn er daarnaast verschillen tussen de studies in definities voor een slechte neurologische uitkomst en in meetmomenten wat de vergelijkbaarheid belemmert. Vanwege de sterke variatie in gevonden afkapwaarden en prognostische waarden (imprecisie) worden de conclusies over de prognostische waarden met nog een niveau omlaag gebracht naar zeer laag.
Voor de studies naar de biomarkers Brain Enriched microRNA (miR-124), Secretoneurin (SN) en Glial Fibrillary Acidic Protein (GFAP) geldt dat de onderzoekspopulatie zeer beperkt is, waardoor ook voor deze conclusies sprake is van ernstige imprecisie en de bewijskracht van de conclusies voor deze biomarkers wordt gegradeerd als zeer laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de prognostische waarde van neurologische biomarkers voor het voorspellen van een slechte neurologische uitkomst bij patiënten met postanoxisch coma?
P: Volwassen patiënten (≥ 18 jaar) die na een reanimatie en cardiopulmonale resuscitatie in een postanoxisch coma zijn.
I: Neurologische biomarkers (NSE en S100B).
C: -
O: Prognostische waarde voor het voorspellen van een slechte neurologische uitkomst.
Relevante uitkomstmaten
De werkgroep achtte de prognostische waarden, zoals de false positive rate (FPR; 1 – specificiteit), sensitiviteit, positief voorspellende waarde (PVW), negatief voorspellende waarde (NVW) voor het voorspellen van een slechte neurologische uitkomst) voor de besluitvorming kritieke uitkomstmaten.
De indeling voor goede en slechte uitkomst zoals beschreven in de inleiding is toegepast. Als studies andere schaal dan de CPC of de GOS gebruikten dan werden de uitkomsten “vertaald” naar de CPC indeling.
Zoeken en selecteren (Methode)
In de database Medline (via OVID) is met relevante zoektermen gezocht naar systematische reviews en studies die de prognostische waarde van neurologische biomarkers onderzochten bij patiënten in een postanoxisch coma. We hebben de zoekactie beperkt tot studies gepubliceerd na een systematische literatuurstudie over dit onderwerp (Sandroni et al., 2014). De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
De literatuurzoekactie leverde 120 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: betreft primair onderzoek of een systematische review van primair onderzoek naar de waarde van biomarkers bij volwassen comateuze patiënten na een reanimatie. Op basis van titel en abstract werden in eerste instantie 32 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 15 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 17 studies definitief geselecteerd.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Referenties
- Calderon LM, Guyette FX, Doshi AA, Callaway CW, Rittenberger JC; Post Cardiac Arrest Service. Combining NSE and S100B with clinical examination findings to predict survival after resuscitation from cardiac arrest. Resuscitation. 2014 Aug;85(8):1025-9.
- Choi S, Park K, Ryu S, Kang T, Kim H, Cho S, Oh S. Use of S-100B, NSE, CRP and ESR to predict neurological outcomes in patients with return of spontaneous circulation and treated with hypothermia. Emerg Med J. 2016 Oct;33(10):690-5.
- Dragancea I, Backman S, Westhall E, Rundgren M, Friberg H, Cronberg T. Outcome following postanoxic status epilepticus in patients with targeted temperature management after cardiac arrest. Epilepsy Behav. 2015 Aug;49:173-7.
- Gilje P, Gidlöf O, Rundgren M, Cronberg T, Al-Mashat M, Olde B, Friberg H, Erlinge D. The brain-enriched microRNA miR-124 in plasma predicts neurological outcome after cardiac arrest. Crit Care. 2014 Mar 3;18(2):R40.
- Hasslacher J, Lehner GF, Harler U, Beer R, Ulmer H, Kirchmair R, Fischer-Colbrie R, Bellmann R, Dunzendorfer S, Joannidis M. Secretoneurin as a marker for hypoxic brain injury after cardiopulmonary resuscitation. Intensive Care Med. 2014 Oct;40(10):1518-27.
- Huntgeburth M, Adler C, Rosenkranz S, Zobel C, Haupt WF, Dohmen C, Reuter H. Changes in neuron-specific enolase are more suitable than its absolute serum levels for the prediction of neurologic outcome in hypothermia-treated patients with out-of-hospital cardiac arrest. Neurocrit Care. 2014 Jun;20(3):358-66.
- Kamps MJ, Horn J, Oddo M, et al. Prognostication of neurologic outcome in cardiac arrest patients after mild therapeutic hypothermia: a meta-analysis of the current literature. Intensive Care Med 2013.
- Larsson IM, Wallin E, Kristofferzon ML, Niessner M, Zetterberg H, Rubertsson S. Post-cardiac arrest serum levels of glial fibrillary acidic protein for predicting neurological outcome. Resuscitation. 2014 Dec;85(12):1654-61.
- Leão R, Ávila P, Cavaco R, Germano N, Bento L. Therapeutic hypothermia after cardiac arrest: outcome predictors. Rev Bras Ter Intensiva. 2015;27(4):322-332
- Lee BK, Jeung KW, Lee HY, Jung YH, Lee DH. Combining brain computed tomography and serum neuron specific enolase improves the prognostic performance compared to either alone in comatose cardiac arrest survivors treated with therapeutic hypothermia. Resuscitation. 2013 Oct;84(10):1387-92.
- Oddo M, Rossetti AO. Early multimodal outcome prediction after cardiac arrest in patients treated with hypothermia. Crit Care Med. 2014 Jun;42(6):1340-7. doi: 10.1097/CCM.0000000000000211..
- Pfeifer R, Franz M, Figulla HR. Hypothermia after cardiac arrest does not affect serum levels of neuron-specific enolase and protein S-100b. Acta Anaesthesiol Scand. 2014 Oct;58(9):1093-100.
- Roger C, Palmier L, Louart B, Molinari N, Claret PG, de la Coussaye JE, Lefrant JY, Muller L. Neuron specific enolase and Glasgow motor score remain useful tools for assessing neurological prognosis after out-of-hospital cardiac arrest treated with therapeutic hypothermia. Anaesth Crit Care Pain Med. 2015 Aug;34(4):231-7.
- Ruivo C, Jesus C, Morais J, Viana P. Predictors of death among cardiac arrest patients after therapeutic hypothermia: A non-tertiary care center's initial experience. Rev Port Cardiol. 2016 Jul-Aug;35(7-8):423-31.
- Sandroni C, Cariou A, Cavallaro F, Cronberg T, Friberg H, Hoedemaekers C, Horn J, Nolan JP, Rossetti AO, Soar J. Prognostication in comatose survivors of cardiac arrest: an advisory statement from the European Resuscitation Council and the European Society of Intensive Care Medicine. Resuscitation. 2014 Dec;85(12):1779-89.
- Sandroni C, Cavallaro F, Callaway CW, et al. Predictors of poor neurological outcome in adult comatose survivors of cardiac arrest: a systematic review and meta-analysis. Part 1: patients not treated with therapeutic hypothermia. Resuscitation 2013a;84:131023.
- Sandroni C, Cavallaro F, Callaway CW, et al. Predictors of poor neurological outcome in adult comatose survivors of cardiac arrest: a systematic review and meta-analysis. Part 2: Patients treated with therapeutic hypothermia. Resuscitation 2013b;84:132438.
- Scheel M, Storm C, Gentsch A, Nee J, Luckenbach F, Ploner CJ, Leithner C. The prognostic value of gray-white-matter ratio in cardiac arrest patients treated with hypothermia. Scand J Trauma Resusc Emerg Med. 2013 Apr 8;21:23.
- Stammet P, Collignon O, Hassager C, Wise MP, Hovdenes J et al.; TTM-Trial Investigators. Neuron-Specific Enolase as a Predictor of Death or Poor Neurological Outcome After Out-of-Hospital Cardiac Arrest and Targeted Temperature Management at 33°C and 36°C. J Am Coll Cardiol. 2015 May 19;65(19):2104-14. doi: 10.1016/j.jacc.2015.03.538. Erratum in: J Am Coll Cardiol. 2015 Aug 25;66(8):983. PubMed PMID: 25975474.
- Stammet P, Dankiewicz J, Nielsen N, Fays F, Collignon O et al.; Target Temperature Management after Out-of-Hospital Cardiac Arrest (TTM) trial investigators. Protein S100 as outcome predictor after out-of-hospital cardiac arrest and targeted temperature management at 33 °C and 36 °C. Crit Care. 2017 Jun 20;21(1):153. doi: 10.1186/s13054-017-1729-7.
- Wiberg S, Hassager C, Stammet P, Winther-Jensen M, Thomsen JH, Erlinge D, Wanscher M, Nielsen N, Pellis T, Åneman A, Friberg H, Hovdenes J, Horn J, Wetterslev J, Bro-Jeppesen J, Wise MP, Kuiper M, Cronberg T, Gasche Y, Devaux Y, Kjaergaard J. Single versus Serial Measurements of Neuron-Specific Enolase and Prediction of Poor Neurological Outcome in Persistently Unconscious Patients after Out-Of-Hospital Cardiac Arrest - A TTM-Trial Substudy. PLoS One. 2017 Jan 18;12(1):e0168894.
- Zellner T, Gärtner R, Schopohl J, Angstwurm M. NSE and S-100B are not sufficiently predictive of neurologic outcome after therapeutic hypothermia for cardiac arrest. Resuscitation 84. 2013 13821386
Evidence tabellen
Evidence-table for prognostic studies
Research question: What is the prognostic value of neurologic biomarkers for predicting outcome of patients in post anoxic coma?
|
Study reference |
Study characteristics |
Patient/study characteristics |
Prognostic factor(s) |
Follow-up
|
Outcome measures and effect size |
Comments |
||||
|
Sandroni, 2014 |
Type of study: Systematic review |
Inclusion criteria: All studies on adult (≥16 years) patients who were comatose following resuscitation from cardiac arrest and were treated with TH were considered for inclusion. Patients defined as unconscious, unresponsive, or having a Glasgow Coma Scale score (GCS)13 ≤8 were considered as comatose.
Exclusion criteria: Studies including non-comatose patients or patients in hypoxic coma from causes other than cardiac arrest (e.g., respiratory arrest, carbon monoxide intoxication, drowning and hanging) were excluded, except when a subpopulation of cardiac arrest patients could be evaluated separately
N= 92 (50 about patients not treated with hypothermia, 37 about patients treated with hypothermia, 5 additional studies)
24 studies on biomarkers |
Prognostic factors: clinical examination, electrophysiology, biomarkers and imaging
Timing of measurement: ≤7 days
|
Endpoint of follow-up: Varying from 14 days - 48 months or ICU discharge or hospital discharge.
|
Poor neurological outcome was defined as a Cerebral Performance Category (CPC) of 3 to 5 (severe neurological disability, persistent vegetative state or death) as opposed to CPC 1–2 (absent, mild or moderate neurological disability.
|
|
||||
|
Calderon, 2014 |
Type of study: prospective study
Setting: University hospital
Country: US
Source of funding: NR. Authors have no conflict of interest |
Inclusion criteria: age >18 yr, cardiac arrest.
Exclusion criteria: pregnancy, prisoner, withdrawal of care <6h of hospital arrival, pre-existing do-not resuscitate order, re-arrest with unsuccessful resuscitation <6h of hospital arrival and arrest due to trauma. Subjects following commands after resuscitation (PCAC I) or not having TH were also excluded.
Therapeutic hypothermia? (yes/no): yes
N= 72
Mean age ± SD: 59±16
Sex: 58%M (n=42)
|
Prognostic factor: NSE and S100B
Timing of measurement: 0, 6, 12, 24, 48 and 71h after successful resuscitation from cardiac arrest
|
Endpoint of follow-up: - Illness severity (Pittsburgh Cardiac Arrest Category (PCAC) on hospital arrival - Survival at hospital discharge (median 8 dys)
For how many participants were no complete outcome data available? N (%): 0
|
NSE Rising NSE within each PCAC group was associaterd with death, while decreasing NSE was associated with survival.
NSE at 0h, NSE at 24 h, and change in NSE were not reliable predictors for death.
NSE >49,5 ng/mL in PCAC II subjects and >10.44 ng/mL in PCAC IV subjects at 48h resulted in 100% death.
NSE > 10.59 in PCAC IV subjects at 72h resulted in 100% death.
S100B Persistently elevated levels of S100B were associated with death, while decreasing levels were associated with survival.
S100B at 0h, 24 or 48h, and change in S100B were not reliable predictors for death.
S100B>0.414 ng/mL in PCAC IV subjects at 72 h resulted in 100% death. |
Poor outcome was defined as death
Illness severity was assessed at arrival using PCAC: PCAC I: awake PCAC II: moderate coma PCAC III: moderate coma + moderate-severe cardiopulmonary dysfunction PCAC IV: deep coma |
||||
|
Choi, 2016 |
Type of study: prospective study
Setting: University hospital
Country: Korea
Source of funding: NR. No competing interests |
Inclusion criteria: Patients who experienced ROSC after OHCA and underwent TH
Exclusion criteria: age <18 years old, arrest after trauma and marked signs of infection.
Therapeutic hypothermia? (yes/no): Yes
N= 119
Mean age ± SD: 53.8±15.6
Sex: 81 M (68,1%)
|
Prognostic factor: NSE S100B
Timing of measurement: at ROSC, 24 and 48 hours after ROSC
|
Endpoint of follow-up: Hospital discharge
For how many participants were no complete outcome data available? N (%): 0
|
Prognostic value of NSE 48hr post-ROSC Cut-off: 31.03 ng/mL Sens: 83.9% (95% CI 66.3 to 94.5) Spec: 96.9% (95% CI 83.8 to 99.9)
Prognostic value of S100b at 24hr post-ROSC Cut-off: 0.12 g/L Sens: 95% (95% CI 86.1 to 99.0) Spec: 75.6% (95% CI 60.5 to 87.1)
The S-100B level decreased until 48 hours post-ROSC in the good neurological outcome group, and it increased until 24 hours post-ROSC in the poor neurological outcome group, after which it decreased until 48 hours post-ROSC.
The NSE values decreased after 24 hours in the good neurological outcome group and increased until 48 hours in the poor neurological outcome group. |
|
||||
|
Dragancea, 2015 |
Type of study: Retrospective study
Setting: University hospital
Country: Sweden
Source of funding: NR. No conflicts of interest |
Inclusion criteria: Consecutive comatose survivors of CA, regardless of initial rhythm and without contraindications for hypothermia and with detected or suspected electrographic status epilepticus (ESE)
Exclusion criteria: contraindications for TH
Therapeutic hypothermia? (yes/no): yes
N= 41 with ESE
Median age (IQR): 68 (60-72)
Sex: 68% M (n= 28/41)
|
Prognostic factor: NSE
Timing of measurement: 48hr after CA
|
Endpoint of follow-up: 6 months after CA
For how many participants were no complete outcome data available? N (%): 43/170 (18 not receiving TH, 11 regained consciousness, 13 lacking cEEG, 1 lost to follow-up)
|
NSE outcome
Patients with DC/BS EEG pattern: median 110 (IQR 49-157) Patients with C/NC EEG pattern: median 30 (IQR: 22-44) P= 0.038
Survivors: median 22 (IQR 18-34) Nonsurvivors: median 47 (IQR 26-82) P= 0.06
|
Only patients with postanoxic status epilepticus after cardiac arrest
NSE results are not reported for patients with good vs. poor neurological outcome (only for survivors vs. nonsurvivors) Predictive value of NSE was not calculated. Data are not reported. |
||||
|
Gilje, 2014 |
Type of study: prospective study
Setting: University hospital
Country: Sweden
Source of funding: Supported by the Swedish Heart and Lung Foundation, the Swedish Scientific Research Council, ALI, the European Union INTERREG IVA programme and Skane University Hospitale Funcds.
Authors declare they have no competing interest. |
Inclusion criteria: Unconscious patients resuscitated after cardiac arrest, regardless of location or initial cardiac rhythm.
Exclusion criteria: Unwitnessed asystole, intracranial bleeding on CT.
Therapeutic hypothermia? (yes/no): Yes
N= 65
Median age (range): CPC 1-2: 65 (15-81) CPC 3-5: 72 (14-87)
Sex: CPC 1-2: 74%M (n=26) CPC 3-5: 53%M (n=16)
|
Prognostic factor: Selected tissue-specific microRNAs (miRNA) levels
Timing of measurement: <6 hr, at 24 ±4 hr and at 48 ±4 hr after admission
|
Endpoint of follow-up: 6 months after cardiac arrest
For how many participants were no complete outcome data available? N (%): 27/92 (25 missing samples, 2 unknown outcomes and/or missing patient data)
|
<6 hr miRNA levels were not sign. different between outcome groups (poor neurological outcome: CPC 3-5 vs. good neurological outcome: CPC 1-2).
miR-124 levels at admission were elevated tenfold compared to healthy controls.
At 24 hr miR-124 was elevated 14-fold in patients with poor outcome, compared with those with favourable outcome (P<0,00001, AUC 0.87). Cutoff of 44 yielded 100% spec and 30% sens for poor neurological outcome. Cutoff of 12 yielded 97% spec and 53% sens.
At 48 hr miR-146a, miR-122, miR208b, miR-9 and miR-128 levels did not differ between outcome groups.
miR-124 was elevated 24-fold in patients with poor outcome, compared with those with favourable outcome (P<0,00001, AUC 0.89). Cutoff of 12 yielded 100% spec and 63% sens for poor neurological outcome.
Analysis for NSE at 24 and 48 hr revealed AUCs similar to results of miR-124. Combining miR-124 and NSE did not improve diagnostic accuracy. |
|
||||
|
Hasslacher, 2014 |
Type of study: prospective study
Setting: University hospital
Country: Austria
Source of funding: NR. No conflicts of interest. |
Inclusion criteria: Adult patients, admitted to medical ICU from September 2008 – April 2013 after successful cardiopulmonary resuscitation
Exclusion criteria: Neuroendocrine tumour stroke, intracranial haemorrhage or trauma as cause of CA as well as life expectancy <24 h determined by treating physician.
Therapeutic hypothermia? (yes/no): Partly (44%)
N= 134
Median age (range): 64 (53-75)
Sex: 74% M (n=99)
|
Prognostic factor: neuropeptide secretoneurin (SN)
Timing of measurement: 0-24 hr (day 0), 24-48 hr (day 1), 48-72 hr (day 2), 72-96 hr (day 3), 96-120 hr (day 4), 120-144 hr (day 5) and 144-168 hr (day 6)
|
Endpoint of follow-up: discharge from hospital or a long-term care facility
For how many participants were no complete outcome data available? N (%): 18/152 (4 missing follow-up, 4 missing values, 10 death due to non-neurological causes)
|
SN peaked in all patient at day 0 (0-24 hr): 54 (28-87) fmol.ml compared to 9 fmol/ml in healthy volunteers. During following days SN decreased to almost normal values.
Day 0 Good outcome (CPC 1-2): 38 (23-68) fmol/ml SN Poor outcome (CPC 3-5): 75 (43-111) fmol/ml SN P<0.001
Differences were also significant at day 1.
SN 0-48 hr Cut off: >65 fmol/ml: AUC 0.753 (0.665 – 0.841) Sens: 38% Spec: 95%
SN<48h and NSE<72h were both significantly associated with poor outcome when adjusted for age, first monitored rhythm, time to ROSC, bystander initiated CPR, MTH and lactate. The two biomarkers combined reached:
Kinetics of SN was not influences by TH. Levels of SN or NSE were not significantly different between TH and non Th groups.
|
|
||||
|
Huntgeburth, 2014 |
Type of study: retrospective study
Setting: University hospital
Country: Germany
Source of funding: NR. No conflicts of interest |
Inclusion criteria: Patients with restoration of spontaneous circulation (ROSC) after out-of hospital cardiac arrest (OHCA), Glasgow-coma scale <8 and no contraindications.
Exclusion criteria: death by non neurological causes
Therapeutic hypothermia? (yes/no): yes
N= 73
Mean age (range): 61.5 (26-86)
Sex: 88% M (n=64)
|
Prognostic factor: Changes in serum NSE
Timing of measurement: 0-24 hr (day 1), 24-48 hr (day 2), 48, 72 hr (day 3) after cardiac arrest.
|
Endpoint of follow-up: 2 months after CPR
For how many participants were no complete outcome data available? N (%): 0
|
Prediction of poor outcome (CPC 4-5):
NSE 36.8 ng/mL at day 1 Sens: 70% Spec: 62%
NSE 42.4 ng/mL at day 2 Sens: 85% Spec: 86%
NSE 36.3 ng/mL at day 3 Sens: 88% Spec: 95%
ΔNSE ≥ +4.3 ng/mL between day 1 and 2 Sens: 80% Spec: 100%
ΔNSE ≥ -6.2 ng/mL between day 2 and 3 Sens: 63% Spec: 81% |
Poor outcome was defined as CPC 4-5 |
||||
|
Larsson, 2014 |
Type of study: prospective study
Setting: three hospitals (one university, two general county)
Country: Sweden
Source of funding: Department of surgical sciences, anaesthesiologie & intensive care, Uppsala university, Swedish research council, Swedish state support for clinical research, the Knut and Alice Wallenberg Foundation
|
Inclusion criteria: Cardiac arrest with successful restoration of spontaneous circulation (ROSC), syst blood pressure ≥80 mmHg >5 min and unconscious with GSC, treated with TH and age >18 yr.
Exclusion criteria: NR
Therapeutic hypothermia? (yes/no): yes
N= 125
Mean age ± SD: 66±14
Sex: 66%M (n=83)
|
Prognostic factor: NSE S100B GFAP (glial fibrillary acidic protein)
Timing of measurement: ASAP, 24, 48, 72, 96 and 108 hr after cardiac arrest
|
Endpoint of follow-up: 6 months after arrest
For how many participants were no complete outcome data available? N (%): 0
|
Predictive values for predicting poor neurological outcome (CPC 3-5) GFAP at 96 hr Cut-off: 0.04 ng/mL Sens: 32% Spec: 100%
NSE at 96 hr Cut-off: 18µg/L Sens: 55% Spec: 100%
S100B at 72 hr Cut-off: 0.38 µg/L Sens: 30% Spec: 100% |
|
||||
|
Leao, 2015 |
Type of study: prospective study
Setting: general hospital
Country: Portugal
Source of funding: NR. no conflicts of interest |
Inclusion criteria: Adult patients with cardiac arrest and subjected to hypothermia protocol.
Exclusion criteria: NR
Therapeutic hypothermia? (yes/no): yes
N= 67
Mean age ± SD: 62.6 ±13
Sex: 73%M (n=49)
|
Prognostic factor: NSE
Timing of measurement:72 hr after arrest
|
Endpoint of follow-up: 6 months after arrest
For how many participants were no complete outcome data available? N (%): 0
|
NSE outcome Good outcome (CPC 1-2): 23.33 ng/mL (SD 17.75) Poor outcome (CPC 3-5): 103.36 ng/mL (SD 75.80) P= 0.02
Predictive value NSE Cut off: >58 ng/mL Sens: 79% Spec: 100%
|
|
||||
|
Lee, 2013 |
Type of study: retrospective study
Setting: University hospital
Country: Korea
Source of funding: NR. No conflict of interest |
Inclusion criteria: Patients >16 yr treated with TH following cardiac arrest.
Exclusion criteria: different TH protocol regarding target temperature (<32 or >34) or hypothermia duration, interrupted TH due to haemodynaic instability, recurrent lethal arrhythmia or death, neither brain CT nor serum NSE value was obtained after ROSC.
Therapeutic hypothermia? (yes/no): yes
N= 224
Median age (IQR): 57 (45 to 69)
Sex: 66.5%M (n=149)
|
Prognostic factor: NSE
Timing of measurement: Immediately after return of spontaneous circulation (ROSC) 24hr after ROSC 48 hr after ROSC
|
Endpoint of follow-up: hospital discharge
For how many participants were no complete outcome data available? N (%): 5/224 (no brain CT and NSE, but still included in analysis)
|
NSE immediately after ROSC
NSE outcome Good neurological outcome (CPC 1-2): 17.1 (10.3 – 27.1) Poor neurological outcome (CPC 3-5): 23.5 (17.1-33.3) P= 0.003
Predictive value NSE Cut off: 62 ng/mL Sens: 7.8% Spec: 100%
NSE 24hr after ROSC
NSE outcome Good neurological outcome (CPC 1-2): 18.0 (10.8-31.2) Poor neurological outcome (CPC 3-5): 41.7 (25.3-82.7) P= <0.001
Predictive value NSE Cut off: 80.8 ng/mL Sens: 27.3% Spec: 100%
NSE 48hr after ROSC
NSE outcome Good neurological outcome (CPC 1-2): 13.2 (8.0-22.5) Poor neurological outcome (CPC 3-5): 67.4 (27.1-128.5) P= <0.001
Predictive value NSE Cut off: 52.7 ng/mL Sens: 60.2% Spec: 100%
|
|
||||
|
Pfeifer, 2014 |
Type of study: retrospective study
Setting: University hospital
Country: Germany
Source of funding: No funding. No competing interests. |
Inclusion criteria: comatose adult patients suffered in- or out-of-hospital nontraumatic cardiac arrest.
Exclusion criteria: patients who reacted adequately during 1hr observation phase without sedation and patients who died during first 48h after CA.
Therapeutic hypothermia? (yes/no): Partly (140 yes, 61 received comparable intensive care therapy without hypothermia)
N= 140 TH treated (HG), 61 not TH treated (NG)
Mean age ± SD: HG: 63.2 ±14.2 NG: 67.8 ±14.4
Sex: HG: 78,6% M (n=110) NG: 59% M (n=36)
|
Prognostic factor: NSE S100b
Timing of measurement: Every day, starting immediately on admission, until 5 days after ROSC
|
Endpoint of follow-up: 4 weeks
For how many participants were no complete outcome data available? N (%): 0
|
NSE level was significantly higher in the HG group compared to the NG group, only on day 4.
S100b level was significantly higher in the HG group compared to the NG group, only on day 5.
There was a trend for both serum levels to be lower in the NG group.
HG group:
NSE and S100b levels were significantly higher for patients with poor neurologic outcome compared to those with good neurologic outcome on each day.
NG group: NSE and S100b levels were significantly higher for patients with poor neurologic outcome compared to those with good neurologic outcome on each day, except day 1.
Complete group:
Good outcome: NSE and S100b levels peaked after 24 h and declined to normal after 48 h Poor outcome: NSE and S100b levels increased continuously and peaked at day 3.
Discriminative power of ROC curves is highest on third day following ROSC for both serum levels.
Predictive value of NSE 3rd day Cut-off: ≥40 ng/mL Sens: 74.1% Spec: 95.2%
Predictive value of S100b 3rd day Cut-off: ≥1.03 µg/L Sens: 57.8% Spec: 95.6%
|
Poor outcome was defined as CPC 4-5 |
||||
Roger, 2015 |
Type of study: retrospective study
Setting: University hospital
Country: France
Source of funding: NR. No conflicts of interest |
Inclusion criteria: Adult patients successfully resuscitated following out-of-hospital cardiac arrest and admitted to ICU.
Exclusion criteria: Died before admission
Therapeutic hypothermia? (yes/no): yes
N= 130
Mean age ± SD: 63.9 ± 13.7
Sex: 70% M (n=90)
|
Prognostic factor: NSE
Timing of measurement: Between day 2 and 3 (around 72 hr after ROSC)
|
Endpoint of follow-up: 6 month
For how many participants were no complete outcome data available? N (%): 50/130 (dies in the first 3 days
|
NSE outcome Good neurological outcome (CPC 1-2): 14.4 ng/mL ± 7.4 Poor neurological outcome (CPC 3-5): 158.5 ng/mL ± 163.7 P= <0.0001
Predictive value of NSE Cut-off: >28.8 µg/L Sens: 85% Spec: 100%
NSE >28.8 µg/L and Glasgow Motor Score (GCS-M) <3 gave 100% sens and 100% spec
NSE >28.8 µg/L and absent pupillary reflex gave 100% sens and 100% spec
|
|
||||
|
Rossetti, 2017 |
Type of study: retrospective analysis of prospective registries
Setting: University hospital and Mayo Clinics
Country: Switzerland and USA
Source of funding: Swiss National Science Foundation, Austin Epilepsy Care Center, GW Pharma (not related to this project), GRifols (co-investigator of a drug study not related to this projected), David J Hawk Family charitable gift. |
Inclusion criteria: adults receiving TTM in ICU for hypoxic-ischemic encephalopathy following CA, with both early and late EEG and functional outcome at 3 months.
Exclusion criteria: Missing EEG data
Therapeutic hypothermia? (yes/no): yes
N= 357 (Lausanne: 260, Mayo clinic: 97)
Mean age ± SD: Lausanne: 61.8 ± 14.5 Mayo Clinic: 61.2 ± 11.3
Sex: Lausanne: 71.9% M (n=187) Mayo Clinic: 70% M (n=68)
|
Prognostic factor: NSE
Timing of measurement: Within 72 hr
|
Endpoint of follow-up: 3 month
For how many participants were no complete outcome data available? N (%): 0
|
Predictive value of NSE for good neurologic outcome (CPC 1-2) Cut-off: <75 µg/L Sens: 100% Spec: 38.1%
|
Predictive value for 100% sens instead of 100% spec is calculated. |
||||
|
Ruivo, 2016 |
Type of study: retrospective study
Setting: general hospital
Country: Portugal
Source of funding: NR. No conflicts of interest |
Inclusion criteria: comatose adults admitted to ICU with ROSC after cardiac arrest, treated by TH
Exclusion criteria: patients without known time of CA, in comatose state before CA or with terminal illness that preceded CA.
Therapeutic hypothermia? (yes/no): yes
N= 15
Mean age ± SD: 47.3 ±14.3
Sex: 66.6% M (n=10)
|
Prognostic factor: NSE
Timing of measurement: <72 hr of CA
|
Endpoint of follow-up: 6 months after discharge
For how many participants were no complete outcome data available? N (%): 0
|
NSE outcome Survivors: 42.6 ±35.1 Non-survivors: 138.4 ±133.4 P= 0.020
Predictive value of NSE for mortality Cut off: >76 µg/L OR: 7.5 (95%CI 0.76-74.16) P=0.082 |
NSE values for good neurologic outcome (CPC 1-2) and poor neurologic outcome (CPC 3-5) are not presented |
||||
|
Scheel, 2013 |
Type of study: retrospective analysis of prospective registry
Setting: University hospital
Country: Germany
Source of funding: Supported by the Friedrich C. Luft Clinical Scientist Pilot Program, funded by Volkswagen Foundation and Charité Foundation |
Inclusion criteria: Patients resuscitated from cardiac arrest, treated with mild hypothermia in accordance with established guidelines and had received cranial CT within seven days after arrest.
Exclusion criteria: Findings that would have biased measurement of Housfield units and GWR calculation.
Therapeutic hypothermia? (yes/no): yes
N= 98
Median age (IQR): 61 (47-72.2)
Sex: 66.3% M (n=65)
|
Prognostic factor: NSE
Timing of measurement: 72 hr after admission to ICU
|
Endpoint of follow-up: discharge from ICU
For how many participants were no complete outcome data available? In 14 out of 98 patients NSE serum levels were not determined
|
Predictive value of NSE for poor neurologic outcome (CPC 3-5) Cut off: >97 µg/L Sens: 53.1% Spec: 100% |
NSE cut-off was set beforehand. |
||||
|
Stammet, 2013 |
Type of study: Prospective study
Setting: Academic tertiary care hospital
Country: Luxembourg
Source of funding: NR |
Inclusion criteria: patients with cardiac arrest, unconscious on admission with a Glasgow coma score below 8.
Exclusion criteria: no blood sample to measure biomarkers or enrolled in another ongoing study
Therapeutic hypothermia? (yes/no): yes
N=75
Median age (range): Good outcome: 61 (29-82) Poor outcome: 69 (38-83)
Sex: Good outcome: 83% M (34/41) Poor outcome: 68% (23/34)
|
Prognostic factor: NSE S100b
Timing of measurement: 48hr after CA
|
Endpoint of follow-up: 6 months after discharge from ICU
For how many participants were no complete outcome data available? N (%): 0
|
NSE and S100b were significantly higher in patients with poor outcome compared to patients with good outcome (4-fold and 10-fold respectively; p<0.001)
Predictive value of NSE was not calculated, because NSE failed to improve discrimination of patients misclassified by a model including BIS and S100b
Predictive value of S100b
Cut off: 0.03µg/L Sens: 76% Spec: 78%
Cut off: 0.3µg/L Sens: NR Spec: 100%
|
|
||||
|
Wiberg, 2017 |
Type of study: post-hoc analysis of a randomized, parallel-group trial
Setting: multi-center study
Country:
Source of funding: funded by independent research grants from the Swedisch Heart Lung Foundation; Arbetsmarknadens Fo¨rsa¨kringsaktiebolag Insurance Foundation; Swedish Research Council; regional research support, Region Skåne; governmental funding of clinical research within the Swedish National Health Services; Thelma Zoega Foundation; Krapperup Foundation; Thure Carlsson Foundation; HansGabriel and Alice Trolle-Wachtmeister Foundation for Medical Research; Skåne University Hospital, Sweden; TrygFonden, Denmark; the European Clinical Research Infrastructures Network; and the European Critical Care Research Network.
There was no commercial funding. Funding organizations neither had any access to the data nor had any influence on the analysis or interpretation.
Authors declare no competing interests exist. |
Inclusion criteria: comatose adult patients admitted after out-of-hospital cardiac arrest of presumed cardiac origin with Glasgow coma scale below 8 and sustain ROSC for more than 20 minutes.
Exclusion criteria: Unwitnessed CA with an initial rhythm of asystole, sustained cardiac shock and lack of randomization after 240 minutes after ROSC
Therapeutic hypothermia? (yes/no): Yes, at either 33 or 36 degrees.
N= 685
Mean age: 63.5
Sex: 81% M
|
Prognostic factor: NSE
Timing of measurement: 24, 48 and 72 hrs after ROSC.
|
Endpoint of follow-up: 180 days after arrest
For how many participants were no complete outcome data available? N (%): 0
|
Zie *
There were no significant differences in NSE at any time point for patients treated with TH 33 or TH 36 degrees.
In patients dying before day 3, the geometrical area under the NSE curve yielded an AUC of 0.84 and the combination of all three NSE measures yielded an AUC of 0.87 for prediction of poor outcome (p = .0004).
NSE proved to be a poor predictor of poor outcome in patients regaining consciousness within 3 days but having CPC 3-5 180 days after arrest (AUC = 0.62 for NSE measured at 48 hours). NSE proved to be an equally robust predictor of poor outcome in patients remaining unconscious at day three after OHCA as in the total population of OHCA patients (AUC 0.83– 0.88 versus 0.84–0.87), even after adjustment for confounding factors.
NSE measurement at 24 hours was significantly inferior to measurement at 48 hours (AUC 0.71 versus 0.83, p <.0001, Table 2A). NSE measurement at 72 hours achieved a nonsignificant higher AUC than a measurement at 48 hours (AUC 0.85 versus 0.83, p = .05), however this difference was no longer present after adjustment for confounding factors (AUC 0.92 versus 0.92, p = .42).
A combination of all three NSE measurements yielded the highest discovered AUC (0.88, p = .0002). Easily applicable combinations of serial NSE measurements did not significantly improve prediction over a single measurement at 48 hours (AUC 0.58–0.84 versus 0.83). |
|
||||
|
Zellner, 2013 |
Type of study: retrospective study
Setting: University hospital
Country: Germany
Source of funding: No additional funding was received. No conflicts of interest declared. |
Inclusion criteria: Patients ≥18 yr with coma after cardiac arrest with ROSC, treated by TH and survived the first night in ICU.
Exclusion criteria: Patients with do-not-rususcitate/intubate orders after resuscitation and patients with in-hospital cardiac arrest in operating room, catheterization lab, on ICU or with telemetry.
Therapeutic hypothermia? (yes/no): yes
N= 123
Mean age ± SD: 63 ± 14
Sex: 79,9% M (n=98)
|
Prognostic factor: NSE S100b
Timing of measurement: NSE: On day 1 and day 2 post-ROSC S100b: On admission and on day 1 post ROSC.
|
Endpoint of follow-up: 6 months after discharge
For how many participants were no complete outcome data available? N (%): 0
|
S100b Serum levels on both days were significantly associated with poor neurologic outcome (both p=0.004)
Prognostic value day 0: Cut-off: 0.614 µg/L Sens: 90% Spec: 31% Cut-off: 5.480 µg/L Sens: 18% Spec: 90%
Prognostic value day 1: Cut-off: 0.120 µg/L Sens: 90% Spec: 35% Cut-off: 0.462 µg/L Sens: 50% Spec: 90%
NSE Serum levels on both days were significantly associated with poor neurologic outcome (p=0.020 and P<0.001)
Prognostic value day 1: Cut-off: 17.0 µg/L Sens: 90% Spec: 26% Cut-off: 41.1 µg/L Sens: 57% Spec: 90% Cut-off: 151.5 µg/L Sens: 13% Spec: 100%
Prognostic value day 2: Cut-off: 18.1 µg/L Sens: 90% Spec: 40% Cut-off: 53.1 µg/L Sens: 61% Spec: 90% Cut-off: 151.5 µg/L Sens: 23% Spec: 100%
NSE > 33 µg/: on day 1 or 2: Sens: 84% Spec: 76%
NSE increase day 1-2: Sens: 89% Spec: 85% NSE & S100b
NSE >41.1 µg/ and S100b > 0.462 µg/L on day 1 Sens: 29% Spec: 96% |
|
||||
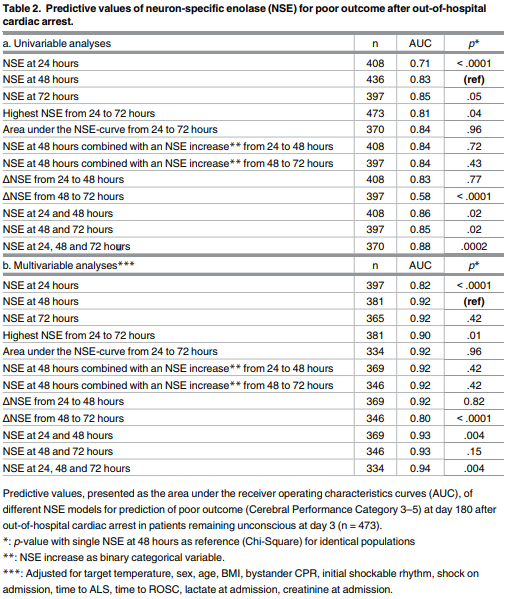
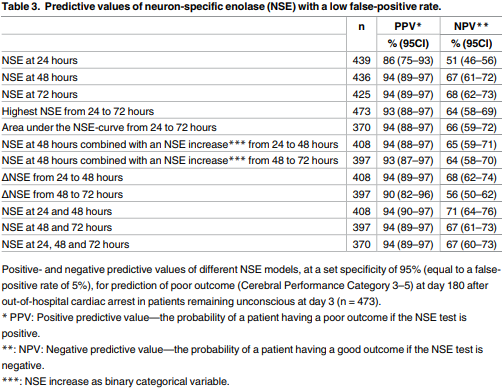
Table of quality assessment for systematic reviews
(Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS
Med 6: e1000097; doi:10.1371/journal.pmed1000097))
|
Study First author, year |
Appropriate and clearly focused question?1 Yes/no/unclear |
Comprehensive and systematic literature search?2 Yes/no/unclear |
Description of included and excluded studies?3 Yes/no/unclear |
Description of relevant characteristics of included studies?4 Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5 Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6 Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7 Yes/no/unclear |
Potential risk of publication bias taken into account?8 Yes/no/unclear |
Potential conflicts of interest reported?9 Yes/no/unclear |
|
Sandroni, 2014 |
yes |
yes |
yes |
yes |
Not applicable |
yes |
yes |
yes |
yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, Risk of Bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of quality assessment – prognostic studies
(The criteria used in this checklist are adapted from: Altman DG (2001). Systematic reviews of evaluations of prognostic variables. In: Egger M, Smith GD, Altman DG (eds.). Systematic reviews in health care. London: BMJ Books; Laupacis A, Wells G, Richardson WS, Tugwell P (1994). Users' guides to the medical literature. How to use an article about prognosis. Evidence-Based Medicine Working Group. JAMA,272:234-7)
|
Study reference
(first author, year of publication) |
Was there a representative and well-defined sample of patients at a similar point in the course of the disease?
(yes/no/unclear) |
Was follow-up sufficiently long and complete?
(yes/no/unclear) |
Was the outcome of interest defined and adequately measured?
(yes/no/unclear) |
Was the prognostic factor of interest defined and adequately measured?
(yes/no/unclear) |
Was the treating team blinded to the results of prognostic factor?
(yes/no/unclear) |
Was loss to follow-up / incomplete outcome data described and acceptable?
(yes/no/unclear) |
Level of evidence
|
|
Calderon, 2014 |
Yes |
Yes |
No |
Yes |
No |
Yes |
B |
|
Choi, 2016 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
|
Dragancea, 2015 |
Yes |
Yes |
No |
Yes |
No |
Yes |
B |
|
Gilje, 2014 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
|
Hasslacher, 2014 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
A2 |
|
Huntgeburth, 2014 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
|
Larsson, 2014 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
|
Leao, 2015 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
|
Lee, 2013 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
|
Pfeifer, 2014 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
Roger, 2015 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
|
Rossetti, 2017 |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
B |
|
Ruivo, 2016 |
Yes |
Yes |
No |
Yes |
No |
Yes |
B |
|
Scheel, 2013 |
Yes |
Yes |
yes |
Yes |
No |
Yes |
B |
|
Stammet, 2013 |
Yes |
Yes |
Yes |
Yes |
Yes for s100b |
Yes |
B |
|
Wiberg, 2017 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
A2 |
|
Zellner, 2013 |
Yes |
Yes |
Yes |
yes |
No |
Yes |
B |
A1: Meta-analysis of at least 2 independent studies of level A2
A2: Prospective inception cohort* (patients enrolled at same point in disease course), adequate study size and follow-up (≥80%), adequate control for confounding and no selective loss to follow-up
B: Prospective cohort* but not fulfilling all criteria for category-A2, retrospective cohort study or, case-control study, or cross-sectional study
C: non-comparative study
* untreated controls from a RCT can also be considered as a cohort.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-02-2019
Beoordeeld op geldigheid : 01-04-2019
Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Neurologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Neurologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (http://www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Met de update van de richtlijn “prognose van postanoxisch coma” streeft de werkgroep ernaar om de betrokken artsen een leidraad voor de dagelijkse praktijk te geven over het gebruik van diagnostische tests. Het doel van deze richtlijn is allereerst om adviezen te geven voor het betrouwbaar identificeren van patiënten met postanoxisch coma die een slechte neurologische uitkomst hebben (voor definitie zie tabblad verantwoording). Op basis van deze prognose kunnen beslissingen omtrent het behandelbeleid genomen worden. Daarnaast geeft deze richtlijn ook advies over diagnostische methoden die behulpzaam kunnen zijn bij het identificeren van patiënten met een grote kans op een goede neurologische uitkomst.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met ernstige postanoxische hersenschade na een geslaagde reanimatie, zich uitend in coma. In de dagelijkse praktijk zijn dit intensivisten en neurologen.
Samenstelling werkgroep
- Dr. J. Horn, intensivist-neuroloog, Amsterdam UMC, locatie AMC, NVN (voorzitter richtlijn);
- Dr. C.W.E. Hoedemaekers, internist-intensivist, Radboud UMC, Nijmegen, NIV;
- Dr. J. Hofmeijer, neuroloog, Rijnstate, Arnhem, NVN;
- Drs. L.S.D. Jewbali, cardioloog-intensivist, Erasmus MC, Rotterdam, NVVC;
- Dr. J.H.T.M. Koelman, neuroloog, Amsterdam UMC, NVN;
- Dr. W. de Ruijter, anesthesioloog-internist, Noordwest Ziekenhuisgroep, Alkmaar, NVA.
Met ondersteuning van:
- P.H. Broos MSc, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- K. Venhorst MSc, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- N. Bullock, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Horn |
Neuroloog-intensivist, afdeling Intensive Care Volwassenen, Amsterdam UMC, locatie AMC |
Adviseur Bard Medical, spreken op congressen, kosten worden vergoed |
Geen |
N.v.t. |
|
Jewbali |
cardioloog-intensivist (50% aanstelling via vakgroep Cardiologie en 50% aanstelling via vakgroep Intensive Care). 100% dienstverband |
Vertegenwoordiger vanuit de NVV in de Gemeenschappelijke Intensivisten Commissie |
Geen |
N.v.t. |
|
Hoedemaekers |
Internist-intensivist radboudUMC |
Geen |
1. Deelnemer aan expert panel postanoxische encephalopathie ESICM |
Modules worden in duo’s uitgewerkt, indien sprake is van eigen publicaties in literatuuranalyse. |
|
Hofmeijer |
Neuroloog Ziekenhuis Rijnstate |
Universitair docent Universiteit Twente (betaald) |
Betrokken bij wetenschappelijk onderzoek naar waarde EEG bij prognose postanoxisch coma. Participatie in Ghreline studie (hoofdonderzoeker J. Hofmeijer), gefinancierd door ZonMw en de Hersenstichting |
Modules worden in duo’s uitgewerkt, indien sprake is van eigen publicaties in literatuuranalyse. |
|
Koelman |
Klinisch neurofysioloog, afd Neurologie, Amsterdam UMC, locatie AMC |
Geen |
Geen |
N.v.t. |
|
Ruijter |
Anesthesioloog- intensivist, Noord-West ziekenhuisgroep- Alkmaar |
Anesthesioloog, Booerhaave Medisch Centrum- Amsterdam (betaald) |
Studie: Procalcitonin and proadrenomedullin: biomarkers for bacterial infection in patients after cardiopulmonary resuscitation? Van procalcitonine is ondertussen vast komen te staan dat dit een rol zou kunnen spelen bij vaststellen prognose van gereanimeerd patiënten. Dit was niet de opzet dat de studie. Er wordt op dit moment over een dergelijke rol zo nu en dan gepubliceerd. Over een dergelijke rol van pro-adrenomedulline is nog nooit gepubliceerd, en is door mij ook niet vastgesteld. De labbepalingen van procalcitonine zijn door de firma Brahms betaald. Verder is er niet betaald voor de studie. |
Modules worden in duo’s uitgewerkt, indien sprake is van eigen publicaties in literatuuranalyse. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de richtlijn ter commentaar te sturen naar de Patiëntenfederatie Nederland en Hersenletsel.nl.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn en de verschenen internationale richtlijn van Sandroni et al. (2014) op noodzaak tot revisie. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.)
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, systematische reviews, en literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. Aangezien herstel bij een postanoxische encefalopathie langzaam kan verlopen, is het moment van vaststellen van de uitkomst belangrijk. Idealiter is de follow-up van de studie minimaal 6 maanden, maar studies met kortere periode van follow-up werden niet geëxcludeerd. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de richtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep heeft echter besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken, of omdat er al voldoende ondersteunende maatregelen actief zijn in de zorgpraktijk. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. Link:
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
Zoekverantwoording
|
Referentie |
Reden exclusie |
|
Chou, 2014 |
Systematische review, maar geïncludeerde studies zijn geïncludeerd in syst review Sandroni of los geselecteerd |
|
Culler, 2014 |
Niet systematische review |
|
Friberg, 2013 |
Niet systematische review |
|
Golan, 2014 |
Systematische review, maar includeert geen meer recente literatuur t.o.v. syst review Sandroni |
|
Juan, 2015 |
Andere onderzoeksvraag, vergelijkt patiënten met herstel in EEG activiteit na geen reactieve EEG tijdens TH met patiënten zonder herstel in EEG activiteit, onder andere op NSE |
|
Karapetkova, 2016 |
Systematische review, includeert geen meer recente literatuur ten opzichte van syst review Sandroni |
|
Mlynash, 2013 |
Voldoet niet aan zoekvraag (wel relevant, maar voor overwegingen) |
|
Nishikimi, 2017 |
Lactaat betreft geen neurologische biomarker |
|
Oddo, 2014 |
Overlap populatie Rosetti 2017 |
|
Sawamoto, 2014 |
Betreft geen neurologische biomarkers |
|
Solari, 2017 |
Kijkt naar pupil licht reflex (PLR) als prognostische factor. NSE is secundaire uitkomstmaat om correlatie met PLR te bekijken |
|
Stammet, 2015 |
Exact zelfde populatie als Wiberg, maar Wiberg kijkt ook naar prognostische waarde NSE veranderingen en series over tijd. Lijkt daarom zelfde plus extra informatie te bieden |
|
Thomke, 2013 |
Niet systematische review |
|
Tsetsou, 2013 |
Overlap populatie Rosetti 2017 |
|
Tsetsou, 2017 |
Overlap populatie Rosetti 2017 |
