Indicatie voor colonoscopie bij bloedverlies per anum
Uitgangsvraag
Wanneer is er een indicatie voor een colonoscopie bij patiënten met (gering) bloedverlies per anum?
Aanbeveling
Voor patiënten jonger dan 50 jaar met bloedverlies per anumzonder risico-indicatoren voor CRC* of verdenking op inflammatoir darmlijden kan endoscopie achterwege worden gelaten.
Voor patiënten jonger dan 50 jaar met bloedverlies per anum, met risico-indicatoren voor CRC* of verdenking op een inflammatoir darmlijden dient een colonoscopie verricht te worden (gelijk de NHG standaard).
Bij persisterend bloedverlies per anum na behandeling voor vermeende hemorroïden moet laagdrempelig een colonoscopie gedaan worden (zie ook module 'Behandelalgoritme symptomatische hemorroïden').
Bij patiënten met een hoog risico op complicaties bij een colonoscopie dient individueel afgewogen te worden of een colonoscopie verricht moet worden ter uitsluiting van CRC of een HRA. Zo nodig kan voor een CT colografie gekozen worden.
*Risico-indicatoren voor CRC bij patiënten met bloedverlies per anum (veranderd defecatiepatroon, ontlasting vermengd met bloed, afwezigheid perianale afwijkingen, CRC familie<70e jaar).
Zie ook het stroomdiagram bij de aanverwante producten van deze module.
Overwegingen
Patiënten ouder dan 50 jaar met bloedverlies per anum krijgen volgens de NHG-standaard een colonoscopie. Er zijn vooralsnog in de literatuur geen redenen om hier van de NHG-standaard af te wijken. Het is echter de vraag hoe er gehandeld dient te worden bij patiënten onder de 50 jaar die geen risico-indicatoren (veranderd defecatiepatroon, ontlasting vermengd met bloed, afwezigheid perianale afwijkingen, CRC familie <70e jaar) of verdenking op een inflammatoir darmlijden hebben. Hieronder worden de beschikbare literatuur en overwegingen beschreven.
In hoeverre kan men bij patiënten <50 jaar met bloedverlies per anum en hemorroïden zonder risico-indicatoren afzien van colonoscopie?
Bij patiënten met een fissuur, fistel of een anaalcarcinoom is bloedverlies per anum niet het enige symptoom, zodat deze discussie zich toespitst op hemorroïden. Er zijn weinig studies die deze vraag direct beantwoorden. Een aantal nuttige studies zijn samengevoegd in tabel 3.1.
In een studie uit Pakistan werd bij 379 patiënten met helder rood rectaal bloedverlies zonder risicofactoren een colonoscopie verricht. Hemorroïden werden gevonden bij 219 patiënten (57.2%), waarvan bij 198 patiënten hemorroïden de enige bevinding waren (52,2%). In de totale populatie werd bij de 248 patiënten <40 jaar (65%) bij 7 (2,8%) een advanced adenoom of CRC gevonden, allemaal gelokaliseerd in het distale colon. Bij de patiënten >40 jaar was dit 7%, waarbij één tumor in het proximale colon was gevonden (Khalid,2011). Het is echter de vraag in hoeverre deze resultaten uit Zuid-Azië extrapoleerbaar zijn naar de Nederlandse situatie. In een Nederlandse studie waarin alle patiënten met rectaal bloedverlies en hemorroïden een colonoscopie ondergingen, werden bij 861 (45,1%) patiënten enkel hemorroïden gevonden; bij 1049 (54,9%) patiënten werden hemorroïden plus een additionele vondst gevonden. In totaal hadden 48 (4,7%) patiënten een CRC. Carcinomen en andere colonpathologie werd vaker gezien bij ouderen (Koning, 2010). In deze studie werden patiënten met risicofactoren echter niet geëxcludeerd. Een Britse studie bij 604 patiënten die een “open acces” diagnostische kliniek bezochten in verband met bloedverlies (alle soorten), toonde dat bij patiënten met hemorroïden (n=159 (26,3%)) bij 2% een CRC aanwezig was (Robertson, 2006). In studie uit Iran werd bij 404 patiënten met rectaal bloedverlies zonder risicofactoren een colonoscopie verricht. Bij 218 (54,2%) werden hemorroïden gevonden (<40 jaar: 62 (35,0%) en >40 jaar 156 (69,3). In totaal werd bij 6,5% een CRC (<40 jaar: 4 (2,3%); >40 jaar: 22 (9,8%)) en bij 7,5% adenomateuze poliepen gevonden. Slechts bij twee patiënten werd er een laesie in het transversum gevonden, waarbij beide patiënten wel hemorroïden hadden (Nikpour, 2008). Het is in deze studie echter onduidelijk bij hoeveel van de patiënten met hemorroïden een carcinoom gevonden werd. Een studie in USA bij in een tertiair centrum door eenzelfde endoscopist was de indicatie voor colonoscopie (9098 patiënten) bij 703 (7,7 %) helder rood bloedverlies. Bij deze 703 patiënten werd bij 47 (6,7%) een CRC of een advanced polyp gevonden. Bij de 182 patiënten <50 jaar hadden slechts 3 (1,6) een CRC of een advanced polyp. De plaats van deze bevindingen werd in de studie niet gerapporteerd (Marderstein, 2008). Een Nederlandse studie keek prospectief naar bijkomende pathologie bij patiënten verwezen voor hemorroïden behandeling. Bij 961 van de 1005 (95%) waren hemorroïden aanwezig. Bij acht patiënten werd een maligniteit gevonden, allen ouder dan 40 jaar. Zij suggereren een sigmoïdoscopie boven het 40e jaar. In hoeverre er alarmsymptomen aanwezig waren en wat de locatie was bij deze acht patiënten wordt niet helemaal duidelijk (Vening, 2010).
Al deze studies laten zien dat de kans dat een patiënt met minimaal helderrood bloedverlies en hemorroïden onder de 50 jaar en vooral onder de 40 jaar een (rectaal) CRC heeft als oorzaak van rectaal bloedverlies, uitermate klein is. De werkgroep is daarom van mening dat voor deze patiënten het niet standaard, dus indien er geen andere risico-indicatoren aanwezig zijn, nodig is aanvullende diagnostiek in te zetten om CRC uit te sluiten.
Er zijn echter situaties waarbij aanvullende diagnostiek wel wenselijk kan zijn. Bij sommige patiënten treedt na behandeling van hemorroïden geen verbetering in de klachten op (zie ook de module behandelalgoritme hemorroïden). Bij deze patiënten moet opnieuw worden overwogen colonoscopie in te zetten. In alle gevallen moet de mogelijke winst van het inzetten van aanvullende diagnostiek worden afgewogen tegen de mogelijk nadelige effecten.
Een colonoscopie heeft een geringe kans op complicaties. Het risico op een ernstige complicatie (perforatie, nabloeding) is 0,02%. Factoren die het risico op deze complicaties verhogen zijn: instrumentatie (poliepectomie), stollingsproblemen (bloedingen) en afhankelijk van de soort ingreep is het risico hoger. Patiënten met ASA klasse 3 tot 4 hebben een verhoogd risico op cardiopulmonale problemen (Church, 2013). Bij patiënten met een verhoogd risico op complicaties bij de colonoscopie (ASA IV) kan overwogen worden om een CT-colografie te doen.
De aanbevelingen van deze module zijn samengevat in een stroomdiagram (zie aanverwant product 'Stroomdiagram aanvullende diagnostiek bij bloedverlies per anum').
Tabel 3.1 Samenvatting studies
|
Auteur, jaartal |
Studie karakteristieken |
Patiënt karakteristieken |
Soort diagnostiek |
Resultaten |
Opmerkingen/conclusie van de auteurs |
|
Koning, 2010 |
Opzet: Retrospectief
Setting: Ziekenhuis
Land: Nederland
Patiënten: hemorroïden. N=1910 |
Indicaties voor endoscopie: normal clinical indications in daily practice (abdominal complaints, diarrhoea, rectal bleeding, anaemia, changes in bowel habits, family history of colorectal cancer and screening) |
Colonoscopie: (n=1777 (93%) Sigmoïdoscopie: (n= 133 (7%) |
Alleen hemorroïden: 861 (45.1%) Hemorroïden + additionele vondst: 1049 (54.9%) Carcinoom na colonoscopie: 48 (4.7%) Incidentie na 50 loopt op. |
In normal daily practice, especially bright rectal bleeding without further abdominal complaints will mostly be due to haemorrhoids in patients below the age of fifty. In case no other symptoms are present, haemorrhoids are seen during rectal examination, and there is no family history of colorectal cancer, the clinician could refrain from total colonoscopy in these patients. In patients above the age of fifty years endoscopic evaluation of the rectum and colon is advocated. |
|
Sajid,
|
Opzet: retrospectief Setting: tertiair ziekenhuis Land: Irak Incl: 18-50 years, PBPR (fresh blood per rectum, red in feces, toilet paper, in toilet bowl) in previous 6 months. Excl: IBD, colorectal surgery, family history of CRC, bleeding diathesis; iron deficiency anemia; anticoagulant therapy; significant bleeding per rectum requiring blood transfusions and/or emergency room visit. N=379 |
(+ indicatie voor diagnostiek?): patiënten met helderrood bloedverlies <50, zonder risicofactoren 257 men (67.8 %) and 122 women (32.2 %). Subgroepen qua leeftijd: 131 patients (34.6 %) in the 40 – 50 years age group 248 (65.4 %) under 40 years old.
|
Soort diagnostiek: colonoscopie |
Resultaten (CRC, poliepen, anders): Hemorroïden: 219 (57.8%) Enkel hemorroïden: 198 (52.2%) Hemorroïden + andere laesies: 21 (5.5%) Adenomateuze poliep/CRC: <40: 7 (2.8) |
|
|
Nikpour, 2008
|
Soort onderzoek: Setting: Land: Iran Excl: colorectal neoplasm, IBD, first degree family history of colorectal neoplasm, history of altered bowel habits, iron deficiency anemia, neoplastic polyps, colorectal carcinoma N=402 |
(+ indicatie voor diagnostiek?): patiënten met minimaal helderood rectaal bloedverlies (alle leeftijden), zonder risicofactoren Male: 219 (54.5%) female: 183 (45.5%). Mean age (range) 43.6 ± 15.7 years (13 to 86). <40: 177 (44.0%) There were another 94 young patients (41 male, 53 female; aged 27.6 ± 5.8 years), who met the eligibility criteria, but did not agree to participate and undergo colonoscopy |
Soort diagnostiek |
Resultaten (CRC, poliepen, anders) Hemorrhoiden: = 218 (54.2) Carcinoom:
|
Our study showed that significant lesions in the proximal colon are infrequent in patients with minimal BRBPR. Colonoscopy is recommended for the evaluation of rectal bleeding in patients who are at increased risk for colorectal neoplasms (‘red flags’)[3], but there are no specific recommendations for the appropriate evaluation of the majority of patients who lack these risk factors. The decision about the extent of the evaluation of these patients should be based on the prevalence of clinically significant lesions, potential need for a repeat procedure, costs and availability of the facility. Some experts recommend that young patients do not require further evaluation, if the presentation and history do not suggest an increased risk of cancer and a potential source of bleeding (such as hemorrhoids or an anal fissure) is identified in the clinical evaluation |
Onderbouwing
Achtergrond
Bloedverlies per anum kan een symptoom zijn van anale afwijkingen, zoals hemorroïden, fissuren, anaalcarcinomen, maar ook van hogerop gelegen afwijkingen als (procto)colitis, hoog-risico adenomen (HRA) (advanced adenomen of advanced polyps in de angelsaktische literatuur) en colorectaal carcinomen (CRC).
Het voorkomen van CRC in de Nederlandse bevolking in de periode 2009 tot 2012 is goed te zien in Figuur 3.1 (IKNL, 2013). CRC komt tussen de 40 en 50 jaar voor bij 15 tot 30 patiënten per 100.000 inwoners. Beneden het 40e jaar komen CRC bij 8 per 100.000 inwoners. Kijkend naar uitsluitend rectumcarcinoom bedraagt dit respectievelijk 5 tot 11,5 per 100.000 en 1,2 per 100.000 inwoners. De incidentie bij mannen is iets hoger dan bij vrouwen. Het is niet bekend bij welke patiënten het CRC daadwerkelijk tot bloedverlies heeft geleid. Vermoedelijk zullen vooral de recto-sigmoïd carcinomen hier aanleiding toe hebben gegeven.
Incidentie van colorectaal carcinoom in Nederland per 100.000 in de periode 2008-2012 per 5 jaar-leeftijdscategorie
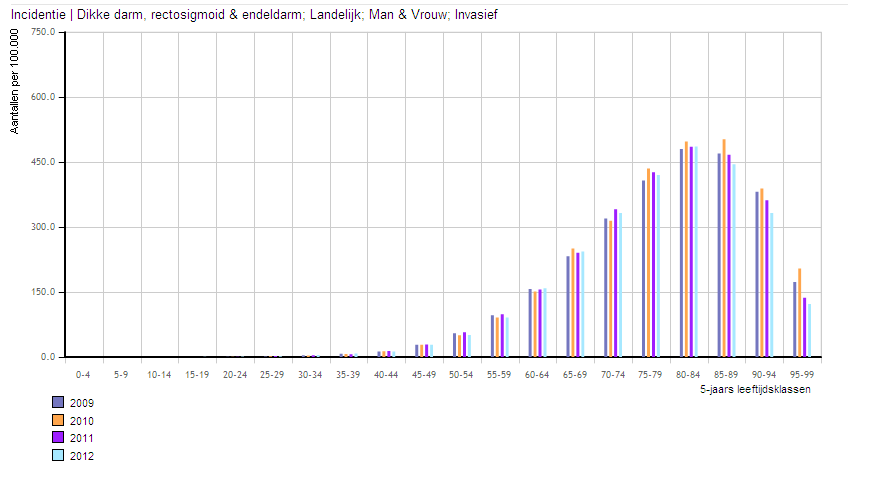
Voor rectaal bloedverlies bestaat een NHG-Standaard. In deze standaard wordt een colonoscopie aanbevolen voor mensen met rectaal bloedverlies en een van de volgende risico-indicatoren: leeftijd boven de 50 jaar, veranderd defecatiepatroon, ontlasting vermengd met bloed, afwezigheid perianale afwijkingen, CRC familie <70e jaar. Of indien er een verdenking op inflammatoir darmlijden is (Damoiseaux , 2009).
In 2013 werd de richtlijn colonoscopie surveillance afgerond, waar over de wijze van surveillance gesproken wordt na het vinden van poliepen, carcinomen en bij familiair risico op colorectaal carcinoom. In deze richtlijn wordt de kwaliteit van aanvullend onderzoek (colonoscopie/signoidoscopie) beschreven (hoofdstuk 2), en gesteld dat er geen indictie is voor aanvullende diagnostiek middels sigmoïdoscopie (NVMDL, 2013).
Voor patiënten onder de 50 jaar met bloedverlies per anum zonder risico-indicatoren bestaat in de praktijk geen eenduidig beleid voor het inzetten van aanvullende diagnostiek ter uitsluiting van een colorectaal carcinoom. Hierbij moet een afweging gemaakt worden tussen de belasting, de kosten en de risico’s van endoscopie ten opzichte van het risico om een carcinoom HRA te missen.
Zoeken en selecteren
Er is geen systematische zoekactie uitgevoerd voor deze uitgangsvraag. Wel is gebruik gemaakt van de beschikbare wetenschappelijke literatuur.
Referenties
- Church J. Complications of colonoscopy. Gastroenterol Clin North Am 2013;42(3):639-57.
- Damoiseaux RAMJ, De Jong RM, De Meij MA, et al. NHG-Standaard Rectaal bloedverlies. Huisarts Wet 2009:52(1):23-38.
- Givel JC, Mortensen N, Roche B. Anorectal and Colonic Diseases. A Practical Guide to their Management. 3rd ed. 2010.
- Khalid AB, Majid S, Salih M, et al. Is full colonoscopic examination necessary in young patients with fresh bleeding per rectum? Endoscopy 2011;43(8):692-6.
- Koning MV, Loffeld RJ. Rectal bleeding in patients with haemorrhoids. Coincidental findings in colon and rectum. Fam Pract 2010;27(3):260-2.
- Lohsiriwat V. Hemorrhoids: from basic pathophysiology to clinical management.World J Gastroenterol 2012;18(17):2009-17.
- Marderstein EL, Church JM. Classic "outlet" rectal bleeding does not require full colonoscopy to exclude significant pathology. Dis Colon Rectum 2008;51(2):202-6.
- Nikpour S, Ali Asgari A. Colonoscopic evaluation of minimal rectal bleeding in average-risk patients for colorectal cancer. World J Gastroenterol 2008;14(42):6536-40.
- NVMDL. Nederlandse Richtlijn Coloscopie Surveillance. 2013
- Robertson R, Campbell C, Weller DP, et al. Predicting colorectal cancer risk in patients with rectal bleeding. Br J Gen Pract 2006;56(531):763-7.
- Vening W, Willigendael EM, Tjeertes EK, et al. Timing and necessity of a flexible sigmoidoscopy in patients with symptoms suggestive of haemorrhoids. Colorectal Dis 2010;12(2):109-13.
- Williams NS, Keighley MRB. Surgery of The Anus, Rectum and Colon. 1999 (2nd Edition).
Evidence tabellen
|
Auteur, jaartal |
Studie karakteristieken |
Patiënt karakteristieken |
Soort diagnostiek |
Resultaten |
Opmerkingen/conclusie van de auteurs |
|
Koning, 2010 |
Opzet: Retrospectief
Setting: Ziekenhuis
Land: Nederland
Patiënten: hemorroïden. N=1910 |
Indicaties voor endoscopie: normal clinical indications in daily practice (abdominal complaints, diarrhoea, rectal bleeding, anaemia, changes in bowel habits, family history of colorectal cancer and screening) |
Colonoscopie: (n=1777 (93%) Sigmoïdoscopie: (n= 133 (7%) |
Alleen hemorroïden: 861 (45.1%) Hemorroïden + additionele vondst: 1049 (54.9%)
Carcinoom na colonoscopie: 48 (4.7%) Incidentie na 50 loopt op. |
In normal daily practice, especially bright rectal bleeding without further abdominal complaints will mostly be due to haemorrhoids in patients below the age of fifty. In case no other symptoms are present, haemorrhoids are seen during rectal examination, and there is no family history of colorectal cancer, the clinician could refrain from total colonoscopy in these patients. In patients above the age of fifty years endoscopic evaluation of the rectum and colon is advocated. |
|
Sajid,
|
Opzet: retrospectief Setting: tertiair ziekenhuis Land: Irak Incl: 18-50 years, PBPR (fresh blood per rectum, red in feces, toilet paper, in toilet bowl) in previous 6 months. Excl: IBD, colorectal surgery, family history of CRC, bleeding diathesis; iron deficiency anemia; anticoagulant therapy; significant bleeding per rectum requiring blood transfusions and/or emergency room visit. N=379 |
(+ indicatie voor diagnostiek?): patiënten met helderrood bloedverlies <50, zonder risicofactoren 257 men (67.8 %) and 122 women (32.2 %). Subgroepen qua leeftijd: 131 patients (34.6 %) in the 40 – 50 years age group 248 (65.4 %) under 40 years old.
|
Soort diagnostiek: colonoscopie |
Resultaten (CRC, poliepen, anders): Hemorroïden: 219 (57.8%) Enkel hemorroïden: 198 (52.2%) Hemorroïden + andere laesies: 21 (5.5%) Adenomateuze poliep/CRC:
<40: 7 (2.8) |
|
|
Nikpour, 2008
|
Soort onderzoek: Setting: Land: Iran Excl: colorectal neoplasm, IBD, first degree family history of colorectal neoplasm, history of altered bowel habits, iron deficiency anemia, neoplastic polyps, colorectal carcinoma N=402 |
(+ indicatie voor diagnostiek?): patiënten met minimaal helderood rectaal bloedverlies (alle leeftijden), zonder risicofactoren Male: 219 (54.5%) female: 183 (45.5%). Mean age (range) 43.6 ± 15.7 years (13 to 86). <40: 177 (44.0%) There were another 94 young patients (41 male, 53 female; aged 27.6 ± 5.8 years), who met the eligibility criteria, but did not agree to participate and undergo colonoscopy |
Soort diagnostiek |
Resultaten (CRC, poliepen, anders)
Hemorrhoiden: = 218 (54.2)
Carcinoom:
|
Our study showed that significant lesions in the proximal colon are infrequent in patients with minimal BRBPR. Colonoscopy is recommended for the evaluation of rectal bleeding in patients who are at increased risk for colorectal neoplasms (‘red flags’)[3], but there are no specific recommendations for the appropriate evaluation of the majority of patients who lack these risk factors. The decision about the extent of the evaluation of these patients should be based on the prevalence of clinically significant lesions, potential need for a repeat procedure, costs and availability of the facility. Some experts recommend that young patients do not require further evaluation, if the presentation and history do not suggest an increased risk of cancer and a potential source of bleeding (such as hemorrhoids or an anal fissure) is identified in the clinical evaluation |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 17-07-2015
Laatst geautoriseerd : 17-07-2015
Geplande herbeoordeling : 01-01-2019
Uiterlijk in 2019 bepaalt het bestuur van de NVvH of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten.
De NVVH is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
De richtlijn moet heldere en eenduidige aanbevelingen opleveren ter ondersteuning van de dagelijkse praktijkvoering van zorgverleners die betrokken zijn bij patiënten met hemorroïden, fissuren en perianale fistels. De richtlijn geeft aanbevelingen over de diagnostiek en zowel chirurgische als conservatieve behandeling. De richtlijn beoogt hiermee de kwaliteit van de zorgverlening te verbeteren, het klinisch handelen meer te baseren op bewijs dan op ervaringen en meningen, de transparantie te vergroten en de diversiteit van handelen door professionals te verminderen.
Doelgroep
Doelgroep van deze richtlijn zijn alle zorgverleners die betrokken zijn bij de behandeling van patiënten met hemorroïden, fistels of fissura ani.
Samenstelling werkgroep
- Dr. M.S. Dunker, voorzitter werkgroep, chirurg, Nederlandse Vereniging voor Heelkunde
- Dr. D.D.E. Zimmerman, chirurg, Nederlandse Vereniging voor Heelkunde
- Dr. N.A.T. Wijffels, chirurg, Nederlandse Vereniging voor Heelkunde
- Dr. M.J. Lahaye, radioloog, Nederlandse Vereniging voor Radiologie
- Dr. O. van Ruler, chirurg, Nederlandse Vereniging voor Heelkunde
- Dr. E. Mitalas, chirurg, Nederlandse Vereniging voor Heelkunde
- Dr. R.J.F. Felt-Bersma, MDL-arts, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Drs. M.T. Bousema, dermatoloog, Nederlandse Vereniging voor Dermatologie en Venereologie
- Dr. P.G. Doornebosch, chirurg, Nederlandse Vereniging voor Heelkunde
Met ondersteuning van:
- Drs. E.E. Volmeijer, junior adviseur, Kennisinstituut van Medisch Specialisten
- Dr. M.A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
Met dank aan (meeleescommissie):
- Dr. M. Gerhards, chirurg, Nederlandse Vereniging voor Heelkunde
- Dr. A. Pronk, chirurg, Nederlandse Vereniging voor Heelkunde
- Prof. dr. André D'Hoore, chirurg, University Hopitals Gasthuisberg
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. Er werd beoordeeld dat er geen sprake was van belangen, en werd geen van de werkgroepleden uitgesloten van inspraak of besluitvorming. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (Kennisinstituut), een overzicht vindt u hieronder:
|
Naam werkgroeplid |
Belangen, ja / nee |
Toelichting |
|
Dr. M.S. Dunker |
Nee |
|
|
Dr. D.D.E. Zimmerman |
Nee |
|
|
Dr. N.A.T. Wijffels |
Nee |
|
|
Dr. M.J. Lahaye |
Nee |
|
|
Dr. O. van Ruler |
Nee |
|
|
Dr. E. Mitalas |
Nee |
|
|
Dr. R.J.F. Felt-Bersma, |
Ja, oordeel: niet conflicterend |
Extern gefinancierd onderzoek (Unrestricted Grant Shire 2012-2013 voor OIOS) |
|
Drs. M.T. Bousema, |
Nee |
|
|
Dr. P.G. Doornebosch, |
Nee |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in samenwerking met de Nederlandse Patiënten Consumenten Federatie (NPCF) een enquête uit te zetten. Een verslag van de enquête is besproken in de werkgroep. Belangrijkste knelpunten zijn verwerkt in de richtlijn. Het verslag is te vinden in aanverwant product 'Patiëntenperspectief'. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de NPCF.
Methode ontwikkeling
Evidence based
Implementatie
Er werd aandacht besteed aan de implementatie van deze richtlijn. Het implementatieplan bij deze richtlijn kunt u vinden in aanverwant product 'Implementatieplan'.
Werkwijze
Knelpunteninventarisatie
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Zorgverzekeraars Nederland werd gevraagd knelpunten aan te leveren voor de richtlijn.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (Artsennet, Guidelines International Network, Trip en National guideline clearinghouse (USA), Europese en Amerikaanse beroepsorganisaties) en naar systematische reviews (Medline, Embase, Cochrane). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de zoekverantwoording van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het (beste) beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes (zie aanverwante producten).
Commentaar- en autorisatiefase
Volgt later (na commentaarfase)
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
