Primaire tumor onbekend - Prognose: niet-behandelbare subgroep
Uitgangsvraag
Welke prognostische factoren geven een indicatie van een zeer slechte of juist relatief gunstige prognose?
Zijn er factoren bekend die een indicatie geven van de respons op systemische therapie bij patiënten met een metastase van onbekende origine wanneer gekeken wordt naar mortaliteit en kwaliteit van leven?
Aanbeveling
Binnen de groep met bewezen onbekende primaire tumor, niet behorend tot een behandelbare subgroep, zijn er twee prognostische groepen, gebaseerd op de performance status.
Voor de behandeling is het belangrijk onderscheid te maken tussen patiënten met een goede performance status (< 1) en met een slechte performance status (> 2).
Overwegingen
De studies die in de evidence review zijn opgenomen, zijn gedaan onder een geselecteerde groep van behandelde patiënten. Dit zijn derhalve patiënten met een relatief gunstige prognose vanwege hun goede conditie. De mediane overleving in een ongeselecteerde populatie van patiënten, niet behorend tot een behandelbare subgroep, is 3 maanden (40). De mediane overleving van patiënten met een goede performance status is 8 maanden tot een jaar.
Van de performance status is relatief goede evidence beschikbaar voor wat betreft de prognostische waarde. Van overige in de literatuur genoemde mogelijke prognostische factoren (levermetastasen, botmetastasen, verhoogd LDH, verlaagd albumine) is het bewijs niet consistent genoeg om dit in de aanbevelingen op te nemen.
Systemische behandeling van patiënten met een onbekende primaire tumor lijkt bij patiënten met ongunstige prognostische factoren weinig effectief. Hier zijn echter geen gerandomiseerde data voor beschikbaar. Deze therapie gaat gepaard met veel bijwerkingen.
Onderbouwing
Conclusies / Summary of Findings
|
Een goede ‘performance status' is een prognostisch gunstige factor bij patiënten met een metastase van een onbekende primaire tumor. Onafhankelijke negatieve voorspellende factoren lijken de aanwezigheid van levermetastasen, laag serum albumine en verhoogd serum lactaat dehydrogenase te zijn. Er zijn geen goede modellen voorhanden die de overleving bij individuele patiënten valide kunnen schatten. |
Samenvatting literatuur
Wetenschappelijke onderbouwing
Vertaling ‘Short Summary' vanuit NICE richtlijn (1):
Er is bewijs dat een aantal factoren geassocieerd is met de respons op chemotherapie en de totale overleving bij mensen met een onbekende primaire tumor.
Terwijl veel prognostische factoren belangrijk bleken bij univariate analyse, bleven er maar weinig factoren over na multivariate analyse. Onafhankelijke negatieve prognostische factoren zijn: de aanwezigheid van levermetastasen, laag serum albumine en verhoogd serum lactaat dehydrogenase. De enige gunstige prognostische factor die consequent in onderzoeken wordt gerapporteerd is een goede performance status.
Verschillende auteurs hebben eenvoudige modellen ontwikkeld waarin mensen met een onbekende primaire tumor aan de hand van een aantal factoren worden ingedeeld in laagrisico en hoogrisico groepen. Deze risicogroepen hebben statistisch significante verschillen in totale overleving, maar de klinische relevantie is onduidelijk: er zijn geen studies die evalueren of deze prognostische modellen behandelingsbeslissingen beïnvloeden. Er is inconsistentie in de factoren die in de prognostische modellen zijn gebruikt, wat suggereert dat er verschillen zijn in de onderzochte populaties waarin de prognostische modellen ontwikkeld zijn.
Er zijn geen goede prognostische modellen voorhanden om de absolute overlevingskans van een bepaalde patiënt met een onbekende primaire tumor te schatten.
De literatuursearch die voor de NICE richtlijn is gedaan, is geactualiseerd. Na de literatuursearch en literatuurselectie bleven 39 artikelen over die full-tekst zijn beoordeeld. Een aantal artikelen viel vervolgens af omdat deze binnen de inclusiecriteria van de NICE evidence review vielen (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19). Additioneel werd een aantal artikelen geëxcludeerd vanwege methodologische tekortkomingen of inhoudelijke redenen (omdat het artikel de uitgangsvraag niet beantwoordde) (20) (21) (22) (23) (24) (25) (26) (27) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36).
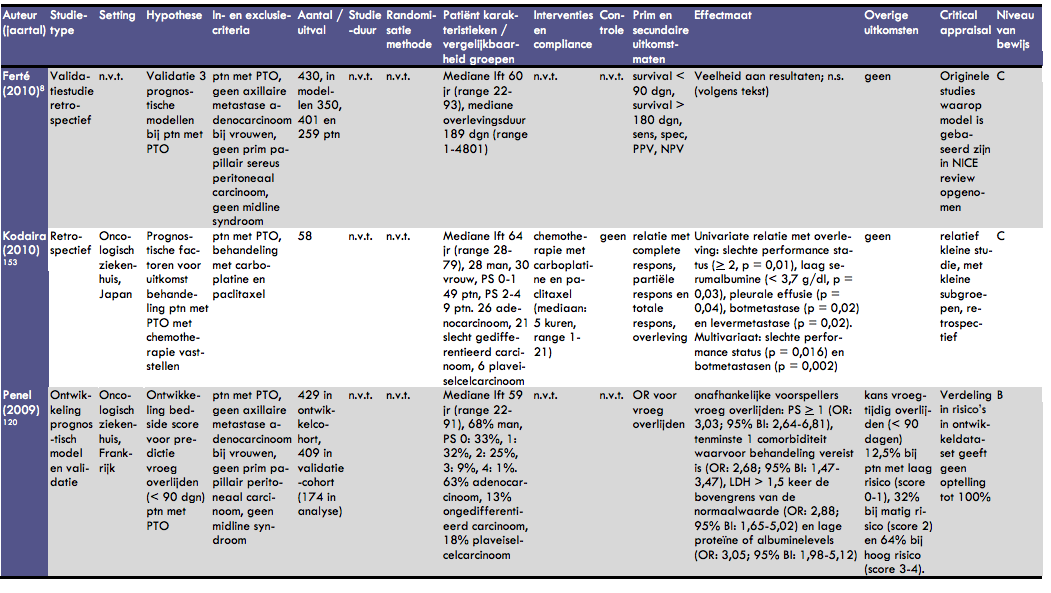
Ferté et al. evalueerden in een retrospectief onderzoek de waarde van 3 scoringssystemen om de prognose van patiënten met een onbekende primaire tumor te kunnen schatten (37). Hiertoe werden de dossiers van 430 opeenvolgende patiënten met een onbekende primaire tumor geëvalueerd. De mediane leeftijd van deze patiënten was 60 jaar (range 22-93 jaar); 69% was man. De mediane overlevingsduur na diagnose was 189 dagen (range 1-4801 dagen). In het onderzoek zijn 3 scoringssystemen (van der Gaast, Culine, Seve) geëvalueerd. In deze analyse konden respectievelijk 350, 401 en 259 patiënten worden geïncludeerd. Uit een univariate analyse is geconcludeerd dat met deze scoringssystemen groepen patiënten met een goede prognose en patiënten met een slechte prognose kunnen worden onderscheiden. Individuele voorspellingen van de levensverwachting zijn echter met deze modellen niet te maken; de positief en negatief voorspellende waarden van de patiënten met een overleving van minder dan 90 dagen en van patiënten met een overleving van meer dan 180 dagen (dit zijn de extremen in het model) overlappen. De studies van van der Gaast, Culine en Seve zijn in de NICE evidence review opgenomen.
In het onderzoek van Kodaira et al. is een groep van 58 patiënten met een onbekende primaire tumor retrospectief geëvalueerd om zo een subgroep met een gunstige prognose na behandeling met carboplatine en paclitaxel te kunnen vaststellen (38). Er werd gekeken naar progressievrije overleving en totale overleving na chemotherapie. De mediane leeftijd van de patiënten was 64 jaar (range 28-79 jaar); er waren 28 mannen en 30 vrouwen. De performance status was 0-1 bij 49 patiënten en 2-4 bij 9 patiënten. Van alle patiënten hadden er 26 een adenocarcinoom, 21 een slecht gedifferentieerd carcinoom en 6 een plaveiselcelcarcinoom. De patiënten kregen 1-21 cycli chemotherapie (mediaan 5). De totale responsrate na chemotherapie was 42% voor patiënten met een adenocarcinoom, 50% voor patiënten met een plaveiselcelcarcinoom en 24% voor patiënten met een slecht gedifferentieerd carcinoom. Factoren die verband hielden met een slechte prognose na behandeling (univariate analyse) waren een slechte performance status (> 2, p = 0,01), laag serumalbumine (< 3,7 g/dl, p = 0,03), pleurale effusie (p = 0,04), botmetastase (p = 0,02) en levermetastase (p = 0,02). In een multivariaat model bleken slechte performance status (p = 0,016) en botmetastasen (p = 0,002) onafhankelijke prognostische factoren voor een slechte overleving.
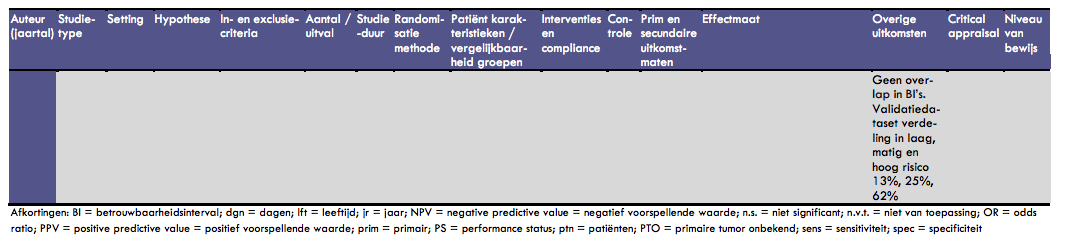
In de studie van Penel et al. is de ontwikkeling van een prognostisch model bij 429 patiënten met een onbekende primaire tumor en de validatie ervan bij een groep van 409 patiënten beschreven (39). Het doel van deze studie was een ‘bedside' score vast te stellen waarmee een voorspelling gedaan zou kunnen worden met betrekking tot vroegtijdig overlijden (levensverwachting van minder dan 90 dagen). Een consequentie hiervan zou kunnen zijn om bij de groep bij wie een snel overlijden wordt verwacht af te zien van agressieve chemotherapie en de behandeling te richten op palliatieve zorg. De patiëntengroep (ontwikkeling prognostisch model) bestond uit 429 opeenvolgende patiënten; de mediane leeftijd was 59 jaar (range 22-91 jaar), 68% was man. De performance status van deze patiënten was 0 bij 33%, 1 bij 32%, 2 bij 25%, 3 bij 9% en 4 bij 1%. Van alle patiënten had 63% een adenocarcinoom, 13% een ongedifferentieerd carcinoom en 18% een plaveiselcelcarcinoom. Uit het ontwikkelmodel bleken in de multivariate analyse (logistische regressie) 4 onafhankelijke voorspellers van vroeg overlijden te kunnen worden vastgesteld: performance status > 1 (OR: 3,03; 95% BI: 2,64-6,81), tenminste 1 co morbiditeit waarvoor behandeling vereist is (OR: 2,68; 95% BI: 1,47-3,47), LDH > 1,5 keer de bovengrens van de normaalwaarde (OR: 2,88; 95% BI: 1,65-5,02) en lage proteïne of albuminelevels (OR: 3,05; 95% BI: 1,98-5,12). Op basis van dit model was de kans op vroegtijdig overlijden (< 90 dagen) 12,5% bij patiënten met een laag risico (score 0-1), 32% voor patiënten met een matig risico (score 2) en 64% voor patiënten met een hoog risico (score 3-4). Er was geen overlap in de betrouwbaarheidsintervallen voor deze risicogroepen. In de validatiedataset werden dezelfde scores berekend; deze konden berekend worden voor 174 patiënten. De verdeling in laag, matig en hoog risico in deze groepen was 13%, 25% en 62%. Bij dit onderzoek moet opgemerkt worden dat de percentages in de ontwikkelgroep niet optellen tot 100% (maar tot 108,5%).
Referenties
- 1 - NICE. NIfHaCE. Diagnosis and management of metastatic malignant disease of unknown primary origin. Full Guideline. 2010 [cited; Available from: http://www.nice.org.uk/nicemedia/live/13044/49864/49864.pdf
- 2 - Kaya AO, Coskun U, Unlu M, Akdemir UO, Ozdemir NY, Zengin N, et al. Whole body 18F-FDG PET/CT imaging in the detection of primary tumours in patients with a metastatic carcinoma of unknown origin. Asian Pac J Cancer Prev. 2008; 9(4): 683-6.
- 3 - Miller FR, Karnad AB, Eng T, Hussey DH, Stan McGuff H, Otto RA. Management of the unknown primary carcinoma: long-term follow-up on a negative PET scan and negative panendoscopy. Head Neck. 2008; 30(1): 28-34.
- 4 - Weber A, Schmoz S, Bootz F. CUP (carcinoma of unknown primary) syndrome in head and neck: clinic, diagnostic, and therapy. Onkologie. 2001; 24(1): 38-43.
- 5 - Oien KA. Pathologic evaluation of unknown primary cancer. Semin Oncol. 2009; 36(1): 8-37.
- 6 - Greco FA, Pavlidis N. Treatment for patients with unknown primary carcinoma and unfavorable prognostic factors. Semin Oncol. 2009; 36(1): 65-74.
- 7 - Hainsworth JD, Fizazi K. Treatment for patients with unknown primary cancer and favorable prognostic factors. Semin Oncol. 2009; 36(1): 44-51.
- 8 - Faure E, Riquet M, Lombe-Weta PM, Hubsch JP, Carnot F. [Malignant mediastinal lymph node tumors with unknown primary cancers]. Rev Mal Respir. 2000; 17(6): 1095-9.
- 9 - Carroll MC, Fleming M, Chitambar CR, Neuburg M. Diagnosis, workup, and prognosis of cutaneous metastases of unknown primary origin. Dermatol Surg. 2002; 28(6): 533-5.
- 10 - Culine S. Prognostic factors in unknown primary cancer. Semin Oncol. 2009; 36(1): 60-4.
- 11 - Dova L, Pentheroudakis G, Golfinopoulos V, Malamou-Mitsi V, Georgiou I, Vartholomatos G, et al. Targeting c-KIT, PDGFR in cancer of unknown primary: a screening study for molecular markers of benefit. J Cancer Res Clin Oncol. 2008; 134(6): 697-704.
- 12 - Fencl P, Belohlavek O, Skopalova M, Jaruskova M, Kantorova I, Simonova K. Prognostic and diagnostic accuracy of [18F]FDG-PET/CT in 190 patients with carcinoma of unknown primary. Eur J Nucl Med Mol Imaging. 2007; 34(11): 1783-92.
- 13 - Greco FA, Erland JB, Morrissey LH, Burris HA, 3rd, Hermann RC, Steis R, et al. Carcinoma of unknown primary site: phase II trials with docetaxel plus cisplatin or carboplatin. Ann Oncol. 2000; 11(2): 211-5.
- 14 - Huebner G, Link H, Kohne CH, Stahl M, Kretzschmar A, Steinbach S, et al. Paclitaxel and carboplatin vs gemcitabine and vinorelbine in patients with adeno- or undifferentiated carcinoma of unknown primary: a randomised prospective phase II trial. Br J Cancer. 2009; 100(1): 44-9.
- 15 - Koivunen P, Laranne J, Virtaniemi J, Back L, Makitie A, Pulkkinen J, et al. Cervical metastasis of unknown origin: a series of 72 patients. Acta Otolaryngol. 2002; 122(5): 569-74.
- 16 - McMahon J, Hruby G, O'Brien CJ, McNeil EB, Bagia JS, Clifford AR, et al. Neck dissection and ipsilateral radiotherapy in the management of cervical metastatic carcinoma from an unknown primary. Aust N Z J Surg. 2000; 70(4): 263-8.
- 17 - Pimiento JM, Teso D, Malkan A, Dudrick SJ, Palesty JA. Cancer of unknown primary origin: a decade of experience in a community-based hospital. Am J Surg. 2007; 194(6): 833-7; discussion 7-8.
- 18 - Tong CC, Luk MY, Chow SM, Ngan KC, Lau WH. Cervical nodal metastases from occult primary: undifferentiated carcinoma versus squamous cell carcinoma. Head Neck. 2002; 24(4): 361-9.
- 19 - Yakushiji S, Ando M, Yonemori K, Kohno T, Shimizu C, Katsumata N, et al. Cancer of unknown primary site: review of consecutive cases at the National Cancer Center Hospital of Japan. Int J Clin Oncol. 2006; 11(6): 421-5.
- 20 - Pentheroudakis G, Lazaridis G, Pavlidis N. Axillary nodal metastases from carcinoma of unknown primary (CUPAx): a systematic review of published evidence. Breast Cancer Res Treat. 2010; 119(1): 1-11.
- 21 - Pentheroudakis G, Greco FA, Pavlidis N. Molecular assignment of tissue of origin in cancer of unknown primary may not predict response to therapy or outcome: a systematic literature review. Cancer Treat Rev. 2009; 35(3): 221-7.
- 22 - Mylona S, Stroumpouli E, Pomoni M, Galani P, Ntai S, Thanos L. Radiofrequency ablation of liver metastases from cancer of unknown primary site. Diagn Interv Radiol. 2009; 15(4): 297-302.
- 23 - Thom I, Rogers C, Andritzky B, Witzel I, Schuch G, Hossfeld DK, et al. Single-center management of 136 patients with cancer of unknown primary site (CUP syndrome) over a period of 10 years. Onkologie. 2009; 32(12): 741-6.
- 24 - Greco FA, Erlander MG. Molecular classification of cancers of unknown primary site. Mol Diagn Ther. 2009; 13(6): 367-73.
- 25 - Greco FA, Spigel DR, Yardley DA, Erlander MG, Ma XJ, Hainsworth JD. Molecular profiling in unknown primary cancer: accuracy of tissue of origin prediction. Oncologist. 2010; 15(5): 500-6.
- 26 - van Laar RK, Ma XJ, de Jong D, Wehkamp D, Floore AN, Warmoes MO, et al. Implementation of a novel microarray-based diagnostic test for cancer of unknown primary. Int J Cancer. 2009; 125(6): 1390-7.
- 27 - Lee CC, Faries MB, Wanek LA, Morton DL. Improved survival for stage IV melanoma from an unknown primary site. J Clin Oncol. 2009; 27(21): 3489-95.
- 28 - Moller AK, Pedersen KD, Gothelf A, Daugaard G. Paclitaxel, cisplatin and gemcitabine in treatment of carcinomas of unknown primary site, a phase II study. Acta Oncol. 2010; 49(4): 423-30.
- 29 - Mukai H, Katsumata N, Ando M, Watanabe T. Safety and efficacy of a combination of docetaxel and cisplatin in patients with unknown primary cancer. Am J Clin Oncol. 2010; 33(1): 32-5.
- 30 - Pavlidis N, Pentheroudakis G, Plataniotis G. Cervical lymph node metastases of squamous cell carcinoma from an unknown primary site: a favourable prognosis subset of patients with CUP. Clin Transl Oncol. 2009; 11(6): 340-8.
- 31 - Randen M, Rutqvist LE, Johansson H. Cancer patients without a known primary: incidence and survival trends in Sweden 1960-2007. Acta Oncol. 2009; 48(6): 915-20.
- 32 - Rodel RM, Matthias C, Blomeyer BD, Wolff HA, Jung K, Christiansen H. Impact of distant metastasis in patients with cervical lymph node metastases from cancer of an unknown primary site. Ann Otol Rhinol Laryngol. 2009; 118(9): 662-9.
- 33 - Rutkowski P, Nowecki ZI, Dziewirski W, Zdzienicki M, Pienkowski A, Salamacha M, et al. Melanoma without a detectable primary site with metastases to lymph nodes. Dermatol Surg. 2010; 36(6): 868-76.
- 34 - Schuette K, Folprecht G, Kretzschmar A, Link H, Koehne CH, Gruenwald V, et al. Phase II trial of capecitabine and oxaliplatin in patients with adeno- and undifferentiated carcinoma of unknown primary. Onkologie. 2009; 32(4): 162-6.
- 35 - Varadhachary GR, Greco FA. Overview of patient management and future directions in unknown primary carcinoma. Semin Oncol. 2009; 36(1): 75-80.
- 36 - Yonemori K, Ando M, Yunokawa M, Hirata T, Kouno T, Shimizu C, et al. Irinotecan plus carboplatin for patients with carcinoma of unknown primary site. Br J Cancer. 2009; 100(1): 50-5.
- 37 - Ferte C, Penel N, Bonneterre J, Adenis A. Individual life expectancy estimation using validated prognostic scores for patients with cancer of unknown primary. Oncology. 2010; 78(2): 87-93.
- 38 - Kodaira M, Takahashi S, Yamada S, Ueda K, Mishima Y, Takeuchi K, et al. Bone metastasis and poor performance status are prognostic factors for survival of carcinoma of unknown primary site in patients treated with systematic chemotherapy. Ann Oncol. 2010; 21(6): 1163-7.
- 39 - Penel N, Negrier S, Ray-Coquard I, Ferte C, Devos P, Hollebecque A, et al. Development and validation of a bedside score to predict early death in cancer of unknown primary patients. PLoS One. 2009; 4(8): e6483.
- 40 - van de Wouw AJ, Janssen-Heijnen ML, Coebergh JW, Hillen HF. Epidemiology of unknown primary tumours; incidence and population-based survival of 1285 patients in Southeast Netherlands, 1984-1992. Eur J Cancer. 2002; 38(3): 409-13.
Evidence tabellen
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 24-06-2012
Commentaar en autorisatie
Na het vaststellen van de conceptrichtlijn door de kerngroep is deze ter commentaar rondgestuurd naar de gehele werkgroep. Na verwerking van dit commentaar door de kerngroep is de richtlijn voor commentaar gestuurd naar de verenigingen aan wie ook een knelpunteninventarisatie is gestuurd. Ook hierbij werd het commentaar door de kerngroep verwerkt. Tot slot is de richtlijn ter autorisatie naar de besturen van de (wetenschappelijke) verenigingen gestuurd. Na autorisatie is de richtlijn de professionele standaard voor de leden van die verenigingen. Tijdens de bijeenkomst op 3 en 4 februari 2011 is besloten dat de richtlijn is geaccepteerd, wanneer tenminste de verenigingen die vertegenwoordigd zijn in de kerngroep, aangevuld met de Nederlandse Vereniging voor Radiotherapie en Oncologie, de richtlijn hebben geautoriseerd.
Juridische betekenis
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'.
Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Herziening
De werkgroep vindt dat de richtlijn regelmatig geëvalueerd moet worden en zo nodig op onderdelen moet worden herzien, bijvoorbeeld door 1x per jaar na te gaan of er ontwikkelingen dan wel onbeantwoorde knelpunten zijn die nopen tot bijstelling van de richtlijn. Dat vereist dat de werkgroepleden door hun wetenschappelijke vereniging hiertoe zijn gemandateerd en dat de werkgroep een procedure hanteert waarbij werkgroepleden tussentijds kunnen worden vervangen indien dat wenselijk is. Een werkwijze die men hiervoor kan hanteren is bijvoorbeeld dat ieder werkgroeplid voor de duur van drie jaar wordt benoemd en dat die na drie jaar nog eens voor drie jaar kan worden herbenoemd. Een volgende benoeming kan alleen plaatsvinden indien vanuit de werkgroep door de voorzitter of door de wetenschappelijke vereniging expliciet wordt gevraagd het desbetreffende werkgroeplid nogmaals te benoemen voor drie jaar. Die wijze van herbenoeming kan daarna nog meerdere malen worden herhaald. Bij elke bijstelling is autorisatie vereist door de wetenschappelijke verenigingen die deel uitmaken van de kernwerkgroep. De bijgestelde richtlijn wordt uitgebracht via de daarvoor aangewezen kanalen. De werkgroep zal deze werkwijze proberen uit te voeren, maar is afhankelijk van structurele financiering door bijvoorbeeld de SKMS.
De werkgroep vindt het van belang dat in een revisie van deze richtlijn meer aandacht aan patiëntenvoorlichting zou moeten worden gegeven.
Doel en doelgroep
Doel van de richtlijn
Het doel van deze richtlijn is het bieden van ondersteuning aan zorgverleners bij het realiseren van een uniform en zoveel mogelijk evidence-based beleid voor nadere diagnostiek, behandeling en nazorg van patiënten met een onbekende primaire tumor. Hiermee wordt voorts beoogd diagnostiek te verminderen, samenwerkingsafspraken tussen verschillende specialismen te bevorderen en de informatieoverdracht naar de patiënt te verbeteren.
Deze richtlijn is primair geschreven voor behandelaars van deze patiënten.
Huidige tekortkomingen in het beleid bij patiënten met een onbekende primaire tumor
De diagnostiek en het behandelbeleid bij patiënten met een metastase van onbekende primaire tumor is complex, variabel en niet perfect. De tekortkomingen in het bestaande beleid kunnen worden toegeschreven aan de volgende factoren:
· Het ontbreken van een richtlijn voor deze patiënten
· Gebrek aan wetenschappelijk onderzoek
· Weinig kennis over cellulaire factoren die van belang zijn voor prognose en eventuele therapie keuzes
Samenstelling werkgroep
Om de knelpunten in de zorg voor patiënten met een onbekende primaire tumor te verbeteren is in juni 2010 een multidisciplinaire werkgroep samengesteld. Deze werkgroep bestond uit een kernwerkgroep, die de conceptaanbevelingen opstelde en een ‘schil' die betrokken was bij de inventarisatie van de knelpunten en de commentaarronde. De werkgroepleden hebben onafhankelijk gehandeld en zijn gemandateerd door hun vereniging. De werkgroep werd ondersteund door PROVA en de Nederlandse Vereniging voor Pathologie. Aan de werkgroepleden is gevraagd een belangenverklaring in te vullen, waarin hun eventuele relaties met commerciële bedrijven konden worden aangegeven (zie Belangenverklaringen).
Kerngroep
- Dr. J.J. (Joost) Oudejans, patholoog, Diakonessenhuis, Utrecht, namens de Nederlandse Vereniging voor Pathologie (voorzitter)
- Mw. drs. M.K. (Mariska) Tuut, epidemioloog, PROVA, Varsseveld (secretaris)
- Dr. M.R.W. (Marc) Engelbrecht, radioloog, Academisch Medisch Centrum, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (vanaf december 2010)
- Dr. R.J.J. (Robert) van Es, kaakchirurg-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Werkgroep Hoofd-Hals Tumoren en de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Mw. dr. H.M. (Houke) Klomp, chirurgisch oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Chirurgische Oncologie - Nederlandse Vereniging voor Heelkunde
- Dr. J.A. (Alain) Kummer, patholoog, Antonius Ziekenhuis, Nieuwegein, namens de Nederlandse Vereniging voor Pathologie
- Mw. drs. C.A.H. (Charlotte) Lange, radioloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (tot november 2010)
- Prof. dr. H.A.M. (Henri) Marres, KNO-arts, Radboud Universitair Medisch Centrum, Nijmegen, namens de Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied en de Nederlandse Werkgroep Hoofd-Hals Tumoren
- Prof. dr. J. (Hans) Morreau, patholoog, Leids Universitair Medisch Centrum, Leiden, namens de Nederlandse Vereniging voor Pathologie
- Mw. dr. A.J. (Yes) van de Wouw, internist-oncoloog, VieCuri Medisch Centrum Venlo, namens de Nederlandse Vereniging voor Medische Oncologie
Overige werkgroepleden
- Dr. J.D. (Jeroen) van Bergeijk, Maag-, Darm-, Leverarts, Gelderse Vallei, Ede, namens de Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Mw. drs. T. (Thea) Brouwer, psycholoog, Arnhem, namens de Nederlandse Federatie van Kankerpatiëntenorganisaties
- Drs. H.M.J. (Harry) Groen, longarts, Universitair Medisch Centrum Groningen, namens de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. J.M.G. (Hans) Bonfrer, klinisch chemicus, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Klinische Chemie
- Dr. W.V. (Wouter) Vogel, nucleair geneeskundige, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Nucleaire Geneeskunde
- Mw. drs. E. (Eleonora) van Dorst, gynaecoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. A.P. (Adriaan) Visser, psycholoog, De Vruchtenburg, centrum voor begeleiding bij kanker, Rotterdam, namens de Nederlandse Vereniging voor Psychosociale Oncologie
- Dr. C.H.J. (Chris) Terhaard, radiotherapeut-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Radiotherapie en Oncologie
Betrokken bij knelpunten en commentaarronde:
- Integraal Kankercentrum Nederland (IKNL)
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging voor Urologie
- Verpleegkundigen en Verzorgenden Nederland
Belangenverklaringen
Een overzicht van deze belangenverklaringen is opgenomen. De leden van de kerngroep, alsook de extra ondersteuners, hebben tijdens de tweedaagse op 3 en 4 februari allen een belangenverklaring ingevuld, waarin zij hebben aangegeven of en welke activiteiten zij in de laatste vier jaar hebben ontplooid op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn.
De resultaten van deze inventarisatie staan in een overzicht weergegeven.
|
Naam |
Activiteiten op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn, gedurende de laatste vier jaar |
|
Joost Oudejans (voorzitter) |
Geen |
|
Mariska Tuut (secretaris) |
Geen |
|
Marc Engelbrecht |
Geen |
|
Robert van Es |
Geen |
|
Alain Kummer |
Geen |
|
Hans Morreau |
Geen |
|
Henri Marres |
Geen |
|
Houke Klomp |
Geen |
|
Yes van de Wouw |
Geen |
|
Rinke Borgonjen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Jannes van Everdingen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Geert Kleinnibbelink (procesbegeleider tijdens tweedaagse) |
Geen |
Methode ontwikkeling
Evidence based
Werkwijze
Knelpunteninventarisatie
In december 2009 - januari 2010 is een knelpunteninventarisatie verricht onder verenigingen die betrokken zijn bij de zorg voor mensen met een onbekende primaire tumor. Op basis hiervan is een knelpuntenlijst door de werkgroep vastgesteld in juni 2010.
In de knelpunteninventarisatie is een brief met een voorbereide lijst met mogelijke knelpunten gestuurd naar:
- Nederlands Huisartsen Genootschap
- Nederlandse Federatie van Kankerpatiëntenverenigingen
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Heelkunde
- Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-Halsgebied
- Nederlandse Vereniging voor Klinische Chemie
- Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Nederlandse Vereniging voor Neurologie
- Nederlandse Vereniging voor Nucleaire Geneeskunde
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Pathologie
- Nederlandse Vereniging voor Psychosociale Oncologie
- Nederlandse Vereniging voor Radiologie
- Nederlandse Vereniging voor Radiotherapie en Oncologie
- Nederlandse Werkgroep voor Hoofd-Hals Tumoren
- Vereniging voor Integrale Kankercentra
- Verpleegkundigen en Verzorgenden Nederland - Oncologie
Onderstaande mogelijke knelpunten waren in deze brief opgenomen, met de vraag of de betreffende vereniging deze knelpunten onderschreef en of er aanvulling nodig was.
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine.
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling)
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten
- Uitwendig
- Inwendig (endoscopisch)
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie
- Het optimale begeleidingstraject voor patiënten met een tumor van onbekende origine is niet duidelijk
In juni 2010 is door de werkgroep de lijst met onderstaande knelpunten vastgesteld:
- Er is behoefte aan een eenduidige definitie van het begrip ‘metastase van onbekende origine / primaire tumor onbekend';
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine;
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling);
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties;
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten;
- Uitwendig;
- Inwendig (endoscopisch);
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten;
- Het is onduidelijk wat de rol is van klierextirpatie zonder een cytologische punctie vooraf;
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten;
- Het is onvoldoende duidelijk omschreven welke groepen patiënten te identificeren zijn:
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft;
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn met een relatief gunstige prognose;
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen;
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling;
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie;
- Het optimale begeleidingstraject (inclusief psychosociale begeleiding) voor patiënten met een tumor van onbekende origine is niet duidelijk;
- Het is onbekend hoe groot de behoefte is aan lotgenotencontact en/of psychosociale begeleiding;
- Het is onduidelijk of er een noodzaak bestaat tot het herhalen van de primaire screening bij patiënten met een langere overleving;
- Verwijzingscriteria van eerste naar tweede lijn en omgekeerd zijn niet duidelijk.
Literatuuronderzoek
Bij elk van de uitgangsvragen is uitgebreid gezocht naar literatuur. De recente richtlijn ‘Diagnosis and management of metastatic malignant disease of unknown primary origin' van NICE werd waar mogelijk als input gebruikt, waarbij de literatuur werd geactualiseerd. Voor uitgangsvragen waarbij geen overlap met de NICE richtlijn werd gevonden, is uitgebreid literatuur gezocht. De beschrijving van de literatuursearches is opgenomen in Zoekverantwoording.
Na het zoeken van de literatuur, waarbij grote lijsten met abstracts werden verkregen, is de literatuur geselecteerd. Op basis van de abstracts werd vooral geselecteerd op onderwerp. De artikelen moesten in hoofdzaak gaan over primaire tumor onbekend. Daarnaast werd geselecteerd op origineel onderzoek (bijvoorbeeld systematische reviews, gerandomiseerde klinische trial, cohortonderzoeken) en geen editorials, letters of reviews. Een overzicht van de literatuurselectie per uitgangsvraag is opgenomen in Zoekverantwoording. Daarna werd de literatuur full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. Dit leidde tot verdere selectie, omdat op basis van de full-tekst ook nog artikelen afvielen. Dit staat beschreven in de afzonderlijke hoofdstukken over de verschillende uitgangsvragen. De gebruikte literatuur is samengevat in de inhoudelijke hoofdstukken van deze richtlijn onder het kopje ‘wetenschappelijke onderbouwing'. De korte samenvattingen die gepubliceerd zijn in de evidence review van de NICE-richtlijn zijn, waar van toepassing, integraal overgenomen in het Nederlands.
De literatuur is daarnaast per uitgangsvraag samengevat in evidence tabellen volgens het format van CoCanCPG (bijlage 2). De evidence tabellen (zie Evidence tabellen) zijn ook volgens het format van CoCanCPG en gegradeerd naar mate van bewijs volgens de indeling in bijlage 3.
De literatuur uit de NICE richtlijn is niet separaat gegradeerd. Elke wetenschappelijke onderbouwing is afgesloten met één of meerdere conclusies. Ook aan deze conclusies is een niveau toegekend. Alle gebruikte literatuur is opgenomen in de referentielijst.
Het literatuuronderzoek werd uitgevoerd door een epidemioloog (M.K. Tuut) met input van de werkgroep. Voor de literatuursearches werd ondersteuning verkregen van het CBO.
Totstandkoming aanbevelingen
In een tweedaagse bijeenkomst op 3 en 4 februari 2011 hebben de leden van de kerngroep het evidence rapport (wetenschappelijke onderbouwing en conclusies) beoordeeld en vastgesteld. Op basis van de evidence zijn vervolgens aanbevelingen geformuleerd. Echter, naast de evidence uit de literatuur zijn er ook andere overwegingen die meespelen bij het formuleren van aanbevelingen. Deze zogeheten overige overwegingen zijn expliciet vermeld en zijn onder andere onderstaande overwegingen:
- Klinische relevantie
- Veiligheid
- Patiënten-perspectief
- Professioneel perspectief
- Beschikbaarheid van voorzieningen
- Zorgorganisatie
De aanbevelingen zijn gebaseerd op de evidence, de overige overwegingen en discussie in de werkgroep. De aanbevelingen zijn afgeleid van de antwoorden op de uitgangsvragen. Deze zijn niet gegradeerd. Vanwege zeer recent beschikbaar gekomen evidence is in de autorisatiefase een wijziging doorgevoerd in module over behandelbare metastasen in het hoofd-halsgebied. Hierover is consensus bereikt door de Nederlandse Werkgroep Hoofd Hals Tumoren, Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie en de Nederlandse Vereniging voor Radiotherapie en Oncologie.
Zoekverantwoording
De literatuursearches zijn per uitgangsvraag weergegeven (bijlage 4). De vetgedrukte regels zijn de bestanden waarvan de abstracts zijn beoordeeld in de literatuurselectie.
Alle abstracts die gevonden zijn in de literatuursearch (bijlage 5) zijn beoordeeld op relevantie. Daarbij zijn met name artikelen die niet over onbekende primaire tumoren gingen afgevallen. Ook werd gekeken naar de methodologie. Artikelen waarbij zeker was dat het geen systematisch onderzoek betrof, werden geëxcludeerd (bijvoorbeeld narratieve reviews, letters, case reports). De referenties (ref's) die overbleven na de literatuurselectie werden full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. In de tekst per module is beschreven welke artikelen op basis van full-tekst alsnog afvielen.
