Primaire tumor onbekend - Behandeling: niet behorend tot een behan
Uitgangsvraag
Wat is de effectiviteit van systemische behandeling van patiënten met een metastase van een onbekende origine wanneer gekeken wordt naar mortaliteit en kwaliteit van leven?
Welke palliatieve zorg is effectief voor patiënten met een metastase van een onbekende origine wanneer gekeken wordt naar kwaliteit van leven?
Aanbeveling
Overweeg systemische behandeling bij patiënten met een goede performance status (=0-1).
Overweeg in overleg met de patiënt om van therapie af te zien bij een slechte performance status (> 2).
Geadviseerd wordt chemotherapie bij voorkeur binnen studieverband te geven.
Indien inclusie in een studie niet mogelijk is, bestaat de behandeling bij voorkeur uit een schema dat gericht is op het orgaan waarin de primaire tumor het meest waarschijnlijk is gelokaliseerd. Als er geen richting te geven is, is behandeling met een uniform schema te overwegen (gezien de internationale aanbevelingen geniet gemcitabine/cisplatinum hierin de voorkeur). Behandeling binnen een multidisciplinair team is wenselijk.
Voor ‘best supportive care' wordt verwezen naar de al beschikbare richtlijnen op Oncoline/Pallialine. Een punt van aandacht is hierbij het benoemen en onderkennen dat de primaire onbekende tumoren een aparte groep tumoren zijn; net als andere groepen tumoren. Goede palliatieve zorg is eveneens gebaseerd op een multidisciplinaire benadering.
Overwegingen
De werkgroep vindt het aannemelijk dat patiënten die worden behandeld met chemotherapie voor het orgaan waarin zich mogelijk de primaire tumor bevindt, vergelijkbare uitkomsten hebben met patiënten met gevorderde ziekte van dat orgaan.
De patiëntenpopulaties in de literatuur zijn veelal geselecteerd. Er zitten mogelijk meer patiënten met een goede performance status in de studies en de patiënten die bij voorbaat al niet in aanmerking kwamen voor chemotherapie zitten waarschijnlijk niet in de studies.
Naast chemotherapie kan een specifieke ‘targeted' therapie worden overwogen gericht tegen een tumorspecifieke mutatie, zoals tyrosine kinase remmers bij adenocarcinomen waarbij een EGFR mutatie is aangetoond. In deze groep patiënten is hier echter geen evidence voor.
Onderbouwing
Conclusies / Summary of Findings
|
|
Het is onduidelijk of chemotherapie een voordeel oplevert bij patiënten met een metastase van een onbekende primaire tumor ten opzichte van ‘best supportive care'; een goed vergelijkend onderzoek is nooit verricht. |
|
|
Chemotherapeutische regimes met cisplatinum en/of doxorubicine lijken geassocieerd met een betere respons dan regimes met carboplatine en/of irinotecan bij patiënten met metastasen van een onbekende primaire tumor. |
| Niveau 3 |
Er lijkt geen verschil in effectiviteit tussen behandelingen met paclitaxel/carboplatine/etoposide en gemcitabine/irinotecan. De eerste behandeling lijkt gepaard te gaan met een hogere toxiciteit. |
Samenvatting literatuur
Wetenschappelijke onderbouwing
Vertaling ‘Short Summary' vanuit NICE richtlijn (1):
Chemotherapie voor mensen met een onbekende primaire tumor niet behorend tot een van de behandelbare subgroepen:
Bewijs over chemotherapie voor onbekende primaire tumoren komt van kleine fase II onderzoeken. Er was geen sterk bewijs voor het optimale chemotherapie regime voor de behandeling van mensen met een onbekende primaire tumor (die niet behoren tot een bepaalde subgroep).
Er zijn geen vergelijkende studies tussen chemotherapie en ondersteunende zorg bij patiënten met onbekende primaire tumoren. Observationele studies laten een slechtere totale overleving zien bij patiënten die alleen ondersteunende zorg kregen in vergelijking met patiënten die met chemotherapie werden behandeld. Echter, de evidence suggereert dat fittere patiënten eerder chemotherapie krijgen en dit kan het verschil in overleving verklaren.
Bewijs uit fase II onderzoeken suggereert een iets betere mediane overleving en behandelingsrespons bij platine- of platine-/taxaneregimes dan bij fluorouracil-/anthracyclineregimes, maar dit zou wel gepaard gaan met een grotere behandelingstoxiciteit.
Systemische behandeling bij hersenmetastasen van onbekende origine (op basis van de vermoedelijke primaire origine):
Bewijs vanuit patiëntenseries suggereert dat chemotherapie zelden wordt gebruikt voor de behandeling van mensen met hersenmetastasen van een onbekende primaire tumor. Uit 18 studies waarin meer dan 350 patiënten waren opgenomen waren van slechts 3 patiënten data opgenomen over behandeling met chemotherapie.
Er is onvoldoende gepubliceerd bewijs om een conclusie te kunnen trekken over de effectiviteit van chemotherapie op de vermoedelijke primaire tumor bij deze groep patiënten.
In gerandomiseerd onderzoek is de toevoeging van chemotherapie aan WBRT (whole brain radiotherapy) voor de behandeling van hersenmetastasen van een bekende primaire tumor onderzocht, specifiek bij patiënten met niet-kleincellig longcarcinoom. Een systematische review van drie van deze onderzoeken concludeerde dat het gebruik van chemotherapie in deze groep experimenteel blijft en dat er onvoldoende bewijs is om de effectiviteit te beoordelen.
Chemotherapie gebaseerd op de vermoedelijke primaire tumor bij patiënten met behandelbare entiteiten met onbekende primaire tumoren
Er was een gebrek aan prospectieve studies die systemische behandeling vergeleken met empirische chemotherapie. Patiënten met zogenoemde behandelbare entiteiten worden veelal geëxcludeerd uit klinische onderzoeken over chemotherapie bij onbekende primaire tumoren.
Bewijs uit patiëntenseries en fase II onderzoeken laat zien dat de respons op chemotherapie bij patiënten met behandelbare entiteiten hoger is dan bij de rest van de patiënten met een onbekende primaire tumor.
Het bewijs suggereert bovendien dat de uitkomsten van orgaanspecifieke therapie bij patiënten met behandelbare entiteiten vergelijkbaar zijn met die van patiënten met gevorderde ziekte van dat primaire orgaan.
Geïsoleerde hersenmetastasen van onbekende primaire origine
Er waren geen vergelijkende studies over lokale therapie bij patiënten met een geïsoleerde hersenmetastase van onbekende primaire origine. De totale overleving was beter bij patiënten die lokaal waren behandeld dan bij patiënten die alleen palliatieve radiotherapie kregen. Het is echter aannemelijk dat patiënten die chirurgisch werden behandeld op voorhand al een betere prognose hadden dan patiënten die alleen met palliatieve radiotherapie werden behandeld.
Er was inconsistent bewijs uit gerandomiseerde trials over het effect van chirurgie bij hersenmetastasen op de totale overleving bij patiënten met een bekende primaire tumor. Het bewijs suggereert dat chirurgie functionele onafhankelijke overleving zou kunnen verbeteren en het risico op sterfte vanwege neurologische oorzaken zou kunnen verminderen wanneer dit wordt vergeleken met radiotherapie van de hersenen. Er was niet voldoende bewijs om te kunnen vaststellen welke behandelingsoptie de laagste kans op complicaties had.
De literatuursearch die voor de NICE richtlijn is gedaan, is geactualiseerd. Na deze literatuursearch en de literatuurselectie bleven 12 artikelen over, die full-tekst zijn beoordeeld. Een aantal artikelen viel vervolgens af omdat deze binnen de inclusiecriteria van de NICE evidence review vielen (2) (3) (4) (5). Additioneel werd een aantal artikelen geëxcludeerd vanwege methodologische tekortkomingen of inhoudelijke redenen (omdat het artikel de uitgangsvraag niet beantwoordde) (6) (7) (8).
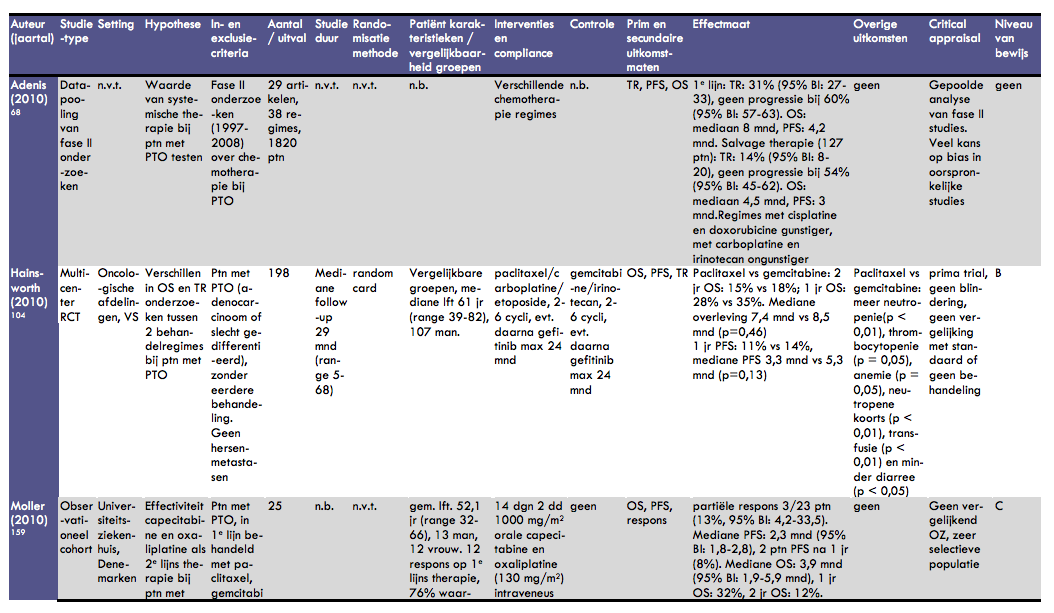
Adenis et al. publiceerden in 2010 een gepoolde analyse van fase II onderzoeken (onderzoek onder een beperkt aantal deelnemers naar nieuwe middelen, niet gerandomiseerd e.d.) naar de werkzaamheid van systemische therapie bij patiënten met een onbekende primaire tumor (9). Het doel was om een relatie te kunnen leggen tussen behandelstrategieën en behandelrespons en overleving (totaal en progressievrij). De resultaten van dit onderzoek zijn behoorlijk beperkt weergegeven in het artikel. Er werden 29 artikelen waarin 38 behandelregimes werden onderzocht geïncludeerd, met een totaal van 1820 patiënten. Als eerstelijns behandeling werden 34 regimes gevonden, waarmee 1380 patiënten werden behandeld. De totale respons (overall respons rate, dus complete en partiële respons) bedroeg 31% (95% BI: 27-33). Het percentage patiënten bij wie tenminste geen progressie werd bereikt was 60% (95% BI: 57-63). De mediane totale overlevingsduur was 8 maanden en de mediane progressievrije overleving bedroeg 4,2 maanden. Bij 440 patiënten werden in totaal vier verschillende behandelregimes als ´salvage´ behandeling toegepast. Slechts bij 127 patiënten werd de behandeling geëvalueerd. De totale respons bedroeg hierbij 14% (95% BI: 8-20) en het percentage patiënten zonder ziekteprogressie bedroeg 54% (95% BI: 45-62). De mediane overleving bij salvage therapie was 4;5 maanden en de mediane progressievrije overleving bedroeg 3 maanden. Wanneer gekeken werd naar de respons op behandeling, bleken 2 behandelingen (cisplatine en doxorubicine) geassocieerd met een betere respons en 2 behandelingen (carboplatine en irinotecan) met een slechtere respons. Hierbij (statistisch significante) relatieve risico's genoemd, waarbij echter niet wordt vermeld waarmee de genoemde therapie is vergeleken (bijvoorbeeld vergeleken met standaardbehandeling of geen behandeling). De waarde van deze bevindingen is derhalve beperkt, zeker ook omdat het een datapooling van fase II onderzoeken betreft.
Hainsworth et al. publiceerden in 2010 de resultaten van een gerandomiseerd fase III onderzoek waarin behandeling van patiënten met een onbekende primaire tumor met paclitaxel/carboplatine/etoposide werd vergeleken met gemcitabine/irinotecan (10). In dit onderzoek werden patiënten met een onbekende primaire tumor (adenocarcinoom of slecht gedifferentieerd carcinoom) zonder bekend syndroom geïncludeerd. Patiënten met (niet behandelde) hersenmetastasen werden geëxcludeerd. Patiënten werden gerandomiseerd voor beide behandelingen. Na (telkens) 2 behandelcycli (6 weken) werd de respons geëvalueerd en bij respons gecontinueerd tot een maximum van 6 cycli. Daarna kregen patiënten in beide groepen gefitinib gedurende maximaal 24 maanden (tot tumorprogressie). In totaal werden 198 patiënten (vanuit 27 ziekenhuizen) geïncludeerd in dit onderzoek. In de paclitaxelgroep zaten 93 patiënten en in de gemcitabinegroep 150 patiënten. De groepen waren vergelijkbaar qua klinische karakteristieken, leeftijd, geslacht, performance status en metastasering. De mediane leeftijd was 61 jaar (range 39 - 82 jaar), 107 patiënten waren man. Het mediane aantal behandelcycli was 3 in de paclitaxelgroep en 4 in de gemcitabinegroep. Van alle patiënten waren er 76 (38%) die alle geplande chemotherapie kregen en daarna werden behandeld met gefitinib. De mediane behandelduur met gefitinib was 12 weken (range 1-60 weken). Na een mediane follow-up van 29 maanden (range 5 - 68 maanden) waren 31 patiënten (16%) nog in leven. Vergelijkingen in totale overleving tussen het paclitaxelregime en het gemcitabineregime lieten geen statistisch significant verschil zien (p = 0,46): 2-jaarsoverleving 15% versus 18%, 1-jaarsoverleving 28% versus 35% en mediane overleving 7,4 maanden versus 8,5 maanden. Ook het verschil in progressievrije overleving was niet statistisch significant (p = 0,13): mediane progressievrije overleving: 3,3 maanden versus 5,3 maanden; 1-jaars progressievrije overleving: 11% versus 14%. De responspercentages waren in beide behandelgroepen gelijk. Behandeling met het gemcitabineregime leidde tot significant minder behandelingsgerelateerde toxiciteit dan behandeling met het paclitaxelregime, met name voor wat betreft neutropenie (p < 0,01), thrombocytopenie (p = 0,05), anemie (p = 0,05), neutropene koorts (p < 0,01), transfusie (p < 0,01) en diarree (p < 0,05), waarbij dit laatste juist meer bij patiënten met het gemcitabineregime voorkwam.
Moller et al. bestudeerden de werking van capecitabine en oxaliplatine als tweedelijns behandeling van patiënten met een onbekende primaire tumor (11). Hiertoe includeerden zij 25 patiënten die als eerstelijnstherapie een combinatie van paclitaxel, gemcitabine en platinum hadden gehad. De verwachting hierbij was dat deze patiënten een grotere kans op een primaire tumor in het gastro-intestinale stelsel zouden hebben. De behandeling bestond uit 14 dagen tweemaal daags 1000 mg/m2 orale capecitabine en oxaliplatine (130 mg/m2) intraveneus op dag 1. Deze behandelingscyclus werd elke 21 dagen herhaald, totdat er ziekteprogressie of onacceptabele toxiciteit optrad of de patiënt zich terugtrok. De gemiddelde leeftijd van de patiënten was 52 jaar (range 32 - 66 jaar); de groep bestond uit 13 mannen en 12 vrouwen. Bij 12 patiënten was een respons op basis van de eerstelijns behandeling vastgesteld met een mediane progressievrije overleving van 6 maanden (95% BI: 5 - 7 maanden). In de meerderheid van de patiënten (76%) leek een primaire tumor in het gastro-intestinale stelsel op basis van histopathologie aannemelijk. Het mediane aantal behandelcyli bedroeg 3 (range 1 - 19). Dosisverlaging was nodig bij 5 patiënten; 7 patiënten stopten met de behandeling voor de eerste evaluatie. Bij 23 patiënten werd (intention-to-treat) analyse gedaan. Een partiële respons werd gezien bij 3 patiënten (13%; 95% BI: 4% - 34%). De mediane progressievrije overleving bij alle 25 patiënten was 2 maanden (95% BI: 2 - 3 maanden); 2 patiënten waren progressievrij na een jaar (8%). De mediane totale overleving was 4 maanden (95% BI: 2-6 maanden); de 1-jaarsoverleving was 32% (8 patiënten) en de 2-jaarsoverleving 12% (3 patiënten).
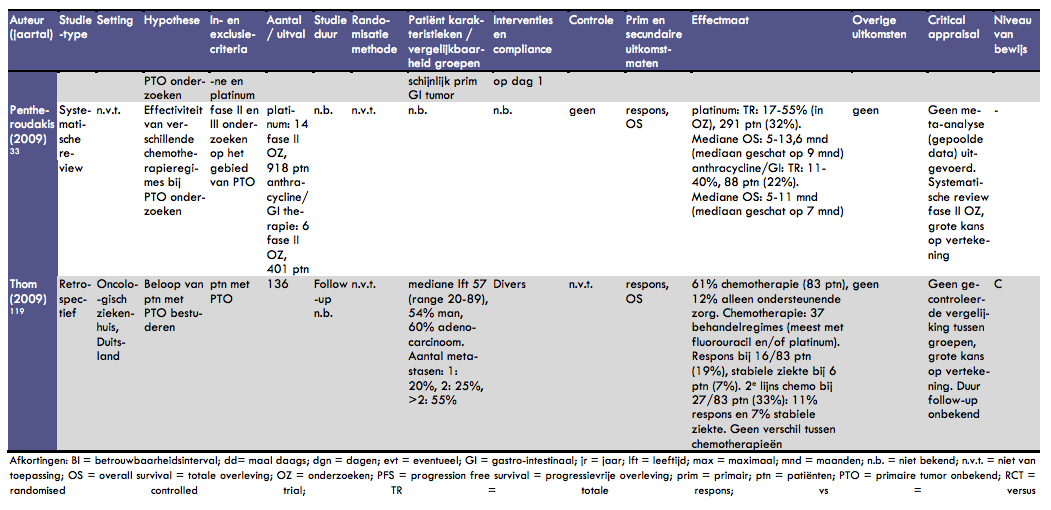
In de systematische review van Pentheroudakis et al. werd onder meer gekeken naar de effectiviteit van verschillende chemotherapieregimes voor de behandeling van patiënten met een onbekende primaire tumor (12). De methoden en resultaten zijn vrij beperkt weergegeven in het artikel. In totaal werden 14 fase II onderzoeken met tenminste 30 patiënten over platinumgebaseerde behandelregimes geïncludeerd. In totaal werden hierin 918 patiënten met een onbekende primaire tumor opgenomen. Patiëntenkarakteristieken zijn niet in het artikel opgenomen. De responsrates varieerden van 17% tot 55% (veelal tussen 20-30%). In totaal was er bij 291 patiënten (32%) een reactie op de gegeven chemotherapie. De mediane overleving in de geïncludeerde onderzoeken varieerde van 5 tot 13,6 maanden. De mediane overleving lijkt ongeveer 9 maanden te zijn in deze groep patiënten. In de review waren ook 6 fase II onderzoeken opgenomen die antrhacycline of op gastro-intestinale tumoren gerichte chemotherapie onderzochten. Hierin werden in totaal 401 patiënten geïncludeerd. De responsrates varieerden hierbij van 11% tot 40% (veelal tussen 15-25%). In totaal werd er bij 88 patiënten een respons op de chemotherapie gezien (22%). De mediane overleving varieerde van 5 tot 11 maanden; de mediane overleving leek hierbij ongeveer 7 maanden te zijn. Er wordt in dit artikel veel gebruik gemaakt van schattingen en er is geen gepoolde data-analyse gedaan. Bovendien zijn de genoemde resultaten gebaseerd op gepubliceerde fase II onderzoeken, waarbij de kans op vertekening van de resultaten vrij groot is.
In het artikel van Thom et al. wordt het behandelbeleid van 136 patiënten met een onbekende primaire tumor in een periode van 10 jaar besproken (13). Het betreft een retrospectieve studie waarin de progressievrije en totale overleving zijn bestudeerd als ook factoren die daarop van invloed zouden zijn. De mediane leeftijd van de patiënten bedroeg 57 jaar (range 20 - 89 jaar), 54% van hen was man en 60% had een adenocarcinoom. 20% van de patiënten had 1 metastase, 25% had 2 metastasen en 55% had 3 of meer metastasen. Er was een grote diversiteit in behandelbeleid, maar 61% van de patiënten onderging chemotherapie. Vanwege de slechte performance status kreeg 12% van de patiënten alleen ondersteunende zorg. Als eerstelijns chemotherapie werden 37 verschillende behandelregimes gebruikt. De meeste regimes bevatten 5-fluorouracil en/of platinum. Respons werd gezien bij 16/83 patiënten die eerstelijns chemotherapie gebruikten (19%). Daarnaast werd stabiele ziekte gezien bij 6 patiënten (7%). Tweedelijns chemotherapie werd gegeven aan 27/83 patiënten (33%). Hierbij trad bij 11% respons op en bij 7% stabiele ziekte. Bij de follow-up (duur onbekend) was 4% nog in leven, 85% overleden en 11% lost-to-follow-up. Een subgroepanalyse liet geen verschillen tussen soort chemotherapie zien op de totale overleving. Er is in dit onderzoek geen sprake van gecontroleerde vergelijking tussen groepen patiënten. De kans op vertekening van de resultaten is dan ook behoorlijk groot.
Geïsoleerde hersenmetastasen
In het onderzoek van Niranjan et al. werd gekeken naar het effect van stereotactische radiochirurgie bij patiënten met hersenmetastasen van onbekende primaire origine (14). In deze studies zijn 29 patiënten met hersenmetastasen zonder bekende primaire tumor geïncludeerd; het betreft 15 mannen en 14 vrouwen met een gemiddelde leeftijd van 61,7 jaar (range 37,9 - 78,7 jaar). Van deze patiënten hadden er 10 solitaire hersenmetastasen. De overige 19 patiënten hadden multipele hersenmetastasen (range 2 - 11). Alle patiënten werden behandeld met eenmalige stereotactische radiochirurgie. Het mediane en gemiddelde tumorvolume was 1,0 cc en 2,8 cc (range 0,02 - 23,7 cc). De mediane bestralingsdosis was 16,0 Gray (range 13-25 Gray). De mediane totale overleving was 12 maanden. Bij geen van de patiënten ontstonden bijwerkingen als gevolg van de radiotherapeutische behandeling. Bij de follow-up (mediaan 7,8 maanden; range 2,5-194 maanden) waren 5 patiënten nog in leven en 24 patiënten overleden. De totale overleving na stereotactische radiochirurgie was 82,8% na 6 maanden en 57,2% na 12 maanden. Uit univariate analyse bleek dat lokalisatie van de metastase in de hersenstam de enige statistisch significante prognostische variabele was die geassocieerd was met een slechtere totale overleving (p < 0,0001). In dit onderzoek is stereotactische radiotherapie niet vergeleken met een andere of geen behandeling; alle patiënten in het onderzoek hebben immers dezelfde behandeling ondergaan. Daardoor is het niet mogelijk iets te zeggen over de meerwaarde van stereotactische radiotherapie.
Referenties
- 1 - NICE. NIfHaCE. Diagnosis and management of metastatic malignant disease of unknown primary origin. Full Guideline. 2010 [cited; Available from: http://www.nice.org.uk/nicemedia/live/13044/49864/49864.pdf
- 2 - Lazaridis G, Pentheroudakis G, Fountzilas G, Pavlidis N. Liver metastases from cancer of unknown primary (CUPL): a retrospective analysis of presentation, management and prognosis in 49 patients and systematic review of the literature. Cancer Treat Rev. 2008; 34(8): 693-700.
- 3 - Huebner G, Link H, Kohne CH, Stahl M, Kretzschmar A, Steinbach S, et al. Paclitaxel and carboplatin vs gemcitabine and vinorelbine in patients with adeno- or undifferentiated carcinoma of unknown primary: a randomised prospective phase II trial. Br J Cancer. 2009; 100(1): 44-9.
- 4 - Golfinopoulos V, Pentheroudakis G, Salanti G, Nearchou AD, Ioannidis JP, Pavlidis N. Comparative survival with diverse chemotherapy regimens for cancer of unknown primary site: multiple-treatments meta-analysis. Cancer Treat Rev. 2009; 35(7): 570-3.
- 5 - Varadhachary GR, Raber MN, Matamoros A, Abbruzzese JL. Carcinoma of unknown primary with a colon-cancer profile-changing paradigm and emerging definitions. Lancet Oncol. 2008; 9(6): 596-9.
- 6 - Morawietz L, Floore A, Stork-Sloots L, Folprecht G, Buettner R, Rieger A, et al. [Comparing immunohistochemical diagnosis of cancer of unknown primary with gene expression-based tumor classification]. Pathologe. 2009; 30 Suppl 2: 168-72.
- 7 - Pentheroudakis G, Pavlidis N. Serous papillary peritoneal carcinoma: unknown primary tumour, ovarian cancer counterpart or a distinct entity? A systematic review. Crit Rev Oncol Hematol. 2010; 75(1): 27-42.
- 8 - Sendler A, Strumberg D, Tannapfel A. [Carcinoma of unknown primary site (CUP syndrome)]. Chirurg. 2008; 79(7): 689-95; quiz 96.
- 9 - Adenis A, Ferte C, Penel N. Phase II trials in patients with carcinoma of unknown primary: a pooled data analysis. Invest New Drugs. 2010; 28(2): 178-84.
- 10 - Hainsworth JD, Spigel DR, Clark BL, Shipley D, Thompson DS, Farley C, et al. Paclitaxel/carboplatin/etoposide versus gemcitabine/irinotecan in the first-line treatment of patients with carcinoma of unknown primary site: a randomized, phase III Sarah Cannon Oncology Research Consortium Trial. Cancer J. 2010; 16(1): 70-5.
- 11 - Moller AK, Pedersen KD, Abildgaard J, Petersen BL, Daugaard G. Capecitabine and oxaliplatin as second-line treatment in patients with carcinoma of unknown primary site. Acta Oncol. 2010; 49(4): 431-5.
- 12 - Pentheroudakis G, Greco FA, Pavlidis N. Molecular assignment of tissue of origin in cancer of unknown primary may not predict response to therapy or outcome: a systematic literature review. Cancer Treat Rev. 2009; 35(3): 221-7.
- 13 - Thom I, Rogers C, Andritzky B, Witzel I, Schuch G, Hossfeld DK, et al. Single-center management of 136 patients with cancer of unknown primary site (CUP syndrome) over a period of 10 years. Onkologie. 2009; 32(12): 741-6.
- 14 - Niranjan A, Kano H, Khan A, Kim IY, Kondziolka D, Flickinger JC, et al. Radiosurgery for brain metastases from unknown primary cancers. Int J Radiat Oncol Biol Phys. 2010; 77(5): 1457-62.
Evidence tabellen
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 24-06-2012
Commentaar en autorisatie
Na het vaststellen van de conceptrichtlijn door de kerngroep is deze ter commentaar rondgestuurd naar de gehele werkgroep. Na verwerking van dit commentaar door de kerngroep is de richtlijn voor commentaar gestuurd naar de verenigingen aan wie ook een knelpunteninventarisatie is gestuurd. Ook hierbij werd het commentaar door de kerngroep verwerkt. Tot slot is de richtlijn ter autorisatie naar de besturen van de (wetenschappelijke) verenigingen gestuurd. Na autorisatie is de richtlijn de professionele standaard voor de leden van die verenigingen. Tijdens de bijeenkomst op 3 en 4 februari 2011 is besloten dat de richtlijn is geaccepteerd, wanneer tenminste de verenigingen die vertegenwoordigd zijn in de kerngroep, aangevuld met de Nederlandse Vereniging voor Radiotherapie en Oncologie, de richtlijn hebben geautoriseerd.
Juridische betekenis
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'.
Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Herziening
De werkgroep vindt dat de richtlijn regelmatig geëvalueerd moet worden en zo nodig op onderdelen moet worden herzien, bijvoorbeeld door 1x per jaar na te gaan of er ontwikkelingen dan wel onbeantwoorde knelpunten zijn die nopen tot bijstelling van de richtlijn. Dat vereist dat de werkgroepleden door hun wetenschappelijke vereniging hiertoe zijn gemandateerd en dat de werkgroep een procedure hanteert waarbij werkgroepleden tussentijds kunnen worden vervangen indien dat wenselijk is. Een werkwijze die men hiervoor kan hanteren is bijvoorbeeld dat ieder werkgroeplid voor de duur van drie jaar wordt benoemd en dat die na drie jaar nog eens voor drie jaar kan worden herbenoemd. Een volgende benoeming kan alleen plaatsvinden indien vanuit de werkgroep door de voorzitter of door de wetenschappelijke vereniging expliciet wordt gevraagd het desbetreffende werkgroeplid nogmaals te benoemen voor drie jaar. Die wijze van herbenoeming kan daarna nog meerdere malen worden herhaald. Bij elke bijstelling is autorisatie vereist door de wetenschappelijke verenigingen die deel uitmaken van de kernwerkgroep. De bijgestelde richtlijn wordt uitgebracht via de daarvoor aangewezen kanalen. De werkgroep zal deze werkwijze proberen uit te voeren, maar is afhankelijk van structurele financiering door bijvoorbeeld de SKMS.
De werkgroep vindt het van belang dat in een revisie van deze richtlijn meer aandacht aan patiëntenvoorlichting zou moeten worden gegeven.
Doel en doelgroep
Doel van de richtlijn
Het doel van deze richtlijn is het bieden van ondersteuning aan zorgverleners bij het realiseren van een uniform en zoveel mogelijk evidence-based beleid voor nadere diagnostiek, behandeling en nazorg van patiënten met een onbekende primaire tumor. Hiermee wordt voorts beoogd diagnostiek te verminderen, samenwerkingsafspraken tussen verschillende specialismen te bevorderen en de informatieoverdracht naar de patiënt te verbeteren.
Deze richtlijn is primair geschreven voor behandelaars van deze patiënten.
Huidige tekortkomingen in het beleid bij patiënten met een onbekende primaire tumor
De diagnostiek en het behandelbeleid bij patiënten met een metastase van onbekende primaire tumor is complex, variabel en niet perfect. De tekortkomingen in het bestaande beleid kunnen worden toegeschreven aan de volgende factoren:
· Het ontbreken van een richtlijn voor deze patiënten
· Gebrek aan wetenschappelijk onderzoek
· Weinig kennis over cellulaire factoren die van belang zijn voor prognose en eventuele therapie keuzes
Samenstelling werkgroep
Om de knelpunten in de zorg voor patiënten met een onbekende primaire tumor te verbeteren is in juni 2010 een multidisciplinaire werkgroep samengesteld. Deze werkgroep bestond uit een kernwerkgroep, die de conceptaanbevelingen opstelde en een ‘schil' die betrokken was bij de inventarisatie van de knelpunten en de commentaarronde. De werkgroepleden hebben onafhankelijk gehandeld en zijn gemandateerd door hun vereniging. De werkgroep werd ondersteund door PROVA en de Nederlandse Vereniging voor Pathologie. Aan de werkgroepleden is gevraagd een belangenverklaring in te vullen, waarin hun eventuele relaties met commerciële bedrijven konden worden aangegeven (zie Belangenverklaringen).
Kerngroep
- Dr. J.J. (Joost) Oudejans, patholoog, Diakonessenhuis, Utrecht, namens de Nederlandse Vereniging voor Pathologie (voorzitter)
- Mw. drs. M.K. (Mariska) Tuut, epidemioloog, PROVA, Varsseveld (secretaris)
- Dr. M.R.W. (Marc) Engelbrecht, radioloog, Academisch Medisch Centrum, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (vanaf december 2010)
- Dr. R.J.J. (Robert) van Es, kaakchirurg-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Werkgroep Hoofd-Hals Tumoren en de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Mw. dr. H.M. (Houke) Klomp, chirurgisch oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Chirurgische Oncologie - Nederlandse Vereniging voor Heelkunde
- Dr. J.A. (Alain) Kummer, patholoog, Antonius Ziekenhuis, Nieuwegein, namens de Nederlandse Vereniging voor Pathologie
- Mw. drs. C.A.H. (Charlotte) Lange, radioloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (tot november 2010)
- Prof. dr. H.A.M. (Henri) Marres, KNO-arts, Radboud Universitair Medisch Centrum, Nijmegen, namens de Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied en de Nederlandse Werkgroep Hoofd-Hals Tumoren
- Prof. dr. J. (Hans) Morreau, patholoog, Leids Universitair Medisch Centrum, Leiden, namens de Nederlandse Vereniging voor Pathologie
- Mw. dr. A.J. (Yes) van de Wouw, internist-oncoloog, VieCuri Medisch Centrum Venlo, namens de Nederlandse Vereniging voor Medische Oncologie
Overige werkgroepleden
- Dr. J.D. (Jeroen) van Bergeijk, Maag-, Darm-, Leverarts, Gelderse Vallei, Ede, namens de Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Mw. drs. T. (Thea) Brouwer, psycholoog, Arnhem, namens de Nederlandse Federatie van Kankerpatiëntenorganisaties
- Drs. H.M.J. (Harry) Groen, longarts, Universitair Medisch Centrum Groningen, namens de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. J.M.G. (Hans) Bonfrer, klinisch chemicus, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Klinische Chemie
- Dr. W.V. (Wouter) Vogel, nucleair geneeskundige, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Nucleaire Geneeskunde
- Mw. drs. E. (Eleonora) van Dorst, gynaecoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. A.P. (Adriaan) Visser, psycholoog, De Vruchtenburg, centrum voor begeleiding bij kanker, Rotterdam, namens de Nederlandse Vereniging voor Psychosociale Oncologie
- Dr. C.H.J. (Chris) Terhaard, radiotherapeut-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Radiotherapie en Oncologie
Betrokken bij knelpunten en commentaarronde:
- Integraal Kankercentrum Nederland (IKNL)
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging voor Urologie
- Verpleegkundigen en Verzorgenden Nederland
Belangenverklaringen
Een overzicht van deze belangenverklaringen is opgenomen. De leden van de kerngroep, alsook de extra ondersteuners, hebben tijdens de tweedaagse op 3 en 4 februari allen een belangenverklaring ingevuld, waarin zij hebben aangegeven of en welke activiteiten zij in de laatste vier jaar hebben ontplooid op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn.
De resultaten van deze inventarisatie staan in een overzicht weergegeven.
|
Naam |
Activiteiten op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn, gedurende de laatste vier jaar |
|
Joost Oudejans (voorzitter) |
Geen |
|
Mariska Tuut (secretaris) |
Geen |
|
Marc Engelbrecht |
Geen |
|
Robert van Es |
Geen |
|
Alain Kummer |
Geen |
|
Hans Morreau |
Geen |
|
Henri Marres |
Geen |
|
Houke Klomp |
Geen |
|
Yes van de Wouw |
Geen |
|
Rinke Borgonjen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Jannes van Everdingen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Geert Kleinnibbelink (procesbegeleider tijdens tweedaagse) |
Geen |
Methode ontwikkeling
Evidence based
Werkwijze
Knelpunteninventarisatie
In december 2009 - januari 2010 is een knelpunteninventarisatie verricht onder verenigingen die betrokken zijn bij de zorg voor mensen met een onbekende primaire tumor. Op basis hiervan is een knelpuntenlijst door de werkgroep vastgesteld in juni 2010.
In de knelpunteninventarisatie is een brief met een voorbereide lijst met mogelijke knelpunten gestuurd naar:
- Nederlands Huisartsen Genootschap
- Nederlandse Federatie van Kankerpatiëntenverenigingen
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Heelkunde
- Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-Halsgebied
- Nederlandse Vereniging voor Klinische Chemie
- Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Nederlandse Vereniging voor Neurologie
- Nederlandse Vereniging voor Nucleaire Geneeskunde
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Pathologie
- Nederlandse Vereniging voor Psychosociale Oncologie
- Nederlandse Vereniging voor Radiologie
- Nederlandse Vereniging voor Radiotherapie en Oncologie
- Nederlandse Werkgroep voor Hoofd-Hals Tumoren
- Vereniging voor Integrale Kankercentra
- Verpleegkundigen en Verzorgenden Nederland - Oncologie
Onderstaande mogelijke knelpunten waren in deze brief opgenomen, met de vraag of de betreffende vereniging deze knelpunten onderschreef en of er aanvulling nodig was.
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine.
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling)
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten
- Uitwendig
- Inwendig (endoscopisch)
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie
- Het optimale begeleidingstraject voor patiënten met een tumor van onbekende origine is niet duidelijk
In juni 2010 is door de werkgroep de lijst met onderstaande knelpunten vastgesteld:
- Er is behoefte aan een eenduidige definitie van het begrip ‘metastase van onbekende origine / primaire tumor onbekend';
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine;
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling);
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties;
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten;
- Uitwendig;
- Inwendig (endoscopisch);
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten;
- Het is onduidelijk wat de rol is van klierextirpatie zonder een cytologische punctie vooraf;
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten;
- Het is onvoldoende duidelijk omschreven welke groepen patiënten te identificeren zijn:
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft;
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn met een relatief gunstige prognose;
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen;
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling;
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie;
- Het optimale begeleidingstraject (inclusief psychosociale begeleiding) voor patiënten met een tumor van onbekende origine is niet duidelijk;
- Het is onbekend hoe groot de behoefte is aan lotgenotencontact en/of psychosociale begeleiding;
- Het is onduidelijk of er een noodzaak bestaat tot het herhalen van de primaire screening bij patiënten met een langere overleving;
- Verwijzingscriteria van eerste naar tweede lijn en omgekeerd zijn niet duidelijk.
Literatuuronderzoek
Bij elk van de uitgangsvragen is uitgebreid gezocht naar literatuur. De recente richtlijn ‘Diagnosis and management of metastatic malignant disease of unknown primary origin' van NICE werd waar mogelijk als input gebruikt, waarbij de literatuur werd geactualiseerd. Voor uitgangsvragen waarbij geen overlap met de NICE richtlijn werd gevonden, is uitgebreid literatuur gezocht. De beschrijving van de literatuursearches is opgenomen in Zoekverantwoording.
Na het zoeken van de literatuur, waarbij grote lijsten met abstracts werden verkregen, is de literatuur geselecteerd. Op basis van de abstracts werd vooral geselecteerd op onderwerp. De artikelen moesten in hoofdzaak gaan over primaire tumor onbekend. Daarnaast werd geselecteerd op origineel onderzoek (bijvoorbeeld systematische reviews, gerandomiseerde klinische trial, cohortonderzoeken) en geen editorials, letters of reviews. Een overzicht van de literatuurselectie per uitgangsvraag is opgenomen in Zoekverantwoording. Daarna werd de literatuur full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. Dit leidde tot verdere selectie, omdat op basis van de full-tekst ook nog artikelen afvielen. Dit staat beschreven in de afzonderlijke hoofdstukken over de verschillende uitgangsvragen. De gebruikte literatuur is samengevat in de inhoudelijke hoofdstukken van deze richtlijn onder het kopje ‘wetenschappelijke onderbouwing'. De korte samenvattingen die gepubliceerd zijn in de evidence review van de NICE-richtlijn zijn, waar van toepassing, integraal overgenomen in het Nederlands.
De literatuur is daarnaast per uitgangsvraag samengevat in evidence tabellen volgens het format van CoCanCPG (bijlage 2). De evidence tabellen (zie Evidence tabellen) zijn ook volgens het format van CoCanCPG en gegradeerd naar mate van bewijs volgens de indeling in bijlage 3.
De literatuur uit de NICE richtlijn is niet separaat gegradeerd. Elke wetenschappelijke onderbouwing is afgesloten met één of meerdere conclusies. Ook aan deze conclusies is een niveau toegekend. Alle gebruikte literatuur is opgenomen in de referentielijst.
Het literatuuronderzoek werd uitgevoerd door een epidemioloog (M.K. Tuut) met input van de werkgroep. Voor de literatuursearches werd ondersteuning verkregen van het CBO.
Totstandkoming aanbevelingen
In een tweedaagse bijeenkomst op 3 en 4 februari 2011 hebben de leden van de kerngroep het evidence rapport (wetenschappelijke onderbouwing en conclusies) beoordeeld en vastgesteld. Op basis van de evidence zijn vervolgens aanbevelingen geformuleerd. Echter, naast de evidence uit de literatuur zijn er ook andere overwegingen die meespelen bij het formuleren van aanbevelingen. Deze zogeheten overige overwegingen zijn expliciet vermeld en zijn onder andere onderstaande overwegingen:
- Klinische relevantie
- Veiligheid
- Patiënten-perspectief
- Professioneel perspectief
- Beschikbaarheid van voorzieningen
- Zorgorganisatie
De aanbevelingen zijn gebaseerd op de evidence, de overige overwegingen en discussie in de werkgroep. De aanbevelingen zijn afgeleid van de antwoorden op de uitgangsvragen. Deze zijn niet gegradeerd. Vanwege zeer recent beschikbaar gekomen evidence is in de autorisatiefase een wijziging doorgevoerd in module over behandelbare metastasen in het hoofd-halsgebied. Hierover is consensus bereikt door de Nederlandse Werkgroep Hoofd Hals Tumoren, Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie en de Nederlandse Vereniging voor Radiotherapie en Oncologie.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
