Chirurgische technieken bij primaire spontane pneumothorax
Uitgangsvraag
Welke chirurgische techniek (pleura-interventie) tijdens VATS heeft de voorkeur bij patiënten met een primaire spontane pneumothorax?
Aanbeveling
Indien een VATS wordt uitgevoerd; behandel patiënten met een primaire spontane pneumothorax met een pleura-interventie tijdens VATS, daarbij zijn mechanische pleurodese, chemische pleurodese en pleurectomie bruikbare technieken.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Zes RCT’s hebben verschillende chirurgische interventies tijdens VATS omschreven, waarvan vijf uitgevoerd in Azië en één in Europa. Alle studies hebben verschillende technieken vergeleken (pleurectomie, mechanische/chemische pleurodese of geen pleurale interventie). Ondanks dat de studieomvang van deze studies redelijk goed is, is het door de variatie in interventies niet mogelijk om een generieke uitspraak te doen over welke chirurgische techniek resulteert in de beste patiëntuitkomsten. Mogelijk resulteert het uitvoeren van een pleura-interventie, ten opzichte van geen pleurale interventie, wel tot een lagere recidiefkans. Voor alle uitkomstmaten geldt dat de kwaliteit van het bewijs is beoordeeld als zeer laag. In de geïncludeerde studies werd bij alle patiënten ook een bullectomie uitgevoerd tijdens de operatie. Hierdoor kan geen uitspraak worden gedaan over de waarde van een geïsoleerde chirurgische pleura-interventie als behandeling van een primaire spontane pneumothorax.
In 2016 is er een systematische review verschenen naar de associatie tussen veelgebruikte interventietechnieken (wig resectie, pleurectomie, pleurale abrasie, chemische pleurodese en staple line covering) bij patiënten met een primaire spontane pneumothorax (Sudduth, 2016). Deze systematische review includeerde 51 studies, bestaande uit 6,907 patiënten. De primaire uitkomstmaat was recidiefkans. De systematische review includeerde cohort studies en case series. Een wigresectie inclusief chemische pleurodese (1,7% (95%-BI: 1,0 tot 2,7) en wigresectie inclusief pleurale abrasie én chemische pleurodese (2,8% (95%-BI: 1,7 tot 4,7) resulteert mogelijk in een lagere recidiefkans in vergelijking met enkel een wigresectie (9,7% (95%-BI: 7,7 tot 12,2). De geïncludeerde studies zijn veelal case series, waarbij de heterogeniteit in de behandelgroepen ook een grote rol speelt. Het is dus niet mogelijk om hier een harde conclusie uit te trekken.
Het is van belang om de mogelijke voor- en nadelen mee te wegen bij de keuze voor de gewenste chirurgische techniek: Als er geen pleurale-interventie uitgevoerd wordt, heeft de patiënt mogelijk een hoger risico op een recidief pneumothorax (Chung, 2008; Min, 2014, Lee, 2014). Het aantal cases in deze studies is klein en het verschil is niet significant. Maar de effectschatters wijzen in alle studies in het voordeel van een pleurale interventie. Het toevoegen van chemische pleurodese resulteert mogelijk in een betere recidiefkans, maar er is een kans op meer (vroeg)postoperatieve pijnklachten en meer gebruik van pijnmedicatie (Chen, 2006; Chen, 2012).
De ervaring leert dat een pleurectomie mogelijk resulteert in een hoger risico op hemopneumothorax. Chen (2012) vindt ook vaker een hemopneumothorax na een pleurectomie (3,8%) in vergelijking met een chemische én mechanische pleurodese (0%).
Chemische pleurodese versus VATS
Een andere vraag uit de praktijk is wat de plaats is van een chemische pleurodese via een drain (door de longarts) ten opzichte van een operatieve behandeling middels VATS bij een primaire spontane pneumothorax. Er zijn momenteel geen studies beschikbaar die een pleurodese middels een drain vergelijken met een VATS bij patiënten met een primaire spontane pneumothorax. Er is één studie die heeft gekeken naar talk pleurodese via een drain (n=39) in vergelijking met VATS (n=22) bij patiënten met een secundaire spontane pneumothorax (> 50 jaar) (Kim, 2011). Patiënten die VATS ondergingen hadden een goede conditie, maar hadden onder andere meerdere bullae, inadequate long expansie en langdurige luchtlekkage (> 5 dagen). De VATS groep had een lagere leeftijd (61,3 jaar) in vergelijking met de patiënten met een pleurodese via een drain (71,8 jaar). Talk pleurodese middels VATS resulteerde in een kortere opnameduur (10,6 ± 5,8 dagen) in vergelijking met de pleurodese via een drain (14,2 ± 14,2 dagen). Patiënten met een pleurodese via VATS hadden ook een lagere recidiefkans (4,5% versus 30,7%). Doordat de patiënten met een VATS een betere conditie hadden op baseline, kan dit ook de lagere recidiefkans verklaren. Op basis van deze studie kan de vraag over chemische pleurodese via een drain ten opzichte van VATS nog niet beantwoord worden.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Er zijn geen patiëntvoorkeuren bekend bij de verschillende chirurgische technieken.
Kosten (middelenbeslag)
De kosten voor de verschillende technieken zijn niet substantieel verschillend en hebben geen invloed op de keuze voor een chirurgische techniek.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Samenvattend kan er op basis van de huidige literatuur geen voorkeur worden uitgesproken wat betreft de meest optimale vorm van pleura-interventie ten tijde van een chirurgische behandeling van PSP, noch op basis van recidiefkans noch op basis van postoperatieve complicaties. Alle studies betroffen patiënten met een bullectomie, waardoor er geen uitspraak kan worden gedaan over de waarde van een geïsoleerde chirurgische pleura-interventie als behandeling van een PSP.
Onderbouwing
Achtergrond
VATS (video assisted thoracoscopy) is momenteel de voorkeursbenadering voor de chirurgische behandeling van pneumothorax. Centraal in de operatieve strategie is een aanpak om de longvliezen te laten verkleven om een toekomstig recidief te voorkomen. Dit kan bestaan uit onder andere een chemische pleurodese door middel van een intrapleurale toediening van een scleroserende stof, een mechanische pleurodese (abrasie) of een pleurectomie. De optimale methode is onduidelijk. In de chirurgische praktijk zijn er veel verschillen tussen klinieken en chirurgen onderling, mede door onduidelijkheid over de meest optimale operatieve strategie.
Conclusies / Summary of Findings
Recidiefkans
|
Zeer laag GRADE |
Het is onzeker welke techniek (pleura-interventie) tijdens VATS resulteert in een lagere recidiefkans.
Bronnen: (Chen, 2006; Chung, 2008; Chen, 2012; Rena, 2008; Min, 2014; Lee, 2014) |
Complicaties
|
Zeer laag GRADE |
Het is onzeker welke techniek (pleura-interventie) tijdens VATS resulteert in minder complicaties.
Bronnen: (Chen, 2006; Chen, 2012; Rena, 2008; Min, 2014; Lee, 2014) |
Postoperatieve pijn
|
Zeer laag GRADE |
Het is onzeker welke techniek (pleura-interventie) tijdens VATS resulteert in minder postoperatieve pijn.
Bronnen: (Chen, 2006; Chen, 2012; Rena, 2008; Lee, 2014) |
Re-interventie
|
Zeer laag GRADE |
Het is onzeker welke techniek (pleura-interventie) tijdens VATS resulteert in minder reinterventie.
Bronnen: (Rena, 2008) |
Opnameduur
|
Zeer laag GRADE |
Het is onzeker welke techniek (pleura-interventie) tijdens VATS resulteert in een kortere opnameduur.
Bronnen: (Chen, 2006; Chung, 2008; Chen, 2012; Rena, 2008; Min, 2014; Lee, 2014) |
Samenvatting literatuur
Beschrijving studies
Een overzicht van de studies is weergegeven in tabel 1.
Chen (2006) heeft een RCT uitgevoerd in Taiwan naar de waarde van een postoperatieve chemische pleurodese. Alle patiënten ontvingen een VATS bullectomie en een mechanische pleurodese. Patiënten werden postoperatief na de VATS gerandomiseerd naar additionele chemische pleurodese met minocycline (n=103) of observatie (n=99). Patiënten hadden allen een recidief pneumothorax, langdurige luchtlekkage (≥ 3 dagen) of een hemothorax. De gemiddelde leeftijd was 23,7 jaar in de minocycline groep en 25,5 in de observatiegroep. De patiënten waren voornamelijk mannen (minocycline groep: 86,4%, observatiegroep: 89,9%). Patiënten werden gevolgd voor minimaal 12 maanden, voor complicaties en recidiefkans.
Rena (2008) heeft een RCT uitgevoerd in patiënten met recidief of persisterende (luchtlekkage ≥ 5 dagen) primaire spontane pneumothorax (Italië). Alle patiënten ondergingen een 3-poorts VATS. Patiënten ondergingen allen een bullectomie en werden vervolgens gerandomiseerd naar een mechanische abrasie (n=106) of een partiële pleurectomie (n=102). De gemiddelde leeftijd is ongeveer 25 jaar in ze waren voornamelijk van het mannelijke geslacht.
Chung (2008) heeft in Korea een RCT uitgevoerd naar het effect van een chemische pleurodese tijdens VATS bullectomie bij patiënten met een primaire spontane pneumothorax. Patiënten werden gerandomiseerd naar de volgende behandelingen: 1) alleen bullectomie zonder pleura-interventie (n=50); 2) bullectomie met additioneel pleurodese met 20% dextrose (n=49); 3) bullectomie met additioneel pleurodese met talk en 20% dextrose (n=42). De patiënten waren voornamelijk man (95%) en gemiddeld 23,2 jaar oud. Recidiefkans, ziekenhuisopname, dagen met postoperatieve drain, koorts en pijnmedicatie werden meegenomen als uitkomstmaten.
Chen (2012) heeft in Taiwan een RCT uitgevoerd naar de effectiviteit van een pleurectomie in vergelijking met een pleurale abrasie gecombineerd met postoperatieve chemische pleurodese door middel van minocycline in patiënten met een primaire spontane pneumothorax. Deze patiënten hadden allen een hoge recidiefkans door ipsilaterale recidief, langdurige luchtlekkage (≥ 3 dagen) of geen of meerdere (≥ 3) blebs.
Patiënten ondergingen allen een VATS bullectomie en werden daarna gerandomiseerd naar pleurectomie (n=80) of pleurale abrasie gecombineerd met postoperatieve chemische pleurodese (n=80). De pleurectomie groep bestond voornamelijk uit mannen (86,3%) met een gemiddelde leeftijd van 24,3 jaar. De abrasiegroep bestond voor 90% uit mannen met een gemiddelde leeftijd van 22,9 jaar. Het primaire eindpunt was de recidiefkans gedurende 1 jaar na operatie. Veiligheid en lange termijneffecten werden meegenomen als secundaire uitkomstmaten.
Min (2014) beschreef een RCT naar het effect van mechanische pleurodese in patiënten met primaire spontane pneumothorax in China. Alle patiënten ondergingen een VATS bullectomie en werden gerandomiseerd naar geen pleurale interventie (n=144) of een mechanische pleurodese (n=145). De grootte van de pneumothorax was minimaal 30%. De gemiddelde leeftijd was 22 jaar en ongeveer 90% was man in beide behandelarmen. De patiënten werden gevolgd gedurende minimaal 6 maanden tot 2 jaar.
Lee (2014) heeft, in de studie met de grootste studiepopulatie (N=1.414) over dit onderwerp, gekeken naar “pleurale coverage” (door middel van applicatie van fibrinelijm met een resorbeerbaar cellulose gaas op de stapler lijn na bullectomie) (n=757) vergeleken met mechanische pleurodese (n=657) na een bullectomie bij patiënten met een primaire spontane pneumothorax in Korea. Patiënten hadden allen een bullectomie ondergaan. De gemiddelde leeftijd was 20,8 in de coverage groep en 20,9% in de pleurodese groep, en 92,1% en 91,0% was man. De primaire uitkomstmaten waren reciefkans na 1 jaar en re-interventie (dat wil zeggen heroperaties).
Tabel 1 Gerandomiseerde interventie studies naar pleurale interventies in patiënten met een primaire spontane pneumothorax
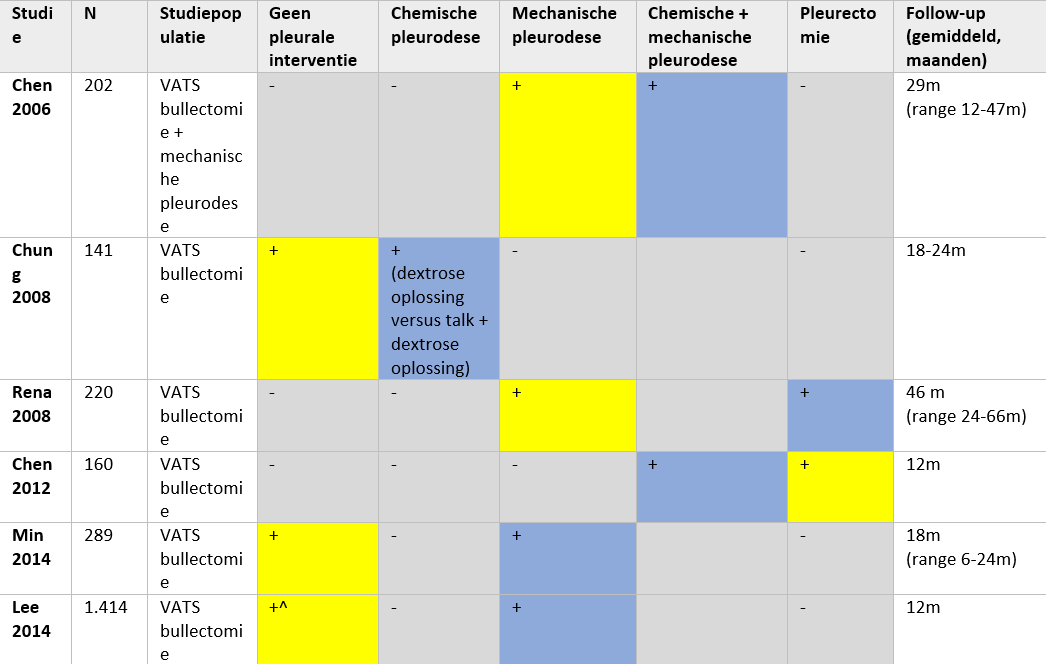
+ Behandeling wel bestudeerd in betreffende studie
- Behandeling niet bestudeerd in betreffende studie
^ Patiënten ondergingen een pleurale coverage van de bullectomie met cellulosegaas (Surgicel) en fibrinelijm
De onderzochte interventie wordt aangegeven in blauwe kolommen, de controle interventie in gele kolommen.
Resultaten
Recidiefkans
Alle studies hebben recidiefkans gerapporteerd, met een follow-up periode van 6 tot 47 maanden (tabel 2). De reciefkans varieert van 1,9% (chemische pleurodese) tot 10,7% (mechanisme pleurodese). Alleen in de studie van Chen (2006) lijkt minocycline na VATS bullectomie mogelijk te resulteren in een lagere recidiefkans (1,9%) in vergelijking met geen minocyline (8,1%).
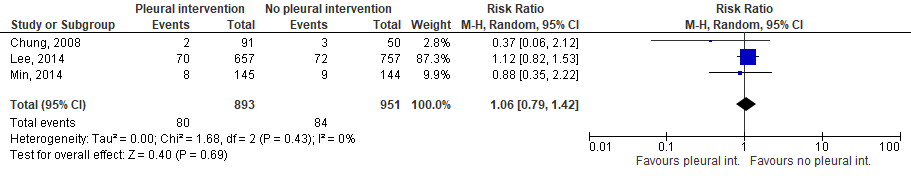
Drie studies hebben een pleurale interventie vergeleken met geen pleurale interventie. Hierbij wordt een relatief risico van 1.06 (95%-BI: 0,79 tot 1,42) gevonden (figuur 1).
Tabel 2 Recidiefkans bij de verschillende chirurgische technieken (n, %)
|
Studie |
Geen pleurale interventie |
Chemische pleurodese |
Mechanische pleurodese |
Chemische + mechanische pleurodese |
Pleurectomie |
p-waarde |
Follow up maanden |
|
Chen, 2006 |
- |
- |
8 (8,1%) |
2 (1,9%) |
- |
0,06
|
12-47 |
|
Chung, 2008 |
3 (6%) |
Dextrose: 1 (2,0%) Dextrose + talk: 1 (2,4%) |
- |
- |
- |
0,50 |
18-24 |
|
Rena, 2008 |
- |
- |
7 (6,2%) |
- |
5 (4,6%) |
0,81 |
24 |
|
Chen, 2012 |
- |
- |
- |
3 (3,8%)
|
3 (3,8%) |
1,00 |
12 |
|
Min, 2014 |
9 (6,3%) |
- |
8 (5,5%) |
- |
- |
0,79 |
6 -24 |
|
Lee, 2014 |
72 (9,5%) |
- |
70 (10,7%) |
- |
- |
- |
12 |
|
Behandeling niet bestudeerd in betreffende studie |
|||||||
Figuur 1 Pleurale interventie in vergelijking met geen pleurale interventie
Complicaties
Complicaties zijn beschreven als langdurige luchtlekkage, pleurale onthechting, empyeem, hemothorax en wondinfecties/wondproblemen. Één studie (Min, 2014) heeft enkel “significant complications” omschreven. Het aantal complicaties lijkt niet te verschillen tussen de verschillende interventie armen (tabel 3). De meeste studies hebben langdurige luchtlekkage (> 5 dagen) apart beschreven, maar ook daar wordt geen verschil gevonden tussen de verschillende chirurgische technieken. Hemothorax kwam voor bij 3 patiënten (3,8%) bij patiënten met een pleurectomie, en in geen van de patiënten met een chemische en mechanische pleurodse (Chen, 2012).
Tabel 3 Het aantal complicaties bij de verschillende chirurgische technieken (n, %)
|
Studie |
Geen pleurale interventie |
Chemische pleurodese |
Mechanische pleurodese |
Chemische + mechanische pleurodese |
Pleurectomie |
p-waarde |
Type complicaties |
|
Chen, 2006 |
- |
- |
11 (11,1%) |
6 (5,8%) |
- |
0,62
|
Luchtlekkage, pleurale onthechting, empyeem, wond infecties. |
|
Rena, 2008 |
- |
- |
6 (5,3%) |
- |
6 (5,5%) |
- |
Luchtlekkage |
|
Chen, 2012 |
- |
- |
- |
4 (5,0%)
|
6 (7,5%) |
0,75 |
Luchtlekkage, pleurale onthechting, hemothorax. |
|
Min, 2014 |
0 |
- |
0 |
- |
- |
- |
“significant complications” |
|
Lee, 2014 |
38 (5,1%) |
- |
37 (5,6%)
|
- |
- |
0,66 |
Luchtlekkage, bloeding, wond probleem. |
|
Langdurige luchtlekkage (> 5 dagen) |
|||||||
|
Chen, 2006 |
- |
- |
6 (6,1%) |
2 (1,9%)
|
- |
0,10 |
|
|
Rena, 2008 |
- |
- |
2 (2,5%) |
- |
2 (2,5%) |
- |
|
|
Chen, 2012 |
- |
- |
- |
6 (5,3%) |
- |
0,98 |
|
|
Lee, 2014 |
30 (4,0%) |
- |
28 (4,2%) |
- |
- |
- |
|
|
Behandeling niet bestudeerd in betreffende studie |
|||||||
Re-interventie
Rena (2008) heeft het aantal re-interventie beschreven en vond maar één patiënt met een re-interventie in beide behandelgroepen.
Postoperatieve pijn
Postoperatieve pijn op dag één en dag drie, gemeten met VAS-scores, is gemeten in drie studies (Chen, 2006; Rena, 2008; Chen, 2012). Enkel de studie van Rena (2008) heeft gekeken naar postoperatieve pijn op langere termijn (30 dagen) (tabel 4).
De pijnscores op de eerste dag varieert sterk tussen de verschillende behandelingen. Chen (2006) laat zien dat toevoegen van minoclycline resulteert in significant meer pijn op de eerste dag, maar niet meer op de tweede en derde dag postoperatief. Rena (2008) vond geen verschil tussen pleurectomie en mechanische pleurodese, maar op dag 30 resulteert pleurectomie in een significant lagere pijnscore. Dit verschil lijkt niet klinisch relevant (VAS 0,9 versus 0,7). Chen (2012) vindt een hogere pijnscore in de groep met een gecombineerde mechanische en chemische pleurodese ten opzichte van een pleurectomie.
Lee (2014) rapporteert het aantal patiënten zonder pijn en vindt minder pijn in de groep met mechanisme pleurodese (n=320, 48,5%) ten opzichte van geen pleura interventie (n=465, 61,4%, p<0,01).
Tabel 4 Postoperatieve pijn gemeten middels VAS bij de verschillende chirurgische technieken
|
Studie |
Geen pleurale interventie |
Chemische pleurodese |
Mechanische pleurodese |
Chemische + mechanische pleurodese |
Pleurectomie |
p-waarde |
|
Chen, 2006 |
- |
- |
1e dag: 5,5 (4,2-4,6) 3e dag: 3,6 (3,3-3,8) |
1e dag: 6,9 (6,6-7,2) 3e dag: 3,4 (3,1-3,6) |
- |
< 0,05 0,20 |
|
Rena, 2008 |
- |
- |
1e dag: 2,41 ± 0,99 3e dag: 1,68 ± 0,84 30 dagen: 0,68 ± 0,80 |
- |
1e dag: 2,48 ± 0,99 3e dag: 1,71 ± 0,75 30 dagen: 0,91 ± 0,96 |
NS NS < 0,05 |
|
Chen, 2012 |
- |
- |
- |
1e dag: 5,7 (3–10) 3e dag: 3,4 (2–7) |
1e dag: 4,7 (1–10) 3e dag: 3,0 (1–7) |
< 0,05 0,09 |
|
Behandeling niet bestudeerd in betreffende studie |
||||||
Opnameduur
De opnameduur varieert van 3,4 tot 10 dagen in de verschillende behandelarmen. Hierbij wordt geen duidelijk voordeel gevonden voor een bepaalde behandeling. Dextrose met talk lijkt te resulteren in een iets hogere opnameduur (Chung, 2008). De postoperatieve opnameduur in de studie van Min was ook hoger (10 dagen) maar dit was vergelijkbaar in beide behandelarmen.
Tabel 5 Opnameduur in dagen (gemiddeld ± sd) na VATS bij de verschillende chirurgische technieken
|
Studie |
Geen pleurale interventie |
Chemische pleurodese |
Mechanische pleurodese |
Chemische + mechanische pleurodese |
Pleurectomie |
p-waarde |
|
Chen, 2006 |
- |
- |
4,3 ± 2,8 |
4,0 ± 1,6 |
- |
0,42 |
|
Chung, 2008 |
4,5 ± 1,9 |
Dextrose: 4,5 ± 2,1 Dextrose + talk: 6,0 ± 2,6 |
- |
- |
- |
0,05 |
|
Rena, 2008 |
- |
- |
3,5 ± 1,6 |
- |
3,9 ±1,7 |
0,08 |
|
Chen, 2012 |
|
|
|
3,6 ± 1,3 |
3,6 ± 1,2 |
0,81 |
|
Min, 2014 |
10 ± 2 |
- |
10 ± 4 |
- |
- |
0,49 |
|
Lee, 2014 |
3,4 ± 2,0 |
|
3,4 ± 1,8 |
- |
- |
0,92 |
|
Behandeling niet bestudeerd in betreffende studie |
||||||
Bewijskracht van de literatuur
De bewijskracht voor RCT’s begint hoog. De bewijskracht voor alle uitkomstmaten is met drie niveaus verlaagd tot zeer laag gezien beperkingen in de tegenstrijdige resultaten (inconsistentie) en met twee niveaus voor het geringe aantal patiënten (imprecisie). Alle studies beschrijven verschillende behandelopties, waardoor het niet mogelijk is de resultaten van de verschillende studies te vergelijken.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Welke chirurgische techniek tijdens VATS resulteert in een lagere recidiefkans en minder complicaties bij PSP?
P: patiënten patiënten met een primaire spontane pneumothorax;
I: interventie pleurectomie, mechanische/pleurodese tijdens VATS (alle minimaal invasieve chirurgische toegangsmogelijkheden);
C: controle geen pleurale interventie, onderlinge vergelijking;
O: outcome recidiefkans, complicaties, persisterend luchtlekkage, postoperatief pijn, re-interventie, opnameduur.
Relevante uitkomstmaten
De werkgroep achtte recidiefkans (een) voor de besluitvorming cruciale uitkomstmaten; en complicaties, persisterend luchtlekkage, postoperatief pijn, re-interventie en opnameduur voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) met relevante zoektermen gezocht naar studies over verschillende chirurgische technieken tijdens VATS bij patiënten met een primaire spontane pneumothorax. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 546 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s naar verschillende technieken tijdens VATS. Op basis van titel en abstract werden in eerste instantie 15 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens negen studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en zes studies definitief geselecteerd.
Resultaten
Zes RCT’s zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Chen, J. S., Hsu, H. H., Chen, R. J., Kuo, S. W., Huang, P. M., Tsai, P. R.,... & Lee, Y. C. (2006). Additional minocycline pleurodesis after thoracoscopic surgery for primary spontaneous pneumothorax. American journal of respiratory and critical care medicine, 173(5), 548-554.
- Chen, J. S., Hsu, H. H., Huang, P. M., Kuo, S. W., Lin, M. W., Chang, C. C., & Lee, J. M. (2012). Thoracoscopic pleurodesis for primary spontaneous pneumothorax with high recurrence risk: a prospective randomized trial. Annals of surgery, 255(3), 440-445.
- Chung, W. J., Jo, W. M., Lee, S. H., Son, H. S., & Kim, K. T. (2008). Effects of additional pleurodesis with dextrose and talc-dextrose solution after video assisted thoracoscopic procedures for primary spontaneous pneumothorax. Journal of Korean medical science, 23(2), 284-287.
- Kim, S. J., Lee, H. S., Kim, H. S., Shin, H. S., Lee, J. W., Kim, K. I.,... & Lee, W. Y. (2011). Outcome of video-assisted thoracoscopic surgery for spontaneous secondary pneumothorax. The Korean journal of thoracic and cardiovascular surgery, 44(3), 225.
- Lee, S., Kim, H. R., Cho, S., Huh, D. M., Lee, E. B., Ryu, K. M.,... & Cho, J. S. (2014). Staple line coverage after bullectomy for primary spontaneous pneumothorax: a randomized trial. The Annals of thoracic surgery, 98(6), 2005-2011.
- Min, X., Huang, Y., Yang, Y., Chen, Y., Cui, J., Wang, C.,... & Wang, J. (2014). Mechanical pleurodesis does not reduce recurrence of spontaneous pneumothorax: a randomized trial. The Annals of thoracic surgery, 98(5), 1790-1796.
- Rena, O., Massera, F., Papalia, E., Della Pona, C., Robustellini, M., & Casadio, C. (2008). Surgical pleurodesis for Vanderschueren's stage III primary spontaneous pneumothorax. European Respiratory Journal, 31(4), 837-841.
- Sudduth, C. L., Shinnick, J. K., Geng, Z., McCracken, C. E., Clifton, M. S., & Raval, M. V. (2017). Optimal surgical technique in spontaneous pneumothorax: a systematic review and meta-analysis. Journal of Surgical Research, 210, 32-46.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
|
Chen, 2006 |
Type of study: RCT
Setting and country: Hospital, Taiwan
Funding and conflicts of interest: no conflict of interest |
Inclusion criteria: All patients requiring VATS caused by ipsilateral recurrence, continuous air leaks for more than 3 d, contralateral recurrence, presence of hemopneumothorax, or uncomplicated first episode with high-risk profession were eligible for this study
Exclusion criteria: greater than 50 yr of age, underlying pulmonary disease, previous ipsilateral thoracic operation, allergy to tetracycline or minocycline, and unwillingness to undergo randomization.
N total at baseline: Intervention: 103 Control:99
Important prognostic factors2: age ± SD: I: 23.7 ± 7.7 C: 25.5 ± 9.0
Sex: I: 86.4% M C: 89.9% M
Smoking: I: 24.3% CL 32.2%
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
In the minocycline group, 20 ml of 2% lidocaine hydrochloride (400 mg) followed by a solution of 20 ml of normal saline containing 300 or 400 mg (7 mg/kg) of minocycline was instilled into the pleural cavity through the thoracostomy tube. The rubber tube connecting the chest tube and chest bottle was raised 40 to 60 cm above the patient to trap the minocycline while allowing air to pass under pressure. Patients were repositioned every 30 min so that the minocycline could contact all pleural surfaces. Side effects and complaints of the patient were recorded. The rubber tube was lowered 6 to 8 h later. To optimize the effects of pleural symphysis, minocycline was administered after full expansion of the lung, which was usually accomplished on the first postoperative day. However, in those patients who had persistent air leaks and could not fully inflate their lung, minocycline was still used after 3 to 5 d of waiting.
|
Describe control (treatment/procedure/test):
Nothing was instilled. A blinded study conducted by saline instillation was not suitable in our experiment. |
Length of follow-up: 6 months
Loss-to-follow-up: No lost to follow-up
|
Outcome measures and effect size (include 95%CI and p-value if available):
Recurrence I:2 (1.9) C:8 (8.1) P=0.06
Complications: I: 6 (5.8) C: 11 (11.1) P=0.62
Postoperative pain, day 3: I: 3.4 (3.1–3.6) C: 3.6 (3.3–3.8) P=0.20
Hospital stay: I: 4.0 ± 1.6 C: 4.3 ± 2.8 P=0.42
|
|
Chung, 2008 |
Type of study: RCT
Setting and country: Hospital, Korea
Funding and conflicts of interest: not decribed |
Inclusion criteria: PSP with pleural/subpleural blebs identified by thoracoscopic examination
Exclusion criteria: underlying lung disease, trauma or iatrogenic injury.
N total at baseline: Intervention-1 (dextrose): 49 Intervention-2 (dextrose + talc): 42 Control: 50
Important prognostic factors2: For example age (range): I1: 24.18 (16-45) I2: 23.02 (15-65) C: 22.26 (13-36)
Sex: I: 93.9% M I2: 100% C: 92% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
TBR and pleurodesis with a 20% dextrose solution (200 cc) (49 patients; group 1), and TBR and pleurodesis with a talc (2 g of asbestos free sterilized talc powder) -20% dextrose mixed solution (200 cc) (42 patients; group 2).
|
Describe control (treatment/procedure/test):
thoracoscopic bleb resection or electrical coagulation (TBR) only |
Length of follow-up (months): I1: 23.65±2.51 12: 17.93± 3.64 C: 20.22±9.71
Loss-to-follow-up: No lost to follow up.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Recurrence I1: 2.04% (N=1) I2: 2.38% (N=1) C: 6% (N=3) P=0.50
Fever I1: 22.45% (N=11) I2: 52.38% (N=22) C: 10% (N=5) P=0.0
Parenteral analgesics (frequencies/patient): I1: 3.42±3.48 I2: 5.02±2.72 C: 2.37±3.51 P=0.00
Hospital stay: I1: 4.49±2.10 I2: 6.00±2.58 C: 4.50±1.85 P=0.001
|
|
Rena, 2008 |
Type of study: RCT
Setting and country: Hospital, Italy
Funding and conflicts of interest: no conflict of interest |
Inclusion criteria: aged 40 yrs affected by recurrent or persistent PSP (air leak from the pleural drainage at first episode persisting for.5 days),
Exclusion criteria: -
N total at baseline: Intervention: 112 Control: 108
Important prognostic factors2: age ± SD: I: 24.5 ± 6.89 C: 25 ± 6.51
Sex: I: 79.3% M C: 83.3% M
Smoker: I: 43.3% C: 49.5%
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Mechanical pleural abrasion using a MarlexTM mesh attached to the tip of a standard endoscopic grasper; abrasion was stopped when a uniform aspect of bloody pleura was obtained.
Intervention was carried out from the fifth rib, either on the left side up to the level of the subclavian artery or on the right side up to the brachiocephalic trunk; the front and rear limits were 1 cm laterally from the sympathetic nerve chain and 1 cm laterally from the internal mammalian artery, respectively. |
Describe control (treatment/procedure/test):
Parietal pleurectomy: the portion of pleural surface submitted to surgical pleurodesis was the same for the two groups, in order to permit successive comparison.
Intervention was carried out from the fifth rib, either on the left side up to the level of the subclavian artery or on the right side up to the brachiocephalic trunk; the front and rear limits were 1 cm laterally from the sympathetic nerve chain and 1 cm laterally from the internal mammalian artery, respectively. |
Length of follow-up: 24-66 months
Loss-to-follow-up: After the first 24 months of the follow-up period, 25 (18.8%) patients in the intervention and 18 (16.7%) from the control group could not be tracked down. |
Outcome measures and effect size (include 95%CI and p-value if available):
Recurrence I: 7 (6.2%) C: 5 (16.7%) P=0.82
Complications, persistent air leak: I: 6/112 (5.3%) C: 6/108 (5.5%)
Postoperative pain (long term, 180 days): I: 0.31± 0.64 C:0.58 ± 0.61 P=0.001
Reintervention: I: n=1 C: n=1
Hospital stay: I: 3.52 ± 1.55 days C: 3.89 ± 1.71 days p=0.08 |
|
Chen 2012 |
Type of study: RCT
Setting and country: Hospital, Taiwan
Funding and conflicts of interest: no conflict of interest |
Inclusion criteria: Patients requiring VATS for ipsilateral recurrence, continuous air leaks for 3 or more days, or contralateral recurrence were selected for this study. Only patients with multiple blebs (≥3) or no identifiable bleb were eligible for this trial because previous studies showed that these patients are associated with higher rates of recurrence after VATS.
Exclusion criteria: older than 50 years, underlying pulmonary disease, pneumothorax requiring bilateral VATS, previous ipsilateral thoracic operation, and allergy to tetracycline or minocycline
N total at baseline: Intervention: 80 Control: 80
Important prognostic factors2: age ± SD: I: 24.3 ± 8.7 C: 22.9 ± 7.2
Sex: I: 86.3 % M C: 90.0 % M
Smoking: I: 18.8% C: 16.3%
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Pleurectomy: For thoracoscopic apical pleurectomy, the inferior border of the pleural strip was marked by endohook electrocautery at the upper margin of the fifth or sixth rib. The dissection was made in an apical direction. The longitudinal limit of the resection ran along the sympathetic trunk posteriorly and the internal mammary artery anteriorly to the height of the left subclavian artery on the left side or the brachiocephalic trunk on the right side |
Describe control (treatment/procedure/test):
Abrasion + minoclyciline: For thoracoscopic pleural abrasion, the parietal surface above the sixth rib was abraded by inserting the curved dissector with a diathermy scratch pad. Abrasion was stopped when a uniform aspect of bloody pleura was obtained. |
Length of follow-up: mean: 26.1 months
Loss-to-follow-up: No lost to follow up at 12 months
|
Outcome measures and effect size (include 95%CI and p-value if available):
Recurrence I: 3 (3.8) C: 3 (3.8) P=1.0
Complications: I: 6 (7.5) C: 4 (5.0) P=0.75
Postoperative pain (day 3): I: 3.0 (1–7) C: 3.4 (2–7) P=0.09
Hospital stay: I: 3.6 ± 1.2 C: 3.6 ± 1.3 P=0.81
|
|
Min 2014 |
Type of study: RCT
Setting and country: Hospital, China
Funding and conflicts of interest: no conflict of interest |
Inclusion criteria: obvious bullae on PSP lines, or whose pneumothorax lines were rough and interrupted, with or without thoracentesis or thoracic closed drainage; lung collapse exceeded 30% estimated by chest X-ray for the first incidence of pneumothorax; between the ages of 14 and 40 years with normal vital signs and normal routine laboratory findings; written informed consent after reviewing the substance, significance, and risks of the study.
Exclusion criteria: patients who refused VATS or refused follow-up or follow-up less than 6 months; postoperative recurrent PSP; SSP including those caused by emphysema, chronic obstructive pulmonary disease, asthma, pulmonary lymphangiomyomatosis, thoracic injury, and other diseases; and inability to provide informed consent.
N total at baseline: Intervention: 145 Control: 144
Important prognostic factors2: age ± SD: I: 22 ± 5 C: 22 ± 5
Sex: I: 90.3 % M C: 89.6 % M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Wedge resection + mechanical abrasion: Mechanical pleurodesis was performed by pleural abrasion and consistent techniques for pleural abrasion were maintained with regard to the extent and aggressiveness of abrasion. The mesothelial layer of the parietal pleura from the cupola of the apex of the thoracic cavity to the fifth intercostal space was abraded using sterile sandpaper until slight bleeding occurred diffusely in the abrasion area
|
Describe control (treatment/procedure/test):
Wedge resection: Wedge resection using a linear endoscopic stapler (Covidien Surgical, Mansfield, MA) included not only targeted bullae but also surrounding degenerated areas |
Length of follow-up: > 6 months, mean follow up: 18 months (range 6-24).
Loss-to-follow-up: Six patients in the treatment group and 7 in the control group dropped out of the trial owing to loss of follow-up; 2 patients in the control group were verified pathologically to be complicated with tuberculosis and 1 pulmonary lymphangiomyomatosis thereafter.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Recurrence I: 8 (5.5%) C: 9 (6.3%) P=0.79
Hospital stay: I: 10 ± 4 C: 10 ± 2 P=0.49
|
|
Lee 2014 |
Type of study: RCT
Setting and country: Hospital, Korea
Funding and conflicts of interest: No conflict of interest |
Inclusion criteria: ipsilateral or bilateral recurrent pneumothorax, history of previous contralateral pneumothorax, visible blebs on the initial plain chest film or computed tomography, persistent air leakage for at least 5 days, and age 15 to 35 years.
Exclusion criteria: underlying pulmonary disease such as pulmonary tuberculosis, previous ipsilateral thoracic operation, and refusal of the study.
N total at baseline: Intervention: 757 Control: 657
Important prognostic factors2: age ± SD: I: 20.7 ± 5.21 C: 20.9 ± 5.08
Sex: I: 92% M C: 91% M
Current smoker I:29.1% C: 30.8%
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Additional coverage procedure on the staple line: For the coverage group, inflated lungs 3 cm all around the staple line were covered with absorbable cellulose mesh and then fibrin glue was sprayed on the mesh.
|
Describe control (treatment/procedure/test):
Pleurodesis: mechanical pleurodesis was performed by scrubbing the parietal pleura with sandpaper and gauze until uniform blood oozing of the pleura was confirmed. The pleural abrasion was limited from the apex down to the fifth intercostal space. |
Length of follow-up: 12 months
Loss-to-follow-up: Patients with follow up < 1 year were excluded.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Recurrence I: 99 (13.8%) C: 93 (14.2%)
Complications: I:38 (5.1%) C: 37 (5.6%) P=0.66
Pain free: I: 465 (61.4%) C: 320 (48.5%)
Reintervention: I: 40 (40.4%) C: 35 (37.6%)
Hospital stay: I: 3.4 ± 1.96 C: 3.4 ± 1.75 P=0.92
|
|
Study reference |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Chen, 2006 |
Randomization was accomplished according to the chart number, which was randomly assigned. If the number was even, the patient was allocated to the minocycline group. |
Unlikely |
Likely Participants were not blinded. |
Likely Care providers were not blinded. |
Unlikely
|
Unlikely |
Unlikely |
Unlikely |
|
Chung, 2008 |
The allocation of the patients was conducted by the fixed date. |
Unclear |
Unclear Blinding was not described. |
Likely Care providers were not blinded. |
Unclear Blinding was not described. |
Unclear Blinding was not described. |
Unlikely |
Unlikely |
|
Rena, 2008 |
Method not described |
Unclear |
Unclear Blinding was not described. |
Likely Care providers were not blinded. |
Unclear Blinding was not described. |
Unclear Blinding was not described. |
Unlikely Dropout was comparable in both groups. |
Unlikely |
|
Chen, 2012 |
Randomization was accomplished according to random numbers in sealed envelopes, which were opened before each thoracoscopic pleurodesis |
Unlikely |
Likely Participants were not blinded. |
Likely Care providers were not blinded. |
Unlikely
|
Unlikely |
Unlikely |
Unlikely |
|
Min, 2014 |
computer-generated randomization concealed in a sealed envelope until the day of operation. |
Unlikely |
Likely Participants were not blinded. |
Likely Care providers were not blinded. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Lee, 2014 |
An envelope containing a random number was opened for each patient |
Unlikely |
Unclear Blinding was not described. |
Likely Care providers were not blinded. |
Unclear Blinding was not described. |
Unlikely |
Unlikely |
Unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Al-Mourgi, 2015 |
Onjuiste interventie: VATS versus drainplaatsing |
|
Ayed, 2000 |
Onjuiste interventie: VATS versus open |
|
Foroulis, 2012 |
Onjuiste interventie: VATS versus open |
|
Freixinet, 2004 |
Onjuiste interventie: VATS versus open |
|
Kutluk, 2018 |
Onjuiste interventie: uni versus multiportal |
|
Olessen, 2018 |
Onjuiste interventie: VATS versus drainplaatsing |
|
Miller, 2000 |
Onjuiste interventie: VATS versus open |
|
Waller, 1994 |
Onjuiste interventie: VATS versus open |
|
Wang, 2014 |
Artikel in Chinees |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-01-2022
Beoordeeld op geldigheid : 20-01-2022
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2026 bepaalt het bestuur van de NVALT of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Voor goedkering van deze richtlijn wordt hij aangeboden aan de Patiëntenfederatie Nederland.
Doel en doelgroep
Doel
Deze richtlijn geeft aanbevelingen ten aanzien van behandeling van volwassen patiënten (leeftijd ≥ 18 jaar) met een primaire spontane pneumothorax. Doel van deze gedeeltelijke herziening is om een richtlijn te verkrijgen waarin de meeste recente medische kennis omtrent de zorg voor patiënten met een primaire spontane pneumothorax wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een primaire spontane pneumothorax.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een primaire spontane pneumothorax.
Werkgroep
- Dr. F.M.N.H. Schramel, longarts, werkzaam in St. Antonius ziekenhuis, NVALT, voorzitter van de werkgroep.
- Drs. A.K.M. Korte, longarts, werkzaam in het Erasmus MC, NVALT.
- Drs. S. Boerman, longarts, werkzaam in St. Antonius ziekenhuis, NVALT.
- Drs. B.C. Klap, longarts, werkzaam in het Tergooi ziekenhuis, Hilversum, NVALT.
- Drs. M.D.M. Bolmers, chirurg, werkzaam in het Dijklander Ziekenhuis, NVvL.
- Drs. H.H. Dol, SEH-arts, werkzaam in het Jeroen Bosch Ziekenhuis, NVSHA.
- Drs. W.W.L. Li, cardio-thoracaal chirurg, werkzaam in het Radboudumc Nijmegen, NVT.
- Dr. F.A.A. Mohamed Hoesein, radioloog, werkzaam in het UMC Utrecht, NVvR.
- Drs. C.S. Sie (sinds augustus 2020), anesthesioloog, werkzaam in het Ikazia Ziekenhuis Rotterdam, NVA.
- Mw. N.M.C. Torrenga-Sieling, MSc, verpleegkundig specialist AGZ/longgeneeskunde, werkzaam in onder andere G.C. Lombok, Utrecht en het Diakonessenhuis, V&VN.
Met ondersteuning van
- Drs. I. van Dusseldorp, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. S.R. Zwakenberg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. M.M.A. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. Schramel, longarts, NVALT, voorzitter |
Longarts, St. Antonius ziekenhuis Utrecht/Nieuwegein |
Geen |
Geen |
Geen |
|
Drs. Korte, longarts, NVALT |
Longarts, Erasmus MC Rotterdam |
Geen |
Geen |
Geen |
|
Drs. Boerman, longarts, NVALT |
Longarts, St. Antonius ziekenhuis |
Geen |
Geen |
Geen |
|
Drs. Klap, longarts, NVALT |
Longarts, Tergooi ziekenhuis, Hilversum |
Geen |
Geen |
Geen |
|
Drs. Bolmers, chirurg, NVvL |
Chirurg, Dijklander ziekenhuis |
Geen |
Geen |
Geen |
|
Drs. Dol, SEH-arts, NVSHA |
SEH-arts, KNMG, Jeroen Bosch Ziekenhuis 's-Hertogenbosch |
Geen |
Geen |
Geen |
|
Drs. Li, cardio-thoracaal chirurg, NVT |
Cardiothoracaal chirurg, Radboudumc Nijmegen |
Bestuurslid NVT |
Geen |
Geen |
|
Dr. Mohamed Hoesein, radioloog, NVvR |
Radioloog. UMC Utrecht |
Geen |
Geen |
Geen |
|
Drs. Sie (sinds augustus 2020), anesthesioloog, NVA |
Anesthesioloog, Ikazia Ziekenhuis Rotterdam |
Geen |
Betrokken bij studie naar meest optimale pijnstilling bij VATS lobectomieën. Dit start pas na ontwikkeling van de richtlijn. |
Geen |
|
MW. Torrenga, MSc (sinds september 2020), verpleegkundig specialist, V&VN |
Verpleegkundig Specialist AGZ, gespecialiseerd in longgeneeskunde. Verpleegkundige longafdeling Diakonessenhuis Utrecht |
Scholingscommissie V&VN longverpleegkundige, lid commissie richtlijn COPD bij KNGF, “zinnige zorg” deelnemer/aanspreekpunt V&VN longverpleegkundigen (onbetaald). Mede-auteur boek "Ik heb COPD, wat kan ik doen?", Pharos, juni 2020. Sinds 2018 lid werkgroep Medicatietrouw van het Instituut Verantwoord Medicijngebruik, Utrecht |
Geen |
Geen |
Inbreng patiëntenperspectief
Het was niet haalbaar om een patiëntvertegenwoordiger te laten plaatsnemen aan de werkgroep. De richtlijn wordt wel aangeboden aan verschillende patiëntvertegenwoordigers om het patiëntperspectief te waarborgen.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de leden van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Richtlijn Primaire Spontane Pneumothorax, 2001) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door middel van een schriftelijke Invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep en de adviseur concept-uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De gespecificeerde zoekstrategieën zijn op te vragen bij het Kennisinstituut.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (eindconclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een eindconclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialist.
Zoekverantwoording
|
Uitgangsvraag: Richtlijn PSP, UV7 welke chirurgische techniek (pleura interventie) tijdens VATS resulteert in een lagere recidiefkans en minder complicaties bij PSP |
|
|
Database(s): PubMed, Embase |
Datum: 19-09-2019 |
|
Periode: niet van toepassing |
Talen: niet van toepassingvt |
|
Toelichting: In plaats van te kiezen voor specifieke technieken als abrasion, pleurectomy en pleurodesis in combinatie met VATS is gekozen om alleen VATS te kiezen zodat er zo min mogelijk verloren gaat. En zelfs met het kiezen voor VATS blijkt dat het 3e sleutelartikel van Sudduth wordt gemist. De reden hiervan is dat in titel/abstract niet wordt gesproken over VATS en dat er in trefwoorden alleen ‘hoog over’ wordt gecombineerd op spontaneous pneumothorax en surgical techniques. Om te voorkomen dat relevante literatuur wordt gemist is er voor gekozen om een aparte search uit te voeren met trefwoord: surgical techniques, waarvan vervolgens alleen de systematic reviews/meta-analyses worden geselecteerd. De uitkomst is toegevoegd aan de resultaten van de specifieke search. |
|
Studietype |
Totaal |
Ontdubbeld |
|
SR |
74 |
58 |
|
RCT |
265 |
207 |
|
Vergelijkend overig |
594 |
338 |
PUBMED
History
|
Search |
Query |
Items found |
|
Search #4 AND #18 |
||
|
Search #4 AND #17 |
||
|
Search #19 OR #20 |
||
|
Search #15 AND #16 |
||
|
Search #4 AND #16 |
||
|
Search "Epidemiologic Studies"(Mesh) OR cohort(tiab) OR (case(tiab) AND (control(tiab) OR controll*(tiab) OR comparison(tiab) OR referent(tiab))) OR risk(tiab) OR causation(tiab) OR causal(tiab) OR "odds ratio"(tiab) OR etiol*(tiab) OR aetiol*(tiab) OR "natural history"(tiab) OR predict*(tiab) OR prognos*(tiab) OR outcome(tiab) OR course(tiab) OR retrospect*(tiab) |
||
|
Search randomized controlled trial(pt) OR controlled clinical trial(pt) OR randomized(tiab) OR placebo(tiab) OR drug therapy(sh) OR randomly(tiab) OR trial(tiab) OR groups(tiab) |
||
|
Search ("Meta-Analysis as Topic"(Mesh) OR “Meta-Analysis”(Publication Type) OR metaanaly*(tiab) OR metanaly*(tiab) OR meta-analy*(tiab) OR meta synthes*(tiab) OR metasynthes*(tiab) OR meta ethnograph*(tiab) OR metaethnograph*(tiab) OR meta summar*(tiab) OR metasummar*(tiab) OR meta-aggregation(tiab) OR metareview(tiab) OR meta-review(tiab) OR overview of reviews(tiab) OR ((systematic*(ti) OR scoping(ti) OR umbrella(ti) OR meta-narrative(ti) OR metanarrative(ti) OR evidence based(ti)) AND (review*(ti) OR overview*(ti))) OR ((evidence(ti) OR narrative(ti) OR metanarrative(ti) OR qualitative(ti)) AND synthesis(ti)) OR systematic review(pt) OR prisma(tiab) OR preferred reporting items(tiab) OR quadas*(tiab) OR systematic review*(tiab) OR systematic literature(tiab) OR structured literature search(tiab) OR systematic overview*(tiab) OR scoping review*(tiab) OR umbrella review*(tiab) OR mapping review*(tiab) OR systematic mapping(tiab) OR evidence synthes*(tiab) OR narrative synthesis(tiab) OR metanarrative synthesis(tiab) OR research synthesis(tiab) OR qualitative synthesis(tiab) OR realist synthesis(tiab) OR realist review(tiab) OR realist evaluation(tiab) OR systematic qualitative review(tiab) OR mixed studies review(tiab) OR mixed methods synthesis(tiab) OR Mixed research synthesis(tiab) OR quantitative literature review(tiab) OR systematic evidence review(tiab) OR evidence-based review(tiab) OR comprehensive literature search(tiab) OR integrated review*(tiab) OR integrated literature review(tiab) OR integrative review*(tiab) OR integrative literature review*(tiab) OR structured literature review*(tiab) OR systematic search and review(tiab) OR meta-narrative review*(tiab) OR metanarrative review(tiab) OR systematic narrative review(tiab) OR systemic review(tiab) OR systematized review(tiab) OR systematic research synthesis(tiab)) NOT ("Comment" (Publication Type) OR "Letter" (Publication Type)) NOT (“Animals”(Mesh) NOT “Humans”(Mesh)) |
||
|
Search #2 AND #14 |
||
|
Search "Surgical Procedures, Operative"(Mesh) |
||
|
Search #4 AND #7 |
||
|
Search #3 OR #5 OR #6 |
||
|
Search pleurectom*(tiab) |
||
|
Search abrasion(tiab) |
||
|
Search #1 AND #2 |
||
|
Search "Pleurodesis"(Mesh) OR pleurodesis(tiab) |
||
|
Search ("Pneumothorax"(Mesh) AND spontaneous*(tiab)) OR spontaneous pneumothorax(tiab) |
||
|
Search "Thoracic Surgery, Video-Assisted"(Mesh) OR video assisted thoracic surger*(tiab) OR video assisted thoracoscopic surger*(tiab) OR VATS*(tiab) OR uniportal thoracoscopic surger*(tiab) |
Embase
|
No. |
Query |
Results |
|
#21 |
#14 OR #15 |
48 |
|
#17 |
#7 AND #13 |
390 |
|
#16 |
#7 AND #12 |
94 |
|
#15 |
#7 AND #11 |
20 |
|
#14 |
#10 AND #11 |
45 |
|
#13 |
cohort:ab,ti OR (case:ab,ti AND (control:ab,ti OR controll*:ab,ti OR comparison:ab,ti OR referent:ab,ti)) OR risk:ab,ti OR causation:ab,ti OR causal:ab,ti OR 'odds ratio':ab,ti OR etiol*:ab,ti OR aetiol*:ab,ti OR 'natural history':ab,ti OR predict*:ab,ti OR prognos*:ab,ti OR outcome:ab,ti OR course:ab,ti OR retrospect*:ab,ti OR 'epidemiology'/de |
7596111 |
|
#12 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract'/it |
2289944 |
|
#11 |
('meta-analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
453075 |
|
#10 |
#1 AND #9 |
1970 |
|
#9 |
'surgical technique'/exp |
1581289 |
|
#8 |
#1 AND #5 AND #6 |
423 |
|
#7 |
#1 AND #6 |
887 |
|
#6 |
'video assisted thoracoscopic surgery'/exp OR 'vats':ti,ab OR 'video assisted thoracic surgery':ti,ab OR 'video assisted thoracoscopic surgery':ti,ab OR 'videothoracoscopic surgery':ti,ab |
14896 |
|
#5 |
#2 OR #3 OR #4 |
16677 |
|
#4 |
'abrasion'/de OR 'abrasion':ti,ab |
9475 |
|
#3 |
'pleurodesis'/exp OR 'pleurodesis':ti,ab |
5515 |
|
#2 |
'pleurectomy'/exp OR 'pleura excision':ti,ab OR 'pleura resection':ti,ab OR 'pleural excision':ti,ab OR 'pleural resection':ti,ab OR 'pleurectomy':ti,ab |
2382 |
|
#1 |
'primary spontaneous pneumothorax'/exp OR 'spontaneous pneumothorax'/exp OR 'spontaneous pneumothorax':ti,ab |
6320 |