Organisatie van zorg (randvoorwaarden bij de zorg van patiënten met PDS)
Uitgangsvraag
Hoe ziet gedeelde zorg eruit bij patiënten met het prikkelbaredarmsyndroom?
Welke voorlichting kan worden gegeven aan patiënten?
Aanbeveling
Gedeelde zorg
- Begeleid PDS zoveel mogelijk in de eerste lijn. Laagdrempelig contact voor consultatie met een mdl-arts is wenselijk, in bijvoorbeeld een model van anderhalvelijnszorg.
- Sluit aan bij regionale samenwerkingsverbanden.
- Daarnaast bevelen we aan om regionaal met modellen voor gedeelde zorg te experimenteren en dat in onderzoeksverband te evalueren.
- Verwijs naar de bedrijfsarts wanneer de klachten impact hebben op werk (bijvoorbeeld frequent verzuim, verergering van klachten door stress vanuit het werk, omgaan met klachten tijdens het werk).
Voorlichting aan patiënten
- Bied voorlichtingsmateriaal aan en verwijs naar de informatie op Thuisarts.nl. De informatie op Thuisarts.nl is gebaseerd op deze richtlijn en de NHG-Standaard.
- Attendeer de patiënt op de Prikkelbare Darm Syndroom Belangenorganisatie en de mogelijkheden van lotgenotencontact.
Overwegingen
Gedeelde zorg
Voor- en nadelen van de interventie
De hierboven beschreven zorgmodellen zijn onderzocht in andere zorgstelsels dan het Nederlandse. De zorg voor PDS-patiënten in Nederland vindt primair plaats in de eerste lijn. In de Nederlandse situatie is het daarom van groot belang dat er duidelijke afspraken worden gemaakt tussen de huisarts en andere betrokken zorgverleners over de behandeling van PDS in de zorgketen. Die afspraken kunnen worden vastgelegd in een zorgpad of in een regionale transmurale afspraak. Binnen de eerstelijnszorg kan dat gaan om samenwerkingsafspraken tussen de huisarts en diëtist, eerstelijnspsycholoog of hypnotherapeut over PDS-behandeling. Ook de bedrijfsarts kan betrokken worden als de klachten invloed hebben op werk, er sprake is van (frequent) verzuim, stress van werk waardoor klachten verergeren of als er sprake is van klachten waar lastig mee kan worden omgegaan tijdens het werk.
De specialistische zorg aan PDS-patiënten kan binnen dat zorgpad op verschillende manieren worden aangeboden; bijvoorbeeld door de individuele mdl-arts, of multidisciplinair via een ‘zorgteam functionele buikklachten’ in het ziekenhuis, vaak gecoördineerd door een mdl-verpleegkundige.
Er zijn diverse ziekenhuizen in Nederland die multidisciplinaire PDS-zorg aanbieden en waar patiënten besproken worden in het multidisciplinair overleg gericht op functionele MDL-aandoeningen. Deze ziekenhuizen werken samen in een landelijk netwerk, waar patiënten met moeilijk te behandelen klachten door zowel huisarts als mdl-arts naar toe verwezen kunnen worden voor verdere uitleg, bespreking en uitvoering van behandeling en begeleiding.
In het kader van gedeelde PDS-zorg zijn er op veel plaatsen regionale initiatieven ontstaan waarbij samenwerking tussen huisarts en mdl-arts op een andere wijze wordt ingericht. Dat gaat vaak in de vorm van zogenaamde anderhalvelijnszorg. Hierbij wordt zorg die door een medisch specialist wordt verleend verplaatst van het ziekenhuis naar huisartsenpraktijk of gezondheidscentrum. Er zijn diverse manieren waarop deze zorg kan worden ingericht:
- de medisch specialist verricht een eenmalig consult in de eerste lijn en stelt daarna een advies op voor de huisarts, die de patiënt (met PDS) verder opvolgt
- teleconsultatie, waarbij huisartsen laagdrempelig een mdl-arts kunnen consulteren over een PDS-patiënt. Op basis van patiëntengegevens die worden uitgewisseld kan de mdl-arts een advies formuleren
- meekijkconsult of gezamenlijk consult, waarbij de mdl-arts en huisarts(en) samen het consult doen, eventueel via een videoverbinding.
Hoewel een aantal van deze initiatieven goed is gedocumenteerd, is er (nog) geen wetenschappelijk onderzoek verricht naar de effectiviteit ervan in de Nederlandse situatie. Een evaluatie van anderhalvelijnszorg in verschillende ‘proeftuinen’ door Maastricht UMC+ laat zien dat patiënten en zorgverleners tevreden zijn over deze aanpak, dat de verbetering in ervaren gezondheid gelijk is aan die in reguliere zorg en dat er geen nadelige gevolgen zijn.
Bij alle vormen van gedeelde zorg is het belangrijk dat de huisarts samen met de patiënt het verdere beleid bespreekt op grond van contact met de mdl-arts.
Landelijke ontwikkelingen zoals gepaste en doelmatige zorg en taakherschikking krijgen aandacht en verdienen ruimere toepassing binnen de PDS-zorg. Diverse initiatieven en projecten zijn gestart in regionaal of lokaal verband. Het is van belang dat deze projecten wetenschappelijk worden geëvalueerd op (kosten)effectiviteit, kwaliteit van zorg en duurzaamheid.
Wat betreft taakherschikking wordt de PDS-zorg in de tweede lijn in toenemende mate mede verleend door mdl-verpleegkundigen en verpleegkundig specialisten wat betreft intakes, behandeling, begeleiding en als contactpersoon en coördinator van multidisciplinair overleg. Dat gebeurt onder supervisie van een mdl-arts. Een dergelijke constructie kan in de toekomst ook in de eerste of anderhalve lijn worden georganiseerd.
Bepaalde behandelingen kunnen worden begeleid door andere (para)medici, waar het gaat om complexere diëten of psychologische behandelingen zoals cognitieve gedragstherapie of hypnotherapie. Zie hiervoor de module Voeding, de module Psychologische behandelingen en de verwijscriteria onder Consultatie en verwijzing (NHG-Standaard).
Waarden en voorkeuren van patiënten
Zoals in elk arts-patiëntcontact is het ook bij PDS van groot belang om goede voorlichting en advies te geven die aansluit bij wensen en voorkeuren van patiënten. In Nederlands onderzoek noemen PDS-patiënten de volgende onderwerpen als belangrijk: open communicatie met hun behandelaar(s), breed toegankelijke informatie en – indien nodig – toegang tot een multidisciplinair behandelteam en PDS-expertisecentra. Bovendien onderstrepen patiënten het belang van wetenschappelijk onderzoek over PDS (Masclee, 2021).
Uit ervaringen van PDS-patiënten (via de patiëntenorganisatie PDSB) blijkt dat patiënten regelmatig uit ongerustheid of onbegrip om een verwijzing naar de tweede lijn vragen. Patiënten zijn dan bang dat ze een andere aandoening hebben of zijn in de veronderstelling dat de huisarts niet voldoende kennis en ervaring heeft om de diagnose PDS te kunnen stellen. Gedeelde zorg, waarbij de huisarts met een mdl-arts overlegt over de patiënt, zorgt ervoor dat de patiënt zich meer serieus voelt genomen. Voor de patiënten is goede uitleg waarom een verwijzing niet nodig is belangrijk. Uit wetenschappelijk onderzoek komt naar voren dat PDS-patiënten behoefte hebben aan meer informatie over PDS, met name wat betreft oorzaken, ziektebeloop, diagnostiek, behandelmogelijkheden, voeding, psychische factoren en manieren om beter met de aandoening te leren omgaan (Flik, 2015). Gegevens over voorlichting aan PDS-patiënten zijn verder uitgewerkt in submodule 2.
Kosten
Zorg in het ziekenhuis is momenteel duurder dan eerstelijnszorg. Gedeelde zorg tussen eerste en tweede lijn kan bijdragen aan lagere kosten omdat er minder patiënten naar het ziekenhuis worden verwezen en anderhalvelijnszorg een goedkoper alternatief is. Uit de evaluatie door het Maastricht UMC+ blijkt dat de gemiddelde zorgkosten van patiënten verwezen naar de anderhalvelijnszorg significant lager liggen dan zorgkosten van patiënten die rechtstreeks verwezen zijn naar het ziekenhuis [Van den Bogaart 2019]. Of dit ook betekent dat anderhalvelijnszorg ook daadwerkelijk kostenbesparend is op de langere termijn en of dit meer specifiek ook geldt voor PDS-zorg, is onbekend. Er is in 2022 nog geen structurele financiering voor anderhalvelijns PDS-zorg.
Aanvaardbaarheid en haalbaarheid
Diagnostiek, begeleiding en behandeling van PDS-patiënten vindt grotendeels al in de eerste lijn plaats. Als dat niet het gewenste effect heeft, kan de PDS-patiënt voor advies verwezen worden naar de tweede lijn. De bovengenoemde initiatieven voor anderhalvelijns zorg vormen daar mogelijk een goed alternatief voor, vanuit het perspectief van doelmatigheid en passende zorg. Meer wetenschappelijk onderzoek is nodig om vast te stellen of anderhalvelijnszorg werkelijk tot substitutie van zorg leidt.
Uit de evaluatie van het Maastricht UMC+ over anderhalvelijnszorg blijkt dat zowel huisartsen als specialisten aangeven dat er nog verbetering kan plaatsvinden op het gebied van communicatie, samenwerking en kennis delen tussen huisartsen en specialisten. Het was bijvoorbeeld niet voor alle huisartsen duidelijk welke patiënten terecht kunnen bij de anderhalvelijnscentra en beide partijen hadden gehoopt meer te leren van elkaars expertise.
Uitgangspunt is dat de PDS zoveel mogelijk in de eerste lijn wordt behandeld. Verwijzing is alleen noodzakelijk bij twijfel over de diagnose, vastlopend behandeltraject in de eerste lijn of bij complexe achtergrond), maar dan bij voorkeur consultatief, en niet ter overname van de behandeling en liefst buiten het ziekenhuis, bijvoorbeeld via anderhalvelijnszorg.
Onderbouwing
Achtergrond
De diagnostiek van PDS is gestoeld op de anamnese, met lichamelijk onderzoek en eventueel beperkt aanvullend onderzoek. Diagnostiek en behandeling vinden in principe plaats in de eerste lijn. Alleen bij specifieke indicaties (twijfel over de diagnose of onvoldoende effect van behandeling) wordt een patiënt ter consultatie verwezen naar de tweede lijn (en daarna met advies in principe weer terugverwezen). PDS-zorg moet kwalitatief goede en doelmatige zorg zijn. Huisartsen, mdl-artsen en internisten met ervaring in de gastro-enterologie zijn bevoegd en bekwaam om PDS te behandelen en hun kennis is complementair bij PDS. Daarom wordt steeds meer toegewerkt naar ‘gedeelde zorg’ tussen huisarts en mdl-arts en naar samenwerking met niet-medische disciplines zoals diëtist en psycholoog (zie submodule 1).
PDS is een symptoomgebaseerde diagnose zonder zichtbare anatomische afwijkingen en met meerdere pathofysiologische verklaringen. Patiënt en arts kunnen verschillende verwachtingen of ideeën hebben over de ziekte en de onderliggende verklaringen. In de klinische praktijk kan dit een belemmering zijn die de diagnosestelling, communicatie en begeleiding bemoeilijkt [Hungin 2015]. Ook blijkt er vaak miscommunicatie te zijn tussen wat de patiënt denkt dat de oorzaak van de klachten is en hoe de arts dat ziet (zie submodule 2).
Om deze redenen is het van groot belang dat PDS-zorg wordt geboden in een zorgcontinuüm, waarin de betrokken zorgprofessionals dezelfde uitgangsprincipes ten aanzien van de aandoening en het beleid hebben, er goede onderlinge communicatie bestaat en er duidelijke samenwerkingsafspraken zijn gemaakt over ieders bijdrage in het zorgtraject. Dit shared care-principe kan op verschillende manieren worden ingevuld. Daarom hebben we in de wetenschappelijke literatuur gekeken naar bewijs van effectiviteit van de verschillende samenwerkingsvormen in de PDS-zorg.
Zoeken en selecteren
Voor de subvraag over gedeelde zorg is een systematische search verricht. Er werd gezocht naar modellen voor gedeelde zorg bij PDS (shared care, integrated delivery of health care, health care coalitions, extramural, multidisciplinary or interdisciplinary care or model). Van de 228 gevonden artikelen zijn 9 artikelen geïncludeerd die modellen voor gedeelde zorg beschreven.
Voor de subvraag over patiëntenvoorlichting is geen systematisch literatuuronderzoek verricht. De aanbevelingen zijn gebaseerd op de beschreven overwegingen. Deze overwegingen zijn opgesteld door de werkgroepleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door niet-systematisch literatuuronderzoek.
Gedeelde zorg
In het Nederlandse zorgstelsel presenteert de patiënt zich in eerste instantie bij de huisarts. De huisarts is primair degene die de diagnosestelling, behandeling en begeleiding van de patiënt uitvoert. Alleen op indicatie (diagnostische twijfel, vastlopend behandeltraject, complexe achtergrond) volgt verwijzing voor kortdurende specialistische consultatie (dus in principe geen overname van behandeling). Laagdrempelig contact van huisarts met de tweede lijn is nodig wanneer er twijfel is over de diagnose of bij ernstige PDS-klachten wanneer eerstelijnsbehandelingen niet het gewenste effect hebben.
De hieronder beschreven zorgmodellen over gedeelde zorg bij PDS zijn onderzocht in zorgstelsels die duidelijk verschillen van de Nederlandse situatie, waarbij de huisarts, anders dan in Nederland, geen poortwachtersfunctie heeft.
In de literatuur worden 3 verschillende zorgmodellen voor functionele maag-darmaandoeningen (FGID) en PDS beschreven, waarbij altijd een mdl-arts is betrokken:
- zorg door mdl-arts
- niet-geïntegreerde multidisciplinaire zorg: mdl-arts plus ≥ 1 disciplines
- geïntegreerde multidisciplinaire zorg: mdl-arts plus ≥ 1 disciplines
In figuur 3.1 worden de modellen als opeenvolgend weergegeven (Berry, 2021).
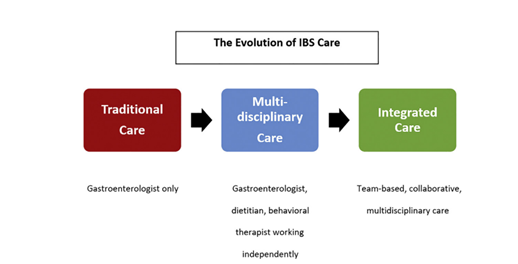
Figuur 3.1 De evolutie van PDS-zorg (Berry, 2021)
In het traditionele monodisciplinaire zorgmodel wordt de patiënt door de huisarts verwezen naar de mdl-arts, en deze is de enige die PDS-zorg verleent. Basnayake (2020) noemt in zijn review dat onderzoek liet zien dat een minderheid van de patiënten verbetering rapporteerde en dat een meerderheid van de patiënten in het onderzoek (die alleen zorg van een mdl-arts kregen) het gevoel had dat hun klachten hetzelfde waren of dat er verslechtering was.
In het multidisciplinaire zorgmodel verlenen naast de mdl-arts ook andere individuele zorgverleners een deel van de PDS-zorg. Bijvoorbeeld psychologische therapie door een psycholoog (Basnayake, 2020) of onafhankelijke diagnostiek en management door een verpleegkundige (Linedale, 2020). De effecten van deze gecombineerde zorg lijken iets beter dan in het monodisciplinaire model: een deel van de patiënten geeft aan dat hun klachten verminderd zijn en er zijn minder medische procedures nodig wanneer naast de gebruikelijke zorg een andere vorm van zorg gegeven wordt, zoals cognitieve gedragstherapie of hypnotherapie (de review beschrijft geen getallen) (Basnayake, 2020; Linedale, 2020). Er zijn echter niet minder bezoeken aan de mdl-arts, waarschijnlijk omdat dit 2 losse trajecten zijn (Basnayake, 2020; Linedale, 2020).
Het geïntegreerde zorgmodel beschrijft een zorg die meer op samenwerking tussen mdl-arts en andere professionals gebaseerd is. Bijvoorbeeld dat patiënten worden getrieerd, gescreend en gezien door een verpleegkundige of diëtist voor- of nadat ze naar de mdl-arts gaan (Basnayake, 2020; Linedale 2020). Vaak wordt er educatie gegeven tijdens deze consulten. Het effect hiervan is soms verbetering van de klachten, soms ook niet, maar vaak zijn er daarna wel minder ziekenhuisbezoeken en minder verwijzingen (Basnayake, 2020; Linedale, 2020; Mutsekwa, 2019; Novak, 2020; Williams, 2020). Wanneer een mdl-arts en psycholoog samen een consult met de patiënt hebben, is er een positiever effect dan wanneer de patiënt in een traject met alleen de mdl-arts of alleen de psycholoog zou samenzitten (Basnayake, 2020; Gerson, 2003). Dit komt waarschijnlijk doordat de eventuele psychologische comorbiditeit ook aandacht krijgt en behandeld wordt (Basnayake, 2020). Wanneer patiënten tijdens hetzelfde ziekenhuisbezoek meerdere disciplines (diëtist, psychiater, biofeedback-therapeut, hypnotherapeut) kunnen spreken en therapie ontvangen, en in een multidisciplinair overleg worden besproken, zijn de uitkomsten (symptomen, kwaliteit van leven) beter dan bij gebruikelijke zorg van alleen de mdl-arts (Basnayake, 2020b).
Volgens 2 onderzoeken (Chey, 2021; Berry, 2021). is in theorie een tertiair zorgteam bestaand uit mdl-arts plus een verpleegkundig specialist, diëtist, psycholoog, psychotherapeut, fysiotherapeut en huisarts het meest ideaal (Chey, 2021; Berry, 2021). Het is (nog) niet exact beschreven hoe dit praktisch te realiseren is en de waarde van het model is (nog) niet wetenschappelijk onderzocht.
Er zijn nog geen multidisciplinaire zorgmodellen of modellen van gedeelde zorg beschreven vanuit de eerste lijn. Het ligt voor de hand dat in de Nederlandse situatie deze zorgmodellen voor PDS ook vanuit de eerste lijn opgezet gaan worden.
Submodule 3.2 Voorlichting aan patiënten
Voor veel patiënten met PDS is het feit dat er geen duidelijke aantoonbare medische oorzaak voor hun klachten is en er soms geen eenduidige behandeling bestaat, lastig te begrijpen en soms moeilijk te accepteren. Uit focusgroepen blijkt dat patiënten behoefte hebben aan duidelijke en open communicatie, adequate voorlichting en breed beschikbare informatie over PDS [Masclee 2021]. Dat vraagt een goede vertrouwensrelatie met hun behandelaar en gezamenlijke besluitvorming. Vooral erkenning en herkenning zijn voor veel PDS-patiënten heel belangrijk. Bij PDS is het belangrijk om als professional de juiste insteek te kiezen: benader PDS als een diagnose die op basis van bepaalde criteria kan worden gesteld en niet als een ‘uitsluitingsdiagnose’ (zie Bijlage: korte uitleg voor de patiënt over PDS). Uit wetenschappelijk onderzoek blijkt dat de positieve benadering even effectief is, even acceptabel voor de patiënt en tot aanzienlijk lagere kosten leidt.
Vanuit patiënten is er behoefte aan duidelijke uitleg over de betekenis van factoren die in de verklaring van een ‘multidimensionale’ ziekte als PDS een rol kunnen spelen: verstoord microbioom, verhoogde darmgevoeligheid, verstoorde peristaltiek, verstoorde werking van de darm-hersenas, copingmechanismen, voedselintolerantie enzovoort. Goede uitleg en aansluiting op de beleving van de patiënt zorgt ervoor dat patiënten niet naar huis gaan met het idee dat het ‘tussen de oren zit’ of geen idee hebben wat ze ermee moeten. De arts moet in ieder geval voldoende tijd nemen om uitleg te geven en de patiënt handvatten te geven om zelf aan de slag te gaan, zodat de patiënt ervaart zelf de regie te hebben over de eigen gezondheid. Over de verschillende mogelijke behandelingen is uitleg nodig. Patiënten kunnen verwezen worden naar Thuisarts.nl, de Keuzehulp PDS en de PDSB-website. Patiënten kunnen baat hebben bij lotgenotencontact met andere PDS-patiënten via de PDSB.
Submodule 3.2 Voorlichting aan patiënten
Voor veel patiënten met PDS is het feit dat er geen duidelijke aantoonbare medische oorzaak voor hun klachten is en er soms geen eenduidige behandeling bestaat, lastig te begrijpen en soms moeilijk te accepteren. Uit focusgroepen blijkt dat patiënten behoefte hebben aan duidelijke en open communicatie, adequate voorlichting en breed beschikbare informatie over PDS [Masclee 2021]. Dat vraagt een goede vertrouwensrelatie met hun behandelaar en gezamenlijke besluitvorming. Vooral erkenning en herkenning zijn voor veel PDS-patiënten heel belangrijk. Bij PDS is het belangrijk om als professional de juiste insteek te kiezen: benader PDS als een diagnose die op basis van bepaalde criteria kan worden gesteld en niet als een ‘uitsluitingsdiagnose’ (zie Bijlage: korte uitleg voor de patiënt over PDS). Uit wetenschappelijk onderzoek blijkt dat de positieve benadering even effectief is, even acceptabel voor de patiënt en tot aanzienlijk lagere kosten leidt.
Vanuit patiënten is er behoefte aan duidelijke uitleg over de betekenis van factoren die in de verklaring van een ‘multidimensionale’ ziekte als PDS een rol kunnen spelen: verstoord microbioom, verhoogde darmgevoeligheid, verstoorde peristaltiek, verstoorde werking van de darm-hersenas, copingmechanismen, voedselintolerantie enzovoort. Goede uitleg en aansluiting op de beleving van de patiënt zorgt ervoor dat patiënten niet naar huis gaan met het idee dat het ‘tussen de oren zit’ of geen idee hebben wat ze ermee moeten. De arts moet in ieder geval voldoende tijd nemen om uitleg te geven en de patiënt handvatten te geven om zelf aan de slag te gaan, zodat de patiënt ervaart zelf de regie te hebben over de eigen gezondheid. Over de verschillende mogelijke behandelingen is uitleg nodig. Patiënten kunnen verwezen worden naar Thuisarts.nl, de Keuzehulp PDS en de PDSB-website. Patiënten kunnen baat hebben bij lotgenotencontact met andere PDS-patiënten via de PDSB.
Voorlichting en advies
Informeer de patiënt in een zo vroeg mogelijk stadium over mogelijke verklaringen voor PDS, de prognose en de bijbehorende klachten.
Mogelijke verklaringen
Geef voorlichting over de mogelijke oorzaak van PDS en leg het volgende uit
- Er is tot nu toe geen eenduidige verklaring voor de klachten van PDS gevonden.
- Er zijn verschillende theoretische verklaringen voor het ontstaan van PDS, waaronder verhoogde gevoeligheid van de darmen, veranderingen in de darmbeweeglijkheid, verstoorde balans tussen verschillende soorten darmbacteriën, veranderingen in de darmafweerfunctie en in de doorlaatbaarheid van darmcellen, veranderingen in de communicatie tussen darmen en hersenen (darm-hersenas, zie Etiologie).
- De diagnose wordt gesteld op basis van symptomen en klachten.
- Er bestaan verschillende vormen van PDS: bij PDS met diarree op de voorgrond werken de darmen te snel, bij PDS met obstipatie op de voorgrond werken de darmen te langzaam en er
- is een mengvorm waarbij de ene keer diarree en de andere keer obstipatie op de voorgrond staat.
- De koliekachtige pijn ontstaat doordat de darm sterk kan samentrekken.
- Er is geen verhoogd risico op het ontstaan van ernstige darmziekten.
- De klachten lijken soms te ontstaan na een heftige darminfectie of bij een periode van grote spanning.
Beloop en prognose
- Leg uit dat het individuele beloop van de klachten niet te voorspellen valt. Sommige mensen hebben periodiek klachten van wisselende aard, bij anderen houden de klachten lang aan.
- Geef aan dat er verschillende theoretische verklaringen zijn voor het voortduren van de klachten.
- Mensen met PDS zijn gevoeliger voor pijn in de darmen en merken meer van de werking van de darmen dan mensen zonder PDS. De exacte oorzaak van deze pijngevoeligheid is niet bekend, mogelijk speelt overgevoeligheid van de zenuwen in de darmen en hersenen een rol.
- Spanningen kunnen de klachten verergeren; veel mensen zijn ongerust over hun PDS-klachten en ook dat kan de klachten in stand houden of verergeren; darmklachten kunnen een signaal zijn dat men (langdurig) in een stressvolle situatie zit.
Aanvullend onderzoek
- Leg uit dat aanvullend onderzoek naar de oorzaak van PDS, bijvoorbeeld coloscopie, niet zinvol is omdat mogelijke oorzaken hiermee niet aan te tonen zijn. Coloscopie heeft geen consequenties voor het beleid en is niet zonder risico’s.
Mogelijke behandelingen van PDS
- Leg uit dat elke behandeling bij slechts een deel van de patiënten werkt (de effectiviteit van de behandelingen is onzeker).
- Leg uit dat welke behandeling het beste bij de patiënt past, afhangt van diens eigen klachten en voorkeuren. Ook mét behandeling kunnen klachten blijven bestaan of terugkomen.
Thuisarts
- Bied voorlichtingsmateriaal aan en verwijs naar de informatie op Thuisarts.nl. De informatie op Thuisarts.nl is gebaseerd op deze NHG-Standaard.
- Patiëntenorganisatie
- Attendeer de patiënt op de Prikkelbare Darm Syndroom Belangenorganisatie en de mogelijkheden van lotgenotencontact.
Referenties
- Basnayake C, Kamm MA, Salzberg MR, Wilson-O'Brien A, Stanley A, Thompson AJ. Delivery of care for functional gastrointestinal disorders: A systematic review. J Gastroenterol Hepatol. 2020 Feb;35(2):204-210. doi: 10.1111/jgh.14830. Epub 2019 Sep 3. PMID: 31411755.
- Basnayake C, Kamm MA, Stanley A, Wilson-O'Brien A, Burrell K, Lees-Trinca I, Khera A, Kantidakis J, Wong O, Fox K, Talley NJ, Liew D, Salzberg MR, Thompson AJ. Standard gastroenterologist versus multidisciplinary treatment for functional gastrointestinal disorders (MANTRA): an open-label, single-centre, randomised controlled trial. Lancet Gastroenterol Hepatol. 2020 Oct;5(10):890-899. doi: 10.1016/S2468-1253(20)30215-6. Epub 2020 Jul 14. PMID: 32679040.
- Berry SK, Chey WD. Integrated Care for Irritable Bowel Syndrome: The Future Is Now. Gastroenterol Clin North Am. 2021 Sep;50(3):713-720. doi: 10.1016/j.gtc.2021.04.006. Epub 2021 Jul 3. PMID: 34304796.
- Van den Bogaart E, Quanjel T, Kroese M, et al. Monitoring en evaluatie van substitutie van zorg in drie Limburgse proeftuinen – Evaluatierapport, 2019
- Chey WD, Keefer L, Whelan K, Gibson PR. Behavioral and Diet Therapies in Integrated Care for Patients With Irritable Bowel Syndrome. Gastroenterology. 2021 Jan;160(1):47-62. doi: 10.1053/j.gastro.2020.06.099. Epub 2020 Oct 19. PMID: 33091411.
- Flik CE, van Rood YR, de Wit NJ. Systematic review: knowledge and educational needs of patients with irritable bowel syndrome. Eur J Gastroenterol Hepatol. 2015 Apr;27(4):367-71. doi: 10.1097/MEG.0000000000000252. PMID: 25874506.
- Gerson CD, Gerson MJ. A collaborative health care model for the treatment of irritable bowel syndrome. Clin Gastroenterol Hepatol. 2003 Nov;1(6):446-52. doi: 10.1016/s1542-3565(03)00218-0. PMID: 15017644.
- Keszthelyi D, Troost FJ, Simrén M, Ludidi S, Kruimel JW, Conchillo JM, Masclee AA. Revisiting concepts of visceral nociception in irritable bowel syndrome. Eur J Pain. 2012 Nov;16(10):1444-54. doi: 10.1002/j.1532-2149.2012.00147.x. Epub 2012 Apr 13. PMID: 22504901.
- Linedale EC, Mikocka-Walus A, Gibson PR, Andrews JM. The Potential of Integrated Nurse-Led Models to Improve Care for People With Functional Gastrointestinal Disorders: A Systematic Review. Gastroenterol Nurs. 2020 Jan/Feb;43(1):53-64. doi: 10.1097/SGA.0000000000000379. PMID: 31990873.
- Ludidi S, Conchillo JM, Keszthelyi D, Van Avesaat M, Kruimel JW, Jonkers DM, Masclee AA. Rectal hypersensitivity as hallmark for irritable bowel syndrome: defining the optimal cutoff. Neurogastroenterol Motil. 2012 Aug;24(8):729-33, e345-6. doi: 10.1111/j.1365-2982.2012.01926.x. Epub 2012 May 16. PMID: 22591192.
- Masclee GMC, Snijkers JTW, Boersma M, Masclee AAM, Keszthelyi D. Patient preferences of healthcare delivery in irritable bowel syndrome: a focus group study. BMC Gastroenterol. 2021 Nov 23;21(1):438. doi: 10.1186/s12876-021-02030-x. PMID: 34814846; PMCID: PMC8609738.
- Mutsekwa RN, Larkins V, Canavan R, Ball L, Angus RL. A dietitian-first gastroenterology clinic results in improved symptoms and quality of life in patients referred to a tertiary gastroenterology service. Clin Nutr ESPEN. 2019 Oct;33:188-194. doi: 10.1016/j.clnesp.2019.05.016. Epub 2019 Jun 6. PMID: 31451260.
- Novak KL, Halasz J, Andrews C, Johnston C, Schoombee W, Tanyingoh D, Kaplan GG, van Zanten SV, Swain M. Nurse-Led, Shared Medical Appointments for Common Gastrointestinal Conditions-Improving Outcomes Through Collaboration With Primary Care in the Medical Home: A Prospective Observational Study. J Can Assoc Gastroenterol. 2020 Apr;3(2):59-66. doi: 10.1093/jcag/gwy061. Epub 2018 Oct 24. PMID: 32328544; PMCID: PMC7165260.
- Williams M, Barclay Y, Harper L, Marchant C, Seamark L, Hickson M. Feasibility, acceptability and cost efficiency of using webinars to deliver first-line patient education for people with Irritable Bowel Syndrome as part of a dietetic-led gastroenterology service in primary care. J Hum Nutr Diet. 2020 Dec;33(6):758-766. doi: 10.1111/jhn.12799. Epub 2020 Aug 20. PMID: 32816367.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 07-11-2022
Algemene gegevens
Het Prikkelbaredarmsyndroom (PDS) kenmerkt zich door terugkerende episodes van buikpijn die samenhangen met een wisselling of verandering (in vorm en/of frequentie) in ontlastingspatroon. PDS is de meest voorkomende functionele darmaandoening in zowel de eerste als de tweede lijn.
Internationaal is er een brede variatie in prevalenties van PDS, met uitersten van 1,1% (Frankrijk en Iran) tot 35,5% (Mexico). De gepoolde wereldwijde prevalentie is 8,8% (Sperber, 2017). De prevalentie van PDS in de algemene Nederlandse bevolking bedraagt 3,8% op basis van de Rome-IV-criteria en 9,7% op basis van de ruimere Rome-III-criteria (Sperber, 2021). De internationale prevalentie volgens de Rome-IV-criteria is naar schatting 4,1% (5,2% bij vrouwen en 2,9% bij mannen) (Sperber, 2021). Wat oudere data uit Nederlandse morbiditeitsregistraties in de huisartsenpraktijk laten grote verschillen zien, afhankelijk van de PDS-definitie en de gebruikte Rome-criteria. De Continue Morbiditeitsregistratie geeft voor de periode 1998-2006 een incidentie bij mannen van 2-3 en bij vrouwen van 6-7 per 1000 patiënten per jaar, en een prevalentie van 4 per 1000 mannen en 10 per 1000 vrouwen.
De diagnose PDS wordt vooral gesteld op jongere leeftijd. In Nederland zijn de prevalenties 5,3% in de leeftijd 18-39 jaar, 3,7% in de leeftijd 40-64 jaar en 1,7% in de leeftijd ≥ 65 jaar. Van de mensen met klachten die passen bij PDS zoekt 33-50% hulp (Van de Lisdonk, 2008). Naar schatting 90% van de patiënten met PDS wordt behandeld in de eerste lijn; van de patiënten met chronische darm- en buikklachten in de eerste lijn heeft ongeveer de helft een somatisch onvoldoende verklaarde maagdarmstoornis, de meesten PDS (Guthrie, 2002). PDS veroorzaakt vaak langdurig klachten. Deze klachten zijn regelmatig ernstig invaliderend, hebben grote impact op de kwaliteit van leven en zorgen voor ziekteverzuim en beperkingen in het sociaal functioneren.
Doel en doelgroep
In de richtlijn staan aanbevelingen voor diagnostiek en behandeling van volwassen patiënten met PDS in de eerste en tweede lijn. Daar waar nodig gaat de richtlijn in op de behandeling door andere zorgverleners zoals psychologen, hypnotherapeuten en diëtisten.
Samenstelling werkgroep
Werkgroep
- Prof. Dr. A.A.M. (Ad) Masclee, MDL-arts, (voorzitter) NVMDL
- Drs. J. (Jacintha) Van Balen, huisarts, (voorzitter) NHG
- Prof. Dr. J. (Jean) Muris, huisarts, (vice-voorzitter) NHG
- Dr. C.H.M. (Cees) Clemens, MDL-arts, NVMDL
- Drs. B.J.T. (Bertram) Haarhuis, MDL-arts, NVMDL
- Prof dr. D. (Daniel) Keszthelyi, MDL-arts, NVMDL
- Prof. Dr. N. (Niek) de Wit, huisarts, NHG
- Dr. A.O. (Otto) Quartero, huisarts, NHG
- Dr. C.E. (Carla) Flik, klinisch psycholoog (niet praktiserend), op persoonlijke titel
- Drs. D.D (Dyana) Loehr, patiëntvertegenwoordiger, PDSB
- J.H.M. (Jenny) Brouns, diëtist, NVD
Met ondersteuning van:
- Dr. E. Belfroid, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. Minnaard, wetenschappelijk medewerker, Nederlands Huisartsen Genootschap
- Dr. A. Schep, epidemioloog, Nederlands Huisartsen Genootschap
- Dr. ir. N.L. van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben een verklaring ingevuld. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de tabel. De volledige belangenverklaringen zijn op te vragen via het secretariaat van het Kennisinstituut en het NHG.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Masclee, Voorzitter richtlijnwerk- groep |
Hoofd MDL- ziekten en hoogleraar MDL- ziekten, Maastricht UMC+ (t/m oktober 2021) |
|
-ZonMw subsidie Goed Gebruik Geneesmiddelen: Peppermint oil for the treatment of irritable bowel syndrome: optimalisation of anti- nociception through targeted delivery in the large bowel.
samenwerkingsverband |
Geen. (alternerend) voorzitterschap lag bij mede- voorzitter tijdens bespreking pepermuntolie |
|
Van Balen, Voorzitter richtlijnwerk- groep |
Senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap (0,7 fte) en huisarts (0,2 fte) |
Geen |
Geen |
Geen acties nodig |
|
Muris |
Hoogleraar Huisartsengenees kunde Universiteit Maastricht, 1,0 fte Vervangende werkzaamheden in huisartsen- praktijk Geulle (1- 2 × per maand 1 dag) |
|
Geen |
Geen acties nodig |
|
Haarhuis |
Mdl-arts Bernhoven te Uden |
Geen |
Geen |
Geen acties nodig |
|
Loehr |
Coördinator social media en lid medische commissie bij de Prikkelbare Darm Syndroom Belangenorgani- satie (als vrijwilliger, ± 8 uur per week) |
|
Geen |
Geen acties nodig |
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Clemens |
Mdl-arts Alrijne Zorggroep |
Geen |
Geen |
Geen acties nodig |
|
Keszthelyi |
Mdl-arts Maastricht UMC+ (1,0 fte) |
enterologie (NVGE, onbetaald).
|
(projectleider).
projectleider). |
Geen trekker bij module over Pepermuntolie. Restricties t.a.v. besluitvorming over pepermuntolie. |
|
De Wit |
- Voorzitter divisie Julius Centrum voor Gezondheidswe- tenschappen en Eerstelijns Geneeskunde |
Onbezoldigd:
|
- Projectleider van het CEDAR onderzoek; ZonMw project naar kosteneffectiviteit van coloscopie aanvragen door de huisarts bij onderbuikspijnklachten. |
Restricties t.a.v. module over hypnotherapie |
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
|
UMC Utrecht - Hoogleraar Huisartsgenees- kunde UMC Utrecht |
European Society for Primary Care Gastroenterology (ESPCG)
programmacommissie Doen of Laten
kwartiermakersoverleg Onderzoek en Innovatie voor de regio
Bezoldigd
Hilversum |
|
|
|
Quartero |
Huisarts, vrijgevestigd |
Voorzitter huisartsencoöperatie HCDO; hiervoor ontvang ik per kwartaal vacatiegeld (afhankelijk van gedraaide uren €1300-€1500 per kwartaal) |
Geen |
Geen acties nodig |
|
Flik |
Gepensioneerd klinisch psycholoog (n.p.) |
Eigenaar van de digitale verbeteringen Hypnotherapie gemaakt in het kader van mijn onderzoek |
Geen |
Restricties t.a.v. hypnotherapie (opstellen uitgangsvraag en geen leidende rol in schrijven van de module) |
|
Brouns |
Diëtist met specifieke deskundigheid MDL waaronder PDS, 28 uur per week (24 uur patiënt gerelateerde zorg, 4 uur MDL innovatie) UMC+ Maastricht |
|
Geen |
Geen acties nodig |
Inbreng patiëntenperspectief
Voor het ontwikkelen van de richtlijn zijn een multidisciplinaire werkgroep en een klankbordgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de paragraaf ‘Samenstelling van de werkgroep’) die betrokken zijn bij de zorg voor patiënten met PDS.
Er werd aandacht besteed aan het patiëntperspectief door zitting van een afgevaardigde van de patiëntenorganisatie (PDSB) in de werkgroep. De Patiëntenfederatie Nederland en PDSB werden uitgenodigd voor de invitational conference/knelpunteninventarisatie. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De richtlijn is tevens voor commentaar voorgelegd aan de PDSB en de Patiëntenfederatie.
Kwalitatieve raming van mogelijk financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming gedaan of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst.
Uit de kwalitatieve raming blijkt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), maar dat er waarschijnlijk geen substantiële financiële gevolgen zijn. Zie tabel voor een overzicht van uitkomsten van de kwalitatieve raming met bijbehorende toelichting.
Tabel Kwalitatieve raming in het kader van de Wkkgz
|
Module |
Uitkomst raming |
Toelichting |
|
Calprotectinetest |
Geen financiële gevolgen |
Het betreft geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Fecaal Immunochemische test (FIT) |
Geen financiële gevolgen |
De aanbeveling heeft een kostenbesparend effect, omdat de diagnostiek minder zal worden ingezet dan in de huidige situatie. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Coloscopie |
Geen financiële gevolgen |
De aanbeveling heeft een kostenbesparend effect, omdat de diagnostiek minder zal worden ingezet dan in de huidige situatie. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
Geen financiële gevolgen |
De aanbevelingen betreffen geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners en geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Probiotica |
Geen financiële gevolgen |
De aanbeveling is zwak negatief geformuleerd. Er worden daarom geen substantiële financiële gevolgen verwacht. Bovendien betalen patiënten zelf voor het middel. |
|
Pepermuntolie |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
|
Module |
Uitkomst raming |
Toelichting |
|
Linaclotide |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
|
Antidepressiva |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
|
Psychologische behandelingen |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
|
Organisatie van zorg |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn. Echter, uit de toetsing volgt ook dat de aanbevelingen volgens de criteria beschreven in het uitvoeringsbesluit Wkkgz 2.1b en 2.1c ten opzichte van de huidige situatie geen substantiële financiële investering vragen, en geen wijziging in het opleidingsniveau van zorgpersoneel en geen toename (> 5% fte) in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreffen. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Patiëntvoorlichting |
Geen financiële gevolgen |
De aanbevelingen volgend uit deze module zijn voorlichtend van aard en bevorderen hoogstens in enige mate de zelfredzaamheid van de patiënt. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Implementatie
In de verschillende fasen van de richtlijnontwikkeling heeft de werkgroep rekening gehouden met de implementatie van de richtlijn en de uitvoerbaarheid van de aanbevelingen. Daarbij heeft de werkgroep expliciet gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Bij elke module is een implementatietabel opgesteld. Bij elke aanbeveling is een inventarisatie gedaan van de mogelijke bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door de verschillende partijen ondernomen dienen te worden.
Werkwijze
Aanleiding herziening en definitie ‘richtlijn’
Op initiatief van het Nederlands Huisartsen Genootschap (NHG) en de Nederlandse Vereniging van Maag-Darm-Leverartsen (NVMDL) is in september 2020 gestart met de herziening van de multidisciplinaire richtlijn en de NHG-Standaard Prikkelbaredarmsyndroom (PDS). Aanleiding voor het gezamenlijk oppakken van de herziening van deze richtlijnen, is de wens tot nadere afstemming van het aanbevolen beleid tussen eerste en tweede lijn. De tweedelijnsrichtlijn bestaat uit een set van modules waarin de aanbevelingen staan met onderbouwing. De NHG-Standaard bestaat uit een volledige tekst met aanbevelingen, waarbij voor de onderbouwing wordt verwezen naar de details.
Een deel van deze details komt inhoudelijk overeen met de modules uit de
tweedelijnsrichtlijn. Wanneer in deze totstandkoming wordt gesproken over ‘de richtlijn’
dan worden hiermee de tweedelijnsrichtlijn én de NHG-Standaard bedoeld.
Doel van de richtlijn
Deze richtlijn geeft adviezen over diagnostiek, behandeling, begeleiding en voorlichting in de eerste en tweede lijn voor patiënten met een prikkelbaredarmsyndroom. De modules zijn onderverdeeld in 3 overkoepelende onderwerpen:
- diagnostiek
- begeleiding en behandeling
- organisatie van zorg
Afbakening van het onderwerp
Deze richtlijn beschrijft de zorg voor alle patiënten met prikkelbaredarmsyndroom, zowel voor de eerste als voor de tweede lijn.
Werkwijze
Voor het herzien van de multidisciplinaire richtlijn en de NHG-Standaard is een multidisciplinaire werkgroep en een klankbordgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met PDS. In de multidisciplinaire werkgroep zijn de modules uitgewerkt die onderdeel zijn van de tweedelijnsrichtlijn én de NHG-Standaard. In een aparte vergadering met de huisartsen en een van de medisch specialisten van de multidisciplinaire werkgroep zijn de ‘extra’ onderdelen van de NHG-Standaard besproken (volledige tekst, details die niet als module in de multidisciplinaire werkgroep besproken zijn).
Een kerngroep bestaande uit de 2 voorzitters van de multidisciplinaire werkgroep, de wetenschappelijk medewerkers van het NHG en de adviseurs van het Kennisinstituut van de Federatie Medisch Specialisten (Kennisinstituut) was verantwoordelijk voor de afstemming binnen het project.
Het NHG en het Kennisinstituut hebben de richtlijnontwikkeling zowel procesmatig als methodologisch ondersteund.
Gebruikers van de richtlijn
De richtlijn is bedoeld voor alle zorgverleners die betrokken zijn bij de zorg aan patiënten met prikkelbaredarmsyndroom. De NHG-Standaard is primair bedoeld voor de huisartsen, de tweedelijnsrichtlijn is primair bedoeld voor alle zorgverleners die de medische specialistische zorg verlenen, zoals mdl-artsen, internisten, (klinisch) psychologen en diëtisten. Waar mdl-arts wordt genoemd in deze richtlijn kan ook internist met specialisatie in gastro-enterologie worden gelezen.
Presentatie
De tweedelijnsrichtlijn wordt gepresenteerd in de Richtlijnendatabase van de Federatie Medisch Specialisten en de NHG-Standaard op de NHG-richtlijnenwebsite. Deze databases/sites verschillen qua structuur en opbouw iets van elkaar, en dit maakt dat sommige onderdelen uit de richtlijn specifiek zijn voor of de Richtlijnendatabase, of de NHG- richtlijnenwebsite. Daarnaast is een vertaling van de richtlijn gemaakt naar informatie op Thuisarts.nl, zodat de actuele informatie ook voor patiënten beschikbaar is.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling heeft de werkgroep rekening gehouden met de implementatie van de richtlijn en de uitvoerbaarheid van de aanbevelingen. Daarbij heeft de werkgroep expliciet gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Bij elke module is een implementatietabel opgesteld. Bij elke aanbeveling is een inventarisatie gedaan van de mogelijke bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door de verschillende partijen ondernomen dienen te worden.
Juridische status van richtlijnen
Richtlijnen bevatten geen wettelijke voorschriften, maar aanbevelingen die zo veel mogelijk op bewijs gebaseerd zijn. Zorgverleners kunnen aan de aanbevelingen voldoen in het streven om kwalitatief goede of ‘optimale’ zorg te verlenen. Aangezien deze aanbevelingen gebaseerd zijn op ‘algemeen bewijs voor optimale zorg’ en de inzichten van de werkgroep hierover, kunnen zorgverleners op basis van hun professionele autonomie zo nodig in individuele gevallen afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van
de patiënt dat vereist, zelfs noodzakelijk. Wanneer zorgverleners van deze richtlijn afwijken, wordt het aanbevolen om dit beargumenteerd, gedocumenteerd en waar relevant in overleg met de patiënt te doen. Wij verwijzen voor huisartsen naar de disclaimer en voor medisch specialisten naar het rapport Medisch Specialistische Richtlijnen 2.0.
Deze richtlijn is ontwikkeld volgens de Handleiding Ontwikkelen van NHG-richtlijnen (verkorte versie Totstandkoming NHG-Standaarden | NHG-Richtlijnen) en het rapport Medisch Specialistische Richtlijnen 2.0. Op punten waar deze van elkaar verschilden is overeenstemming gezocht tussen NHG en Kennisinstituut.
Voorbereidingsfase
Knelpuntenanalyse
Tijdens de voorbereidende fase is een invitational conference georganiseerd, waarvoor betrokken verenigingen en organisaties zijn uitgenodigd. Voorafgaand aan de invitational conference zijn door het NHG knelpunten in de huisartsenzorg verzameld. Het conceptraamwerk met geïdentificeerde onderwerpen gedeeld met aanwezigen, en aanwezigen hebben kunnen reageren op het raamwerk. Tijdens de invitational conference zijn de onderwerpen besproken en was er gelegenheid te reageren. Een verslag van de invitational conference is opgenomen als bijlage in de richtlijn. Het NHG en het Kennisinstituut hebben samen met de voorzitters vervolgens op basis van de resultaten van de knelpunteninventarisatie de onderwerpen geselecteerd die opgenomen zouden kunnen worden in de richtlijn. Na bespreking in de werkgroep zijn concept-uitgangsvragen opgesteld en definitief vastgesteld.
Opstellen van uitgangsvragen
De werkgroep heeft aan het begin van het traject besloten voor welke uitgangsvragen een literatuursamenvatting met GRADE-beoordeling geschreven kon worden (dit betreft vooral diagnostische of therapeutische vragen), en voor welke uitgangsvragen geen literatuursamenvatting of een literatuursamenvatting zonder GRADE-beoordeling zou worden opgenomen. In het geval van een diagnostische of therapeutische vraag is de uitgangsvraag vertaald naar een PICO of PIRO (patient, intervention, control/reference test, outcome). Aan het begin van het traject heeft de werkgroep per uitgangsvraag de patiëntrelevante uitkomstmaten vastgesteld. Deze uitkomstmaten zijn vervolgens geprioriteerd: ze werden gelabeld als cruciaal, belangrijk en niet-belangrijk.
Voor de onderwerpen die niet geselecteerd zijn, is de onderbouwing onveranderd overgenomen uit de vorige versie van de richtlijn/standaard.
Ontwikkelingsfase – uitgangsvragen met GRADE-beoordeling
Zoekstrategie en selectie van literatuur
Voor elke PICO voerde een medisch informatiespecialist van het NHG of het Kennisinstituut een literatuursearch uit. De gevonden literatuur is gescreend op basis van titel en abstract. De relevante literatuur werd geselecteerd en de volledige tekst van het artikel werd aangevraagd. De resultaten van de literatuurselectie van iedere PICO zijn samengevat in PRISMA-stroomdiagrammen.
In eerste instantie zijn systematische reviews (SR’s) en (buitenlandse) richtlijnen van goede kwaliteit gebruikt voor de beantwoording van de uitgangsvragen. De kwaliteit van de SR’s of van de samenvattingen van het wetenschappelijk bewijs die deel uitmaakten van een
richtlijn werd beoordeeld; alleen SR’s die aan enkele minimale eisen voldeden (componenten PICO beschreven; PICO aansluitend bij uitgangsvraag; systematische search uitgevoerd; geïncludeerde artikelen beschreven; recente zoekdatum) werden gebruikt.
Indien er voor een uitgangsvraag een geschikte SR werd gevonden, zijn aanvullend individuele onderzoeken van na de sluitingsdatum van de zoekactie van deze SR gescreend.
Indien er geen SR beschikbaar was, werd naar individuele onderzoeken gekeken, waarbij werd gefilterd op methodologie (bijvoorbeeld RCT’s bij interventievragen).
Samenvatting van het wetenschappelijke bewijs
Indien er voor een uitgangsvraag een geschikte SR werd gevonden, werd de samenvatting van het wetenschappelijk bewijs uit deze SR gebruikt. Anders werden de resultaten van individuele primaire onderzoeken samengevat. Indien mogelijk werden de resultaten gepoold. Van iedere geïncludeerde studie werd het risico op vertekening beoordeeld.
Beoordeling en gradering van het wetenschappelijke bewijs
Het beoordelen en graderen van het bewijs heeft plaatsgevonden met de GRADE-methode. GRADE beoordeelt de zogenoemde body of evidence: de verzameling van alle gevonden onderzoeken per uitkomstmaat. De onderverdeling van de kwaliteit van het wetenschappelijk bewijs kent 4 niveaus: hoog, redelijk, laag of zeer laag. Een hoge kwaliteit wil zeggen dat het geschatte en het werkelijke effect dicht bij elkaar liggen. Naarmate de kwaliteit van bewijs lager is, neemt de onzekerheid daarover toe (zie tabel 1).
Tabel 1 Definitie kwaliteit van bewijs
|
Kwaliteit |
Interpretatie |
|
Hoog |
Het werkelijke effect ligt dicht in de buurt van de schatting van het effect. |
|
Redelijk |
Het werkelijke effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
|
Laag |
Het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
|
Zeer laag |
We zijn onzeker over het werkelijke effect. |
Kwaliteit Interpretatie
Hoog Het werkelijke effect ligt dicht in de buurt van de schatting van het effect.
Redelijk Het werkelijke effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt.
Laag Het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect.
Zeer laag We zijn onzeker over het werkelijke effect.
Bij het beoordelen van het verschil in effecten tussen interventies is gelet op het bestaan van klinisch relevante verschillen tussen interventies. Daarvoor wordt bij voorkeur gelet op absolute verschillen (indien deze gegevens beschikbaar zijn). De werkgroep heeft per uitkomstmaat bepaald wat de grens voor een klinisch relevant verschil (voor- of nadeel) is.
Van bewijs naar aanbeveling (overwegingen).
Na de samenvatting en beoordeling van het wetenschappelijk bewijs volgt de vertaling van de resultaten naar aanbevelingen voor de praktijk, oftewel de zogenoemde vertaalslag ‘Van bewijs naar aanbeveling’. Ook praktische en contextuele factoren spelen een rol om tot goed toepasbare aanbevelingen te komen. De volgende zes factoren komen hierbij aan de orde:
- Voor- en nadelen
- Kwaliteit van bewijs
- Waarden en voorkeuren van patiënten
- Kosten (NB De werkgroep heeft geen formele kosteneffectiviteits- of budgetimpactanalyses gedaan)
- Aanvaardbaarheid
- Haalbaarheid en implementatie
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie tabel 2). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 2 Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Synthese van bewijs en opstellen van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE- methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Ontwikkelingsfase – overig
Voor een aantal modules/details is geen literatuursamenvatting of een literatuursamenvatting zonder GRADE-beoordeling opgenomen. Dit is het geval bij modules/details die meer achtergrondinformatie geven (epidemiologie, etiologie en pathofysiologie) of gericht zijn op de organisatie van zorg. Indien er wel een systematische zoekactie is uitgevoerd, dan vond er geen systematische selectie, beoordeling en gradering van de evidence plaats, maar is de literatuur narratief beschreven. Daarnaast worden er in de volledige tekst (NHG-Standaard) naast de aanbevelingen ook praktische adviezen gegeven die niet worden onderbouwd (in een detail), zoals de onderdelen anamnese, lichamelijk onderzoek, evaluatie, controles en verwijzingen. Deze teksten zijn – na discussie door de werkgroep – op basis van consensus tot stand gekomen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de
uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde PICO’s is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat er nog kennislacunes bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk. Om deze reden heeft de werkgroep per module aangegeven op welke vlakken nader onderzoek gewenst is. Hierbij heeft er een prioritering plaatsgevonden waarbij is uitgegaan van maximum van 5 lacunes. Deze kennislacunes zijn gepubliceerd op Lacunes & onderzoeken | NHG-Richtlijnen en als bijlage van de richtlijnmodules op de Richtlijnendatabase.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd in het voorjaar van 2022 aan de NHG-Autorisatiecommissie (NHG AC), de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar.
Twee leden van de NHG-Adviesraad Standaarden (NAS) hebben tijdens de commentaarronde de standaard beoordeeld. Tien huisartsen gaven via het HAweb- ledenforum commentaar op de NHG-Standaard.
De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd na bespreking voorgelegd aan de NHG AC, de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voor (bestuurlijke) goedkeuring en werd door hen geautoriseerd dan wel geaccordeerd.
Procedure voor herziening
Deze richtlijn wordt periodiek herzien. Uiterlijk in 2026 bepalen het NHG en de NVMDL of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van deze richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanpassing aan de aanbevelingen nodig maken, en daarmee aanleiding zijn om een herzieningstraject te starten.
