Voeding
Uitgangsvraag
Wat is het advies ten aanzien van voeding bij patiënten met PDS?
Aanbeveling
1. Adviseer patienten met PDS de Richtlijnen goede voeding 2015 te volgen.
2. Bij gebruik van 1 of enkele duidelijke voedingsgerelateerde triggers zoals gasvormers, lactose, frisdrank, overmatig vet, pittige kruiden, cafeïne, alcohol, sorbitol, kunstmatige zoetstoffen en tarwezemelen kan de voeding hierop aangepast worden. Uitgangspunt is het behoud van een evenwichtig voedingspatroon.
3. Overweeg het gebruik van psylliumvezels (zonder hulpstoffen zoals sorbitol, inuline of aspartaam) als mogelijke aanvulling op de adviezen over goede voeding, wanneer deze adviezen onvoldoende verbetering geven, of wanneer de voeding te weinig vezels bevat:
- Dosering 1-3 sachets per dag.
- Bespreek de voordelen (klachtenverlichting, weinig bijwerkingen) en nadelen (smaak, kosten, enige gasvorming, met name in de eerste week toename van buikklachten).
- Adviseer de vochtinname aan te passen op grond van de consistentie van de ontlasting (dat wil zeggen met veel vocht bij obstipatie, en met weinig bij diarreeklachten).
4. Verwijs patiënten met PDS laagdrempelig naar de diëtist voor voedingsadvies:
- wanneer er meerdere voedingsgerelateerde triggers bestaan
- wanneer er sprake is van een onevenwichtig voedingspatroon
- als de patiënt (als mogelijke volgende stap in de dieetbehandeling) in aanmerking zou kunnen komen voor het laag-FODMAP-dieet.
Zie het factsheet Voedingsadvies bij PDS is maatwerk voor wat de diëtist kan betekenen voor een patiënt met PDS.
Voor de praktische uitwerking voor de diëtist, zie bijlage.
We bevelen een glutenvrij dieet bij PDS niet aan.
Gebruik bij verwijzing naar een diëtist bij voorkeur de verwijsreden ‘Dieetbehandeling bij PDS’ omdat de diëtist dan aan de hand van het diëtistisch onderzoek maatwerkgericht een dieetbehandelplan kan opstellen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In deze uitgangsvragen onderzochten we de effectiviteit van het glutenvrije dieet, het laag-FODMAP-dieet, het NICE-IBS-dieet en psylliumvezels bij patiënten met PDS. Er zijn diverse RCT’s uitgevoerd naar glutenvrij dieet, laag-FODMAP-dieet en psylliumvezels bij patiënten met PDS. De diëten werden afzonderlijk van elkaar vergeleken met een controledieet. Het NICE-IBS-dieet werd alleen beschreven als controledieet, maar is in feite al een dieetinterventie.
Over het NICE-IBS-dieet in vergelijking met het gebruikelijke voedingspatroon is geen relevante literatuur gevonden, dus kan over de effectiviteit van dit dieet geen conclusie worden getrokken. De plaats van de diëten ten opzichte van elkaar is dus niet bestudeerd.
Hieronder beschrijven we kort de resultaten, en de voor- en nadelen van de 4 diëten afzonderlijk.
Glutenvrij dieet
De geïdentificeerde onderzoeken beschreven de uitkomstmaten buikpijn, algemene verbetering en verlichting van klachten. Kwaliteit van leven werd niet beschreven. De bewijskracht was zeer laag en daarmee kunnen ook geen uitspraken worden gedaan over de effectiviteit van een glutenvrij dieet bij patiënten met PDS. Het volgen van een glutenvrij dieet is intensief en heeft een grote sociale en financiële impact. Bovendien bevatten glutenvrije producten vaak meer vet, suiker en zout en minder vezels, vitamines en mineralen dan de reguliere producten, wat ongunstig is voor de algehele gezondheid. Gezien de aanzienlijke publieke interesse in dit type dieetbehandeling dient middels gerandomiseerde gecontroleerde onderzoeken meer bewijs te worden verzameld. Temeer omdat de mogelijke verbetering na een glutenvrij dieet niet door het elimineren van gluten per se wordt veroorzaakt, maar mogelijk door reductie van inname van fructanen (een FODMAP) of zogenaamde Amylase Trypsin Inhibitors (ATI’s). ATI’s zijn specifieke eiwitten die je in alle glutenbevattende granen vindt en ook een immunologische reactie kunnen uitlokken (Shewry, 2021).
Over het algemeen is een glutenvrije voeding minder gezond (meer vet, suiker en zout en minder vezels, vitamines en mineralen dan de reguliere producten) en zijn de gezondheidsrisico’s op de langere termijn onbekend.
Laag FODMAP-dieet
De geïncludeerde onderzoeken beschreven de uitkomstmaten buikpijn, global improvement, kwaliteit van leven en verlichting van klachten. De bewijskracht was laag tot zeer laag. Het laag-FODMAP-dieet lijkt een klinisch relevant effect te hebben op de uitkomstmaat algemene verbetering. Over de uitkomstmaten buikpijn, kwaliteit van leven en verlichting van klachten kunnen geen uitspraken worden gedaan omdat het bewijs op deze uitkomstmaten zeer laag is. Meta-analyses van de uitkomstmaat algemene verbetering laten zien dat het effect van het laag-FODMAP-dieet groter is wanneer het wordt vergeleken met het normale dieet van de patiënt of met een hoog-FODMAP-dieet, dan wanneer het wordt vergeleken met een alternatief dieet – vaak een (aangepast) NICE-IBS-dieet dat relatief weinig FODMAP’s bevat.
Een belangrijke aantekening hierbij is dat de metingen in de onderzoeken plaatsvonden op het moment dat alle hoog-FODMAP-producten al enkele weken vermeden waren, maar niet na de herintroductieperiode. Hoe het laag-FODMAP-dieet scoort op de gedefinieerde uitkomstmaten na herintroductie van FODMAP’s is dus niet bekend.
Ook de langetermijneffecten van het laag-FODMAP-dieet zijn nog niet bekend. FODMAP’s vormen het substraat voor het darmmicrobioom en depletie van deze koolhydraten kan nadelige effecten hebben op de samenstelling en de activiteit van het microbioom. Bovendien zijn FODMAP’s ook een bron van korteketenvetzuren, die een positief effect hebben op het darmepitheel (bron van energie en antioxidante werking) (Hamer, 2008).
Belangrijk is dat het laag-FODMAP-dieet, in tegenstelling tot veel andere diëten, niet bedoeld is om langere tijd te volgen. Het laag-FODMAP-dieet is alleen bedoeld om uit te zoeken op welke FODMAP’s de patiënt reageert en op welke niet. Binnen een paar maanden is het dieet klaar en gaat de patiënt weer ‘normaal’ eten zonder de FODMAP’s die veel klachten geven.
FODMAP’s hebben een osmotisch effect en zijn substraten voor bacteriële fermentatie, en zullen dus vooral diarree, krampen en overmatige gasvorming veroorzaken. Dat geldt in het bijzonder voor mensen met de viscerale overgevoeligheid die kenmerkend is voor PDS.
Het laag-FODMAP-dieet vergt veel inspanning van de patiënt en mag alleen gevolgd worden onder begeleiding van een diëtist vanwege het risico op deficiënties bij verkeerde toepassing. In samenspraak met de diëtist vermijdt de patiënt 2-6 weken lang alle producten uit het normale dieet die veel FODMAP’s bevatten en vervangt die door producten die weinig FODMAP’s bevatten. De keuze aan voedingsmiddelen is dus beperkt. Wanneer de PDS-klachten tijdens de eliminatieperiode verminderen, worden de geëlimineerde voedingsmiddelen onder begeleiding van de diëtist stuk voor stuk opnieuw geïntroduceerd en wordt gemonitord hoe de patiënt erop reageert. Vooralsnog zijn er geen onderzoeken verricht naar deze herintroductiefase en naar de klachten die PDS-patiënten daarna ervaren.
Gezien de intensieve aard van het dieet kan, in overleg met de diëtist, eerst worden gepoogd een aantal FODMAP-rijke producten te beperken alvorens over te gaan tot een volledig laag-FODMAP-dieet. Voor deze specifieke benadering is echter geen wetenschappelijk bewijs voorhanden.
NICE dieet
Er is geen relevante literatuur gevonden waarin het NICE-IBS-dieet wordt vergeleken met het gebruikelijke voedingspatroon bij patiënten met PDS. Er kan daarom geen conclusie worden getrokken over de uitkomstmaten bij dit dieet. Patiënten met PDS hebben vaak een ongezond eetpatroon: vezelarm en vetrijk, zeer eenzijdig of zeer onregelmatig. Uit de praktijk blijkt dat patiënten doorgaans al een stuk minder klachten ervaren door normalisering van hun voeding. Het NICE-IBS-dieet sluit in grote lijnen aan bij de Richtlijnen goede voeding 2015 van de Gezondheidsraad, met een extra beperking van voedingsmiddelen die PDS-klachten kunnen uitlokken, zoals gasvormers, cafeïne, alcohol en frisdranken. Het NICE-IBS-dieet bevat relatief weinig FODMAP’s en is minder restrictief dan bijvoorbeeld het FODMAP-dieet, maar toch kan ook dit dieet voor de patiënt lastig op te volgen zijn, niet alleen omdat veranderen van (voedings)gedrag moeilijk is, maar ook omdat het individueel bepaald is welke voedingsmiddelen de PDS-klachten triggeren, in welke hoeveelheden en op welk moment.
Omdat de klachten zo uiteenlopen blijft voedingsadvies maatwerk. Wanneer de patiënt hiervoor openstaat, kan de diëtist ondersteunend en motiverend zijn bij de verandering van voedingsgedrag en helpen om voedingstriggers te elimineren en te onderzoeken. Daarnaast zal de diëtist een adequate voedingsinname waarborgen.
Psylliumvezels
De geïdentificeerde systematische review beschreef enkel de uitkomstmaat ‘algemene verbetering’. De bewijskracht voor deze uitkomstmaat was redelijk: het gebruik van psylliumvezels heeft een positief effect op de algemene verbetering, maar informatie over de dosis ontbreekt. De follow-upduur van de geïncludeerde onderzoeken is kort en dus is het lastig om uitspraken te doen over de voordelen van psylliumvezels op de lange termijn. Psylliumvezels zijn beperkt fermenteerbaar door colonbacteriën en geven daardoor weinig gasvormingsklachten. Bij obstipatie is voldoende vochtinname essentieel om coprostase te voorkomen. Bij diarree daarentegen moeten psylliumvezels met zo min mogelijk vocht ingenomen worden. Op basis van klinische ervaring lijken de bijwerkingen gering.
Algemene aandachtspunten bij diëten
Patiënten mijden vaak bepaalde voedingsmiddelen op eigen initiatief door een geconditioneerde, maar vaak maladaptieve respons als gevolg van door voeding uitgelokte darmklachten. Als de voeding te eenzijdig wordt, kan dit ook negatieve gevolgen hebben op de gezondheid en het microbioom [Leerning 2019]. Er kan dan een neerwaartse spiraal ontstaan. Het is belangrijk om de patiënt hierop te wijzen omdat dit op termijn kan leiden tot een eetstoornis zoals Avoidant Restrictive Food Intake Disorder (ARFID).
Het gevaar van eliminatiediëten zoals het glutenvrij of het laag-FODMAP-dieet is de kans op voedingsdeficiënties, zowel in kwantitatieve als kwalitatieve zin, en op een te restrictief eetpatroon. Derhalve is het noodzakelijk om een dergelijke dieetinterventie onder begeleiding van een ter zake kundige diëtist uit te voeren.
Terughoudendheid met betrekking tot eliminatiediëten is belangrijk bij patiënten met kenmerken die wijzen op een eetstoornis (onder andere ARFID) of wanneer er aanwijzingen voor een onderliggende angst- of paniekstoornis zijn. Verwijs de patiënt in dat geval naar een psycholoog.
Kwaliteit van bewijs
- Glutenvrij dieet: kwaliteit van bewijs zeer laag.
- Laag-FODMAP-dieet: bewijskracht voor de korte termijn laag tot zeer laag, mede door kleine aantallen, gebrek aan blindering en heterogeniteit in de onderzoeken. Voor de lange termijn zijn er nog niet voldoende onderzoeken.
- NICE-dieet: geen onderzoeken geïncludeerd.
- Psylliumvezels: bewijskracht laag.
De gekozen uitkomstmaten zijn subjectief en kunnen op veel verschillende manieren gemeten worden. Bij de uitkomstmaat ‘verlichting van klachten’ worden verschillende klachten gemeten die per onderzoek kunnen verschillen.
Het blinderen van patiënten was in veel onderzoeken niet mogelijk. Ook al gaven de onderzoekers aan dat de patiënten geblindeerd werden, dan nog konden de deelnemers eenvoudig achterhalen of zij in de interventiegroep of controlegroep waren geplaatst.
Bovenstaande punten maken het poolen van resultaten complex of niet mogelijk.
Waarden en voorkeuren van de patiënt
Van de PDS-patiënten rapporteert 80% dat de klachten een relatie hebben met hun voedingsinname (Böh, 2013). Afhankelijk van motivatie, voorkeuren en bereidheid om het voedingsgedrag aan te passen, kan een gepaste dieetinterventie worden aangeboden. Het volgen van een dieet kan voor een deel van de PDS-patiënten tijdelijk zwaar zijn, maar veel patiënten hebben dat er wel voor over. Immers, het merendeel ervaart dat de voeding invloed heeft op de klachten. De meeste patiënten begrijpen ook het principe van eliminatie en provocatie om persoonlijke triggers op te sporen. De dieetbehandeling vergt wel enige inspanning van de patiënt zelf; de zorgverlener heeft hierbij een adviserende en ondersteunende rol. Het is belangrijk om ook de verwachtingen te bespreken; aanpassingen van het dieet zullen over het algemeen niet leiden tot klachtenvrij kunnen eten, aangezien PDS-klachten multifactorieel bepaald worden.
Kosten
- Glutenvrije producten zijn over het algemeen duurder dan reguliere producten.
- De kosten van een laag-FODMAP-dieet verschillen niet erg van een eetpatroon volgens de Richtlijnen goede voeding.
- De kosten van het NICE-IBS-dieet verschillen weinig van een eetpatroon volgens de Richtlijnen goede voeding.
- De kosten van psylliumvezels variëren per merk en worden niet vergoed.
- Het tarief van een diëtist is ongeveer € 60-70 per uur. In 2022 vergoedt de basisverzekering de eerste 3 behandeluren bij een diëtist; dit gaat af van het eigen risico. De behandeling kan worden verdeeld over meerdere zorgjaren. Een aanvullende verzekering vergoedt vaak meer uren. De beperkte vergoeding van diëtetiek vanuit het basispakket kan een belemmerende factor zijn voor patiënten, zeker als het eigen risico nog niet aangesproken is.
Aanvaardbaarheid
Glutenvrij dieet
Het is maatschappelijk aanvaardbaar om zelf minder gluten te gebruiken als er een verband met buikklachten wordt ervaren, maar gezien het beperkte bewijs en de gezondheidsrisico’s op de lange termijn is er medisch gezien geen reden om dit dieet te adviseren. Patiënten die de onzekerheid over de effectiviteit geen probleem vinden en die voldoende gemotiveerd zijn, staat het vrij dit dieet toch te volgen. Daarbij moet wel gewezen worden op de financiële en sociale impact. Restaurants, horeca, winkels, bakkers en feestjes bij familie en bekenden zijn vaak niet ingericht op een glutenvrij dieet.
Laag FODMAP dieet
Het wordt algemeen aanvaard dat mensen hun dieet aanpassen om minder klachten te hebben. De sociale en financiële impact van het laag-FODMAP-dieet is minder groot dan van het glutenvrije dieet, maar toch aanzienlijk. Herintroductie van FODMAPs is essentieel in verband met het voorkomen van deficiënte voeding/ gezondheidsrisico’s op de lange termijn.
NICE-dieet
Het wordt algemeen aanvaard dat mensen hun dieet aanpassen om minder klachten te hebben. Het NICE-IBS-dieet overlapt met de Richtlijnen goede voeding 2015 en zal waarschijnlijk geaccepteerd worden door de patiënt.
Psylliumvezels
Het wordt over het algemeen aanvaard dat mensen iets innemen (anders dan medicatie) om minder klachten te hebben.
Haalbaarheid en implementatie
Glutenvrij dieet
Een glutenvrij dieet vergt gezien de restrictieve aard substantiële inspanningen van de patiënt. Het is belangrijk zich bewust te zijn van het risico op deficiënties bij het weglaten van gluten uit het dieet. Glutenvrije producten bevatten vaak meer vetten en suikers, en weinig vezels, ijzer, zink, magnesium en vitamine B. Bij de overgang naar een glutenvrij dieet is voedingseducatie en begeleiding van een diëtist met kennis van glutenvrije voeding raadzaam.
Laag FODMAP-dieet
Een laag-FODMAP-dieet vergt gezien de restrictieve aard substantiële inspanningen van de patiënt. Het is een tijdelijk dieet dat bedoeld is om uit te zoeken welke groepen voedingsmiddelen klachten geven, en is niet geschikt voor de lange termijn. Het volgen van een laag-FODMAP-dieet mag alleen gebeuren onder begeleiding van een diëtist met kennis van dit dieet. De beschikbaarheid van diëtisten met specifieke kennis over het laag-FODMAP-dieet kan een belemmering zijn.
NICE dieet
Het NICE-IBS-dieet is deels vergelijkbaar met de Richtlijnen goede voeding 2015. Het maakt deel uit van een breder concept van gezonde leefstijl en hangt samen met algemene gezondheidsvaardigheden. Mensen met lage gezondheidsvaardigheden zullen doorgaans meer moeite hebben met de therapietrouw.
Psylliumvezels
Psylliumvezels zijn afkomstig van de zaden en zaadhuiden van de plant Plantago ovata. Het feit dat dit geen farmacologisch (chemisch) supplement is, kan mensen aanspreken. Psylliumvezels zijn vrij verkrijgbaar bij drogist, supermarkt en online. Bepaalde psylliumvezelpreparaten bevatten echter toevoegingen (bijvoorbeeld sorbitol, een FODMAP) die juist bij PDS-patiënten voor een toename van klachten zorgen.
Dieetbehandeling
De meeste huisartsenpraktijken hebben al een korte lijn met een diëtistenpraktijk. De diëtist werkzaam in het gezondheidscentrum, de huisartsenpraktijk of de afdeling diëtetiek van het regionale ziekenhuis beschikt over een regionale sociale kaart van diëtisten en hun specialismen, zoals de subspecialisatie ‘PDS/laag-FODMAP’.
Terughoudendheid met betrekking tot een eliminatiedieet is belangrijk bij patiënten met kenmerken die wijzen op een eetstoornis (zoals ARFID) of wanneer er aanwijzingen zijn voor een onderliggende angst- of paniekstoornis. Verwijs de patiënt in dat geval naar een psycholoog of andere ter zake kundige zorgprofessional.
Rationale van de aanbeveling: Waarom deze aanbeveling?
Patiënten met PDS hebben vaak een ongezond eetpatroon en een ongezonde leefstijl. Deze patiënten hebben allereerst baat bij normalisering van hun voeding. De Richtlijnen goede voeding 2015 van de Gezondheidsraad zijn gericht op de algemene bevolking. Bepaalde voedingsmiddelen uit deze richtlijnen kunnen (tijdelijk) PDS-klachten triggeren, daarom is het raadzaam deze triggers te onderzoeken en zo nodig (tijdelijk) te verminderen of te elimineren. Uit onderzoek blijkt dat mensen die ernstige PDS-symptomen ervaren, vaker en heviger reageren op voedingstriggers (Rijnaarts, 2021). Angst-gerelateerd aan gastro-intestinale klachten kan de reactie op voedingstriggers versterken.
Het NICE-IBS-dieet geeft richting aan het opsporen van voedingstriggers die PDS-klachten kunnen verergeren. Omdat voedingstriggers individueel bepaald worden, is het meestal niet nodig alle voedingstriggers te elimineren en is verminderen of elimineren van alleen de persoonlijke triggers veelal genoeg.
Het onderzoeken van voedingstriggers (moet) bij voorkeur plaatsvinden onder professionele begeleiding van een diëtist en moet gericht zijn op zo min mogelijk (tijdelijke) eliminaties. Indien de PDS-klachten het toelaten, is het advies om de Richtlijnen goede voeding 2015 te volgen en alleen de nodige triggers te beperken of te elimineren.
Bij het bestaan van meerdere voedingsgerelateerde triggers en/of een onevenwichtig voedingspatroon kan een diëtist voedingsadvies geven (zie factsheet Voedingsadvies bij PDS is maatwerk). Geef als verwijsreden bij voorkeur ‘Dieetbehandeling bij PDS’, dan kan de diëtist aan de hand van het diëtistisch onderzoek maatwerkgericht een dieetbehandelplan opstellen.
Het gebruik van psylliumvezels zou PDS-klachten kunnen verlichten en heeft maar beperkte bijwerkingen. Dit maakt dat psylliumvezels als dieetbehandeling kunnen worden ingezet naast de Richtlijnen goede voeding 2015, vooral als de patiënt te weinig voedingsvezels (groente, fruit, volkoren granen) eet. Verschillende psylliumproducten bevatten hulpstoffen zoals sorbitol of aspartaam, en smaakstoffen voor een verbeterde smaakervaring. Deze hulpstoffen kunnen PDS-klachten juist doen verergeren; adviseer daarom psylliumproducten zonder deze hulpstoffen.
Een gepersonaliseerd laag-FODMAP-dieet wordt aanbevolen als mogelijke volgende stap in een dieetbehandeling omdat dit dieet effect kan hebben op de algemene verbetering. Het is bedoeld om uit te zoeken welke groepen voedingsmiddelen klachten geven en niet geschikt voor de lange termijn. Geadviseerd wordt bij dit dieet maatwerk toe te passen en het alleen te volgen onder begeleiding van een diëtist met kennis van dit dieet. Aangezien het klassieke laag-FODMAP-dieet veel vraagt van de patiënt en bij gebrek aan kwalitatief hoogstaand wetenschappelijk onderzoek grotendeels gebaseerd is op klinische ervaring en expertise, valt te overwegen om dit dieet in overleg met de patiënt bottom-up aan te pakken in plaats van top-down (zie figuur 1). Bij de stapsgewijze bottom-up-aanpak wordt op basis van het diëtistisch onderzoek eerst een selectie van FODMAP’s geëlimineerd en de symptoomrespons hierop afgewacht, alvorens het dieet in samenspraak met de patiënt verder te intensiveren (Singh, 2022). Bij de ‘klassieke’ top-down-aanpak worden gedurende 2-6 weken (bij voorkeur zo kort mogelijk) zoveel mogelijk FODMAP’s geëlimineerd, waarna de verschillende FODMAP’s weer langzaam stuk voor stuk worden geïntroduceerd en gemonitord.
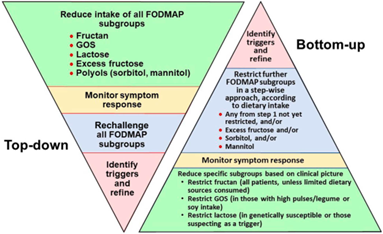
Figuur 1: Top-down” of “bottom-up” aanpak van het laag FODMAP dieet (bron: Singh, 2022).
Er is onvoldoende wetenschappelijk bewijs voor de effectiviteit van een glutenvrij dieet bij PDS. Derhalve dient dit niet te worden geadviseerd aan patiënten. Als er een sterk vermoeden is dat de patiënt toch op gluten reageert, is het verstandig coeliakie uit te sluiten (zie Anamnese).
Onderbouwing
Achtergrond
Dieetaanpassing is een belangrijke initiële behandelstap bij patiënten met PDS. Er zijn verschillende soorten dieetinterventies en er is veel publieke en wetenschappelijke interesse voor de verschillende diëten. Deze toegenomen aandacht heeft ervoor gezorgd dat meer mensen zich zijn gaan verdiepen in voeding en darmklachten. Het gevaar daarbij is dat er vaak (digitale) bronnen geraadpleegd worden die niet noodzakelijkerwijs de meest accurate informatie weergeven. Veel patiënten volgen een bepaald dieet, vaak op eigen initiatief, zonder adequate (medische of diëtistische) begeleiding. Dit kan leiden tot nadelige gezondheidsuitkomsten, zoals deficiënties of ongewenste gewichtsverandering.
In deze module worden 4 dieetinterventies vergeleken met de Richtlijnen goede voeding 2015 van de Gezondheidsraad. Deze 4 dieetinterventies zijn uitgekozen omdat ze op dit moment populair zijn bij PDS-patiënten en er vragen zijn over de effectiviteit.
Glutenvrij dieet
Gluten is een mengsel van eiwitten dat van nature voorkomt in bepaalde granen, zoals tarwe (waaronder spelt), rogge en gerst. Bij een glutenvrij dieet worden producten die gluten bevatten vermeden. Een gedeelte van de PDS-patiënten geeft aan te denken dat ze overgevoelig of intolerant zijn voor gluten, zonder dat ze coeliakie hebben.
Laag FODMAP-dieet
FODMAP is de verzamelnaam voor een aantal koolhydraten die slecht of niet opgenomen worden in de dunne darm: fermenteerbare oligosacchariden, disacchariden, monosacchariden en polyolen. FODMAP’s trekken door hun osmotische werking vocht aan in het darmlumen en dit kan zorgen voor dunne ontlasting. De fermentatie van deze koolhydraten in het colon leidt bovendien tot overmatige gasvorming.
Het laag-FODMAP-dieet is een eliminatiedieet dat berust op het tijdelijk (bij voorkeur zo kort mogelijk) vermijden van de FODMAP-koolhydraten. Na 2-6 weken worden de verschillende groepen koolhydraten weer langzaam een voor een getest. Na meerdere keren testen weet de patiënt welke groepen FODMAP’s klachten geven. Daarna kan de patiënt weer ‘normaal’ eten, zij het met minder of geen van de koolhydraten die tot de FODMAP’s behoren die klachten geven.
NICE-PDS
Het NICE-IBS-dieet maakt deel uit van het voedings- en leefstijladvies in de Britse NICE-Guideline Irritable bowel syndrome. Het dieet beschrijft onder andere regelmatig en rustig eten, met aandacht voor voldoende inname van (oplosbare) voedingsvezels en vocht bij beperkte inname van voedingsmiddelen die klachten geven zoals gasvormers, cafeïne, alcohol en frisdranken.
Psyllium
Psylliumvezels zijn oplosbare viskeuze vezels die maar beperkt fermenteerbaar zijn en die veel water kunnen opnemen. Psylliumvezels kunnen zowel bij obstipatie als bij diarreeklachten worden gebruikt om de ontlasting te verbeteren.
Bij obstipatie is het van belang om de psylliumvezels met ruim voldoende vocht in te nemen. De ontlasting wordt dan zachter en zwelt wat op, wat de stoelgang stimuleert. Bij te weinig vochtinname kan hinderlijke coprostase ontstaan.
Bij diarree moeten de psylliumvezels met zo min mogelijk vocht ingenomen worden. Dan kunnen ze in de darm het teveel aan vocht binden en zo de ontlasting juist vaster maken.
Doordat psylliumvezels beperkt fermenteerbaar zijn in het colon geven ze minder gasvormingsklachten dan andere typen vezels (So 2021).
Samenvatting literatuur
Since four different dietary interventions were included in the clinical question, we divided this summary into four parts, each part describing one of the dietary interventions.
1. Gluten free diet
Description of studies
Dionne (2018) conducted a systematic review and meta-analysis of randomized controlled trials examining the efficacy of exclusion diets (low FODMAP and gluten-free
diets) in IBS. A search of the literature was conducted in MEDLINE, EMBASE, Cochrane Central Register of Controlled Trials and Cochrane Database of Systematic Reviews until November 2017. RCTs that evaluated an FODMAP exclusion diet versus an alternative or usual diet and assessed improvement in either global IBS symptoms or abdominal pain were included. Data were synthesized as relative risk of symptoms remaining using a random effects model. A total of nine studies were eligible for inclusion. There were two RCTs describing a gluten free diet (111 participants) and seven RCTs comparing a low FODMAP diet with various control interventions (397 participants). Below the two RCT included in this review on a gluten free diet (Biesiekierski and Shahbazkhani) are described in detail.
- Biesiekierski (2011) performed a double-blind, randomized, placebo-controlled trial undertaken in patients with IBS who were symptomatically controlled on a gluten-free diet. After a two-week run-in period, participants continued the gluten free diet. After the two-week run-in period, all participants continued the gluten free diet and received in addition two bread slices and one muffin per day for six weeks. In the gluten group the bread and muffin contained gluten (total intake of 16 g / day). In the for the placebo group the bread and muffin were gluten free. with a gluten-free diet for up to six weeks. A total of 34 patients (aged 29 – 59 years, 12% men) completed the study. Nineteen patients were included in the gluten group and fifteen in the gluten free group. The primary outcome was the proportion of patients answering “ no ” on more than half of the symptom assessments to the question. “ Over the last week were your symptoms adequately controlled? ” was asked at the end of each study week or at withdrawal if premature. Secondary outcomes were change in overall and individual gastrointestinal symptoms as assessed by the visual analog scale.
- Shahbazkhani (2015) studied the effect of a gluten-free diet on gastrointestinal symptoms in patients with IBS. In a double-blind RCT, 148 IBS patients fulfilling the Rome III criteria were enrolled. The gluten free diet was started in 102 IBS patients; 22 patients found it hard and difficult to continue with the gluten-free diet and subsequently were withdrawn from study. Eighty patients responded to the diet and achieved significant improvement. From this group 8/80 did not follow a strict gluten free diet and were unwilling to continue the diet any further, and the remaining 72 patients commenced on a gluten-free diet for up to six weeks and completed the study. From this group, 35 out of 72 were randomized in the gluten group and 37 out of 72 were in the placebo group for six weeks. The mean age in the gluten group was 44.5 ± 10 years and 43.2 ± 17 years in the placebo group. Six patients (17.1%) in the gluten group and 13 in the placebo group (35.1%) were male. In the second stage after six weeks, patients whose symptoms improved to an acceptable level were randomly divided into two groups; patients either received packages containing powdered gluten (35 cases) or patients received placebo (gluten free powder) (37 cases). Both groups still continued their gluten free diet. Outcomes were assessed using a symptom questionnaire containing the question for the primary outcomes including bloating, abdominal pain, defecation satisfaction, nausea, fatigue and overall symptoms, and scored with visual analogue scale (VAS), with 0 representing no symptoms and 10 indicating severe clinical signs and symptoms.
Zanwar (2016) aimed to evaluate the effects of gluten on IBS symptoms. A double-blind randomized placebo-controlled rechallenge trial was performed in a tertiary care hospital with IBS patients who fulfilled the Rome III criteria. The participants were administered a gluten-free diet for 4 weeks and were asked to complete a symptom-based questionnaire to assess their overall symptoms, abdominal pain, bloating, wind, and tiredness on the visual analog scale (0−100) at the baseline and every week thereafter. The participants who showed improvement were randomly assigned to one of two groups to receive either a placebo (gluten-free breads) or gluten (whole cereal breads) as a rechallenge for the next 4 weeks. Sixty-five patients underwent randomization; 34 received gluten and 31 received placebo. Sixty patient completed the study.
Table 2: Description of study characteristics
|
Included in SR |
RCT |
Participants |
Study duration |
Total intervention / controls |
Intervention vs control |
Outcome measures |
|
Dionne (2018) |
Biesiekierski (2011) |
Rome III IBS patients intolerant of gluten but celiac excluded |
4 weeks |
19/20 |
Diet spiked with 16g gluten vs placebo |
Patients answering “no” to the question “Over the last week were your symptoms adequately controlled?” |
|
Dionne (2018) |
Shahbazkhani (2015) |
Rome III IBS patients intolerant of gluten but celiac excluded. |
6 weeks |
37/35 |
Packages containing powdered gluten vs gluten-free powder in addition to a gluten free diet |
“Symptom control” unclear what these symptoms were but it is implied that this includes stool satisfaction, pain, and bloating. |
|
|
Zanwar (2016) |
ROME III IBS criteria, tertiary care |
4 weeks |
34/31 |
Gluten containing bread vs gluten free bread in addition to a gluten free diet |
Abdominal pain, relief of symptoms |
Results
Summary of Findings Table 3.
|
Outcome
|
Study results and measurements |
Absolute effect estimates |
Certainty of the Evidence (Quality of evidence) |
Plain text summary |
|
|
Advice healthy nutrition |
Gluten free diet |
||||
|
Abdominal pain
|
Based on data from 166 patients in 3 studies Follow up 4-6 weeks |
Two studies reported that the severity score for pain was significantly higher for those consuming the gluten diet compared to the gluten free diet. One study reported no statistically significant difference. |
Very Low Severe risk of bias, severe indirectness, severe imprecision1 |
We are uncertain about the effect of a gluten free diet on abdominal pain in IBS patients. |
|
|
Global improvement
|
Hazard Ratio: 0.42 (CI 95% 0.11 - 1.55) Based on data from 111 patients in 2 studies Follow up 6 weeks |
727 per 1000 |
286 per 1000 |
Very Low Severe risk of bias, severe imprecision, severe indirectness2 |
We are uncertain about the effect of a gluten free diet on global improvement in IBS patient |
|
|
|||||
|
Quality of life |
x |
x |
No Grade |
x |
|
|
Relief of symptoms
|
Based on data from 166 patients in 3 studies Follow up 4-6 weeks |
1: Over the entire study period, the severity scores of pain, satisfaction with stool consistency, and tiredness were significantly higher for those consuming the gluten diet. No adequate control of symptoms gluten n = 13/19 (68%), gluten free: n = 6/15 (40 %) 2. Patients in the gluten-containing group exhibited worsening of symptoms, with significantly higher weekly median overall symptom VAS, compared to those in the gluten free group (P <0.05). 3. Gluten: symptoms were controlled in nine patients (25.7%), gluten free: symptoms were controlled in 31 patients (83.8%) |
Very Low Severe risk of bias, severe imprecision, severe indirectness3 |
We are uncertain about the effect of a gluten free diet on reducing gastrointestinal symptoms in IBS patients. |
|
1. Risk of bias: Serious. Incomplete data and / or a lot of drop-out of participants (loss to follow up); Indirectness: Serious. Only patients who showed improvement on a gluten-free diet were enrolled in some of the studies; Imprecision: Serious. Low number of patients (<100) / Average number of patients (100-300);
2. Risk of bias: Serious. Incomplete data and / or a lot of drop-out of participants (loss to follow up); Indirectness: Serious. Only patients who showed improvement on a gluten-free diet were enrolled in the studies; Imprecision: Serious. Low number of patients (<100) / Average number of patients (100-300);
3. Risk of bias: Serious. Incomplete data and / or a lot of drop-out of participants (loss to follow up); Indirectness: Serious. Only patients who showed improvement on a gluten-free diet were enrolled in the studies; Imprecision: Serious. Low number of patients (<100) / Average number of patients (100-300);
Abdominal pain
Biesiekierski (2011) found that, over the entire study period, the severity score for pain was statistically significantly higher for those consuming the gluten diet compared to the gluten free diet. Absolute numbers were not reported in the paper but estimated from the included graph. After 6 weeks, the score for pain was 38 in the gluten group and 18 in the gluten free group (approximation).
Shahbazkhani (2015) found that in the gluten-containing group, abdominal pain increased (from mean 3.1 ± 2.3 to 5.1 ± 2.2 measured on a VAS) one week after starting the gluten diet. No absolute number were reported for any of the other weeks. A graph was included in the result section of the paper but it was not possible to read the absolute values from it. However, after six weeks, no statistically significant difference between the two groups was observed.
Zanwar (2016) found that after four weeks of gluten free diet, the median value for abdominal pain (measured on a VAS scale) was 15. After four weeks rechallenge, patients in the gluten group reported a median VAS of 30, while patients in the gluten free group reported a mean VAS of 10. Patients in the gluten group showed statistically significantly higher changes in the abdominal pain VAS scores from the fourth week of GFD to each of the 4 rechallenge weeks, compared to the patients in the placebo group (P<0.05).
Global improvement
Dionne (2018) performed a meta-analysis with primary outcome global improvement in IBS symptoms. If global improvement was not reported, abdominal pain was used as the outcome of interest. If different definitions of symptom improvement were provided in the same study, the most stringent outcome reported was used that minimized placebo response rate (e.g., an improvement in IBS symptoms of >50% would be chosen ahead of an improvement in symptoms of >25%).
A greater proportion of participants had an exacerbation of their IBS symptoms among
those allocated to have their diet spiked with gluten, compared with those remaining on a gluten free diet. The pooled RR was 0.42; 95% CI 0.11 to 1.55; I2 = 88%.
Quality of life
None of the included studies reported the outcome measure quality of life.
Relief of symptoms (likertscale; number of days without symptoms)
Biesiekierski (2011) found that significantly more patients in the gluten group (68 %; n = 13 / 19) reported no adequate control of symptoms on more than half of the symptom assessments compared to those using no gluten (40 % ; n = 6 / 15) ( P = 0.001; generalized estimating equation). Changes in symptoms from baseline to end of week 1 as scored on the visual analog scale after 1 week ’s therapy were significantly greater in those patients who consumed the gluten diet for overall symptoms, pain, bloating, satisfaction with stool consistency, and tiredness, but not for wind or nausea. Over the entire study period, the severity scores of pain, satisfaction with stool consistency, and tiredness were significantly higher for those consuming the gluten diet. Absolute numbers were not reported in the paper but were read from the graph included in the study. After 6 weeks, the VAS score for overall symptoms was 38 in the gluten group compared to 24 in the gluten free group.
Shahbazkhani (2015) found after six weeks of the diet, that symptoms were controlled in nine patients (25.7%) in the gluten-containing group, compared to 31 patients (83.8%) in the gluten free group, indicating that 26 out of 35 patients in the gluten group became symptomatic on a gluten containing diet (p < 0.001). In the gluten-containing group, all symptoms significantly increased one week after starting the gluten. Mean bloating VAS before starting the gluten-free diet in the gluten group was 8.4 ± 1.5, and after the six-week diet was decreased to 3.1 ± 2.3. Overall time trend analysis revealed statistically significant satisfaction with stool consistency (p = 0.01) and bloating (p = 0.05) (but no statistically significant difference between the two groups). After a one-week gluten challenge, the mean score was increased to 4 ± 2.1, which was not statistically significant compared with the gluten free group. But this symptom continued to increase to 5.1 ± 2.2 in the fifth week.
Zanwar (2016) found that out of the initial group of 180 patients on a gluten free diet, overall symptom VAS improved for 65 patients after a gluten free diet. These 65 were subsequently randomized to a gluten free diet or gluten containing diet. After four weeks of food rechallenge, patients in the gluten-containing group exhibited worsening of symptoms, with significantly higher weekly median overall symptom VAS, compared to those in the gluten free group (P <0.05). The mean VAS in the gluten group was 25 and in the gluten free group 10 for overall symptoms. During the entire rechallenge period, the median VAS scores for abdominal pain, bloating, and tiredness were significantly higher in the gluten group compared to the placebo. Patients in the gluten group showed significantly higher changes in the abdominal pain, bloating, and tiredness VAS scores from the fourth week of GFD to each of the four rechallenge weeks, compared to the patients in the placebo group (P <0.05). However, VAS score for wind was not significantly different in both groups following the rechallenge (P >0.05). Within the gluten group, the VAS scores for abdominal pain, bloating, wind, tiredness, and overall symptoms, differed significantly over the entire study period. The placebo group also showed similar changes in the VAS symptom scores over the study period; however, only the changes in abdominal pain and wind VAS scores after rechallenge remained significantly different following post hoc analysis (P <0.05).
Conclusions gluten free diet
- We are uncertain about the effect of a gluten free diet on abdominal pain in IBS patients.
- We are uncertain about the effect of a gluten free diet on global improvement in IBS patient
- The outcome measure ‘Quality of live’ was not reported in the included studies
- We are uncertain about the effect of a gluten free diet on reducing gastrointestinal symptoms in IBS patients.
2. Low FODMAP diet
Description of studies
One systematic review and five RCTs were identified. To enhance readability the studies are described briefly and the information per study is displayed in table 3.
The systematic review of Dionne (2018) is described on page 41. Table 2.1.4 describes the individual study characteristics. Seven RCTs were included that compared a low FODMAP diet with various control interventions in 397 participants (Staudacher, 2012, Eswaran, 2016; McIntosh, 2017; Böhn, 2015; Halmos, 2014; Hustoft, 2017; Staudacher, 2017).
Zahedie (2017) compared a low FODMAP diet with a standard diet according to the British Dietetic Association’s guidelines in patients with IBS-D. Participants were randomly assigned to the low FODMAP diet (n=55) or general dietary advice group N=55). All participants met with the specialized dietitians to educate and receive dietary plan in a 45-min one-to one appointment. The low FODMAP diet was supplied less than 0.5 gr per meal fermentable oligosaccharides, monosaccharides, disaccharides, and polyols. The general dietary advice group received recommendations such as limitation of caffeine, alcohol, spicy food, fatty food, and carbonated drinks; to eat small frequency meals; to eat slowly and in peace; and avoidance of chewing gums and sweeteners containing polyols. Participants had to follow the diet for six weeks. One-hundred-and-one participants completed the study.
Eswaran (2016/2017) compared a low FODMAP diet with a modified diet recommended by the National Institute for Health and Care Excellence (mNICE) in patients with IBS-D. Eswaran conducted two studies using the same patient population. One study (Eswaran 2016, included in the review of Dionne) included the outcome measures adequate relief. The other study (Eswaran 2017) included the outcome measure quality of life. Participants were randomly assigned to the low FODMAP diet (n=50) or the mNICE diet (n=42). Specially trained research dieticians gave standardized instructions about the diet interventions. The mNICE group was instructed to eat small frequent meals, avoid trigger foods, and avoid excess alcohol and caffeine. Foods containing FODMAPs were not specifically excluded as part of the mNICE instructions provided to study participants. Participants had to follow the diet for four weeks. Eighty-four participants completed the study
Harvie (2017) compared a low FODMAP diet with no dietary advices in patients with IBS. Patients were randomly assigned to the low FODMAP diet (n=23) or to the control group (n=27). At three months, the comparator group crossed over to a low FODMAP diet and the initial low FODMAP group started re-challenging foods. Dietary advice was provided to individual participants in a standardized manner by an experienced registered dietitian. At the initial consultation all participants were advised to significantly reduce their intake of excess fructose, lactose, sorbitol, mannitol, Fructooligosaccharide (FOS) and Galactooligosaccharide (GOS). At follow-up (after 3 months) participants were taught to systematically try to reintroduce FODMAP molecules individually, one follow-up appointment was scheduled and then additional appointments were provided on demand. Fifty patients completed the study.
Patcharatrakul (2019) compared a structural individual low FODMAP diet with a commonly recommended diet in patients with IBS. Patients with moderate-to-severe IBS were randomized to a low FODMAP diet (n=33) or a brief advice on a commonly recommended diet (n=33). Patients randomized to the low FODMAP diet received a maximum of 30 minutes of advice. High-FODMAP items that might aggravate the patient’s symptoms were identified from an individual 7-day food diary. Then, the investigator discussed with the patients to avoid high-FODMAP items and modify recipe/menu with the commonly available low-FODMAP items. The control group received brief advice on a commonly recommended diet, which included reducing certain foods that have been traditionally recognized as triggers for gas, bloating, or abdominal pain, including fruits, vegetables, nuts, beans, and garlic, and avoidance of large meals. Patients followed the diet for four weeks. Sixty-four patients completed the study.
Pedersen (2014) compared a low FODMAP diet to a normal Danish/Western Diet in patients with IBS. Patients were randomized to a low FODMAP diet (n=42) or a normal Danish/Western diet (n=40). Each patient allocated to the low FODMAP diet was instructed
during a one hour session by nutritionists or dietitians. Patients allocated to the normal diet were requested to follow an unchanged normal (Danish/Western) diet during the 6-wk study. Seventy-one patients completed the study.
Table 4: Description of study characteristics – low FODMAP
Results
Table 5 shows the summary of findings for the various outcome measures. Below the table, more detailed information on the outcomes can be found. Forest plots can be found in the attachment 5.
Table 5 Summary of Findings table low FODMAP diet
|
Outcome
|
Study results and measurements |
Absolute effect estimates |
Certainty of the Evidence (Quality of evidence) |
Plain text summary |
|
|
Control |
Low FODMAP diet |
||||
|
Abdominal pain
|
Based on data from 308 patients in 4 studies Follow up 4 weeks - 3 months |
All studies show that a low FODMAP diet results in less abdominal pain. Since abdominal pain is measured in different ways using different instruments the results of individual studies are described in table 2.1.1 |
Very low Because of severe risk of bias, severe indirectness and severe imprecision1
|
The evidence is very uncertain about the effect of a low FODMAP diet on abdominal pain |
|
|
Global improvement (measured as symptoms remaining after diet)
|
Relative risk: 0.69 (CI 95% 0.54 - 0.88) Based on data from 397 patients in 7 studies
|
616 per 1000 |
432 per 1000 |
Low Because of severe risk of bias andsevere indirectness2 |
A low FODMAP diet may increase global improvement. |
|
Difference: 184 fewer per 1000
|
|||||
|
Global Improvement (IBS-SSS)
|
Measured by: IBS-SSS Scale: 0-500 High better Based on data from 217 patients in 3 studies Follow up 4 week - 3 months |
|
|
Low Because of severe risk of bias and severe indirectness2 |
A low FODMAP diet may increase global improvement. |
|
Difference: MD 83.64 lower (CI 95% 48.96 lower - 118.33 lower) |
|||||
|
Global improvement (0-100 VAS) 4 weeks |
Based on data from 66 patients in 1 studies Follow up 4 weeks |
The group on the low FODMAP diet started at 61.2±21 at baseline and improved to 38.5 ± 20 at 4 weeks. The control group started at 56.3± 17.8 at baseline and improved to 53.5 ±19.2 at 4 weeks. |
Low Because of severe risk of bias and severe indirectness2 |
A low FODMAP diet may increase global improvement. |
|
|
Quality of life
|
Measured by: IBS-QoL Scale: 0-100 High better Based on data from 310 patients in 4 studies Follow up 4 weeks - 3 months |
|
|
Very low Because of severe risk of bias, severe indirectness and severe imprecision3
|
The evidence is very uncertain about the effect of a low FODMAP diet on quality of life. |
|
Difference: MD 7.29 higher (CI 95% -1.12 higher - 15.71 higher) |
|||||
|
Relief of symptoms
|
Based on data from 176 patients in 2 studies Follow up 4-6 weeks |
The results are very wide spread, sometimes in favour of low FODMAP diet, sometimes in favour of the control diet. Since relief of symptoms is measured in different ways using different instruments the results of indivual studies are described in table X. |
Very Low Because of severe risk of bias, severe inconsistency, severe indirexctness and severe imprecision4
|
The evidence is very uncertain about the effect of a low FODMAP diet on relief of symptoms |
|
1. Risk of bias: Serious. Insufficient blinding / lack of blinding of the participants and researchers, which may cause bias; Indirectness: Serious. Wrong control group, follow-up duration insufficient; Imprecision: Serious. Low number of patients (<100) / Average number of patients (100-300);
2. Risk of bias: Serious. Insufficient blinding / lack of blinding of the participants and researchers, which may cause bias; ; Indirectness: Serious. Wrong control group, follow-up duration insufficient
3. Risk of bias: Serious. Insufficient blinding / lack of outcome assessors, possibly causing detection bias; ; Indirectness: Serious. Wrong control group, follow-up duration insufficient; Imprecision: Serious. Low number of patients (<100) / Average number of patients (100-300);
4. Risk of bias: Serious. Insufficient blinding / lack of outcome assessors, possibly causing detection bias; Inconsistency: Serious. Unexplained variability of the data; Indirectness: Serious. Wrong control group, follow-up duration insufficient; Imprecision: Serious. Low number of patients (<100) / Average number of patients (100-300)
Abdominal pain
Zahedi (2017), Harvie (2017), Pederson (2014) and Patcharatrakul (2019) reported the outcome measure abdominal pain. A meta-analysis was not possible because different measurement instruments were used to measure abdominal pain and not all studies reported the absolute values. A summary of the results is presented in table 2.1.6. All studies showed a reduction in abdominal pain for the low FODMAP group compared to the control group. This difference is in some cases a clinically relevant difference.
Table 6: Results of a low FODMAP diet on abdominal pain measures
|
Study |
Pain |
Measurement method |
Low FODMAP (Mean ± SD)
|
Control (Mean ± SD) |
Difference* between low FODMAP and control group |
|
Zehedi (2017) |
Pain intensity |
IBS-SSS subscale |
48.38 ± 29.57 at baseline to 16.13 ± 13.13
Mean difference*: -32.26 (95% CI -41.3 - -23.17) SE 4.576 |
Mean ± SD 47.38 ± 33.03 to 25.88 ± 21.11
Mean difference*: -21.5 (95%CI -32.4 - -10.7) SE 5.489 |
-10.76 (95% CI -24.8 – 3.2) P=0.1361
Favors low FODMAP diet |
|
|
Pain frequency |
IBS-SSS subscale |
37.38 ± 31.63 to 13.25 ± 14.21 P<0.001 Mean difference*: -24.13 (95% CI -33.9 - -14.4) SE 4.904 |
32 ± 28.75 to 16.75 ± 17.74 P<0.001 Mean difference*: -15.25 (95%CI -24.6 - -5.9) SE 4.731 |
-8.88 (95% CI -22.23 – 4.48) P=0.19
Favors low FODMAP diet |
|
Harvie (2017) |
Pain intensity |
IBS-SSS subscale
Absolute numbers were not reported |
No effect of the low FODMAP diet was seen on severity of pain. |
|
X |
|
|
Pain frequency |
IBS-SSS subscale (days of pain in ten days) |
Reduction in how often participants experienced pain: 3.4 ± 2.9 d in ten days
|
Reduction in how often participants experienced pain: 0.2 ± 1.9 d in ten days
|
Difference in reduction in how often participants experienced pain 3.2 days (95% CI 1.81 – 4.59) P=0.00
Favors low FODMAP diet
|
|
Patcharatrakul (2019) |
Pain |
0-10 VAS |
4.8 (range 0 - 6.9) at baseline to 1.7 (range 0 –4.1) Mean difference*: -0.7 |
from mean 4.4 (range 0.5–6.4) to mean 3.9 (range 0–5.2) Mean difference*: -0.5 |
-0.2
Favors low FODMAP diet |
|
|
Percentage responders |
the proportion of subjects who had at least a 30% decrease in the average daily worst abdominal pain or abdominal discomfort |
18 out of 30 patients responded to the diet (60%) |
9 out of 32 responded to the diet (28%) |
35% |
|
Pederson (2014) |
Pain intensity |
IBS-SSS subscale (0-100) VAS
Absolute numbers were not reported but read from a graph. This is an approximation |
From 64 to 30 Difference*: -34 |
From 68 to 56 Difference*: -12 |
-22
Favors low FODMAP diet
|
|
|
Pain severity |
IBS-SSS subscale (0-100) VAS
Absolute numbers were not reported but read from a graph. This is an approximation. |
From 58 to 36 Difference*: -22 |
From 48 to 46 Difference*: -2 |
-20
Favors low FODMAP diet
|
*: Not reported in the study but calculated by Kennisinstituut van de Federatie Medisch Specialisten
Global improvement
Global improvement was measured in different ways across the studies, which made it not possible to pool the results of all studies. We used the meta-analysis of Dionne as a measure for global improvement and performed a meta-analysis on the results of the RCTs that reported the IBS-SSS. We describe the results of Patcharatrakul separately since they could not be combined with any of the meta-analysis.
Dionne (2018) included 7 RCTs in the meta-analysis (figure 1 –Attachment 5). The primary outcome was global improvement in IBS symptoms. If global improvement was not reported, abdominal pain was used as the outcome of interest. If different definitions of symptom improvement were provided in the same study an improvement in IBS symptoms of >50% would be chosen ahead of an improvement in symptoms of >25%. This approach may lead to an underestimation of the effect of a low FODMAP diet. The relative risk of symptoms not improving in IBS compared with control was 0.69 (95%CI 0.54 – 0.88).
Three studies used the IBS-SSS as an outcome measure (Zehedi, Harvie, Pedersen). We performed a meta-analysis by extracting the mean difference in IBS-SSS score between the endpoint and baseline for the low FODMAP group and the control group for all studies. If this information was not available, we calculated it ourselves by using the data from the papers. Pooled mean difference was -83.6 (-118.3, -49.0) meaning that patients in the low FODMAP group scored 83.6 points lower on the IBS-SSS compared to the control group (Figure 2 – Attachment 5).
Patcharatrakul (2019) measured global IBS symptom severity using a VAS scale (0-100). The group on the low FODMAP diet started at 61.2±21 at baseline and improved to 38.5 ± 20 at 4 weeks. The control group started at 56.3± 17.8 at baseline and improved to 53.5 ±19.2 at 4 weeks.
Quality of life
Five studies assessed quality of life (QoL) by the OBS-QoL (0= worst quality of life, 100=best quality of life). (Eswaran, Harvie, Zahedi, Pederson, Staudacher 2017). The results of four of these studies could be pooled in a meta-analysis (figure 3 – Attachment 5). From each study, we extracted the mean difference in QoL score between the endpoint and baseline for the low FODMAP group and the control group. If this information was not available in the studies we calculated it ourselves by using the data from the papers. We calculated a pooled mean difference of 7.29 (-1.1, 15.7) meaning that patients in the low FODMAP group scored 7.3 points higher on the IBS-QoL compared to the control group.
Relief of symptoms
The systematic review of Dionne (2018) did not report on relief of symptoms. Patcharatrakul (2019) assessed abdominal discomfort, bloating, belching and stool urgency.
In the low FODMAP group, abdominal discomfort and bloating improved statistically significant after four weeks. In the control group, none of the symptoms improved statistically significant. When comparing the improvement in the low FODMAP group with the improvement in the control group there was no clinically relevant differences between both group and no statistically significant difference.
Table 7 Results of a low FODMAP diet on abdominal pain measures
|
Study |
Symptom |
Measurement method |
Low FODMAP baseline and after follow-up |
Control group at baseline and after follow-up |
Difference* |
|
Patcharatrakul (2019) |
Stool urgency |
0–10 cm VAS |
0 (0–8.1) to 0 (0–5.4) Difference*: 0 |
2.3 (0–6.6) to 0 (0–4.2) Difference*: -2.3 |
2.3
Favors control group |
|
Zahedi (2017) |
Stool consistency |
Bristol stool form scale |
5.92 ± 0.45 to 4.3 ± 0.5 Difference: -1.62 ± 0.51 |
5.67 ± 0.61 to 4.61 ± 0.69 Difference: -1.05 ± 0.79 |
-0.57 (95% CI -0.83 - -0.31)
Favors low FODMAP diet |
|
Zahedi (2017) |
Stool frequency |
number of stools per day |
3.29 ± 0.87 to -1.91 ± 0.56 Difference: - 1.37 ± 0.62 |
3.3 ± 0.77 to 2.6 ± 0.96 Difference: -0.7 ± 0.88 |
-0.67 (95% CI -0.97 - -0.37)
Favors low FODMAP diet |
|
Zahedi (2017) |
Abdominal distension |
IBS-SSS subscale |
60.50 ± 26.98 to 26.25 ± 18.35 Difference*: -34.25 (95% CI -43.4 - -25.1) SE 4.614 |
58.75 ± 27.09 to 36.88 ± 15.83 Difference*: -21.87 (95% CI -30.59 - -13.15) SE 4.394
|
-12.38 (95% CI -24,87 - - 0.11)
Favors low FODMAP diet |
|
Patcharatrakul (2019) |
Abdominal discomfort |
0–10 cm VAS |
5.5 (range 4.5–7.1) To 3.2 (range 1.7–5.5) Difference*: -2.3 |
5.6 (range 4.1–7.1) to 4.5 (range 2.6–6.6) Difference*: -1.1 |
-1.2
Favors low FODMAP diet |
|
Patcharatrakul (2019) |
Bloating |
0–10 cm VAS |
5.1 (2.5–7.5) to 3.1 (1.8–5.7) Difference*: -2 |
6.2 (2.1–7.8) to 4.0 (0–6.2) Difference*: -2.2 |
0.2
Favors control group |
|
Patcharatrakul (2019) |
Belching |
0–10 cm VAS |
1.4 (0–5.5) to 0.7 (0–4.7) Difference*: -0.7 |
2.7 (0–5.6) to 1.0 (0–5.4) Difference*: -1.7 |
1
Favors control group |
Conclusions
- The evidence is very uncertain about the effect of a low FODMAP diet on abdominal pain.
- A low FODMAP diet may increase global improvement.
- The evidence is very uncertain about the effect of a low FODMAP diet on quality of life.
- The evidence is very uncertain about the effect of a low FODMAP diet on relief of symptoms
3. NICE diet
There were no studies identified that met the PICO.
4. Psyllium fibre
Description of studies
One systematic review was identified on psyllium fibre.
Ford (2018) aimed to assess the efficacy of psyllium fibre compared to placebo on global improvement in IBS symptoms and quality of life in a systematic review. MEDLINE, EMBASE, EMBASE classic, PsychINFO and the Cochrane central register of controlled trials were searched until July 2017. Fifteen RCTs were identified on fibre, of which seven described ispaghula husk (psyllium) in 499 patients. A meta-analysis was performed on global improvement, defined as symptoms or abdominal pain persisting with intervention compared with control. This was expressed as a relative risk (RR) with 95 % confidence intervals (CIs).
Table 8: Description of study characteristics
|
Included in SR |
RCT |
Participants |
Study duration |
Total intervention / controls |
Intervention vs control |
Outcome measures |
|
Ford (2018) |
Ritchie (1979) |
Author-defined IBS, tertiary care |
3 months |
12/12 |
Ispaghula husk vs placebo |
Dichotomous assessment of IBS symptoms: “ improved ” or “ not improved ” |
|
Ford (2018) |
Longstreth (1981) |
Author-defined IBS, secondary care. |
8 weeks |
37/40 |
Ispaghula vs placebo |
Global assessment of IBS symptoms on Likert scale. Much or a little better from baseline symptoms |
|
Ford (2018) |
Arthurs (1983) |
Author-defined IBS, secondary care. |
4 weeks |
40/38 |
Ispaghula husk vs placebo |
Global assessment of IBS symptoms on Likert scale. Resolved or improved from baseline symptoms |
|
Ford (2018) |
Nigam (1984) |
Author-defined IBS, secondary care. |
3 months |
21/21 |
Ispaghula husk vs placebo |
Dichotomous assessment of IBS: “ improved ” or “ not improved ” |
|
Ford (2018) |
Prior (1987) |
Author-defined IBS, tertiary care |
12 weeks |
40/40 |
Ispaghula husk vs placebo |
Overall improvement in well-being discussed with patient, and rated as “ satisfactory ” or “ unsatisfactory ” |
|
Ford (2018) |
Jalihal (1990) |
Author-defined IBS, secondary care |
4 weeks |
11/9 |
Ispaghula husk vs placebo |
Dichotomous assessment of IBS: “ improved ” or “ no change ” |
|
Ford (2018) |
Bijkerk (2009) |
Author-defined or Rome II IBS., primary care |
12 weeks |
85/93 |
20g Ispaghula husk vs placebo |
Adequate relief of IBS related abdominal pain or discomfort in the last week, with responders defined as those with adequate relief for 2 out of the last 4 weeks |
Results
Table X shows the summary of findings for the various outcome measures. Below the table, more detailed information on the outcomes can be found. Forest plots can be found in the attachment 5.
Table 9. Summary of Findings table Psyllium fibre
|
Outcome Timeframe |
Study results and measurements |
Absolute effect estimates |
Certainty of the Evidence (Quality of evidence) |
Plain text summary |
|
|
Comparator |
Psyllium |
||||
|
Global improvement1
|
Relative risk: 0.83 (CI 95% 0.73 - 0.94) Based on data from 499 patients in 7 studies2 NNT 7 (4 – 25) Follow up 4 weeks - 3 months |
703 per 1000 |
583 per 1000 |
Low Because of severe risk of bias and severe imprecision3 |
The evidence suggests the use of psyllium fibre may result in an increase in global improvement |
|
Difference: 120 fewer per 1000 (CI 95% 190 fewer - 42 fewer) |
|||||
|
Abdominal pain
|
x |
x |
x |
The outcome abdominal pain was not reported in the included studies. |
The outcome abdominal pain was not reported in the included studies. |
|
|
|||||
|
Quality of life
|
x |
x |
x |
The outcome quality of life was not reported in the included studies. |
The outcome quality of life was not reported in the included studies. |
|
|
|||||
|
Relief of symptoms
|
x |
x |
x |
The outcome relief of symptoms was not reported in the included studies. |
The outcome relief of symptoms was not reported in the included studies. |
|
|
|||||
1.symptoms not improving
2.Risk of bias: Serious. Inadequate or unclear randomization; Imprecision: Serious. Wide confidence interval, not a minimal clinically important difference;
Abdominal pain
Not reported.
Global improvement
Ford (2018) conducted a meta-analysis for the outcome measure global improvement, including 7 RCTs and 499 patients. If this was not available then improvement in abdominal pain was taken as the primary outcome. When more than one definition was provided for improvement in the primary outcome, the most stringent definition with the lowest placebo response rate was taken. The pooled risk ratio of global symptoms not improving of Ispaghula (psyllium) versus placebo was 0.83 95%CI: 0.73, 0.94, meaning that Ispaghula (psyllium) is beneficial in treating IBS symptoms. The number needed to treat (NNT) was 7 (95% 4-25).
Quality of live
Not reported.
Relief of symptoms
Not reported.
Conclusions
- Use of psyllium fibre may result in an increase in global improvement
- The outcome abdominal pain was not reported in the included studies.
- The outcome quality of life was not reported in the included studies.
- The outcome relief of symptoms was not reported in the included studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the PICO:
|
Patients |
Patients with IBS (primary and secondary care; all subgroups of IBS) |
|
Intervention A Intervention B Intervention C Intervention D |
gluten free diet low FODMAP diet NICE-IBS diet psyllium fiber |
|
Control |
Dietary advice on healthy balanced diet/ Dutch guideline of a healthy diet |
|
Outcomes |
Abdominal pain (crucial) Global improvement)/ IBS-SSS (crucial) Quality of life (crucial) Relief of symptoms (crucial) |
|
Selection criteria |
Study design: systematic reviews and RCTs |
Relevant outcome measures
The guideline development group considered abdominal pain, global improvement / IBS-symptom severity score, quality of life, relief of symptoms (Likert scale; number of days without symptoms) as critical outcome measures for decision making.
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures, except the IBS-SSS. That means a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of (10-)20% of the total score on a questionnaire. A 10% (50 points) improvement on the IBS-SSS is considered a minimal clinically (patient) important difference (based on literature).
The working group defined the outcome measures as follows:
- Abdominal pain: abdominal pain can be measured on different scales, for example VAS-scale or the IBS-SSS subscale
- Global improvement / IBS symptom severity scale (IBS-SSS): global improvement or global relief is usually measured by asking patients if their symptoms were adequately controlled in the past 7 days. The IBS-SSS is in this literature summary used as a measure for global improvement.
- Quality of life: measured with a general questionnaire, such as the SF 36, or disease-specific (IBS-QOL)
- Relief of symptoms: there are many different symptoms of irritable bowel syndrome, for example bloating, nausea, stool consistency. All symptoms described in the included papers are used.
Search and select (Methods)
The databases [Medline (via OVID) and Embase (via Embase.com)] were searched with relevant search terms from 2000 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/ under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Results
Two systematic reviews (SR) and eight RCTs were included in the analysis of the literature, see Table 2.1.1 Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Table 1. Results of systematic literature search
|
Intervention |
Studies included |
|
Gluten free diet |
SR: Dionne (2018) RCTs: Biesiekierski (2011), Shahbazkhani (2015), Zanwar (2016) |
|
Low FODMAP diet |
SR: Dionne (2018), RCTs: Zahedie (2017), Eswaran (2017), Harvie (2017), Patcharatrakul (2019), Pedersen (2014) |
|
NICE-IBS diet |
X |
|
Psyllium fiber |
SR: Ford (2018) |
Referenties
- Biesiekierski JR, Newnham ED, Irving PM, Barrett JS, Haines M, Doecke JD, Shepherd SJ, Muir JG, Gibson PR. Gluten causes gastrointestinal symptoms in subjects without celiac disease: a double-blind randomized placebo-controlled trial. Am J Gastroenterol. 2011 Mar;106(3):508-14; quiz 515. doi: 10.1038/ajg.2010.487. Epub 2011 Jan 11. PMID: 21224837.
- Dionne J, Ford AC, Yuan Y, Chey WD, Lacy BE, Saito YA, Quigley EMM, Moayyedi P. A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol. 2018 Sep;113(9):1290-1300. doi: 10.1038/s41395-018-0195-4. Epub 2018 Jul 26. PMID: 30046155.
- Shahbazkhani B, Sadeghi A, Malekzadeh R, Khatavi F, Etemadi M, Kalantri E, Rostami-Nejad M, Rostami K. Non-Celiac Gluten Sensitivity Has Narrowed the Spectrum of Irritable Bowel Syndrome: A Double-Blind Randomized Placebo-Controlled Trial. Nutrients. 2015 Jun 5;7(6):4542-54. doi: 10.3390/nu7064542. PMID: 26056920; PMCID: PMC4488801.
- Zanwar VG, Pawar SV, Gambhire PA, Jain SS, Surude RG, Shah VB, Contractor QQ, Rathi PM. Symptomatic improvement with gluten restriction in irritable bowel syndrome: a prospective, randomized, double blinded placebo controlled trial. Intest Res. 2016 Oct;14(4):343-350. doi: 10.5217/ir.2016.14.4.343. Epub 2016 Oct 17. PMID: 27799885; PMCID: PMC5083263.
- Dionne J, Ford AC, Yuan Y, Chey WD, Lacy BE, Saito YA, Quigley EMM, Moayyedi P. A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol. 2018 Sep;113(9):1290-1300. doi: 10.1038/s41395-018-0195-4. Epub 2018 Jul 26. PMID: 30046155.
- Eswaran S, Chey WD, Jackson K, Pillai S, Chey SW, Han-Markey T. A Diet Low in Fermentable Oligo-, Di-, and Monosaccharides and Polyols Improves Quality of Life and Reduces Activity Impairment in Patients With Irritable Bowel Syndrome and Diarrhea. Clin Gastroenterol Hepatol. 2017 Dec;15(12):1890-1899.e3. doi: 10.1016/j.cgh.2017.06.044. Epub 2017 Jun 28. PMID: 28668539.
- Harvie RM, Chisholm AW, Bisanz JE, Burton JP, Herbison P, Schultz K, Schultz M. Long-term irritable bowel syndrome symptom control with reintroduction of selected FODMAPs. World J Gastroenterol. 2017 Jul 7;23(25):4632-4643. doi: 10.3748/wjg.v23.i25.4632. PMID: 28740352; PMCID: PMC5504379.
- Patcharatrakul T, Juntrapirat A, Lakananurak N, Gonlachanvit S. Effect of Structural Individual Low-FODMAP Dietary Advice vs. Brief Advice on a Commonly Recommended Diet on IBS Symptoms and Intestinal Gas Production. Nutrients. 2019 Nov 21;11(12):2856. doi: 10.3390/nu11122856. PMID: 31766497; PMCID: PMC6950148.
- Pedersen N, Andersen NN, Végh Z, Jensen L, Ankersen DV, Felding M, Simonsen MH, Burisch J, Munkholm P. Ehealth: low FODMAP diet vs Lactobacillus rhamnosus GG in irritable bowel syndrome. World J Gastroenterol. 2014 Nov 21;20(43):16215-26. doi: 10.3748/wjg.v20.i43.16215. PMID: 25473176; PMCID: PMC4239510.
- Zahedi MJ, Behrouz V, Azimi M. Low fermentable oligo-di-mono-saccharides and polyols diet versus general dietary advice in patients with diarrhea-predominant irritable bowel syndrome: A randomized controlled trial. J Gastroenterol Hepatol. 2018 Jun;33(6):1192-1199. doi: 10.1111/jgh.14051. Epub 2018 Feb 21. PMID: 29159993.
- Ford AC, Moayyedi P, Chey WD, Harris LA, Lacy BE, Saito YA, Quigley EMM; ACG Task Force on Management of Irritable Bowel Syndrome. American College of Gastroenterology Monograph on Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2018 Jun;113(Suppl 2):1-18. doi: 10.1038/s41395-018-0084-x. PMID: 29950604.
- Böhn L, Störsrud S, Törnblom H, Bengtsson U, Simrén M. Self-reported food-related gastrointestinal symptoms in IBS are common and associated with more severe symptoms and reduced quality of life. Am J Gastroenterol. 2013 May;108(5):634-41. doi: 10.1038/ajg.2013.105. PMID: 23644955.
- Geisslitz S, Shewry P, Brouns F, America AHP, Caio GPI, Daly M, D'Amico S, De Giorgio R, Gilissen L, Grausgruber H, Huang X, Jonkers D, Keszthelyi D, Larré C, Masci S, Mills C, Møller MS, Sorrells ME, Svensson B, Zevallos VF, Weegels PL. Wheat ATIs: Characteristics and Role in Human Disease. Front Nutr. 2021 May 28;8:667370. doi: 10.3389/fnut.2021.667370. PMID: 34124122; PMCID: PMC8192694.
- Hamer HM, Jonkers D, Venema K, Vanhoutvin S, Troost FJ, Brummer RJ. Review article: the role of butyrate on colonic function. Aliment Pharmacol Ther. 2008 Jan 15;27(2):104-19. doi: 10.1111/j.1365-2036.2007.03562.x. Epub 2007 Oct 25. PMID: 17973645.
- Leeming ER, Johnson AJ, Spector TD, Le Roy CI. Effect of Diet on the Gut Microbiota: Rethinking Intervention Duration. Nutrients. 2019;11(12):2862. Published 2019 Nov 22. doi:10.3390/nu11122862
- Singh P, Tuck C, Gibson PR, Chey WD. The Role of Food in the Treatment of Bowel Disorders: Focus on Irritable Bowel Syndrome and Functional Constipation. Am J Gastroenterol. 2022 Jun 1;117(6):947-957. doi: 10.14309/ajg.0000000000001767. Epub 2022 Apr 8. PMID: 35435179; PMCID: PMC9169760.
- So D, Gibson PR, Muir JG, Yao CK. Dietary fibres and IBS: translating functional characteristics to clinical value in the era of personalised medicine. Gut. 2021 Dec;70(12):2383-2394. doi: 10.1136/gutjnl-2021-324891. Epub 2021 Aug 20. PMID: 34417199.
- Tigchelaar EF, Mujagic Z, Zhernakova A, Hesselink MAM, Meijboom S, Perenboom CWM, Masclee AAM, Wijmenga C, Feskens EJM, Jonkers DMAE. Habitual diet and diet quality in Irritable Bowel Syndrome: A case-control study. Neurogastroenterol Motil. 2017 Dec;29(12). doi: 10.1111/nmo.13151. Epub 2017 Jul 17. PMID: 28714091
Evidence tabellen
Diet – Evidence table for intervention studies (baseline characteristics) – Gluten free diet
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/control (C) |
Follow-up |
|
Biesiekierski, 2011 |
Type of study: double blind randomized placebo controlled trial
Setting and country: patients recruited through advertisements and by referral in private dietetic practice, Australia
Funding: the Helen Macpherson Smith Trust, the National Health and Medical Research Council (NHMRC) of Australia, and the Vera and Les Erdi Foundation
Conflicts of interest: Susan J. Shepherd has published cookbooks directed toward issues of dietary fructan restrictions, fructose malabsorption, and celiac disease. She has also published shopping guides for low FODMAPs and low fructose and fructan foods. |
Inclusion criteria: age > 16 years, symptoms of IBS fulfilling Rome III criteria that have improved on a gluten-free diet, and adherence to the diet for at least 6 weeks immediately before screening
Exclusion criteria: Celiac disease, significant gastrointestinal disease (such as cirrhosis or inflammatory bowel disease), excessive alcohol intake, intake of non- steroidal anti-inflammatory agents, and unable to give written informed consent
N total at baseline: Intervention (gluten): 19 Control (gluten free): 15
Important prognostic factors2: Median age (range): Gluten: 40 (29-55) Gluten free:49 (33-51)
Sex: Gluten: 16% Gluten free: 7%
Number with predominant bowel habit Gluten: constipation (16%), diarrhea (58%), alternation (26%) Glutenfree: Constipation (20%), diarrhea (33%), alternating (47%)
Groups comparable at baseline? No statistical analysis were performed to compare groups at baseline |
Before participating in the study patients had to adhere to a gluten free diet for at least 6 weeks immediately before screening. Patients were randomized to either the gluten or the placebo treatment group. Participants continued on a gluten-free diet throughout the study, but were asked to consume one study muffin and two study slices of bread containing gluten (total intake of 16 g / day) every day for 6 weeks. |
Before participating in the study patients had to adhere to a gluten free diet for at least 6 weeks immediately before screening. Patients continued their gluten free diet and received one study muffin and two study slices of bread containing no gluten every day for 6 weeks. . |
Length of follow-up: 9 weeks (three weeks after completion of the intervention)
Loss-to-follow-up: Gluten: N: 6, withdrew after a median of 7 (range 2 – 18) days Reasons (describe)
Gluten free: N: 3, withdrew after a median of 16 (range 11 – 21) days
There were no statistical differences between the groups in frequency and timing of withdrawal.
Incomplete outcome data: NA |
|
Zanwar, 2016 |
Type of study: a prospective, randomized, double blinded placebo controlled trial
Setting and country: tertiary health care center in the gastroenterology outpatient clinic affiliated to a University Medical College in Mumbai, India
Funding: None
Conflicts of interest: None |
Inclusion criteria: patients aged >16 years, symptoms of IBS as per the Rome III criteria, willing to adhere to the prescribed diet
Exclusion criteria: Patients already on a gluten free diet, presence of cirrhosis or inflammatory bowel disease, excessive alcohol intake, patients currently prescribed and using systemic immunosuppressants, nonsteroidal anti- inflammatory agents, or medications affecting gastrointestinal motility, abnormal thyroid function tests, presence of a psychiatric disease, pregnancy, inability to give written informed consent
N total at baseline: 180 patients started a gluten free diet. 65 Patients responded to the gluten free diet. Those 65 patients were randomized. 5 patients were lost to follow up. N total = 60 Gluten: N = 30 Gluten free: N=30
Important prognostic factors2: Age mean (+- SD) Gluten: 37 (18-60) Gluten free 35 (18-56)
Male Sex: Gluten: 17 (56%) Gluten free: 18 (60%)
Groups comparable at baseline? Yes (based on age, gender, bmi, duration of illness, IgA tTG antibody level, ESR) |
At the beginning of the study, a dietician provided advice to all patients on following a gluten free diet for 4 weeks. Patients who responded adequately to the gluten free diet and had improvement in their symptoms, defined as a 30% decrease in symptom VAS from the baseline for at least 50% of the time, were included in the study. Patients who did not respond to the GFD were allowed to withdraw from the study. After 4 weeks of the washout (elimination diet) period, the responding patients were randomly assigned into two groups for a double-blind, placebo-controlled rechallenge.
Rechallenge: The patients in the gluten group consumed two slices of bread containing gluten each morning for the course of the rechallenge. Rechallenge lasted 4 weeks and the patients were advised to maintain a gluten free diet throughout this period. |
At the beginning of the study, a dietician provided advice to all patients on following a gluten free diet for 4 weeks. Patients who responded adequately to the gluten free diet and had improvement in their symptoms, defined as a 30% decrease in symptom VAS from the baseline for at least 50% of the time, were included in the study. Patients who did not respond to the GFD were allowed to withdraw from the study. After 4 weeks of the washout (elimination diet) period, the responding patients were randomly assigned into two groups for a double-blind, placebo-controlled rechallenge.
Rechallenge: Patients in the gluten free group consumed consumed two slices of gluten-free breads, each morning for the course of the rechallenge. Rechallenge lasted 4 weeks and the patients were advised to maintain a gluten free diet throughout this period. |
Length of follow-up: until week 4 of the rechallenge
Loss-to-follow-up: In total 180 patients started a gluten free diet, 65 responded to the diet and 16 were unable to tolerate a gluten free diet. 65 patients were included in the randomization. Gluten: 34 patients were allocated to the gluten intervention, 4 were lost to follow-up Gluten free: 31 patients were allocated to the intervention, 1 was lost to follow-up
Incomplete outcome data: NA
|
|
Shahbazkhani, 2015 |
Type of study: double-blind randomized placebo- controlled trial
Setting and country: suburban, outpatient, private-practice gastroenterology clinic in Imam Khomeini hospital, Tehran, Iran
Funding: not reported Conflicts of interest: None |
anti-inflammatory drugs, abnormal levels of: glucose, urea, creatinine, sodium, potassium, hemoglobin, ESR) and thyroid function tests, and those who did not sign the consent form to participate in the study
N total at baseline: 102 patients started the gluten free diet 22 were withdrawn (found it difficult to follow gluten free diet). 80 patients responded to the diet and achieved significant improvement. 8/80 did not follow a strict gluten free diet and were excluded. 72 patients were included in the study.
N gluten = 35 N gluten free = 37
Important prognostic factors2: Mean age (+- SD) Gluten: 44.5 (10) Gluten free: 43.2 (17)
Male sex (%) Gluten: 6 (17.1%) Gluten free: 13 (35.1%)
Kind of IBS Gluten Constipation: 10 (28.6%) Diarrhea: 19 (54.3%) Mixed: 6 (17.1%) Gluten free Constipation: 6 (16.2%) Diarrhea: 18 (48.6%) Mixed: 13 (35.1%)
Groups comparable at baseline? Yes (for age, sex, kind of IBS, Anti-tTG IgA, Anti-tTg IgG, AGA IGA, AGA IgG, Positive DQ2/8 HLA) |
All patients started a gluten free diet.
Patients in both groups consumed powder for six weeks, while both groups were on gluten-free diets.
The gluten containing group), was given a packet (100 g) containing a gluten meal (free of fermentable oligo di- monosaccharides and polyols and proteins including 2.3% non-gluten, 52% gluten and/or gliadin and 27.7 g glucose) |
All patients started a gluten free diet.
Patients in both groups consumed powder for six weeks, while both groups were on gluten-free diets.
The gluten free group was given packets (100 g) containing powder of gluten- free foods (rice flour, corn starch and glucose). |
Length of follow-up: 6 weeks
Loss-to-follow-up: Not mentioned
Incomplete outcome data: NA
|
Diet – Evidence table for systematic reviews (baseline characteristics) – Gluten free diet and low FODMAP
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/control (C) |
Follow-up |
|
Dionne, 2018 |
SR and meta-analysis of RCT’s
Literature search up to November 2017
A: Biesiekierski, 2011 B:Shahhbazkhani, 2015 C: Bohn (2015) D: Eswaran (2015) E: Halmos (2014) F: McIntosh (2017) G: Staudacher (2017) H: Staudacher (2012) I:Husthof (2017)
Study design: A: RCT B: RCT C: RCT D: RCT E: RCT F: RCT G: RCT, 2x2 factorial design H:RCT I:RCT
Setting and Country:
Source of funding and conflicts of interest: the American College of Gastroenterology Institute and the Canadian Institute for Health Research, one of the authors has conducted one of the included trials. |
Inclusion criteria SR: Parallel-group RCT’s (or first arm of cross-over) adults (participants aged >17 years), Diagnosis of IBS based on either a clinician’s opinion or meeting specific diagnostic criteria. Compared dietary exclusion of gluten or FODMAPs with placebo diet or usual diet. Alternatively, all patients received GFD or low FODMAP diet and then randomized to challenge or continue on diet. Minimum duration of therapy and follow-up 7 days. Dichotomous assessment of response to therapy in terms of effect on global IBS symptoms or abdominal pain following therapy
Exclusion criteria SR: Insufficient data, no comparator arm, did not include outcome of interest, drug comparator, duplicates, not RCT, not a clinical study, psychiatric intervention, not IBS, IBS/IBD overlap.
9 studies included, 2 concerning gluten free diet, 7 concerning low FODMAP diet
Important patient characteristics at baseline: NA
We were unable to assess if groups were comparable at because this data is not provided in the SR |
A: Gluten free diet B: Patients randomized to packages containing powdered gluten C: Low FODMAP D: Low FODMAP E: Low FODMAP F: Low FODMAP G: Low FODMAP H: Low FODMAP I: Low FODMAP |
A: Gluten free plus study bread and muffin containing 16 g of gluten/ day) B: Patients randomized to packages containing gluten free powder C: traditional IBS diet advise (3 meals and 3 snacks per day with even fiber distribution) D: modified NICE guidelines diet E: typical diet F: High FODMAP G: sham diet, or low FODMAP/probiotics, or low FODMAP/placebo, sham diet/probiotic, sham diet/placebo H: usual diet I: High FODMAP |
End-point of follow-up:
A: 6 weeks B: 6 weeks C: 4 weeks D: 4 weeks E: 3 weeks F: 3 weeks G: 4 weeks H: 4 weeks I: 9 weeks
For how many participants were no complete outcome data available? NA |
Diet – Evidence table for intervention studies (baseline characteristics) – low FODMAP diet
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison/control (C) 3 |
Follow-up |
|
Zahedi (2017) |
Type of study: RCT (single blinded) Setting and country: patients referred to the gastroenterology department
Funding: grant from Vice Chancellor for Research, Kerman University of Medical Sciences, Kerman, Iran
Conflicts of interest: None declared |
Inclusion criteria: IBS-D (Bristol stool form scale ≥ 5) and age 20–60 years old
Exclusion criteria: having a confounder medical condition such as celiac disease, inflammatory bowel disease, or presence of cardiovascular, liver, kidney, neurologic diseases, diabetes, and thyroid disorders, consumption of ω-3 fatty acids and other nutritional supplements in the last 3 months, and pregnancy during the study
N total at baseline: N=110 I: 55 C: 55
Important prognostic factors2: Age (median ± SD) I: 37.60 ±11.09 C: 37.43±13.27
Gender (%male) I: 52% C: 47.05%
There was no statistically significant difference in age, gender, BMI, HADS, IBS-SSS, QoL and stool frequency at baseline. For Stool consistency there was a statistically significant difference (I: 5.92±0.45 C: 5.67±0.61) |
Dietary education: LFD (<0.5 g of FODMAPs per meal) |
Traditional IBS diet (British Dietetic Association) |
Length of follow-up: 6 weeks
Loss-to-follow-up: I: 3 noncompliance, 2 lost to follow-up C: 2 excluded because of travel, 2 lost to follow-up
Incomplete outcome data: NA |
|
Eswaran (2017) |
Type of study: RCT Setting and country: patients recruited from the gastroenterology and primary care clinics, USA
Funding: Michigan Nutrition Obesity Research Center Grant (P30 DK089503), Clinical and Translational Science Award Grant (2UL1TR000433-06), Prometheus Therapeutics and Diagnostics (San Diego, CA).
Conflicts of interest: William D. Chey has served as a consultant for and received grant funding |
Inclusion criteria: IBS-D patients meeting the Rome III criteria with an average daily abdominal pain score of 4 or higher on an 11-point numerical rating scale, and an average daily stool consistency, assessed by the Bristol Stool Form Scale, of >5
Exclusion criteria: NA
N total at baseline: 171 subjects enrolled and screened 84 completed the study. I: 45 C: 39
Important prognostic factors2: Median age (range): Gluten: 40 (29-55) Gluten free:49 (33-51)
Age (mean±sd): I: 41.6±14.7 C: 43.8±15.2
Sex (% male) I: 34% C: 23.8%
Demographics and baseline QOL measures were similar between groups, except that there were more obese patients in the mNICE group. |
Low FODMAP diet
Instruction was administered in a standardized manner according to published materials from Monash University. Subjects were given teaching materials created from the University of Michigan. |
modified diet recommended by the National Institute for Health and Care Excellence (mNICE)
Using standardized instructions, the mNICE group was instructed to eat small frequent meals, avoid trigger foods, and avoid excess alcohol and caffeine |
Length of follow-up: 4 weeks
Loss-to-follow-up: I: 5 C: 2
Incomplete outcome data: NA |
|
Harvie (2017) |
Type of study: RCT, parallel design study
Setting and country: subjects recruited through gastroenterology outpatient clinics, GP practices and by advertising, New Zealand
Funding: NA Conflicts of interest: None reported |
Inclusion criteria: meeting the Rome III criteria
Exclusion criteria: coeliac disease, inflammatory bowel disease (IBD), pregnancy or lactation, major abdominal surgery and inability to understand English
N total at baseline: I: 23 C: 27
Important prognostic factors2: Age (mean±sd): I: 43.3±13.8 C: 40.6±13.3
Sex (%male) I: 26% C: 4%
Information on comparability of the groups is not reported, only that groups were different regarding sex.
|
Low FODMAP
Dietary advice was provided to individual participants in a standardized fashion by an experienced registered dietitian. At the initial consultation (approx. 1 h duration) all participants were advised to significantly reduce their intake of excess fructose, lactose, sorbitol, mannitol, FOS and GOS. Participants then purchased and prepared their own food
There was a 16.5 ± 15.6 g/d (p < 0.01) reduction in total FODMAP intake of participants in this group |
Regular diet |
Length of follow-up: 3 months
Loss-to-follow-up: NA
Incomplete outcome data: NA |
|
Patcharatrakul (2019) |
Type of study: RCT Setting and country: enrolled from the gastroenterology outpatient clinic Thailand Funding: Ratchadapiseksompotch Fund, Chulalongkorn University and a grant from The Gastroenterological Association of Thailand
Conflicts of interest: None declared |
Inclusion criteria: Adult patients (18–70 years of age) who were diagnosed as IBS by Rome III criteria with moderate-to-severe GI symptoms
Exclusion criteria: previous surgery of the GI tract except for appendectomy and hemorrhoidectomy; inflammatory bowel disease; celiac disease; GI malignancy; and severe heart, liver, lung, neurological, or psychiatric diseases
N total at baseline: I: 33 C: 33
Important prognostic factors2: Age (mean±sd): I: 50.0±13.7 C: 52.0±14 Sex (%female): I: 76.7% C: 75%
Groups were comparable at baseline (for age, gender, BMI, education, global IBS severity score, Symptom severity score, HAD score anxiety, HAD score depression, total high-FODMAPs per week) |
Low FODMAP
High-FODMAP items that might aggravate the patient’s
symptoms were identified from an individual 7-day food diary. Then, the investigator discussed with the patients to avoid high- FODMAP items and modify recipe/menu with the commonly available low- FODMAP items. The items low in FODMAPs in our country with an example food menu using these low- FODMAP items were listed in the pamphlets provided to the patients. |
Patients received 5 min of dietary advice from an investigator, which included reducing certain foods that have been traditionally recognized as triggers for gas, bloating, or abdominal pain, including fruits, vegetables, nuts, beans, and garlic, and avoidance of large meals. |
Length of follow-up: 4 weeks
Loss-to-follow-up: I: 3 C: 1
Incomplete outcome data: NA
|
|
Pederson (2014) |
Type of study: unblinded RCT Setting and country: IBS patients from Herlev Hospital, Denmark
Funding: NA
Conflicts of interest: NA |
Inclusion criteria: Meeting Rome III criteria for IBS, a negative outcome of colonoscopy, negative transglutaminase antibodies and lactose intolerance gene test prior to study enrolment
Exclusion criteria: Patients with a BMI<18
N total at baseline: I: 42 C: 40
Important prognostic factors2: Age mean (range): I: 37 (18-71) C: 32 (18-73)
Sex (male/female): I: 8/34 C: 11/29
Baseline characteristics were similar in both groups (age, gender, BMI, smoking, disease duration, subtype, ibs related medication, IBS-SSS, IBS-QOL). |
Low FODMAP
Each patient allocated to the LFD was instructed in the diet during a one hour session by nutritionists or dietitians with a special interest in IBS and the LFD. All patients were requested not to eat food components with a high content of FODMAPs and a list of these was provided at the session with the dietitian. All patients were encouraged to contact the dietitian in case of any uncertainties regarding the diet. |
An unchanged normal (Danish/Western) |
Length of follow-up: 6 weeks
Loss-to-follow-up: I: 8 C: 3
Incomplete outcome data:
|
Diet – Evidence table for systematic reviews (baseline characteristics) – psyllium fibre
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/control (C) |
Follow-up |
Comments |
|
Ford (2018) |
SR and meta-analysis of RCT’s
Literature search up to July 2017
A: Ritchie, 1979 B: Longstreth, 1981 C: Arthurs, 1983 D: Nigam, 1984 E: Prior, 1987 F: Jalihal, 1990 G: Bijkerk, 2009
Study design: RCT Setting: A: tertiary care B: secondary care C: secondary care D: secondary care E: tertiary care F: secondary care G: primary care
Source of funding and conflicts of interest: Unrestricted educational grant. Several of the authors were consultant for Allergan or Ironwood or Nestle. |
Inclusion criteria SR: Randomized controlled trials, Adults (participants aged > 16 years), Diagnosis of irritable bowel syndrome (IBS) based on either a clinician ’ s opinion or meeting specific diagnostic criteria (Manning, Kruis score, Rome I, II, or III), Compared fiber supplementation with placebo or no therapy, Minimum duration of therapy 7 days, Minimum duration of follow- up 7 days, Dichotomous assessment of response to therapy in terms of effect on global IBS symptoms or abdominal pain following therapy
Exclusion criteria SR: NA
7 studies included
Important patient characteristics at baseline:
N, IBS definition, IBS type A: 100, Author-defined IBS, NA B: 77, Author-defined IBS, NA C: 80, Author-defined IBS, NA D: 168, Author-defined IBS, NA E: 80, Author-defined IBS, IBS-C 49% F: 22, Author-defined IBS, IBS- C 25%, IBS-D 75% G: 275, Author-defined or ROME II IBS, IBS-C 56%, IBS-D 25%, IBA-M 19%
Sex (% female): A: 77% B: 83% C: 78% D: 45% E: 90% F: 20% G: 79%
Groups comparable at baseline? NA |
Describe intervention:
A: Ispaghula husk B: Ispaghula C: Ispaghula husk D: Ispaghula husk E: Ispaghula husk F: Ispaghula husk G: 20 g Ispaghula husk |
Describe control:
A: placebo B: placebo C: placebo D: placebo E: placebo F: placebo G: placebo |
End-point of follow-up:
A: 3 months B: 8 weeks C: 4 weeks D: 3 months E: 12 weeks F: 4 weeks G: 12 weeks
For how many participants were no complete outcome data available? NA |
Author’s conclusions: Poorly fermentable, soluble fiber remains an evidence-based treatment for IBS. The low cost and lack of significant side effects makes soluble fibre a reasonable first-line therapy for IBS patients. |
Diet – Table of quality assessment for systematic reviews of RCT’s and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Ford (2018) |
Yes |
Yes |
No (but can be found in Moayyedi 2014) |
No (but can be found in Moayyedi 2014) |
Not applicable |
Yes |
Yes |
No |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCT’s)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies
Diet – Psyllium fibre: Table of quality assessment for systematic reviews of RCT’s and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Dionne, 2018 |
Yes |
Yes |
Yes |
No (age, gender and other characteristics of participants in the included studies were not mentioned in the SR) |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCT’s)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Diet – Gluten free and low FODMAP – Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Zahedi (2017) |
participants were randomly allocated into two groups according to the pre- arranged balanced block randomization |
Unlikely |
Likely |
Unclear (dieticians were not blinded) |
unclear |
unlikely |
unlikely |
unlikely |
|
Eswaran (2017) |
via computer generation in a 1:1 ratio |
unlikely |
Likely |
unclear |
unlikely |
unlikely |
Likely |
unlikely |
|
Harvie (2017) |
Randomization of numbers was done online (http://www.rando m.org) |
unlikely |
Likely |
Unclear |
unclear |
Unlikely |
unclear |
unlikely |
|
Patcharatrakul (2019) |
Not described |
unclear |
Likely |
unclear (dieticians were not blinded) |
Likely |
unlikely |
Unlikely |
unlikely |
|
Pederson (2014) |
Random allocation software at a 1:1:1 based on http:// mahmoodsaghaei.t ripod.com/Softwar es/randalloc.html |
unlikely |
Likely (unblinded) |
Unclear |
likely |
unlikely |
Likely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Diet – Gluten free: Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Biesiekierski, 2011 |
Patients were randomized according to a computer- generated list of random numbers held by an independent observer to either the gluten or the placebo treatment group |
Unlikely (patients randomized according to computer-generated list) |
Unlikely (patients were blinded to the study treatment, κ score of 0.24, low agreement between actual treatment and participant guessing) |
Unlikely (investigators were blinded to study treatment) |
Unlikely (investigators evaluating patients were blinded to study treatment) |
unlikely |
Likely (no statistical difference between both groups in patients that ended prematurely reported in terms of days but not on outcome measures) |
unlikely |
|
Zanwar, 2016 |
Patients were randomized by an independent observer according to a computer- generated list of random numbers. Both patients and investigators were blinded to the study treatment. |
Unlikely (Patients were randomized by an independent observer according to a computer- generated list) |
Unclear |
Unclear |
Likely (symptoms are very subjective. Patients that are included in the trial responded to the initial gluten free diet) |
Unlikely |
Likely (more loss to follow up in the gluten group) |
unlikely |
|
Shahbazkhani, 2015 |
The patients were randomized according to block randomization method held by an independent observer to either the gluten or the placebo treatment group. Both patients and investigators evaluating patients were blinded to the study treatment. |
Unlikely |
Unclear |
Unclear |
Unclear (symptoms are very subjective. Patients that are included in the trial responded to the initial gluten free diet) |
Unlikely |
Unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis
Diet: Table of excluded studies (SR and RCT’s) gluten free
|
Author and year |
Reason for exclusion |
|
Systematic reviews |
|
|
Ford (2015) |
More recent systematic review available |
|
Moayyedi (2015) |
More recent systematic review available |
|
Singh (2018) |
More recent systematic review available |
|
Scarpato (2019) |
Wrong P (functional gastrointestinal disorders) |
|
RCT’s |
|
|
x |
x |
Diet: Table of excluded studies (SR and RCT’s) low FODMAP
|
Author and year |
Reason for exclusion |
|
Systematic reviews |
|
|
Ford (2015) |
More recent systematic review available |
|
Moayyedi (2015) |
More recent systematic review available |
|
Rao (2015) |
More recent systematic review available |
|
Altobelli (2017) |
More recent systematic review available |
|
Korgsgaard (2017) |
More recent systematic review available |
|
Varju (2017) |
More recent systematic review available |
|
Schumann (2018) |
Presentation of outcome measures difficult to interpret |
|
RCT’s |
|
|
Guerreiro (2020) |
Wrong study design |
|
Gravina (2020) |
No control group |
Diet: Table of excluded studies NICE diet
|
Author and year |
Reason for exclusion |
|
x |
x |
Diet: Table of excluded studies (SR and RCT’s) psyllium fiber
|
Author and year |
Reason for exclusion |
|
Systematic reviews |
|
|
Zuckerman |
Not a systematic review (search strategy unknown, databases unknown) |
|
Spiller |
Not a systematic review (search strategy unknown, databases unknown) |
|
Moayyedi (2014) |
Updated in Ford 2018 |
|
Enck (2010) |
Wrong intervention |
|
Bijkerk 2004 |
More recent systematic review available |
|
Bijkerk 2004 |
More recent systematic review available |
|
Bijkerk 2005 |
More recent systematic review available |
|
Quartero 2005 |
More recent systematic review available |
|
Ford 2008 |
More recent systematic review available |
|
Ruepert (2011) |
More recent systematic review available |
|
RCT’s |
|
|
Oskouie (2018) |
Wrong intervention, wrong outcome |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 29-11-2022
Beoordeeld op geldigheid : 07-11-2022
Algemene gegevens
Het Prikkelbaredarmsyndroom (PDS) kenmerkt zich door terugkerende episodes van buikpijn die samenhangen met een wisselling of verandering (in vorm en/of frequentie) in ontlastingspatroon. PDS is de meest voorkomende functionele darmaandoening in zowel de eerste als de tweede lijn.
Internationaal is er een brede variatie in prevalenties van PDS, met uitersten van 1,1% (Frankrijk en Iran) tot 35,5% (Mexico). De gepoolde wereldwijde prevalentie is 8,8% (Sperber, 2017). De prevalentie van PDS in de algemene Nederlandse bevolking bedraagt 3,8% op basis van de Rome-IV-criteria en 9,7% op basis van de ruimere Rome-III-criteria (Sperber, 2021). De internationale prevalentie volgens de Rome-IV-criteria is naar schatting 4,1% (5,2% bij vrouwen en 2,9% bij mannen) (Sperber, 2021). Wat oudere data uit Nederlandse morbiditeitsregistraties in de huisartsenpraktijk laten grote verschillen zien, afhankelijk van de PDS-definitie en de gebruikte Rome-criteria. De Continue Morbiditeitsregistratie geeft voor de periode 1998-2006 een incidentie bij mannen van 2-3 en bij vrouwen van 6-7 per 1000 patiënten per jaar, en een prevalentie van 4 per 1000 mannen en 10 per 1000 vrouwen.
De diagnose PDS wordt vooral gesteld op jongere leeftijd. In Nederland zijn de prevalenties 5,3% in de leeftijd 18-39 jaar, 3,7% in de leeftijd 40-64 jaar en 1,7% in de leeftijd ≥ 65 jaar. Van de mensen met klachten die passen bij PDS zoekt 33-50% hulp (Van de Lisdonk, 2008). Naar schatting 90% van de patiënten met PDS wordt behandeld in de eerste lijn; van de patiënten met chronische darm- en buikklachten in de eerste lijn heeft ongeveer de helft een somatisch onvoldoende verklaarde maagdarmstoornis, de meesten PDS (Guthrie, 2002). PDS veroorzaakt vaak langdurig klachten. Deze klachten zijn regelmatig ernstig invaliderend, hebben grote impact op de kwaliteit van leven en zorgen voor ziekteverzuim en beperkingen in het sociaal functioneren.
Doel en doelgroep
In de richtlijn staan aanbevelingen voor diagnostiek en behandeling van volwassen patiënten met PDS in de eerste en tweede lijn. Daar waar nodig gaat de richtlijn in op de behandeling door andere zorgverleners zoals psychologen, hypnotherapeuten en diëtisten.
Samenstelling werkgroep
Werkgroep
- Prof. Dr. A.A.M. (Ad) Masclee, MDL-arts, (voorzitter) NVMDL
- Drs. J. (Jacintha) Van Balen, huisarts, (voorzitter) NHG
- Prof. Dr. J. (Jean) Muris, huisarts, (vice-voorzitter) NHG
- Dr. C.H.M. (Cees) Clemens, MDL-arts, NVMDL
- Drs. B.J.T. (Bertram) Haarhuis, MDL-arts, NVMDL
- Prof dr. D. (Daniel) Keszthelyi, MDL-arts, NVMDL
- Prof. Dr. N. (Niek) de Wit, huisarts, NHG
- Dr. A.O. (Otto) Quartero, huisarts, NHG
- Dr. C.E. (Carla) Flik, klinisch psycholoog (niet praktiserend), op persoonlijke titel
- Drs. D.D (Dyana) Loehr, patiëntvertegenwoordiger, PDSB
- J.H.M. (Jenny) Brouns, diëtist, NVD
Met ondersteuning van:
- Dr. E. Belfroid, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. Minnaard, wetenschappelijk medewerker, Nederlands Huisartsen Genootschap
- Dr. A. Schep, epidemioloog, Nederlands Huisartsen Genootschap
- Dr. ir. N.L. van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben een verklaring ingevuld. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de tabel. De volledige belangenverklaringen zijn op te vragen via het secretariaat van het Kennisinstituut en het NHG.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Masclee, Voorzitter richtlijnwerk- groep |
Hoofd MDL- ziekten en hoogleraar MDL- ziekten, Maastricht UMC+ (t/m oktober 2021) |
|
-ZonMw subsidie Goed Gebruik Geneesmiddelen: Peppermint oil for the treatment of irritable bowel syndrome: optimalisation of anti- nociception through targeted delivery in the large bowel.
samenwerkingsverband |
Geen. (alternerend) voorzitterschap lag bij mede- voorzitter tijdens bespreking pepermuntolie |
|
Van Balen, Voorzitter richtlijnwerk- groep |
Senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap (0,7 fte) en huisarts (0,2 fte) |
Geen |
Geen |
Geen acties nodig |
|
Muris |
Hoogleraar Huisartsengenees kunde Universiteit Maastricht, 1,0 fte Vervangende werkzaamheden in huisartsen- praktijk Geulle (1- 2 × per maand 1 dag) |
|
Geen |
Geen acties nodig |
|
Haarhuis |
Mdl-arts Bernhoven te Uden |
Geen |
Geen |
Geen acties nodig |
|
Loehr |
Coördinator social media en lid medische commissie bij de Prikkelbare Darm Syndroom Belangenorgani- satie (als vrijwilliger, ± 8 uur per week) |
|
Geen |
Geen acties nodig |
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Clemens |
Mdl-arts Alrijne Zorggroep |
Geen |
Geen |
Geen acties nodig |
|
Keszthelyi |
Mdl-arts Maastricht UMC+ (1,0 fte) |
enterologie (NVGE, onbetaald).
|
(projectleider).
projectleider). |
Geen trekker bij module over Pepermuntolie. Restricties t.a.v. besluitvorming over pepermuntolie. |
|
De Wit |
- Voorzitter divisie Julius Centrum voor Gezondheidswe- tenschappen en Eerstelijns Geneeskunde |
Onbezoldigd:
|
- Projectleider van het CEDAR onderzoek; ZonMw project naar kosteneffectiviteit van coloscopie aanvragen door de huisarts bij onderbuikspijnklachten. |
Restricties t.a.v. module over hypnotherapie |
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
|
UMC Utrecht - Hoogleraar Huisartsgenees- kunde UMC Utrecht |
European Society for Primary Care Gastroenterology (ESPCG)
programmacommissie Doen of Laten
kwartiermakersoverleg Onderzoek en Innovatie voor de regio
Bezoldigd
Hilversum |
|
|
|
Quartero |
Huisarts, vrijgevestigd |
Voorzitter huisartsencoöperatie HCDO; hiervoor ontvang ik per kwartaal vacatiegeld (afhankelijk van gedraaide uren €1300-€1500 per kwartaal) |
Geen |
Geen acties nodig |
|
Flik |
Gepensioneerd klinisch psycholoog (n.p.) |
Eigenaar van de digitale verbeteringen Hypnotherapie gemaakt in het kader van mijn onderzoek |
Geen |
Restricties t.a.v. hypnotherapie (opstellen uitgangsvraag en geen leidende rol in schrijven van de module) |
|
Brouns |
Diëtist met specifieke deskundigheid MDL waaronder PDS, 28 uur per week (24 uur patiënt gerelateerde zorg, 4 uur MDL innovatie) UMC+ Maastricht |
|
Geen |
Geen acties nodig |
Inbreng patiëntenperspectief
Voor het ontwikkelen van de richtlijn zijn een multidisciplinaire werkgroep en een klankbordgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de paragraaf ‘Samenstelling van de werkgroep’) die betrokken zijn bij de zorg voor patiënten met PDS.
Er werd aandacht besteed aan het patiëntperspectief door zitting van een afgevaardigde van de patiëntenorganisatie (PDSB) in de werkgroep. De Patiëntenfederatie Nederland en PDSB werden uitgenodigd voor de invitational conference/knelpunteninventarisatie. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De richtlijn is tevens voor commentaar voorgelegd aan de PDSB en de Patiëntenfederatie.
Kwalitatieve raming van mogelijk financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming gedaan of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst.
Uit de kwalitatieve raming blijkt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), maar dat er waarschijnlijk geen substantiële financiële gevolgen zijn. Zie tabel voor een overzicht van uitkomsten van de kwalitatieve raming met bijbehorende toelichting.
Tabel Kwalitatieve raming in het kader van de Wkkgz
|
Module |
Uitkomst raming |
Toelichting |
|
Calprotectinetest |
Geen financiële gevolgen |
Het betreft geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Fecaal Immunochemische test (FIT) |
Geen financiële gevolgen |
De aanbeveling heeft een kostenbesparend effect, omdat de diagnostiek minder zal worden ingezet dan in de huidige situatie. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Coloscopie |
Geen financiële gevolgen |
De aanbeveling heeft een kostenbesparend effect, omdat de diagnostiek minder zal worden ingezet dan in de huidige situatie. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
Geen financiële gevolgen |
De aanbevelingen betreffen geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners en geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Probiotica |
Geen financiële gevolgen |
De aanbeveling is zwak negatief geformuleerd. Er worden daarom geen substantiële financiële gevolgen verwacht. Bovendien betalen patiënten zelf voor het middel. |
|
Pepermuntolie |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
|
Module |
Uitkomst raming |
Toelichting |
|
Linaclotide |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
|
Antidepressiva |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
|
Psychologische behandelingen |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
|
Organisatie van zorg |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn. Echter, uit de toetsing volgt ook dat de aanbevelingen volgens de criteria beschreven in het uitvoeringsbesluit Wkkgz 2.1b en 2.1c ten opzichte van de huidige situatie geen substantiële financiële investering vragen, en geen wijziging in het opleidingsniveau van zorgpersoneel en geen toename (> 5% fte) in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreffen. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Patiëntvoorlichting |
Geen financiële gevolgen |
De aanbevelingen volgend uit deze module zijn voorlichtend van aard en bevorderen hoogstens in enige mate de zelfredzaamheid van de patiënt. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Implementatie
In de verschillende fasen van de richtlijnontwikkeling heeft de werkgroep rekening gehouden met de implementatie van de richtlijn en de uitvoerbaarheid van de aanbevelingen. Daarbij heeft de werkgroep expliciet gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Bij elke module is een implementatietabel opgesteld. Bij elke aanbeveling is een inventarisatie gedaan van de mogelijke bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door de verschillende partijen ondernomen dienen te worden.
Werkwijze
Aanleiding herziening en definitie ‘richtlijn’
Op initiatief van het Nederlands Huisartsen Genootschap (NHG) en de Nederlandse Vereniging van Maag-Darm-Leverartsen (NVMDL) is in september 2020 gestart met de herziening van de multidisciplinaire richtlijn en de NHG-Standaard Prikkelbaredarmsyndroom (PDS). Aanleiding voor het gezamenlijk oppakken van de herziening van deze richtlijnen, is de wens tot nadere afstemming van het aanbevolen beleid tussen eerste en tweede lijn. De tweedelijnsrichtlijn bestaat uit een set van modules waarin de aanbevelingen staan met onderbouwing. De NHG-Standaard bestaat uit een volledige tekst met aanbevelingen, waarbij voor de onderbouwing wordt verwezen naar de details.
Een deel van deze details komt inhoudelijk overeen met de modules uit de
tweedelijnsrichtlijn. Wanneer in deze totstandkoming wordt gesproken over ‘de richtlijn’
dan worden hiermee de tweedelijnsrichtlijn én de NHG-Standaard bedoeld.
Doel van de richtlijn
Deze richtlijn geeft adviezen over diagnostiek, behandeling, begeleiding en voorlichting in de eerste en tweede lijn voor patiënten met een prikkelbaredarmsyndroom. De modules zijn onderverdeeld in 3 overkoepelende onderwerpen:
- diagnostiek
- begeleiding en behandeling
- organisatie van zorg
Afbakening van het onderwerp
Deze richtlijn beschrijft de zorg voor alle patiënten met prikkelbaredarmsyndroom, zowel voor de eerste als voor de tweede lijn.
Werkwijze
Voor het herzien van de multidisciplinaire richtlijn en de NHG-Standaard is een multidisciplinaire werkgroep en een klankbordgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met PDS. In de multidisciplinaire werkgroep zijn de modules uitgewerkt die onderdeel zijn van de tweedelijnsrichtlijn én de NHG-Standaard. In een aparte vergadering met de huisartsen en een van de medisch specialisten van de multidisciplinaire werkgroep zijn de ‘extra’ onderdelen van de NHG-Standaard besproken (volledige tekst, details die niet als module in de multidisciplinaire werkgroep besproken zijn).
Een kerngroep bestaande uit de 2 voorzitters van de multidisciplinaire werkgroep, de wetenschappelijk medewerkers van het NHG en de adviseurs van het Kennisinstituut van de Federatie Medisch Specialisten (Kennisinstituut) was verantwoordelijk voor de afstemming binnen het project.
Het NHG en het Kennisinstituut hebben de richtlijnontwikkeling zowel procesmatig als methodologisch ondersteund.
Gebruikers van de richtlijn
De richtlijn is bedoeld voor alle zorgverleners die betrokken zijn bij de zorg aan patiënten met prikkelbaredarmsyndroom. De NHG-Standaard is primair bedoeld voor de huisartsen, de tweedelijnsrichtlijn is primair bedoeld voor alle zorgverleners die de medische specialistische zorg verlenen, zoals mdl-artsen, internisten, (klinisch) psychologen en diëtisten. Waar mdl-arts wordt genoemd in deze richtlijn kan ook internist met specialisatie in gastro-enterologie worden gelezen.
Presentatie
De tweedelijnsrichtlijn wordt gepresenteerd in de Richtlijnendatabase van de Federatie Medisch Specialisten en de NHG-Standaard op de NHG-richtlijnenwebsite. Deze databases/sites verschillen qua structuur en opbouw iets van elkaar, en dit maakt dat sommige onderdelen uit de richtlijn specifiek zijn voor of de Richtlijnendatabase, of de NHG- richtlijnenwebsite. Daarnaast is een vertaling van de richtlijn gemaakt naar informatie op Thuisarts.nl, zodat de actuele informatie ook voor patiënten beschikbaar is.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling heeft de werkgroep rekening gehouden met de implementatie van de richtlijn en de uitvoerbaarheid van de aanbevelingen. Daarbij heeft de werkgroep expliciet gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Bij elke module is een implementatietabel opgesteld. Bij elke aanbeveling is een inventarisatie gedaan van de mogelijke bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door de verschillende partijen ondernomen dienen te worden.
Juridische status van richtlijnen
Richtlijnen bevatten geen wettelijke voorschriften, maar aanbevelingen die zo veel mogelijk op bewijs gebaseerd zijn. Zorgverleners kunnen aan de aanbevelingen voldoen in het streven om kwalitatief goede of ‘optimale’ zorg te verlenen. Aangezien deze aanbevelingen gebaseerd zijn op ‘algemeen bewijs voor optimale zorg’ en de inzichten van de werkgroep hierover, kunnen zorgverleners op basis van hun professionele autonomie zo nodig in individuele gevallen afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van
de patiënt dat vereist, zelfs noodzakelijk. Wanneer zorgverleners van deze richtlijn afwijken, wordt het aanbevolen om dit beargumenteerd, gedocumenteerd en waar relevant in overleg met de patiënt te doen. Wij verwijzen voor huisartsen naar de disclaimer en voor medisch specialisten naar het rapport Medisch Specialistische Richtlijnen 2.0.
Deze richtlijn is ontwikkeld volgens de Handleiding Ontwikkelen van NHG-richtlijnen (verkorte versie Totstandkoming NHG-Standaarden | NHG-Richtlijnen) en het rapport Medisch Specialistische Richtlijnen 2.0. Op punten waar deze van elkaar verschilden is overeenstemming gezocht tussen NHG en Kennisinstituut.
Voorbereidingsfase
Knelpuntenanalyse
Tijdens de voorbereidende fase is een invitational conference georganiseerd, waarvoor betrokken verenigingen en organisaties zijn uitgenodigd. Voorafgaand aan de invitational conference zijn door het NHG knelpunten in de huisartsenzorg verzameld. Het conceptraamwerk met geïdentificeerde onderwerpen gedeeld met aanwezigen, en aanwezigen hebben kunnen reageren op het raamwerk. Tijdens de invitational conference zijn de onderwerpen besproken en was er gelegenheid te reageren. Een verslag van de invitational conference is opgenomen als bijlage in de richtlijn. Het NHG en het Kennisinstituut hebben samen met de voorzitters vervolgens op basis van de resultaten van de knelpunteninventarisatie de onderwerpen geselecteerd die opgenomen zouden kunnen worden in de richtlijn. Na bespreking in de werkgroep zijn concept-uitgangsvragen opgesteld en definitief vastgesteld.
Opstellen van uitgangsvragen
De werkgroep heeft aan het begin van het traject besloten voor welke uitgangsvragen een literatuursamenvatting met GRADE-beoordeling geschreven kon worden (dit betreft vooral diagnostische of therapeutische vragen), en voor welke uitgangsvragen geen literatuursamenvatting of een literatuursamenvatting zonder GRADE-beoordeling zou worden opgenomen. In het geval van een diagnostische of therapeutische vraag is de uitgangsvraag vertaald naar een PICO of PIRO (patient, intervention, control/reference test, outcome). Aan het begin van het traject heeft de werkgroep per uitgangsvraag de patiëntrelevante uitkomstmaten vastgesteld. Deze uitkomstmaten zijn vervolgens geprioriteerd: ze werden gelabeld als cruciaal, belangrijk en niet-belangrijk.
Voor de onderwerpen die niet geselecteerd zijn, is de onderbouwing onveranderd overgenomen uit de vorige versie van de richtlijn/standaard.
Ontwikkelingsfase – uitgangsvragen met GRADE-beoordeling
Zoekstrategie en selectie van literatuur
Voor elke PICO voerde een medisch informatiespecialist van het NHG of het Kennisinstituut een literatuursearch uit. De gevonden literatuur is gescreend op basis van titel en abstract. De relevante literatuur werd geselecteerd en de volledige tekst van het artikel werd aangevraagd. De resultaten van de literatuurselectie van iedere PICO zijn samengevat in PRISMA-stroomdiagrammen.
In eerste instantie zijn systematische reviews (SR’s) en (buitenlandse) richtlijnen van goede kwaliteit gebruikt voor de beantwoording van de uitgangsvragen. De kwaliteit van de SR’s of van de samenvattingen van het wetenschappelijk bewijs die deel uitmaakten van een
richtlijn werd beoordeeld; alleen SR’s die aan enkele minimale eisen voldeden (componenten PICO beschreven; PICO aansluitend bij uitgangsvraag; systematische search uitgevoerd; geïncludeerde artikelen beschreven; recente zoekdatum) werden gebruikt.
Indien er voor een uitgangsvraag een geschikte SR werd gevonden, zijn aanvullend individuele onderzoeken van na de sluitingsdatum van de zoekactie van deze SR gescreend.
Indien er geen SR beschikbaar was, werd naar individuele onderzoeken gekeken, waarbij werd gefilterd op methodologie (bijvoorbeeld RCT’s bij interventievragen).
Samenvatting van het wetenschappelijke bewijs
Indien er voor een uitgangsvraag een geschikte SR werd gevonden, werd de samenvatting van het wetenschappelijk bewijs uit deze SR gebruikt. Anders werden de resultaten van individuele primaire onderzoeken samengevat. Indien mogelijk werden de resultaten gepoold. Van iedere geïncludeerde studie werd het risico op vertekening beoordeeld.
Beoordeling en gradering van het wetenschappelijke bewijs
Het beoordelen en graderen van het bewijs heeft plaatsgevonden met de GRADE-methode. GRADE beoordeelt de zogenoemde body of evidence: de verzameling van alle gevonden onderzoeken per uitkomstmaat. De onderverdeling van de kwaliteit van het wetenschappelijk bewijs kent 4 niveaus: hoog, redelijk, laag of zeer laag. Een hoge kwaliteit wil zeggen dat het geschatte en het werkelijke effect dicht bij elkaar liggen. Naarmate de kwaliteit van bewijs lager is, neemt de onzekerheid daarover toe (zie tabel 1).
Tabel 1 Definitie kwaliteit van bewijs
|
Kwaliteit |
Interpretatie |
|
Hoog |
Het werkelijke effect ligt dicht in de buurt van de schatting van het effect. |
|
Redelijk |
Het werkelijke effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
|
Laag |
Het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
|
Zeer laag |
We zijn onzeker over het werkelijke effect. |
Kwaliteit Interpretatie
Hoog Het werkelijke effect ligt dicht in de buurt van de schatting van het effect.
Redelijk Het werkelijke effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt.
Laag Het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect.
Zeer laag We zijn onzeker over het werkelijke effect.
Bij het beoordelen van het verschil in effecten tussen interventies is gelet op het bestaan van klinisch relevante verschillen tussen interventies. Daarvoor wordt bij voorkeur gelet op absolute verschillen (indien deze gegevens beschikbaar zijn). De werkgroep heeft per uitkomstmaat bepaald wat de grens voor een klinisch relevant verschil (voor- of nadeel) is.
Van bewijs naar aanbeveling (overwegingen).
Na de samenvatting en beoordeling van het wetenschappelijk bewijs volgt de vertaling van de resultaten naar aanbevelingen voor de praktijk, oftewel de zogenoemde vertaalslag ‘Van bewijs naar aanbeveling’. Ook praktische en contextuele factoren spelen een rol om tot goed toepasbare aanbevelingen te komen. De volgende zes factoren komen hierbij aan de orde:
- Voor- en nadelen
- Kwaliteit van bewijs
- Waarden en voorkeuren van patiënten
- Kosten (NB De werkgroep heeft geen formele kosteneffectiviteits- of budgetimpactanalyses gedaan)
- Aanvaardbaarheid
- Haalbaarheid en implementatie
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie tabel 2). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 2 Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Synthese van bewijs en opstellen van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE- methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Ontwikkelingsfase – overig
Voor een aantal modules/details is geen literatuursamenvatting of een literatuursamenvatting zonder GRADE-beoordeling opgenomen. Dit is het geval bij modules/details die meer achtergrondinformatie geven (epidemiologie, etiologie en pathofysiologie) of gericht zijn op de organisatie van zorg. Indien er wel een systematische zoekactie is uitgevoerd, dan vond er geen systematische selectie, beoordeling en gradering van de evidence plaats, maar is de literatuur narratief beschreven. Daarnaast worden er in de volledige tekst (NHG-Standaard) naast de aanbevelingen ook praktische adviezen gegeven die niet worden onderbouwd (in een detail), zoals de onderdelen anamnese, lichamelijk onderzoek, evaluatie, controles en verwijzingen. Deze teksten zijn – na discussie door de werkgroep – op basis van consensus tot stand gekomen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de
uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde PICO’s is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat er nog kennislacunes bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk. Om deze reden heeft de werkgroep per module aangegeven op welke vlakken nader onderzoek gewenst is. Hierbij heeft er een prioritering plaatsgevonden waarbij is uitgegaan van maximum van 5 lacunes. Deze kennislacunes zijn gepubliceerd op Lacunes & onderzoeken | NHG-Richtlijnen en als bijlage van de richtlijnmodules op de Richtlijnendatabase.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd in het voorjaar van 2022 aan de NHG-Autorisatiecommissie (NHG AC), de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar.
Twee leden van de NHG-Adviesraad Standaarden (NAS) hebben tijdens de commentaarronde de standaard beoordeeld. Tien huisartsen gaven via het HAweb- ledenforum commentaar op de NHG-Standaard.
De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd na bespreking voorgelegd aan de NHG AC, de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voor (bestuurlijke) goedkeuring en werd door hen geautoriseerd dan wel geaccordeerd.
Procedure voor herziening
Deze richtlijn wordt periodiek herzien. Uiterlijk in 2026 bepalen het NHG en de NVMDL of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van deze richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanpassing aan de aanbevelingen nodig maken, en daarmee aanleiding zijn om een herzieningstraject te starten.
