Behandeling parodontitis ter preventie van vroeggeboorte
Uitgangsvraag
Wat zijn de (on)gunstige effecten van het behandelen van een parodontitis preconceptioneel danwel tijdens de zwangerschap ter voorkoming van spontane vroeggeboorte bij eenling zwangerschap?
Aanbeveling
Bied in de zwangerschap geen behandeling aan voor parodontitis met als doel spontane vroeggeboorte te voorkomen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De uitgangsvraag richtte zich, naast de antenale behandeling van parodontitis, tevens op de preconceptionele behandeling hiervan. De veronderstelling hierbij van de richtlijnwerkgroep was dat het mogelijke behandelingseffect ter voorkoming van spontane vroeggeboorte groter zou zijn, naarmate de parodontitis in een vroeger (preconceptioneel) stadium behandeld wordt. Echter, er werden geen studies gevonden die de preconceptionele behandeling van parodontitis onderzochten.
Op basis van de beschreven literatuur over het behandelen van parodontitis tijdens de zwangerschap is de bewijskracht voor perinatale en neonatale uitkomsten laag tot zeer laag. De bewijskracht voor de vier gegradeerde uitkomstmaten was namelijk laag tot zeer laag (vroeggeboorte <37 weken; perinatale sterfte; sepsis; samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit). Voor het merendeel van de cruciale (vroeggeboorte <34 weken; vroeggeboorte <28 weken) en belangrijke uitkomstmaten was geen data beschikbaar (respiratoir distress syndroom; intraventriculaire bloeding; necrotiserende enterocolitis; neonatale sterfte).
De overall bewijskracht voor de cruciale uitkomstmaten is dan ook gegradeerd als zeer laag. RCTs beginnen op een hoog niveau van bewijskracht. Echter, bij de cruciale uitkomstmaat vroeggeboorte <37 weken was sprake van substantiële heterogeniteit en werd afgewaardeerd voor een hoog risico op bias. Daarbij werd geen bewijs gevonden voor twee van de drie cruciale uitkomstmaten. Tevens werd de overall bewijskracht voor de belangrijke uitkomstmaten als zeer laag gegradeerd. Voor de belangrijke uitkomstmaten werden geregeld weinig events gerapporteerd of betrouwbaarheidsintervallen van het (gepoolde) effect die zowel geen effect als een klinisch relevant effect omvatten (imprecisie). Voor vier van de zeven belangrijke uitkomstmaten werd geen bewijs gevonden.
Het is daarom, op basis van de literatuuranalyse, onduidelijk of behandeling van parodontitis gedurende de zwangerschap van invloed is op de perinatale en neonatale uitkomsten.
Beperkingen studies
Er was variatie in de gehanteerde definities van parodontitis tussen de studies. Bovendien werden zwangere vrouwen met een verschillende ernst van parodontitis geïncludeerd, variërend van mild tot ernstig. Tevens bestonden er verschillen tussen studies wat betreft de toegepaste parodontale behandeling. De Cochrane review van Iheozor-Ejiofor (2017) concludeert dat de antenale behandeling van parodontitis de parodontale gezondheid mogelijk lichtelijk verbeterd (onder andere pocketdiepte, verlies aan hechting). De basis van het theoretische effect van het behandelen van parodontis op vroeggeboorte, is de effectiviteit van de paradontale behandeling op de paradontale gezondheid. Echter, niet alle studies rapporteren data ten aanzien van parodontale gezondheidsuitkomsten.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Parodontitis kan meerdere gezondheidseffecten hebben. Het zal voor de algemene gezondheid van patiënten in hun voordeel zijn om deze te behandelen.
Kosten (middelenbeslag)
Tandartskosten vallen niet binnen de standaard verzekerde basiszorg. Daarmee zal het advies van tandartsbezoek leiden tot hogere kosten voor de vrouw met een kinderwens en een zwangere. Het bereiken van de juiste patiëntengroep zal een uitdaging zijn, mede gezien de associatie met sociaaleconomische status.
Aanvaardbaarheid, haalbaarheid en implementatie
Het is bij de algemene populatie, maar ook bij veel hulpverleners in de verloskundige zorgketen niet bekend dat parodontitis mogelijk een associatie heeft met slechte zwangerschapsuitkomsten. Uitleg zal daarom extra tijd kosten tijdens de prenatale zorg.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Uit de beperkte literatuur blijkt geen overtuigend bewijs voor het behandelen van parodontitis tijdens de zwangerschap ter preventie van vroeggeboorte, perinatale en neonatale uitkomsten. Verder zijn er hoogstwaarschijnlijk, gezien de bevindingen, geen nadelige effecten te verwachten van de behandeling van parodontitis voor of in de zwangerschap. Bij klachten kan men op basis van deze gegevens met een redelijke mate van zekerheid adviseren de klachten te behandelen, in elk geval in het kader van effect op vroeggeboorte en perinatale en neonatale uitkomsten. Het effect op andere obstetrische uitkomsten is hier niet onderzocht.
Onderbouwing
Achtergrond
Spontane vroeggeboorte is een multifactorieel proces. Er zijn aanwijzingen dat parodontitis geassocieerd is met een verhoogd risico op vroeggeboorte (Xiong 2006; Vergnes, 2007). Er zijn verschillende hypothesen genoemd voor de associatie tussen parodontitis en vroeggeboorte. Een hiervan is dat parodontitis leidt tot een milde bacteriemie die kan leiden tot een lokale foetoplacentaire ontsteking, een ander is dat inflammatoire reactie op de parodontitis een rol speelt. Een derde optie is dat zowel de tandvleesaandoeningen als de vroeggeboorte een uiting zijn van een individuele genetische predispositie die leidt tot een versterkte intrinsieke inflammatoire of immunologische respons die de aanleiding is tot beide aandoeningen.
Vooralsnog zijn er epidemiologische verbanden aangetoond (associatie); of er daarmee ook een causaal verband is, is niet duidelijk aangetoond.
Aangezien er minimaal een associatie is, werd onderzocht of het behandelen van een parodontitis leidt tot het voorkomen van vroeggeboorte.
Conclusies / Summary of Findings
|
Low GRADE |
Periodontal treatment during pregnancy may result in little to no difference in preterm birth <37 weeks
Sources: Iheozor-Ejiofor, 2017; Khairnar 2015; Reddy, 2014 |
|
Very low GRADE |
The evidence is very uncertain about the effect of treating periodontitis during pregnancy on perinatal death (included fetal and neonatal deaths up to the first 28 days after birth)
Sources: Iheozor-Ejiofor, 2017 |
|
Low GRADE |
Periodontal treatment during pregnancy may result in little to no difference in neonatal sepsis (necessitating antibiotics)
Sources: Newnham, 2009 |
|
Low GRADE |
Periodontal treatment during pregnancy may result in little to no difference in a composite outcome of neonatal morbidity and mortality*
*This outcome encompasses fetal demise after randomization, neonatal death before discharge, respiratory distress syndrome, proven sepsis, intraventricular hemorrhage grades III and IV, necrotizing enterocolitis requiring treatment, and congenital abnormalities. Sources: Offenbacher 2009 |
Samenvatting literatuur
Description of studies
Iheozor-Ejiofor (2017) performed a Cochrane review on the treatment of periodontal disease in order to prevent adverse outcomes in pregnant women. A literature search was conducted up to October 2016. Primary perinatal outcomes were gestational age at birth (preterm birth), birth weight, small for gestational age, and perinatal mortality. Inclusion criteria were randomised controlled trials (RCTs), including pregnant women considered to have periodontal disease (periodontitis or gingivitis) after dental examination, that compare antenatal periodontal treatments with no treatment or with alternative interventions. Fifteen RCTs were included in the qualitative synthesis of this Cochrane review.
In total, these 15 RCTs included 7161 pregnant women. Antenatal periodontal treatment consisted of scaling and root planing or scale and polish. Eleven studies compared antenatal periodontal treatment versus no treatment (i.e., postnatal periodontal treatment) (Farrell, 2003; Herrera, 2009; López, 2002; López, 2005; Michalowicz, 2006; Newnham, 2009; Offenbacher, 2009; Oliveira, 2011; Radnai, 2009; Sadatmansouri, 2006; Tarannum, 2007). Four studies compared antenatal periodontal treatment with an alternative periodontal treatment (a less intensive or complex intervention, i.e., superficial tooth cleaning procedure) (Jeffcoat, 2003; Macones, 2010; Offenbacher, 2006; Pirie, 2013). Fourteen studies included women with periodontitis, 1 study with gingivitis (López, 2005). The severity of the periodontitis ranged from moderate to severe and there was variation in definition of periodontitis across the studies. Participants were mostly in their first or second trimester. Nine studies reported baseline data on the proportion of participants with previous history of various adverse obstetric outcomes ranging from 3% to 55%.
Khairnar (2015) performed a single-centre RCT in rural India and included 100 pregnant women with periodontitis (periodontitis was defined as at least >20 erupted teeth, excluding third molars with >2 mm of clinical attachment loss (CAL) at >50% examine sites).
Further inclusion criteria were a maternal age between 17-35 years and a singleton pregnancy between 11 and 20 weeks. Exclusion criteria were: H/o congenital heart disease, diabetes mellitus, corticosteroid therapy, asthmatics, kidney disorder, hyperthyroidism, multiple gestation, +Rh factor, systemic infection, alcoholic, tobacco chewers, smokers,
and one with H/o periodontal therapy in last 6 months and on antibiotic or antifungal medication therapy. Women in the intervention group (n=50) received scaling and root planning performed under local anesthesia during the second trimester of their gestational period. At the beginning of treatment, each subject was instructed to rinse once a day with 0.2% chlorhexidine. Women in the control group (n=50) received no periodontal treatment during their gestational period. Only low socioeconomic status women participated in the study.
Reddy (2014) included 20 pregnant women with chronic periodontitis recruited from a single hospital in India. Chronic periodontitis was established based on clinical findings of gingival inflammation; loss of attachment 1 mm; probing pocket depth 4 mm at three to four sites in more than four teeth in each quadrant. Further inclusion criteria for this RCT were a maternal age between 18-35 years and a singleton pregnancy between 12 and 24 weeks. Exclusion criteria were: periodontal treatment within the previous 6 months, smoking, history of alcohol consumption, taking systemic medications, and systemic diseases or any other complications. Women in the intervention group (n=10) received phase-I periodontal
therapy before 28 weeks of gestational age. Women in the control group (n=10) only received oral hygiene instructions (considered as no intervention). Complete periodontal therapy was given after delivery
Results
Outcome measure 1: preterm birth <37 weeks
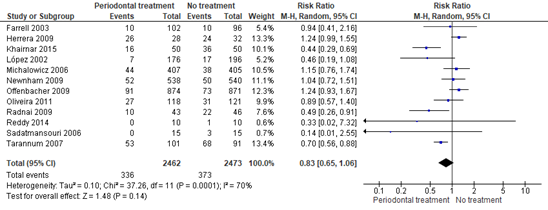
Ten RCTs that were included in the Cochrane review of Iheozor-Ejiofor (2017) compared periodontal treatment versus no treatment in pregnant women with periodontitis regarding the outcome measure preterm birth <37 weeks. The RCTs of Khairnar (2015) and Reddy (2014) also reported on the outcome preterm birth <37. Preterm birth <37 weeks was reported for 336 of 2462 (13.6%) infants of mothers receiving periodontal treatment compared to 373 of 2473 (15.1%) infants of mothers receiving no periodontal treatment (RR 0.83 (95% CI 0.65 to 1.06)) (Figure 1.1).
Figure 1.1. Preterm birth <37 weeks, comparison periodontal treatment versus no treatment during pregnancy
Outcome measure 2: early preterm birth <34 weeks
Preterm birth <34 weeks was not reported by the included studies (Iheozor-Ejiofor, 2017; Khairnar 2015; Reddy, 2014). Preterm birth <35 weeks was reported by two RCTs (Michalowicz 2006; Offenbacher 2009) included in the Cochrane review of Iheozor-Ejiofor (2017).
Outcome measure 3: extremely preterm birth <28 weeks
Preterm birth <28 weeks was not reported by the included studies (Iheozor-Ejiofor, 2017; Khairnar 2015; Reddy, 2014). Preterm birth <32 weeks was reported by three RCTs (Farrell, 2003; Michalowicz 2006; Offenbacher 2009) included in the Cochrane review of Iheozor-Ejiofor (2017).
Outcome measure 4: respiratory distress syndrome
The outcome measure respiratory distress syndrome was not reported (separately) by the included studies (Iheozor-Ejiofor, 2017; Khairnar 2015; Reddy, 2014). Respiratory distress syndrome was only reported as a component of a composite outcome measure of neonatal morbidity and mortality (see Outcome measure 10).
Outcome measure 5: intraventricular hemorrhage
The outcome measure intraventricular hemorrhage was not reported (separately) by the included studies (Iheozor-Ejiofor, 2017; Khairnar 2015; Reddy, 2014). Intraventricular hemorrhage grades III and IV was only reported as a component of a composite outcome measure of neonatal morbidity and mortality (see Outcome measure 10).
Outcome measure 6: necrotizing enterocolitis
The outcome measure necrotizing enterocolitis was not reported (separately) by the included studies (Iheozor-Ejiofor, 2017; Khairnar 2015; Reddy, 2014). Necrotizing enterocolitis (requiring treatment) was only reported as a component of a composite outcome measure of neonatal morbidity and mortality (see Outcome measure 10).
Outcome measure 7: neonatal sepsis
In the Cochrane review of Iheozor-Ejiofor (2017) one RCT was included (Newnham, 2009) reporting on the outcome neonatal sepsis (necessitating antibiotics) comparing periodontal treatment versus no treatment. Sepsis was reported for 25/538 (4.7%) infants of mothers receiving periodontal treatment versus 17/540 (3.1%) infants of mothers receiving not treatment (RR 1.48 (95% CI 0.81 to 2.70).
Outcome measure 8: neonatal death
The Cochrane review of Iheozor-Ejiofor (2017) reported on perinatal mortality, including fetal and neonatal deaths up to the first 28 days after birth (see outcome measure 9). The outcome measure neonatal death was not reported separately.
Outcome measure 9: perinatal death
In the Cochrane review of Iheozor-Ejiofor(2017) six trials were included comparing periodontal treatment versus no treatment in pregnant women with periodontitis on the outcome measure perinatal mortality. Perinatal mortality included fetal and neonatal deaths up to the first 28 days after birth according to the Cochrane review of Iheozor-Ejiofor.
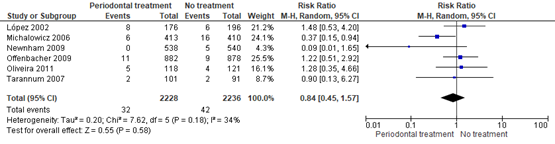
Perinatal mortality was reported for 32 of 2228 (1.4%) infants of mothers receiving periodontal treatment compared to 42 of 2263 (1.9%) infants of mothers receiving no periodontal treatment (RR 0.84 (95% CI 0.45 to 1.57)) (Figure 1.2).
Figure 1.2. Perinatal mortality (including fetal and neonatal deaths up to the first 28 days after birth), comparison periodontal treatment versus no treatment during pregnancy
Outcome measure 10: composite outcome of neonatal morbidity and mortality
In the Cochrane review of Iheozor-Ejiofor (2017) one trial was included (Offenbacher, 2009) comparing periodontal treatment versus no treatment on a composite outcome of neonatal morbidity and mortality. This outcome encompasses fetal demise after randomization, neonatal death before discharge, respiratory distress syndrome, proven sepsis, intraventricular hemorrhage grades III and IV, necrotizing enterocolitis requiring treatment, and congenital abnormalities. The composite of adverse outcomes was reported for 39/882 (4.4%) infants of mothers receiving periodontal treatment versus 41/878 (4.7%) infants of mothers receiving no periodontal treatment (RR 0.95 (95% CI 0.62 to 1.45)).
Level of evidence of the literature
Studies with a randomized, placebo-controlled design start at a high GRADE. The following six outcome measures were not reported: 1) preterm birth <34 weeks; 2) preterm birth <28 weeks; 3) respiratory distress syndrome; 4) intraventricular hemorrhage; 5) necrotizing enterocolitis; and 6) neonatal death.
The level of evidence regarding the outcome measure preterm birth <37 weeks was downgraded by two levels to a low GRADE because of risk of bias (high risk of bias due to imbalance in baseline characteristics) (-1) and inconsistency (substantial heterogeneity) (-1).
The level of evidence regarding the outcome measure perinatal death (included fetal and neonatal deaths up to the first 28 days after birth) was downgraded by three levels to a very low GRADE because of risk of bias (high risk of attrition and other bias due to early termination of trial) (-1) and imprecision (-2) (number of events was low: 32/2228 in the intervention group and 42/2263 in the control group. The 95% confidence interval of the effect includes no effect, a clinically relevant effect in favour for the intervention group, and a clinically relevant effect in favour for the control group).
The level of evidence regarding the outcome measure neonatal sepsis was downgraded by two levels to a low GRADE because of imprecision (-2) (one RCT and number of events was low: 25/538 in the intervention group and 17/540 in the control group. The 95% confidence interval of the effect includes no effect as well as a clinically relevant effect).
The level of evidence regarding the composite outcome of neonatal morbidity and mortality was downgraded by two levels to a low GRADE because of imprecision (-2) (one RCT and number of events was low: 39/882 in the intervention group and 41/878 in the control group. The 95% confidence interval of the effect includes no effect, a clinically relevant effect in favour for the intervention group, and a clinically relevant effect in favour for the control group).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favourable effects of the treatment of periodontitis during pregnancy or preconceptional in the prevention of spontaneous preterm birth in singleton pregnancies?
|
P: patients |
pregnant women or women planning to conceive with periodontitis |
|
I: intervention |
treatment of periodontitis |
|
C: control |
no treatment of periodontitis |
|
O: outcome measure |
preterm birth <37 weeks, preterm birth <34 weeks, preterm birth <28 weeks, respiratory distress syndrome, intraventricular heamorrhage, necrotizing enterocolitis, neonatal sepsis, neonatal death, perinatal death, composite outcome of neonatal morbidity and mortality |
Relevant outcome measures
The guideline development group considered preterm birth<37 weeks, preterm birth<34
weeks, and preterm birth <28 weeks as critical outcome measures for decision making;
and respiratory distress syndrome, intraventricular hemorrhage, necrotizing enterocolitis,
neonatal sepsis, neonatal death, perinatal death, and a composite outcome of neonatal
morbidity and mortality as important outcome measures for decision making.
A priori, the working group did not define the important outcome measures, but used the definitions used in the studies.
The working group defined a relative risk ≤0.9 or ≥1.1 as a minimal clinically important difference for preterm birth and ≤0.8 or ≥1.25 as a minimal clinically important difference for all other outcome measures.
Search and select (Methods)
A search was performed in the databases Medline (via OVID) and Embase (via Embase.com) to find the most recent literature published between 2010 and April 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 258 hits. Studies were selected based on the following criteria: 1) the study compared the treatment of periodontitis in pregnant women or women who have planned to conceive versus no treatment of periodontitis in pregnant women or women who have planned to conceive; 2) at least one of the predefined outcome measures was reported. Eighteen studies were initially selected based on title and abstract screening. After reading the full text, 15 studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies were included in the analysis of the literature: one Cochrane review Iheozor-Ejiofor (2017) and two RCTs (Khairnar, 2015; Reddy, 2014). Important study characteristics and results are summarized in the evidence tables. All studies only included pregnant women, no studies included women planning to conceive with periodontitis. The assessment of the risk of bias is summarized in the risk of bias tables. The risk of bias assessment of Iheozor-Ejiofor (2017) was adopted.
Referenties
- Iheozor-Ejiofor Z, Middleton P, Esposito M, Glenny AM. Treating periodontal disease for preventing adverse birth outcomes in pregnant women. Cochrane Database Syst Rev. 2017;6(6):CD005297. Published 2017 Jun 12. doi:10.1002/14651858.CD005297.pub3
- Khairnar MS, Pawar BR, Marawar PP, Khairnar DM. Estimation of changes in C-reactive protein level and pregnancy outcome after nonsurgical supportive periodontal therapy in women affected with periodontitis in a rural set up of India. Contemp Clin Dent. 2015;6(Suppl 1):S5-S11. doi:10.4103/0976-237X.152930
- Reddy BV, Tanneeru S, Chava VK. The effect of phase-I periodontal therapy on pregnancy outcome in chronic periodontitis patients. J Obstet Gynaecol. 2014;34(1):29-32. doi:10.3109/01443615.2013.829029
- Vergnes JN, Sixou M. Preterm low birth weight and maternal periodontal status: a meta-analysis. Am J Obstet Gynecol. 2007 Feb;196(2):135.e1-7. doi: 10.1016/j.ajog.2006.09.028. PMID: 17306654.
- Xiong X, Buekens P, Fraser WD, Beck J, Offenbacher S. Periodontal disease and adverse pregnancy outcomes: a systematic review. BJOG. 2006 Feb;113(2):135-43. doi: 10.1111/j.1471-0528.2005.00827.x. PMID: 16411989.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Iheozor-Ejiofor, 2017 |
Yes |
Yes |
Yes |
No, relevant confounders not reported |
Not applicable |
Yes |
Yes |
Yes |
Yes |
Risk of bias assessment
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Derived from the Cochrane review of Iheozor-Ejiofor (2017):
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Khairnar, 2015 |
Random assignment of patients to treatment and control group. Method of randomisation is not further described.
|
Unclear
Randomisation method was not described
|
Likely
Blinding of participants impossible because of type of intervention (mechanical treatment of periodontitis)
|
Likely
Blinding not feasible |
Unlikely
Objective outcome measures (preterm birth; low birth weight; serum C-reactive protein levels)
|
Unlikely
Study protocol not available. Outcomes listed in the methods section are similar with those in the results section.
|
Unlikely
No loss to follow-up was reported
|
Unclear
Not mentioned in the methods section of Khainar.
|
|
Reddy, 2014 |
Grouping of the subjects was done randomly. Method of randomisation is not further described. |
Unclear
Randomisation method was not described
|
Likely
Blinding of participants impossible because of type of intervention (mechanical treatment of periodontitis)
|
Likely
Blinding not feasible |
Unlikely
Objective outcome measures (preterm birth; low birth weight; cord blood samples tested for IgM and IgG) |
Unlikely
Study protocol not available. Outcomes listed in the methods section are similar with those in the results section.
|
Unlikely
No loss to follow-up was reported
|
Unclear
Not mentioned in the methods section of Reddy.
|
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Bi 2019 |
Systematic review and meta-analysis of less quality than the Cochrane review 2017. Most recent RCTs included published in 2015. |
|
Caneiro-Queija 2019 |
Not conform PICO (wrong comparison: peridontal treatment versus alternative periodontal treatment) |
|
Da Silva 2017 |
Focus on inflammatory biomarkers |
|
Gilbert 2010 |
Wrong study type (infoPOEMs) |
|
Govindasamy 2020 |
Systematic review, no meta-analysis. Of less quality than the Cochrane review 2017. Most recent RCTs included published in 2015. |
|
Jeffcoat 2011a |
Wrong treatment (the study compared antimicrobial mouthrinse with no mouthrinse in women wo refused mechanical dental care during pregnancy: antimicrobial mouthrinse alone is not considered a periodontal treatment). |
|
Jeffcoat 2011b |
Overlap with an included study (Jeffcoat 2003) and does not contain useful additional information to supplement the primary publication (in exclusion table Cochrane review 2017) |
|
Jiang 2016 |
The study compared antimicrobial mouthrinse with toothbrushing. Antimicrobial mouthrinse alone is not considered a periodontal treatment (in exclusion table Cochrane review 2017). |
|
Macones 2010 |
Not conform PICO (wrong comparison: periodontal treatment versus alternative periodontal treatment) |
|
Merchant 2018 |
Re-analysis of the data of Michalowicz 2006. Michalowicz is included in the Cochrane review 2017 |
|
Lopez 2015 |
Systematic review of meta-analyses: older than Cochrane review 2017 |
|
Oliveira 2011 |
RCT included in Cochrane review 2017 |
|
Pirie 2013 |
Not conform PICO (wrong comparison: periodontal treatment versus alternative periodontal treatment) |
|
Sant'ana 2011 |
There was no randomisation (patients who did not agree in receiving non-surgical periodontal treatment during pregnancy composed the "no intervention group") |
|
Weidlich 2013 |
Not conform PICO (pregnant women regardless of their periodontal status; in exclusion table Cochrane review 2017) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-02-2025
Beoordeeld op geldigheid : 20-11-2024
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor zwangere vrouwen zonder klinische verschijnselen van een vroeggeboorte, die al dan niet in een eerdere zwangerschap een spontane vroeggeboorte hebben doorgemaakt.
Werkgroep
- Prof. dr. M.A. Oudijk, gynaecoloog, NVOG (voorzitter)
- Dr. N. Horree, gynaecoloog, NVOG
- Dr. J.B. Derks, gynaecoloog, NVOG
- Dr. T.A.J. Nijman, gynaecoloog, NVOG
- Dr. F. Vlemmix, gynaecoloog, NVOG
- Dr. D.A.A. van der Woude, gynaecoloog, NVOG
- L.T. Brammerloo-Read, MSc, verloskundige, KNOV
- Dr. M.A.C. Hemels, kinderarts-neonatoloog, NVK
- F.A.B.A. Schuerman, MSc, kinderarts-neonatoloog, NVK
- J.D.M. Wagemaker, patiëntenvereniging, Care4Neo
Met ondersteuning van:
- Dr. L. Viester, adviseur, Kennisinstituut van Medisch Specialisten (tot augustus 2022)
- T. Geltink, MSc, adviseur, Kennisinstituut van Medisch Specialisten (vanaf augustus 2022)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. M.A. Oudijk |
Gynaecoloog |
Voorzitter Pijler FMG van de NVOG, onbetaald, alleen vacatiegelden. Voorzitter wetenschapscommissie pijler FMG, onbetaald. Member of the board of the foundation 'Stoptevroegbevallen'; a non-profit foundation with the purpose to raise funds for research projects on preterm labour/birth, onbetaald. Member of the scientific committee of the 'Fonds Gezond Geboren', a non-profit foundation with the purpose to raise funds for reserarch projects on preterm birth and placental insufficiency, onbetaald. Member of the advisory board of the N3, the Dutch Neonatology research network, onbetaald. President of the European Spontaneous Preterm Birth Congress to be held in Haarlem, The Netherlands, www. espbc.eu, onbetaald |
2015 ZonMW836041012 The effect of tocolysis with nifedipine or atosiban on infant development: the APOSTEL III follow-up study. € 43,772. 2015 ZonMW 836041006 Low dose aspirin in the prevention of recurrent spontaneous preterm labour: the APRIL study € 351.898. 2016 Zon|MW 80-84800-98-41027 Atosiban versus placebo in the treatment of late threatened preterm labour: the APOSTEL VIII study € 1.393.639. Hoofdaanvrager/projectleider van deze vroeggeboorte studies. Subsidie wordt alleen aangewend ten behoeve van het onderzoek, promoventi etc. Geen persoonlijke salariëring vanuit deze ZonMw studie |
geen restricties |
|
Dr. N. Horree |
Gynaecoloog |
geen |
Participatie binnen ziekenhuis aan consortium studies vanuit de NVOG. Hieronder vallen ook onderzoek naar vroeggeboorte (o.a. Apnel studies) en preventie vroeggeboorte (April). QP PC - studies |
geen restricties |
|
Dr. J.B. Derks |
Gynaecoloog |
Lid bestuur werkgroep perinatologie en maternale ziektes (onbetaald); Lid otterlo groep (Cie. Ontwikkeling richtlijnen obstetrie) (onbetaald) |
Deelname consortiumstudies waaronder de April studie |
geen restricties |
|
T.A.J. Nijman |
Gynaecoloog |
Lid Commissie Gynaecongres, VAGO-vertegenwoordiger, onbetaald; Lid Koepel Wetenschap. VAGO-vertegenwoordiger, onbetaald |
Project groep April studie, ZonMW gesponsorde Consortium studie naar aspirine vs placebo bij preventie herhaalde vroeggeboorte. |
geen restricties |
|
Dr. F. Vlemmix |
Gynaecoloog |
Lid werkgroep patiëntcommunicatie NVOG |
geen |
geen restricties |
|
Dr. D.A.A. van der Woude |
Gynaecoloog & postdoc |
geen |
geen |
geen restricties |
|
L.T. Brammerloo-Read |
Verloskundige |
geen |
De praktijk + kliniek waarin werkzaam heeft deelname in cervix-meting van patiënten om vroeggeboorte op te kunnen sporen, hierbij geen financieel belang. |
geen restricties |
|
Dr. M.A.C. Hemels |
Kinderarts-neonatoloog |
Faculty cursus antibiotica bij kinderen, betaald |
Deelname APRIL studie, meelezen protocol betreffende de neonatale uitkomst maten |
geen restricties |
|
F.A.B.A. Schuerman |
Kinderarts-neonatoloog |
Bestuurslid stichting kindersedatie Nederland (betaald) |
geen |
geen restricties |
|
J.D.M. Wagemaker |
Patiëntvertegenwoordiger care |
geen |
geen |
geen restricties |
Inbreng patiëntenperspectief
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntenfederatie Nederland, Stichting Kind en Ziekenhuis en Vereniging Ouders Couveusekinderen voor de schriftelijke knelpunteninventarisatie en een afgevaardigde patiëntenvereniging in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland, Stichting Kind en Ziekenhuis en Vereniging Ouders Couveusekinderen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor zwangere vrouwen zonder klinische verschijnselen van een vroeggeboorte, die al dan niet in een eerdere zwangerschap een spontane vroeggeboorte hebben doorgemaakt. Tevens zijn er knelpunten aangedragen door Patiëntenfederatie Nederland, Verpleegkundigen & Verzorgenden Nederland, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging voor Medische Microbiologie, LAREB, Nederlandse Vereniging voor Klinische Fysica, Kind en Ziekenhuis via een schriftelijke knelpunteninventarisatie .
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
What are the (un)favourable effects of the treatment of periodontitis during pregnancy or preconceptional in the prevention of spontaneous preterm birth in singleton pregnancies? |
|
|
Database(s): Medline, Embase |
Date: 14-4-2020 |
|
Publication date range: 2010 – April 2020 |
Languages: English |
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Obstetric Labor, Premature/ or ((labo*r or delivery or parturition or birth) adj3 (premature or preterm or 'pre term' or early or prior)).ti,ab,kw. (59855) 2 exp Periodontics/ or exp Periodontal Diseases/ or periodont*.ti,ab,kf. or paradontitis.ti,ab,kf. or parodontitis.ti,ab,kf. or peridontitis.ti,ab,kf. or gingivitis.ti,ab,kf. (125319) 3 1 and 2 (688) 4 limit 3 to (english language and yr="2016 -Current") (124) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (441020) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1970026) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3408080) 8 4 and 5 (13) 9 (4 and 6) not 8 (11) 10 (4 and 7) not (8 or 9) (47) 11 4 not (8 or 9 or 10) (53) 12 8 or 9 or 10 or 11 (124) |