Verlaging valrisico ouderen in ziekenhuis
Uitgangsvraag
Welke valrisico verlagende interventies zijn effectief bij ouderen in het ziekenhuis?
Aanbeveling
Verricht bij ouderen in het ziekenhuis met een verhoogd valrisico een multifactoriële interventie gericht op geïdentificeerde valrisicofactoren.
Verwerk in de multifactoriële interventie de positief gescoorde valrisicofactoren en overweeg minimaal de volgende items:
- intensief bewegingsprogramma (minimaal één keer per dag), bij voorkeur onder begeleiding van de fysiotherapeut of oefentherapeut;
- voedingsinterventie (extra eiwitten, calorieën en vitaminen);
- medicatie afbouw op basis van medicatiebeoordeling;
- kennisoverdracht aan patiënten.
Ook organisatie- en omgevingsgerichte interventies kunnen onderdeel uitmaken van een multifactoriële interventie.
Gebruik echter niet enkel interventies gericht op organisatie- en omgevingsgerichte risicofactoren om valincidenten bij ouderen in het ziekenhuis te voorkomen.
Overwegingen
Tijdens ziekenhuisopname hebben ouderen een hoger risico om te vallen dan in de thuissituatie. Dit wordt gedeeltelijk veroorzaakt door nieuw verworven risicofactoren (zoals acute ziekte, delier, verminderde mobiliteit en medicatie) en een onbekende omgeving, waardoor de persoons-omgevingsinteractie verandert. Vaak wordt een valpartij veroorzaakt door een samenspel van meerdere factoren en is het achteraf moeilijk te bepalen welke factor de belangrijkste bijdrage tot een val heeft geleverd.
De afgelopen jaren zijn er meerdere interventies ontwikkeld om valincidenten in het ziekenhuis te reduceren. Deze interventies kunnen grofweg worden verdeeld in twee groepen: omgevings- en organisatiegerichte interventies (zoals gebruik van alarmering, voorlichting/educatie aan personeel en aandacht voor de omgeving) en interventies gericht op de individu (zoals oefenprogramma’s, medicatiereview, voedings- en vitamine interventies en multifactoriële interventies). In multifactoriële interventies kunnen zowel interventies gericht op de omgeving en de organisatie van het ziekenhuis als interventies gericht op individuele risicofactoren aan bod komen.
Er is onvoldoende bewijs dat een interventie alleen gericht op de omgeving en/of de organisatie van een ziekenhuis voldoende is om valincidenten te voorkomen. Dit komt overeen met de resultaten van een recent gepubliceerde trial (Barker, 2016). Deze studie is gepubliceerd nadat de literatuursearch voor de richtlijn al verricht was en kon derhalve niet meer in de resultaten meegenomen worden. Dit is de grootste studie die ooit verricht is met betrekking tot valpreventie in het ziekenhuis. Het betreft een Australische studie die uitgevoerd is bij ruim 46.000 patiënten die opgenomen waren op een chirurgische of interne geneeskunde afdeling. De patiënten werden gerandomiseerd in twee groepen. De interventiegroep kreeg een programma bestaande uit zes algemene interventies gericht op de omgeving en/of de organisatie van het ziekenhuis: “falls alert sign”, toezicht bij bezoek aan de badkamer, loophulpmiddel binnen bereik, toiletschema, gebruik van een laagbed en gebruik van een alarm. De controlegroep kreeg de gebruikelijke zorg. Na een onderzoeksperiode van 1 jaar was er geen verschil in het aantal valincidenten of valgerelateerde verwondingen tussen beide groepen (Incidence Rate Ratio (IRR) 1,04 95%BI: 0,78 tot 1,37 en IRR 0,96 95%BI: 0,72 tot 1,27, respectievelijk).
Studies gericht op de belangrijkste individuele risicofactoren bleken wel effectief te zijn in het voorkomen van valincidenten. Dit betreft de volgende vier verschillende interventies:
- medicatie review;
- intensieve oefentherapie (minimaal 1 keer per dag);
- voedingsinterventie (bestaande uit extra eiwitten, calorieën en vitamines);
- kennisoverdracht aan patiënten.
Hoewel bovenstaande enkelvoudige interventie studies een positief effect hebben op het voorkomen van valincidenten, zijn in de praktijk de meeste valincidenten multifactorieel bepaald. Het lijkt daarom logischer om voor de meeste patiënten een geïndividualiseerde multifactoriële valinterventie in te zetten. Het is wel aan te bevelen om de bovenstaande enkelvoudige interventies onderdeel te laten uitmaken van een multifactoriële interventie. Het is nog onduidelijk uit welke onderdelen het ideale multifactoriële valpreventieprogramma zou moeten bestaan. Gezien het feit dat er zeer veel risicofactoren en oorzaken voor vallen zijn, zijn er dus ook vele mogelijkheden voor interventies. Vaak maken interventies gericht op de omgeving en/of de organisatie van een ziekenhuis ook onderdeel uit van een multifactoriële interventie. Hierbij kun je ook denken aan instructies en oefenen van de dagelijkse handelingen binnen deze omgeving (bijvoorbeeld in overleg met een ergotherapeut). De interventies die gebruikt zijn in de bestaande multifactoriële valpreventieprogramma’s, kunnen worden onderverdeeld in de volgende factoren: valrisicobeoordeling; voorlichting aan verpleging en patiënten; aanpassen omgeving en het handelen van de patient in relatie tot de omgeving; aandacht voor toiletgebruik; interventies gericht op het verbeteren van de mobiliteit; interventies gericht op verwardheid/verminderde cognitie; aanpassen medicatie en overige maatregelen. Houd bij het inzetten van de interventies ook rekening met de wensen van de patiënt. Een multifactorieel valpreventie programma wordt bij voorkeur opgesteld en uitgevoerd door een multidisciplinair team bestaande uit een arts, een verpleegkundige, een fysiotherapeut/oefentherapeut en op indicatie ook een ergotherapeut en een diëtiste.
Vrijheidsbeperkende maatregelen, zoals een positioneringsband of bedhekken, worden regelmatig toegepast in het ziekenhuis bij patiënten met een verhoogd valrisico die een verminderd ziekte-inzicht, verward en/of geagiteerd zijn. Eerdere studies laten zien dat het gebruik van vrijheidsbeperkende maatregelen teruggedrongen kan worden zonder dat het aantal valincidenten toeneemt (Enns, 2014; Sze, 2012). Bovendien kan het gebruik van vrijheidsbeperkende maatregelen negatieve effecten voor de patiënt hebben. Dit soort maatregelen worden dan ook niet aanbevolen om het aantal valincidenten in het ziekenhuis te verminderen. Wel kunnen eventueel alternatieve maatregelen bij deze doelgroep ingezet worden, zoals lage bedden, de patiënt dichter naar de zusterpost verplaatsen, een individueel rust-activiteitenprogramma, assistentie van de familie, regelmatig naar het toilet gaan, aanpassingen in de omgeving, enzovoort. Er is echter geen bewijs dat hiermee valincidenten voorkomen kunnen worden.
Over de preventie van de gevolgen van vallen (met name fracturen) in het ziekenhuis is weinig bekend. Zo is er nog geen onderzoek verricht naar het gebruik van heupbeschermers in het ziekenhuis. Ook de rol van de fysiotherapeut of oefentherapeut bij de preventie van de gevolgen van een val in een ziekenhuis is op dit moment nog onduidelijk. Mogelijk dat calcium en vitamine suppletie of de inzet van een multifactoriële interventie een rol kunnen spelen bij het verlagen van het fractuurrisico in het ziekenhuis (Burleigh 2007, Cameron 2012). Nader onderzoek in de toekomst zal hier meer gegevens over moeten geven.
Daarnaast is het belangrijk nazorg te regelen voor ouderen patiënten in het ziekenhuis met een verhoogd valrisico. Het valrisico is de eerste maanden na ontslag verhoogd door de onderliggende ziekte en de behandeling daarvan (ref Hill et al.). Het is belangrijk om daar in de thuissituatie aandacht voor te hebben. Vermeld het verhoogde valrisico daarom in de overdracht aan de vervolgbehandelaar en overweeg de ingezette interventies in het ziekenhuis in de thuissituatie te continueren. Dit onderwerp zal verder uitgewerkt worden in de module ‘Organisatie van zorg bij valpreventie ouderen’ betreffende organisatie van zorg.
Onderbouwing
Achtergrond
Valincidenten zijn de meest voorkomende reden voor incidentmeldingen in het ziekenhuis. Ongeveer 35% van de valincidenten in het ziekenhuis leidt tot een verwonding (Healey, 2008). Deze verwondingen kunnen variëren van hematomen en kneuzingen tot hoofdletsel en botfracturen. Vooral bij ouderen kan een val leiden tot angst om nogmaals te vallen, waardoor men minder gaat mobiliseren en toenemend afhankelijk wordt, wat verdere hospitalisatie tot gevolg kan hebben. Andere negatieve gevolgen kunnen bestaan uit langere opnameduur, vaker uitplaatsing naar verzorgings- of verpleeghuizen, de noodzakelijkheid van extra diagnostische procedures en eventueel ook chirurgisch ingrijpen. Al deze gevolgen van vallen zorgen er ook voor dat de kosten van valincidenten voor de gezondheidszorg hoog zijn.
Het is daarom belangrijk om valincidenten in het ziekenhuis te voorkomen. Het is echter nog onduidelijk welke interventies het beste kunnen worden ingezet om valincidenten te voorkomen.
Conclusies / Summary of Findings
1. Lichamelijke oefeningen versus fysiotherapie
Aantal vallers
|
Zeer laag GRADE |
Additionele lichamelijke oefeningen naast reguliere fysiotherapie bij oudere patiënten in het ziekenhuis leidde tot een afname in het aantal patiënten dat valt vergeleken met reguliere fysiotherapie.
Bronnen (Donald, 2000; Jarvis, 2007) |
Valfrequentie
|
Zeer laag GRADE |
Het is noch aan te tonen noch uit te sluiten dat additionele lichamelijke oefeningen naast reguliere fysiotherapie leidde tot een afname in de valfrequentie vergeleken met reguliere fysiotherapie in oudere patiënten opgenomen in het ziekenhuis. |
2. Vitamine D supplementen versus geen vitamine D supplementen
Aantal vallers
|
Zeer laag GRADE |
Er is mogelijk geen verschil in het aantal patiënten dat valt bij gebruik van vitamine D (800 IU) en calcium (1200 mg) of alleen calcium (1200 mg) in oudere patiënten opgenomen in het ziekenhuis.
Bronnen (Burleigh, 2007) |
Valfrequentie
|
Zeer laag GRADE |
Het is noch aan te tonen noch uit te sluiten dat vitamine D (800 IU) en calcium (1200 mg) leidde tot een afname in het risico op een fractuur vergeleken met calcium (1200 mg) in oudere patiënten opgenomen in het ziekenhuis.
Bronnen (Burleigh, 2007) |
3. Omgevingsinterventies versus reguliere zorg
Aantal vallers
|
Geen GRADE |
Vanwege het verschil in de aard van de toegepaste omgevingsinterventies in de verschillende studies kan er geen conclusie worden getrokken over het effect van omgevingsinterventies op het aantal patiënten dat valt in het ziekenhuis.
Bronnen (Donald, 2000; Mayo, 1994; Sahota, 2014; Tideiskaar, 1993) |
Valfrequentie
|
Geen GRADE |
Vanwege het verschil in de aard van de toegepaste omgevingsinterventies kan er geen conclusie worden getrokken over het effect van omgevingsinterventies op de valfrequentie bij ziekenhuispatiënten.
Bronnen (Donald, 2000; Haines, 2010; Mayo, 1994; Sahota, 2014; Shorr, 2012) |
Botbreuken
|
Geen GRADE |
Vanwege het lage aantal patiënten met een botbreuk als gevolg van een val kan er geen conclusie getrokken worden over het risico op een fractuur bij ziekenhuispatiënten bij een omgevingsinterventie.
Bronnen (Sahota, 2014; Shorr, 2012) |
4. Organisatiegerichte interventies versus controle
Aantal vallers
|
Geen GRADE |
Vanwege het verschil in interventies gericht op de organisatie van zorg kan er geen conclusie worden getrokken over het aantal patiënten dat valt tijdens een ziekenhuisopname.
Bronnen (Dykes, 2010; Mador, 2004) |
Valfrequentie
|
Geen GRADE |
Vanwege het verschil in interventies gericht op de organisatie van zorg kan er geen conclusie worden getrokken over de valfrequentie tijdens een ziekenhuisopname.
Bronnen (Dykes, 2010; Koh, 2009; Van Gaal, 2011; Wald, 2011) |
5. Kennisoverdracht/scholing interventies versus reguliere zorg
Aantal vallers
|
Matig GRADE |
Het geven van individueel afgestemde educatie over valrisico aan patiënten opgenomen in het ziekenhuis verlaagt het aantal patiënten dat valt vergeleken met reguliere zorg.
Bronnen (Ang, 2011; Hill, 2013) |
Valfrequentie
|
Geen GRADE |
Vanwege een verschil in de wijze waarop kennis over valrisico was overgedragen en het gebruikte materiaal kan er geen conclusie worden getrokken over valfrequentie tijdens ziekenhuisopname.
Bronnen (Haines, 2011; Hill, 2015) |
Botbreuken
|
Geen GRADE |
Vanwege te weinig gegevens kan geen conclusie getrokken worden over het risico op een fractuur bij het geven van informatie over valrisico tijdens ziekenhuisopname.
Bronnen (Hill, 2015; Hill, 2013) |
6. Multifactoriële interventies
Aantal vallers
|
Laag GRADE |
Multifactoriële interventies vergeleken met reguliere zorg verlaagt mogelijk het aantal patiënten dat valt onder oudere patiënten opgenomen in het ziekenhuis.
Bronnen (Cumming, 2008; Haines, 2004; Stenvall, 2007) |
Valfrequentie
|
Laag GRADE |
Valfrequentie in oudere patiënten in het ziekenhuis die multifactoriële interventies kregen is verlaagd vergeleken met reguliere zorg.
Bronnen (Cumming, 2008; Haines, 2004; Healey, 2004; Stenvall, 2007) |
Botbreuken
|
Laag GRADE |
Multifactoriële interventies bij oudere patiënten in het ziekenhuis leidden mogelijk tot een afname in het risico op een fractuur vergeleken met reguliere zorg.
Bronnen (Cumming, 2008; Haines, 2004; Stenvall, 2007) |
7. Medicatie beoordeling versus reguliere zorg
Aantal vallers
|
Laag GRADE |
Beoordelen van medicatie wat betreft het gebruik van valrisico verhogende of verlagende medicatie verlaagt het aantal patiënten dat valt onder oudere patiënten opgenomen in het ziekenhuis vergeleken met reguliere zorg.
Bronnen (Michalek, 2014; Sjoberg, 2013) |
Valfrequentie
|
Laag GRADE |
Beoordelen van medicatie wat betreft het gebruik van valrisico verhogende of verlagende medicatie verlaagt de valfrequentie bij oudere patiënten opgenomen in het ziekenhuis vergeleken met reguliere zorg.
Bron (Michalek, 2014) |
Botbreuken
|
Laag GRADE |
Beoordelen van medicatie wat betreft het gebruik van valrisico verhogende of verlagende medicatie lijkt geen effect te hebben op het risico op een fractuur bij oudere patiënten opgenomen in het ziekenhuis vergeleken met reguliere zorg.
Bron (Sjoberg, 2013) |
8. Voedingstherapie versus reguliere zorg
Aantal vallers
|
Zeer laag GRADE |
Een interventie gericht op voeding bij oudere patiënten opgenomen in het ziekenhuis verlaagt het aantal patiënten dat valt vergeleken met reguliere zorg.
Bron (Neelemaat, 2012) |
Samenvatting literatuur
Beschrijving Cochrane review
Cameron (2012) ondernam een systematische literatuur zoekactie naar de effecten van interventies ter preventie van vallen in ouderen patiënten wonend in een zorginstelling of opgenomen in een ziekenhuis. De zoekactie was in maart 2012 uitgevoerd. In totaal waren 60 trials met 60.345 deelnemers geïncludeerd. Voor het beantwoorden van deze vraag wordt alleen data van interventies in een ziekenhuispopulatie beschreven. 17 trials met 29.972 deelnemers betrof een ziekenhuispopulatie. De volgende interventies ter preventie van vallen zijn beschreven in de Cochrane review:
- lichamelijke oefeningen versus fysiotherapie;
- vitamine D supplementen versus geen vitamine D supplementen;
- omgevingsinterventies versus reguliere zorg;
- sociale omgeving versus controle;
- kennisoverdracht/scholing interventies versus reguliere zorg;
- multifactoriële interventies.
Beschrijving nieuwe studies
Uit de update van de Cochrane review werden acht nieuwe trials geïncludeerd. In totaal beschreven zes trials data van 2572 deelnemers, één trial data van 3606 opnames in het ziekenhuis en één trial data van acht verpleegafdelingen. Vijf van de acht geïncludeerde trials hebben interventies geëvalueerd ook beschreven in de Cochrane review; twee trials vergeleken omgevingsinterventies met reguliere zorg, twee trials bekeken het effect van kennisoverdracht/scholing versus reguliere zorg en één trial evalueerde een multifactoriële interventie. Drie trials hebben interventies bestudeerd die nog niet eerder waren bestudeerd. De volgende interventies waren aan de review toegevoegd:
- medicatie beoordeling versus reguliere zorg;
- voedingsondersteuning versus reguliere zorg.
De resultaten van de update zullen tezamen met de al reeds gepubliceerde data uit de Cochrane review van (Cameron, 2012) per interventie worden beschreven.
Interventies ter preventie van vallen
1. Lichamelijke oefeningen versus fysiotherapie
De update van (Cameron, 2012) vond geen trials met lichamelijke oefeningen als interventie. Twee trials (Donald, 2000; Jarvis, 2007) evalueerden het effect van additionele lichamelijke oefeningen naast reguliere fysiotherapie op het valrisico. Donald (2000) gaf zittende patiënten versterkende been oefeningen bovenop functioneel gebaseerde fysiotherapie één of twee maal per dag. Jarvis (2007) vergeleek tien fysiotherapeutische sessies per week met drie sessies per week waarbij fysiotherapie strekoefeningen, beenoefeningen en balans en loopactiviteiten betrof.
Resultaten
I. Vallen
I.I Het aantal vallers
Gepoolde data van deze twee trials met in totaal 83 deelnemers liet een effect zien van lichamelijke oefeningen bovenop fysiotherapie. Het aantal patiënten dat valt was 64% lager in de interventiegroep vergeleken met de controlegroep (RR 0,36 95%BI: 0,14 tot 0,93).
Figuur 1
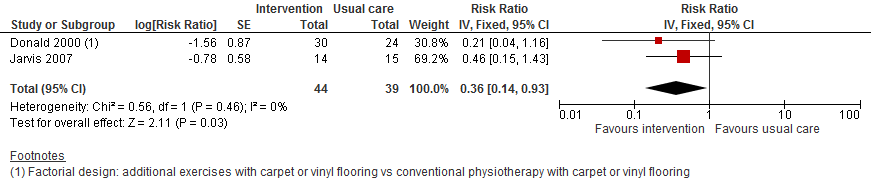
II. Valfrequentie
Donald (2000) observeerde een mogelijke verlaging in valfrequentie van 46% (RR 0,54 95%BI: 0,16 tot 1,81) met een breed betrouwbaarheidsinterval.
III. Botbreuken
Donald (2000) en Jarvis (2007) rapporteerden geen data over botbreuken.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vallen (het aantal patiënten dat valt en valfrequentie) is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het geringe aantal patiënten (imprecisie).
2. Vitamine D supplementen versus geen vitamine D supplementen
De review van (Cameron, 2012) vond één trial die als interventie vitamine D supplementen onderzocht. De update vond geen additionele trials. (Burleigh, 2007) onderzochten of 800 IU van vitamine D met 1200 mg calcium supplementen het valrisico verlagen vergeleken met alleen 1200 mg calcium supplementen in ziekenhuispatiënten.
Resultaten
I. Vallen
I.I Het aantal vallers
Burleigh (2007) observeerden geen verschil in het aantal patiënten dat valt tussen patiënten die vitamine D (800 IU) met calcium (1200 mg) kregen vergeleken met patiënten die alleen calcium (1200 mg) kregen (RR 0,82, 95%BI: 0,59 tot 1,14).
Figuur 2
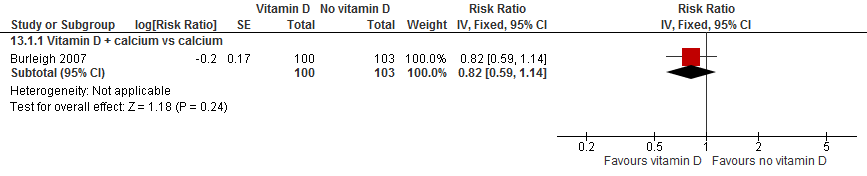
II. Valfrequentie
Burleigh (2007) rapporteerden geen data over de valfrequentie.
III. Botbreuken
Burleigh (2007) observeerden een mogelijke verlaging in het risico op een fractuur in patiënten die vitamine D en calcium kregen versus alleen calcium (RR 0,34 95%BI: 0,04 tot 3,05). Echter, vanwege het brede betrouwbaarheidsinterval is geen effect of een verhoogde risico op botbreuken niet uit te sluiten.
Figuur 3
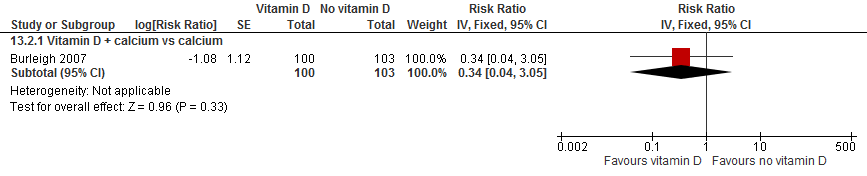
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten vallen (het aantal patiënten dat valt) en fracturen zijn met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het geringe aantal patiënten (imprecisie).
3. Omgevingsinterventies versus reguliere zorg
In de Cohrane review van (Cameron, 2012) hebben vier trials omgevingsinterventies vergeleken met reguliere zorg (Donald, 2000; Haines, 2010; Mayo, 1994; Tideiksaar, 1993). Donald (2000) vergeleken vloerbedekking met bestaande vinyl vloeren in 54 oudere patiënten in het ziekenhuis. Haines (2010) evalueerden het effect van een zeer laag bed met standaard bedden door per 12 bedden één bed te vervangen met een zeer laag bed onder 11.099 oudere patiënten. Mayo (1994) bestudeerden het effect van het dragen van een blauw identificatie armband door 134 patiënten met een verhoogd valrisico. Tideiksaar (1993) bestudeerden het gebruik van bed alarmen ter preventie van vallen in ziekenhuis onder 70 patiënten.
De update leverde twee additionele studies op. Sahota (2014) ondernamen een pragmatisch, gerandomiseerd trial naar het effect van druksensoren in het bed en stoel op vallen in een acute, algemene, ouderenzorg verpleegafdeling in het een ziekenhuis. Alle patiënten opgenomen op zo’n verpleegafdeling kwamen in aanmerking voor inclusie in de trial. In totaal waren 1839 patiënten geïncludeerd waarvan 918 patiënten de interventie ontvingen. Bij deze patiënten waren druksensoren in het bed en stoel aanwezig die bij afwezigheid van druk langer dan 5 seconden een alarm deden afgaan. De controlegroep hadden geen druk sensoren in het bed of stoel. Het is onbekend hoe lang de patiënten waren vervolgd voor de uitkomst vallen en fracturen. De trial heeft de patiënten en behandelaars niet kunnen blinderen. Aangezien de patiënten als individu waren gerandomiseerd in plaats van de verpleegafdeling/unit, kan dit mogelijk hebben geleid tot bias in de resultaten. Vallen was in het ziekenhuis met incidentie reportage formulieren gedocumenteerd. Het gebruik van deze formulieren was verplicht en werd ook afgedwongen door systematische procedures.
Shorr (2012) onderzochten of een interventie om het gebruik van bed alarmen te verhogen tot een afname in vallen en gerelateerde events in het ziekenhuis leidden. Zij ondernamen een cluster gerandomiseerde trial waarbij de verpleegafdelingen/units waren gerandomiseerd. In totaal waren 16 units geïncludeerd, waarvan acht de interventie kregen en acht units als controle fungeerde. De interventie units ontvingen scholing, training en technische ondersteuning om het gebruik van een standaard bed alarm systeem te bevorderen. Dit alarm systeem maakt gebruik van 1 of 2 drukgevoelige sensoren in het bed, stoel of bij gebruik van het toilet. Bij het verbreken van het contact met de sensor gaat een alarm in de kamer van de patiënt af en wordt er een signaal naar het kantoor van de verpleegsters verstuurd. De 16 verpleegafdelingen waren over 18 maanden gevolgd waarvan twee afdelingen onverwacht sloten. Er was geen reden gegeven waarom deze afdelingen sloten. Het betrof twee afdelingen die de interventie ontvingen.
Resultaten
I. Vallen
I.I Het aantal patiënten dat valt
In de trial van (Donald, 2000) was het valrisico zevenmaal verhoogd bij patiënten met vloerbedekking in de kamer vergeleken met patiënten met een vinyl vloer (RR 8,33 95%BI: 0,95 tot 73.37). Het gebruik van een blauwe identificatie armband verhoogde mogelijk het risico op een val met 34% (RR 1,34 95%BI: 0,76 tot 2,36). Tideiskaar (1993) rapporteerden alleen dat er geen verschil was in het aantal vallen tussen het gebruik van een bed alarm of geen alarm (p=1,00). In de trial van (Sahota, 2014) waren 65 (7%) patiënten gevallen die gebruik maakte van druksensoren ten opzichte van 64 (7%) patiënten die reguliere zorg ontvingen. Er was geen verschil in het risico op vallen bij het gebruik van druksensoren of reguliere zorg (RR 1,02 95%BI: 0,73 tot 1,42).
Figuur 4
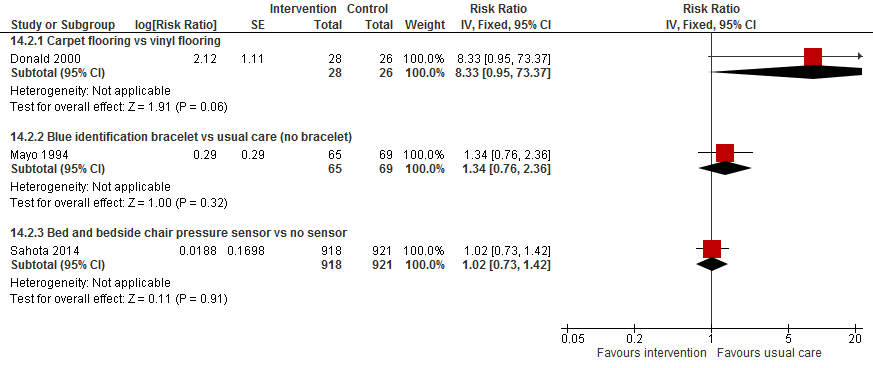
II. Valfrequentie
Donald (2000) constateerde een verhoogde valfrequentie bij vloerbedekking op de kamer vergeleken met een vinyl vloer (RR 14.73 95%BI: 1,88 tot 115,35). In de trial van (Haines, 2010) had het gebruik van een zeer laag bed geen invloed op de valfrequentie (RR 1,39 95%BI: 0,22 tot 8,78). Ook het gebruik van een blauw identificatie armband voor patiënten met een verhoogd valrisico had geen effect op de valfrequentie in de trial van (Mayo, 1994) (RR 1,15 95%BI: 0,72 tot 1,84). Sahota, 2014 observeerde een valfrequentie van 8.71 vallen per 1.000 patiënt dagen bij het gebruik van druksensoren en een valfrequentie van 9.84 vallen per 1.000 patiënt dagen onder reguliere zorg. Er was geen verschil in de valfrequentie tussen interventie en controlegroep (RR 0,89 95%BI:0,65 tot 1,20). Shorr, 2012 observeerde een valfrequentie van 5.62 vallen per 1.000 patiënt dagen in 8 units die voorlichting over het gebruik van een bed alarmsysteem hebben gekregen. In de 8 units in de controle arm was de rate 4.56 per 1.000 patiënt dagen. De rate op baseline was ook gemeten en vergeleken met rate tijdens de studieperiode. Op basis van de ratio van de rate tijdens de studieperiode gedeeld door de rate op baseline is de ratio van rate berekend. Er was geen verschil in de valfrequentie tussen interventie en controle units (RR 1,09 95%BI: 0,85 tot 1,53).
Figuur 5
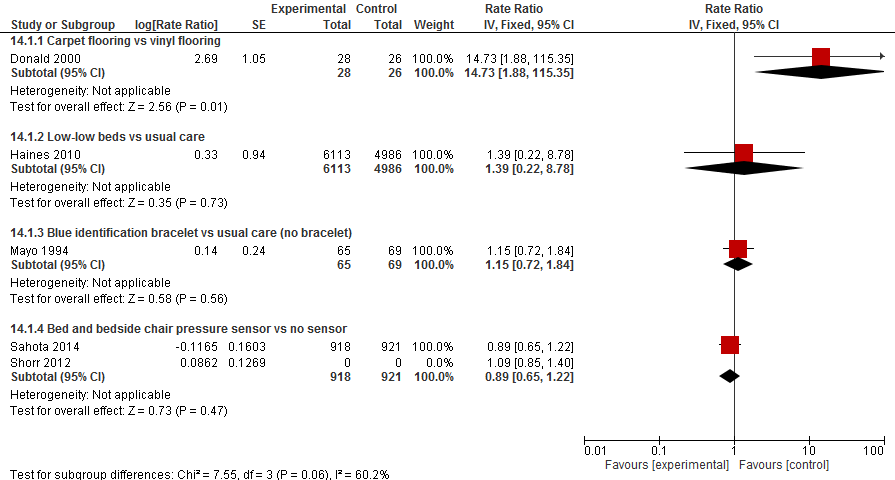
III. Botbreuken
Sahota (2014) en Shorr (2012) hebben ook de gevolgen van een val bekeken. Sahota, (2014) rapporteerde twee (0,2%) botbreuken in patiënten in de interventie arm en drie (0,3%) in controle arm. Deze aantallen zijn te laag om een effectschatter te kunnen berekenen. Ook in de trial van (Shorr, 2012) waren de aantallen te laag om een effectschatter te kunnen berekenen. In deze trial waren het aantal majeure gevolgen gerapporteerd en betrof gevolgen waarvoor een operatie, gispen, tractie of neurologische consultatie nodig waren. Eén patiënt in de interventiegroep en vijf patiënten uit de controlegroep hadden zulke majeure gevolgen van een val.
Bewijskracht van de literatuur
Vanwege het verschil in omgeving interventie is de data van verschillende trials niet gepoold. Er kan geen algemene conclusie worden getrokken over omgeving interventies en het valrisico, valfrequentie of het risico op een fractuur.
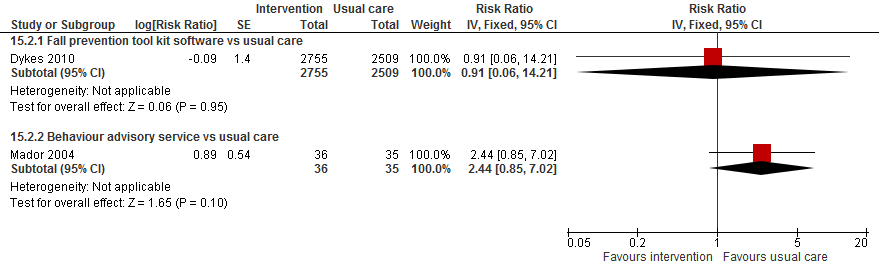
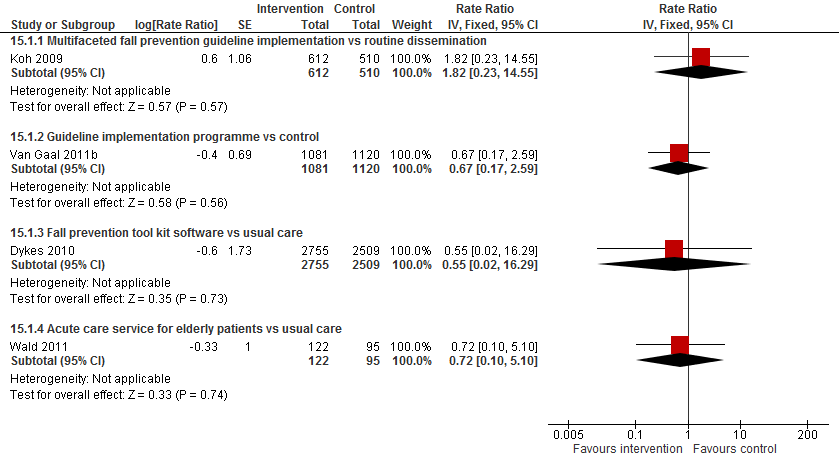
4. Organisatiegerichte interventies versus controle
De review van (Cameron, 2012) beschreef vier studies met interventies gericht op de organisatie van het ziekenhuis. Dit type interventies richt zich op werknemers en veranderingen in de organisatie in plaats van patiënten. De update vond geen additionele organisatiegerichte trials. (Koh, 2009) vergeleken een veelzijdige implementatie van een val preventie richtlijn met routine disseminatie op vallen onder 1122 patiënten. Van Gaal (2011) beoordeelden de implementatie van drie richtlijn over vallen, urineweginfecties en druk ulcera in 2201 patiënten. Dykes (2010) testten onder 5264 patiënten en computer-gebaseerde val preventie tool kit. (Wald, 2011) vergeleken een verpleegafdeling met een service gericht op ouderen met een verpleegafdeling met reguliere zorg. In (Mador, 2004) werd advies ten aanzicht van gedrag in 71 verwarde patiënten vergeleken met reguliere zorg.
Resultaten
I. Vallen
I.I Het aantal patiënten dat valt
Dykes (2010) observeerde geen verschil in het valrisico bij het gebruik van een valpreventie tool kit (RR 0.91 95%BI: 0,06 tot 14,21). Advies ten aanzien van gedrag in verwarde patiënten verhoogde mogelijk het risico op een val met 144% met een breed betrouwbaarheidsinterval (RR 2,44 95%BI: 0,85 tot 7,02).
Figuur 6
II. Valfrequentie
Koh (2009) rapporteerde een mogelijke verhoging in de valfrequentie met 82% (RR 1,82 95%BI: 0,23 tot 14,55) met een breed betrouwbaarheidsinterval. Van Gaal (2011) observeerde een mogelijke verlaging in de valfrequentie met 33% (RR 0,67 95%BI: 0,17 tot 2,59) met een breed betrouwbaarheidsinterval. Valfrequentie nam mogelijk af met 28% op verpleegafdelingen die een op ouderen gerichte service aanboden vergeleken met reguliere zorg in de trial van (Wald, 2011) (RR 0.72 95%BI: 0,10 tot 5,10). Het betrouwbaarheidsinterval sluit een vijfmaal verhoogde rate niet uit.
Figuur 7
Bewijskracht van de literatuur
Vanwege het verschil in interventies gericht op de sociale omgeving van een oudere patiënt is de data van verschillende trials niet gepoold. Er kan geen algemene conclusie worden getrokken over interventies in de sociale omgeving van een patiënt en het aantal patiënten dat valt, valfrequentie of het risico op een fractuur.
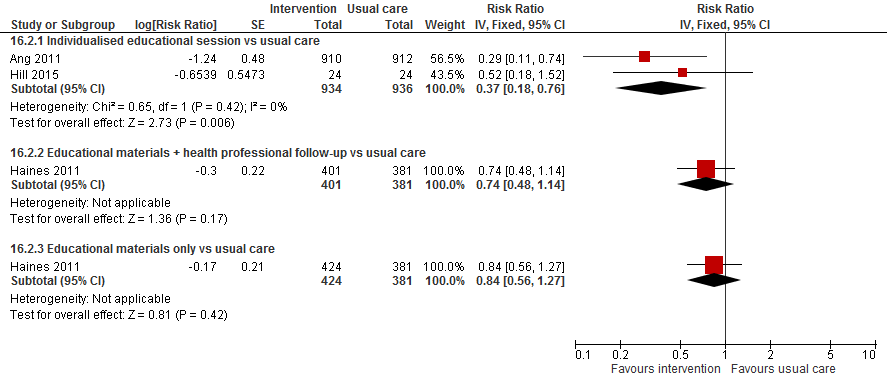
5. Kennisoverdracht/scholing interventies versus reguliere zorg
Uit Cameron (2012) zijn twee trials geïncludeerd die als interventie hebben gekeken naar het effect van scholing op het valrisico tijdens opname in het ziekenhuis. (Ang, 2011) onderzochten of een educatie sessie gegeven door een getrainde verpleegkundige over individuele valrisicofactoren resulteerde in een afname in het valrisico. Haines (2011) vergeleek twee methoden van multimedia patiënten informatie met reguliere zorg. Eén methode bestond uit geschreven en videomateriaal met één op één follow-up; de andere methode bevatte alleen de educatie materialen. De update leverde twee extra studies op.
Hill (2015) onderzochten de effectiviteit van geïndividualiseerde valpreventie scholing voor patiënten ondersteund door training en feedback van staf geleverd op afdeling niveau. Acht rehabilitatie afdelingen in ziekenhuizen waren gerandomiseerd volgens een stepped-wedge design. In dit design werd de interventie geleidelijk uitgerold over de unit; elke unit begint als controle en eindigt als interventie unit. In totaal waren 1623 opnames op een interventie-unit en 1983 opnames op een controle-unit. Als interventie ontvingen patiënten een geïndividualiseerde valpreventie scholing die was gebaseerd op principes over het veranderen van gezondheidsgedrag. Dit programma had tot doel patiënten te wijzen op hun persoonlijk risico op vallen, om hun kennis te vergroten over val epidemiologie en valpreventie en om hen te motiveren deel te nemen aan valpreventie strategieën. Als controle werd reguliere zorg geboden. De units werden in totaal voor 50 weken gevolgd.
Hill (2013) evalueerden het effect van scholing over valpreventie in het ziekenhuis op betrokkenheid van valpreventiegedrag een maand na ontslag en op het door de patiënt zelf beoordeelde valrisico en kennis over vallen en valpreventie strategieën. Het betrof een pilot van een gerandomiseerde trial in 50 patiënten. De interventie was een op de patiënt afgesteld pakket met multimedia informatie over valpreventie met follow-up door een getrainde medisch professional. 25 patiënten ontvingen de interventie en 25 patiënten ontvangen reguliere zorg als controle. Alle patiënten werden tot één maand na ontslag uit het ziekenhuis gevolgd.
Resultaten
I. Vallen
I.I Het aantal patiënten dat valt
In totaal deden 1822 patiënten mee aan de trial van Ang (2011). Het valrisico was met 71% verlaagd in patiënten die informatie verkregen over hun individuele risicofactoren vergeleken met reguliere zorg (RR 0,29 95%BI:0,11 tot 0,74). Hill (2015) rapporteerde dat 136 (8%) patiënten vielen tijdens de interventie periode en 248 (13%) patiënten tijdens de controle periode. De odds om te vallen was 0.55 maal lager tijdens de interventieperiode vergeleken met de controleperiode (OR 0,55 95%BI: 0,38 tot 0,81). Vanwege het design van de studie is deze effectschatter voor gecontroleerd voor het clustereffect. Het nadeel van het berekenen van een odds ratio in een RCT is dat de odds ratio het effect van de interventie kan overschatten als de uitkomst niet zeldzaam is. In deze studie is de uitkomst het aantal vallen relatief zeldzaam, maar het gerapporteerde odds ratio kan alsnog het effect hebben overschat. In de trial van (Hill, 2013) vielen vier (17%) patiënten uit de interventiegroep ten opzichte van negen (38%) patiënten uit de controlegroep. Het risico om te vallen was 48% lager in de interventiegroep vergeleken met de controlegroep (RR 0,52 95%BI: 0,18 tot 1,52).
In totaal vergeleken twee trials individueel geleverde educatie sessies met reguliere zorg (Ang, 2011; Hill, 2013). Beide vonden een afname in het valrisico met een gepoold effect van 0,37 (95%BI: 0,18 tot 0,76). Patiënten die een persoonlijk afgestemde educatie sessie kregen over hun valrisico hadden een 67% lager risico om te vallen.
Figuur 8
II. Valfrequentie
Valfrequentie was tijdens de interventieperiode in de trial van (Hill, 2015) 7,80 per 1000 patiënt dagen en 13,78 per 1000 patiënt dagen tijdens de controleperiode. De valfrequentie was 40% lager tijdens de interventieperiode vergeleken met controleperiode (RR 0,60 95%BI: 0,42 tot 0,94). Hill, 2103 observeerde een valfrequentie van 5,4 per 1000 patiënt dagen in de interventiegroep en 18,7 per 1000 patiënt dagen in de controlegroep. De auteurs observeerde dat de valfrequentie ruim driemaal groter is in de controlegroep vergeleken met de interventiegroep (RR 3,38 95%BI: 0,98 tot 11,56).
Figuur 9
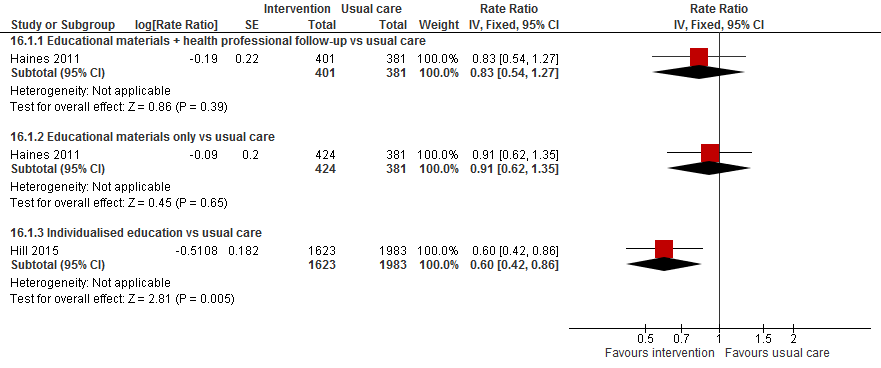
III. Botbreuken
Beide trials bekeken ook de gevolgen van een val. Hills (2015) rapporteerde het aantal botbreuken en vier en zes patiënten tijdens respectievelijk de interventie- en controleperiode hadden een botbreuk als gevolg van de val. Deze aantallen zijn te laag om een effectschatter te kunnen berekenen. Ook in de trial van (Hill, 2013) waren de aantallen te laag om een effectschatter te kunnen berekenen. Eén (4%) patiënt in de interventiegroep en twee (8%) patiënten uit de controlegroep hadden een botbreuk opgelopen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat het aantal patiënten dat valt is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie). Vanwege een verschil in de wijze waarop kennis over valrisico werd overgedragen en het gebruikte materiaal kan er geen conclusie worden getrokken over de valfrequentie. Vanwege weinig data over het aantal fracturen kan er geen conclusie worden getrokken over het effect van educatie over valrisico.
6. Multifactoriële interventies
Vier trials in de Cochrane review van (Cameron, 2012) testten het effect van multifactoriële interventies in het ziekenhuis (Cumming, 2008; Haines, 2004; Healey, 2004; Stenvall, 2007). Details over de componenten van de interventies zijn te vinden in (Cameron, 2012).
De update leverde een extra studie op. Shyu (2012) evalueerden de lange termijneffecten van een interdisciplinair interventie programma in oudere patiënten met een heupfractuur. Het interventieprogramma betrof een geriatrisch consultatie, een rehabilitatie programma en een ontslag planning service. Het geriatrisch consult werd gebruikt om medische en functionele problemen vast te stellen en om enige vertraging voor een operatie te verminderen. Patiënten ontvingen zowel in het ziekenhuis als thuis rehabilitatie. Bij de ontslag service behoorde een ontslag beoordeling, mogelijke verwijzingen, een beoordeling van de thuissituatie en mogelijke veranderingen aan de omgeving. De controlegroep ontving reguliere zorg. In totaal werden 160 patiënten geïncludeerd waarvan 79 patiënten de interventie kregen. Patiënten werden voor twee jaar gevolgd. Mede daardoor was de drop-out hoog in beide groepen. 15 (19%) patiënten in de interventiegroep weigerden tijdens enige moment in de follow-up om mee te doen vergeleken met 20 (25%) patiënten uit de controlegroep.
Resultaten
I. Vallen
Data over het aantal vallen in de trial van (Shyu, 2012) werden op elke tijdsmoment gerapporteerd. Vanwege de hoge drop-out frequentie en het missen van informatie over het aantal dagen dat patiënten werden gevolgd is het niet mogelijk om een effectschatter te kunnen berekenen en interpreteren.
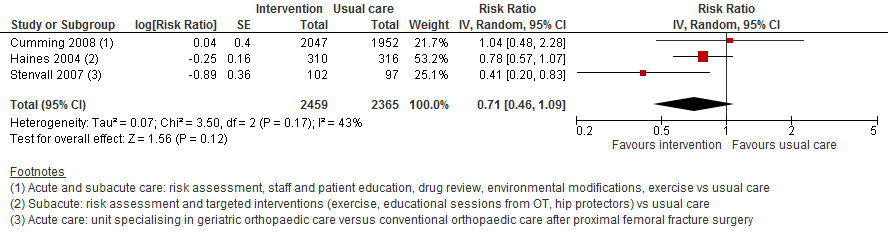
I.I Het aantal patiënten dat valt
In drie trials met data over het aantal patiënten dat valt was het risico op vallen 29% lager bij een multifactoriële interventies vergeleken met reguliere zorg (RR 0,71 95%BI: 0,46 tot 1,09).
Figuur 10
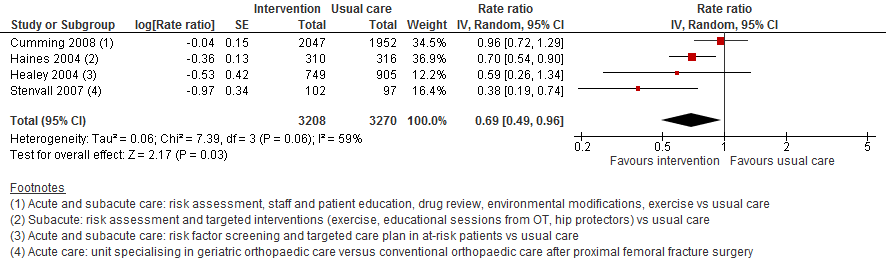
II. Valfrequentie
Uit data van vier trials bleek de valfrequentie 31% lager te zijn bij multifactoriële interventie in oudere patiënten in het ziekenhuis vergeleken met reguliere zorg (RR 0,69 95%BI: 0,49 tot 0,96).
Figuur 11
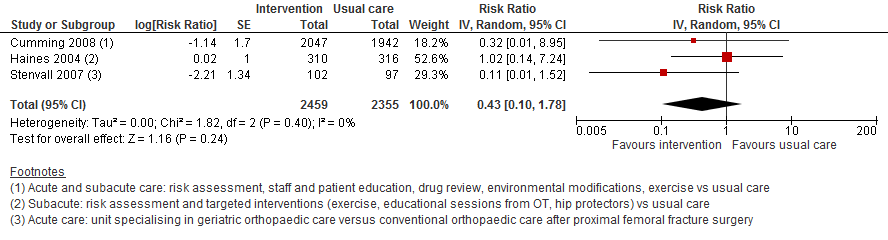
III. Botbreuken
Shyu (2012) rapporteerde geen data over botbreuken. Drie trials uit (Cameron, 2012) rapporteerden het risico op een fractuur. De meta-analyse liet zien dat het risico op een botbreuk mogelijk met 57% verlaagd is (RR 0,43 95%BI: 0,10 tot 1,78). Een verhoogd risico is echter niet uit te sluiten.
Figuur 12
Twee van de vier interventies onderzocht in vier trials bleken effectief te zijn. In de trial van (Haines, 2004) (626 deelnemers) bestond de interventie gericht op de individu uit een val risico kaart en een brochure, lichamelijke oefeningen, scholingsprogramma en heupbeschermers. Stenvall (2007) vergeleken postoperatieve zorg en een uitgebreide oudere service met reguliere zorg in 199 patiënten na een operatie als gevolg van heupfractuur. De interventie bevatte een uitgebreide beoordeling en behandeling van val risicofactoren door een multidisciplinair team.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vallen (het aantal patiënten dat valt en valfrequentie) is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet en tegenstrijdige resultaten (inconsistentie). De bewijskracht voor de uitkomstmaat fracturen is met twee niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie) en een breed betrouwbaarheidsinterval (imprecisie).
7. Medicatie beoordeling versus reguliere zorg
Twee trials hebben als interventie het medicatie gebruik van patiënten beoordeeld en mogelijk aangepast om het gebruik van val bevorderende medicatie te beperken. Michalek (2014) ondernam een pilot gerandomiseerde trial naar de impact van een bepaalde assessment tool voor het beoordelen van het medicatiegebruik. In totaal werd het medicatiegebruik van 58 patiënten beoordeeld en 56 patiënten ontvingen reguliere zorg. Patiënten waren tot ontslag gevolgd. Verblijf in het ziekenhuis was voor 50% van patiënten ten minste 20 dagen.
Sjoberg (2013) onderzochten of medicatie beoordeling de behandeling met valpreventieve medicatie zou verhogen en leidde tot een afname in het gebruik van valrisico verhogende medicatie. Bij 100 patiënten werd het medicatiegebruik beoordeeld en 99 patiënten ontvingen reguliere zorg. Patiënten waren in totaal voor 12 maanden gevolgd.
Resultaten
I. Vallen
I.I Het aantal patiënten dat valt
In de trial van (Michalek, 2014) waren er twee (3%) vallers in de interventiegroep vergeleken met 12 (21%) vallers in de controlegroep. Het risico om te vallen was 84% lager bij een medicatie beoordeling vergeleken met reguliere zorg (RR 0,16 95%BI: 0,04 tot 0,69). In de trial van (Sjoberg, 2013) vielen er 24 (24%) patiënten die een medicatie beoordeling kregen versus 33 (33%) patiënten die reguliere zorg kregen. Het valrisico was 28% lager bij een medicatiebeoordeling vergeleken met regulier zorg (RR 0,72 95%BI: 0,46 tot 1,13). Het gepoolde effect suggereerde een verlaging van het valrisico van 43% (RR 0,57 95%BI: 0,37 tot 0,87).
Figuur 13
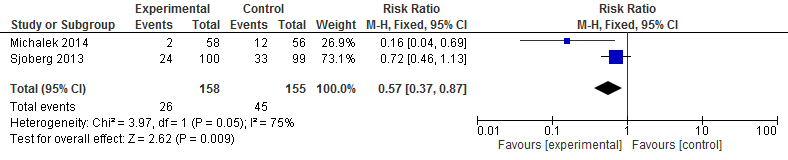
II. Valfrequentie
Alleen de trial van (Michalek, 2014) heeft de valfrequentie berekend. Bij een medicatiebeoordeling was de rate 1,5 per 1000 patiënt dagen vergeleken met 10,6 bij reguliere zorg. De valfrequentie was 86% lager bij een medicatiebeoordeling vergeleken met reguliere zorg (RR 0,14 95%BI: 0,02 tot 0,61).
III. Botbreuken
Alleen de trial van (Sjoberg, 2013) rapporteerde data over botbreuken. 13 (13%) patiënten met een medicatiebeoordeling hadden een botbreuk vergeleken met 14 (14%) patiënten uit de controlegroep. Het risico op een botbreuk was niet verschillend tussen de interventie en controlegroep (RR 0,92 95%BI: 0,46 tot 1,85).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten aantal vallers, valfrequentie en botbreuken is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het geringe aantal patiënten (imprecisie).
8. Voedingstherapie versus reguliere zorg
Cameron (2012) beschreef geen studies die het effect van voedingstherapie op valrisico onder ziekenhuispatiënten onderzochten. De update vond één relevante studie. (Neelemaat, 2012) evalueerden het effect van een kortdurende voedingsinterventie met eiwitten en vitamine D op vallen in ondervoede ouderen. De voedingsinterventie bestond uit een energie en eiwit verrijkt dieet; tweemaal daags een oraal voedingssupplement, 400 IU van vitamine D3 per dag; en een telefonisch consult met een diëtist. De controlegroep ontving reguliere zorg. Hierbij werd alleen ondersteuning wat betreft voeding voorgeschreven door een behandelend ars. Over het algemeen kreeg de controlegroep geen ondersteuning na ontslag. In totaal werden 105 patiënten gerandomiseerd naar de interventiegroep en 105 naar de controlegroep. Patiënten werden tot drie maanden na ontslag uit het ziekenhuis gevolgd.
Resultaten
I. Vallen
I.I Het aantal patiënten dat valt
In de trial van (Neelemaat, 2012) vielen 10 (10%) patiënten in de interventiegroep en 24 (23%) patiënten in de controlegroep. Het risico om te vallen was 57% lager in patiënten die ondersteuning kregen wat betreft hun dieet vergeleken met patiënten die reguliere zorg ontvingen (RR 0,43 95%BI: 0,22 tot 0,86).
II. Valfrequentie
Deze data was niet gerapporteerd in de trial van (Neelemaat, 2012).
III. Botbreuken
Botbreuken werden niet standaard gemeten in het onderzoek van (Neelemaat, 2012).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat het aantal patiënten dat valt is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
Wat is de effectiviteit van valpreventieve interventies vergeleken met geen interventies of andere interventie bij ouderen in het ziekenhuis?
P: oudere patiënten in het ziekenhuis;
I: interventies ter preventie van vallen;
C: geen / andere interventies die geen effect hebben op vallen;
O: valrisico (het aantal patiënten dat valt en valfrequentie)/ fracturen.
Relevante uitkomstmaten
De werkgroep achtte vallen een voor de besluitvorming kritieke uitkomstmaat en fracturen een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde het voorkomen van een of meer valincidenten tijdens een ziekenhuisopname als een klinisch relevant verschil.
Zoeken en selecteren (Methode)
Voor de uitwerking van deze vraag wordt een bestaande Cochrane review geüpdatet. (Cameron, 2012) ondernamen een systematische literatuur zoekactie naar interventies om de incidentie van vallen in ouderen in verpleeghuizen of ziekenhuizen te verlagen. In deze review zijn de Cochrane Bone, Joint and Muscle Trauma Group Specialised register, CENTRAL, Medline, EMBASE, CINAHL en online trial registers met relevante zoektermen doorzocht. Voor deze richtlijn is dezelfde zoekstrategie gebruikt om de Cochrane review te updaten met relevante publicaties in de periode 2012 tot augustus 2015. Voor het beantwoorden van de uitgangsvraag wordt alleen de data van ouderen opgenomen in het ziekenhuis beschreven.
De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 2923 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerde trials met interventies ter preventie van vallen in ouderen in het ziekenhuis. Op basis van titel en abstract werden in eerste instantie 47 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 39 studies geëxcludeerd (zie exclusietabel), en acht studies definitief geselecteerd.
Resultaten
Acht onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De evidence-tabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Ang E, Mordiffi SZ, Wong HB. Evaluating the use of a targeted multiple intervention strategy in reducing patient falls in an acute care hospital: a randomized controlled trial. Journal of Advanced Nursing. 2011;67(9):198492.
- Barker AL, Morello RT, Wolfe R, et al. 6-PACK programme to decrease fall injuries in acute hospitals: cluster randomized controlled trial. BMJ. 2016;352:Epub.
- Burleigh E, McColl J, Potter J. Does vitamin D stop inpatients falling? A randomised controlled trial. Age and Ageing. 2007;36(5):50713.
- Cumming RG, Sherington C, Lord SR, et al. Cluster randomised trial of a targeted multifactorial intervention to prevent falls among older people in hospital. BMJ. 2008;336(7647):75860.
- Donald IP, Pitt K, Armstrong E, et al. Preventing falls on an elderly care rehabilitation ward. Clinical Rehabilitation. 2000;14(2):17885.
- Dykes PC, Carroll DL, Hurley A, et al. Fall prevention in acute care hospitals: A randomized trial. JAMA - Journal of the American Medical Association. 2010;304(17):19128.
- Enns E, Rhemtulla R, Ewa V, et al. A controlled quality improvement trial to reduce the use of physical restraints in older hospitalized adults. J Am Geriatr Soc. 2014;62(3):541-5.
- Haines TP, Bell RA, Varghese PN. Pragmatic, cluster randomized trial of a policy to introduce low-low beds to hospital wards for the prevention of falls and fall injuries. Journal of the American Geriatrics Society. 2010;58(3):43541.
- Haines TP, Bennell KL, Osborne RH, et al. Effectiveness of targeted falls prevention programme in subacute hospital setting: randomised controlled trial. BMJ. 2004;328(7441):6769.
- Haines TP, Hill AM, Hill KD, et al. Patient education to prevent falls among older hospital inpatients: a randomized controlled trial. Archives of Internal Medicine. 2011;171(6):51624.
- Healey F, Monro A, Cockram A, et al. Using targeted risk factor reduction to prevent falls in older in-patients: a randomised controlled trial. Age and Ageing. 2004;33(4):3905.
- Healey F, Scobie S, Oliver D, et al. Falls in English and Welsh hospitals: a national observational study based on retrospective analysis of 12 months of patient safety incident reports. Qual Saf Health Care. 2008;17(6):424-30.
- Hill AM, Hoffmann T, McPhail S, et al. Evaluation of the sustained effect of inpatient falls prevention education and predictors of falls after hospital discharge--follow-up to a randomized controlled trial. J Gerontol A Biol Sci Med Sci. 2011;66(9):1001-12.
- Jarvis N, Kerr K, Mockett S. Pilot study to explore the feasibility of a randomised controlled trial to determine the dose effect of physiotherapy on patients admitted to hospital following a fall. Practical Evidence. 2007;2(2):412.
- Koh SL, Hafizah N, Lee JY, et al. Impact of a fall prevention programme in acute hospital settings in Singapore. Singapore Medical Journal. 2009;50(4):42532.
- Mador JE, Giles L, Whitehead C, et al. A randomized controlled trial of a behavior advisory service for hospitalized older patients with confusion. International Journal of Geriatric Psychiatry. 2004;19(9):85863.
- Mayo NE, Gloutney L, Levy AR. A randomized trial of identification bracelets to prevent falls among patients in a rehabilitation hospital. Archives of Physical Medicine & Rehabilitation. 1994;75(12):13028.
- Stenvall M, Olofsson B, Lundstrom M, et al. A multidisciplinary, multifactorial intervention program reduces postoperative falls and injuries after femoral neck fracture. Osteoporosis International. 2007;18(2):16775.
- Sze TW, Leng CY, Lin SK. The effectiveness of physical restraints in reducing falls among adults in acute care hospitals and nursing homes: a systematic review. JBI Libr Syst Rev. 2012;10(5):307-351.
- Tideiksaar R, Feiner CF, Maby J. Falls prevention: the efficacy of a bed alarm system in an acute-care setting. Mount Sinai Journal of Medicine. 1993;60(6):5227.
- Van Gaal BG, Schoonhoven L, Mintjes JA, et al. Fewer adverse events as a result of the SAFE or SORRY? programme in hospitals and nursing homes. part i: primary outcome of a cluster randomised trial. International Journal of Nursing Studies. 2011;48(9):10408.
- Wald HL, Glasheen JJ, Guerrasio J, et al. Evaluation of a hospitalist-run acute care for the elderly service. Journal of Hospital Medicine (Online). 2011;6(6):31321.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Medication |
|||||||
|
Michalek, 2014 |
Type of study: RCT
Setting: Acute geriatric unit at tertiary medical center
Country: Germany
Source of funding: Not stated |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 58 Control: 56
Important prognostic factors2: Age, median (IQR): I: 84 (81-87) C: 83 (79-87)
Sex: Not reported
Length of stay, days: I: 20 (16-26) C: 20 (16-30)
Groups comparable at baseline? Yes |
Drugs were evaluated according to the FORTA list and changed as guided by FORTA within the first week in the hospital.
Weekly meetings for intervention were performed that encompassed a thorough evaluation of patient diseases, functional status, prognosis, and need for drugs. Decisions were based on the FORTA suggestions.
Drugs were continued despite unfavourable FORTA labelling if patients insisted. Since FORTA is an implicit tool, physicians are not obliged to strictly follow the proposals. |
Usual care
|
Length of follow-up: Until discharge; median hospital stay 20 days in both groups
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 1,000 patient days
Number of fallers, risk ratio I: 2 (3.4%) C: 12 (21.4%) RR 0.16 (95%CI: 0.04-0.69)
Rate of falls, rate ratio I: 1.5 (95%CI: 0.7-3.7) C: 10.6 (95%CI: 3.8-17.4) RR 0.14 (95%CI: 0.02-0.61)
2. Fractures Not reported |
Patients were only included in the first 3 days of the week because of staff availability. Potentially, this could lead to selection bias; however, patients most likely won’t differ when admitted a certain day of the week.
Data on sex was collected, but not reported.
This is a pilot trial. |
|
Sjoberg, 2013 |
Type of study: RCT
Setting: Patients undergone surgery for a hip fracture at a major orthopaedic hospital
Country: Sweden
Source of funding: Non-commercial (Swedish National Board of Health and Welfare) |
Inclusion criteria:
N total at baseline: Intervention: 100 Control: 99
Important prognostic factors2: Age, mean (SD): I: 85 (7.3) C: 84 (6.9
Sex: I: 34% M C: 33% M
Groups comparable at baseline? Yes |
Medication review by a geriatrician
Based on assessment of the individual’s risk of fractures and falls, the medication lists of intervention participants were evaluated to optimize drug treatment with regard to fracture-preventing and fall-risk-increasing drugs. This part of the intervention was performed once during the hospital stay and twice after discharge from the hospital (at 3-5 and 6-8 months, respectively). Assessment of fracture and fall risks and suggestions for drug treatment changes were conveyed orally and in writing to the hospital physician in a brief consultation on the ward and to the GP over the telephone and in the mail. |
Usual care
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N=27 (27%) Reasons: 27 died during study
Control: N=19 (19%) Reasons: 19 died during study
Incomplete outcome data: Intervention: N=27 (27%) Reasons: 27 died during study
Control: N=19 (19%) Reasons: 19 died during study |
1. Falls Measured as the number of fallers, n (%)
I: 24 (24) C: 33 (33) RR 0.72 (95%CI: 0.46-1.13)
2. Fractures Measured as the number of fractures, n (%)
I: 13 (13) C: 14 (14) RR: 0.92 (95%CI: 0.46-1.85) |
|
|
Fluid or nutrition therapy |
|||||||
|
Neelemaat, 2012 |
Type of study: RCT
Setting: University Medical center
Country: The Netherlands
Source of funding: Non-commercial (Zon-MW) |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 105 Control: 105
Important prognostic factors2: Age (SD): I: 74 (10) C: 74 (9)
Sex: I: 47% M C: 43% M
Groups comparable at baseline? Yes |
Standardized nutritional support starting in the hospital and continuing for three months after discharge.
|
Usual care |
Length of follow-up: Three months after hospital discharge
Loss-to-follow-up: Intervention: N=30 (29%) Reasons: 16 withdrawal, 14 died
Control: N=30 (29%) Reasons: 19 withdrawal, 11 died
Incomplete outcome data: Intervention: N=30 (29%) Reasons: 16 withdrawal, 14 died
Control: N=30 (29%) Reasons: 19 withdrawal, 11 died |
1. Falls Measured as the number of fallers, n (%)
I: 10 (10%) C: 24 (23%) RR 0.43 (95%CI: 0.22-0.86)
2. Fractures Only one participant in the control group reported a fracture after a fall incident. |
Secondary analysis of RCT.
Usual care could include nutritional support only on prescription from their treating physician. In general, they did not receive post discharge nutritional support.
Participants were asked to record their falls with a diary.
As fractures were not readily incorporated in the dairy, this outcome was not taken into account. |
|
Environment/assistive technology |
|||||||
|
Sahota, 2014 |
Type of study: RCT
Setting: Acute, general medical elderly care wards
Country: United Kingdom
Source of funding: Non-commercial (NIHR) |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 918 Control: 921
Important prognostic factors2: Age ± SD: I: 84 (7) C: 84 (7)
Sex: I: 44% M C: 47% M
Groups comparable at baseline? Yes |
Bed and bedside chair pressure sensor linked to a radio-pager
When a participant left the bed or bedside chair, a radio signal alert was transmitted from a transmitter box attached to the foot of the participant’s bed, to the radio-pager carried by a member of the nursing team. An absence of pressure on the sensor of 5 s or more triggered an alert. |
No sensor |
Length of follow-up: Not stated
Loss-to-follow-up: Intervention: N=55 (6%) Reasons: 13 withdrew consent, 42 died
Control: N=64 (7%) Reasons: 3 withdrew consent, 61 died
Incomplete outcome data: Intervention: N=55 (6%) Reasons: 13 withdrew consent, 42 died
Control: N=64 (7%) Reasons: 3 withdrew consent, 61 died |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 1,000 bed days
Number of fallers, risk ratio I: 65 (7) C: 64 (7) RR 1.02 (95%CI: 0.71-1.46)
Rate of falls, rate ratio I: 8.71 C: 9.84 RR 0.89 (95%CI: 0.65-1.20)
2. Fractures
I: 2 (0.2) C: 3 (0.3) No estimate was calculated due to small number of fractures |
|
|
Shorr, 2012 |
Type of study: Pair-matched, cluster randomized trial
Setting: Urban, academically affiliated community hospital
Country: USA
Source of funding: Non-commercial (National Institute on Aging) |
Inclusion criteria:
N total at baseline: Intervention: 8 units (patient-days 83604) Control: 8 units (patient-days 59011)
Important prognostic factors2: “At baseline, the 8 intervention and 8 control nursing unites were similar in staffing, demographic characteristics, fall risk, and psychotropic drug use.” |
Education, training, and technical support to promote use of a standard bed alarm system
The alarm system operates using 1 or 2 weight-sensitive sensor pads applied to the bed, chair, or commode. When contact is broken with the alarm sensor pad, an alarm sounds within the patient’s room and as a call at the central nurses’ station. |
Bed alarms available but not formally promoted or supported |
Length of follow-up: 18 months
Loss-to-follow-up: Intervention: N=2 (25%) Reasons: Two units unexpectedly closed
Control: N=0 (0%)
Incomplete outcome data: Intervention: N=2 (25%) Reasons: Two units unexpectedly closed
Control: N=0 (0%) |
1. Falls Measured as the rate of falls per 1,000 bed days
Rate of falls, rate ratio Baseline I: 5.76 (4.31-7.86) C: 5.11 (4.07-6.75) Study period I: 5.62 (4.98-7.76) C: 4.56 (3.80-5.81) Ratio: Study period/baseline I: 0.98 (0.77-1.39) C: 0.89 (0.75-1.03)
RR 1.09 (95%CI: 0.85-1.53)
2. Fractures Measured as falls resulting major injuries*, n (%)
I: 1 (0.3) C: 5 (1.2) No estimate was calculated due to small number of fractures |
Two units unexpectedly closed during the study and provided data for only 3 months. However, no explanation is given for the closure of the units.
*Major injuries were defined as falls resulting in injury needing surgery, casting, traction, or neurologic consultation for change in level of consciousness. |
|
Knowledge/education |
|||||||
|
Hill, 2015 |
Type of study: Cluster-randomised, stepped-wedge controlled trial
Setting: Eight publicly funded, rehabilitation units in general hospitals (clusters) that admit patients for rehabilitation from disorders such as hip fracture or medical illness.
Country: Australia
Source of funding: Non-commercial (State Health Research Advisory Council from Government of Western Australia) |
Inclusion criteria: Patients admitted to a participating unit during an intervention period were prospectively screened on ward admission and, where eligibility criteria were met, patients were offered the individualised education. Patients were eligible to receive the individualised education if they:
N total at baseline: Intervention: 1623 Control: 1983
Important prognostic factors2: Age ± SD: I: 81 (9) C: 82 (8)
Sex: I: 38% M C: 39% M
Length of stay Median (IQR) I: 12 (7-21) C: 11 (6-20)
Groups comparable at baseline? Yes |
Individualised patient falls-prevention education programme
This programme was based on the principles of changes to health behaviour. The programme was aimed to alert patients to their personal risk of falls, raise their knowledge about falls epidemiology and falls prevention, and to motivate them to engage in falls-prevention strategies. |
Usual care |
Length of follow-up: 50 weeks
Loss-to-follow-up: Intervention: N=0 (0%)
Control: N=0 (0%)
Incomplete outcome data: Intervention: N=0 (0%)
Control: N=0 (0%) |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 1,000 bed days
Number of fallers, odds ratio I: 136 (8) C: 248 (13) OR 0.55 (95%CI: 0.38-0.81)
Rate of falls, rate ratio I: 7.80 C: 13.78 RR 0.60 (95%CI: 0.42-0.94)
2. Fractures
I: 4 C: 6 No estimate was calculated due to small number of fractures |
RCT used a stepped-wedge design.
Risk ratio could not be calculated by hand, because of the cluster design. Odds ratio tend to overestimate the effect in RCT when the outcome is not rare. In this case, the outcome is relatively rare. However, the reported odds ratio may still overestimate the effect. |
|
Hill, 2013 |
Type of study: Randomized trial
Setting: Stroke and rehabilitation units
Country: Australia
Source of funding: Non-commercial (The Menzies Foundation) |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 25 Control: 25
Important prognostic factors2: Age ± SD: I: 78 (9) C: 78 (8)
Sex: I: 36% M C: 32% M
Groups comparable at baseline? Yes |
Multimedia falls prevention education with between 2 and 4 individual health professional follow-up sessions for each patient in the week prior to hospital discharge and one follow-up telephone call for each patient made in the fortnight after hospital discharge to consolidate the education. Each participant in the intervention group to receive education individually by being shown a DVD and also being given written materials with workbook. Patient receives individual tailored discussion and feedback that allow them to develop goals and strategies. |
Usual care |
Length of follow-up: One month after discharge
Loss-to-follow-up: Intervention: N=1 (4%) Reason: Did not receive the full intervention
Control: N=1 (4%) Reason: Died
Incomplete outcome data: Intervention: N=1 (4%) Reason: Did not receive the full intervention
Control: N=1 (4%) Reason: Died |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 1,000 bed days
Number of fallers, risk ratio I: 4 (17) C: 9 (38) RR 0.52 (95%CI: 0.18-1.52)*
Rate of falls, rate ratio I: 5.4 C: 18.7 RR 3.38 (95%CI: 0.98-11.56)*
2. Fractures
I: 1 (4) C: 2 (8) No estimate was calculated due to small number of fractures |
This is a pilot trial.
*Study adjusted for length of follow-up after discharge. However, because in this case the outcome is not rare, the odds ratio overestimates the effect. The risk ratio was calculated based on crude number. As length of follow-up is not a confounder, adjustment for this variable would remove noise from the estimation, i.e. the confidence interval is broader than with adjustment.
**NB: control group was compared with the intervention group. |
|
Multifactorial |
|||||||
|
Shyu, 2012 |
Type of study: RCT
Setting: Hospitalized patients with a single-side fracture
Country: Taiwan
Source of funding: Non-commercial (National Health Research Institue) |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 79 Control: 81
Important prognostic factors2: Age: Cannot be deduced
Sex: I: 34% M C: 31% M
Length of stay un days, mean (SD): I: 10.1 (3.7) C: 9.7 (5.0)
Groups comparable at baseline? Yes |
Geriatric consultation service, rehabilitation program and a discharge-planning service
Geriatric consultation: subjects were surveyed to detect potential medical and functional problems and to decrease delays before surgery. The rehabilitation component included both in-patient and in-home rehabilitation. Discharge service included a discharge assessment, necessary referrals, a home assessment, and suggested environmental modifications. |
Usual care |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: N=24 (30%) Reasons: 15 refused to participate and 9 died
Control: N=33 (41%) Reason: 20 refused to participate and 13 died
Incomplete outcome data: Intervention: N=24 (30%) Reasons: 15 refused to participate and 9 died
Control: N=33 (41%) Reason: 20 refused to participate and 13 died |
1. Falls Measured as the number of falls, n/N
1 months I: 3/71 C: 8/75 3 months I: 5/67 C: 10/69 6 months I: 2/65 C: 10/67 12 months I: 6/60 C: 7/61 18 months I: 9/57 C: 13/54 24 months I: 9/55 C: 7/48
2. Fractures Not reported
|
Data was described per subgroup based on cognitive impairment.
No effect estimate was calculated because of the large drop-out rate and because the number of falls were recorded without the number of patient-days. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Medication |
||||||||
|
Michalek, 2014 |
“Patients were assigned randomly by number of entrance to one of two wards. The assignment was performed by a manger not involved in patient care and blinded to the aim of the study. One ward served as the intervention area and the other ward as the control area.” |
Unclear. Not stated |
Unlikely. Although patients were most likely not blinded, switching from intervention to control as wards were randomized seems unlikely. |
Unlikely. All other staff of both wards were blinded to the aim of the study. During the course of the study, major characteristics of staffing were similar. |
Unlikely. Although not reported, falls were registered by means of an established in-hospital recording system, most likely filled in by staff of the wards. |
Likely. Falls were not reported as a secondary outcome in the trial registry. |
Unclear. Not stated |
Unclear. Although not stated, most likely patients assigned to intervention were analysed in the intervention group. |
|
Sjoberg, 2013 |
“Participants were randomly allocated 1:1 to an intervention or control group. A person not involved in the study provided a computer-generated random number list in blocks of six, and another person arranged sequentially numbered, opaque, sealed envelopes. To prevent subversion of the allocation sequence, an individual who had previously enrolled and assessed each participant wrote the name and personal identity number of the participant on the envelope Carbon paper inside the envelop transferred the information onto the allocation card inside the envelope.” |
Unlikely |
Unlikely. Study was blinded for the participants. |
Likely. Physicians and investigator were not blinded. |
Unclear. Not stated |
Unlikely. Trial registered; registered primary and secondary outcomes are reported |
Unlikely. For 15 of the intervention participants who died, the authors determined that the changes in drug treatment occurred because the medication reviews were unlikely to cause death. For the remaining 12, no change in medications occurred or the changes were not related to the medication reviews. |
Unlikely. […] were used for comparison between the randomization groups. |
|
Fluid or nutritional therapy |
||||||||
|
Neelemaat, 2012 |
“A computerized random number generator was used to assign participants in blocks of 10 to the control or intervention groups. At the end of the baseline interview and measurements, the primary investigator opened a consecutively numbered opaque envelope containing the participant’s group assignment.” |
Unlikely |
Likely. Participants, research assistants, researchers were aware of group assignment during the intervention phase. |
Likely. Participants, research assistants, researchers were aware of group assignment during the intervention phase. |
Likely. Participants recorded their falls weekly. |
Unlikely. Trial was registered. Outcome was not registered; however, diaries were used to record falls which would have been given at the start of the trial. |
Unlikely. Although dropout rate was high (29%), reasons were similar in both groups. |
Unlikely. All randomized participants received treatment according to randomization. |
|
Environment/assistive technology |
||||||||
|
Sahota, 2014 |
“Subjects were randomised to the intervention group or the control group using a web based randomisation service […]. The allocation schedule was generated using random permuted blocks of randomly varying size.” |
Unclear. Not stated |
Likely. It was not possible to blind participants or those providing medical or nursing care to the intervention or control group allocation. |
Likely. It was not possible to blind participants or those providing medical or nursing care to the intervention or control group allocation. |
Unlikely. Although falls were recorded by ward clinical teams, the use of incident reporting forms was mandatory within the hospital and enforced by systematic quality assurance processes. |
Unclear. Although trial was registered, this was done a year after recruitment started. |
Unlikely. None were lost to follow-up. |
Unlikely. From supplementary data: “Analysis were carried out on the basis of intention to treat.” |
|
Shorr, 2012 |
“To ensure the comparability of intervention and control nursing units, the interventionist assigned the nursing units a number between 1 and 16 in decreasing order of fall rates. “Neighbors” in this rank order were matched into eight pairs. The first in the pair was randomly assigned to the intervention or control group so that the other unit received the opposite assignment. Units were allocated by using a random-number sequence […], generated by a statistical consultant who was blinded to the identity of the units.” |
Unlikely. Although the interventionist assigned the intervention to the units, there would most likely not be any preference for one unit over the other to assign the intervention. |
Unlikely. “Patients were blinded to unit assignment.” |
Likely. Care providers were part of the intervention and decided whether or not to use the standard bed alarm system. |
Unlikely. “Outcome assessors were blinded to unit assignment.” |
Unclear. Trial was not registered. |
Likely. “Two units unexpectedly closed during the study and provided data for only three months.” No reasons for closure was given. |
Unlikely. |
|
Knowledge/education |
||||||||
|
Hill, 2015 |
“[…] randomly assigned the eight units, by use of a computer-generated, random allocation sequence.” |
Unlikely. Although unit managers were informed before the start of the trial the allocation details, “neither the randomisation sequence nor the dates that the units started the intervention had any delays or changes” |
Unlikely. Patients were not blinded; however, switching between units seems unlikely. |
Unlikely. Care providers were not blinded; however, as units were randomised movement of staff was not deemed to influence the trial. |
Unlikely. Data for in-hospital falls were obtained with two approaches-by use of data extracted from the hospital incident report system and auditing of patient notes. |
Unlikely. Trial was registered with registered outcomes reported. |
Unlikely. None were lost to follow-up. |
Unlikely. “All analyses were by intention to treat.” |
|
Hill, 2013 |
“A computer-generated, random number schedule was developed and placed into opaque, consecutively numbered envelopes by a researcher not involved in the project. The randomization envelopes were stored off the hospital site and one envelope was opened for each participant in order of recruitment on completion of the baseline assessment. |
Unlikely. |
Unlikely. “Participants were not informed if they were in the intervention or control group, although participants in the intervention group were made aware that they were receiving education designed to assist them to safely manage at home.” |
Unclear. |
Unlikely. “Research assistants who approached participants for consent and completed the baseline, discharge and one month follow-up assessments were blinded to group allocation.” |
Likely. Falls were not reported as a secondary outcome in the trial registry. |
Unlikely. Low drop-out rate. |
Unlikely. “All analyses were conducted on an intention to treat principle.” |
|
Multifactorial |
||||||||
|
Shyu, 2012 |
“[…] were randomly assigned to an intervention or control group by flipping a coin.” |
Unclear. Not stated |
Unlikely. Participants were blinded. |
Likely. “The personnel delivering the intervention […] were not blinded.” |
Likely. “The personnel […] assessing the outcomes were not blinded.” How falls were assessed was not stated. |
Likely. “The present study was a post hoc analysis […].” |
Likely. In total, 30% in the intervention group and 41% in the control group refused to participate or died at various points during follow-up. |
Unlikely. Data was analysed as intention to treat with appropriate analysis for sample attrition. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Exercises |
|
|
Anonynmous, 2015 |
Geen origineel onderzoek |
|
Grabiner, 2014 |
Geen origineel onderzoek |
|
McCullagh, 2012 |
Interventie gericht op opname duur, functie en kwaliteit van leven in kwetsbare ouderen |
|
Poletto, 2015 |
Interventie gefocust op revalidatie |
|
Sherrington, 2014 |
Populatie: thuiswonenden met een follow-up van 12 maanden |
|
Tuunainen, 2013 |
Verpleeghuispatienten |
|
Van het Reve, 2014 |
Verpleeghuispatienten |
|
Medication |
|
|
Hill, 2012 |
Review |
|
Fluid or nutrution therapy |
|
|
Moon, 2012 |
Geen origineel onderzoek; beschrijving van een RCT |
|
Psychological |
|
|
Bird, 2014 |
Letter to the editor |
|
Environment/assistive technology |
|
|
Anonymous, 2012 |
Journalistiek artikel; geen origineel onderzoek |
|
Anonymous, 2014 |
Beschrijving van een product |
|
Vass, 2013 |
Conference abstract; fulltekst geïncludeerd |
|
Knowledge/education interventions |
|
|
AbuAlRub, 2014 |
Geen vergelijkende studie |
|
Clarke, 2012 |
Geen gerandomiseerd onderzoek |
|
Hill, 2013 |
Risicofactoren voor vallen en eigenschappen van vallen |
|
Lee, 2014 |
Review |
|
Multifactorial |
|
|
Anonymous, 2012 |
Geen origineel onderzoek |
|
Chunhu, 2014 |
Geen origineel onderzoek |
|
Colon-Emeric, 2013 |
Betreft een interventie gericht op verpleeghuis staf |
|
Correa, 2012 |
Geen gerandomiseerd onderzoek; geschreven in het Portugees |
|
Dean, 2012 |
Geen origineel onderzoek |
|
Gladman, 2013 |
Patiënten waren ontslagen uit het ziekenhuis |
|
Lohse, 2012 |
Geen vergelijkend onderzoek |
|
Stenvall, 2012 |
Interventie gericht op revalidatie |
|
Trombetti, 2013 |
Geen gerandomiseerd onderzoek |
|
Overig |
|
|
Babine, 2013 |
Preventie van delirium met als gevolg ook preventie van vallen; mogelijk geen origineel onderzoek |
|
Downet, 2013 |
Screening voor valpreventie |
|
Hempel, 2013 |
Review |
|
Kwok, 2014 |
Geen vergelijkend onderzoek |
|
Hung, 2013 |
Geen gerandomiseerd onderzoek |
|
Jones, 2015 |
Editorial/letter (gecheckt) |
|
Li-Chi, 2015 |
Geen gerandomiseerd onderzoek |
|
Peyro Saint Paul, 2013 |
Merendeel populatie verpleeghuispatienten |
|
Resnick, 2013 |
Verpleeghuispatienten |
|
Santesso, 2014 |
Review |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 31-03-2017
Beoordeeld op geldigheid : 01-02-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel in stand gehouden. Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Vereniging voor Klinische Geriatrie of de modules van deze richtlijn nog actueel zijn, behalve de module over het beoordelen van valrisicoverhogende medicatie. De actualiteit van deze module dient uiterlijk 2019 te worden beoordeeld, vanwege de verwachting dat een tegen die tijd gepubliceerde systematische review over valrisicoverhogende medicatie de aanbevelingen kan aanscherpen. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Klinische Geriatrie is regiehouder van deze richtlijnen eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het expliciteren van goed medisch handelen. De doelstelling is het ontwikkelen van een multidisciplinaire evidence-based richtlijn gericht op de secundaire en tertiaire preventie van valincidenten bij ouderen vanaf 65 jaar, toepasbaar in thuissituatie (zelfstandig wonende ouderen), verzorgingshuis, verpleeghuis en ziekenhuis.
Doelgroep
De gebruikers van de richtlijn zijn alle zorgverleners die met een oudere patiënt met een verhoogd valrisico te maken krijgen. Hierbij kan worden gedacht aan hulpverleners in de drie volgende omgevingen:
- thuissituatie (zelfstandig wonende ouderen);
- verzorgings- en verpleeghuis;
- ziekenhuis.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij valpreventie van ouderen van 65 jaar of ouder.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. N. (Nathalie) van der Velde, geriater en internist-ouderengeneeskunde, AMC Amsterdam, NVKG, (voorzitter)
- Dr. Y. (Yvonne) Schoon, geriater, RadboudUMC, Nijmegen, NVKG
- Dr. M.H. (Mariëlle) Emmelot-Vonk, geriater, UMCU Utrecht, NVKG
- Prof. dr. A.B. (Andrea) Maier, internist-ouderengeneeskunde, VUmc, Amsterdam, (tot januari 2016), NIV
- Drs. H.H.M. (Harianne) Hegge, internist-ouderengeneeskunde, UMCG, Groningen, (vanaf januari 2016), NIV
- Dr. J.H.W. (Joost) Rutten, internist-vasculair geneeskundig, RadboudUMC, Nijmegen, NIV
- Prof. dr. J.G. (Gert) van Dijk, neuroloog, LUMC, Leiden, NVN
- Dr. A.J.J. (Arnaud) Aerts, cardioloog, Stichting Zuyderland Medisch Centrum, Sittard-Geleen/Heerlen, NVVC
Klankbordgroep:
- Dr. E. (Ellen) Smulders, wetenschappelijk onderzoeker, RadboudUMC, Nijmegen, KNGF
- M. (Myrthe) Pruijn, ergotherapeut, Slotervaartziekenhuis, Amsterdam, EN
- M. (Miran) van Eijk, verpleegkundig specialist, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, V&VN
- R. (Rinie) Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
- C. (Charlotte) Scherphof, beleidsmedewerker, Patiëntenfederatie Nederland (tot september 2016)
- W. (Willem) Vos, huisarts, huisartsenpraktijk W. Vos, NHG (tot maart 2016)
- C.S. (Corrie) Jongsma, huisarts, W.J.M. Brunninkhuis en C.S. Jongsma, huisartsen, Drachten, NHG (vanaf april 2016)
- Prof. dr. W. (Willem) Lems, reumatoloog, VUmc, Amsterdam, NVR
- M. (Marion) de Rooi, MSc, SEH-arts KNMG, Zaans Medisch Centrum, Zaandam, NVSHA
- Drs. A. (Anneke) van Strien- van Merkestein, specialist ouderengeneeskunde, Saffier de Residentie groep, Den Haag, Verenso
Met ondersteuning van:
- Dr. B.H. (Bernardine) Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
- Drs. E.E. (Eva) Volmeijer, adviseur, Kennisinstituut van Medisch Specialisten
- A.A. (Toon) Lamberts, MSc, beleidsadviseur, NVKG
- M. (Monique) Wessels, MSc, medisch informatiespecialist, Kennisinstituut van Medisch Specalisten
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Met dank aan:
- Dr. G. (Geeske) Peters, (senior) research fellow, Global Brain Health Institute, Brisbane Australië
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van der Velde |
Geriater en internist-ouderengeneeskunde |
Postdoc geriatrie Erasmus MC (onbetaald) werkgroeplid werkgroep wetenschap (onbetaald) Lid sectie NIV ouderengeneeskunde (vacatiegelden) Voorzitter SIG valnetwerk NVKG (onbetaald) Werkgroeplid EUGMS SIG falls fractive preventies (onbetaald) Voorzitter EU werkgroep “knowledge dissmination on fall-risk-increasing drugs (onbetaald) |
B-PROOF-NED ZonMW-effect. Genetische variatie op medicatie gerelateerd vallen Amsterdams Universitair Fonds: 'Val me Bij'project (kennisdissiminatie valrisicoverhogende medicatie) 'Gepersonaliseerde medicatieaanpassing bij oudere vallers' ZonMW 'SeniorStap' (medeaanvrager) RAAK: 'Bewegingsregistratie en Analyse voor Valrisicoschatting bij Ouderen' (medeaanvrager) |
Geen actie (valt buiten de afbakening van de richtlijn) |
|
Schoon |
Geriater |
Voorzitter regionaal valpreventie Netwerk Nijmegen |
Projectleider KWF beleidsprojecten |
Geen actie (vallen buiten de afbakening van de richtlijn) |
|
Emmelot-Vonk |
Geriater |
Bestuurslid stichting IWO (interdisciplinaire werkgroep osteoporose) (onkostenvergoeding). Voorzitter werkgroep wetenschap NVKG (onbetaald). Werkgroeplid SIG valnetwerk NVKG (onbetaald). Werkgroeplid EUGMS SIG Falls and fractures prevention (onbetaald). Full board member EUGMS (onbetaald). Lid werkgroep richtlijnen NVKG (onbetaald). |
- |
Geen actie |
|
Maier |
Internist-ouderengeneeskunde |
Bestuur Vilans |
Onderzoek met Nutricia sacropenie; onderzoek naar myalgie (FP7-project) |
Geen actie (vallen buiten de afbakening van de richtlijn) |
|
Hegge |
Geriater en internist-ouderengeneeskunde |
- |
- |
Geen actie |
|
Rutten |
Internist-vasculair geneeskundige |
- |
- |
Geen actie |
|
Van Dijk |
Neuroloog |
Voorzitter werkgroep Syncope |
- |
Geen actie |
|
Aerts |
Cardioloog |
Lid richtlijnenforum commissie kwaliteit NVVC Lid werkgroep Syncope |
Carelink studie stichting Epilepsie Instellingen Nederland |
Geen actie (valt buiten de afbakening van het de richtlijn) |
|
Smulders |
Hoofddocent Master Geriatric Physical Therapy Avans+ Wetenschappelijk onderzoeker Radboud UMC afdeling revalidatie |
Cursusleider en docent Paramedisch instituut (betaald)
|
- |
Geen actie |
|
Pruijn |
Ergotherapeut |
- |
- |
Geen actie |
|
Van Eijk |
Verpleegkundig specialist |
Gastdocent Radboud Zorgacademie (betaald) |
- |
Geen actie |
|
Lammers |
Beleidsmedewerker |
- |
- |
Geen actie |
|
Scherphof |
Beleidsmedewerker |
- |
- |
Geen actie |
|
Vos |
Huisarts |
- |
- |
Geen actie |
|
Jongsma |
Huisarts |
Bestuur Laego (betaald) |
- |
Geen actie |
|
Lems |
Reumatoloog |
Adviesraden (betaald) :MSD, Amgen, Eli Lilly, Takeda, Will Pharma, Pfizer, Servier, Novartis, Roche. Wetenschappelijk secretaris NV Reumatologie Hoofdredacteur tijdschrift reumatologie. |
- |
Geen actie (betreft advies over reumamedicatie of ostoeporose medicatie ) |
|
De Rooi |
SEH-arts KNMG |
- |
- |
Geen actie |
|
Van Strien-van Merkestein |
Specialist ouderengeneeskunde |
- |
- |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland in de klankbordgroep op te nemen. Daarnaast is gebruik gemaakt van informatie uit kwalitatieve studies (compliantie en patiëntenpreferenties) die naar voren zijn gekomen door het zoekfilter patiëntenperspectief toe te passen. Tot slot is gebruik gemaakt van regionaal verkregen patientenfocusgroep informatie (regio Nijmegen).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn “Richtlijn Preventie van valincidenten bij ouderen” NVKG 2004 op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door Ergotherapie, KNGF, KNMP, NHG, NIV, NVKG, NVSHA, NVZ, NVZA, V&VN, VeiligheidNL, Verenso en Zorginstituut Nederland via invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|||||||||||||||||||||||||||||||||||||||
|
Medline (OVID) Aug. 2015 |
1 Accidental Falls/ (16942) 2 (falls or faller$1).tw. (32735) 3 1 or 2 (40806) 4 exp Aged/ (2494674) 5 (senior? or elderly or older).tw. (468589) 6 4 or 5 (2694517) 7 3 and 6 (17530) 8 limit 7 to yr="2012 -Current" (4769) 9 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial or comparative study).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2576065) 10 8 and 9 (1304) – 1190 uniek |
2923 |
|||||||||||||||||||||||||||||||||||||||
|
Embase (Elsevier) |
'falling'/exp OR falls:ab,ti OR fallers:ab,ti AND ('aged'/exp OR elderly:ab,ti OR senior*:ab,ti OR older:ab,ti) AND [2012-2015]/py AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR 'comparative study'/exp OR placebo*:ab,ti) NOT 'conference abstract':it AND [embase]/lim (1142) - 699 uniek |
||||||||||||||||||||||||||||||||||||||||
|
Cochrane (Wiley) |
#1 MeSH descriptor: [Accidental Falls] explode all trees #2 ("falls" or "faller*"):ti,ab #3 #1 or #2 #4 MeSH descriptor: [Aged] explode all trees #5 ("older" or "senior*" or "elderly"):ti,ab #6 #4 or #5 #7 #3 and #6 Publication Year from 2012 to 2015 (395) – 89 uniek |
||||||||||||||||||||||||||||||||||||||||
|
Cinahl |
|
