Wondbeschermers bij laparotomie
Uitgangsvraag
Wat is de plaats van wondbeschermers (wondbeschermingshulpmiddelen) bij chirurgische patiënten ter preventie van postoperatieve wondinfecties?1
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
1 De WHO-richtlijn beschrijft geen uitgangsvragen. De uitgangsvragen voor deze module zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
Aanbeveling
Overweeg het gebruik van wondbeschermers (WP) bij schoon-gecontamineerde en gecontamineerde abdominale chirurgische ingrepen en bij abdominale ingrepen met verontreiniging om het aantal postoperatieve wondinfecties te verminderen [WHO, 2018].
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van wondbeschermingshulpmiddelen in vergelijking met conventionele wondbescherming bij patiënten die chirurgische procedures ondergaan. Postoperatieve wondinfecties werden als cruciale uitkomstmaat gedefinieerd. Een verschil van 10% voor continue uitkomstmaten, een verschil in relatief risico kleiner 0.95 of groter dan 1.05 voor infectie-gerelateerde mortaliteit en een relatief risico kleiner dan 0.80 of groter dan 1.25 tussen beide interventies voor overige dichotome uitkomstmaten werden als klinisch relevant verschillend beschouwd.
Er werden elf studies geïncludeerd in de literatuuranalyse. Het is op basis van de literatuur vanwege de lage bewijskracht onduidelijk of wondbeschermers de kans op het verkrijgen van postoperatieve wondinfecties reduceren wanneer patiënten een chirurgische procedure ondergaan (RR 0.49 (95% BI 0.34 tot 0.69). De bewijskracht werd als ‘laag’ ingeschaald vanwege de kans op aanwezigheid van selectie bias. Hierdoor is de bewijskracht met twee niveaus afgewaardeerd.
Bij patiënten met abdominale adhesies kan het inbrengen van een wondbeschermer moeilijk zijn en leiden tot de noodzaak om de incisie te vergroten, iatrogeen letsel aan de dunne darm en een langere operatieduur. Er kan ook beperkte ruimte zijn om toegang te krijgen tot het operatiegebied na het inbrengen van het hulpmiddel. Derhalve moet de chirurg vertrouwd zijn met het hanteren van een wondbeschermer tijdens het plaatsen, in de operatiefase, en bij het verwijderen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Er zijn geen onderzoeken bekend naar de waarden en voorkeuren van patiënten met betrekking tot deze interventie. Patiënten zullen zeker de voorkeur geven aan behandeling door chirurgen die vertrouwd zijn met het gebruik van WP-apparaten om het risico op complicaties te verkleinen.
Kosten (middelenbeslag)
Een aantal studies rapporteerden de kosteneffectiviteit van de interventie (Lee, 2009; Pinkey, 2013). Lee (2009) vond het gebruik van WP's kosteneffectief terwijl één ander groter onderzoek dat niet vond (Gheorghe, 2014). Sookhai (1999) berekende dat het gebruik van wondbeschermers zou hebben geleid tot een potentiële besparing van US$ 319,913 tegen totale kosten van US$ 1,620 per patiënt per procedure. Lee (2009) berekende een potentiële besparing van US$ 430 per patiënt per procedure. Cheng (2012) concludeerde dat er 350 Britse pond nodig is om één waarschijnlijke oppervlakkige SSI te voorkomen die 117 Britse pond kost om te behandelen. De auteurs vonden de extra kosten echter te moeilijk om te kwantificeren. Een kosteneffectieve analyse van een RCT waarin een WP met enkele ring werd vergeleken met standaard wondbescherming, toonde aan dat de verhouding van de marginale kosten per voor kwaliteit gecorrigeerd levensjaar (QALY) niet de moeite waard was (Gheorghe, 2014). In dat onderzoek was het gebruik van een WP-apparaat duurder en even effectief in vergelijking met standaardzorg, maar er was aanzienlijke onzekerheid over de incrementele kosten en QALY's.
Aanvaardbaarheid, haalbaarheid en implementatie
Aangezien deze interventie met kosten gepaard gaat, zal het veld veel bewijs willen zien om wondbeschermers te gaan gebruiken. Het bewijsniveau is laag tot zeer laag, wat implementatie van wondbeschermers minder aanvaardbaar maakt. Tegelijkertijd zijn er geen alternatieven die zowel de wondranden beschermen als de laparotomiewond openspreiden, dus gebruiksgemak kan veel uit maken. Bij laparoscopische ingrepen met een hand-assisted of extractiesite via een Pfannenstiel incisie is de duo functie van wondrandbescherming en openspreiden van wondbeschermingshulpmiddelen aantrekkelijk vergeleken met het alternatief van een laparotomiespreider die geen wondbescherming geeft.
Duurzaamheid
Duurzaamheid is niet benoemd in de WHO-richtlijn en er is niet aanvullend naar gezocht.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Literatuur met een lage bewijskracht toont aan dat wondbeschermers met enkele of dubbele ring een mogelijk voordelig effect kunnen hebben bij het verminderen van het aantal POWI in vergelijking met reguliere wondbescherming. Meta-regressieanalyse toonde geen sterk bewijs voor een verschil in effect tussen wondbeschermers met één of twee ringen. Er was ook geen bewijs dat het effect verschilde tussen schone en vervuilde chirurgie of bij enige andere chirurgische ingreep. De werkgroep was het erover eens om het gebruik van een van beide wondbeschermers te overwegen bij abdominale chirurgie met laparotomie om POWI’s te verminderen. Gezien de zeer lage kwaliteit van het bewijs werd de sterkte van de aanbeveling als voorwaardelijk beschouwd om de noodzaak te benadrukken van zorgvuldige lokale evaluatie over de vraag of en hoe deze aanbeveling moet worden toegepast. In het bijzonder met betrekking tot de beschikbaarheid van deze hulpmiddelen en de bijbehorende kosten.
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
Onderbouwing
Achtergrond
Hoewel er door chirurgen veel aandacht wordt besteed aan het voorkomen van postoperatieve wondinfecties (POWI’s), zijn wondinfecties van de plaats van incisie een frequent postoperatief ongewenst voorval dat de veiligheid van de patiënt in gevaar brengt en de kosten van de gezondheidszorg verhoogt. Een nauwgezette aseptische operatietechniek en de toediening van adequate antibioticaprofylaxe voorkomen postoperatieve wondinfectie door contaminatie te verminderen en micro-organismen die de operatieplaats binnendringen te elimineren.
Conventionele chirurgische afdekdoeken of disposable afdekmateriaal met kleefrand worden gewoonlijk door chirurgen gebruikt om het aseptische operatiegebied te beperken en de wondranden af te dekken. Deze mechanische barrière kan echter losraken of mogelijk gecontamineerd raken.
Er bestaan verschillende chirurgische wondbeschermers (WP). Deze nieuwe chirurgische hulpmiddelen bestaan uit een niet-klevende plastic sheet die is bevestigd aan een enkele of dubbele flexibele rubberen ring die de plastic sheet stevig om de wondranden heen vastzet, waarbij de laparotomiewond verder wordt opengesperd. Bij een enkele flexibele rubberen ring bevindt deze ring zich onder de wondrand tegen het peritoneale oppervlak. Bij de dubbele flexibele rubber ring is eerste ring onder de wondrand tegen het peritoneum aan en de tweede ring op de huid rondom de laparotomiewond; de plastic sheet bevindt zich daartussen en bedekt de incisierand rondom. Deze chirurgische hulpmiddelen zijn op de markt beschikbaar, maar het is belangrijk om de effectiviteit en kosteneffectiviteit te onderzoeken.
Deze module betreft een adaptatie van de module ‘Wound protector devices’ van de WHO-richtlijn ‘Global guidelines for the prevention of surgical site infection’ (2018). Voor een toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
Conclusies / Summary of Findings
1. Surgical site infections (all studies; single-ring and double-ring)1
|
Low GRADE |
Use of wound protector devices (single-ring and double-ring) may reduce the incidence of surgical site infections when compared to conventional wound protection in patients undergoing surgical operations (any type of procedure).
Sources: Baier (2012); Brunet (1994); Cheng (2012); Horiuchi (2007); Lee (2009); Mihaljevic (2014); Pinkney (2013); Redmond (1994); Reid (2010); Sookhai (1999); Theodoridis (2011). |
Surgical site infections (single-ring)
|
Low GRADE |
Use of single-ring wound protector devices likely reduces surgical site infections when compared to conventional wound protection in patients undergoing surgical operations (any type of procedure).
Sources: Baier (2012); Brunet (1994); Mihaljevic (2014); Pinkney (2013); Redmond (1994); Sookhai (1999). |
Surgical site infections (double-ring)
|
Low GRADE |
Use of single-ring wound protector devices likely reduces surgical site infections when compared to conventional wound protection in patients undergoing surgical operations (any type of procedure).
Sources: Cheng (2012); Horiuchi (2007); Lee (2009); Reid (2010); Theodoridis (2011). |
2. Surgical site infections (degree of wound contamination)1
Surgical site infections (clean-contaminated surgery)
|
Low GRADE |
Use of wound protector devices likely reduces surgical site infections when compared to conventional wound protection in patients undergoing clean-contaminated surgery (any type of procedure).
Sources: Cheng (2012); Mihaljevic (2014); Pinkney (2013); Redmond (1994); Sookhai (1999). |
Surgical site infections (contaminated surgery)
|
Low GRADE |
Use of wound protector devices likely reduces surgical site infections when compared to conventional wound protection in patients undergoing contaminated surgery (any type of procedure).
Sources: Brunet (1994); Mihaljevic (2014); Pinkney (2013); Redmond (1994); Sookhai (1999). |
Surgical site infections (dirty surgery)
|
Low GRADE |
Use of single-ring wound protector devices likely results in little to no difference in surgical site infections when compared to conventional wound protection in patients undergoing dirty surgery (any type of procedure).
Sources: Brunet (1994); Lee (2009); Mihaljevic (2014); Pinkney (2013); Redmond (1994); Sookhai (1999). |
3. SSI-attributable mortality1
|
No GRADE |
No evidence was found regarding the effect of wound protector devices on SSI-attributable mortality when compared to conventional wound protection in patients undergoing surgical operations (any type of procedure).
Sources: - |
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
1 The WHO-guideline did not provide GRADE-conclusions for the effect of wound protector devices compared to conventional wound protection in patients undergoing clean-contaminated, contaminated, and dirty surgery. The GRADE-conclusions for clean-contaminated, contaminated, and dirty surgery for this module were prepared in accordance with the standard procedures of the Knowledge Institute of the Federation of Medical Specialists.
Samenvatting literatuur
Description of studies
Eleven studies, including ten randomized controlled trials (Baier, 2012; Cheng, 2012; Horiuchi, 2007; Lee, 2009; Mihaljevic, 2014; Pinkney, 2013; Redmond, 1994; Reid, 2010; Sookhai, 1999; Theodoridis, 2011) and one prospective controlled trial (Brunet, 1994), comparing the use of a WP device vs. conventional wound protection were identified with an SSI outcome. Patients were adults undergoing abdominal surgical procedures with laparotomy.
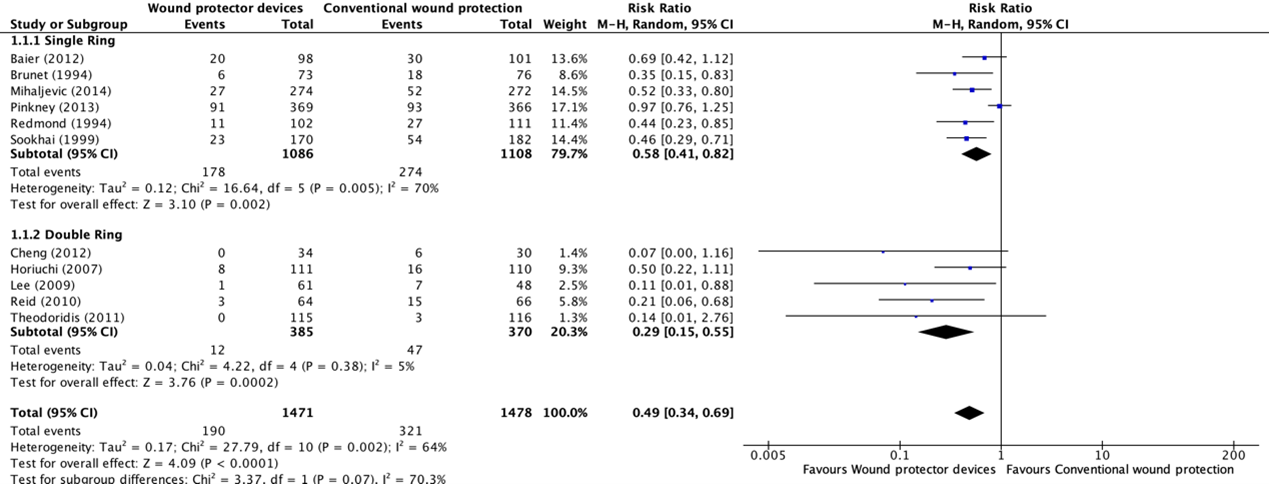
Six studies (Baier, 2012), Mihaljevic, 2014; Pinkney, 2013; Remond, 1994), Sookhai, 1999; Brunet, 1994) used a single-ring WP device as the intervention. Among these, four trials (Mihaljevic, 2014; Redmond, 1994; Sookhai, 1999; Brunet, 1994) demonstrated that the use of a single-ring WP led to a significant reduction of the SSI rate when compared with standard wound protection. However, two trials showed no difference of risk (Baier, 2012; Pinkney, 2013). A meta-analysis of this subgroup (Comparisons) showed the benefit of a single-ring WP in reducing the SSI rate when compared with standard wound protection (OR: 0.51; 95% CI; 0.34–0.76) (RR: 0.58 95% CI 0.41 to 0.82).
Five (Cheng, 2012; Horiuchi, 2007; Lee, 2009; Reid, 2010; Theodoridis, 2011) of the eleven studies used a double-ring WP device as the intervention. In two trials (Lee, 2009; Reid, 2010), there was a significant reduction of the SSI rate when using a double-ring WP. Three trials (Cheng, 2012; Horiuchi, 2007; Theodoridis, 2011) showed no difference in risk. A meta-analysis of this subgroup (Comparisons) showed the benefit of a double-ring WP in reducing the rate of SSI (OR: 0.25; 95% CI: 0.13– 0.50) (RR: 0.29 95% CI 0.15 to 0.55).
Results
1. Surgical site infections
The overall meta-analysis (Comparisons) including all eleven studies showed the benefit of using a WP device when compared with standard wound protection in reducing the rate of SSI (OR: 0.42; 95% CI: 0.28 to 0.62) (RR: 49 95% CI: 0.34 to 0.69). In meta-regression analysis, there was no strong evidence for a difference in the effect between a single- and double-ring WP (P=0.107). A sensitivity analysis comparing the RCTs, and the prospective controlled trial (Brunet, 1994) indicated that there was no difference in the results, irrespective of whether the quasi-randomized trial was included or not.
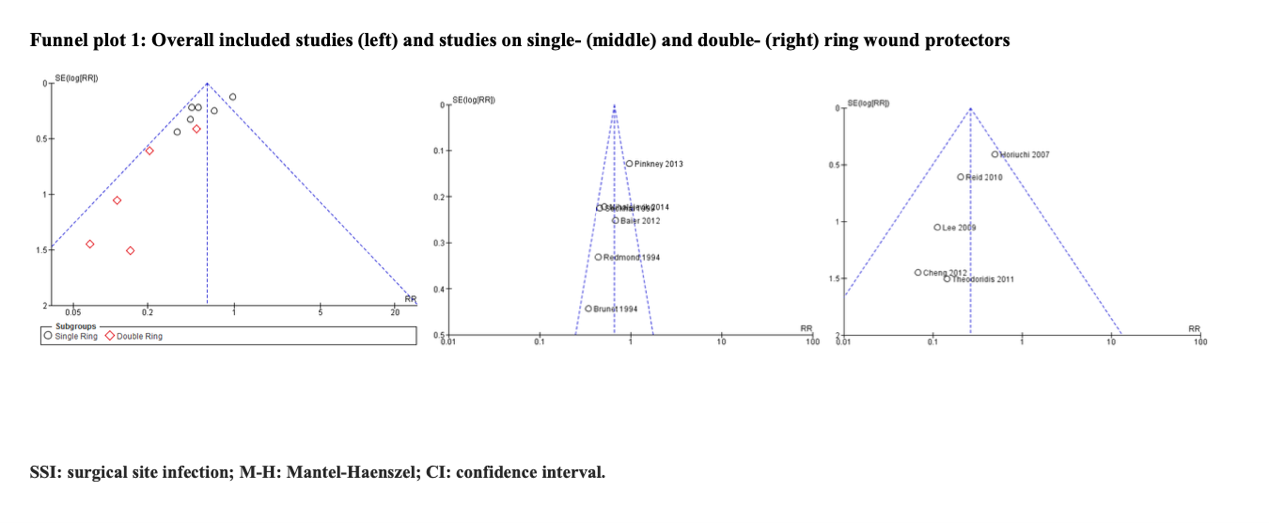
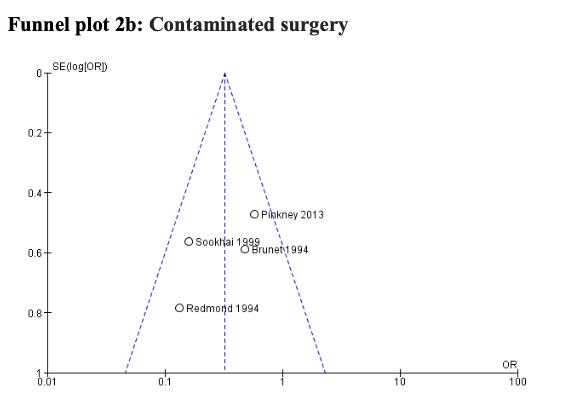
The quality of the evidence for this comparison was very low due to risk of bias, inconsistency, and publication bias (Risk of bias assessment of the included studies). Most studies had an unclear to high risk in random sequence generation and unclear allocation concealment. There was considerable asymmetry observed in the funnel plot, compatible with the preferential publication of small studies demonstrating a benefit (Comparisons).
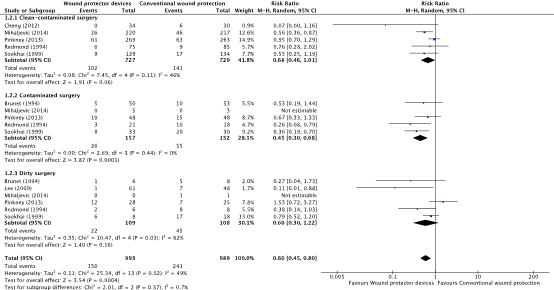
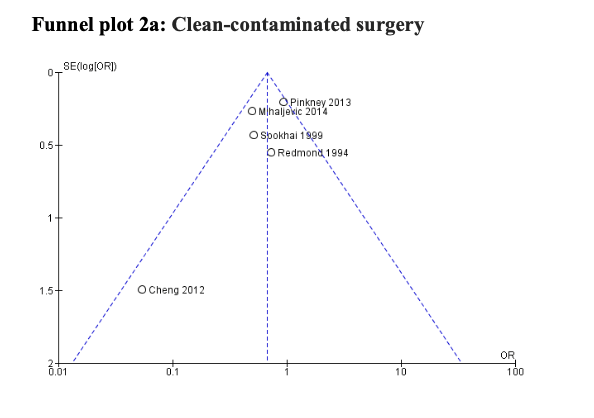
A subgroup analysis discriminating between different degrees of wound contamination in abdominal surgery (clean-contaminated, contaminated and dirty) showed that the use of a WP device is beneficial in reducing the SSI rate when compared to standard wound protection in clean-contaminated (OR: 0.63; 95% CI: 0.4–0.99) (RR: 0.68 95% CI 0.46 to 1.01) and contaminated (OR: 0.31; 95% CI: 0.15–0.64) (RR: 0.45 95% CI: 0.30 to 0.68) procedures, but not in dirty (OR: 0.22; 95% CI: 0.04–1.21) (RR: 0.60 95% CI 0.30 to 1.28) surgery (Comparisons). However, in meta-regression analysis, there was no evidence that the effect differed between clean-contaminated (P=0.244) or contaminated (P=0.305) or dirty (P=0.675) surgery and other surgery.
The body of retrieved evidence focused on adult patients and no study was available in the paediatric population. The literature search did not identify any studies that reported SSI-attributable mortality.
1. Surgical site infections (all studies; single-ring and double-ring)
Comparison 1: Wound protector device (single- and double-ring) vs. conventional wound protection in abdominal surgery
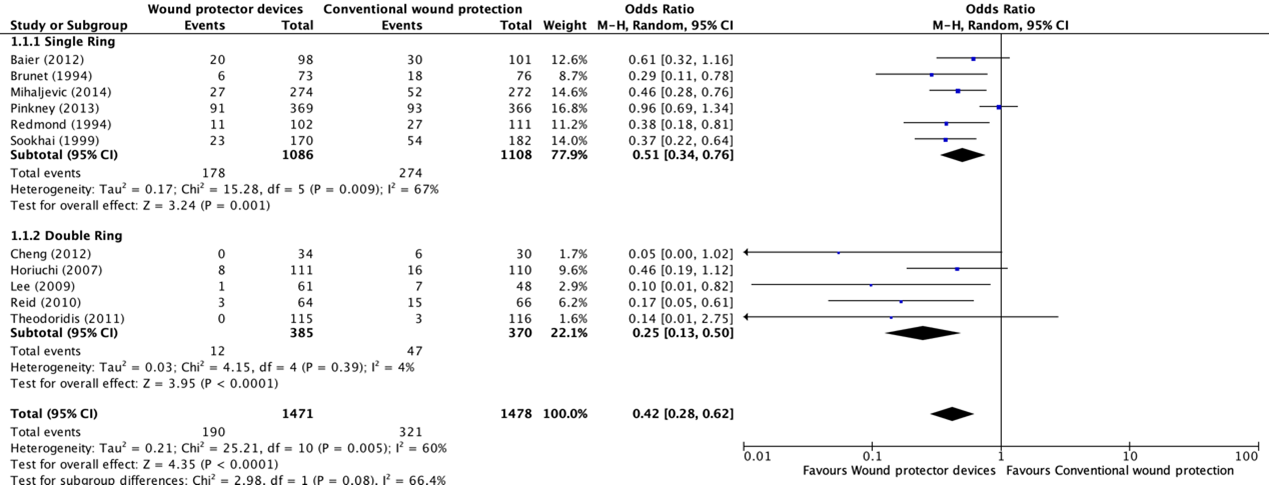
Forest plot showing the comparison between wound protector devices to conventional wound protection for surgical site infections. Pooled risk-ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
2. Surgical site infections (degree of wound contamination)
Comparison 2: Wound protector vs. no wound protector. Subgroup analysis of degree of wound contamination (clean-contaminated, contaminated, and dirty)
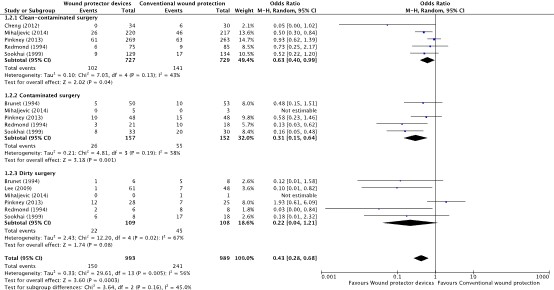
Forest plot showing the comparison between wound protector devices to conventional wound protection for surgical site infections in clean-contaminated surgery, contaminated surgery, and dirty surgery. Pooled odds-ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
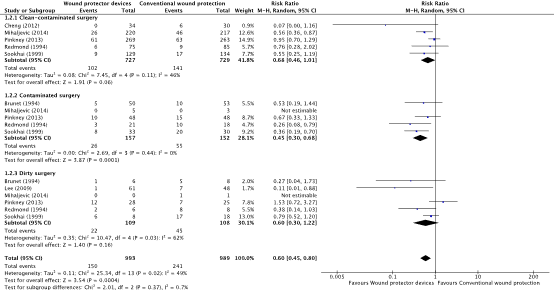
Forest plot showing the comparison between wound protector devices to conventional wound protection for surgical site infections in clean-contaminated surgery, contaminated surgery, and dirty surgery. Pooled risk-ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
3. SSI-attributable mortality
The literature search did not identify any studies that reported SSI-attributable mortality.
Level of evidence of the literature1
1. Surgical site infections (all studies; single-ring and double-ring)
The level of evidence regarding the outcome surgical site infections (overall analysis) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of risk of selection bias (risk of bias, -1) and risk of publication bias (other bias, -1). The level of evidence was considered as low (GRADE Table).
Surgical site infections (single-ring)
The level of evidence regarding the outcome surgical site infections (single-ring) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of risk of selection bias (risk of bias, -1) and because of high heterogeneity (inconsistency, -1) The level of evidence was considered as low (GRADE Table).
Surgical site infections (double-ring)
The level of evidence regarding the outcome surgical site infections (double-ring) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of risk of selection bias (risk of bias, -1) and because the optimal information size was not met (imprecision, -1). The level of evidence was considered as low (GRADE Table).
2. Surgical site infections (degree of wound contamination)
Surgical site infections (clean-contaminated surgery)
The level of evidence regarding the outcome surgical site infections (clean-contaminated surgery) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of risk of selection bias (risk of bias, -1) and the wide confidence interval crossing the lower threshold of clinical relevance (imprecision, -1). The level of evidence was considered as low (GRADE Table).
Surgical site infections (contaminated surgery)
The level of evidence regarding the outcome surgical site infections (contaminated surgery) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of the risk of selection bias (risk of bias, -1) and the small number of events (imprecision, -1). The level of evidence was considered as low (GRADE Table).
Surgical site infections (dirty surgery)
The level of evidence regarding the outcome surgical site infections (clean-contaminated surgery) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of risk of selection bias (risk of bias, -1) and because of high heterogeneity (inconsistency, -1). The level of evidence was considered as low (GRADE Table).
3. SSI-attributable mortality
Since none of the included studies reported information regarding SSI-attributable mortality, the level of evidence could not be graded.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
1 The WHO-guideline did not provide GRADE-conclusions for the effect of wound protector devices compared to conventional wound protection in patients undergoing clean-contaminated, contaminated, and dirty surgery. The GRADE-conclusions for clean-contaminated, contaminated, and dirty surgery for this module were prepared in accordance with the standard procedures of the Knowledge Institute of the Federation of Medical Specialists.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the (un)beneficial effects of wound protector devices on the incidence of surgical site infections (SSI) and SSI-attributable mortality in inpatients and outpatients undergoing surgical operations (any type of procedure)?1
P: Inpatients and outpatients of any age undergoing either elective or urgent abdominal surgery
through conventional open access.
I: Use of single or double plastic ring wound protector (WP) devices.
C: Conventional wound protection, mainly through placing wet towels between the wound edge and steel type retractors.
O: Surgical site infections (SSI), SSI-attributable mortality.
Relevant outcome measures2
The guideline development group considered surgical site infections as a critical outcome for decision making; and SSI-attributable mortality as an important outcome for decision making.
The working group defined a threshold of 10% for continuous outcomes, a relative risk ratio (RR) of <0.95 and >1.05 for SSI-attributable mortality, and a RR of <0.80 and >1.25 for other dichotomous as minimal clinically (patient) important differences.
Search and select (Methods)
The WHO searched the following databases: Medline (PubMed); EMBASE; Cumulative Index to Nursing and Allied Health Literature (CINAHL); Cochrane Central Register of Controlled Trials (CENTRAL); and WHO regional medical databases. The time limit for the review was between 1 January 1990 and 28 November 2014. Language was restricted to English, French and Spanish. A comprehensive list of search terms was used, including Medical Subject Headings (MeSH). The detailed search strategy is available under the "Evidence tabellen" tab.
Two independent reviewers screened the titles and abstracts of retrieved references for potentially relevant studies. The full text of all potentially eligible articles was obtained, and two authors then independently reviewed these for eligibility based on inclusion criteria. Duplicate studies were excluded.
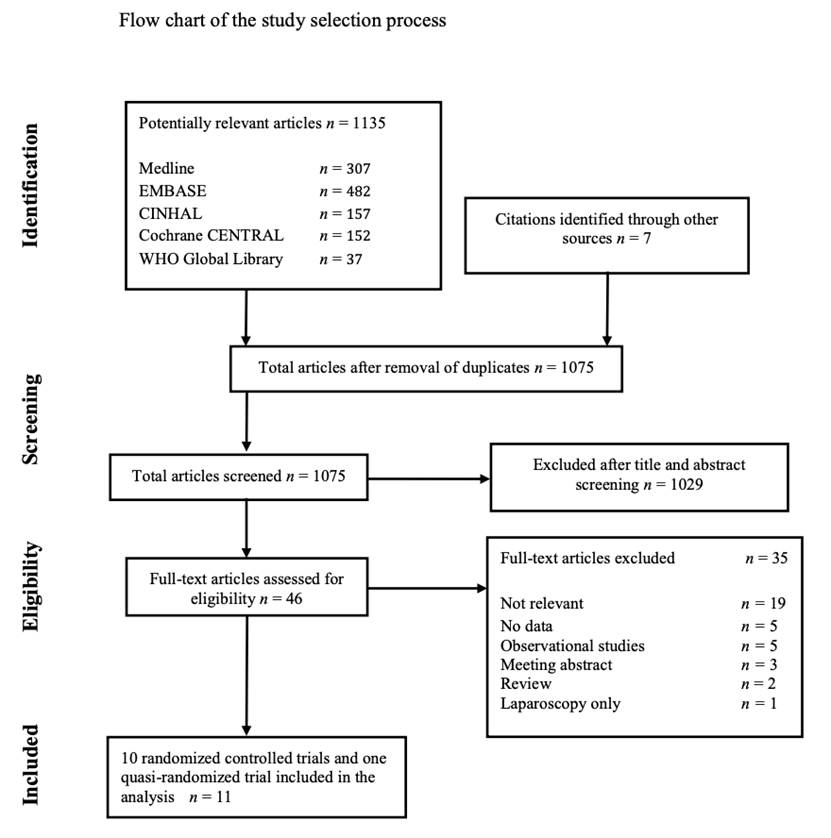
The WHO systematic literature search resulted in 1135 hits. Forty-six studies were initially selected based on title and abstract screening. After reading the full text, thirty-five studies were excluded (Study selection) ten randomized controlled trial and one quasi-randomized controlled trial were included. The two authors extracted data in a predefined evidence table (Evidence table) and critically appraised the retrieved studies. Quality was assessed using the Cochrane Collaboration tool to assess the risk of bias of randomized controlled studies (RCTs) (3) (Appendix 3). Any disagreements were resolved through discussion or after consultation with the senior author, when necessary. Meta-analyses of available comparisons were performed using Review Manager version 5.3 as appropriate (4) (Comparisons). Adjusted odds ratios (OR) with 95% confidence intervals (CI) were extracted and pooled for each comparison with a random effects model. The Grading of Recommendations Assessment, Development and Evaluation (GRADE) methodology (5) (GRADE Pro software) (6) was used to assess the quality of the body of retrieved evidence (Appendix 5). In addition to the WHO meta-analyses, relative risks (RR) and risk differences (RD) with 95% confidence intervals (CI) were extracted and pooled with a random effects model and added to the current literature analysis.
Results3
Eleven studies were included in the analysis of the literature (Summary of literature). Important study characteristics and results are summarized in Evidence table. The assessment of the risk of bias is summarized in Risk of bias assessment of the included studies.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
1 The working group modified the WHO-search question by including all WHO-defined outcomes.
2 The WHO-guideline did not distinguish between crucial and important outcome measures and did not define thresholds for clinical decision making.
3 The WHO-guideline did not report risk ratios and risk differences.
Evidence tabellen
Studies related to single-ring wound protectors
|
Author, year, references |
Study design/setting |
Population, type of surgery, approach, timing |
Type of wound included |
Intervention
|
Comparison |
Outcome - SSI definitions |
Results |
Limitations |
|
Baier (2012) |
RCT single centre
university hospital.
Germany |
199 patients
Colorectal for malign and benign colorectal diseases. No appendectomy or ostomy reduction.
Laparotomy and laparoscopy-assisted surgery.
Elective antibiotic prophylaxis, skin preparation and sterile draping were standardized.
|
Groups:
1. cleancontaminated 2. contaminated 3. dirty |
n=98
3M SteriDrape™ (3M, St Paul, MN; USA) with ring (3 sizes according to the length of the incision). |
Standard measures and wet cloth towel (n=101) |
Incisional
CDC criteria
Follow-up 30 days (early discharge patients contacted by telephone at day 30) |
I: 20/98 (20%) (superficial SSI: 17/98; deep SSI: 3/98) C: 30/101 (29.7%) (superficial SSI: 22/101; deep SSI: 8/101) P > 0.05 for all SSIs.
OR not provided Lost to follow up: 33 In a subgroup of patients with contaminated or dirty surgery (n=116): I: 10/116 C: 23/116 P <0.05
In a multivariate analysis, wound classification was not a a risk factor. |
Underpowered study: the authors calculated the sample size from a study with 3 times more patients and an expected high effect of 75% SSI decrease. 33 previously included patients were also excluded from the analysis because of reoperation/ complications different from SSI. The authors simply removed them from the analysis. No intention-totreat analysis, no reporting of adverse events. |
|
Brunet (1994) |
Quasi-RCT single centre
November 1991-November 1992
France |
149 patients Abdominal - laparotomy - elective/urgent. |
Groups: 1. clean 2. contaminated 3. dirty |
n=73
Adhesive plastic with ring (3 sizes to adequately encompass the incision). |
n=76
Not specified |
Incisional SSI: non-CDC criteria; pus oozing from the wound.
Follow-up: up to 1 month after surgery |
I: 6/73 (8.2%) C: 18/76 (23.7%) P=0.01
No OR or RR reported SSI rate per group:
1: 0/17 (0%) vs. 3/15 (20%) P=0.09
2: 5/50; 10% vs. 10/53 (18.9%) P=0.2
3: 1/6; 17% vs. 5/8 (62.5%) P=0.12
|
Published in a non-indexed journal. Although there are significant differences, the quality of the study is poor and adverse events and standard measures are not specifically described. Two patients excluded because of technical difficulties in placing the wound ring protector, but unclear if patients were removed from the analysis. Antibiotic prophylaxis was given in elective cases only for colorectal procedures. No significant differences between groups, probably because the study was underpowered. |
|
Mihaljevic (2014) |
RCT
multicentre 16 hospitals
September 2010- November 2012
Germany |
546 patients
Mean age, 68 years
Abdominal – laparotomy - elective. |
Groups: A priori 1. clean 2.cleancontaminated (clean, cleancontaminated, contaminated and dirty at the final analysis) |
n=274
3M SteriDrape™ with ring. |
n=272 Surgical towels |
SSI: CDC criteria
Follow-up: external monitoring. Up to 45 days fixed (2,4,6 and 8) and in between periods (10 to 14 and 30 to 45).
Lost to followup: 46 (all included in the intention-totreat analysis).
Overall mortality (deaths): I: 7 C: 4 Not attributable to study. |
Overall SSI Intention-to-treat analysis I: 53/300 (17.7%) C: 74/294 (25.5%) OR: 0.64 (95% CI : 0.43-0.95) P=0.026
Complete case analysis I: 27/274 (9.9%) C: 52/272 (19.1%) OR: 0.46 (95% CI: 0.28-0.76) P=0.002
Per protocol analysis I: 25/240 (10.4%) C: 52/267 (19.5%) OR: 0.48 (95% CI: 0.29-0.8) P=0.005
Subgroup analysis: for clean contaminated/contaminated I: 26/225 (11.6%) C: 47/221 (21.3%) OR: 0.48 (95% CI: 0.29-0.81) P=0.006 |
No information about how surgeons and the surgical team (nurses, assistants) handle surgical field protectors /towels when contaminated at some point during the surgical procedure. |
|
Pinkney (2013) |
RCT
multicentre 21 hospitals February 2010- January 2012
UK |
735 patients
Median age: I: 66.4 years C: 64.2 years
Abdominal Laparotomy - elective/urgent |
Groups: 1. clean 2. cleancontaminated 3. contaminated 4. dirty |
n=369 (382 randomized; 376 received laparotomy; 7 lost to followup.)
3M SteriDrape™ with ring (3 sizes available). |
n=378 (378 randomized; 373, received laparotomy, 7 lost to followup.)
Surgical towels (surgeon decision) |
Incisional SSI (superficial): CDC criteria.
Follow-up: on days 5 to 7 or at discharge, then on days 30 to 33. For those patients unable to come to the hospital, home visits were planned.
Among the total patients initially assessed for eligibility, 118 were excluded (reasons well defined) prior to randomization.
Lost to followup: 14 (7 in each group). |
I: 91/369 (24.7%) C: 93/366 (25.4%) OR: 0.97 (95% CI: 0.69-1.36) P=0.85
Assuming the maximum benefit from the intervention in post hoc sensitivity analysis: OR: 0.77 (95% CI: 0.54-1.09) P=0.14
SSI rate (degree of wound contamination) 1: I: 8/24 (33.3%) C: 7/29 (24.1%)
2: I: 61/269 (22.7%) C: 63/263 (24%)
3: I: 10/48; (20.8%) C: 15/48 (31.3%)
4: I: 12/28 (42.9%) C: 7/25 (28%)
Length of stay (median of days): I: 9 (IQR: 6-15) C: 9 (IQR: 6-14) P=0.83
Overall mortality: no difference I: 8 (2.13%) C: 12 (3.21%) |
SSI not classified other than superficial. Authors reported the rate of superficial incisional infection; no data provided on the overall SSI rate. No information about how surgeons and surgical team (nurses, assistants) handle visibly contaminated surgical field protectors in either group. |
|
Redmond (1994) |
RCT
single centre university hospital
Ireland |
213 patients Mean age: 60 years Gastrointestinall aparotomy - elective/urgent.
Antibiotic prophylaxis and skin preparation standardized. |
Groups: 1. cleancontaminated 2. contaminated 3. dirty |
n=102 WP not specified, poor description. |
n=111 “received no protection”. |
Incisional
SSI: non-CDC criteria; purulent discharge or bacterial growth in wound samples.
Follow-up at postoperative days 5-10 and 30. |
I: 11/102 (10.8%) C: 27/111 (24.3%) P<0.05
OR not provided
SSI rate per group: 1: I: 6/75 (8%) C: 9/85 (10.58%)
2: I: 3/21 (14.28%) C: 10/18 (55.5%) 3: I: 2/6 (33.3%) C: 8/8 (100%) |
Study published as an abstract A great amount of information on the methodology is lacking |
|
Sookhai (1999) |
RCT, single centre, university hospital
Ireland |
352 patients
Abdominal laparotomy- not specified
Antibiotic prophylaxis and skin preparation standardized. |
Groups: 1. cleancontaminated 2. contaminated 3. dirty |
n=170 Single-ring WP
"wound protector with a plastic ring placed inside the peritoneal cavity” – “impermeable plastic drape with four adhesive patches” |
N=182
No WP |
Incisional
SSI: non-CDC criteria
Presence of a purulent discharge, a culture positive at discharge, pain/tenderness, localized swelling, erythema or cellulitis occurring within 30 days of surgery.
30-day follow-up. |
I: 23/170 (13.5%) P <0.001 OR for each group:
2: 0.16 (95% CI: 0.05-0.48) I: 8/33 C: 20/30
3: 0.18 (95% CI: 0.01-2.31)
|
Not indicated how patients lost to follow-up were handled- RCT published as a letter in The Lancet. Randomization sequence generation not defined. Intention-to- treat analysis not performed.
|
Studies related to double-ring wound protectors
|
Author, year, references |
Study design/setting |
Population, type of surgery, approach, timing |
Type of wound included |
Intervention
|
Comparison |
Outcome - SSI definitions |
Results |
Limitations |
|
Cheng (2012) |
RCT
single centre university hospital
November 2008- November 2010
Malaysia
|
64 patients
Colorectal laparotomy - elective
Bowel preparation only for ultra-low anterior resection with protective ileostomy.
|
Group:
Clean-contaminated |
n=34
|
n=30
|
ncisional SSI: CDC criteria
30-day follow- up.
|
I: 0/34 (0%) C: 6/30 (20%) P=0.006
OR not provided
Lost to follow- up: 8
|
3 cases per month in a a university hospital department: restricted/low rate of recruitment. No statement about adverse events. No statement about handling of patients lost to follow- up/intention-to- treat.
|
|
Horiuchi (2007) |
RCT
single centre university hospital
September 2003- August 2004
Japan
|
221 patients
Gastrointestinal surgery laparotomy - not specified
They stated "open non- traumatic colorectal and gastric surgery".
Excluded: gastrointestinal perforations.
Groups: gastric colorectal, hepato- pancreato- biliary other.
Antibiotic prophylaxis standardized according to type of surgery. Bowel preparation for colorectal surgery.
|
Group:
Clean-contaminated |
n=111
Alexis®-O double-ring WP (Applied Medical, Rancho Santa Margarita, CA, USA)
Gastric (n=37) colorectal (n=40) hepato- pancreato- biliary (n=23) other (n=11)
|
n=110 Gastric (n=36) colorectal (n=52) hepato- pancreato- biliary (n=18) other (n=4)
|
Incisional SSI: CDC criteria Follow-up unclear
|
S SI - incisional I: 0/111 (0%) C: 9/110 (8.1%) P= 0.002 SSI total SSI total: Analysis for colorectal surgery: difference for incisional SSI found. I: 0/40 (0%) Length of stay: I: 34.4 days Deaths following anastomotic
|
No method of concealment described or follow-up period. Within the colorectal surgery: no description of the degree of wound contamination.
|
|
Lee (2009) |
RCT single centre community teaching hospital May 2006- May 2008 USA
|
109 patients Appendiceal surgery McBurney laparotomy - urgent Groups were comparable for “degree of appendicitis at time of operation”. Antibiotic regimen was standardized (preoperative, simple application, complicated application, ruptured).
|
Group:
Dirty. |
n=61 Alexis®-O double-ring WP (small size, 2.5- 6 cm) “..degree of appendicitis at time of operation”: acute (n=28) suppurative (n=11) gangrenous (n=7) perforated (n=15)
|
n=48 “..degree of appendicitis at time of operation”: acute (n=23) suppurative (n=7) gangrenous (n=4) perforated (n=14)
|
Incisional SSI: not CDC criteria “significant subcutaneous SSI” necessitating wound opening or treatment with antibiotics. Included patients prescribed a separate course of antibiotics after discharge from the hospital. Follow-up: 21 days
|
I: 1/61(1.6%) C: 7/48 (14.6%) P=0.02 I: Perforated (n=1) OR not provided Lost to follow- up: 1
|
Study SSI definition: it is quite common that patients operated for a complicated appendicitis receive an additional antibiotic treatment, regardless of the postoperative outcome. However, there is a risk that a patient with an uneventful postoperative course could be classified in the SSI incisional infection group because of the postoperative antibiotic treatment. No description of the size of the incision. |
|
Reid (2010) |
RCT multicentre 4 hospitals January 2007- June 2008 Australia
|
130 patients (mean age, 63 years) Colorectal (benign and malign) surgery. Laparotomy - elective
|
Group: clean- contaminated
|
n=64 Alexis®-O double-ring WP
|
n=66 Of note, it is not clear if some additional protection was used and placed in between the regular retractors and the wound incision
|
Incisional SSI: CDC criteria Follow-up: 30 days
|
I: 3/64 (4.69%) C: 16/66 (22.7%) P=0.004 OR not provided Number needed to treat to prevent 1 SSI: 6 (95% CI: 3.4- 15) Absolute risk reduction of 18.04% by employing a WP Mean length of stay: Lost to follow- up:
|
8 different surgeons were involved; the proportion of operations was unequally distributed among all surgeons. Bowel preparation plus surgical technique depending on surgeon. 5 patients excluded from the analysis; 2 deaths and 3 protocol violations. No clear statement regarding death as an adverse event. No statement about handling of patients lost to follow- up/intention-to- treat. The authors report one organ/space infection in each group and 2 anastomotic leaks in the intervention group (unclear whether the patients had also incisional SSI or not). |
|
Theodoritis (2011) |
RCT single centre university hospital January 2008- July 2008 Greece
|
231 patients C-section Pfanestiel laparotomy - elective or urgent-emergent Both arms have the same antibiotic prophylaxis after cord clamping - 2 doses up to a maximum of 24 hours |
Group: clean- contaminated
|
n=115 Alexis®-O double-ring WP
|
n=116
|
Incisional SSI: not CDC criteria Wound dehiscence, pain or tenderness at the lower abdomen, localized swelling, redness and heat or purulent discharge from the wound. Follow-up unclear. |
I: 0/115 (0%) C: 3/116 (2.6%) P: 0,006 No OR provided
|
Unclear process of randomization and blinding. No data are provided on follow-up, adverse events, intention-to-treat analysis and blind assessment. |
SSI: surgical site infection; RCT: randomized controlled trial; WP: wound protector; CDC: Centers for Disease Prevention and Control; I: intervention; C: control; SSI: surgical site infection; OR: odds ratio; CI: confidence interval.
Risk of bias assessment of the included studies
|
Type of study |
RCT Author, year, reference |
Random sequence generation
|
Allocation concealment |
Blinding of participants |
Blinding for care providers |
Blinding of outcome assessment |
Incomplete outcome data |
Selective outcome reporting |
Other sources of bias |
|
Single-ring WP |
Baier (2012) |
HIGH |
UNCLEAR |
HIGH |
HIGH |
UNCLEAR |
HIGH |
LOW |
- |
|
Brunet (1994) |
HIGH1 |
UNCLEAR |
LOW |
HIGH |
HIGH |
HIGH |
LOW |
HIGH2 |
|
|
Mihaljevic (2014) |
LOW |
LOW |
LOW |
HIGH |
LOW |
LOW |
LOW |
- |
|
|
Pinkney (2013) |
LOW |
LOW |
LOW |
HIGH |
LOW |
LOW |
LOW |
- |
|
|
Redmond (1994) |
UNCLEAR |
UNCLEAR |
UNCLEAR |
HIGH |
LOW |
UNCLEAR |
LOW |
- |
|
|
Sookhai (1999) |
UNCLEAR |
UNCLEAR |
UNCLEAR |
HIGH |
LOW |
UNCLEAR |
UNCLEAR |
- |
|
|
Double-ring WP |
Cheng (2012) |
UNCLEAR |
LOW |
LOW |
HIGH |
|
LOW |
HIGH |
HIGH3 |
|
Horiuchi (2007) |
UNCLEAR |
UNCLEAR |
UNCLEAR |
HIGH |
LOW |
UNCLEAR |
UNCLEAR |
- |
|
|
Lee (2009) |
LOW |
UNCLEAR |
LOW |
HIGH |
LOW |
LOW |
LOW |
- |
|
|
Reid (2010) |
LOW |
LOW |
LOW |
HIGH |
LOW |
LOW |
LOW |
HIGH4 |
|
|
Theodoridis (2011) |
UNCLEAR |
UNCLEAR |
UNCLEAR |
HIGH |
UNCLEAR |
UNCLEAR |
LOW |
- |
1 Quasi-randomized controlled trial.
2 Antibiotic prophylaxis was given in elective cases only for colorectal operations.
3 3 cases per month in a university hospital department: restricted/low rate of recruitment. The number of procedures per surgeon is not provided, thus a potential bias might be
derived from such a possible imbalance if poor performers are in the standard group.
4 The proportion of operations was unequally distributed among all surgeons who participated in the study. The surgeon may contribute to different SSI rates.
WP: wound protector
Comparisons
In addition to the odds ratios (OR) reported by the WHO, relative risks (RR) and risk differences (RD) with 95% confidence intervals (CI) were extracted and pooled with a random effects model and added to the current literature analysis.
Comparison 1: Wound protector device (single- and double-ring) vs. conventional wound protection in abdominal surgery (odds-ratio)
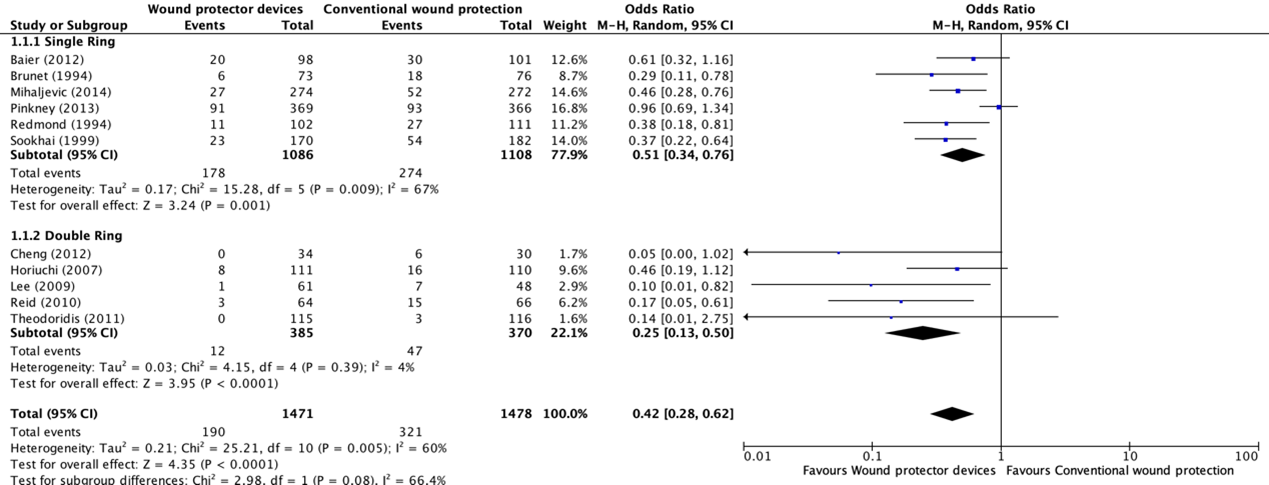
Comparison 1: Wound protector device (single- and double-ring) vs. conventional wound protection in abdominal surgery (risk-ratio)
Comparison 2: Wound protector vs. no wound protector. Subgroup analysis of degree of wound contamination (clean-contaminated, contaminated and dirty) – SSI outcome
Comparison 2a: Clean-contaminated surgery, 2b: contaminated surgery, and 2c: dirty surgery (odds-ratio)

Comparison 2a: Clean-contaminated surgery, 2b: contaminated surgery, and 2c: dirty surgery (risk-ratio)

GRADE Table
|
Quality assessment |
No. of patients |
Effect |
Quality |
||||||||
|
No. of studies |
Study design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Wound protector device |
No wound protector |
Relative (95% CI |
Absolute (95% CI |
|
|
Surgical site infections: all studies |
|||||||||||
|
11 |
RCTs |
Serious1 |
Serious2 |
Not serious |
Not serious |
Publication bias strongly suspected5 |
190/1471 (12.9%) |
321/1478 (21.7%) |
OR: 0.42 (0.29-0.62) RR: 0.49 (0.34-0.69) |
113 fewer per 1000 (from 70 fewer to 145 fewer) |
⨁⨁◯◯ LOW |
|
Surgical site infections: single-ring wound protector only |
|||||||||||
|
6 |
RCTs |
Serious1 |
Serious3 |
Not serious |
Not serious |
Publication bias strongly suspected5 |
178/1086 (16.4%) |
274/1108 (24.7%) |
OR: 0.51 (0.34-0.76) RR: 0.58 (0.41-0.82) |
104 fewer per 1000 (from 47 fewer to 147 fewer) |
⨁⨁◯◯ LOW
|
|
Surgical site infection: double-ring wound protector only |
|||||||||||
|
5 |
RCTs |
Serious1 |
Not serious |
Not serious |
Serious4 |
Publication bias strongly suspected5 |
12/385 (3.1%) |
47/370 (12.7%) |
OR: 0.25 (0.13-0.50) RR: 0.29 (0.15-0.55) |
92 fewer per 1000 (from 59 fewer to 108 fewer) |
⨁⨁◯◯ LOW
|
|
Surgical site infection: clean-contaminated surgery |
|||||||||||
|
5 |
RCTs |
Serious1 |
Not serious |
Not serious |
Serious6 |
Publication bias strongly suspected5 |
102/727 (14.0%) |
141/729 (19.3%) |
OR: 0.63 (0.40-0.99) RR: 0.68 (0.46-1.01) |
|
⨁⨁◯◯ LOW |
|
Surgical site infection: contaminated surgery |
|||||||||||
|
5 |
RCTs |
Serious1 |
Serious2 |
Not serious |
Not serious |
Publication bias strongly suspected5 |
26/157 (16.6%) |
55/152 (36.2%) |
OR: 0.31 (0.15-0.64) RR: 0.45 (0.30-0.68) |
|
⨁⨁◯◯ LOW
|
|
Surgical site infection: dirty surgery |
|||||||||||
|
6 |
|
|
|
|
|
|
22/109 (20.2%) |
45/108 (41.7%) |
OR: 0.22 (0.04-1.21) RR: 0.60 (0.30-1.22) |
|
◯◯
|
2High heterogeneity, I2 =60%.
3High heterogeneity, I2 =70%.
4Optimal information size not met.
5Although not a large number of studies, there is a considerable asymmetry in the funnel plot.
6Wide confidence interval crossing one or more thesholds of clinical relevance.
Study selection
Search strategy
Medline (through PubMed)
1. "surgical wound infection"[Mesh] OR surgical site infection* [TIAB] OR "SSI" OR "SSIs"
OR surgical wound infection* [TIAB] OR surgical infection*[TIAB] OR post-operative wound
infection* [TIAB] OR postoperative wound infection* [TIAB] OR wound infection*[TIAB]
2. (wound protect*) OR wound retractor) OR Alexis retractor) OR Alexis wound protector) OR
wound protector) OR wound protector device) OR "protective devices"[MeSH Terms]
3. Step 1 AND Step 2
4. "colony count, microbial"[Mesh] or colonization [TIAB] OR transmission [TIAB] OR
contamination [TIAB]
5.* ((((wound retractor) OR Alexis retractor) OR Alexis wound protector) OR wound protector) OR wound protector device
6. Step 4 AND Step 5
7. Step 3 OR Step 6
8. AND ("1990/01/01"[PDat] : "2014/12/31"[PDat])))
*Excluded protective devices (mesh) due to the large amount of extra not relevant hits (1600)
EMBASE
1. surgical infection/ or (surgical site infection* or SSI or SSIs or surgical wound infection* or
surgical infection* or post-operative wound infection* or postoperative wound infection*). ti,ab,kw.
2. wound retractor.mp. or exp retractor/ OR wound protector.mp. OR protective device.mp. or exp protective equipment/ OR Alexis retractor.mp.
3. Step 1 AND Step 2
4. surgery.ti,ab,kw.
5. colony count, microbial.ti,ab,kw. OR colonization.ti,ab,kw. OR contamination.ti,ab,kw. OR
transmission.ti,ab, kw.
6. Step 2 AND Step 4 AND Step 5
7. Step 3 OR Step 6
8. limit 7 to yr="1990 - current"
CINAHL
S1. MH "wound infection+") OR "wound infection" OR (MH "surgical wound infection")
S2. (MH "surgical instruments") OR (MH "surgical mesh") OR "wound protector" OR "wound
retractor"
S3. S2 AND S1
Cochrane CENTRAL
1. wound infection:ti,ab,kw
2. surgical wound infection:ti,ab,kw
3. wound protector OR wound retractor OR (protective device AND surgery) OR wound protection
4. 1 or 2
5. 4 AND 3
WHO Global Regional Medical Databases
((SSI) OR (surgical site infection) OR (surgical site infections) OR (wound infection) OR (wound infections)) AND ((wound protector) OR (wound retractor) OR (protective device) OR (wound protection)
ti: title; ab: abstract; kw: keyword
1 Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-12-2024
Beoordeeld op geldigheid : 01-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS) en . De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules 1 tot 16 is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor preventie van postoperatieve wondinfecties. Daarnaast is in 2022 een separate multidisciplinaire werkgroep samengesteld voor de herziening van de WIP richtlijn over postoperatieve wondinfecties: module 17-22. De ontwikkelde modules van beide werkgroepen zijn in deze richtlijn samengevoegd.
Belangenverklaringen
Voor het ontwikkelen van de richtlijnmodules 1 tot 16 is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor preventie van postoperatieve wondinfecties. Daarnaast is in 2022 een separate multidisciplinaire werkgroep samengesteld voor de herziening van de WIP richtlijn over postoperatieve wondinfecties: module 17-22. De ontwikkelde modules van beide werkgroepen zijn in deze richtlijn samengevoegd.
Werkgroep NVvH - Module 1-16
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. prof. dr. M.A. Boermeester |
Chirurg |
* Medisch Ethische Commissie, Amsterdam UMC, locatie AMC * Antibiotica Commissie, Amsterdam UMC |
Persoonlijke financiële belangen Hieronder staan de beroepsmatige relaties met bedrijfsleven vermeld waarbij eventuele financiële belangen via de AMC Research B.V. lopen, dus institutionele en geen persoonlijke gelden zijn: Skillslab instructeur e/of spreker (consultant) voor KCI/3M, Smith&Nephew, Johnson&Johnson, Gore, BD/Bard, TELABio, GDM.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Institutionele grants van KCI/3M, Johnson&Johnson en New Compliance.
Intellectuele belangen en reputatie Ik maak me sterk voor een 100% evidence-based benadering van maken van aanbevelingen, volledig transparant en reproduceerbaar. Dat is mijn enige belang in deze, geen persoonlijk gewin.
Overige belangen Geen.
|
Geen. |
|
Dhr. dr. M.J. van der Laan |
Vaatchirurg |
Vice voorzitter Consortium Kwaliteit van Zorg NFU, onbetaald
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen.
|
|
Dhr. dr. W.C. van der Zwet |
Arts-microbioloog |
Lid Regionaal Coördinatie Team, Limburgs infectiepreventie & ABR Zorgnetwerk (onbetaald) |
||
|
Dhr. dr. D.R. Buis |
Neurochirurg |
Lid Hoofdredactieraad Tijdschrift voor Neurologie & Neurochirurgie - onbetaald |
||
|
Dhr. dr. J.H.M. Goosen |
Orthopaedisch Chirurg |
Inhoudelijke presentaties voor Smith&Nephew en Zimmer Biomet. Deze worden vergoed per uur. |
||
|
Mw. drs. H. Jalalzadeh |
Arts-onderzoeker |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen.
|
|
Dhr. dr. N. Wolfhagen |
AIOS chirurgie |
|||
|
Mw. drs. H. Groenen |
Arts-onderzoeker |
|||
|
Dhr. dr. F.F.A. Ijpma |
Traumachirurg |
|||
|
Dhr. dr. P. Segers |
Cardiothoracaal chirurg |
|||
|
Mw. Y.E.M. Dreissen |
AIOS neurochirurgie |
|||
|
Dhr. R.R. Schaad |
Anesthesioloog |
Werkgroep SRI - Module 17-22
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. prof. dr. M.A. Boermeester |
Chirurg |
* Medisch Ethische Commissie, Amsterdam UMC, locatie AMC * Antibiotica Commissie, Amsterdam UMC |
Persoonlijke financiële belangen Hieronder staan de beroepsmatige relaties met bedrijfsleven vermeld waarbij eventuele financiële belangen via de AMC Research B.V. lopen, dus institutionele en geen persoonlijke gelden zijn: Skillslab instructeur e/of spreker (consultant) voor KCI/3M, Smith&Nephew, Johnson&Johnson, Gore, BD/Bard, TELABio, GDM.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Institutionele grants van KCI/3M, Johnson&Johnson en New Compliance.
Intellectuele belangen en reputatie Ik maak me sterk voor een 100% evidence-based benadering van maken van aanbevelingen, volledig transparant en reproduceerbaar. Dat is mijn enige belang in deze, geen persoonlijk gewin.
Overige belangen Geen.
|
Geen. |
|
Dhr. R.R. Schaad |
Anesthesioloog |
Geen |
Geen |
Geen. |
|
Dhr. dr. J.H.M. Goosen |
Orthopedisch Chirurg |
Inhoudelijke presentaties voor Smith&Nephew en Zimmer Biomet. Deze worden vergoed per uur |
Geen |
Geen. |
|
Dhr. dr. N. Hartwig |
Kinderarts-infectioloog |
Freelance: Medisch adviseur Veduma Medisch Advies te Zaltbommel. Betaald per uitgebracht advies
Lid-beroepsgenoten Regionaal Tuchtcollege te Amsterdam Betaald per zitting
Commissies: Commissie-lid: commissie Vaccinaties van de Gezondheidsraad Commissie-lid: commissie Vaccinaties voor werknemers van de Gezondheidsraad Commissie-lid: commissie Vaccinaties COVID-19 van de Gezondheidsraad Betaald: volgens vaccatie-regeling |
Geen |
Geen |
|
Dhr. Dr. R. Jansen |
Arts Microbioloog |
Geen |
Geen |
Geen |
|
Mevr. dr. M. Reinders |
Dermatoloog |
Geen |
Geen |
Geen |
|
Mevr. E. van de Helder-Vreugdenhil, MSc. |
Verpleegkundig specialist Wondzorg |
Geen |
Geen |
Geen |
|
Mevr. M. van de Biezen-Brinkman |
Deskundige infectiepreventie |
Geen |
Geen |
Geen |
|
Mevr. dr. K. Vliegenthart |
Internist-infectioloog |
Onbetaald: Commissie Kwaliteit voor de NVII, comissielid ter beoordeling van richtlijnen en ondersteunen van kwaliteitsinitiatieven, tevens notulist Internationaal co-assistenten begeleider (Haydom Lutheran Hospital) Minor Global Health, begeleider voor Tanzania (Erasmus MC) Medisch Team, lid, World Servants |
Geen |
Geen |
|
Mevr. dr. E. Moll |
Gynacoloog-perinatoloog |
MOET cursus docent, onbetaald, wel onkostenvergoeding SAVER cursus docent, onbetaald, wel onkostenvergoeding Lid van werkgroep NVOG, Gynaecoloog en Recht. Vanuit die functie schrijven van expertiserapporten, betaald. |
Geen |
Geen |
|
Dhr. dr. M. Cromheecke |
Plastisch chirurg |
Geen |
Geen |
Geen |
|
Mevr. G. v.d. Heijden, MSc. |
Verpleegkundig specialist (wondzorg en vaatchirurgie) |
Geen |
Geen |
Geen |
|
Mevr. K. Spijkers |
Adviseur Patiëntfederatie Nederland |
Voorzitter Ervaringsraad SKILZ (afgevaardigd Patientenfederatie). Bestuurslid Stichting Revalidatie Impact (afgevaardigd Patientenfederatie). |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt. Voor de modules 17-22 was de patiëntfederatie vertegenwoordigd in de werkgroep.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn.
Voor module 8 (Negatieve druktherapie) geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000 - 40.000 patiënten). Tevens volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
Voor de overige modules en aanbevelingen geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten). Tevens volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Ook wordt geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners verwacht of een wijziging in het opleidingsniveau van zorgpersoneel. Er worden daarom geen substantiële financiële gevolgen verwacht.
Implementatie
Zie voor de implementatie het implementatieplan in het tabblad 'Bijlagen'.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroepen de knelpunten in de zorg voor patiënten die chirurgie ondergaan. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. De verslagen hiervan zijn opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Adaptatie
Een aantal modules van deze richtlijn betreft een adaptatie van modules van de World Health Organization (WHO)-richtlijn ‘Global guidelines for the prevention of surgical site infection’ (WHO, 2018), te weten:
- Module Normothermie
- Module Immunosuppressive middelen
- Module Glykemische controle
- Module Antimicrobiële afdichtingsmiddelen
- Module Wondbeschermers bij laparotomie
- Module Preoperatief douchen
- Module Preoperatief verwijderen van haar
- Module Chirurgische handschoenen: Vervangen en type handschoenen
- Module Afdekmaterialen en operatiejassen
Methode
- Uitgangsvragen zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- De inleiding van iedere module betreft een korte uiteenzetting van het knelpunt, waarbij eventuele onduidelijkheid en praktijkvariatie voor de Nederlandse setting wordt beschreven.
- Het literatuuronderzoek is overgenomen uit de WHO-richtlijn. Afhankelijk van de beoordeling van de actualiteit van de richtlijn is een update van het literatuuronderzoek uitgevoerd.
- De samenvatting van de literatuur is overgenomen van de WHO-richtlijn, waarbij door de werkgroep onderscheid is gemaakt tussen ‘cruciale’ en ‘belangrijke’ uitkomsten. Daarnaast zijn door de werkgroep grenzen voor klinische besluitvorming gedefinieerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten, en is de interpretatie van de bevindingen primair gebaseerd op klinische relevantie van het gevonden effect, niet op statistische significantie. In de meta-analyses zijn naast odds-ratio’s ook relatief risico’s en risicoverschillen gerapporteerd.
- De beoordeling van de mate van bewijskracht is overgnomen van de WHO-richtlijn, waarbij de beoordeling is gecontroleerd op consistentie met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten (GRADE-methode; http://www.gradeworkinggroup.org/). Eventueel door de WHO gerapporteerde bewijskracht voor observationele studies is niet overgenomen indien ook gerandomiseerde gecontroleerde studies beschikbaar waren.
- De conclusies van de literatuuranalyse zijn geformuleerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- In de overwegingen heeft de werkgroep voor iedere aanbeveling het bewijs waarop de aanbeveling is gebaseerd en de aanvaardbaarheid en toepasbaarheid van de aanbeveling voor de Nederlandse klinische praktijk beoordeeld. Op basis van deze beoordeling is door de werkgroep besloten welke aanbevelingen ongewijzigd zijn overgenomen, welke aanbevelingen niet zijn overgenomen, en welke aanbevelingen (mits in overeenstemming met het bewijs) zijn aangepast naar de Nederlandse context. ‘De novo’ aanbevelingen zijn gedaan in situaties waarin de werkgroep van mening was dat een aanbeveling nodig was, maar deze niet als zodanig in de WHO-richtlijn was opgenomen. Voor elke aanbeveling is vermeld hoe deze tot stand is gekomen, te weten: ‘WHO’, ‘aangepast van WHO’ of ‘de novo’.
Voor een verdere toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
World Health Organization. Global guidelines for the prevention of surgical site infection,
second edition. Geneva: World Health Organization; 2018. (https://www.who.int/publications/i/item/9789241550475, accessed 12 June 2023).
Zoekverantwoording
Zie voor de zoekstrategie het tabblad 'Evidence tabellen'.
