Normothermie
Uitgangsvraag
Wat is de plaats van systemische verwarming van het lichaam van chirurgische patiënten ter preventie van postoperatieve wondinfecties?1
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
1 De WHO-richtlijn beschrijft geen uitgangsvragen. De uitgangsvragen voor deze module zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
Aanbeveling
Overweeg het gebruik van verwarmingstechnieken (zoals omgevingswarmte, opwarmdeken met geforceerde luchtstroom en verwarmde vloeistoffen) in de operatiekamer en tijdens chirurgische ingrepen om afkoeling van de lichaamstemperatuur tot onder 36°C te voorkomen ter preventie van postoperatieve wondinfecties [aangepast WHO, 2018].
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van normothermie in vergelijking met standaard pre- en postoperatieve procedures bij patiënten die chirurgische procedures ondergaan. Postoperatieve wondinfecties werden als cruciale uitkomstmaat gedefinieerd. Een verschil van 10% voor continue uitkomstmaten, een verschil in relatief risico kleiner 0.95 of groter dan 1.05 voor infectie-gerelateerde mortaliteit en een relatief risico kleiner dan 0.80 of groter dan 1.25 tussen beide interventies voor overige dichotome uitkomstmaten werden als klinisch relevant verschillend beschouwd.
Er werden twee studies geïncludeerd in de literatuuranalyse. Op basis van de literatuur is er redelijk robuuste bewijskracht dat normothermie hoogstwaarschijnlijk de kans op het verkrijgen van postoperatieve wondinfecties reduceert wanneer patiënten een chirurgische procedure ondergaan (OR 0.33 (95% BI 0.17 tot 0.62). De uitkomstmaat werd echter op een kleine studiepopulatie gebaseerd, waardoor er sprake kan zijn van imprecisie van de studieresultaten. Hierdoor is de bewijskracht met één niveau afgewaardeerd, waardoor de bewijskracht is uitgekomen op ‘moderate GRADE’. Recente literatuur (Sessler, 2022) laat geen duidelijk verschil in incidentie wondinfecties zien tussen agressieve verwarming (kerntemperatuur 37°C) versus routine verwarming.
Er is meervoudig bewijs dat bloedverlies en kritieke myocardinfarcten verminderen wanneer actieve verwarmingsstrategieën worden toegepast (Frank, 1997; Ho, 2011). Een meta-analyse die zich richtte op opwarming van het lichaam vond een 16% toename van bloedverlies en een toename van 22% in het relatieve risico op de noodzaak van een bloedtransfusie bij patiënten bij wie de temperatuur gemiddeld ongeveer 1°C lager was dan de 36°C drempelwaarde (Rajagopalan, 2008). Dit zijn voordelen van lichaamswarmte die verder gaan dan het voorkomen van SSI, maar deze voordelen zijn het waard om te benadrukken. Wat betreft mogelijke schade zijn er individuele gevallen bekend van brandwonden veroorzaakt door het onjuiste gebruik van apparaten voor geforceerde luchtverwarming (Chung, 2012; Uzun, 2010).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De werkgroep wees op een mogelijk gevaar van huidverbranding, afhankelijk van het verwarmingsapparaat (mogelijk bij geleidende verwarmingsmatrassen). Ook werd opgemerkt dat de verhoogde temperatuur in de werkomgeving een probleem kan vormen voor het chirurgisch personeel. Het verhogen van de kamertemperatuur is een lastige interventie om de patiënt te verwarmen, omdat dit ongemak veroorzaakt voor het chirurgisch personeel, met een verhoogd risico op zweetdruppels op de operatieplaats.
Er werden geen studies gevonden over waarden en voorkeuren van patiënten met betrekking tot deze interventie. De werkgroep benadrukte dat pijn, misselijkheid en rillingen tot de meest gemelde bijwerkingen behoren na afkoeling van de lichaamstemperatuur op de operatiekamer. Daarom erkende de werkgroep dat patiënten er mogelijk voorkeur aan kunnen geven om tijdens de chirurgische ingreep warm te worden gehouden en tevens hieraan de voorkeur geven aan deze ingreep om het risico op SSI te verminderen. De werkgroep is er daarentegen van overtuigd dat patiënten beschermd willen worden tegen huidverbranding als gevolg van temperatuur en contactdruk door te kiezen voor een bewezen veilige methode.
Kosten (middelenbeslag)
De kosten van verwarmingssystemen, waaronder verwarming met geforceerde lucht, stralingsdekens en andere apparaten, zijn aanzienlijk. Het gebruik van deze hulpmiddelen verhoogt in de eerste plaats de zorgkosten, maar de kostenbesparingen door de afname van transfusies, morbide cardiale infarcten en SSI maken het kosteneffectief indien het in de juiste instellingen wordt gebruikt (Everett, 1991; Shafer, 2014; Fleisher, 1998; Mahoney, 1999; Beal, 2000; Berry, 2008).
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn geen kwantitatieve of kwalitatieve studies bekend naar de aanvaardbaarheid, haalbaarheid en implementatie van normothermie bij patiënten die een chirurgische ingreep ondergaan. Echter, het toepassen van een verwarmingssysteem ter preventie van hypothermie bij grote chirurgie is standaardpraktijk. Bezwaren die er zijn hangen samen met de contra-indicaties dan wel met interferentie van de gekozen methode met het operatiegebied. Bezwaren ten aanzien van de indicatie zijn niet bekend. Indien de interventie specifiek gedefinieerd is als het handhaven van normothermie wordt dit bij gebrek aan definitie niet nagestreefd. Er bestaat geen barrière vanuit de snijdende specialismen. Mogelijk belemmeringen voor implementatie kunnen gelegen zijn in de scholing voor bediening van de apparatuur en afstemming in de samenwerking op de OK met het anesthesieteam.
Duurzaamheid
Duurzaamheid is niet benoemd in de WHO-richtlijn en er is niet aanvullend naar gezocht.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
In het algemeen zijn robuuste studies van hoge kwaliteit nodig die de doeltreffendheid van systemische opwarming van het lichaam evalueren in vergelijking met standaard chirurgische zorg. Er is weinig consensus over de patiëntenpopulatie die perioperatief moeten worden verwarmd. Er is ook geen consensus over de duur van pre- en postoperatieve opwarming. Toekomstig onderzoek moet zich richten op het werkingsmechanisme, de beoogde verwarmingstemperatuur, het optimale apparaat en de juiste timing en duur van de opwarming.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Onderbouwing
Achtergrond
Hypothermie wordt gedefinieerd als een kerntemperatuur van het lichaam onder 36°C . Dit komt vaak voor tijdens en na grote operatieve ingrepen die langer dan twee uur duren. Blootstelling aan een koude operatiekamer en door anesthesie veroorzaakte aantasting van de thermoregulatoire controle zijn de meest voorkomende gebeurtenissen die tot onderkoeling leiden. Blootstelling van het huidoppervlak tijdens de perioperatieve periode kan het warmteverlies vergroten. Bovendien koelen koele intraveneuze en irrigatievloeistoffen de patiënten rechtstreeks af. Een aantal problemen die in verband gebracht kunnen worden met onderkoeling zijn een langer herstel na anesthesie en een langere verblijfsduur in het ziekenhuis. Het lijkt erop dat dit verhoogde risico kan worden omgekeerd door het handhaven van normothermie.
Het is onduidelijk hoe het handhaven van normothermie de incidentie van chirurgische wondinfecties (SSI) kan verminderen. Alle beschikbare studies op dit gebied meten de kerntemperatuur en niet de perifere temperatuur. Recente gezondheidszorgbundels en richtlijnen voor SSI-preventie bevelen aan dat de lichaamstemperatuur tijdens de perioperatieve periode gestreefd moet worden naar een situatie van een normale lichaamstemperatuur onder normale omstandigheden, maar er is geen consensus tussen deze aanbevelingen over de ondergrens voor normothermie of de optimale timing ervan.
Deze module betreft een adaptatie van de module ‘Maintaining normal body temperature (normothermia)’ van de WHO-richtlijn ‘Global guidelines for the prevention of surgical site infection’ second edition. 2018’ (WHO, 2018A; WHO, 2018B). Voor een toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
Conclusies / Summary of Findings
1. Surgical site infections1
|
Moderate GRADE |
Systemic body warming likely reduces surgical site infections when compared to no warming in patients undergoing surgical operations (any type of procedure).
Sources: Kurz (1996); Melling (2001). |
2. SSI-attributable mortality1
|
No GRADE |
No evidence was found regarding the effect of systemic body warming on SSI-attributable mortality when compared to no warming in patients undergoing surgical operations (any type of procedure).
Sources: - |
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
1 The conclusions of the literature analysis were formulated in accordance with the standard procedures of the Knowledge Institute of the Federation of Medical Specialists.
Samenvatting literatuur
Description of studies
Two randomized RCTs (Kurz, 1996; Melling, 2001) that evaluated systemic body warming to achieve normothermia versus no warming for the prevention of SSI were included. No relevant observational studies were identified to answer the PICO question. One study collected data from three hospitals. Both studies addressed pre- and intraoperative warming. No studies assessing the effect of postoperative warming on SSI were identified. One study included adults undergoing elective colorectal surgery and the other concerned patients operated for hernia repair or vascular and breast surgical procedures. Both studies used forced-air warming in the intervention group to maintain patient normothermia during the procedure. In one study, patients in the control group were actively cooled and intravenous fluids were administered through a fluid warmer to both the intervention and the control groups, but the warmer was activated only in patients assigned to the intervention group. Both studies used a modified version of the ASEPSIS (Additional treatment, Serous discharge, Erythema, Purulent exudate, Separation of deep tissues, Isolation of bacteria and Stay as inpatient prolonged over fourteen days) scoring system for the definition of SSI. A third study (Wong, 2007) was identified as potentially relevant, but it was excluded after careful appraisal against the PICO question as warming procedures were applied in both the intervention and control groups.
Results
1. Surgical site infections
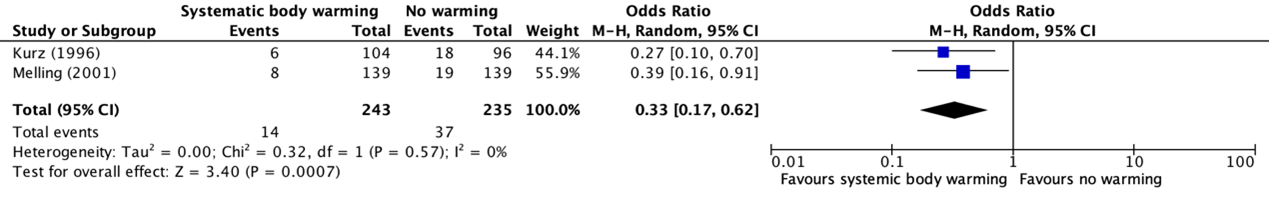
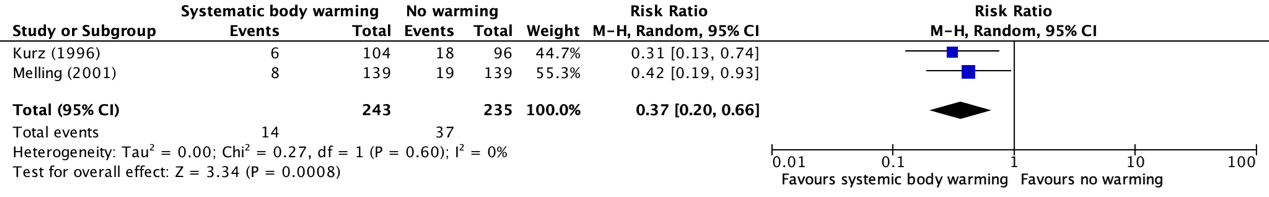
Each of the two included studies reported independently that systemic body warming has significant benefit compared to no warming in reducing SSI following surgery and this was confirmed by meta-analysis (OR: 0.33; 95% CI: 0.17-0.62) (Bijlage comparisons). In addition to the WHO-meta-analysis, a meta-analysis with relative risk was added as the effect estimate was performed and is presented in Figure 1. The analysis resulted in a relative risk ratio (RR) of 0.37 (95% CI 0.20 to 0.66), in favor of normothermia. Of note, there are some limitations to this analysis as it is based only on two studies with a relatively small sample size and populations undergoing only clean or clean-contaminated surgical procedures.
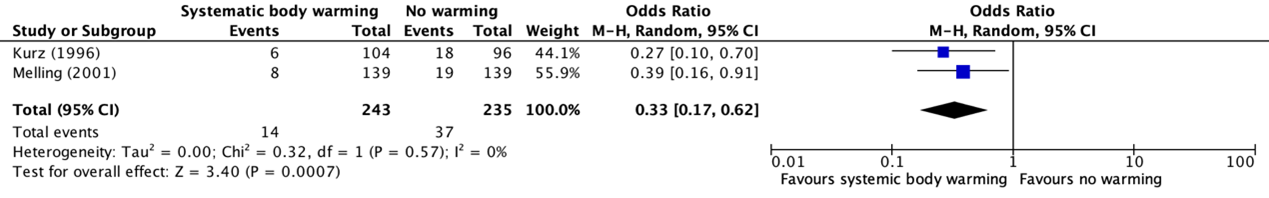
Figure 1a: Forest plot showing the comparison between systematic body warming to no warming for surgical site infections. Pooled odds-ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
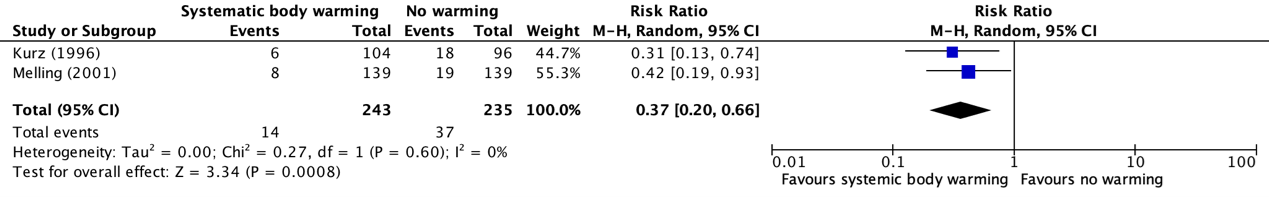
Figure 1b: Forest plot showing the comparison between systematic body warming to no warming for surgical site infections. Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
2. SSI-attributable mortality
The WHO guideline did not prioritize SSI-attributable mortality as a relevant outcome measure. However, SSI-attributable mortality was defined as an important outcome measure for this guideline module. Supplementary to the WHO guideline, the included studies were checked for reporting SSI- attributable mortality. However, none of the included studies reported results regarding SSI-attributable mortality.
Level of evidence of the literature
1. Surgical site infections
The level of evidence regarding the outcome surgical site infections was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by one level since the optimal information size was not met (imprecision, -1). The level of evidence was considered as moderate (Bijlage 11.5).
2. SSI-attributable mortality
Since none of the included studies reported information regarding SSI-attributable mortality, the level of evidence could not be graded.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Zoeken en selecteren
The WHO performed a systematic review of the literature to answer the following (search) question:
What are the (un)beneficial effects of normothermia (warming) on the incidence of surgical site infections (SSI) and SSI-attributable mortality in inpatients and outpatients undergoing surgical operations (any type of procedure)?2
P: Inpatients and outpatients of any age undergoing surgical operations
(any type of procedure).
I: Normothermia (warming).
C: Standard procedure (non-warming).
O: Surgical site infections (SSI), SSI-attributable mortality.
Relevant outcome measures
The working group considered surgical site infections as a critical outcome and SSI-attributable mortality as an important outcome for decision making.3
The working group defined a 25% relative difference (RR<0.8 or >1.25) in SSI rate and a 5% relative difference (RR<0.95 or >1.05) in SSI-attributable mortality as minimal clinically (patient) important difference.
Search and select (Methods)
The WHO searched the following databases: Medline (PubMed); Excerpta Medica Database (EMBASE); Cumulative Index to Nursing and Allied Health Literature (CINAHL); Cochrane Central Register of Controlled Trials (CENTRAL); and the WHO Global Health Library. The time limit for the review was between 1 January 1990 and 17 August 2015. Language was restricted to English, French and Spanish. A comprehensive list of search terms was used, including Medical Subject Headings (MeSH). The detailed search strategy is available under the "Evidence tabellen" tab. Two WHO-authors extracted data in a predefined evidence table (Evidence table) and critically appraised the retrieved studies. Quality was assessed using the Cochrane Collaboration tool to assess the risk of bias of randomized controlled trials (RCTs) (Higgins, 2011) and the Newcastle-Ottawa Quality Assessment Scale for cohort studies (Wells, 2014) (Risk of bias assessment of the included studies). Any disagreements were resolved through discussion or after consultation with the senior WHO-author, when necessary.
Two independent reviewers screened the titles and abstracts of retrieved references for potentially relevant studies. The full text of all potentially eligible articles was obtained. Two authors independently reviewed the full text articles for eligibility based on inclusion criteria. Duplicate studies were excluded.
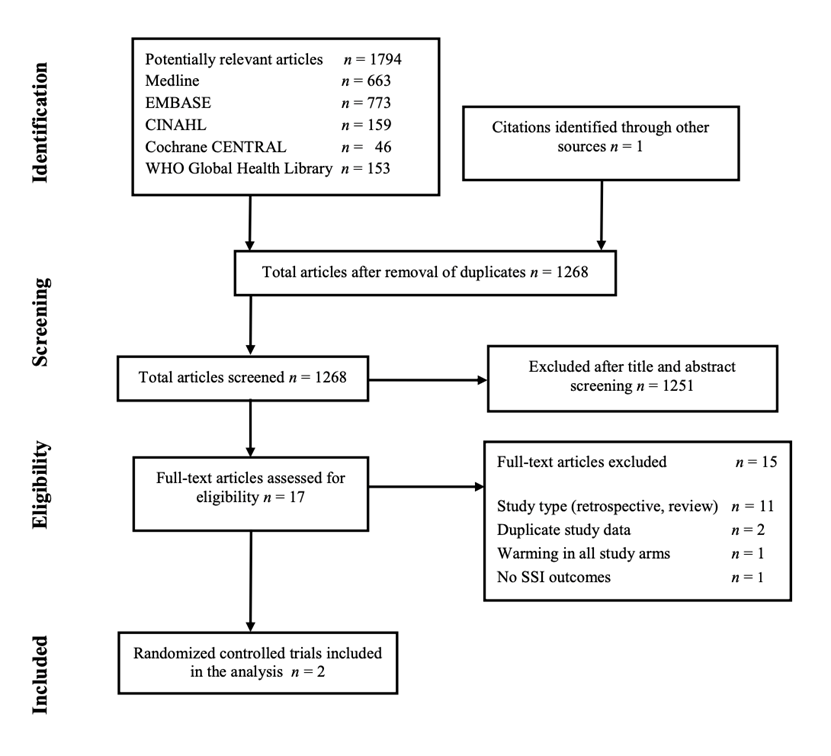
The WHO systematic literature search resulted in 1268 hits. Seventeen studies were initially selected based on title and abstract screening. After reading the full text, fifteen studies were excluded, (Study selection) and two randomized controlled trials (RCTs) were included. Meta-analyses of available comparisons were performed using Review Manager v5.3 as appropriate 18 (Comparisons). The WHO extracted and pooled adjusted odds ratios (OR) with 95% confidence intervals (CI) for each comparison with a random effects model. In addition to the WHO meta-analyses, relative risks (RR) and risk differences (RD) with 95% confidence intervals (CI) were extracted and pooled with a random effects model and added to the current literature analysis.4
Results
Two studies were included in the analysis of the literature (Summary of literature). Important study characteristics and results are summarized in the evidence tables (Evidence table). The assessment of the risk of bias is summarized in the risk of bias tables (Risk of bias assessment of the included studies).
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
2 The working group modified the WHO-search question by including all WHO-defined outcomes.
3 The WHO-guideline did not distinguish between crucial and important outcome measures and did not define thresholds for clinical decision making.
4 The WHO-guideline did not report relative risks and risk differences.
Referenties
- Beal MW, Brown DC, Shofer FS. The effects of perioperative hypothermia and the duration of anesthesia on postoperative wound infection rate in clean wounds: a retrospective study. Vet Surg. 2000;29:123-7.
- Berry D, Wick C, Magons P. A clinical evaluation of the cost and time effectiveness of the ASPAN Hypothermia Guideline. J Perianesth Nurs. 2008;23:24-35.
- Campbell G, Alderson P, Smith AF, Warttig S. Warming of intravenous and irrigation fluids for preventing inadvertent perioperative hypothermia. Cochrane Database Syst Rev.
2015;(4):CD009891. - Chung K, Lee S, Oh SC, Choi J, Cho HS. Thermal burn injury associated with a forced air warming device. Korean J Anesthesiol. 2012;62:391-2.
- Diaz M, Becker DE. Thermoregulation: physiological and clinical considerations during sedation and general anesthesia. Anesth Prog. 2010;57:25-32; quiz 3-4.
- Everett WD, Kipp H. Epidemiologic observations of operating room infections resulting from variations in ventilation and temperature. Am J Infect Control. 1991;19:277-82.
- Fleisher LA, Metzger SE, Lam J, Harris A. Perioperative cost-finding analysis of the routine use of intraoperative forced-air warming during general anesthesia. Anesthesiology. 1998;88:1357-64.
- Frank SM, Beattie C, Christopherson R, Norris EJ, Perler BA, Williams GM, et al. Unintentional hypothermia is associated with postoperative myocardial ischemia. The perioperative ischemia randomized anesthesia trial study group. Anesthesiology. 1993;78:468- 76.
- Frank SM, Cattaneo CG, Wieneke-Brady MB, El-Rahmany H, Gupta N, Lima JA, et al. Threshold for adrenomedullary activation and increased cardiac work during mild core hypothermia. Clin Sci. 2002;102:119-25.
- Frank SM, Fleisher LA, Breslow MJ, Higgins MS, Olson KF, Kelly S, et al. Perioperative maintenance of normothermia reduces the incidence of morbid cardiac events. A randomized clinical trial. JAMA. 1997;277:1127-34.
- GRADEpro Guideline Development Tool. Summary of findings tables, health technology assessment and guidelines. GRADE Working Group. Ontario: McMaster University and Evidence Prime Inc.; 2015 (http://www.gradepro.org, accessed 5 May 2016).
- Hall JE, Guyton AC, editors. Textbook of medical physiology. Philadelphia (PA): Saunders; 2011.
- Higgins JP, Altman DG, Gotzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928. High impact intervention. Care bundle to prevent surgical site infection. London; Department of Health; 2011 (http://hcai.dh.gov.uk/files/2011/03/2011-03-14-HII- PreventSurgical-Site-infection-FINAL.pdf, accessed 6 May 2016).
- Ho KM, Tan JA. Benefits and risks of maintaining normothermia during cardiopulmonary bypass in adult cardiac surgery: a systematic review. Cardiovasc Ther. 2011;29:260-79. Kurz A, Sessler DI, Lenhardt R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of the wound infection and temperature group. New Engl J Med. 1996:334;1209-15.
- Leaper DJ, Tanner J, Kiernan M, Assadian O, Edmiston CE, Jr. Surgical site infection: poor compliance with guidelines and care bundles. Int Wound J. 2015;12:357-62.
- Leslie K, Sessler DI, Bjorksten AR, Moayeri A. Mild hypothermia alters propofol pharmacokinetics and increases the duration of action of atracurium. Anesth Analg. 1995;80:1007-14.
- Mahoney CB, Odom J. Maintaining intraoperative normothermia: a meta-analysis of outcomes with costs. AANA J. 1999;67:155-63.
- Melling AC, Ali B, Scott EM, Leaper DJ. Effects of preoperative warming on the incidence of wound infection after clean surgery: a randomised controlled trial. Lancet. 2001;358:876-80.
- Owens P, McHugh S, Clarke-Moloney M, Healy D, Fitzpatrick F, McCormick P, et al. Improving surgical site infection prevention practices through a multifaceted educational intervention. Ir Med J. 2015;108:78-81.
- Rajagopalan S, Mascha E, Na J, Sessler DI. The effects of mild perioperative hypothermia on blood loss and transfusion requirement. Anesthesiology. 2008;108:71-7.
- Sessler DI. Mild perioperative hypothermia. New Engl J Med. 1997;336:1730-7.
- Sessler DI, Rubinstein EH, Moayeri A. Physiologic responses to mild perianesthetic hypothermia in humans. Anesthesiology. 1991;75:594-610.
- Sessler DI, Pei L, Li K, Cui S, Chan MTV, Huang Y, Wu J, He X, Bajracharya GR, Rivas E, Lam CKM; PROTECT Investigators. Aggressive intraoperative warming versus routine thermal management during non-cardiac surgery (PROTECT): a multicentre, parallel group, superiority trial. Lancet. 2022 May 7;399(10337):1799-1808. doi: 10.1016/S0140-6736(22)00560-8. Epub 2022 Apr 4. PMID: 35390321.
- Shafer SL, Dexter F, Brull SJ. Deadly heat: Economics of continuous temperature monitoring during general anesthesia. Anesth Analg. 2014;119:1235-7.
- Targeted literature review: what are the key infection prevention and control recommendations to inform a surgical site infection (SSI) prevention quality improvement tool? Edinburgh: Health Protection Scotland; version 2.0 December 2012 (http://www.documents.hps.scot.nhs.uk/hai/infection-control/evidence-for-carebundles/literature-reviews/ssi-review.pdf, accessed 6 May 2016).
- The Nordic Cochrane Centre TCC. Review Manager (RevMan). Version 5.3. Copenhagen: The Cochrane Collaboration 2014.
- Uzun G, Mutluoglu M, Evinc R, Ozdemir Y, Sen H. Severe burn injury associated with misuse of forced-air warming device. J Anesth. 2010;24:980-1.
- Warttig S, Alderson P, Campbell G, Smith AF. Interventions for treating inadvertent postoperative hypothermia. Cochrane Database Syst Rev 2014;(11):CD009892.
- Whitney JD, Dellinger EP, Weber J, Swenson RE, Kent CD, Swanson PE, et al. The effects of local warming on surgical site infection. Surg Infect (Larchmt). 2015;6:595-603.
- Wilson AP, Treasure T, Sturridge MF, Gruneberg RN. A scoring method (ASEPSIS) for postoperative wound infections for use in clinical trials of antibiotic prophylaxis. Lancet. 1986;1:311-3.
- Wong PF, Kumar S, Bohra A, Whetter D, Leaper DJ. Randomized clinical trial of perioperative systemic warming in major elective abdominal surgery. Br J Surg. 2007;94:421-6.
- World Health Organization. Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018.(https://www.who.int/publications/i/item/global-guidelines-for-the-prevention-of-surgical-site-infection-2nd-ed/, accessed 12 June 2023). A
- World Health Organization. Global Guidelines for the Prevention of Surgical Site Infection. Geneva: World Health Organization; 2018. Web Appendix 14, Summary of a systematic review on preoperative bathing.(https://www.ncbi.nlm.nih.gov/books/NBK536394/, accessed 12 June 2023). B
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Kurz (1996) |
Type of study: RCT.
Setting and country: 3 hospitals (1 university, n=155; 1 university, n=30; 1 other hospital, n=15) July 1993 to March 1995. Austria.
Funding and conflicts of interest: No information. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: N = 104 Control: N = 96
Important prognostic factors2: age 18-80 years
Sex: Gender (male/female): 108/92
Operating time: I:170±9 minutes C: 169±9 minutes P=0.43 minutes.
Groups comparable at baseline?
|
Describe intervention (treatment/procedure/test):
Normothermia
Patients were randomly assigned to either normothermia or hypothermia groups. Apart from temperature management, other perioperative procedures were standardized for the two groups. Standard mechanical bowel preparation with an electrolyte solution. Intravenous cefamandole (2g every 8 hours) and metronidazole (500 mg every 8 hours) treatment was maintained for approximately 4 days. postoperatively. Fluids were administered as 15 mL of crystalloid per kg per hour throughout surgery and replaced the volume of blood lost with either crystalloid in a 4:1 ratio or colloid in a 2:1 ratio. Fluids were administered intravenously at rates of 3.5 mL per kg per hour for the first 24 hours postoperatively and 2 mL per kg per hour for the subsequent 24 hours.
|
Describe control (treatment/procedure/test):
Hypothermia |
Length of follow-up: Two weeks
Loss-to-follow-up: None. |
SSI: 2 weeks
Overall: 24/200 (12%) I: 6/104 (6%) C: 18/96 (19%)
Smokers: 14/62 (23%) Non-smokers 10/138 (7%)
|
Author’s conclusion: In summary, this double-blind, randomized study indicates that intraoperative core temperatures approximately 2°C below normal triple the incidence of wound infection and prolong hospitalization by about 20 percent. Maintaining intraoperative normothermia is thus likely to decrease infectious complications and shorten hospitalization in patients undergoing colorectal surgery.
Other: Wound infection (suspected): if pus could be expressed from the surgical incision or aspirated from a lobulated mass inside the wound.
Wound infection (confirmed): if pus culture was positive for pathogenic bacteria.
ASPESIS score >20. |
|
Melling (2001) |
Type of study: RCT.
Setting and country: District general hospital April 1999 to May 2000 United Kingdom.
Funding and conflicts of interest:
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: N = Control: N =
Important prognostic factors2: ≥18 years (mean) I1: 49.7 years I2: 50 years
Groups comparable at baseline? Yes.
|
Describe intervention (treatment/procedure/test):
Standard preoperative care plus minimum 30 minutes preoperative warming only at the planned wound area using a noncontact, radiant heat dressing.
|
Describe control (treatment/procedure/test):
None of the interventions. |
Length of follow-up: Six weeks.
Loss-to-follow-up: None.
|
SSI Non-warmed: 19/138 (14%) Local: 5/139 (4%) Systemic: 8/139 (6%)
All warmed: 13/277 (5%)
C vs. local: P=0.003
Co vs. systemic: P=0.026 |
Author’s conclusion: Preoperative warming may be an alternative to the controversial use of prophylactic antibiotics, that avoids the associated risks of allergy and resistance, in clean surgery.
Other: Purulent discharge or a painful erythema lasting 5 days and treated with antimicrobials within 6 weeks of surgery. Wounds were swabbed for culture if purulent discharge present at the time of review. Note: only 14 wound swabs were obtained because of postoperative anti microbials: “Patients seen at 2 and 6 weeks had often been prescribed antimicrobial treatment by their general practitioner without having the wound swabbed.” |
Risk of bias assessment of the included studies
|
RCT Author, year, reference |
Sequence generation |
Allocation concealment |
Participants and personnel blinded |
Outcome assessors blinded |
Incomplete outcome data |
Selective outcome reporting |
Other sources of bias |
|
Kurz (1996) |
Low |
Low |
Low |
Low |
Low |
Low |
Low |
|
Melling (2001) |
Unclear |
Unclear |
Unclear |
Low |
Low |
Low |
Unclear |
Comparisons
In addition to the odds ratios (OR) reported by the WHO, relative risks (RR) and risk differences (RD) with 95% confidence intervals (CI) were extracted and pooled with a random effects model and added to the current literature analysis.
\
Funnel plot
GRADE Table
|
|
Quality assessment |
Number of patients |
Effect |
Quality |
||||||||
|
Outcome |
Number of studies |
Study design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intraoperative warming |
No warming |
Relative (95% CI) |
Absolute (95% CI) |
⨁⨁⨁◯
Moderate |
|
Surgical site infections |
2 |
RCTs |
Not serious |
Not serious |
Not serious |
Serious 1 |
None |
14/243 (5.8%) |
37/235 (15.7%) |
OR 0.33 (0.17 to 0.62)
RR 0.37 (0.20 to 0.66)
|
99 fewer per 1000 (from 54 fewer to 99 fewer). |
|
|
SSI-attributable mortality |
0 |
Not applicable |
Not applicable |
Not applicable |
Not applicable |
Not applicable |
Not applicable |
Not applicable |
Not applicable |
Not applicable |
Not applicable |
- No Grade |
Study selection
Flow chart of the study selection
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Search strategy
Medline (through OvidSP)
1. wound infection.mp. or exp wound infection/
2. exp surgical procedures, operative/ or exp perioperative period/ or preoperative care/ or (surger* or operat* or perioperat* or peri-operat* or pre-operat* or preoperat* or postoperat* or post-operat*).ti,ab,kw.
3. surgical wound infection/ or (surgical site infection* or SSI or SSIs or surgical wound infection* or surgical infection* or post-operative wound infection* or postoperative wound infection*).ti,ab,kw.
4. exp blood volume/ or exp fluid therapy/ or (blood volume* or normovolemia or fluid management).ti,ab,kw. or (circulat* adj2 volume*).ti,ab,kw. or (volume* adj3 blood).ti,ab,kw.
5. 1 or 3
6. 2 and 4 and 5
7. limit 6 to yr="1990 -17-1-2014"
EMBASE
1. surgical infection/ or (surgical site infection* or SSI or SSIs or surgical wound infection* or surgical infection* or post-operative wound infection* or postoperative wound infection*).ti,ab,kw.
2. exp surgery/ or perioperative period/ or preoperative care/ or (surger* or operat* or perioperat* or peri-operat* or pre-operat* or preoperat* or postoperat* or postoperat*).ti,ab,kw.
3. blood volume/ or (blood volume* or normovolemia or fluid management).ti,ab,kw. or (circulat* adj2 volume*).ti,ab,kw. or (volume* adj3 blood).ti,ab,kw.
4. 1 and 2 and 3
5. limit 4 to yr="1990 - 2014"
6. exp wound infection/
7. 1 or 6
8. 2 and 3 and 7
9. limit 8 to yr="1990 -Current"
CINAHL
("normovolemia" OR "GDFT" OR “goal directed fluid therapy” OR (MH "fluid therapy+") OR "fluid therapy" OR (MH "fluid resuscitation")) AND ("ssi" OR (MH "surgical wound infection") OR "surgical site infection" OR (MH "surgical wound infection") OR (MH "wound infection+") OR "wound infection"))
Cochrane CENTRAL
1. wound infection:ti,ab,kw
2. surgical wound infection:ti,ab,kw
3. normovolemia:ti,ab,kw
4. fluid therapy:ti,ab,kw
5. 1 or 2
6. 3 or 4
7. 5 and 6
WHO Global Health Library
1. (ssi)
2. (surgical site infection)
3. (surgical site infections)
4. (wound infection)
5. (wound infections)
6. (postoperative wound infection)
7. (normovolemia) 8. (fluid therapy)
1 Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-12-2024
Beoordeeld op geldigheid : 01-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS) en . De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules 2 tot 16 is in 2020 op initiatief van de NVvH een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor preventie van postoperatieve wondinfecties. Daarnaast is in 2022 op initiatief van het Samenwerkingsverband Richtlijnen Infectiepreventie (SRI) een separate multidisciplinaire werkgroep samengesteld voor de herziening van de WIP-richtlijn over postoperatieve wondinfecties: module 17-22. De ontwikkelde modules van beide werkgroepen zijn in deze richtlijn samengevoegd.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Werkgroep NVvH - Module 2-16
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. prof. dr. M.A. Boermeester |
Chirurg |
* Medisch Ethische Commissie, Amsterdam UMC, locatie AMC * Antibiotica Commissie, Amsterdam UMC |
Persoonlijke financiële belangen Hieronder staan de beroepsmatige relaties met bedrijfsleven vermeld waarbij eventuele financiële belangen via de AMC Research B.V. lopen, dus institutionele en geen persoonlijke gelden zijn: Skillslab instructeur en/of spreker (consultant) voor KCI/3M, Smith&Nephew, Johnson&Johnson, Gore, BD/Bard, TELABio, GDM, Medtronic, Molnlycke.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Institutionele grants van KCI/3M, Johnson&Johnson en New Compliance.
Intellectuele belangen en reputatie Ik maak me sterk voor een 100% evidence-based benadering van maken van aanbevelingen, volledig transparant en reproduceerbaar. Dat is mijn enige belang in deze, geen persoonlijk gewin.
Overige belangen Geen.
|
Extra kritische commentaarronde. |
|
Dhr. dr. M.J. van der Laan |
Vaatchirurg |
Vice voorzitter Consortium Kwaliteit van Zorg NFU, onbetaald
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen.
|
|
Dhr. dr. W.C. van der Zwet |
Arts-microbioloog |
Lid Regionaal Coördinatie Team, Limburgs infectiepreventie & ABR Zorgnetwerk (onbetaald) |
||
|
Dhr. dr. D.R. Buis |
Neurochirurg |
Lid Hoofdredactieraad Tijdschrift voor Neurologie & Neurochirurgie - onbetaald |
||
|
Dhr. dr. J.H.M. Goosen |
Orthopaedisch Chirurg |
Inhoudelijke presentaties voor Smith&Nephew en Zimmer Biomet. Deze worden vergoed per uur. |
||
|
Mw. drs. H. Jalalzadeh |
Arts-onderzoeker |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen.
|
|
Dhr. dr. N. Wolfhagen |
AIOS chirurgie |
|||
|
Mw. drs. H. Groenen |
Arts-onderzoeker |
|||
|
Dhr. dr. F.F.A. Ijpma |
Traumachirurg |
|||
|
Dhr. dr. P. Segers |
Cardiothoracaal chirurg |
|||
|
Mw. Y.E.M. Dreissen |
AIOS neurochirurgie |
|||
|
Dhr. R.R. Schaad |
Anesthesioloog |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt. Voor de modules 17-22 was de patiëntfederatie vertegenwoordigd in de werkgroep.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn.
Voor module 8 (Negatieve druktherapie) geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000 - 40.000 patiënten). Tevens volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
Voor de overige modules en aanbevelingen geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten). Tevens volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Ook wordt geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners verwacht of een wijziging in het opleidingsniveau van zorgpersoneel. Er worden daarom geen substantiële financiële gevolgen verwacht.
Implementatie
Zie voor de implementatie het implementatieplan in het tabblad 'Bijlagen'.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroepen de knelpunten in de zorg voor patiënten die chirurgie ondergaan. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. De verslagen hiervan zijn opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Adaptatie
Een aantal modules van deze richtlijn betreft een adaptatie van modules van de World Health Organization (WHO)-richtlijn ‘Global guidelines for the prevention of surgical site infection’ (WHO, 2018), te weten:
- Module Normothermie
- Module Immunosuppressive middelen
- Module Glykemische controle
- Module Antimicrobiële afdichtingsmiddelen
- Module Wondbeschermers bij laparotomie
- Module Preoperatief douchen
- Module Preoperatief verwijderen van haar
- Module Chirurgische handschoenen: Vervangen en type handschoenen
- Module Afdekmaterialen en operatiejassen
Methode
- Uitgangsvragen zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- De inleiding van iedere module betreft een korte uiteenzetting van het knelpunt, waarbij eventuele onduidelijkheid en praktijkvariatie voor de Nederlandse setting wordt beschreven.
- Het literatuuronderzoek is overgenomen uit de WHO-richtlijn. Afhankelijk van de beoordeling van de actualiteit van de richtlijn is een update van het literatuuronderzoek uitgevoerd.
- De samenvatting van de literatuur is overgenomen van de WHO-richtlijn, waarbij door de werkgroep onderscheid is gemaakt tussen ‘cruciale’ en ‘belangrijke’ uitkomsten. Daarnaast zijn door de werkgroep grenzen voor klinische besluitvorming gedefinieerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten, en is de interpretatie van de bevindingen primair gebaseerd op klinische relevantie van het gevonden effect, niet op statistische significantie. In de meta-analyses zijn naast odds-ratio’s ook relatief risico’s en risicoverschillen gerapporteerd.
- De beoordeling van de mate van bewijskracht is overgnomen van de WHO-richtlijn, waarbij de beoordeling is gecontroleerd op consistentie met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten (GRADE-methode; https://www.gradeworkinggroup.org/). Eventueel door de WHO gerapporteerde bewijskracht voor observationele studies is niet overgenomen indien ook gerandomiseerde gecontroleerde studies beschikbaar waren.
- De conclusies van de literatuuranalyse zijn geformuleerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- In de overwegingen heeft de werkgroep voor iedere aanbeveling het bewijs waarop de aanbeveling is gebaseerd en de aanvaardbaarheid en toepasbaarheid van de aanbeveling voor de Nederlandse klinische praktijk beoordeeld. Op basis van deze beoordeling is door de werkgroep besloten welke aanbevelingen ongewijzigd zijn overgenomen, welke aanbevelingen niet zijn overgenomen, en welke aanbevelingen (mits in overeenstemming met het bewijs) zijn aangepast naar de Nederlandse context. ‘De novo’ aanbevelingen zijn gedaan in situaties waarin de werkgroep van mening was dat een aanbeveling nodig was, maar deze niet als zodanig in de WHO-richtlijn was opgenomen. Voor elke aanbeveling is vermeld hoe deze tot stand is gekomen, te weten: ‘WHO’, ‘aangepast van WHO’ of ‘de novo’.
Voor een verdere toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
World Health Organization. Global guidelines for the prevention of surgical site infection,
second edition. Geneva: World Health Organization; 2018. (https://www.who.int/publications/i/item/9789241550475, accessed 12 June 2023).
Zoekverantwoording
Zie voor de zoekstrategie het tabblad 'Evidence tabellen'.
