Immunosuppressieve middelen
Uitgangsvraag
Wat is het effect van behandeling met immunosuppressiva in de perioperatieve periode op de incidentie van postoperatieve wondinfecties?1
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
1 De WHO-richtlijn beschrijft geen uitgangsvragen. De uitgangsvragen voor deze module zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
Aanbeveling
Overleg met het behandelend specialisme dat de immunosuppressiva heeft voorgeschreven en de patiënt over het stopzetten van een behandeling of het aanpassen van de dosering van immunosuppressiva voorafgaand aan een chirurgische ingreep [aangepast WHO 2018].
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Immunosuppressiva zijn geneesmiddelen die het immuunsysteem onderdrukken door de DNA-synthese of bepaalde enzymen die de celproliferatie en -differentiatie regelen, te blokkeren. Als gevolg van de immunologische onderdrukking kan de kans op infectie bij de patiënt hierdoor toenemen (Groenen, 2023).
Er is literatuuronderzoek verricht naar het effect van het perioperatief stopzetten van behandeling met immunosuppressiva in vergelijking met het perioperatief continueren van de behandeling met immunosuppressiva bij patiënten die een chirurgische ingreep ondergaan. Postoperatieve wondinfecties (POWI) werden als cruciale uitkomstmaat gedefinieerd en POWI-attributieve sterfte als belangrijke uitkomstmaat. Een relatief verschil van 25% (relatief risico kleiner dan 0.80 of groter dan 1.25) in het optreden van POWI en 5% (relatief risico kleiner dan 0.95 of groter dan 1.05) in het optreden van POWI-attributieve sterfte tussen beide interventies werd als klinisch relevant beschouwd.
Er werden acht studies geïncludeerd die het effect van het perioperatief stopzetten van immunosuppressiva vergeleken met het perioperatief continueren van de behandeling met immunosuppressiva bij patiënten die een chirurgische ingreep ondergingen. In totaal includeerden deze studies 2461 patiënten.
De kwaliteit van het bewijs was zeer laag. In de RCT’s was een hoog of onduidelijk risico op allocation concealment, tevens was het proces van blindering veelal onduidelijk of onzorgvuldig. De studies laten een zeer beperkt aantal events zien; de betrouwbaarheidsintervallen zijn wijd. De populaties in de RCT’s betreffen enkel patiënten met reumatoïde artritis. Er waren grote verschillen tussen de studies met betrekking tot het moment en duur van het stopzetten van de behandeling met immunosuppressiva. In enkele studies werd dit zelfs niet gespecificeerd.
Analyse van de studies die het stopzetten versus continuering van Methotrexate (MTX) onderzochten lieten geen effect (of een mogelijk schadelijk effect) zien van het perioperatief stopzetten van MTX op het de incidentie van POWI (odds ratio (OR): 7.75 (95% CI: 1.66 tot 36.24) voor de RCT’s en OR 0.37 (95% CI: 0.07 tot 1.89) voor observationele studies). De twee observationele studies die het staken van tumor necrose factor remmers (anti-TNF) onderzochten (den Broeder, 2007; Berthold, 2013) lieten een mogelijk voordelig effect zien op de incidentie van POWI (OR: 0.59; 95% CI: 0.37 tot 0.95).
Samenvattend betekenen de resultaten dat het erg onzeker is wat het effect is van perioperatief staken van immunosuppressiva in vergelijking met het perioperatief continueren van de behandeling met immunosuppressiva bij patiënten die een chirurgische ingreep ondergaan.
Er is geen conclusie te trekken met betrekking tot het effect van het perioperatief staken van immunosuppressiva op POWI-attributieve sterfte, omdat geen van de geïncludeerde studies POWI-attributieve sterfte als uitkomst heeft gerapporteerd.
Bijwerkingen
Het is belangrijk om een zorgvuldige afweging te maken voor het al dan niet staken van immunosuppressieve therapie voorafgaand aan een chirurgische ingreep. Het risico verbonden aan het stopzetten van de behandeling, zoals het opflakkeren van onderliggende ziekte, moet voor iedere patiënt afzonderlijk worden beoordeeld met betrokkenheid van de behandelend arts, patiënt en chirurg (Sany, 1993; Grennan, 2001; Jain, 2002; Perhala, 1991; Hirano, 2010; Schluender, 2007; Waterman, 2013; Kawakami, 2010). Over het algemeen is het risico op ernstige bijwerkingen geassocieerd met het staken van therapie hoog bij patiënten die immunosuppressieve gebruiken na een orgaantransplantatie of voor reumatoïde artritis. Het risico is mogelijk lager bij patiënten die immunosuppressiva gebruiken voor inflammatoire darmaandoeningen (Sany, 1993; Grennan, 2001; Jain, 2002; Perhala, 1991; Hirano, 2010; Schluender, 2007; Waterman, 2013; Kawakami, 2010).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Er zijn geen studies gevonden naar de waarden en voorkeuren van patiënten met betrekking tot het gebruik van immunosuppressiva. Het is belangrijk dat de patiënt wordt geïnformeerd met betrekking tot de voor- en nadelen (risico’s en bijwerkingen) van het perioperatief staken van deze middelen. De patiënt kan in samenspraak met het behandelend specialisme/ arts die de immunosuppressiva heeft voorgeschreven een beslissing nemen over het al dan niet perioperatief staken van immunosuppressiva.
Kosten (middelenbeslag)
Voor zover bekend bij de werkgroep zijn er geen studies die de kosteneffectiviteit van het staken of continueren van perioperatieve behandeling met immunosuppressiva onderzoeken. Wanneer een besluit wordt genomen over het al dan niet staken van een behandeling met immunosuppressiva zal dit in overleg met de arts moeten plaatsvinden die de onderliggende ziekte behandelt. Dit kan extra kosten met zich meebrengen.
Aanvaardbaarheid, haalbaarheid en implementatie
Het continueren van een behandeling met immunosuppressiva voorafgaand een chirurgisch ingreep wordt al in de praktijk toegepast. De werkgroep verwacht dan ook geen belemmeringen m.b.t. de haalbaarheid en implementatie van de aanbeveling.
Duurzaamheid
Duurzaamheid is niet benoemd in de WHO-richtlijn en er is niet aanvullend naar gezocht.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het bewijs uit de geïncludeerde studies is van zeer lage kwaliteit. De studies laten zien dat het stoppen van immunosuppressiva (methotrexaat (MTX) mogelijk leidt tot bijwerkingen geassocieerd met het staken van de therapie. Er wordt geen effect op het ontstaan van postoperatieve wondinfecties (POWI) waargenomen. Enkel twee observationele studies laten zien dat het stopzetten van tumornecrosefactor-remmers (anti-TNF) voorafgaand aan een chirurgische ingreep mogelijk een voordeel kan hebben om POWI te verminderen.
In de huidige onderzoeken bestaat er een aanzienlijke heterogeniteit met betrekking tot de definitie die wordt gebruikt voor POWI en de tijd tussen stopzetting en operatie evenals de dosering van de immunosuppressieve therapie. Daarnaast gaan de meeste studies over patiënten met reuma. Het is niet duidelijk of deze resultaten generaliseerbaar zijn naar andere patiëntgroepen of patiënten die met andere typen immunosuppressieve middelen (e.g. prednison) worden behandeld. Hierdoor is het niet mogelijk om harde conclusies te trekken en duidelijk richting te geven aan de aanbeveling.
De werkgroep wil het delicate evenwicht benadrukken dat moet worden gevonden bij het besluiten om de handeling met immunosuppressiva voorafgaand aan de operatie al dan niet te continueren. Het staken van deze medicijnen kan enerzijds wondgenezing bevorderen. Dit voordeel moet worden afgewogen tegen de primaire indicatie waarvoor immunosuppressiva zijn voorgeschreven zoals orgaantransplantatie of ernstige auto-immuunziekten. Het onderdrukken van het immuunsysteem is vaak cruciaal om het lichaam te beschermen om de onderliggende ziekte te controleren. Het staken ervan kan ernstige gevolgen hebben voor de patiënt en de onderliggende medische aandoening verergeren. Het is daarom essentieel dat zorgvuldig de risico’s en voordelen worden afgewogen, rekening houdend met zowel de indicatie voor de behandeling met immunosuppressiva als het potentiële effect op het risico op POWI.
Samenvattend, rekening houdend met de zeer beperkte kwaliteit van het bewijs (anti-TNF), het gebrek aan bewijs en zelfs potentiële schadelijke gevolgen (MTX) ten gevolge van het stopzetten van de behandeling en het risico dat gepaard gaat met het stopzetten van de behandeling op de onderliggende ziekte(n) van de patiënt is de werkgroep van mening dat immunosuppressiva niet zonder meer mag worden gestopt voorafgaand aan een chirurgische ingreep om de kans op POWI te voorkomen. Het is belangrijk om een zorgvuldige afweging te maken voor het al dan niet staken van immunosuppressieve therapie voorafgaand aan een chirurgische ingreep. Het risico verbonden aan het stopzetten van de behandeling, zoals het opflakkeren van onderliggende ziekte, het risico op POWI en andere mogelijk nadelige bijwerkingen van continuering van de therapie (e.g. remming op botgenezing) moet voor iedere patiënt afzonderlijk worden beoordeeld. Dit dient zorgvuldig te worden gewogen met betrokkenheid van de behandelend arts, patiënt en chirurg.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Onderbouwing
Achtergrond
Immunosuppressiva zijn geneesmiddelen die de activering van het immuunsysteem remmen of voorkomen. Vaak worden deze middelen voorgeschreven om afstoting van getransplanteerde organen te voorkomen of bij de behandeling van ontstekingsziekten, zoals reumatoïde artritis of inflammatoire darmaandoeningen. Observationeel onderzoek toont aan dat het immunosuppressieve effect van deze middelen kan leiden tot een verminderde wondgenezing en een verhoogd risico op infectie bij patiënten die met deze middelen worden behandeld (Berthold, 2013). Omgekeerd kan het staken van de behandeling met immunosuppressiva leiden tot opflakkering van ziekteactiviteit. Tevens kan langdurig onderbreking van therapie de vorming van antistoffen tegen geneesmiddelen veroorzaken en vervolgens het effect van immunosuppressiva verminderen (Berthold, 2013).
De richtlijn voor de preventie van postoperatieve wondinfectie (POWI) van de Society for Healthcare Epidemiology of America (SHEA/Infectious Diseases Society of America (IDSA)) is de enige richtlijn die aanbevelingen doet m.b.t. immunosuppressiva. Deze richtlijn beveelt aan om het gebruik van immunosuppressiva in de perioperatieve periode te vermijden (Bafford, 2013, Calderwood 20233). Deze aanbeveling is echter niet gebaseerd op systematische review van de literatuur of op een grondige evaluatie van de kwaliteit van het beschikbare bewijs.
Deze module heeft als doel om de invloed van immunosuppressiva op de incidentie van POWI in kaart te brengen en om te bepalen of het staken in vergelijking met het voortzetten van immunosuppressieve medicatie in de perioperatieve periode effectief is op POWI te voorkomen.
Deze module betreft een adaptatie van de module ‘perioperative discontinuation of immunosuppressive agents’ van de World Health Organization (WHO)-richtlijn ‘Global guidelines for the prevention of surgical site infection, second edition. 2018’ (WHO, 2018A; WHO, 2018B). Voor een toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
Conclusies / Summary of Findings
Methotrexate1
|
Very low GRADE |
The evidence is very uncertain about the effect perioperative discontinuation of MTX on surgical site infections when compared to perioperative continuation of with MTX in patients undergoing surgical operations.
Sources: (Sany, 1991; Grennan, 2001) |
|
No GRADE |
No evidence was found about the effect of perioperative discontinuation immunosuppressive agents (MTX) on surgical site infection attributable mortality when compared to perioperative continuation of immunosuppressive agents (MTX) in patients undergoing surgical operations.
Sources: - |
Tumor necrosis factor inhibitors1
|
Very low GRADE |
The evidence is very uncertain about the effect perioperative discontinuation of anti-TNF on surgical site infections when compared to perioperative continuation of with anti-TNF in patients undergoing surgical operations.
Sources: () |
|
No GRADE |
No evidence was found about the effect of perioperative discontinuation immunosuppressive agents (anti-TNF) on surgical site infection attributable mortality when compared to perioperative continuation of immunosuppressive agents (anti-TNF) in patients undergoing surgical operations.
Sources: - |
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
1 The conclusions of the literature analysis were formulated in accordance with the standard procedures of the Knowledge Institute of the Federation of Medical Specialists.
Samenvatting literatuur
Description of studies
Eight studies comparing perioperative discontinuation vs. continuation of immunosuppressive medication with an SSI outcome were identified, including one randomized controlled trial (RCT) (Sany, 1993), one quasi- randomized RCT (Grennan, 2001) and 6 observational studies (Berthold, 2013; Bridges, 1991; Carpenter, 1996; Colombel, 2004; den Broeder, 2007; Murata, 2006). Included patients were taking immunosuppressive agents and undergoing mainly orthopaedic procedures (Berthold, 2013; Sany, 1993; Grennan, 2001; Bridges, 1991; Carpenter, 1996; den Broeder, 2007; Murata, 2006) and hand (Colombel, 2004) surgery. The underlying disorder of most patients was rheumatoid arthritis, but also Crohn’s disease (Colombel, 2004) and other inflammatory rheumatic diseases (Berthold, 2013).
The time point and time interval of discontinuation of the immunosuppressive agent were as follows: seven days before surgery (Sany, 1993); one week prior to surgery and the week of surgery (Carpenter, 1996); two weeks before surgery until two weeks after surgery (Grennan, 2001); within four weeks prior to surgery (Colombel, 2004); four weeks before surgery (Bridges, 1991); and one, four or eight weeks before and reintroduced one week after surgery (Berthold, 2013). The remaining two studies gave a rather unspecific description of the time point and time interval of discontinuation, that is, more than four times the half-life of the agent (den Broeder, 2007) or more than one week during the perioperative period (Murata, 2006).
According to the different immunosuppressive agents investigated in the studies, the following comparisons were evaluated:
Discontinuation vs. continuation of:
1. methotrexate (MTX)
2. tumour necrosis factor (TNF) inhibitors (anti-TNF)
No relevant evidence was found on the perioperative discontinuation of long-term corticosteroid therapy.
Results
Methotrexate
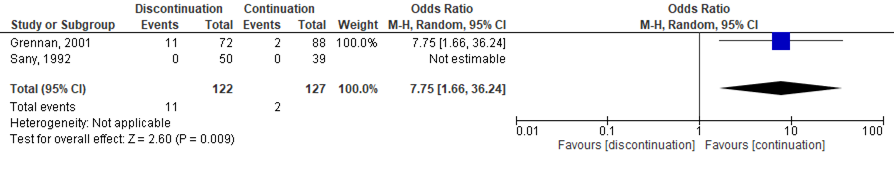
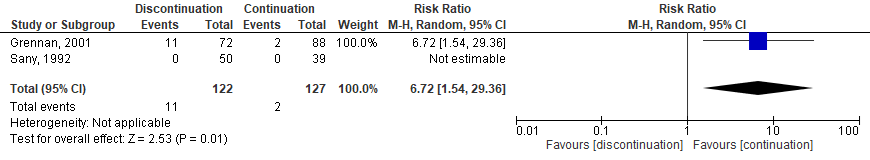
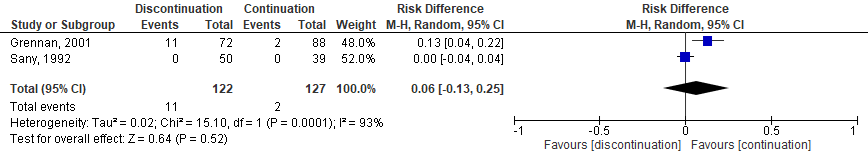
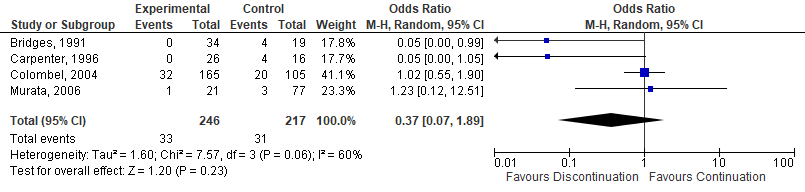
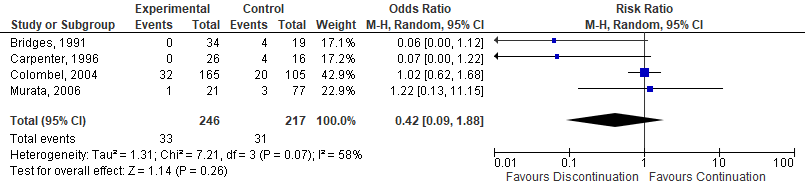
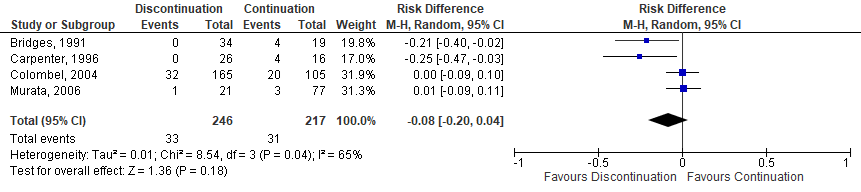
Six studies, one RCT (Sany, 2013), one quasi-RCT (Grennan, 2001) and 4 observational studies (Bridges, 1991; Carpenter, 1996; Colombel, 2004; Murata, 2006) investigated MTX. While the quasi-RCT showed an increased risk for SSI when MTX was discontinued (Grennan, 2001), the RCT had no events estimable in either group (Sany, 2013). One study showed a borderline, significant decreased risk for SSI when MTX was discontinued (Bridges, 1991), whereas 3 studies showed no difference (Carpenter, 1996; Colombel, 2004; Murata, 2006). The meta-analysis showed that the perioperative discontinuation of MTX might increase (Figure 1a, comparisons, comparison 1a (RCT)) or have no effect on the risk of SSI (comparisons, comparison 1b (observational studies)) when compared to continuation of MTX. The combined odds ratio (OR) was 7.75 (95% confidence interval (CI): (1.66 to 36.24)/ RR: 6.72 (1.54 to 29.36) / RD: 0.06 (-0.13 to 0.25) for the RCTs and 0.37 (0.07 to 1.89) / RR: 0.42 (0.09 to 1.88) / RD: -0.08 (-0.20 to 0.04) for the observational studies.
None of the studies reported SSI-attributable mortality rates.
Tumor necrosis factor inhibitors
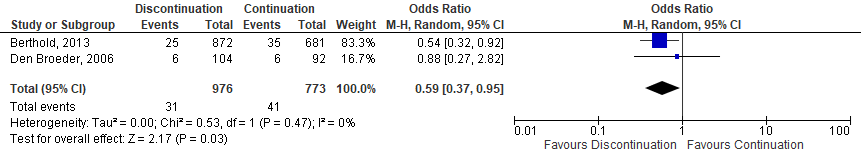
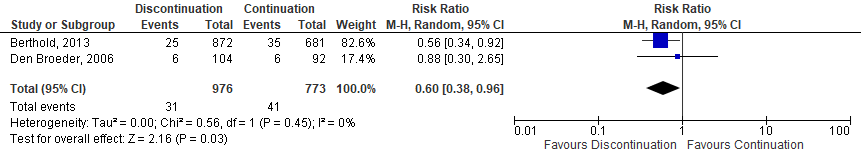
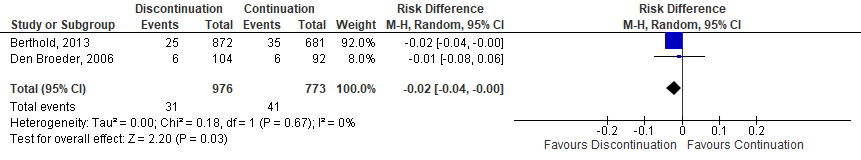
Two observational studies (Berthold,2013; den Broeder, 2007) investigating anti-TNF were identified. One study showed a significantly decreased risk for SSI when anti-TNF was discontinued (Berthold,2013) and the other showed no difference in risk (den Broeder, 2007). A meta-analysis of the 2 studies showed that the perioperative discontinuation of anti-TNF might decrease the risk of SSI (Figure 1b, comparisons, comparison 2) when compared to the continuation of anti-TNF (OR: 0.59; 95% CI: 0.37–0.95) / RR: 0.60 (0.38 to 0.96) / RD: -0.02 (-0.04 to 0.00).
None of the studies reported SSI-attributable mortality rates.

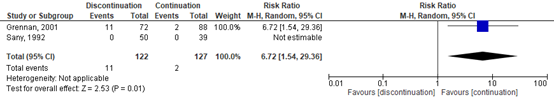
Figure 1a. Forest plot of surgical site infections for perioperative discontinuation MTX versus continuation MTX, randomized controlled trials.
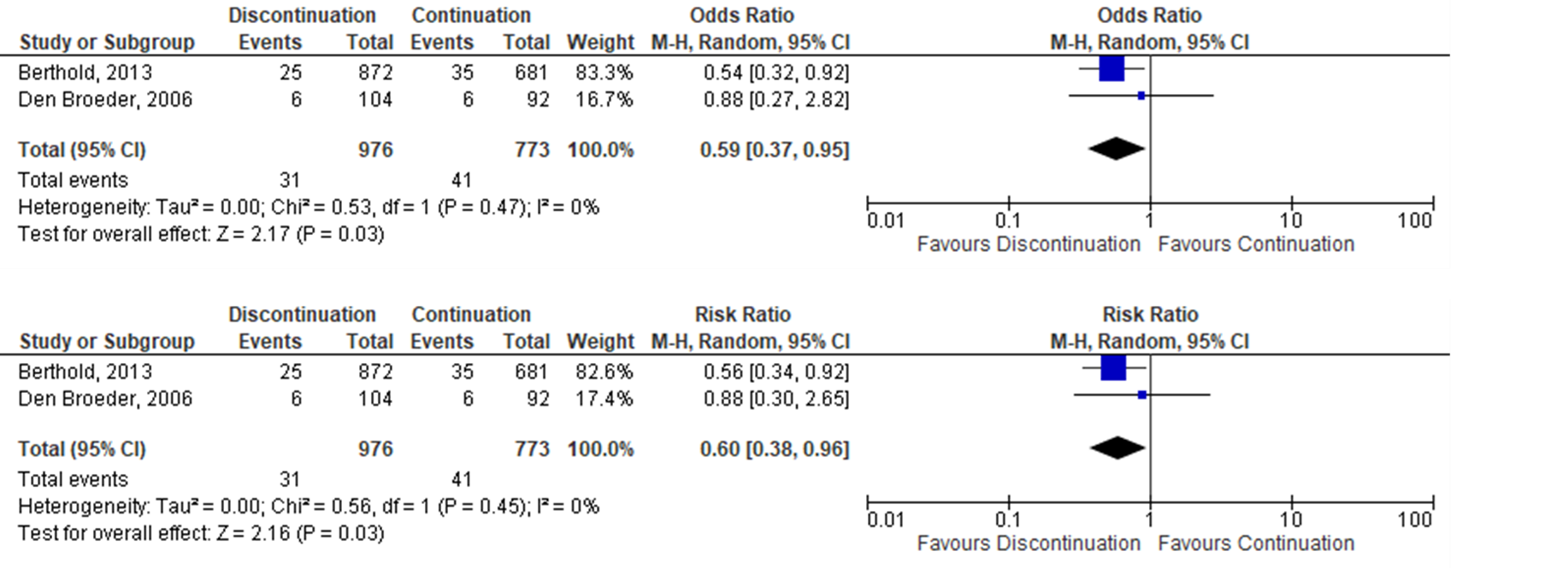
Figure 1b. Forest plot of surgical site infections for perioperative discontinuation anti-TNF versus continuation anti-TNF, observational studies.
Level of evidence of the literature1
Methotrexate
For SSI, the level of evidence, based on the one RCT and one quasi-randomized RCT started at high and was downgraded to very low because of risk of bias (-1), imprecision (-1) and indirectness (-1). (GRADE tables - under tab "evidence tabellen").2
For SSI-attributable mortality, the level of evidence could not be assessed due to the absence of relevant studies.
Tumor necrosis factor inhibitors
For SSI, the level of evidence, based on two observational studies started at low and was downgraded to very low because of imprecision (-1) and indirectness (-1). (GRADE tables - - under tab "evidence tabellen").2
For SSI-attributable mortality, the level of evidence could not be assessed due to the absence of relevant studies.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
1 The level of evidence reported by the WHO for observational studies was not adopted as RCTs were available.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following (search) question:
Should immunosuppressive agents be discontinued perioperatively in surgical patients and does this affect the incidence of SSI and SSI-attributable mortality?2
P: patients of any age taking immunosuppressive agents and undergoing surgical procedures
I: discontinuation of immunosuppressive agents
C: continuation of immunosuppressive agents
O: SSI, SSI-attributable mortality
Relevant outcome measures
The working group considered surgical site infections as a critical outcome and SSI-attributable mortality as an important outcome for decision making.3
The working group defined a 25% relative difference (RR<0.8 or >1.25) in SSI rate and a 5% relative difference (RR<0.95 or >1.05) in SSI-attributable mortality as minimal clinically (patient) important difference.
Search and select (Methods)
The WHO searched the following databases: Medline (via Ovid); Excerpta Medica Database (EMBASE via Ovid); Cumulative Index to Nursing and Allied Health Literature (CINAHL); Cochrane Central Register of Controlled Trials (CENTRAL); and WHO regional medical databases. The time limit for the review was between 1 January 1990 and 17 January 2014. Language was restricted to English, French and Spanish. A comprehensive list of search terms was used. The detailed search strategy is available under the "Evidence tabellen" tab.
Two independent WHO-authors screened the titles and abstracts of retrieved references for potentially relevant studies. The full text of all potentially eligible articles was obtained and then reviewed independently by two WHO authors for eligibility based on inclusion criteria. Duplicate studies were excluded. Data were extracted in a predefined evidence table (Evidence tables) and retrieved studies were critically appraised. Quality was assessed using the Cochrane Collaboration tool (Higgins, 2011) to assess the risk of bias of randomized controlled studies (Risk of bias tables). Any disagreements were resolved through discussion or after consultation with the senior WHO-author, when necessary.
Meta-analyses of available comparisons were performed using Review Manager v5.3 as appropriate (Cochrane Collaboration, 2014) (Comparisons).
The WHO extracted and pooled odds ratios (OR) with 95% confidence intervals (CI) for each comparison with a random effects model. In addition to the WHO meta-analyses, relative risks (RR) and risk differences (RD) with 95% confidence intervals (CI) were extracted and pooled with a random effects model and added to the current literature analysis.4
The WHO used the Grading of Recommendations Assessment, Development and Evaluation (GRADE) methodology (GRADE Pro software) (GRADE Working Group, 2015) to assess the quality of the body of retrieved evidence (GRADE tables).
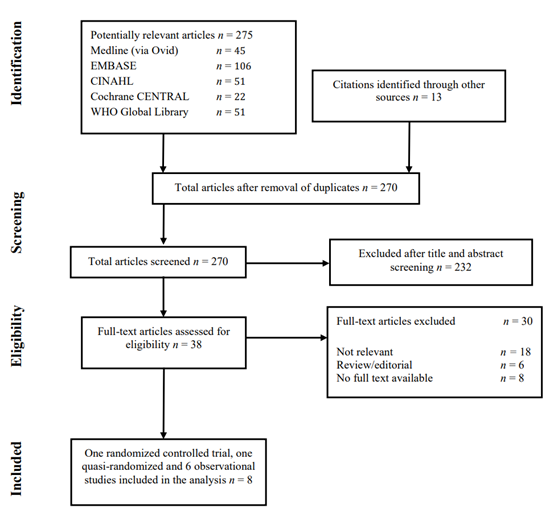
The WHO systematic literature search resulted in 270 (non-duplicate) hits. 38 studies were initially selected based on title and abstract screening; after reading the full text, 30 studies were excluded, and eight studies were included in the analysis (Study selection).
Results
Eight studies were included in the analysis of the literature, one randomized controlled trial (RCT) and one quasi-randomized trial and six observational studies (Summary of literature). Important study characteristics and results are summarized in he Evidence tables. The assessment of the risk of bias is summarized in the Risk of bias tables.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
2 The working group modified the WHO-search question by including all WHO-defined outcomes.
3 The WHO-guideline did not distinguish between crucial and important outcome measures and did not define thresholds for clinical decision making.
4 The WHO-guideline did not report relative risks and risk differences.
Referenties
- Berthold E, Geborek P, Gulfe A. Continuation of TNF blockade in patients with inflammatory rheumatic disease. An observational study on surgical site infections in 1,596 elective orthopedic and hand surgery procedures. Acta Orthop. 2013;84:495-501.
- Bafford AC, Powers S, Ha C, Kruse D, Gorfine SR, Chessin DB, et al. Immunosuppressive therapy does not increase operative morbidity in patients with Crohn's disease. J Clin Gastroenterol. 2013;47:491-5. 3. Anderson DJ, Podgorny K, Berrios-Torres SI, Bratzler DW,
- Bridges SL, Jr., Lopez-Mendez A, Han KH, Tracy IC, Alarcon GS. Should methotrexate be discontinued before elective orthopedic surgery in patients with rheumatoid arthritis? J. Rheumatol. 1991;18:984-8.
- Calderwood MS, Anderson DJ, Bratzler DW, Dellinger EP, Garcia-Houchins S, Maragakis LL, Nyquist AC, Perkins KM, Preas MA, Saiman L, Schaffzin JK, Schweizer M, Yokoe DS, Kaye KS. Strategies to prevent surgical site infections in acute-care hospitals: 2022 Update. Infect Control Hosp Epidemiol. 2023 May;44(5):695-720. doi: 10.1017/ice.2023.67. Epub 2023 May 4. PMID: 37137483.
- Carpenter MT, West SG, Vogelgesang SA, Casey Jones DE. Postoperative joint infections in rheumatoid arthritis patients on methotrexate therapy. Orthopedics. 1996;19:207-10. 13.
- Colombel JF, Loftus EV, Jr., Tremaine WJ, Pemberton JH, Wolff BG, Young Fadok T, et al. Early postoperative complications are not increased in patients with Crohn's disease treated perioperatively with infliximab or immunosuppressive therapy. Am J Gastroenterol. 2004;99:878-83.
- den Broeder AA, Creemers MC, Fransen J, de Rooij DJ, Wymenga A, de Waal-Malefijt M, et al. Risk factors for surgical site infections and other complications in elective surgery in patients with rheumatoid arthritis with special attention for anti-tumor necrosis factor: a large retrospective study. J Rheumatol. 2007;34:689-95. Page 23 of 23 15.
- Dellinger EP, Greene L, et al. Strategies to prevent surgical site infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:605-27.
- GRADEpro Guideline Development Tool [website]. Summary of findings tables, health technology sssessment and guidelines. GRADE Working Group, Ontario: McMaster University and Evidence Prime Inc.; 2015 (http://www.gradepro.org, accessed 5 May 2016).GRADEpro
- Grennan DM, Gray J, Loudon J, Fear S. Methotrexate and early postoperative complications in patients with rheumatoid arthritis undergoing elective orthopaedic surgery. Ann Rheum Dis. 2001;60:214-7.
- Groenen, H., Boermeester, M.A. (2023). Immunosuppression in Surgical Patients. In: Coccolini, F., Catena, F. (eds) Textbook of Emergency General Surgery. Springer, Cham. https://doi.org/10.1007/978-3-031-22599-4_21.
- Higgins JP, Altman DG, Gotzsche PC, Jüni P, Moher D, Oxman AD, et al. T The Cochrane Collaboration's tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
- Hirano Y, Kojima T, Kanayama Y, Shioura T, Hayashi M, Kida D, et al. Influences of anti-tumour necrosis factor agents on postoperative recovery in patients with rheumatoid arthritis. Clin Rheumatol. 2010;29:495-500.
- Jain A, Witbreuk M, Ball C, Nanchahal J. Influence of steroids and methotrexate on wound complications after elective rheumatoid hand and wrist surgery. J Hand Surg. 2002;27:449-55.
- Kawakami K, Ikari K, Kawamura K, Tsukahara S, Iwamoto T, Yano K, et al. Complications and features after joint surgery in rheumatoid arthritis patients treated with tumour necrosis factor-alpha blockers: perioperative interruption of tumour necrosis factor-alpha blockers decreases complications? Rheumatol (Oxford). 2010;49:341-7
- Murata K, Yasuda T, Ito H, Yoshida M, Shimizu M, Nakamura T. Lack of increase in postoperative complications with low-dose methotrexate therapy in patients with rheumatoid arthritis undergoing elective orthopedic surgery. Mod Rheumatol. 2006;16:14-9.
- Perhala RS, Wilke WS, Clough JD, Segal AM. Local infectious complications following large joint replacement in rheumatoid arthritis patients treated with methotrexate versus those not treated with methotrexate. Arthritis Rheum. 1991;34:146-52.
- Sany J, Anaya JM, Canovas F, Combe B, Jorgensen C, Saker S, et al. Influence of methotrexate on the frequency of postoperative infectious complications in patients with rheumatoid arthritis. J Rheumatol. 1993;20:1129-32.
- Schluender SJ, Ippoliti A, Dubinsky M, Vasiliauskas EA, Papadakis KA, Mei L, et al. Does infliximab influence surgical morbidity of ileal pouch-anal anastomosis in patients with ulcerative colitis? Dis. Colon Rectum. 2007;50:1747-53.
- The Nordic Cochrane Centre TCC. Review Manager (RevMan). Version 5.3. Copenhagen: The Cochrane Collaboration; 2014. 7. Guyatt G, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, , et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol. 2011;64:383-94.
- Waterman M, Xu W, Dinani A, Steinhart AH, Croitoru K, Nguyen GC, et al. Preoperative biological therapy and short-term outcomes of abdominal surgery in patients with inflammatory bowel disease. Gut. 2013;62:387-94.
- World Health Organization. Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. (https://www.who.int/publications/i/item/global-guidelines-for-the-prevention-of-surgical-site-infection-2nd-ed/, accessed 12 June 2023). A
- Wells GA, Shea B, O’Connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality if nonrandomized studies in meta-analyses. Toronto: The Ottawa Hospital Research Institute; 2014 (http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp, accessed 13 May 2016).
- World Health Organization. Global Guidelines for the Prevention of Surgical Site Infection. Geneva: World Health Organization; 2018. Web Appendix 12, Summary of a systematic review on the perioperative discontinuation of immunosuppressive agents. (Summary of a systematic review on the perioperative discontinuation of immunosuppressive agents - Global Guidelines for the Prevention of Surgical Site Infection - NCBI Bookshelf (nih.gov), accessed 20 June 2023).
Evidence tabellen
|
Author, year |
Design, scope, setting, population |
Objective |
SSI definition |
Type of surgery |
Study methods |
Intervention |
Results |
|
Berthold, 2013 |
Observational cohort study, single centre, university hospital.
All rheumatic patients undergoing elective surgery |
To assess the influence of TNF inhibitors on the risk of developing SSI. |
CDC health care-associated SSI. |
Elective orthopaedic or hand surgery. (Prosthesis, Arthrodesis, Synovectomy, Resection, Forefoot reconstruction, Miscellaneous) |
Consecutive selection of patients between 2003- 2009. |
A) Discontinuation of TNF inhibitors pre-operatively.
B) TNF inhibitors continued at stable dosage |
A) 872 procedures SSI: (superficial and deep) - 25/872 (3%)
B) 681 procedures SSI: 35/681 (5%)
AE: not specified LF: not specified
P-value/OR: NS
Mortality: not specified |
|
den Broeder, 2006 |
Observational cohort study, multicentre.
All patients with rheumatoid arthritis, patients that underwent elective orthopaedic surgery. |
To assess the effect of withholding vs. maintaining anti-TNF therapy on the incidence of SSI. |
CDC prevention criteria for postoperative infection. |
Elective orthopaedic surgery. (Wrist/hand, ankle/foot, knee, hip shoulder, elbow, other)
|
All consecutive patients with rheumatoid arthritis that underwent orthopaedic surgery between 1997- 2004. |
A) No medication
B) Anti-TNF stopped prior to surgery (>4 times the half-life of antiTNF agent)
C) Anti-TNF continued perioperatively |
A) 1023 procedures SSI: 41/1023 (4%)
B) 104 procedures SSI: 6/104 (6%)
C) 92 procedures SSI: 8/92 (9%)
AE: not specified LF: not specified
OR: 1.56 (95% CI: 0.52–4.66) Page 10 of 23
Mortality: A) 4 (0.4%) B) 0 (0%) C) 0 (0%) |
|
Bridges, 1991 |
Observational cohort study, single centre, university hospital.
All patients with MTX who underwent elective orthopaedic surgery. |
To compare the surgical outcome of rheumatoid arthritis patients with MTX stopped more than 4 weeks preoperatively vs. those with MTX stopped less than 4 weeks preoperatively. |
NS |
Elective orthopaedic surgery. (Joint arhroplasty hip or knee, MCP/schoulder arthroplasty, other)
|
All patients with rheumatoid arthritis between 1981- 1989. |
A) MTX treatment within 4 weeks of surgery.
B) MTX treatment discontinued 4 weeks before surgery or no treatment at all before surgery. |
A) 19 procedures: 4 complications (5%: 2 wound infections, 2 wound dehiscence) B) 34 procedures: 0 complications
AE: not specified LF: 1 patient
P-value/OR: NS
Mortality: A) 1 death (range, 30-144 months after surgery) B) 4 deaths (range, 30-144 months after surgery) |
|
Carpenter, 1996 |
Observational cohort, single centre.
All patients undergoing elective total joint arthroplasty |
To assess the effect of low-dose MTX on postoperative complications in rheumatoid arthritis patients. |
NS |
Elective total joint arthroplasty. (total hip/total wrist arthroplasty) |
All patients with rheumatoid arthritis receiving MTX who were to undergo total joint arthroplasty between 1982- 1991. |
A) MTX withheld 1 week prior to surgery and the week of the surgery (total 2 weeks)
B) MTX maintained throughout the perioperative period |
A) 26 procedures SSI: 0/26
B) 16 procedures SSI: 4/16 procedures (25%)
AE: not specified LF: not specified
P-value/OR: NS Mortality: not specified |
|
Colombel, 2004 |
Retrospective cohort study, single centre.
All patients who underwent abdominal surgery for Crohn’s disease; median age; 40 years (range, 12-83). |
To determine whether the use of immunosuppressive agents prior to abdominal surgery is associated with an increased rate of postoperative complications. |
Septic complications are defined as wound sepsis, intra-abdominal infections and additional abdominal infections. |
Abdominal surgery. (laproscopic procedure, resection, stricturoplasty or resection, stoma or anastomosis). |
All patients who underwent surgical resection, strictureplasty or intestinal bypass for Crohn’s disease between 1998- 2001. |
A) MTX/azathioprine or 6- mercaptopurine continued perioperatively
B) MTX/azathioprine or 6-mercapto-purine discontinued within 4 weeks prior to surgery. |
A) 105 procedures septic complications:20/105 (19%)
B) 165 procedures septic complications:32/165 (19%)
AE: not specified LF: not specified
P-value/OR: NS Mortality: 0% |
|
Grennan, 2001 |
Prospective randomized study, single centre.
All patients undergoing elective orthopaedic surgery. |
To determine whether continued MTX treatment increases the risk of postoperative infections in rheumatoid arthritis patients. |
Wound morbidity (reddening of the wound, discharge), systemic infection or wound dehiscence occurring within 1 year post-surgery. |
Elective orthopaedic surgery. (shoulder, elbow, wrist, hip, knee, ankle, other foot, other hand, metacarpohalangeal)
|
All patients with rheumatoid arthritis receiving MTX and listed for elective orthopaedic surgery.
Patients were allocated by the study coordinator who attempted to match for type of surgery using block randomization. |
A) MTX continued B) MTX discontinued 2 weeks before surgery until 2 weeks after surgery C) Patients with rheumatoid arthritis not taking MTX. |
A) 88 procedures SSI: 2/88 (2%)
B) 72 procedures SSI: 11/72 (15%)
C) 228 procedures SSI: 24/228 (11%)
AE (flare): A) 0 B) 6 (8%) C) 9 (4%)
LF: not specified A vs. B: P<0.003 B vs. C: P=0.026
Mortality: Not specified. |
|
Murata, 2006 |
Retrospective cohort study, single centre.
Rheumatoid arthritis patients undergoing elective orthopaedic surgery. |
To determine the effects of the perioperative use of MTX on complications after surgery. |
Reddening of the wound, discharge and/or re-administration of antibiotics within 1 year after surgery. |
Elective orthopaedic surgery. (Joint arthroplastry (hip, knee, elbow, schoulder – primary/revision), Spine surgery (cervical -, thoracic and lumber spine), hand surgery (synovectomy elbow/wrist, transposition of ulnar nerve), foot surgery (arthrodesis of ankle, toe arhroplastry) |
All patients that underwent orthopaedic surgery between 2000- 2003. |
A) Continuation of MTX
B) Discontinuation of MTX (>1 week perioperatively)
C) No MTX treatment. |
A) 77 procedures SSI: 3/77 (3.9%) B) 21 procedures SSI: 1/21 (4.8%) C) 103 procedures SSI: 4/103 (3.9%)
AE: (flares) A) 3/77 (3.9%) B) 3/21 (14.3%) C) 7/103 (6.8%)
LF: not specified
P= NS Mortality: not specified |
|
Sany, 1992 |
Prospective randomized study, single centre.
Rheumatoid arthritis patients undergoing orthopaedic surgery |
To evaluate the influence of MTX on the frequency of postoperative complications in rheumatoid arthritis patients. |
NS |
Orthopaedic surgery. (total joint arthrorplasty (hip/knee), synovectomie (wrist), tenosynovectomie, arthrodesis (wrist, MP thumb, occiptito -C2, ankle, talonavicuar, other). |
Consecutive patients with rheumatoid arthritis undergoing orthoapedic surgery between 1987- 1990. |
A) MTX discontinued 7 days before surgery
B) MTX continued |
A) 50 procedures SSI: 0/50 (0%)
B) 39 procedures SSI: 0/39 (0%)
AE: (flare) A) 1/39 B) 0/39
LF: not mentioned
P-value/OR: NS Mortality: not specified |
SSI: surgical site infection; TNF: tumor necrosis factor; CDC: Centers for Disease Prevention and Control; AE: adverse event; LF: lost to follow-up; NS: not significant; MTX: methotrexate; OR: odds ratio; CI: confidence interval
Risk of bias in randomized controlled trials (Cochrane Collaboration tool)
|
Author, year |
Sequence generation |
Allocation concealment |
Participants/Careproviders blinded |
Outcome assessors blinded |
Incomplete outcome data |
Selective outcome reporting |
Other sources of bias |
|
Grennan, 2001* |
High |
High |
High/High |
Unclear |
Low |
Unclear |
- |
|
Sany, 1992 |
High |
High |
High/Low |
Unclear |
Low |
Unclear |
- |
*quasi-randomized trial
RCT: randomized controlled trial
Risk of bias in cohort studies (Newcastle Ottawa Quality Assessment Scale)*
|
Author, year |
Representativeness of cohort |
Selection of non-exposed cohort |
Ascertainment of exposure |
Demonstration that outcome of interest was not present at start |
Comparability of cohorts |
Assessment of outcome |
Follow-up long enough |
Adequacy of follow-up of cohorts |
|
Berthold, 2013 |
B (*) |
B |
A (*) |
B |
A (*) |
B (*) |
A (*) |
B (*) |
|
den Broeder, 2006 |
B (*) |
A (*) |
A (*) |
B |
A (*) |
B (*) |
A (*) |
D |
|
Bridges, 1991 |
B (*) |
A (*) |
A (*) |
B |
A (*) |
B (*) |
A (*) |
D |
|
Carpenter, 1996 |
B (*) |
A (*) |
A (*) |
B |
A (*) |
B (*) |
B |
D |
|
Colombel, 2004 |
B (*) |
A (*) |
A (*) |
B |
A (*) |
B (*) |
A (*) |
D |
|
Murata, 2006 |
A (*) |
B |
A (*) |
B |
A (*) |
B (*) |
A (*) |
D |
*Interpretation: A, B, C and D represent answer options for each of the eight items. Answer options are awarded one star or zero stars. A study can be awarded a maximum of one star for each item, except for ‘Comparibility of cohorts’ that can be awarded a maximum of two stars (multiple answers possible). A high number of stars represents a low risk of bias.
Study selection
Flow chart of the study selection
Comparisons
In addition to the odds ratios (OR) reported by the WHO, relative risks (RR) and risk differences (RD) with 95% confidence intervals (CI) were extracted and pooled with a random effects model and added to the current literature analysis.*
Comparison 1a. Discontinuation vs. continuation of MTX (controlled trials)*
Randomized controlled trials
Forest plot 1a
Comparison 1b. Discontinuation vs. continuation of MTX (observational studies)*
Forest plot 1b
Comparison 2. Discontinuation vs. continuation of anti-TNF (observational studies)*
Forest plot 2
* The WHO-guideline did not report relative risks and risk differences.
GRADE tables
Comparison 1. Discontinuation vs. continuation of MTX
|
Outcome |
Quality assessment |
Number of patients |
Effect |
Quality |
||||||||
|
No of studies |
Study design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
With discontinuation of MTX |
With continuation of MTX |
Relative (95% CI) |
Absolute (95% CI) |
||
|
Surgical site infection (SSI) |
2 |
RCTs* |
Serious1 |
Not serious |
Serious2 |
Serious3 |
None |
11/122 (9%) |
2/127 (1.6%) |
OR: 7.75 (1.66 to 36.24)
RR5: 6.75 (1.54 to 29.36) |
95 more per 1000 (from 10 more to 351 more) |
⨁◯◯◯ VERY LOW
|
|
SSI-attributable mortality |
0 |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
No GRADE |
|
|
||||||||||||
|
Surgical site infection (SSI) |
4 |
Observational studies |
Not Serious |
Not Serious |
Not Serious |
Very serious4 |
None |
33/246 (13.4%) |
31/217 (14.3%) |
OR 0.37 (0.07 tot 1.89)
RR5: 0.42 (0.09 to 1.88) |
85 fewer per 1000 (from 97 more to 131 fewer) |
⨁◯◯◯ VERY LOW
|
|
SSI-attributable mortality |
0 |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
* includes one quasi-randomized trial; 1 Risk of performance bias, detection bias; 2 patients with Rheumatoid Arthritis only; 3 Optimal information size not met; 4 Optimal information size not met and CI includes both appreciable benefit and harm (RR and RRR of 25%); 5 Supplementary to WHO-guideline
MTX=methotrexate, CI=confidence interval; OR=odds ratio; RCT=randomized controlled trial; RR=relative risk; RRR= relative risk reduction; NA=not applicable
Comparison 2: Discontinuation vs. continuation of anti-TNF
|
Outcome |
Quality assessment |
Number of patients |
Effect |
Quality |
||||||||
|
No of studies |
Study design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
With discontinuation of anti-TNF |
With continuation of anti-TNF |
Relative (95% CI) |
Absolute (95% CI) |
||
|
Surgical site infection (SSI) |
2 |
Observational studies |
Not serious |
Not serious |
Serious1 |
Serious2 |
None |
31/976 (3.2%) |
41/773 (5.35) |
OR: 0.59 (0.37 to 0.95)
RR3: 0.60 (0.38 to 0.96)
|
21 fewer per 1000 (from 3 fewer to 33 fewer) |
⨁◯◯◯ VERY LOW
|
|
SSI-attributable mortality |
0 |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
No GRADE |
1 Patients undergoing orthopedic surgery only
2 Optimal information size not met
3 Supplementary to WHO-guideline
TNF: tumor necrosis factor; CI: confidence interval; OR: odds ratio; RR=relative risk; RRR= relative risk reduction; NA=not applicable
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Search strategy
Medline (via OVID)
1. wound infection.mp. or exp wound infection/
2. exp surgical procedures, operative/ or exp perioperative period/ or exp preoperative
care/ or exp perioperative care/ or (surger* or operat* or perioperat* or peri-operat*
or pre-operat* or preoperat*).ti,ab,kw.
3. exp immunosuppressive agents/ or exp adrenal cortex hormones/ or (immuno
suppress* or immunosuppress* or immune suppress* or immunesuppress* or
corticosteroid*).ti,ab,kw.
4. surgical wound infection/ or (surgical site infection* or SSI or SSIs or surgical
wound infection* or surgical infection* or post-operative wound infection* or
postoperative wound infection*).ti,ab,kw.
5. (discontinu* or continu*).ti,ab,kw.
6. 2 and 3 and 4 and 5
7. limit 6 to yr="1990 - 2014"
8. 1 or 4
9. 3 and 5
10. 2 and 8 and 9
11. limit 10 to yr="1990 -Current"
EMBASE
1. exp surgery/ or perioperative period/ or preoperative care/ or (surger* or operat* or
perioperat* or peri-operat* or pre-operat* or preoperat*).ti,ab,kw.
2. immunosuppressive agent/ or corticosteroid/ or (immuno suppress* or
immunosuppress* or immune suppress* or immunesuppress* or
corticosteroid*).ti,ab,kw.
3. surgical infection/ or (surgical site infection* or SSI or SSIs or surgical wound
infection* or surgical infection* or post-operative wound infection* or postoperative
wound infection*).ti,ab,kw.
4. (discontinu* or continu*).ti,ab,kw.
5. 1 and 2 and 3 and 4
6. limit 5 to yr="1990 - 2014"
7. exp wound infection/
8. 3 or 7
9. 2 and 4
10. 1 and 8 and 9
11. limit 10 to yr="1990 -Current"
CINAHL
S1. (MH "wound infection+") OR "wound infection" OR (MH "surgical wound
infection")
S2. (MH "immunosuppressive agents+") OR "immunosuppressive agents"
Page 8 of 23
S3. (MH "immunosuppression+") OR "immunosuppression"
S4. S2 OR S3S5. S1 AND S4
Cochrane CENTRAL
(wound infections) AND (immunosuppressive therapy)
WHO Global Regional Medical Databases
((ssi) OR (surgical site infection) OR (surgical site infections) OR (wound infection)
OR (wound infections)) AND immunosuppressive
ti: title; ab: abstract; kw: key word
1 Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-12-2024
Beoordeeld op geldigheid : 01-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS) en . De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules 2 tot 16 is in 2020 op initiatief van de NVvH een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor preventie van postoperatieve wondinfecties. Daarnaast is in 2022 op initiatief van het Samenwerkingsverband Richtlijnen Infectiepreventie (SRI) een separate multidisciplinaire werkgroep samengesteld voor de herziening van de WIP-richtlijn over postoperatieve wondinfecties: module 17-22. De ontwikkelde modules van beide werkgroepen zijn in deze richtlijn samengevoegd.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Werkgroep NVvH - Module 2-16
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. prof. dr. M.A. Boermeester |
Chirurg |
* Medisch Ethische Commissie, Amsterdam UMC, locatie AMC * Antibiotica Commissie, Amsterdam UMC |
Persoonlijke financiële belangen Hieronder staan de beroepsmatige relaties met bedrijfsleven vermeld waarbij eventuele financiële belangen via de AMC Research B.V. lopen, dus institutionele en geen persoonlijke gelden zijn: Skillslab instructeur en/of spreker (consultant) voor KCI/3M, Smith&Nephew, Johnson&Johnson, Gore, BD/Bard, TELABio, GDM, Medtronic, Molnlycke.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Institutionele grants van KCI/3M, Johnson&Johnson en New Compliance.
Intellectuele belangen en reputatie Ik maak me sterk voor een 100% evidence-based benadering van maken van aanbevelingen, volledig transparant en reproduceerbaar. Dat is mijn enige belang in deze, geen persoonlijk gewin.
Overige belangen Geen.
|
Extra kritische commentaarronde. |
|
Dhr. dr. M.J. van der Laan |
Vaatchirurg |
Vice voorzitter Consortium Kwaliteit van Zorg NFU, onbetaald
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen.
|
|
Dhr. dr. W.C. van der Zwet |
Arts-microbioloog |
Lid Regionaal Coördinatie Team, Limburgs infectiepreventie & ABR Zorgnetwerk (onbetaald) |
||
|
Dhr. dr. D.R. Buis |
Neurochirurg |
Lid Hoofdredactieraad Tijdschrift voor Neurologie & Neurochirurgie - onbetaald |
||
|
Dhr. dr. J.H.M. Goosen |
Orthopaedisch Chirurg |
Inhoudelijke presentaties voor Smith&Nephew en Zimmer Biomet. Deze worden vergoed per uur. |
||
|
Mw. drs. H. Jalalzadeh |
Arts-onderzoeker |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen.
|
|
Dhr. dr. N. Wolfhagen |
AIOS chirurgie |
|||
|
Mw. drs. H. Groenen |
Arts-onderzoeker |
|||
|
Dhr. dr. F.F.A. Ijpma |
Traumachirurg |
|||
|
Dhr. dr. P. Segers |
Cardiothoracaal chirurg |
|||
|
Mw. Y.E.M. Dreissen |
AIOS neurochirurgie |
|||
|
Dhr. R.R. Schaad |
Anesthesioloog |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt. Voor de modules 17-22 was de patiëntfederatie vertegenwoordigd in de werkgroep.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn.
Voor module 8 (Negatieve druktherapie) geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000 - 40.000 patiënten). Tevens volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
Voor de overige modules en aanbevelingen geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten). Tevens volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Ook wordt geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners verwacht of een wijziging in het opleidingsniveau van zorgpersoneel. Er worden daarom geen substantiële financiële gevolgen verwacht.
Implementatie
Zie voor de implementatie het implementatieplan in het tabblad 'Bijlagen'.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroepen de knelpunten in de zorg voor patiënten die chirurgie ondergaan. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. De verslagen hiervan zijn opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Adaptatie
Een aantal modules van deze richtlijn betreft een adaptatie van modules van de World Health Organization (WHO)-richtlijn ‘Global guidelines for the prevention of surgical site infection’ (WHO, 2018), te weten:
- Module Normothermie
- Module Immunosuppressive middelen
- Module Glykemische controle
- Module Antimicrobiële afdichtingsmiddelen
- Module Wondbeschermers bij laparotomie
- Module Preoperatief douchen
- Module Preoperatief verwijderen van haar
- Module Chirurgische handschoenen: Vervangen en type handschoenen
- Module Afdekmaterialen en operatiejassen
Methode
- Uitgangsvragen zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- De inleiding van iedere module betreft een korte uiteenzetting van het knelpunt, waarbij eventuele onduidelijkheid en praktijkvariatie voor de Nederlandse setting wordt beschreven.
- Het literatuuronderzoek is overgenomen uit de WHO-richtlijn. Afhankelijk van de beoordeling van de actualiteit van de richtlijn is een update van het literatuuronderzoek uitgevoerd.
- De samenvatting van de literatuur is overgenomen van de WHO-richtlijn, waarbij door de werkgroep onderscheid is gemaakt tussen ‘cruciale’ en ‘belangrijke’ uitkomsten. Daarnaast zijn door de werkgroep grenzen voor klinische besluitvorming gedefinieerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten, en is de interpretatie van de bevindingen primair gebaseerd op klinische relevantie van het gevonden effect, niet op statistische significantie. In de meta-analyses zijn naast odds-ratio’s ook relatief risico’s en risicoverschillen gerapporteerd.
- De beoordeling van de mate van bewijskracht is overgnomen van de WHO-richtlijn, waarbij de beoordeling is gecontroleerd op consistentie met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten (GRADE-methode; http://www.gradeworkinggroup.org/). Eventueel door de WHO gerapporteerde bewijskracht voor observationele studies is niet overgenomen indien ook gerandomiseerde gecontroleerde studies beschikbaar waren.
- De conclusies van de literatuuranalyse zijn geformuleerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- In de overwegingen heeft de werkgroep voor iedere aanbeveling het bewijs waarop de aanbeveling is gebaseerd en de aanvaardbaarheid en toepasbaarheid van de aanbeveling voor de Nederlandse klinische praktijk beoordeeld. Op basis van deze beoordeling is door de werkgroep besloten welke aanbevelingen ongewijzigd zijn overgenomen, welke aanbevelingen niet zijn overgenomen, en welke aanbevelingen (mits in overeenstemming met het bewijs) zijn aangepast naar de Nederlandse context. ‘De novo’ aanbevelingen zijn gedaan in situaties waarin de werkgroep van mening was dat een aanbeveling nodig was, maar deze niet als zodanig in de WHO-richtlijn was opgenomen. Voor elke aanbeveling is vermeld hoe deze tot stand is gekomen, te weten: ‘WHO’, ‘aangepast van WHO’ of ‘de novo’.
Voor een verdere toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
World Health Organization. Global guidelines for the prevention of surgical site infection,
second edition. Geneva: World Health Organization; 2018. (https://www.who.int/publications/i/item/9789241550475, accessed 12 June 2023).
Zoekverantwoording
Zie voor de zoekstrategie het tabblad 'Evidence tabellen'.
