Antimicrobiële afdichtingsmiddelen
Uitgangsvraag
Wat is de plaats van antimicrobiële afdichtingsmiddel voor de preventie van postoperatieve wondinfecties?1
Disclaimer: Dit is een adaptatie van een origineel werk ‘Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.’ (https://www.who.int/publications/i/item/9789241550475). Deze adaptatie is niet uitgevoerd door de WHO. De WHO is niet verantwoordelijk voor de inhoud of nauwkeurigheid van deze adaptatie. De originele uitgave is de bindende en authentieke uitgave.
1 De WHO-richtlijn beschrijft geen uitgangsvragen. De uitgangsvragen voor deze module zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
Aanbeveling
Het gebruik van een antimicrobieel afdichtingsmiddel bij chirurgische ingrepen wordt niet aanbevolen in aanvulling op standaard huiddesinfectie ter preventie van postoperatieve wondinfecties [WHO 2018].
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van antimicrobiële afdichtingsmiddelen na huiddesinfectie in vergelijking met standaard huiddesinfectie bij patiënten die een chirurgische procedures ondergaan. Postoperatieve wondinfecties (POWI) werden als cruciale uitkomstmaat gedefinieerd en POWI-attributieve sterfte als belangrijke uitkomstmaat. Een relatief verschil van 25% (relatief risico kleiner dan 0.80 of groter dan 1.25) in het optreden van POWI en 5% (relatief risico kleiner dan 0.95 of groter dan 1.05) in het optreden van POWI-attributieve sterfte tussen beide interventies werd als klinisch relevant beschouwd.
Er werden negen studies geïncludeerd. De kwaliteit van het bewijs was zeer laag. Analyse van de gerandomiseerde studies liet geen klinisch relevant verschil zien in het optreden van POWI tussen het toepassen van een afdichtingsmiddel en de standaardmethode (RR 0.73; 95% CI 0.43 - 1.23). Er was variatie in de definitie van POWI tussen de studies en tevens was er inconsistentie in de gevonden effecten op POWI’s. Opmerkelijk was dat er meerdere studies werden gefinancierd door fabrikanten, dat blindering onduidelijk was en dat er sprake was van onvolledige en selectieve rapportage van gegevens en uitkomsten.
Samenvattend betekent dit dat het erg onzeker is wat het effect is van het gebruik van een antimicrobieel afdichtingsmiddel op het voorkomen van POWI’s.
Er is geen conclusie te trekken met betrekking tot het effect van antimicrobiële afdichtingsmiddelen op POWI-attributieve sterfte, omdat geen van de geïncludeerde studies POWI-attributieve sterfte als uitkomst heeft gerapporteerd.
Bijwerkingen
Antimicrobiële afdichtingsmiddelen kunnen mogelijke schadelijke effecten hebben op de huid doordat de huid langere tijd bedekt blijft. Het is belangrijk hiermee rekening te houden.
Slechts één van de geïncludeerde studies rapporteerde huidirritatie bij één patiënt in de interventiegroep – mogelijk ten gevolge van het toepassen van het afdichtingsmiddelen. Aanvullende behandeling bij deze patiënt was echter niet nodig (Towfigh, 2008).
Eerdere onderzoeken hebben echter aangetoond dat middelen op basis van cyanoacrylaat bijwerkingen kunnen veroorzaken bij pediatrische patiënten, waaronder huidreacties (Towfigh, 2008, Roy 2014).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Er zijn geen studies gevonden naar de waarden en voorkeuren van patiënten met betrekking tot het gebruik van antimicrobiële afdichtingsmiddelen. Het is belangrijk dat de patiënt wordt geïnformeerd wordt met betrekking tot de voor- en nadelen van het gebruik van deze middelen. Tevens is het van belang de patiënt te informeren over kans op infectie, hoe deze te herkennen en hoe dan te handelen.
Kosten (middelenbeslag)
Voor zover bekend bij de werkgroep zijn er geen studies die de kosteneffectiviteit van afdichtingsmiddelen rapporteren (Lipp 2013). Additioneel gebruik van antimicrobiële afdichtingsmiddel brengt extra kosten met zich mee.
POWI is geassocieerd met extra morbiditeit, langdurige ziekenhuisopname en een aanzienlijke stijging van de gemiddelde kosten voor gezondheidszorg (de Lissovoy, 2009). Een interventie die aantoonbaar de kans op POWI verminderd kan daarom bijdragen aan het verminderen van de kosten voor behandeling van chirurgische patiënten.
Aanvaardbaarheid, haalbaarheid en implementatie
Het toepassen van antimicrobiële afdichtingsmiddelen voorafgaand een chirurgisch ingreep wordt in de praktijk slechts beperkt toegepast. De werkgroep verwacht dan ook geen belemmeringen m.b.t. de haalbaarheid en implementatie van de aanbeveling waarbij het toepassen afgeraden wordt.
Duurzaamheid
Duurzaamheid is niet benoemd in de WHO-richtlijn en er is niet aanvullend naar gezocht.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het bewijs uit de geïncludeerde acht RCTs en één quasi-gerandomiseerde studie is van zeer lage kwaliteit en toont aan dat de preoperatieve toepassing van antimicrobiële afdichtingsmiddelen, naast de standaard huiddesinfectie/voorbereiding van de operatieplaats geen voor- of nadeel oplevert bij het verlagen van de kans op POWI.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Onderbouwing
Achtergrond
Endogene bacteriën op de huid, slijmvliezen en holle organen van een patiënt vormen de belangrijkste bron van verwekkers voor het ontstaan van postoperatieve wondinfecties (POWI) (Mangram 1999). Bij chirurgische ingrepen wordt, voorafgaand aan de incisie, de huid behandeld met antiseptische middelen. De middelen worden effectief beschouwd tegen een breed scala aan bacteriën, schimmels en virussen.
Antimicrobiële afdichtingsmiddelen zijn filmvormende middelen op basis van cyanoacrylaat. Deze worden na desinfectie en voorafgaand aan de incisie aangebracht om de migratie van bacteriën te neutraliseren en daarmee de contaminatie te beperken. Het is echter onduidelijk wat de toegevoegde waarde van deze middelen is in het voorkomen van een POWI.
Deze module betreft een adaptatie van de module ‘Antimicrobial Sealants’ van de World Health Organization (WHO)-richtlijn ‘Global guidelines for the prevention of surgical site infection, second edition. 2018’ (WHO, 2018A; WHO, 2018B). Voor een toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Conclusies / Summary of Findings
Surgical site infections1
|
Very low GRADE |
The evidence is very uncertain about the effect of sealants (in addition to standard surgical site skin preparation) on surgical site infections when compared with standard surgical site skin preparation in patients undergoing surgical operations (any type of procedure).
Sources: (Daeschlein 2014, Doorly 2015, Dromzee 2012, Falk-Brynhildsen 2014, Iyer 2011, Twofigh 2008, Vierhout 2014, von Eckardstein 2011, Waldow 2012) |
Mortality1
|
No GRADE |
No evidence was found about the effect of sealants (in addition to standard surgical site skin preparation) on surgical site infection attributable mortality when compared with standard surgical site skin preparation in patients undergoing surgical operations (any type of procedure).
Sources: - |
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
1 The conclusions of the literature analysis were formulated in accordance with the standard procedures of the Knowledge Institute of the Federation of Medical Specialists.
Samenvatting literatuur
Description of studies
Eight randomized clinical trials (RCTs) (Daeschlein 2014, Doorly 2015, Dromzee 2012, Falk-Brynhildsen 2014, Iyer 2011, Twofigh 2008, Vierhout 2014, von Eckardstein 2011) and one prospective, quasi-randomized trial (Waldow 2012) with surgical side infection (SSI) outcome were identified. They evaluated sealants compared to standard surgical site preparation with antiseptics for the prevention of SSI. All 9 studies compared a cyanoacrylate-based sealant to standard antiseptic preparation without sealant.
One study (Dromzee 2012) included children and adults, while the remaining 8 included adult patients only. Both elective and emergency procedures were included; the types of surgery were cardiac, vascular, colorectal, hernia repair, scoliosis correction and trauma. In each study, the intervention and control groups received the same surgical site skin preparation with the addition of sealant in the intervention groups. The type and concentration of skin preparation varied. Some studies used chlorhexidine gluconate, while others used povidone iodine, all in an alcohol-based solution.
Results
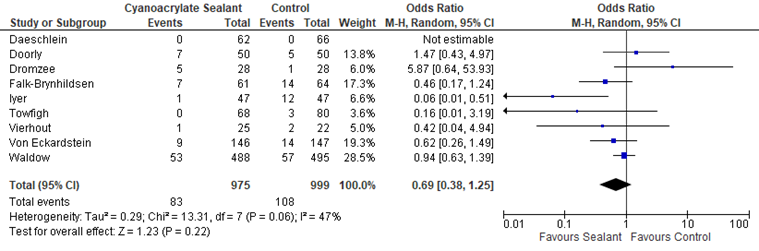
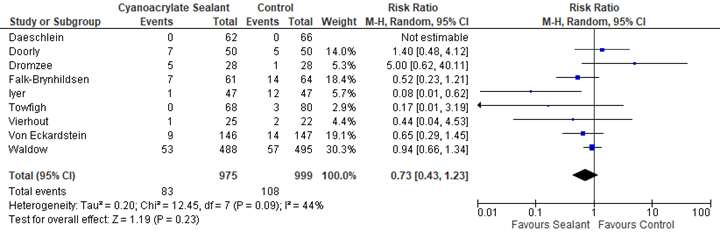
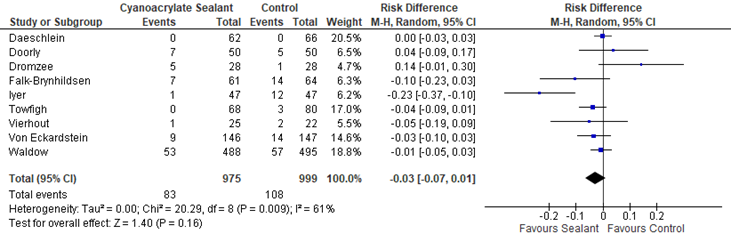
The effects of the intervention on the prevention of SSI varied among studies. One study (Iyer, 2011) reported that sealants may have some benefit compared to standard skin preparation. Five studies (Falk-Brynhildsen 2014, Twofigh 2008, Vierhout 2014, von Eckardstein 2011, Waldow 2012) showed some effect of sealants, but the effect estimate was not clinically relevant compared to the effect of standard skin preparation. Two studies (Doorly 2015, Dromzee 2012) found that sealants may cause harm, but this effect was also not clinically relevant. Meta-analysis of the 8 RCTs and the quasi-randomized trial showed that there was no overall difference between sealants and standard surgical skin preparation in reducing the incidence of SSI (odds ratio (OR): 0.69; 95% confidence interval (CI): 0.38 to 1.25/ RR 0.43; 95% CI 0.43 to 1.23/ RD -0.03; 95% CI -0.03 to 0.01) (Figure 1a, Comparisons). In a sensitivity analysis comparing the overall effect of the included studies with or without the quasi-randomized trial, there was no difference in the results if the trial was included or not (P=0.658).
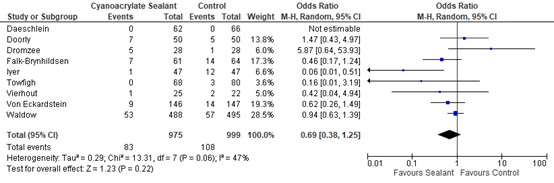
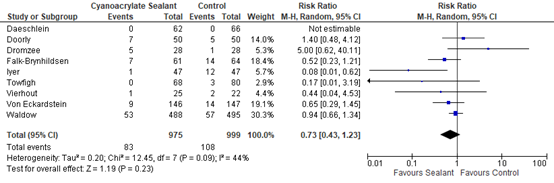
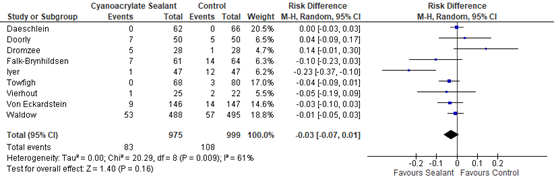
Figure 1a. Forest plot of surgical site infections for sealants versus standard surgical site skin preparation, randomized controlled trials randomized controlled trials (pooled
Level of evidence of the literature
For SSIs, the quality of evidence of the identified studies started at high and was downgraded to very low because of study limitations, including serious risk of bias (mainly due to unclear blinding, incomplete outcome data and selective outcome reporting) and very serious imprecision (risk of bias; -1, imprecision; -2) (GRADE tables).
For SSI-attributable mortality, the level of evidence could not be assessed due to the absence of relevant studies.
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following (search) question:
What is the effect of sealants (in addition to standard surgical site skin preparation) vs. standard surgical site skin preparation for the prevention of SSI and SSI-attributable mortality in surgical patients.1
P: Inpatients and outpatients of any age undergoing surgical operations
(any type of procedure)
I: Sealant in addition to standard surgical site skin preparation
C: Standard surgical site skin preparation
O: SSI, SSI-attributable mortality
Relevant outcome measures2
The working group considered surgical site infections as a critical outcome and SSI-attributable mortality as an important outcome for decision making.
The working group defined a 25% relative difference (RR<0.8 or >1.25) in SSI rate and a 5% relative difference (RR<0.95 or >1.05) in SSI-attributable mortality as minimal clinically (patient) important difference.
Search and select (Methods)
The WHO searched the following databases: Medline (PubMed); Excerpta Medica Database (EMBASE); Cumulative Index to Nursing and Allied Health Literature (CINAHL); Cochrane Central Register of Controlled Trials (CENTRAL); and the WHO Global Health Library. The time limit for the review was between 1 January 1990 and 31 March 2015. Language was Page 2 of 22 restricted to English, French and Spanish. A comprehensive list of search terms was used, including Medical Subject Headings (MeSH). The detailed search strategy is available under the "Evidence tabellen" tab.
Two independent WHO-reviewers screened the titles and abstracts of retrieved references for potentially relevant studies. The full text of all potentially eligible articles was obtained and then reviewed independently by two WHO authors for eligibility based on inclusion criteria. Duplicate studies were excluded. Data were extracted in a predefined evidence table (Evidence tables) and retrieved studies were critically appraised. Quality was assessed using the Cochrane Collaboration tool (Higgins, 2011) to assess the risk of bias of randomized controlled studies (Risk of bias tables). Any disagreements were resolved through discussion or after consultation with the senior WHO-author, when necessary.
Meta-analyses of available comparisons were performed using Review Manager v5.3 as appropriate (Cochrane Collaboration, 2014) (Comparisons).
The WHO extracted and pooled adjusted odds ratios (OR) with 95% confidence intervals (CI) for each comparison with a random effects model. In addition to the WHO meta-analyses, relative risks (RR) and risk differences (RD) with 95% confidence intervals (CI) were extracted and pooled with a random effects model and added to the current literature analysis.
The WHO used the Grading of Recommendations Assessment, Development and Evaluation (GRADE) methodology (GRADE Pro software) (GRADE Working Group, 2015) to assess the quality of the body of retrieved evidence (GRADE tables).
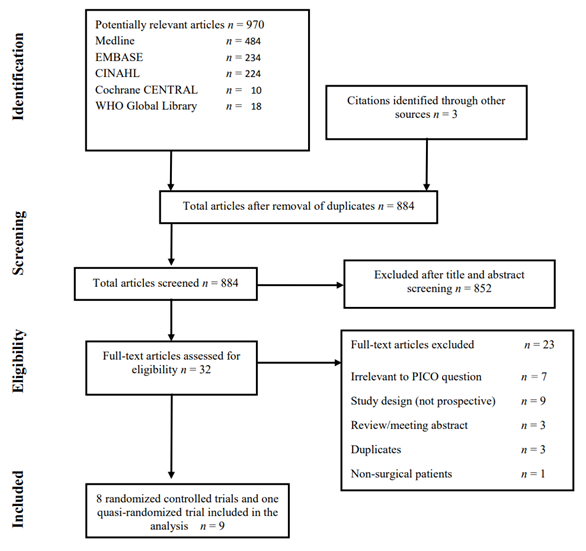
The WHO systematic literature search resulted in 884 (non-duplicate) hits. 32 studies were initially selected based on title and abstract screening; after reading the full text, 23 studies were excluded, and nine studies were included in the analysis (Study selection).
Results3
Nine studies were included in the analysis of the literature, eight RCTs and one prospective, quasi-randomized trial (Summary of literature). Important study characteristics and results are summarized in the evidence tables (Evidence tables). The assessment of the risk of bias is summarized in the risk of bias tables (Risk of bias tables).
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
1 The working group modified the WHO-search question by including all WHO-defined outcomes.
2 The WHO-guideline did not distinguish between crucial and important outcome measures and did not define thresholds for clinical decision making.
3 The WHO-guideline did not report risk ratios and risk differences.
Referenties
- Daeschlein G, Napp M, Assadian O, Bluhm J, Krueger C, von Poedwils S, et al. Influence of preoperative skin sealing with cyanoacrylate on microbial contamination of surgical wounds
following trauma surgery: a prospective, blinded, controlled observational study. Int J Infect Dis. 2014;29:274-8. - Doorly M, Choi J, Floyd A, Senagore A. Microbial sealants do not decrease surgical site infection for clean-contaminated colorectal procedures. Tech Coloproctol. 2015;19:281- 5.
- Dromzee E, Tribot-Laspiere Q, Bachy M, Zakine S, Mary P, Vialle R. Efficacy of integuseal for surgical skin preparation in children and adolescents undergoing scoliosis correction. Spine. 2012;37:E1331-5.
- Falk-Brynhildsen K, Soderquist B, Friberg O, Nilsson U. Bacterial growth and wound infection following saphenous vein harvesting in cardiac surgery: a randomized controlled trial of the impact of microbial skin sealant. Europ J Clin Microbiol Infect Dis. 2014;33:1981-7.
- GRADEpro Guideline Development Tool. Summary of findings tables, health technology assessment and guidelines. GRADE Working Group, Ontario: McMaster University and Evidence Prime Inc.; 2015 (http://www.gradepro.org, accessed 5 May 2016).
- Higgins JP, Altman DG, Gotzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
- Iyer A, Gilfillan I, Thakur S, Sharma S. Reduction of surgical site infection using a microbial sealant: a randomized trial. J Thorac Cardiovasc Surg. 2011;142:438-42.
- Lipp A, Phillips C, Harris P, Dowie I. Cyanoacrylate microbial sealants for skin preparation prior to surgery. Cochrane Database Syst Rev. 2013;(8):CD008062
- de Lissovoy G, Fraeman K, Hutchins V, Murphy D, Song D, Vaughn BB. Surgical site infection: incidence and impact on hospital utilization and treatment costs. Am J Infect Control. 2009;37:387-97. Page 22 of 22
- Mangram AJ, Horan TC, Pearson ML, Silver LC, Jarvis WR. Guideline for prevention of surgical site infection, 1999. Centers for Disease Control and Prevention (CDC) Hospital Infection
Control Practices Advisory Committee. Am J Infect Control. 1999;27:97- 132; quiz 3-4; discussion 96. - The Nordic Cochrane Centre TCC. Review Manager (RevMan). Version 5.3. Copenhagen: The Cochrane Collaboration; 2014.
- Roy P, Loubiere A, Vaillant T, Edouard B. [Serious adverse events after microbial sealant application in paediatric patients]. [Article in French] Ann Pharm Fr. 2014;72:409-14.
- Towfigh S, Cheadle WG, Lowry SF, Malangoni MA, Wilson SE. Significant reduction in incidence of wound contamination by skin flora through use of microbial sealant. Arch Surg. 2008;143:885-91; discussion 91.
- Vierhout BP, Ott A, Reijnen MM, Oskam J, Ott A, van den Dunggen JJ, et al. Cyanoacrylate skin microsealant for preventing surgical site infection after vascular surgery: a discontinued
randomized clinical trial. Surg Infect (Larchmt). 2014;15:425-30. - von Eckardstein AS, Lim CH, Dohmen PM, Pêgo-Fernandez PM, Cooper WA, Oslund SG, et al. A randomized trial of a skin sealant to reduce the risk of incision contamination in cardiac surgery. Ann Thorac Surg. 2011;92:632-7.
- Waldow T, Szlapka M, Hensel J, Plotze K, Matschke K, Jatzwauk L. Skin sealant InteguSeal® has no impact on prevention of postoperative mediastinitis after cardiac surgery. J Hosp Infect. 2012;81:278-82.
- World Health Organization. Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. (https://www.who.int/publications/i/item/global-guidelines-for-the-prevention-of-surgical-site-infection-2nd-ed/, accessed 12 June 2023). A
- World Health Organization. Global Guidelines for the Prevention of Surgical Site Infection. Geneva: World Health Organization; 2018. Web Appendix 9, Summary of a systematic review on antimicrobial skin sealants. (Summary of a systematic review on antimicrobial skin sealants - Global Guidelines for the Prevention of Surgical Site Infection - NCBI Bookshelf (nih.gov), accessed 13 June 2023).
Evidence tabellen
|
Author, year |
Design, scope, setting, population |
Objective |
SSI definition |
Type of surgery |
Study methods |
Intervention |
Results |
|
Daeschlein, 2014 |
Prospective, blinded RCT Germany
Population: 128 adults (male and female) receiving trauma surgery
Exclusion criteria: infected wounds, AIDS, HBV/HCV, known drug users |
To measure the number of bacteria at the base of the wound, along the wound margin, and on the wound sutures in patients undergoing surgery with and without the use of a cyanoacrylate-based adhesive sealant. |
Modified CDC definition, observed by the attending surgeon; not primary study measure.
Follow-up: 3 months postoperatively. |
Trauma surgery |
After assessing eligibility, patients were randomized by opening a sealed envelope, which contained pre-set computer generation number sequence.
Skin antisepsis was performed using a 70% propanol-based product for 1-3 minutes. The control group was covered with a sterile drape prior to incision. The intervention group received an application of cyanoacrylate sealant (InteguSeal®) after antisepsis, but before draping.
Follow-up: 3 months. Three intraoperative swabs were taken from each surgical site and incubated for colony-forming unit data. |
Group 1: no sealant Group 2: cyanoacrylate sealant |
SSI: Group 1: 0/66 Group 2: 0/62 OR: NA CI: NA
This study was financed through the routine research grant of the Institute for Hygiene and Environmental Medicine.
The authors have no competing interests to report. |
|
Doorly, 2015 |
Prospective, randomized trial
Single institution, multicentre; USA
Population: patients undergoing clean contaminated colorectal procedures
Exclusion: less than 18 years, pregnancy, history of hypersensitivity to cyanoacrylate formaldehyde-acetone, emergent surgery, laparotomy within 60 days (or planned), sepsis, neutropenia, previous abdominal wound infection, serum creatinine > 3mg/dL, chemotherapy/radiation within 30 days, steroid use, HIV |
To assess the role of a skin antimicrobial sealant for reducing the rate of superficial and deep wound SSI in a blended case mix of open and laparoscopic cleancontaminated procedures. |
CDC criteria |
Clean contaminated colorectal procedures |
Consenting patients were blinded to allocation; randomization occurred via sealed envelopes containing either “InteguSeal®” or “Control”.
Enrolled patients received the same mechanical bowel preparation and prophylactic antibiotics. Abdomen was prepped with hair removal by clippers and ChloraPrep® (chlorhexidine gluconate 2%, isopropyl alcohol 70%; CareFusion, San Diego, CA, USA) prior to sealant application (in the intervention group). SCIP and a standardized enhanced recovery protocol implemented for all.
Follow-up at 4 weeks. |
I: cyanoacrylate sealant
C: no sealant
The sealant was provided by the InteguSeal® manufacturer. |
SSI: I: 7/50 C: 5/50 P=0.545 |
|
Dromzee, 2012 |
Prospective randomized trial
June 2010 – June 2011; paediatric orthopaedic unit, France
Population: children and adolescents undergoing scoliosis correction
Exclusion criteria: previous spinal surgery and surgery indicated for anterior or combined procedures. |
To explore the use of a antimicrobial sealant applied before the surgical incision to reduce SSI in patients with scoliosis. |
Not specified |
Spine |
Randomization by random number table; impossible to blind surgical attendants.
All patients showered with povidone-iodine the day before and the morning of surgery. Skin was cleaned and prepared in the operating room with 2 consecutive applications of one-step alcohol povidone-iodine 5% solution. Patients were draped either after skin preparation (control) or after the sealant dried (intervention). |
Group 1: drape only after skin preparation (n=28)
Group 2: drape after sterile, film-forming cyanoacrylate liquid application (InteguSeal®; n=28) |
SSI: Group 1: 1/28 Group 2: 5/28 P=0.096
“No benefits in any form have been or will be received from a commercial party related directly or indirectly to the subject of this manuscript.” |
|
Falk-Brynhildsen 2014 |
RCT May 2010-October 2011; Sweden
Population: patients scheduled for elective CABG, with the saphenous vein used for at least two CABG with or without another concomitant cardiac procedure.
Exclusion: emergency operation, previous cardiac surgery, longterm corticosteroid treatment and/or antibiotic treatment within 14 days preoperatively skin disease, infection, or preoperative use of an intra-aortic balloon pump. |
To compare the use of microbial skin sealant vs. bare skin at the saphenous vein harvesting site in patients undergoing CABG with regard to bacterial growth on the skin and in the surgical wound, including the postoperative wound infection rate. |
Primary endpoint was bacterial growth on the wound-adjacent skin or from the subcutaneous wound tissue. Secondary endpoint – SSI: defined as wound complications requiring physician-prescribed antibiotic treatment (telephone call via dedicated nurse)
Follow-up: 2 months |
Coronary artery bypass graft with saphenous vein harvesting site |
Patients were randomized via computer-generated block randomization by an external statistician allocated to two groups: bare skin (control) or microbial skin sealant (intervention). After preoperative disinfection with chlorhexidine 0.5% in ethanol 70%, or nurseapplied microbial skin sealant (InteguSeal®) on the saphenous vein harvest site (in intervention group) prior to incision. |
Sealant group: cyanoacrylate sealant
Control: no sealant |
SSI: I: 7/61 C: 14/64 P=0.120
Kimberly Clark Health Care supported the investigators by providing InteguSeal® to be studied in an elective cardiac surgery population. Kimberly Clark provided no financial support to any author. |
|
Iyer, 2011 |
Prospective RCT 2008; New Zealand
Population: patients undergoing CABG |
To report the effect of pretreatment with an n-butyl cyanoacrylate-based microbial skin sealant in a population undergoing cardiac surgery and discuss its potential use in decreasing infections in other kinds of surgical procedures. |
Southampton score divides wounds into 5 grades: 0=normal healing; 1= normal with bruising or erythema; 2=erythema with other signs of inflammation; 3=haemoserous discharge; 4=purulent discharge; 5=deep or severe infection with or without tissue breakdown. |
CABG |
Hair removal was performed using an electric clipper the day before surgery. Patients washed with soap on the morning of surgery and the skin was disinfected with an alcohol-based povidone-iodine solution and left to dry for 3 minutes before a one-layer application of antimicrobial sealant, which was applied on the intervention leg on a random basis. No sham application was applied on the other leg. Wounds were examined daily during postoperative stay. In the case of infection, swabs were taken; if no infection was present, a culture swab was applied to a segment of the incision before discharge.
Findings were recorded and 1-2 blinded assessors followed up at 4 weeks |
Group 1: Cyanoacrylate-based sealant (InteguSeal®)
Group 2: No sealant |
SSI: Group 1: 1/47 Group 2: 12/47 P=0.0011
“Authors have nothing to disclose with regard to commercial support.” |
|
Towfigh, 2008 |
Prospective randomized multicentre trial Six teaching hospitals; USA
Population: adult patients undergoing open inguinal hernia repair.
Exclusion criteria: sensitivity to cyanoacrylate, existence of infection or use of antibiotics, chemotherapy, diabetes with HbA > 7 within 90 days, pregnant, nursing, participation in other studies. |
To compare the safety and effectiveness of antimicrobial sealant in reducing the incidence of surgical incision bacterial contamination relative to surgical skin preparation alone |
Not specified |
Hernia repair |
Patients were randomized using a 1:1 allocation; each site was supplied with sealed envelopes and the schedule was blocked within the centre to ensure an even distribution. It was not possible to blind the surgeon to the assigned study group.
All patients underwent intraoperative microbial wound sampling at 2 stages during the operation; colony-forming units were quantified.
Follow-up at 2 and 4 weeks postoperatively for signs of infection. |
Group 1: cyanoacrylate sealant
Group 2: control |
SSI: Group 1: 0/68 Group 2: 3/80 OR: 0.45 95% CI: 0.238- 0.88 P=0.02
Funding given for InteguSeal® applicator, standardized microbial sampling supplies and facility reimbursement of study-related costs. |
|
Vierhout, 2014 |
Discontinued RCT
The Netherlands
Population: patients undergoing vascular reconstruction
Exclusion: thrombectomies through inguinal incision, patients under 18 years and those with a previous groin incision or vascular reconstruction done cranially to the site of incision. |
To investigate whether the use of cyanoacrylate skin sealant at the site of surgery could reduce the incidence of SSI in the groin after vascular procedures. |
Southampton wound asssessment scale greater than grade III, erythema plus inflammation and clear or serosanguinous discharge (G3) or pus (G4). |
Vascular reconstruction |
Randomization was completed in a 1:1 ratio by the drawing of a sealed envelope in the operating room 30 minutes before surgery by the surgeon. All patients received cefazolin (2 g intravenous) before incision. Hair removal by clipper done before disinfection with chlorhexidine (0.5% in 70% isopropyl alcohol) and draped with sterile disposable drapes. Intervention group patients received application of cyanoacrylate-based sealant (InteguSeal®) prior to draping and after skin preparation. |
Group 1: control Group 2: cyanoacrylate sealant |
SSI: Group 1: 2/22 Group 2: 1/25 P = NS |
|
Von Eckardstein, 2011 |
Randomized, controlled, parallelgroup, multi-centre, open-label clinical trial
April 2006 to February 2009; 5 centres in Asia, Europe, Latin America and the USA
Population: adult patients undergoing CABG
Exclusion criteria: complex procedures, sensitivity to cyanoacrylate, isopropyl alcohol or iodine; abnormal skin condition; antimicrobial impregnated incise drapes; chemotherapy, immunosuppressive therapy; steroid therapy; use of antibiotics for an active infection, HIV infection with CD4 count <350 mm3 ; therapeutic radiation or renal dialysis; morbid obesity (body mass index [BMI] > 37 kg/m2); neutropenia; intraaortic balloon pump or mechanical assist device in place preoperatively; and hospital stay greater than 14 days. |
To determine if the use of this skin sealant before CABG could reduce surgical wound contamination by skin microflora and decrease postprocedure infections |
CDC criteria |
Cardiac |
Randomization in a 1:1 ratio using a computer-generated randomization schedule balanced by randomly permuted blocks; allocations were concealed in a sealed envelope.
Surgical site was prepared with either povidone-iodine or iodine 0.7% in isopropyl alcohol. In the experimental group, sealant was applied after drying.
Microbial samples were tested for the total bacterial burden and all patients were monitored 30 days postoperatively for SSI. |
Group 1: cyanoacrylate sealant (InteguSeal®)
Group 2: control |
SSI: Group 1: 9/146 Group 2: 14/147 Risk reduction: 35.3%
This clinical study was initiated and funded by the Kimberly Clark Corporation. |
|
Waldow, 2012 |
Single-centre quasi-randomized prospective trial
October 2010-April 2011; Germany
Population: 998 consecutive adult patients undergoing elective cardiac surgical procedures with median sternotomy |
To evaluate the prophylactic effect of a cyanoacrylatebased antimicrobial skin sealant on the incidence of postoperative mediastinitis or any other form of chest skin incision SSI after elective cardiac surgery. |
CDC criteria |
Elective cardiac |
Hair removal by hair clipping and the application of an antiseptic alcohol-based (chlorhexidine-free) solution on the skin surface prior to incision. All measures were performed according to written internal hygienic and perioperative standards valid in the institution.
Group assigned to receive a cyanoacrylate-based antimicrobial skin sealant (InteguSeal®) as a drape accessory.
All patients were prospectively subdivided into two registries by alternating administration of the antimicrobial sealant every second day of surgery regardless of the operation schedule.
SSI follow-up: 30 days |
Group 1: cyanoacrylate-based sealant included with standard pre-operative disinfection
Group 2: standard preoperative preparation |
SSI: Group 1: 53/488 Group 2: 57/495 P = NS
The work was supported by Kimberly-Clark Health Care, which provided investigators with the original InteguSeal® product to be studied in an elective cardiac surgery population. Kimberly-Clark did not provide any financial support to any author of this publication. |
SSI: surgical site infection; CDC: Centers for Disease Control and Prevention; HIV: human immunodeficiency virus; I: intervention; C: control; AIDS: acquired immunodeficiency syndrome; HBV/HCV: hepatitis B virus/hepatitis C virus; NA: not applicable; RCT: randomized controlled trial; CABG: coronary artery bypass graft; OR: odds ratio; CI: confidence interval; SCIP: surgical care improvement project; NS: not significant.
Risk of bias tables
Studies related to antimicrobial sealants
Risk of bias in randomized controlled trials (Cochrane Collaboration tool)
|
Author, year |
Sequence generation |
Allocation concealment |
Participants and personnel blinded |
Outcome assessors blinded |
Incomplete outcome data |
Selective outcome reporting |
Other sources of bias |
|
Daeschlein, 2014 |
Unclear |
Unclear |
Low |
Low |
Unclear |
Unclear |
Unclear |
|
Doorly, 2015 |
Low |
Low |
Unclear |
|
Unclear |
Unclear |
High* |
|
Dromzee, 2012 |
Low |
Low |
Low |
Unclear |
Low |
High |
Unclear |
|
Falk-Brynhildsen, 2014 |
Low |
Unclear |
Unclear |
Unclear |
Low |
Unclear |
High* |
|
Iyer, 2011 |
Unclear |
Unclear |
Low |
Low |
Low |
Low |
Low |
|
Towfigh, 2008 |
Low |
Low |
Low |
Low |
Unclear |
Low |
Unclear |
|
Vierhout, 2014 |
Low |
Low |
|
|
Unclear |
Unclear |
Low |
|
Von Eckardstein, 2011 |
Low |
Low |
Unclear |
Unclear |
Unclear |
Unclear |
High* |
|
Waldow, 2014** |
High |
High |
Unclear |
Unclear |
Low |
Low |
High* |
* Manufacturer of intervention provided product or funding for study
** Quasi-randomized prospective trial
Flow chart of the study selection
Comparisons
In addition to the odds ratios (OR) reported by the WHO, relative risks (RR) and risk differences (RD) with 95% confidence intervals (CI) were extracted and pooled with a random effects model and added to the current literature analysis.1
Comparison 1. Microbial cyanoacrylate sealant vs. standard surgical site preparation
Randomized controlled trials
Forest plot
Comparison 1. Microbial cyanoacrylate sealant vs. standard surgical site preparation
|
Outcome |
Quality assessment |
Number of patients |
Effect |
Quality |
||||||||
|
No of studies |
Study design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Microbial sealant |
Standard surgical site preparation |
Relative (95% CI) |
Absolute (95% CI) |
||
|
Surgical site infection (SSI) |
9 |
RCTs* |
Serious1 |
Not serious |
Not serious |
Very serious2 |
None |
83/975 (8.5%) |
108/999 (10.8%) |
OR: 0.69 (0.38- 1.25)
RR3: 0.73 (0.43-1.23) |
31 fewer per 1000 (from 23 more to 64 fewer) |
⨁◯◯◯ VERY LOW
|
|
SSI-attributable mortality |
0 |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
NA |
No GRADE |
* includes one quasi-randomized trial
1 Risk of performance bias, detection bias, attrition bias and reporting bias
2 Optimal information size not met and CI includes both appreciable benefit and harm
3 Supplementary to WHO-guideline
CI=confidence interval; OR=odds ratio; RCT=randomized controlled trial; RR=relative risk; NA=not applicable
Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
1 The WHO-guideline did not report relative risks and risk differences.
Search strategy
Medline (through PubMed)
(("tissue adhesives"[Mesh] OR "fibrin tissue adhesive"[Mesh] OR "acrylates"[Mesh] OR
“tissue adhesives” [TIAB] OR “tissue adhesive” [TIAB] OR (sealant*[TIAB] AND
(microbial*[TIAB] OR fibrin [TIAB] OR antimicrobial* [TIAB] OR skin [TIAB])) OR
Dermabond [TIAB] OR Integuseal [TIAB] OR acrylate* OR cyanoacrylate* OR
octylcyanoacrylate* OR butylcyanoacrylate* OR bucrylate* OR enbucrilate* OR (sealing
[TIAB] AND skin [TIAB]))) AND (("surgical wound infection"[Mesh] OR surgical site
infection* [TIAB] OR "SSI" OR "SSIs" OR surgical wound infection* [TIAB] OR surgical
infection*[TIAB] OR post-operative wound infection* [TIAB] OR postoperative wound
infection* [TIAB] OR wound infection*[TIAB]))
EMBASE
'fibrin tissue adhesive'/exp OR 'fibrin tissue adhesive' OR 'acrylates'/exp OR 'acrylates' OR
'tissue adhesives'/exp OR 'tissue adhesives' OR 'tissue adhesive'/exp OR 'tissue adhesive' OR
(sealant* AND (microbial* OR 'fibrin'/exp OR fibrin OR antimicrobial* OR 'skin'/exp OR
skin)) OR 'dermabond'/exp OR dermabond OR 'integuseal'/exp OR integuseal OR acrylate*
OR cyanoacrylate* OR octylcyanoacrylate* OR butylcyanoacrylate* OR bucrylate* OR
enbucrilate* OR (sealing AND ('skin'/exp OR skin)) AND ('surgical wound infection'/exp
OR 'surgical wound infection' OR surgical AND site AND infection* OR 'ssi' OR 'ssis' OR
surgical AND ('wound'/exp OR wound) AND infection* OR surgical AND infection* OR
'post operative' AND ('wound'/exp OR wound) AND infection* OR postoperative AND
('wound'/exp OR wound) AND infection* OR 'wound'/exp OR wound) AND infection* AND
[embase]/lim AND [1990-2015]/py
CINAHL
'fibrin tissue adhesive'/exp OR 'fibrin tissue adhesive' OR 'acrylates'/exp OR 'acrylates' OR
'tissue adhesives'/exp OR 'tissue adhesives' OR 'tissue adhesive'/exp OR 'tissue adhesive' OR
(sealant* AND (microbial* OR 'fibrin'/exp OR fibrin OR antimicrobial* OR 'skin'/exp OR
skin)) OR 'dermabond'/exp OR dermabond OR 'integuseal'/exp OR integuseal OR acrylate*
OR cyanoacrylate* OR octylcyanoacrylate* OR butylcyanoacrylate* OR bucrylate* OR
enbucrilate* OR (sealing AND ('skin'/exp OR skin)) AND ('surgical wound infection'/exp
OR 'surgical wound infection' OR surgical AND site AND infection* OR 'ssi' OR 'ssis' OR
surgical AND ('wound'/exp OR wound) AND infection* OR surgical AND infection* OR
'post operative' AND ('wound'/exp OR wound) AND infection* OR postoperative AND
('wound'/exp OR wound) AND infection* OR 'wound'/exp OR wound) AND infection*
Cochrane CENTRAL
(wound infection or surgical wound infection) AND skin antisepsis
WHO Global Health Library
Page 7 of 22
(ssi) OR (surgical site infection) OR (surgical site infections) OR (wound infection) OR
(wound infections) OR (postoperative wound infection) AND ("skin preparation" OR "skin
preparations" OR sealant)
ti: title; ab: abstract
1 Disclaimer: This is an adaptation of an original work “Global guidelines for the prevention of surgical site infection, second edition. Geneva: World Health Organization; 2018. License: CC BY-NC-SA 3.0 IGO.” (https://www.who.int/publications/i/item/9789241550475). This adaptation was not created by WHO. WHO is not responsible for the content or accuracy of this adaptation. The original edition shall be the binding and authentic edition.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-12-2024
Beoordeeld op geldigheid : 01-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS) en . De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules 2 tot 16 is in 2020 op initiatief van de NVvH een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor preventie van postoperatieve wondinfecties. Daarnaast is in 2022 op initiatief van het Samenwerkingsverband Richtlijnen Infectiepreventie (SRI) een separate multidisciplinaire werkgroep samengesteld voor de herziening van de WIP-richtlijn over postoperatieve wondinfecties: module 17-22. De ontwikkelde modules van beide werkgroepen zijn in deze richtlijn samengevoegd.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Werkgroep NVvH - Module 2-16
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. prof. dr. M.A. Boermeester |
Chirurg |
* Medisch Ethische Commissie, Amsterdam UMC, locatie AMC * Antibiotica Commissie, Amsterdam UMC |
Persoonlijke financiële belangen Hieronder staan de beroepsmatige relaties met bedrijfsleven vermeld waarbij eventuele financiële belangen via de AMC Research B.V. lopen, dus institutionele en geen persoonlijke gelden zijn: Skillslab instructeur en/of spreker (consultant) voor KCI/3M, Smith&Nephew, Johnson&Johnson, Gore, BD/Bard, TELABio, GDM, Medtronic, Molnlycke.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Institutionele grants van KCI/3M, Johnson&Johnson en New Compliance.
Intellectuele belangen en reputatie Ik maak me sterk voor een 100% evidence-based benadering van maken van aanbevelingen, volledig transparant en reproduceerbaar. Dat is mijn enige belang in deze, geen persoonlijk gewin.
Overige belangen Geen.
|
Extra kritische commentaarronde. |
|
Dhr. dr. M.J. van der Laan |
Vaatchirurg |
Vice voorzitter Consortium Kwaliteit van Zorg NFU, onbetaald
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen.
|
|
Dhr. dr. W.C. van der Zwet |
Arts-microbioloog |
Lid Regionaal Coördinatie Team, Limburgs infectiepreventie & ABR Zorgnetwerk (onbetaald) |
||
|
Dhr. dr. D.R. Buis |
Neurochirurg |
Lid Hoofdredactieraad Tijdschrift voor Neurologie & Neurochirurgie - onbetaald |
||
|
Dhr. dr. J.H.M. Goosen |
Orthopaedisch Chirurg |
Inhoudelijke presentaties voor Smith&Nephew en Zimmer Biomet. Deze worden vergoed per uur. |
||
|
Mw. drs. H. Jalalzadeh |
Arts-onderzoeker |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen.
|
|
Dhr. dr. N. Wolfhagen |
AIOS chirurgie |
|||
|
Mw. drs. H. Groenen |
Arts-onderzoeker |
|||
|
Dhr. dr. F.F.A. Ijpma |
Traumachirurg |
|||
|
Dhr. dr. P. Segers |
Cardiothoracaal chirurg |
|||
|
Mw. Y.E.M. Dreissen |
AIOS neurochirurgie |
|||
|
Dhr. R.R. Schaad |
Anesthesioloog |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt. Voor de modules 17-22 was de patiëntfederatie vertegenwoordigd in de werkgroep.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn.
Voor module 8 (Negatieve druktherapie) geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000 - 40.000 patiënten). Tevens volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
Voor de overige modules en aanbevelingen geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten). Tevens volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Ook wordt geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners verwacht of een wijziging in het opleidingsniveau van zorgpersoneel. Er worden daarom geen substantiële financiële gevolgen verwacht.
Methode ontwikkeling
Evidence based
Implementatie
Zie voor de implementatie het implementatieplan in het tabblad 'Bijlagen'.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroepen de knelpunten in de zorg voor patiënten die chirurgie ondergaan. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. De verslagen hiervan zijn opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Adaptatie
Een aantal modules van deze richtlijn betreft een adaptatie van modules van de World Health Organization (WHO)-richtlijn ‘Global guidelines for the prevention of surgical site infection’ (WHO, 2018), te weten:
- Module Normothermie
- Module Immunosuppressive middelen
- Module Glykemische controle
- Module Antimicrobiële afdichtingsmiddelen
- Module Wondbeschermers bij laparotomie
- Module Preoperatief douchen
- Module Preoperatief verwijderen van haar
- Module Chirurgische handschoenen: Vervangen en type handschoenen
- Module Afdekmaterialen en operatiejassen
Methode
- Uitgangsvragen zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- De inleiding van iedere module betreft een korte uiteenzetting van het knelpunt, waarbij eventuele onduidelijkheid en praktijkvariatie voor de Nederlandse setting wordt beschreven.
- Het literatuuronderzoek is overgenomen uit de WHO-richtlijn. Afhankelijk van de beoordeling van de actualiteit van de richtlijn is een update van het literatuuronderzoek uitgevoerd.
- De samenvatting van de literatuur is overgenomen van de WHO-richtlijn, waarbij door de werkgroep onderscheid is gemaakt tussen ‘cruciale’ en ‘belangrijke’ uitkomsten. Daarnaast zijn door de werkgroep grenzen voor klinische besluitvorming gedefinieerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten, en is de interpretatie van de bevindingen primair gebaseerd op klinische relevantie van het gevonden effect, niet op statistische significantie. In de meta-analyses zijn naast odds-ratio’s ook relatief risico’s en risicoverschillen gerapporteerd.
- De beoordeling van de mate van bewijskracht is overgnomen van de WHO-richtlijn, waarbij de beoordeling is gecontroleerd op consistentie met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten (GRADE-methode; http://www.gradeworkinggroup.org/). Eventueel door de WHO gerapporteerde bewijskracht voor observationele studies is niet overgenomen indien ook gerandomiseerde gecontroleerde studies beschikbaar waren.
- De conclusies van de literatuuranalyse zijn geformuleerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- In de overwegingen heeft de werkgroep voor iedere aanbeveling het bewijs waarop de aanbeveling is gebaseerd en de aanvaardbaarheid en toepasbaarheid van de aanbeveling voor de Nederlandse klinische praktijk beoordeeld. Op basis van deze beoordeling is door de werkgroep besloten welke aanbevelingen ongewijzigd zijn overgenomen, welke aanbevelingen niet zijn overgenomen, en welke aanbevelingen (mits in overeenstemming met het bewijs) zijn aangepast naar de Nederlandse context. ‘De novo’ aanbevelingen zijn gedaan in situaties waarin de werkgroep van mening was dat een aanbeveling nodig was, maar deze niet als zodanig in de WHO-richtlijn was opgenomen. Voor elke aanbeveling is vermeld hoe deze tot stand is gekomen, te weten: ‘WHO’, ‘aangepast van WHO’ of ‘de novo’.
Voor een verdere toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
World Health Organization. Global guidelines for the prevention of surgical site infection,
second edition. Geneva: World Health Organization; 2018. (https://www.who.int/publications/i/item/9789241550475, accessed 12 June 2023).
Zoekverantwoording
Zie voor de zoekstrategie het tabblad 'Evidence tabellen'.
