Opheffen van spierverslapping
Uitgangsvraag
Wat is de aanbevolen strategie om de kans op postoperatieve pulmonale complicaties te verminderen bij pulmonaal belaste patiënten met betrekking tot perioperatieve neuromusculaire blokkade?
Aanbeveling
Verricht een kwantitatieve meting van residuele verslapping na het gebruik van een niet-depolariserende spierverslapper vóór het moment van detubatie en antagoneer bij een TOF ratio <90%.
Indien zowel sugammadex als neostigmine geïndiceerd zijn als antagonist voor de spierverslapping, gaat de voorkeur uit naar sugammadex, vanwege een gunstiger bijwerkingenprofiel voor de pulmonaal belaste patiënt.
Overwegingen
Balans tussen gewenste en ongewenste effecten
Er is literatuuronderzoek gedaan naar de gunstige en ongunstige effecten van sugammadex vergeleken met neostigmine voor het opheffen van spierverslapping bij pulmonaal belaste patiënten die niet-pulmonale chirurgie ondergaan. Op basis van 12 publicaties lijkt sugammadex tot minder PPC’s (cruciale uitkomstmaat) te leiden dan neostigmine. De overall kwaliteit van bewijs is laag. Dit betekent dat we onzeker zijn over het gevonden geschatte effect van de cruciale uitkomstmaten. De belangrijke uitkomstmaten konden geen richting geven aan de besluitvorming. Er is afgewaardeerd vanwege methodologische beperkingen en onnauwkeurigheid, vanwege het zeer beperkte aantal events.
Op basis van de literatuur lijkt het dat de voorkeur uit zou moeten gaan naar het gebruik van sugammadex om het effect van de spierverslapping te antagoneren en PPC’s bij pulmonaal belaste patiënten te voorkomen. Het bewijs daarvoor is echter zwak.
De werkgroep is van mening dat het risico op postoperatieve pulmonale complicaties door het gebruik van spierverslappers relatief makkelijk te verlagen is. Ten eerste door alleen spierverslappers te gebruiken wanneer dat nodig is, dus bij een endotracheale intubatie of ter verbetering van de chirurgische werkomstandigheden (bijvoorbeeld beter zicht of exposure van het operatiegebied).
Daarnaast dient restverslapping te worden voorkomen door het meten van de mate van spierverslapping voordat een patiënt wordt gedetubeerd. In overeenstemming met de Europese richtlijn (Fuchs-Buder, 2023) dient hiervoor een kwantitatieve neuromusculaire meting te worden uitgevoerd op de musculus adductor pollicis om restverslapping uit te sluiten. Indien de TOF ratio <0,9 (of 90% van de uitgangswaarde) is, is de aanbeveling om een antagonist te gebruiken om de spierverslapping versneld te doen uitwerken. Wanneer aminosteroidale spierverslappers zijn gebruikt (zoals rocuronium of vecuronium) wordt hiertoe bij voorkeur sugammadex gebruikt, omdat de werkgroep van mening is dat dit middel veilig kan worden toegepast en de neveneffecten minder vervelend zijn voor de patiënt dan de neostigmine/glycopyronium combinatie.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten is het van belang PPC’s zoveel mogelijk te voorkomen. Hoewel sugammadex een gunstig bijwerkingenprofiel heeft en ernstige allergische reacties zeldzaam zijn, dient sugammadex alleen te worden gegeven wanneer het geïndiceerd is. Bovendien is de dosering van sugammadex afhankelijk van de mate van spierverslapping, hetgeen vereist dat het neuromusculaire block actief gemonitord wordt.
Kosten (middelenbeslag)
Het meten en eventueel antagoneren van restverslapping is een eenvoudige handeling vóór detubatie van een patiënt. De investeringskosten wegen op tegen de kosten van een verlengde opnameduur van een patiënt ten gevolge van een postoperatieve pulmonale complicatie. Zowel neostigmine als sugammadex kunnen alleen gebruikt worden om niet depolariserende spierverslappers te gebruiken. Voor sugammadex geldt bovendien dat het alleen aminosteroidale spierverslappers kan antagoneren, terwijl neostigmine ook niet aminosteroidale spierverslappers (d.w.z. benzylisoquinolines) kan antagoneren. Verder is de mate van spierverslapping van belang om de juiste dosering te bepalen; en toedienen van een antagonist zonder meting leidt tot een onnodige stijging van de medicatiekosten en mogelijke bijwerkingen of onvolledig herstel van het neuromusclaire block bij de patiënt.
De kosten voor neostigmine/atropine (of glycopyrolaat) zijn lager per patiënt dan een dosering sugammadex. Het bijwerkingenprofiel van sugammadex is echter gunstiger voor de patiënt.
Aanvaardbaarheid, haalbaarheid en implementatie
Het voorkomen van restverslapping na het gebruik van een spierverslapper kan eenvoudig worden gerealiseerd door een kwantitatieve meting van de neuromusculaire blokkade. Hiervoor dient een meting te worden uitgevoerd op de musculus adductor pollicis zoals beschreven in de recente Europese richtlijn (Fuchs-Buder, 2023). Wanneer deze meting correct wordt uitgevoerd, zijn de resultaten valide. Deze meting is helaas nog niet gangbaar in elke anesthesiologische praktijk in Nederland.
De kosten voor neostigmine/atropine of glycopyrolaat zijn lager per patiënt dan een dosering sugammadex. Er zou derhalve een voorkeur kunnen bestaan voor deze combinatie. Het bijwerkingenprofiel van sugammadex is echter gunstiger voor de patiënt met een preexistente pulmonale conditie. Echter, in het geval dat een benzylisoquinoline spierverslapper is gebruikt (zoals atracurium), zal neostigmine de aangewezen antagonist zijn.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de literatuur lijkt het dat de voorkeur uit zou moeten gaan naar het gebruik van sugammadex om het effect van spierverslapping door aminosteroidale spierverslappers te antagoneren en PPC’s bij pulmonaal belaste patiënten te voorkomen. Het bewijs daarvoor is echter zwak. De werkgroep is van mening dat pulmonale complicaties door het gebruik van spierverslappers relatief makkelijk zijn te voorkomen. Ten eerste door alleen spierverslappers te gebruiken wanneer dat nodig is, daarnaast dient restverslapping te worden voorkomen door het meten van de mate van spierverslapping voordat een patiënt wordt gedetubeerd. Indien er een aminosteroidale spierverslapper is gebruikt en de TOF ratio <0,9 is aan het einde van de ingreep, dan gaat de voorkeur uit naar sugammadex als antagonist, omdat er beperkte evidence is dat dit het risico op PPC’s verlaagt en sugammadex een gunstiger bijwerkingenprofiel heeft dan neostigmine/atropine of glycopyronium combinatie.
Onderbouwing
Achtergrond
Introduction
The use of muscle relaxants during general anesthesia is associated with an increased risk of postoperative pulmonary complications (PPCs). The majority of practice benefits can be achieved by preventing residual muscle paralysis. This can be prevented by measuring the degree of neuromuscular blockade using a validated quantitative method to determine the train-of-four (TOF)-ratio and ensuring its full recovery before removing the endotracheal tube. Unfortunately, this recommendation from the European guidelines (Fuchs-Buder, 2023) is not yet consistently followed.
To speed up the recovery of neuromuscular block, an antagonist can be administered. For aminosteroidal muscle relaxants, there are 2 antagonists available: acetylcholinesterase inhibitors (e.g. neostigmine) and sugammadex. Both agents have proven efficacy at shallow levels of neuromuscular block, however sugammadex is more efficient at deeper levels of neuromuscular block and lacks cholinergic side effecs that accompany neostigmine. Currently, it remains unclear whether neostigmine is less suitable for use in patients with a pulmonary precondition due to these side effects, which may precipitate bronchospasm or increased bronchial secretions, even when an anticholinergic agent such as atropine or glycopyrronium is administered simultaneously.
Conclusies / Summary of Findings
Samenvatting literatuur
Description of studies
One systematic review with a meta-analysis was included in the analysis of the literature. The systematic review (Bai, 2023) included 12 RCTs. Important study characteristics and results are summarized in table 1. The assessment of the risk of bias is summarized in the risk of bias tables (under the tab ‘Evidence tabellen’). For this systematic review potential clinical trials, without restricting the language or year of publication were searched from inception to November 28, 2022 on Pubmed, Scopus, Embase and Cochrane library. The following inclusion criteria were used for the search:
- Patients received aminosteroidal non-depolarizing NMB drugs for general anesthesia, meeting at least one criterion of the ARISCAT risk (50 years old, preoperative oxygen saturation of less than 96%, a history of respiratory infection in the month prior to surgery, preoperative anemia, upper abdominal or intrathoracic surgery, surgery lasting longer than 2 h, and emergency surgery.
- The intervention was defined as the application of sugammadex as the NMB reversal agent. Patients in the control group received neostigmine, regardless of the co-administrated anticholinergic agent. Both groups must follow the same neuromuscular relaxation strategy.
- The impact on postoperative complications (PPCs) of sugammadex was compared with that of neostigmine.
- Studies with an explicit statement that they assessed the occurrence of PPCs, whether as a composite outcome or as individual events.
- Only peer-reviewed RCTs for the authenticity of the data.
Table 1. Characteristics of included studies
*For further details, see risk of bias table in the appendix
Results
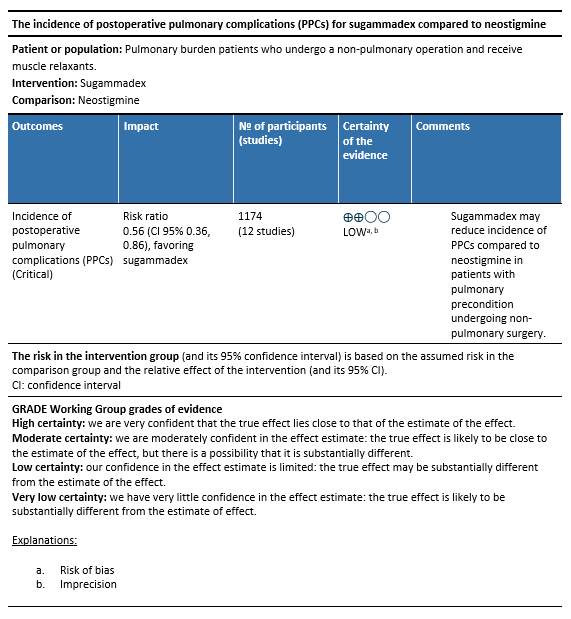
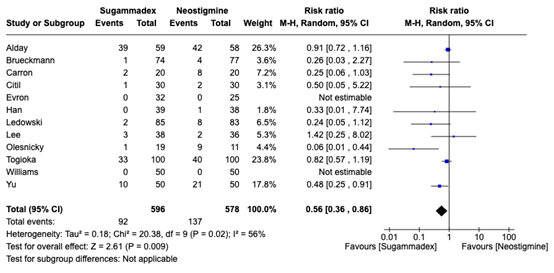
Incidence of postoperative pulmonary complications (critical outcome)
Figure 1.The incidence of postoperative pulmonary complications of sugammadex versus neostigmine
Important outcomes
Desaturation
Three studies reported desaturation. Due to the different definitions, the results could not be pooled.
Alday, 2019: Incidence of postoperative hypoxemia (SpO2 £92%), measured without oxygen after a spontaneous recruitment maneuver (spirometry) was 17 (27%) in the sugammadex group and 14 (21%) in the neostigmine group one hour after surgery. 24 hours after surgery, 10 (16%) patients in the sugammadex group and 1 patient (1%) in the neostigmine group had a SPO2 £92%.
Togioka, 2020: The incidence of desaturation/hypoxemia measured as re-initiation of supplemental oxygen to a Sao2 <90% in the absence of hypoventilation after weaning from adult oxygen mask. There were 6 events in the sugammadex group and 7 events in the neostigmine group.
Olesnicky, 2022: The incidence of desaturation defined as SpO2 < 90% was one in both the sugammadex (5,3%) and neostigmine group (10%).
Adverse events
Five studies reported adverse events. The studies reported different events, and the systematic review did not report the total number of patients with adverse events. Therefore, the results could not be pooled.
Olesnicky, 2022: Postoperative nausea and vomiting (PONV) was reported in three patients in the sugammadex group (3/19) compared to one patient (1/10) in the neostigmine group, RR 1.6 (95% CI, 0.18–13.3).
Togioka, 2020: compared the incidence of adverse events between patients received sugammadex and those received neostigmine. The study population consisted of 100 patients in both groups. The incidence of bronchospasm was lower in the sugammadex group (1/100, 1%) compared to the neostigmine group (2/100, 2%), with an odds ratio of 0.49 (CI, 0.01-9.68). No patients in either group experienced a hypersensitivity reaction (0/100, 0%). The incidence of cough was 4 (4.0%) in the sugammadex group and 5 (5.1%) in the neostigmine group), with an odds ratio of 0.78 (CI 05%, 0.15-3.73). The incidence of headache 7 in both groups, with an odds ratio of 0.99 (CI 95%, 0.28-3.45). The incidence of nausea or vomiting was lower in the sugammadex group (14/100, 14%) compared to the neostigmine group (17/100, 17%), with an odds ratio of 0.78 (CI 95%, 0.33-1.82). The incidence of itching was lower in the sugammadex group (5/100, 5%) compared to the neostigmine group (8/100, 8%), with an odds ratio of 0.60 (95% confidence interval, 0.15-2.17). The incidence of foul, salty, or metallic taste was higher in the sugammadex group (19/100, 19%) compared to the neostigmine group (13/100, 13%), with an odds ratio of 1.55 (95% confidence interval, 0.68-3.66). PONV was reported in 14 patients (14%) in the sugammadex group compared to 17 patients (17%) in the neostigmine group, OR 0.78 (95% CI, 0.33-1.82).
Ledowski, 2021: A total of 85 patients in the sugammadex group and 83 patients in the neostigmine group were analyzed. PONV was reported in 10 patients (12%) in the sugammadex group compared to 12 patients (14%) in the neostigmine group, RR 0.81 (95% CI, 0.37-1.78). Tachycardia/bradycardia was reported in 7 patients (7%) in the sugammadex group and 13 patients (16%) in the neostigmine group.
Citil, 2019: A total of 30 patients in both groups were analyzed. PONV was reported in 1 patient (3%) in the sugammadex group compared to 3 patients (10%) in the neostigmine group, RR 0.33 (95% CI, 0.04-3.03). Sore throat was reported in 1 patient (3%) in the sugammadex group and in 1 patient (3%) in the neostigmine group. Shivering was also reported in 1 patient (3%) in the sugammadex group and in 1 patient (3%) in the neostigmine group. Coughing was reported in 2 patients (7%) in the neostigmine group and in 1 patient (3%) in the sugammadex group. Finally, bradycardia was reported in 1 patient (3%) in the sugammadex group, but none were reported in the neostigmine group.
Williams, 2020: A total of 100 patients were analyzed (50 in sugammadex group and 50 in the neostigmine group). Nausea was reported in 7 patients (14%) in the sugammadex group compared to 6 patients (12%) in the neostigmine group. Emesis (vomiting) was reported in 1 patient (2%) in the sugammadex group compared to 0 (0%) in the neostigmine group.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the benefits and harms of sugammadex compared to neostigmine in patients with a pulmonary precondition undergoing non-pulmonary surgery?
| P (Patients): | Patients with pulmonary precondition undergoing non-pulmonary surgery |
| I (Intervention): | Reversal of aminosteroidal neuromuscular block with sugammadex |
| C (Comparison): | Reversal of neuromuscular block with neostigmine |
| O (Outcomes): |
Incidences of postoperative complications (PPCs), exacerbation, reintubation, desaturation and adverse events |
Relevant outcome measures
The guideline panel considered postoperative pulmonary complications (PPCs) as a critical outcome measure for decision making; and exacerbation, reintubation, desaturation and adverse events as important outcome measures for decision making.
The guideline panel did not define the outcome measures listed above a priori, but followed the definitions used in the studies.
The guideline panel defined 25% as a minimal clinically (patient) important difference for dichotomous outcomes (RR≤0.8 or RR≥1.25).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 14th of May. The detailed search strategy is listed under the tab ‘Literature search strategy’. The systematic literature search resulted in 88 hits. Studies were selected based on the following criteria: randomized clinical trials comparing the use of sugammadex versus neostigmine to antagonize neuromuscular block in patients undergoing surgery, reporting postoperative pulmonary complications. Eleven studies were initially selected based on title and abstract screening. After reading the full text, ten studies were excluded (see the exclusion table under the tab ‘Evidence tabellen’), and one meta-analysis was included.
Referenties
- Bai YX, Han JJ, Liu J, Li X, Xu ZZ, Lv Y, Liu KX, Wu QP. Sugammadex Reduced the Incidence of Postoperative Pulmonary Complications in Susceptible Patients Identified by ARISCAT Risk Index: Systematic Review and Meta-analysis. Adv Ther. 2023 Sep;40(9):3784-3803. doi: 10.1007/s12325-023-02535-9. Epub 2023 Jun 23. PMID: 37351811.
- Fuchs-Buder T, Romero CS, Lewald H, Lamperti M, Afshari A, Hristovska AM, Schmartz D, Hinkelbein J, Longrois D, Popp M, de Boer HD, Sorbello M, Jankovic R, Kranke P. Peri-operative management of neuromuscular blockade: A guideline from the European Society of Anaesthesiology and Intensive Care. Eur J Anaesthesiol. 2023 Feb 1;40(2):82-94. doi: 10.1097/EJA.0000000000001769. Epub 2022 Nov 15. PMID: 36377554.
Evidence tabellen
Risk of Bias tables
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Yu, 2022 |
Definitely yes
Reason: computer generated randomized allocation sequence (1:1 ratio)
|
Definitely yes
Reason: sealed opaque envelopes |
Definitely yes
Reason: study personnel were blinded |
Definitely no
Reason: no loss to follow up |
Definitely no
Reason: all relevant outcomes were reported |
Definitely yes
Reason: No other problems noted |
LOW |
|
Williams, 2020 |
Definitely yes
Reason: Randomization at a 1:1 ratio occurred the morning of surgery using the Research Electronic Data Capture software randomization tool |
Definitely no
Reason: no allocation procedure. |
Definitely yes
Reason: Anaesthesiologist was not blinded to treatment allocation. Clinical research coordinators obtaining data outcome were blinded to assigned treatment group. Subjects, surgeons, and nurses were blinded.
|
Definitely no
Reason: Loss-to follow was infrequent in the intervention group.
|
Definitely yes
Reason: All relevant outcomes are reported. |
Definitely no
Reason: Funded by Merck Sharp & Dohme Corp., USA. |
HIGH |
|
Togioka, 2020
|
Definitely yes
Reason: computer-generated random allocation sequency (1:1 assignment ratio).
|
Definitely yes
Reason: opaque envelopes |
Probably no
Reason: open-label, assessor-blinded. |
Definitely no
Reason: no lost to follow-up |
Definitely yes
Reason: all relevant outcomes are reported. |
Probably no
Reason: Reason: Funded by Merck Sharp & Dohme Corp., USA. |
SOME concerns |
|
Lee, 2020
|
Definitely yes
Reason: / |
Definitely yes
Reason: / |
Definitely no
Reason: / |
Definitely yes
Reason: / |
Definitely yes
Reason: / |
Definitely no
Reason: / |
Some concerns
|
|
Ledowski, 2021
|
Definitely yes
Reason: web-based commercial randomization service (RANDOMIZE.NET) using permuted blocks.
|
probably yes
Reason: some forms of blinding |
Definitely yes
Reason: Investigators were blinded. |
Definitely no
Reason: loss to follow-up was higher in the intervention group. |
Definitely yes
Reason: all relevant outcomes were reported. |
Probably no
Reason: Investigators received honoraria and travel from manufacturer of sugammadex. No conflicts related to planning, conduct, analysis or publication.
|
Some concerns
|
|
Han, 2021 |
Definitely yes
Reason: web-based randomization code
|
Definitely yes
Reason: concealed envelope
|
Definitely yes
Reason: All stakeholders involved were blinded.
|
Probably yes
Reason: Lost-to-follow up was infrequent in the intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported. |
Definitely no
Reason: Research was funded by Seoul National University Bundang Hospital Research Fund
|
LOW |
|
Olesnicky, 2022 |
Definitely yes
Reason: computer- based randomization
|
Definitely yes
Reason: sealed opaque envelope |
Definitely yes
Reason: patient, treating anaesthetist, all care providers, and research personnel assessing patient outcomes were all blinded. |
Definitely no
Reason: Lost-to-follow was frequent in both intervention and control group.
|
Definitely yes
Reason: All relevant outcomes are reported.
|
Definitely yes
Reason: no conflict present |
Low |
|
Evron, 2017 |
Definitely yes
Reason: Computer-generated randomization
|
Definitely no
Reason: No information provided |
Definitely no
Reason: No information provided |
Definitely no
Reason: No difference in lost-to-follow up. |
Probably yes Reason: All relevant outcomes are reported. |
Definitely yes
Reason: No conflict present |
Some concerns |
|
Citil, 2019 |
Definitely yes
Reason: Computer-generated randomization
|
Definitely no
Reason: no information provided |
Definitely no
Reason: no information provided |
Definitely no
Reason: no difference in lost-to-follow up. |
Definitely yes
Reason: all relevant outcomes are reported |
Definitely no
Reason: no conflict present |
Some concerns |
|
Carron, 2013
|
Definitely yes
Reason: Computer-generated randomization
|
Definitely yes
Reason: sealed opaque envelopes |
Definitely no
Reason: No information reported.
|
Definitely yes
Reason: Lost-to-follow was frequent in both intervention and control group. |
Definitely yes
Reason: All relevant outcomes are reported
|
Probably no
Reason: authors received payments from MSD; Johnson & Johnson Medical. |
Some concerns |
|
Brueckmann, 2015 |
Definitely no
Reason: No information provided |
Definitely no
Reason: Not reported. |
Definitely no
Reason: Not reported. |
Definitely yes
Reason: Lost-to-follow up higher in control group compared to intervention group. |
Probably yes
Reason: All relevant outcomes were reported. |
Probably no
Reason: Author received funds. |
HIGH |
|
Alday, 2019 |
Definitely yes
Reason: unrestricted blocked randomization with program M.A.S |
Definitely no
Reason: not reported |
Definitely no
Reason: not reported |
Probably yes
Reason: lost to follow-up infrequent in intervention and control groups. |
Definitely no
Reason: all relevant outcomes were reported |
Probably yes
Reason: Sponsored but not monitored by Merck Investigator Studies Program (MISP). |
HIGH |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Fuchs-Buder T, Romero CS, Lewald H, Lamperti M, Afshari A, Hristovska AM, Schmartz D, Hinkelbein J, Longrois D, Popp M, de Boer HD, Sorbello M, Jankovic R, Kranke P. Peri-operative management of neuromuscular blockade: A guideline from the European Society of Anaesthesiology and Intensive Care. Eur J Anaesthesiol. 2023 Feb 1;40(2):82-94. doi: 10.1097/EJA.0000000000001769. Epub 2022 Nov 15. PMID: 36377554. |
Wrong publication type |
|
Liu HM, Yu H, Zuo YD, Liang P. Postoperative pulmonary complications after sugammadex reversal of neuromuscular blockade: a systematic review and meta-analysis with trial sequential analysis. BMC Anesthesiol. 2023 Apr 20;23(1):130. doi: 10.1186/s12871-023-02094-0. PMID: 37081384; PMCID: PMC10116764. |
More complete meta-analysis used |
|
Olesnicky BL, Farrell C, Clare P, Wen S, Leslie K, Delaney A. The effect of sugammadex on patient morbidity and quality of recovery after general anaesthesia: a systematic review and meta-analysis. Br J Anaesth. 2024 Jan;132(1):107-115. doi: 10.1016/j.bja.2023.10.032. Epub 2023 Nov 29. PMID: 38036323. |
More complete meta-analysis used |
|
Ekinci O, Gulmez DD, Subasi FD, Ozgultekin A, Demiroluk O. Neostigmine versus sugammadex on post-operative recovery following bariatric surgery. North Clin Istanb. 2022 Aug 16;9(4):311-316. doi: 10.14744/nci.2021.94715. PMID: 36276569; PMCID: PMC9514077. |
Wrong population |
|
Hurford WE, Welge JA, Eckman MH. Sugammadex versus neostigmine for routine reversal of rocuronium block in adult patients: A cost analysis. J Clin Anesth. 2020 Dec;67:110027. doi: 10.1016/j.jclinane.2020.110027. Epub 2020 Sep 25. PMID: 32980763. |
Wrong study design |
|
Chen Y, Zhang YG, Yi J. [Evaluation of Postoperative Residual Curarisation after Administration of Neostigmine or Sugammadex by Diaphragmatic Ultrasonography:A Randomized Double-blind Controlled Trial]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2022 Jun;44(3):415-421. Chinese. doi: 10.3881/j.issn.1000-503X.14788. PMID: 35791938. |
Wrong language |
|
He J, He H, Li X, Sun M, Lai Z, Xu B. Required dose of sugammadex or neostigmine for reversal of vecuronium-induced shallow residual neuromuscular block at a train-of-four ratio of 0.3. Clin Transl Sci. 2022 Jan;15(1):234-243. doi: 10.1111/cts.13143. Epub 2021 Nov 2. PMID: 34435439; PMCID: PMC8742655. |
Wrong comparison |
|
Lan W, Tam KW, Chen JT, Cata JP, Cherng YG, Chou YY, Chien LN, Chang CL, Tai YH, Chu LM. Cost-Effectiveness of Sugammadex Versus Neostigmine to Reverse Neuromuscular Blockade in a University Hospital in Taiwan: A Propensity Score-Matched Analysis. Healthcare (Basel). 2023 Jan 12;11(2):240. doi: 10.3390/healthcare11020240. PMID: 36673608; PMCID: PMC9859243. |
Wrong study design |
|
Lu L, Chen X, Li S, Cen Y. Comparison of Effects of Sugammadex and Neostigmine on Postoperative Neuromuscular Blockade Recovery in Patients with Interstitial Lung Diseases Undergoing Transbronchial Cryobiopsy: A Randomized Trial. Med Sci Monit. 2024 May 1;30:e942773. doi: 10.12659/MSM.942773. PMID: 38689479; PMCID: PMC11071690. |
Wrong population |
|
Shehab HA, Mostafa IE, Salman SA. Deep neuromuscular blocking and sugammadex reversing-drug is an efficient strategy permitting successful laparoscopic surgery under low insufflation pressure: Prospective multicenter study. Egyptian Journal of Anaesthesia. 2023 Dec 31;39(1):883-93. |
Wrong publication type |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 29-09-2025
Beoordeeld op geldigheid : 09-07-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met een hoog risico op pulmonale complicaties die een niet-pulmonale ingreep ondergaan.
Werkgroep
Drs. R.P. (Peter) Meijer (voorzitter), anesthesioloog, NVA
Dr. J.P. (Jop) van den Berg, anesthesioloog, NVA
Dr. S.N.T. (Sabrine) Hemmes, anesthesioloog, NVA
Dr. M. (Marije) Marsman, anesthesioloog, NVA
Drs. M.W. (Mart) Groot, anesthesioloog-intensivist, NVIC
Drs. M. (Marjolein) van Laren, longarts, NVALT
Klankbordgroep
Dr. M. (Martijn) Boon, anesthesioloog, NVA
Drs. J.L.A (Jurriën) Embrechts, KNO-arts, NVKNO
Dr. H.J. (Erik) Hulzebos, klinisch inspanningsfysioloog en (sport)fysiotherapeut, KNGF
Drs. Y.J. (Yvonne) Kappe, senior beleidsadviseur/ patiëntvertegenwoordiger, Longfonds
Met ondersteuning van
Drs. F. (Femke) Janssen, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, t/m mei 2023
Drs. A.E. (Amber) van der Meij, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, vanaf maart 2023
Dr. M.S. (Matthijs) Ruiter, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Romke Peter Meijer (voorzitter) |
Anesthesioloog, Amsterdam UMC adjunct medisch directeur, Amsterdam UMC tot 1-5-2019
|
Geen |
Geen |
Geen |
|
Johannes Pieter (Jop) van den Berg |
Anesthesioloog in het UMC Groningen, 0,9FTE, betaald. |
Medisch Manager Evenementenzorg, Rode Kruis, vrijwillig (inmiddels afgerond) Lid Medische Raad, Nederlandse Reanimatieraad, vrijwillig |
Uitsluitend de afdeling anesthesiologie ontving (soms) funding voor lopend onderzoek. Er zijn geen individuele financiële conflicten van belangen te vermelden. |
Geen |
|
Marjolein van Laren |
Longarts Dijklander Ziekenhuis Hoorn en Purmerend |
Geen |
Geen |
Geen |
|
Marije Marsman |
Anesthesioloog UMC Utrecht |
Geen |
Artikel gepubliceerd bij NTVG dat gaat over mate van implementatie van deze richtlijn in het UMC Utrecht. |
Geen |
|
Mart Wouter Groot |
Anesthesioloog-intensivist, Erasmus MC |
Geen |
Geen |
Geen |
|
Sabrine Nienke Tallechina Hemmes |
Anesthesioloog, Het Nederlands Kanker Instituut – Antoni van Leeuwenhoek Ziekenhuis, Afdeling Anesthesiologie. |
Geen |
Publicaties over postoperative pulmonale complicaties. Enkele gepubliceerde onderzoeken werden deels gefinancieerd door onderzoek-specifieke beurzen van de ESAIC. |
Geen |
|
Amber van der Meij |
Adviseur, Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen |
|
Matthijs Ruiter |
Senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen |
|
Klankbord-groeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Erik Hulzebos
|
Medisch Fysioloog en (sport)fysiotherapeut, UMC Utrecht |
Secretaris VHVL |
Extern gefinancierd onderzoek: Prinses Beatrix Spierfonds |
Geen |
|
Jurriën Embrechts |
Rhinologist / anterior skull base surgeon, Christchurch city hospital, (New Zealand).
|
Data scientist, Expertisecentrum Zorgalgoritmen |
Geen |
Geen |
|
Martijn Boon |
Anesthesioloog Leids Universitair Medisch Centrum |
Geen |
Extern gefinancierd onderzoek: 2. MSD: Invloed van diepe neuromusculaire blokkade op de incidentie van intraoperatieve adverse events, projectleider Ja |
Geen |
|
Yvonne Kappe (Longfonds) |
Senior Beleidsadviseur Longfonds |
Beleidsadviseur astmaVereniging Nederland en Davos |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland en Longfonds voor de knelpunteninventarisatie en deelname van Longfonds aan de klankbordgroep. De binnengekomen reacties tijdens op de knelpunteninventarisatie zijn besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voorgelegd aan Longfonds en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Opheffen van spierverslapping |
Geen substantiële financiële gevolgen |
De aanbevelingen zijn breed toepasbaar, maar de verwachting is dat de beperkte kosten voor toepassing opwegen tegen de kostenbesparing door reductie van de ziektelast. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase beoordeelde de werkgroep de aanbevelingen uit de eerdere richtlijn Perioperatieve pulmonale complicaties (NVA, 2012) op noodzaak tot revisie. Daarnaast inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een hoog risico op pulmonale complicaties die een niet-pulmonale ingreep ondergaan. Tevens zijn er knelpunten aangedragen door de NVA, NVKNO en NVKG via een schriftelijke knelpunteninventarisatie. Een overzicht hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpunteninventarisatie zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Database(s): Embase.com, Ovid/Medline |
Datum: 14 mei 2024 |
|
Periode: vanaf 28 mei 2022 (SR Bai et al., 2023, PMID 37351811) |
Talen: geen restrictie |
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR |
14 |
10 |
15 |
|
RCT |
65 |
32 |
73 |
|
Totaal |
79 |
42 |
88* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#1 |
'sugammadex'/exp OR 'sugammadex':ti,ab,kw OR 'bridion':ti,ab,kw |
3496 |
|
#2 |
'neostigmine'/exp OR 'neostigmin*':ti,ab,kw OR prostigmin*:ti,ab,kw OR 'cholinesterase inhibitor'/exp OR (((cholinesterase OR 'choline esterase') NEAR/3 (block* OR inhibit* OR anti)):ti,ab,kw) OR anticholinesterase:ti,ab,kw |
110052 |
|
#3 |
#1 AND #2 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) AND [28-05-2022]/sd |
181 |
|
#4 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
1027702 |
|
#5 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
4030089 |
|
#6 |
#3 AND #4 - SR |
14 |
|
#7 |
#3 AND #5 NOT #6 - RCT |
65 |
|
#8 |
#6 OR #7 |
79 |
Ovid/Medline
|
# |
Searches |
Results |
|
1 |
exp Sugammadex/ or 'sugammadex'.ti,ab,kf. or 'bridion'.ti,ab,kf. |
1659 |
|
2 |
exp Neostigmine/ or 'neostigmin*'.ti,ab,kf. or prostigmin*.ti,ab,kf. or Cholinesterase Inhibitors/ or ((cholinesterase or 'choline esterase') adj3 (block* or inhibit* or anti)).ti,ab,kf. or anticholinesterase.ti,ab,kf. |
33747 |
|
3 |
(1 and 2) not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
408 |
|
4 |
limit 3 to dt="20220528-20240514" |
93 |
|
5 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
745206 |
|
6 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2724047 |
|
7 |
4 and 5 - SR |
10 |
|
8 |
(4 and 6) not 7 - RCT |
32 |
|
9 |
7 or 8 |
42 |