Risicofactoren en klinische symptomen voor een early-onset neonatale infectie
Uitgangsvraag
- Wat zijn belangrijke maternale risicofactoren op een early-onset neonatale infectie?
- Welke klinische neonatale symptomen geven een verhoogd risico op een daadwerkelijke early-onset neonatale infectie?
Aanbeveling
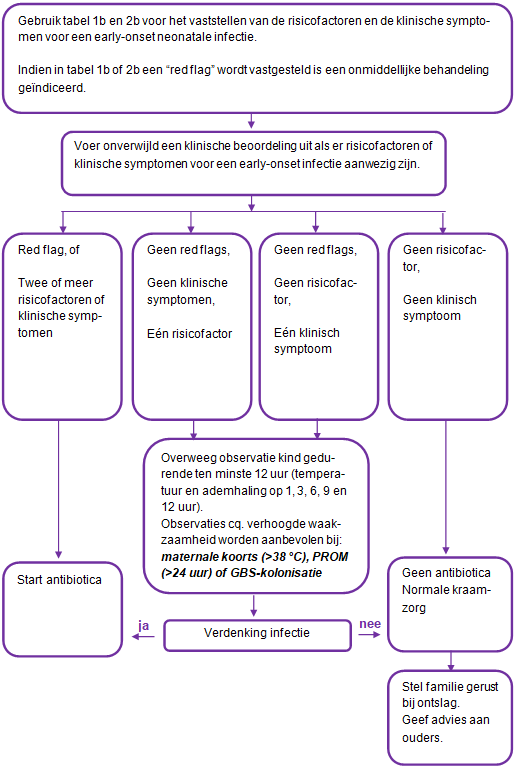
Tabel 1b en 2b worden gebruikt voor het vaststellen van "red flags" en "non-red flags" bij maternale risicofactoren en klinische neonatale symptomen. Het vaststellen van de "flags" wordt gebruikt bij de besluitvorming tot antibiotische behandeling bij de neonaat (schema 2):
- Voer bij neonaten met één “red flag” of met twee of meer “non-red flags” laboratoriumonderzoek uit (zie uitgangsvraag 7) en start met antibiotica. Wacht niet met het starten van antibiotica tot de laboratoriumuitslagen beschikbaar zijn (zie uitgangsvraag 8).
- Overweeg bij neonaten zonder “red flags” met slechts één risicofactor of klinische symptoom (“non-red flag”):
- of het veilig is om antibiotica te onthouden, en;
- of het noodzakelijk is om de vitale kenmerken (temperatuur en ademhaling) en de klinische conditie te observeren. Als observatie of verhoogde waakzaamheid vereist is, ga er dan ten minste 12 uur mee door (1, 3, 6, 9 en 12 uur). Er is geen indicatie voor monitorbewaking.
Tabel 1b: Maternale risicofactoren voor early-onset neonatale infectie (gemodificeerd)
|
Risicofactor |
Red flag |
|
Parenterale antibiotische behandeling van de moeder bij een klinisch beeld van sepsis tijdens de bevalling of binnen 24 uur voor of na de geboorte. |
O |
|
Verdenking of bewezen infectie bij een ander kind in het geval van een meerlingzwangerschap |
O |
|
Invasieve groep B streptokokken infectie bij een voorgaand kinda |
|
|
Maternale groep B streptokokken kolonisatie, bacteriurie of urineweginfectie in de huidige zwangerschapb |
|
|
> 24 uur spontaan gebroken vliezen zonder weeënactiviteit bij een à terme geboren kind |
|
|
Spontane premature geboorte (zwangerschapsduur <37 weken) |
|
|
>18 uur gebroken vliezen (verdenking op of bevestigd) bij een prematuur geboren kind |
|
|
Intrapartum koorts >38°C (ongeacht epidurale analgesie), of chorioamnionitis (verdenking of bewezen) |
|
a, b Deze risicofactoren (“non-red flags”) blijven ook bestaan na GBS-profylaxe, maar maken zonder bijkomende risicofactor geen antibiotische behandeling van de pasgeborene no- dig. Meestal voorkomt deze profylaxe GBS-kolonisatie van pasgeborenen. Desalniette- min is deze profylaxe geen toereikende behandeling voor een reeds aanwezige infectie.
Tabel 2b: Klinische symptomen bij een mogelijke early-onset neonatale infectie (gemodificeerd)
|
Klinische indicator |
Red flag |
|
Respiratoire distress die meer dan vier uur postpartum begint |
O |
|
Neonatale epileptische aanvallena |
O |
|
Noodzaak tot kunstmatige beademing bij een à terme geboren kindb |
O |
|
Tekenen van shockc |
O |
|
Gedragsverandering (stilletjes [weinig reactief], hypotonie) |
|
|
Voedingsproblemen (voedselweigering, maagretentie, braken, bolle buik)d |
|
|
Apnoea en bradycardieënd |
|
|
Tekenen van respiratoire distress (bv. tachypnoe, kreunen, intrekkingen en neusvleugelen)e |
|
|
Hypoxie (bijvoorbeeld centrale cyanose of verlaagde zuurstofsaturatie) |
|
|
Neonatale encefalopathie |
|
|
Noodzaak tot cardiopulmonale reanimatie |
|
|
Noodzaak tot kunstmatige beademing bij een prematuur geboren kinde |
|
|
Persisterende pulmonale hypertensie |
|
|
Koorts (>38°C) of ondertemperatuur (<36°C) die niet door de omgevingsfactoren kunnen worden verklaard |
|
|
Lokale tekenen van infectie (bijvoorbeeld op de huid of ogen) |
|
a Indien neonatale epileptische aanvallen een duidelijke oorzaak hebben zoals een aanleg- stoornis, asfyxie of een geboortetrauma hoeft dit symptoom niet als een indicator voor een verdenking infectie te worden beschouwd.
b Deze klinische indicator kan worden genegeerd als er een goede verklaring is voor de respiratoire insufficiëntie zoals een antenataal vastgestelde congenitale hypotonie (b.v. M. Steinert) of een hernia diafragmatica.
c Shock kan als indicator voor een infectie buiten beschouwing blijven als er sprake is van een verbloeding.
d Deze klinische indicator wordt pas een non-red flag als deze niet past bij de mate van prematuriteit. Een zorgvuldige afweging is hier noodzakelijk.
e Indien er sprake is van een partus middels een sectio caesarea zonder gebroken vliezen en koorts hoeft deze klinische indicator niet als een risico te worden beschouwd. Hier kan bijvoorbeeld sprake zijn van een strikt maternale indicatie danwel foetale nood bij een ernstige preeclampsie/HELPP.
Schema 2: Flowchart neonataal beleid ter preventie of behandeling van een early- onset neonatale infectie
Overwegingen
De risicofactoren en klinische indicatoren voor een early-onset neonatale infectie zijn in diverse publicaties, aanbevelingen en richtlijnen beschreven. Hoewel de aanbevelingen en richtlijnen nuances laten zien, zijn de geraadpleegde publicaties veelal afkomstig uit de periode voorafgaande aan de zgn. GBS-profylaxe. De bewijsvoering van een aantal items is relatief laag en een aantal zijn gebaseerd op een expert opinion.
In de NICE richtlijn was het een consensus van de werkgroep om het afkappunt voor een dusdanig verhoogd risico op infectie dat antibiotica gestart moeten worden bij 2 of meer risicofactoren en/of klinische symptomen te leggen. De werkgroep van deze richtlijn heeft dit besluit overgenomen. Desalniettemin is de tabel ten aanzien van de klinische indicatoren enigszins aangepast waarover hieronder meer.
Maternale risicofactoren:
Ten aanzien van de maternale risicofactoren voor een early-onset neonatale infectie zijn er een aantal belangrijke verschillen wanneer de aanbevelingen van de NICE richtlijn, American Academy of Pediatrics (AAP)/Center for Disease Control and Prevention (CDC) en de huidige richtlijn “Perinatale groep-B-streptokokken (GBS-) ziekte” (NVK/NVOG) met elkaar worden vergeleken.
Het spontaan breken van de vliezen voor de aanwezigheid van weeënactiviteit is reeds een risicofactor in de NICE richtlijn. Hiervoor wordt in de NICE richtlijn enige bewijsvoering getoond. Langdurig gebroken vliezen wordt in alle richtlijnen als een risicofactor beschouwd. Volgens de in december 2014 gereviseerde NICE richtlijn “Intrapartum Care (No 190)” wordt bij à terme neonaten geboren na langdurig gebroken vliezen (>24 uur) een verhoogde waakzaamheid en observatie van vitale parameter aanbevolen. Dit sluit goed aan bij de hedendaagse afspraken binnen de verloskundige praktijk. Immers, indien er sprake is van langdurig gebroken vliezen (>24 uur) worden zwangeren naar de 2de lijn verwezen.
Zowel in de NICE richtlijn als in de huidige richtlijn GBS-ziekte is een spontane premature geboorte bij zwangerschapsduur <37 weken een risicofactor. De NICE richtlijn adviseert dan tevens bij deze termijn een antibiotische behandeling van de neonaat als er sprake is van een bijkomende risicofactor of klinisch symptoom. De huidige richtlijn GBS-ziekte doet de aanbeveling tot een antibiotische behandeling van de neonaat pas bij een zwangerschapsduur <35 weken bij aangetoonde GBS-dragerschap of bij een onbekende GBS-dragerschap afhankelijk van de ernst van de risicofactoren.
Maternale koorts is in de NICE richtlijn slechts een risicofactor terwijl in de richtlijn GBS-ziekte, AAP/CDC onverwijld antibiotica bij de pasgeborene wordt geadviseerd. Verschillende richtlijnen rondom GBS-profylaxe hanteren bij maternale koorts een cutoff van 38ºC waarboven men besluit om de neonaat postpartum te behandelen. Dit geldt ook voor de huidige richtlijn GBS-ziekte maar hier wordt regelmatig van afgeweken. Aangezien koorts in de
NICE richtlijn thans slechts een risicofactor (een "non-red flag") is betekent dat dit aansluit bij de huidige klinische praktijk. Immers, koorts treedt ook regelmatig op bij epidurale analgesie (zie uitgangsvraag 3). Zonder bijkomende risicofactor en/of klinisch symptoom is er nu geen indicatie meer om een neonaat met antibiotica te behandelen.
Klinische neonatale symptomen:
De risicofactoren en klinische symptomen voor een verhoogd risico op of een verdenking early-onset neonatale infectie zoals weergegeven in de NICE richtlijn zijn enigszins aangepast. Een aantal symptomen in Tabel 2b zijn op basis van de expert opinion van de werkgroep samengevoegd. Dit geldt voor zowel voedingsproblemen en –intolerantie als gedragsverandering en verandering van de spiertonus. Icterus binnen 24 uur na de geboorte is niet meegenomen als risicofactor voor een early-onset infectie. Daarnaast worden een aantal symptomen in Tabel 2b pas risicofactoren als deze in het geheel niet passen bij de mate van prematuriteit zoals tijdens de commentaarronde is voorgesteld. Anders komen waarschijnlijk wel heel veel prematuren voor behandeling in aanmerking. De laboratoriumgegevens die als klinische indicator voor een mogelijke early-onset neonatale infectie in de NICE richtlijn worden genoemd, zijn door de werkgroep niet meegenomen in de adaptatie van de NICE richtlijn. Uiteindelijke zijn alleen de klinische symptomen van belang geworden.
Het predictieve model van Puopolo et al. waarmee een inschatting wordt gemaakt ten aanzien van het risico op een early-onset neonatale sepsis heeft duidelijke overeenkomsten met de maternale risicofactoren en klinische symptomen zoals weergegeven in de NICE richtlijn (Escobar, 2014; Puopolo, 2011). De risicoschatting wordt op basis van verschillende risicofactoren gemaakt (zwangerschapsduur, GBS-status van de zwangere, maternale koorts, duur gebroken vliezen). De kans op een daadwerkelijke infectie wordt daarnaast in belangrijke mate bepaald door de klinische presentatie van de patiënt.
Beleid:
Indien er risicofactoren of klinische symptomen (non-red flags) aanwezig zijn wordt in de NICE richtlijn voorgesteld om een observatie gedurende 12 uur te overwegen. Deze periode van observatie wordt in ieder geval door de werkgroep geadviseerd bij langdurig gebroken vliezen (>24 uur) en maternale koorts durante partu (>38.0°C). De duur van observatie is aanmerkelijk korter dan in de huidige richtlijn. Dit is gebaseerd op de studies van Escobar et al. en Lin et al. die hebben vastgesteld dat GBS-ziekte zich in 90% van de casus presenteert binnen 12 uur na de geboorte. Observaties worden globaal aanbevolen rondom de voedingsmomenten, te weten 0,1,3,6, 9 en 12 uur postpartum (Lin, 2001; Escobar, 2000).
Mogelijke gevolgen van perinatale antibiotica
De afgelopen jaren is er een sterk toenemende interesse voor het microbioom. De vaginale microbiota speelt ook een belangrijke rol in het ontstaan en de ontwikkeling van het microbioom van de pasgeborene. Het microbioom wordt beïnvloed door de antenatale en postnatale behandeling met antibiotica van respectievelijk de moeder en het kind en de wijze van partus. Er zijn associaties aangetoond tussen dit gebruik van antibiotica van respectievelijk de moeder en kind. Er is een verhoogde kans op het ontstaan van astma en adipositas (Saari, 2015; Metsala, 2015). Daarnaast wordt bij prematuren een verband gezien tussen prenatale en direct postnatale blootstelling aan antibiotica en het optreden van de necrotiserende entercolitis en late-onset sepsis (Kenyon, 2001; Kuppala, 2011).
Implementatie in de Nederlandse situatie:
Het belangrijkste doel betreffende deze module van de richtlijn neonatale early-onset sepsis is het bereiken van overeenstemming binnen alle beroepsgroepen. Daarnaast dient deze richtlijn aan te sluiten bij de Nederlandse richtlijnen Koorts in de tweede lijn bij kinderen van 0 - 16 jaar, Bacteriële meningitis en Urineweginfectie (UWI) bij kinderen.
Rondom deze richtlijn heeft ieder besluit zijn voor- en nadelen. Enerzijds willen wij geen kinderen ten onrechte met antibiotica behandelen en anderzijds willen wij geen kinderen met een early-onset neonatale infectie missen. Het is van het grootste belang dat deze richtlijn op zijn waarde wordt geëvalueerd.
In de groep à terme kinderen zullen mogelijk minder kinderen met antibiotica worden behandeld aangezien bij maternale koorts als enige risicofactor daar geen reden meer toe is. In de groep prematuren zullen waarschijnlijk meer kinderen voor antibiotica in aanmerking gaan komen. Daartegenover staat dat de duur van observatie bij een gering verhoogd risico op een early-onset neonatale infectie (één risicofactor of klinisch symptoom) wordt verkort naar 12 uur.
Onderbouwing
Achtergrond
Het doel van de eerste uitgangsvraag is het vaststellen van maternale risicofactoren voor een early-onset neonatale infectie. Maternale risicofactoren zijn factoren bij de moeder die een verhoogd risico op een early-onset infectie bij het kind geven. Deze factoren kunnen betrekking hebben op een eerdere zwangerschap (eerder kind met een early-onset GBS infectie) of factoren tijdens de intrapartum of postnatale periode van de huidige zwangerschap. Het doel van de tweede uitgangsvraag is om vast te stellen welke klinische symptomen en/of laboratoriumgegevens bij het kind de beste voorspellers zijn voor een early-onset neonatale infectie.
Er zijn enkele factoren die een duidelijk verhoogd risico op een early-onset infectie geven waardoor er al een indicatie bestaat om een behandeling met antibiotica te starten (“red flags”). Anderzijds kan dit ook gelden voor een combinatie van risicofactoren, symptomen en laboratoriumgegevens (“non-red flags”).
Samenvatting literatuur
Aanbevelingen NICE richtlijn
Herkennen van risicofactoren en klinische symptomen
- Tabel 1a wordt gebruikt om maternale risicofactoren voor early-onset neonatale infectie en tabel 2a om klinische indicatoren voor early-onset neonatale infectie te identificeren.
- Tabellen 1a en 2a worden gebruikt om “non-red flags” te identificeren. Dit zijn risicofactoren en klinische indicatoren waarbij waakzaamheid ten aanzien van early-onset neonatale infectie gewenst is.
Tabel 1a: Risicofactoren voor early-onset neonatale infectie (ongemodificeerd)
|
Risicofactor |
Red flag |
|
Invasieve groep B streptokokken infectie bij een voorgaand kind |
|
|
Maternale groep B streptokokken kolonisatie, bacteriëmie of infectie in de huidige zwangerschap |
|
|
Het spontaan breken van de vliezen zonder weeënactiviteit |
|
|
Spontane premature geboorte (zwangerschapsduur <37 weken) |
|
|
>18 uur gebroken vliezen (verdenking op of bevestigd) bij een prematuur geboren kind |
|
|
Intrapartum koorts >38°C, of chorioamnionitis (verdenking of bewezen) |
|
|
Parenterale behandeling met antibiotica van de moeder bij verdenking op of een bewezen invasieve bacteriële infectie (zoals sepsis) tijdens de bevalling of binnen 24 uur voor of na de geboorte. |
Ja |
|
Verdenking of bewezen infectie bij een ander kind in het geval van een meerlingzwangerschap |
Ja |
Tabel 2a: Klinische indicatoren bij een mogelijke early-onset neonatale infectie
(ongemodificeerd)
|
Klinische indicator |
Red flag |
|
Gedragsverandering |
|
|
Verandering spiertonus (bijvoorbeeld hypotonie) |
|
|
Voedingsproblemen (bijvoorbeeld voedselweigering) |
|
|
Voedselintolerantie, inclusief overgeven, maagretentie en een opgezette buik |
|
|
Abnormale hartfrequentie (bradycardie of tachycardie) |
|
|
Tekenen van respiratoire distress |
|
|
Respiratoire distress die meer dan vier uur postpartum begint |
Ja |
|
Hypoxie (bijvoorbeeld centrale cyanose of verlaagde zuurstofsaturatie) |
|
|
Icterus binnen 24 uur na de geboorte |
|
|
Apneu |
|
|
Neonatale encefalopathie |
|
|
Neonatale epileptische aanvallen |
Ja |
|
Noodzaak tot cardiopulmonale reanimatie |
|
|
Noodzaak tot kunstmatige beademing bij een prematuur geboren kind |
|
|
Noodzaak tot kunstmatige beademing bij een à terme geboren kind |
Ja |
|
Persisterende pulmonale hypertensie |
|
|
Koorts (>38°C) of ondertemperatuur (<36°C) die niet door de omgevingsfactoren kunnen worden verklaard |
|
|
Tekenen van shock |
Ja |
|
Verhoogde bloedingsneiging, trombocytopenie of verlengde stollingstijden (International Normalized Ratio [INR]>2) |
|
|
Persistende oligurie >24 uur postpartum |
|
|
Hypo- of hyperglycemie |
|
|
Metabole acidose (BE< -10 mmol/L) |
|
|
Lokale tekenen van infectie (bijvoorbeeld op de huid of ogen) |
|
Voor de geboorte
- Breng risicofactoren voor early-onset neonatale infectie bij barende vrouwen in kaart (tabel 1a). Monitor het optreden van nieuwe risicofactoren zoals intrapartum koorts >38 °C, of de ontwikkeling van chorioamnionitis gedurende de partus.
- Houd de aanbevelingen uit de NICE richtlijn “Intrapartum care” aan voor het breken van vliezen zonder weeënactiviteit (PROM) op de à terme leeftijd.
Na de geboorte
- Voer een snelle zorgvuldige klinische beoordeling uit als er sprake is van risicofactoren (tabel 1a) of klinische indicatoren (tabel 2a) voor early-onset neonatale infectie. Bekijk de maternale en neonatale geschiedenis en verricht een lichamelijk onderzoek bij de neonaat inclusief een beoordeling van de vitale functies.
- Gebruik tabel 1a en 2a, gebaseerd op risicofactoren en klinische indicatoren, inclusief “red flags”, om keuzes omtrent de behandeling met antibiotica te maken:
- Verricht bij neonaten met één “red flag” of met twee of meer “non-red flags” (zie tabel 1a en 2a) laboratoriumonderzoek (zie uitgangsvraag 7a en 7b) en start met antibiotica. Wacht niet met het starten van antibiotica tot de testresultaten beschikbaar zijn (zie uitgangsvraag 8).
- Overweeg bij neonaten zonder “red flags” met slechts één risicofactor of klinische indicator:
- of het veilig is om antibiotica te onthouden, en;
- of het noodzakelijk is om te vitale kenmerken en de klinische conditie te bewaken. Als bewaking vereist is, ga er dan ten minste 12 uur mee door (bij 0, 1 en 2 uren en elke 2 uur gedurende 10 uur).
- In het geval van neonaten die gemonitord worden in verband met een mogelijke infectie:
- Overweeg diagnostiek (zie uitgangsvraag 7a en 7b) en het starten van een behandeling met antibiotica (zie uitgangsvraag 8) als er redenen tot ongerustheid zijn.
- Als er geen verdere bijzonderheden zijn tijdens de observatieperiode, stel dan de familie gerust en geef advies aan ouders en zorgverleners als het kind wordt ontslagen (zie uitgangsvraag 1).
- Als een neonaat antibiotica nodig heeft, dient dit zo spoedig mogelijk te worden gegeven, maar altijd binnen één uur na het besluit om te behandelen.
- Behandel een verdenking op bacteriële meningitis in overeenstemming met de aanbevelingen in de NICE richtlijn “Bacterial meningitis and meningococcal septicaemia” tenzij het kind al behandeld wordt op de afdeling neonatologie.
- Behandel een verdenking op een urineweginfectie in overeenstemming met de aanbevelingen in de NICE richtlijn “Urinary tract infection in children”.
- Ga door met routinematige postnatale zorg (zie NICE richtlijn “Postnatal care”) bij neonaten zonder risicofactoren (zie tabel 1a) en zonder klinische indicatoren voor een mogelijke infectie (zie tabel 2a).
- Maternale kolonisatie met groep B streptokokken wordt soms pas postpartum bekend. Er wordt dan geadviseerd om de direct bij de zorg betrokken persoon (bijvoorbeeld een ouder, verzorg(st)er of zorgverlener) te informeren. De risicofactoren en klinische indicatoren voor een infectie dienen dan opnieuw te worden beschouwd. Deze evaluatie wordt gebruikt om eventueel alsnog te besluiten tot behandeling (zie tabel 1a en 2a).
Zoeken en selecteren
De NICE richtlijn is als uitgangspunt gebruikt. Daarnaast zijn de maternale risicofactoren en klinische neonatale indicatoren, zoals beschreven in de NICE richtlijn, op hun bewijsvoering en toepasbaarheid in de Nederlandse situatie geëvalueerd.
Referenties
- Agarwal G, Rastogi A, Pyati S, Wilks A, Pildes RS. Comparison of once-daily versus twice-daily gentamicin dosing regimens in infants > or = 2500 g. J Perinatol. 2002;22(4):268-74.
- AGREE Next Stepts Consortium. Appraisal of Guidelines for Research & Evaluation (AGREE) II Instrument. 2013.
- Ansong AK, Smith PB, Benjamin DK, Clark RH, Li JS, Cotten CM, et al. Group B streptococcal meningitis: cerebrospinal fluid parameters in the era of intrapartum antibiotic prophylaxis. Early Hum Dev. 2009;85(10 Suppl):S5-7.
- Auriti C, Rava L, Di Ciommo V, Ronchetti MP, Orzalesi M. Short antibiotic prophylaxis for bacterial infections in a neonatal intensive care unit: a randomized controlled trial. J Hosp Infect. 2005;59(4):292-8.
- Bekker V, Bijisma MW, van de Beek D, Kuijpers TW, van der Ende A. Incidence of invasive group B streptococcal disease and pathogen genotype distribution in newborn babies in the Netherlands over 25 years: a nationwide surveillance study. Lancet Infect Dis. 2014;14(11):1083-9.
- Biondi EA, Mischler M, Jerardi KE, Statile AM, French J, Evans R, et al. Blood culture time to positivity in febrile infants with bacteremia. JAMA Pediatr. 2014;168(9):844-9.
- Campbell D, Halpern S, Muir H, Breen T, Blanchard W. Maternal intrapartum fever and neonatal sepsis. Society for Obstetric Anesthesia and Perinatology 2009. p. 9905:A9.
- Chiesa C, Signore F, Assumma M, Buffone E, Tramontozzi P, Osborn JF, et al. Serial measurements of C-reactive protein and interleukin-6 in the immediate postnatal period: reference intervals and analysis of maternal and perinatal confounders. Clin Chem. 2001;47(6):1016-22.
- Colicchia LC, Lauderdale DS, Du H, Adams M, Hirsch E. Recurrence of group B streptococcus colonization in successive pregnancies. J Perinatol. 2015;35(3):173-6.
- Daniels J, Gray J, Pattison H, Roberts T, Edwards E, Milner P, et al. Rapid testing for group B streptococcus during labour: a test accuracy study with evaluation of acceptability and cost-effectiveness. Health Technol Assess. 2009;13(42):1-154, iii-iv.
- de Alba Romero C, Gomez Castillo E, Manzanares Secades C, Rodriguez Lopez J, Arreaza Lopez L, Saenz Valiente P. Once daily gentamicin dosing in neonates. Pediatr Infect Dis J. 1998;17(12):1169-71.
- de Hoog M, Mouton JW, Schoemaker RC, Verduin CM, van den Anker JN. Extended-interval dosing of tobramycin in neonates: implications for therapeutic drug monitoring. Clin Pharmacol Ther. 2002;71(5):349-58.
- de Hoog M, Schoemaker RC, Mouton JW, van den Anker JN. Tobramycin population pharmacokinetics in neonates. Clin Pharmacol Ther. 1997;62(4):392-9.
- Di Renzo GC, Melin P, Berardi A, Blennow M, Carbonell-Estrany X, Donzelli GP, et al. Intrapartum GBS screening and antibiotic prophylaxis: a European consensus conference. J Matern Fetal Neonatal Med. 2014:1-17.
- El Helali N, Giovangrandi Y, Guyot K, Chevet K, Gutmann L, Durand-Zaleski I. Cost and effectiveness of intrapartum group B streptococcus polymerase chain reaction screening for term deliveries. Obstet Gynecol. 2012;119(4):822-9.
- Engle WD, Jackson GL, Sendelbach D, Ford D, Olesen B, Burton KM, et al. Neonatal pneumonia: comparison of 4 vs 7 days of antibiotic therapy in term and near-term infants. J Perinatol. 2000;20(7):421-6.
- Engle WD, Jackson GL, Sendelbach DM, Stehel EK, Ford DM, McHugh KM, et al. Pneumonia in term neonates: laboratory studies and duration of antibiotic therapy. J Perinatol. 2003;23(5):372-7.
- Escobar GJ, Li DK, Armstrong MA, Gardner MN, Folck BF, Verdi JE, et al. Neonatal sepsis workups in infants >/=2000 grams at birth: A population-based study. Pediatrics. 2000;106(2 Pt 1):256-63.
- Escobar GJ, Puopolo KM, Wi S, Turk BJ, Kuzniewicz MW, Walsh EM, et al. Stratification of risk of early-onset sepsis in newborns >/= 34 weeks' gestation. Pediatrics. 2014;133(1):30-6.
- Garges HP, Moody MA, Cotten CM, Smith PB, Tiffany KF, Lenfestey R, et al. Neonatal meningitis: what is the correlation among cerebrospinal fluid cultures, blood cultures, and cerebrospinal fluid parameters? Pediatrics. 2006;117(4):1094-100.
- Gerard P, Verghote-D'Hulst M, Bachy A, Duhaut G. Group B streptococcal colonization of pregnant women and their neonates. Epidemiological study and controlled trial of prophylactic treatment of the newborn. Acta Paediatr Scand. 1979;68(6):819-23.
- Gonen R, Korobochka R, Degani S, Gaitini L. Association between epidural analgesia and intrapartum fever. Am J Perinatol. 2000;17(3):127-30.
- Guerti K, Devos H, Ieven MM, Mahieu LM. Time to positivity of neonatal blood cultures: fast and furious? J Med Microbiol. 2011;60(Pt 4):446-53.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336(7650):924-6.
- Haberland CA, Benitz WE, Sanders GD, Pietzsch JB, Yamada S, Nguyen L, et al. Perinatal screening for group B streptococci: cost-benefit analysis of rapid polymerase chain reaction. Pediatrics. 2002;110(3):471-80.
- Hammerberg O, Kurnitzki C, Watts J, Rosenbloom D. Randomized trial using piperacillin versus ampicillin and amikacin for treatment of premature neonates with risk factors for sepsis. Eur J Clin Microbiol Infect Dis. 1989;8(3):241-4.
- Hammerschlag MR, Chandler JW, Alexander ER, English M, Chiang WT, Koutsky L, et al. Erythromycin ointment for ocular prophylaxis of neonatal chlamydial infection. JAMA. 1980;244(20):2291-3.
- Hayani KC, Hatzopoulos FK, Frank AL, Thummala MR, Hantsch MJ, Schatz BM, et al. Pharmacokinetics of once-daily dosing of gentamicin in neonates. J Pediatr. 1997;131(1 Pt 1):76-80.
- Heath PT, Jardine LA. Neonatal infections: group B streptococcus. Clin Evid (Online). 2014;2014.
- Heesen M, Klor S, Rossaint R, Straube S, Van de Velde M. Labour epidural analgesia and anti-infectious management of the neonate: a meta-analysis. J Perinat Med. 2012.
- Isemann BT, Kotagal UR, Mashni SM, Luckhaupt EJ, Johnson CJ. Optimal gentamicin therapy in preterm neonates includes loading doses and early monitoring. Ther Drug Monit. 1996;18(5):549-55.
- Itsarayoungyuen S, Riff L, Schauf V, Hamilton L, Otrembiak J, Vidyasagar D. Tobramycin and gentamicin are equally safe for neonates: results of a double-blind randomized trial with quantitative assessment of renal function. Pediatr Pharmacol (New York). 1982;2(2):143-55.
- Jardine L, Davies MW, Faoagali J. Incubation time required for neonatal blood cultures to become positive. J Paediatr Child Health. 2006;42(12):797-802.
- Kaul B, Vallejo M, Ramanathan S, Mandell G. Epidural labor analgesia and neonatal sepsis evaluation rate: a quality improvement study. Anesth Analg. 2001;93(4):986-90.
- Kenyon SL, Taylor DJ, Tarnow-Mordi W, Group OC. Broad-spectrum antibiotics for preterm, prelabour rupture of fetal membranes: the ORACLE I randomised trial. ORACLE Collaborative Group. Lancet. 2001;357(9261):979-88.
- Kuppala VS, Meinzen-Derr J, Morrow AL, Schibler KR. Prolonged initial empirical antibiotic treatment is associated with adverse outcomes in premature infants. J Pediatr. 2011;159(5):720-5.
- Langhendries JP, Battisti O, Bertrand JM, Francois A, Darimont J, Ibrahim S, et al. Once-a-day administration of amikacin in neonates: assessment of nephrotoxicity and ototoxicity. Dev Pharmacol Ther. 1993;20(3-4):220-30.
- Lieberman E, Lang JM, Frigoletto F, Jr., Richardson DK, Ringer SA, Cohen A. Epidural analgesia, intrapartum fever, and neonatal sepsis evaluation. Pediatrics. 1997;99(3):415-9.
- Lin FY, Brenner RA, Johnson YR, Azimi PH, Philips JB, 3rd, Regan JA, et al. The effectiveness of risk-based intrapartum chemoprophylaxis for the prevention of early-onset neonatal group B streptococcal disease. Am J Obstet Gynecol. 2001;184(6):1204-10.
- Mercado MC, Brodsky NL, McGuire MK, Hurt H. Extended interval dosing of gentamicin in preterm infants. Am J Perinatol. 2004;21(2):73-7.
- Metsala J, Lundqvist A, Virta LJ, Kaila M, Gissler M, Virtanen SM. Prenatal and post-natal exposure to antibiotics and risk of asthma in childhood. Clin Exp Allergy. 2015;45(1):137-45.
- Metsvaht T, Ilmoja ML, Parm U, Maipuu L, Merila M, Lutsar I. Comparison of ampicillin plus gentamicin vs. penicillin plus gentamicin in empiric treatment of neonates at risk of early onset sepsis. Acta Paediatr. 2010;99(5):665-72.
- Metsvaht T, Ilmoja ML, Parm U, Merila M, Maipuu L, Muursepp P, et al. Ampicillin versus penicillin in the empiric therapy of extremely low-birthweight neonates at risk of early onset sepsis. Pediatr Int. 2011;53(6):873-80.
- Metsvaht T, Oselin K, Ilmoja ML, Anier K, Lutsar I. Pharmacokinetics of penicillin g in very-low-birth-weight neonates. Antimicrob Agents Chemother. 2007;51(6):1995-2000.
- Miall-Allen VM, Whitelaw AG, Darrell JH. Ticarcillin plus clavulanic acid (Timentin) compared with standard antibiotic regimes in the treatment of early and late neonatal infections. Br J Clin Pract. 1988;42(7):273-9.
- Mukherjee A, Ramalingaiah B, Kennea N, Duffy DA. Management of neonatal early onset sepsis (CG149): compliance of neonatal units in the UK with NICE recommendations. Arch Dis Child Fetal Neonatal Ed. 2015;100(2):F185.
- Muller AE, DeJongh J, Bult Y, Goessens WH, Mouton JW, Danhof M, et al. Pharmacokinetics of penicillin G in infants with a gestational age of less than 32 weeks. Antimicrob Agents Chemother. 2007;51(10):3720-5.
- Muller-Pebody B, Johnson AP, Heath PT, Gilbert RE, Henderson KL, Sharland M. Empirical treatment of neonatal sepsis: are the current guidelines adequate? Arch Dis Child Fetal Neonatal Ed. 2011;96(1):F4-8.
- National Collaborating Centre for Women's and Children's Health. Antibiotics for early-onset neonatal infection. Antibiotics for the prevention and treatment of early-onset neonatal infection. 2012.
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) en Nederlandse Vereniging voor Kindergeneeskunde (NVK). Richtlijn: perinatale groep-B-streptokokken (GBS-)ziekte. 2012.
- Parm U, Metsvaht T, Sepp E, Ilmoja ML, Pisarev H, Pauskar M, et al. Impact of empiric antibiotic regimen on bowel colonization in neonates with suspected early onset sepsis. Eur J Clin Microbiol Infect Dis. 2010;29(7):807-16.
- Patel DM, Rhodes PG, LeBlanc MH, Graves GR, Glick C, Morrison J. Role of postnatal penicillin prophylaxis in prevention of neonatal group B streptococcus infection. Acta Paediatr. 1999;88(8):874-9.
- Philip J, Alexander JM, Sharma SK, Leveno KJ, McIntire DD, Wiley J. Epidural analgesia during labor and maternal fever. Anesthesiology. 1999;90(5):1271-5.
- Puopolo KM, Draper D, Wi S, Newman TB, Zupancic J, Lieberman E, et al. Estimating the probability of neonatal early-onset infection on the basis of maternal risk factors. Pediatrics. 2011;128(5):e1155-63.
- Pyati SP, Pildes RS, Jacobs NM, Ramamurthy RS, Yeh TF, Raval DS, et al. Penicillin in infants weighing two kilograms or less with early-onset Group B streptococcal disease. N Engl J Med. 1983;308(23):1383-9.
- Rastogi A, Agarwal G, Pyati S, Pildes RS. Comparison of two gentamicin dosing schedules in very low birth weight infants. Pediatr Infect Dis J. 2002;21(3):234-40.
- Saari A, Virta LJ, Sankilampi U, Dunkel L, Saxen H. Antibiotic exposure in infancy and risk of being overweight in the first 24 months of life. Pediatrics. 2015;135(4):617-26.
- Schrag SJ, Verani JR. Intrapartum antibiotic prophylaxis for the prevention of perinatal group B streptococcal disease: experience in the United States and implications for a potential group B streptococcal vaccine. Vaccine. 2013;31 Suppl 4:D20-6.
- Sharma SK, Rogers BB, Alexander JM, McIntire DD, Leveno KJ. A randomized trial of the effects of antibiotic prophylaxis on epidural-related fever in labor. Anesth Analg. 2014;118(3):604-10.
- Siegel JD, McCracken GH, Jr., Threlkeld N, DePasse BM, Rosenfeld CR. Single-dose penicillin prophylaxis of neonatal group-B-streptococcal disease. Lancet. 1982;1(8287):1426-30.
- Skopnik H, Wallraf R, Nies B, Troster K, Heimann G. Pharmacokinetics and antibacterial activity of daily gentamicin. Arch Dis Child. 1992;67(1 Spec No):57-61.
- Snelling S, Hart CA, Cooke RW. Ceftazidime or gentamicin plus benzylpenicillin in neonates less than forty-eight hours old. J Antimicrob Chemother. 1983;12 Suppl A:353-6.
- Stocker M, Fontana M, El Helou S, Wegscheider K, Berger TM. Use of procalcitonin-guided decision-making to shorten antibiotic therapy in suspected neonatal early-onset sepsis: prospective randomized intervention trial. Neonatology. 2010;97(2):165-74. (a)
- Stocker M, Hop WC, van Rossum AM. Neonatal Procalcitonin Intervention Study (NeoPInS): Effect of Procalcitonin-guided decision making on duration of antibiotic therapy in suspected neonatal early-onset sepsis: A multi-centre randomized superiority and non-inferiority Intervention Study. BMC Pediatr. 2010;10:89. (b)
- Stoll BJ, Hansen N, Fanaroff AA, Wright LL, Carlo WA, Ehrenkranz RA, et al. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med. 2002;347(4):240-7.
- Stoll BJ, Hansen NI, Sanchez PJ, Faix RG, Poindexter BB, Van Meurs KP, et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 2011;127(5):817-26.
- The Netherlands Perinatal Registry Trends 1999-2012. Utrecht: Stichting Perinatale Registratie Nederland, 2013.
- Trijbels-Smeulders M, de Jonge GA, Pasker-de Jong PC, Gerards LJ, Adriaanse AH, van Lingen RA, et al. Epidemiology of neonatal group B streptococcal disease in the Netherlands before and after introduction of guidelines for prevention. Arch Dis Child Fetal Neonatal Ed. 2007;92(4):F271-6.
- Ungerer RL, Lincetto O, McGuire W, Saloojee H, Gulmezoglu AM. Prophylactic versus selective antibiotics for term newborn infants of mothers with risk factors for neonatal infection. Cochrane Database Syst Rev. 2004(4):CD003957.
- Valitalo PA, van den Anker JN, Allegaert K, de Cock RF, de Hoog M, Simons SH, et al. Novel model-based dosing guidelines for gentamicin and tobramycin in preterm and term neonates. J Antimicrob Chemother. 2015;70(7):2074-7.
- van den Hoogen A, Gerards LJ, Verboon-Maciolek MA, Fleer A, Krediet TG. Long-term trends in the epidemiology of neonatal sepsis and antibiotic susceptibility of causative agents. Neonatology. 2010;97(1):22-8.
- Vergnano S, Menson E, Kennea N, Embleton N, Russell AB, Watts T, et al. Neonatal infections in England: the NeonIN surveillance network. Arch Dis Child Fetal Neonatal Ed. 2011;96(1):F9-F14.
- Wassen MM, Winkens B, Dorssers EM, Marcus MA, Moonen RM, Roumen FJ. Neonatal sepsis is mediated by maternal fever in labour epidural analgesia. J Obstet Gynaecol. 2014;34(8):679-83.
- Wolf RL, Olinsky A. Prolonged rupture of fetal membranes and neonatal infections. S Afr Med J. 1976;50(15):574-6.
- Woodgate P, Flenady V, Steer P. Intramuscular penicillin for the prevention of early onset group B streptococcal infection in newborn infants. Cochrane Database Syst Rev. 2004(3):CD003667.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 07-06-2017
Deze richtlijn dient door de sectie Neonatologie van de NVK elke 5 jaar herzien te worden. Hiervan kan worden afgeweken als nieuwe belangrijke inzichten naar voren komen. Indien herziening noodzakelijk wordt geacht, spant de sectie zich, met de commissie R&I van de NVK, in om hiervoor de benodigde middelen te verkrijgen.
Algemene gegevens
Deze richtlijn is tot stand gekomen door financiering van de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is uniforme, evidence-based, diagnostiek en behandeling van early-onset neonatale infecties. Daartoe behoort ook het zorgvuldig inzetten van antibiotica waarbij rekening wordt gehouden met resistentieontwikkeling. Om hierover gefundeerde aanbevelingen te kunnen doen, wordt een samenvatting gegeven van de wetenschappelijke stand van zaken betreffende early-onset sepsis volgens de methode van evidence-based richtlijnontwikkeling.
Het uiteindelijke doel is dat dit leidt tot gezondheidswinst voor de patiënt (reductie mortaliteit en morbiditeit) maar ook tot besparingen in zorgkosten door het vermijden van onnodige diagnostiek en behandelingen, en mogelijk ook het verminderen van complicaties.
De richtlijn is bedoeld voor alle zorgverleners, maar met name kinderartsen, gynaecologen, verloskundigen en huisartsen die betrokken zijn bij de zorg voor neonaten gedurende de eerste levensdagen.
Doelgroep
De doelgroep omvat zwangeren en pasgeborenen ongeacht zwangerschapsduur die gedurende met name de eerste drie levensdagen een verhoogd risico hebben op of verdacht worden van een early-onset neonatale infectie.
Samenstelling werkgroep
- Dhr. dr. R.F. Kornelisse (projectleider), NVK sectie neonatologie, kinderarts-neonatoloog, Erasmus MC-Sophia, Rotterdam
- Mw. drs. M.K. Tuut, epidemioloog, projectadviseur, PROVA
- Mw. dr. L.M.A.J. Venmans, epidemioloog NVK
- Mw. dr. M.A.C. Hemels, NVK sectie neonatologie, kinderarts-neonatoloog, Isala Klinieken, Zwolle
- Mw. Prof. dr. Y.B de Rijke, NVKC, klinisch chemicus Erasmus MC-Sophia, Rotterdam
- Dhr. dr. T.B.Y. Liem, NVZA, ziekenhuisapotheker, UMC Utrecht - Wilhelmina Kinderziekenhuis
- Dhr. dr. T. van der Bruggen, NVMM, medisch microbioloog, UMC Utrecht,
- Mw. drs. G.E. Kolkman, KNOV, verloskundige-onderzoeker, coördinator richtlijnontwikkeling KNOV, Utrecht tot 1 juli 2015
- Mw. dr. J.B. de Boer, KNOV, psycholoog en beleidsmedewerker richtlijnontwikkeling KNOV, Utrecht vanaf 2 december 2015
- Mw. M. Estourgie, OGBS, oudervertegenwoordiger
- Dhr. drs. T. Njo, OGBS, oudervertegenwoordiger, arts klinische chemie, Saltro, Utrecht
- Dhr. dr. J.J. Duvekot, NVOG, gynaecoloog, Erasmus MC, Rotterdam
- Mw. drs. C.J. Miedema, NVK sectie infectieziekten en immunologie, kinderarts-infectioloog, Catharina Ziekenhuis, Eindhoven
- Mw. dr. M. Trijbels-Smeulders, persoonlijke titel, kinderarts Heideheuvel, Hilversum
Belangenverklaringen
De werkgroepleden hebben een belangenverklaring ingevuld. De verklaringen liggen ter inzage bij de NVK. Er zijn geen werkgroepleden uitgesloten van deelname aan discussies vanwege belangenverstrengeling.
Inbreng patiëntenperspectief
Het perspectief van patiënten/ouders is gewaarborgd doordat in de werkgroep de stichting Ouders Groep B Streptokokken (OGBS) vertegenwoordigd was.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De definitieve richtlijn is onder de verenigingen verspreid en via de website van de NVK (www.nvk.nl) elektronisch beschikbaar gesteld. Verder is er ter ondersteuning van de richtlijn een samenvatting voor ouders/verzorgers van patiënten gemaakt.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zijn interne indicatoren ontwikkeld aan de hand waarvan de implementatie steekproefsgewijs kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren. De interne indicatoren die bij onderhavige richtlijn zijn ontwikkeld worden behandeld bij de aanverwante producten van deze richtlijn.
Werkwijze
De ontwikkeling van deze richtlijn is gefinancierd door Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Gedurende de periode van februari 2014 tot juni 2017 is aan de ontwikkeling van deze richtlijn door leden van de werkgroep gewerkt.
De uiteindelijke tekst van de richtlijn is in juli 2015 ter commentaar voorgelegd aan de leden van de sectie neonatologie, sectie infectieziekten en immunologie, overige leden van de Nederlandse Vereniging voor Kindergeneeskunde (NVK) en aan andere wetenschappelijke verenigingen (NVOG, KNOV, NHG, NVMM, NVKC, NVZA) en de stichting Ouders groep B Streptokokken (OGBS)-patiënten/Patiëntenfederatie. Het commentaar is in de richtlijn verwerkt. De definitieve richtlijn is op 7 juni 2017 door de Nederlandse Vereniging voor Kindergeneeskunde geautoriseerd.
Zoeken (inter)nationale richtlijnen
In eerste instantie werd gezocht naar evidence-based richtlijnen gericht op de preventie en behandeling van early-onset infecties. Hierbij werd gebruik gemaakt van de volgende databases: Medline, SUMSEARCH, Clinical evidence van BMJ, Scottish Intercollegiate Guidelines Network en de TRIP DATABASE. De gevonden richtlijnen werden op kwaliteit beoordeeld met behulp van AGREE II (AGREE Next Stepts Consortium. Appraisal of Guidelines for Research & Evaluation (AGREE) II Instrument. 2013). Bij de beoordeling van de gevonden richtlijnen, kwam de in 2012 verschenen internationale richtlijn van NICE “Antibiotics for early-onset neonatal infection: antibiotics for the prevention and treatment of early-onset neonatal infection” als beste naar voren (National Collaborating Centre for Women's and Children's Health, 2012). Vanwege de goede kwaliteit van deze richtlijn, is deze nieuwe richtlijn hierop grotendeels gebaseerd, zonodig geactualiseerd (evidence) en aangepast (van bewijs naar aanbeveling) aan de Nederlandse situatie. Tevens is ervoor gezorgd dat deze richtlijn goed aansluit bij andere NVK-richtlijnen.
Knelpunten en aanvullende vragen
Er werd door de leden van de werkgroep een knelpuntenanalyse uitgevoerd om de huidige werkwijze ten aanzien van de diagnostiek en behandeling bij neonatale sepsis in Nederland in kaart te brengen. Hiertoe werden de werkgroepleden gevraagd om een top 3 van knelpunten aan te leveren. Een compleet overzicht van de aangedragen knelpunten is opgenomen in de aanverwante producten (Kennislacunes). De resultaten werden besproken tijdens een werkgroepvergadering. Op basis hiervan werden de uitgangsvragen opgesteld. Vervolgens werd per vraag bekeken of gebruik gemaakt kon worden van informatie uit de NICE richtlijn en werd zonodig een (aanvullend) literatuuronderzoek uitgevoerd. Er zijn een aantal aanvullende searches gedaan op de NICE richtlijn. Het betreft searches naar maternale koorts bij epidurale analgesie als risicofactor voor neonatale sepsis (vraag 3), de inzet van een lumbaalpunctie (vraag 7b) en de optimale empirische behandeling met antibiotica waarbij rekening wordt gehouden met de ontwikkeling van antibiotica resistentie (zie vraag 8).
Ten opzichte van de NICE richtlijn zijn twee aanvullende vragen geformuleerd die niet in de NICE richtlijn terugkomen. De eerste vraag gaat over het gebruik van een GBS-sneltest bij maternale risicofactoren ten aanzien van een early-onset neonatale GBS infectie (vraag 4). De tweede vraag heeft betrekking op het beleid bij de pasgeborene indien de zwangere antepartum of durante partu antibiotica heeft gekregen (vraag 11).
Nadat de evidence was samengevat en gegradeerd, werden door de werkgroep aanbevelingen geformuleerd. Naast de evidence werden hierbij overwegingen uit de praktijk, die expliciet genoemd werden, meegenomen. Voorbeelden hiervan zijn patiëntenvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties, veiligheid en kostenoverwegingen.
Zoeken artikelen
Bij de vragen waarvoor een search werd gedaan wordt beschreven welke databases en zoektermen zijn gebruikt en welke zoekperiode is aangehouden. Bij de literatuurselectie zijn alle relevante studies meegenomen, ongeacht de definitie van infectie, sepsis en early-onset.
Eerst werd gezocht naar de hoogste mate van bewijs: systematische reviews en gerandomiseerd en gecontroleerd onderzoek. Als dat niets opleverde, werd verder gezocht naar observationele artikelen (prospectief en retrospectief cohortonderzoek en patiënt-controle onderzoek). Er werd niet gezocht naar onderzoek van een nog lager niveau van bewijs, zoals case studies en dierexperimenteel onderzoek. De gebruikte literatuur is samengevat in de evidence tabellen. Alleen literatuur die voldoende valide en toepasbaar was, werd meegenomen in de richtlijn.
Beoordeling artikelen
De searches bij interventievragen werden met behulp van de GRADE methodiek uitgewerkt. Hierbij werd uitgegaan van de uitkomstmaten die in de NICE richtlijn werden beschreven. Resultaten werden per uitkomstmaat samengevat, waarbij tevens de ‘overall’ kwaliteit van de onderliggende bewijslast (evidence) werd aangegeven. Bij de beoordeling werd gebruik gemaakt van de software “GRADE-pro”. Met behulp van dit programma werd bij elke uitgangsvraag een tabel met bevindingen (“summary of findings”) en een tabel met de beoordeling van het bewijs (“GRADE evidence profile”) gemaakt (zie de evidence tabellen).
GRADE kent vier niveaus: ‘high’, ‘moderate’, ‘low’ en ‘very low’. Per uitkomst werd een GRADE niveau toegekend. Wanneer een uitkomst als ‘high’ geclassificeerd werd, wil dit zeggen dat het onwaarschijnlijk is dat toekomstig onderzoek de schatting van de uitkomst zal veranderen. Met andere woorden, er is veel vertrouwen in de juistheid van de schatting van de uitkomst. Een ‘very low’ classificatie wil zeggen dat er veel onzekerheid is over de juistheid van de uitkomst. Voor een uitgebreidere beschrijving van GRADE verwijzen we naar www.gradeworkinggroup.nl en het artikel van Guyatt (Guyatt, 2008).
Uitgangsvragen
De uitgangsvragen en aanbevelingen in de huidige richtlijn zijn gebaseerd op de NICE richtlijn. In deze nieuwe richtlijn is de indeling enigszins aangepast. Toegevoegd zijn 2 hiervoorgenoemde uitgangsvragen, te weten vraag 4 en 11. Uiteindelijk zijn de volgende uitgangsvragen uitgewerkt:
1. Welke informatie en ondersteuning dienen ouders en/of zorgverleners te krijgen bij (de verdenking op) een early-onset neonatale infectie?
2. Wat zijn indicaties voor intrapartum profylactische behandeling met antibiotica ter preventie van early-onset neonatale infecties?
3. Is maternale koorts bij epidurale analgesie een risicofactor voor early-onset neonatale infectie?
4. Wat is de indicatie voor het uitvoeren van een GBS-sneltest bij de moeder?
5. Wat zijn de maternale en foetale risicofactoren op een early-onset neonatale infectie? Welke neonatale symptomen geven een verhoogd risico op een daadwerkelijke early-onset infectie?
6. Is routinematige antibiotische profylaxe geïndiceerd bij neonaten met maternale risicofactoren om een early-onset infectie te voorkomen?
7a. Welk laboratoriumonderzoek kan beleidsbepalend zijn of een asymptomatische neonaat met risicofactoren of een neonaat met klinische symptomen met antibiotica moet worden behandeld?
7b. Dient een lumbaalpunctie (LP) te worden gedaan voorafgaand aan de behandeling van neonaten met symptomen en neonaten met significante risicofactoren zonder symptomen? En wanneer dient een LP te worden gedaan bij neonaten die behandeld worden?
8. Wat is de meest effectieve en veilige behandeling met antibiotica bij een (verdenking op) early-onset neonatale infectie?
9. Wat is de optimale behandelingsduur met antibiotica bij neonaten:
- met een bewezen early-onset infectie (bloedkweek positief)?
- met een verdenking op early-onset infectie op basis van klinische symptomen zonder dat er een bacteriële oorzaak is vastgesteld?
- die antibiotische profylaxe op basis van maternale risicofactoren krijgen maar asymptomatisch zijn?
10. Therapeutic drug monitoring (TDM) van aminoglycosiden
11. Hoe dient een neonaat met een verdenking op early-onset infectie behandeld te worden indien antepartum antibiotica is gegeven?
Kostenimplicaties
Door de toenemende aandacht voor de kosten in de gezondheidszorg neemt het belang van richtlijnen die doelmatig handelen bevorderen toe. In deze richtlijn is geen analyse gemaakt van de verwachte effecten op de kosten.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence’ gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien deze aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt’, kunnen zorgverleners op basis van hun professionele autonomie zonodig afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.

