Intrapartum antibiotica op basis van risicofactoren bij early-onset neonatale infecties
Uitgangsvraag
Wat zijn indicaties voor intrapartum profylactische behandeling met antibiotica ter preventie van early-onset neonatale infecties?
Aanbeveling
GBS-profylaxe: Groep B streptokokken (GBS)-profylaxe met benzylpenicilline om
een early-onset neonatale infectie te voorkomen is geïndiceerd indien er sprake is van:
- een eerder kind met een invasieve GBS infectie.
- maternale bacteriurie of urineweginfectie door GBS in de huidige zwangerschap
Overweeg GBS-profylaxe als er sprake is van
- maternale GBS-kolonisatie (rectovaginale kweek) zonder andere risicofactoren in de huidige zwangerschap waarbij de voor- en nadelen met de zwangere worden besproken; of
- vroeggeboorte en tevens het voortijdig breken van de vliezen (ongeacht duur) en een onbekende GBS-status.
GBS-status: Het vaststellen van de GBS-status is geïndiceerd indien er sprake is van:
- een dreigende vroeggeboorte; of
- gebroken vliezen zonder weeënactiviteit (PROM). Het vaststellen van de GBS-status bij een zwangerschapsduur >37 weken en PROM gebeurt na 24 uur.
Overweeg in overleg met de zwangere het vaststellen van de GBS-status bij een zwangerschapsduur van 35-37 weken indien:
- er sprake is van GBS-kolonisatie tijdens een voorgaande zwangerschap; of
- een eerder kind is behandeld met een klinisch beeld van early-onset neonatale sepsis/
- meningitis zonder bekende verwekker waarbij sprake was van noodzaak tot kunstmatige beademing en/of circulatoire ondersteuning (schema 1).
Schema 1: Flowchart obstetrisch beleid rondom het voorkomen van een early-onset neonatale infectie
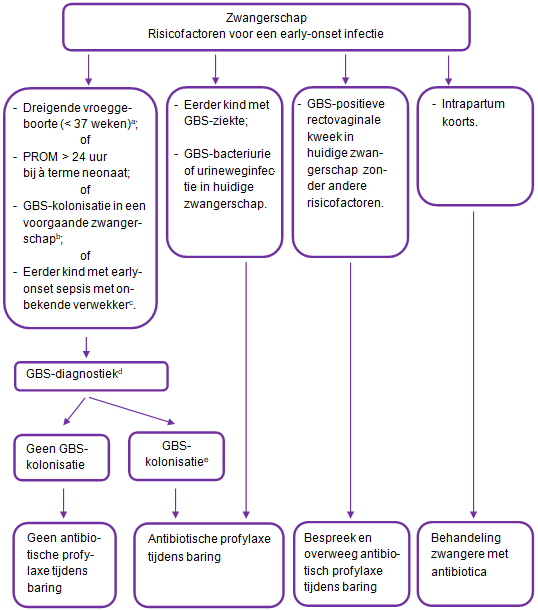
a Premature weeënactiviteit en/of “prelabour rupture of the membranes” (PROM). PROM is gedefinieerd als het breken van de vliezen voor de aanvang van weeënactiviteit.
b Indien GBS-kolonisatie in een voorgaande zwangerschap is vastgesteld, wordt overwogen in de huidige zwangerschap bij een amenorrhoeduur van 35-37 weken GBS-diagnostiek in te zetten.
c Early-onset neonatale sepsis zonder verwekker waarbij sprake is van noodzaak tot kunstmatige beademing en/of circulatoire ondersteuning.
d In aanwezigheid van risicofactoren wordt gescreend op GBS-kolonisatie door middel van een rectovaginale kweek.
e Intrapartum GBS-profylaxe overwegen bij een vroeggeboorte als er tevens sprake is van het voortijdig breken van de vliezen (ongeacht duur) en een onbekende GBS-status.
Overwegingen
Rondom de indicatie van GBS-profylaxe bestaan verschillen. De huidige richtlijn “Perinatale groep-B-streptokokken (GBS-) ziekte” (NVK/NVOG) doet alleen een aanbeveling tot GBS-profylaxe wanneer er bij de zwangere sprake is van ernstige GBS-kolonisatie, zoals bacteriurie of urineweginfectie door GBS. Dit in tegenstelling tot de NICE richtlijn, American Academy of Pediatrics (AAP)/Center for Disease Control and Prevention (CDC) waarbij profylaxe reeds bij een positieve rectovaginale GBS-kweek wordt aanbevolen ongeacht de graad van GBS-kolonisatie. In hoeverre een toevallig gevonden GBS-positieve rectovaginale kweek bij een zwangere zonder risicofactoren het geven van profylaxe rechtvaardigt was een discussiepunt. In een dergelijke situatie bedraagt de geschatte kans op een kind met bewezen of waarschijnlijke early-onset neonatale GBS-infectie ten hoogste 1 op 250 à 300 pasgeborenen. Deze schatting is afgeleid uit het artikel van Trijbels et al.(Trijbels-Smeulders, 2007). De consensus tussen de betrokken beroepsgroepen van deze richtlijn is dat de keuze tot GBS-profylaxe door de zwangere kan worden genomen nadat de voor- en nadelen met haar zijn besproken. Het belangrijke voordeel van profylaxe is dat de kans op een kind met GBS-ziekte wordt gereduceerd. Nadelig wordt gevonden dat de partus van deze voorgenoemde zwangeren vanwege de IV-toediening van antibiotica in het ziekenhuis moet plaatsvinden waarbij relatief veel zwangeren moeten worden behandeld om één kind met een ernstig verlopende GBS-ziekte te voorkomen. Daarnaast is er een kleine kans op ernstige overgevoeligheidsreactie op antibiotica bij de zwangere. Er is een keuzekaart ontwikkeld voor draagsters van de GBS-bacterie zonder risicofactoren, die helpt om de keuze te bespreken om geen antibiotica of wel antibiotica (via een infuus) te gebruiken tijdens de bevalling.
Screening op GBS-kolonisatie is geïndiceerd (schema 1), wanneer er risicofactoren op een early-onset neonatale infectie bestaan zoals dreigende vroeggeboorte en spontaan gebroken vliezen zonder weeënactiviteit (PROM) zoals aangegeven in de NICE richtlijn. Het vaststellen van de GBS-status bij een zwangerschapsduur >37 weken en PROM gebeurt na 24 uur.
Screening op GBS-kolonisatie is ook zinvol en te overwegen als een vrouw in een voorgaande zwangerschap met GBS was gekoloniseerd. Onderzoek toont een sterk vergrote kans op GBS-kolonisatie indien er sprake was van GBS-kolonisatie in een voorgaande zwangerschap (RR 3,6; 95% BI= 3,1-4,3) (Colicchia, 2015). De werkgroep stelt tevens voor een screening op GBS-kolonisatie te overwegen bij zwangeren waarbij een voorgaand kind een early-onset neonatale sepsis/meningitis (noodzaak tot beademing en/of circulatoire ondersteuning) zonder gedocumenteerde verwekker heeft doorgemaakt. Het is belangrijk om de twee voorgenoemde overwegingen tot screening op GBS-kolonisatie met de zwangere vrouwen te bespreken. Dit voorstel betreft een consensus binnen de werkgroep en wordt mede gedaan naar aanleiding van ontvangen opmerkingen in de commentaarronde.
GBS-preventiestrategie:
Sinds het einde van de jaren tachtig is in meerdere studies aangetoond dat maternale intraveneuze antibiotische behandeling (benzylpenicilline, amoxicilline of ampicilline) tijdens de partus het aantal neonatale infecties reduceert. Dit geldt thans als meest effectieve methode. Profylaxe wordt als adequaat verondersteld indien het antibioticum intraveneus in de juiste dosering minstens 4 uur vóór de geboorte (d.w.z. twee doseringen) wordt gestart (tabel 1). Recente observationele studies tonen echter dat de effectiviteit van intrapartum antibiotica bij neonaten geboren uit GBS-positieve vrouwen zonder risicofactoren slechts 85-90% bedraagt (Lin, 2001; Schrag, 2013). Kortom, de gegeven profylaxe is zeker niet altijd toereikend en mogelijkerwijs nog minder effectief in aanwezigheid van andere maternale risicofactoren.
Tabel 1. Antibiotische profylaxe bij de partus ter preventie van neonatale early-onset GBS-sepsis*
|
profylaxe starten tijdens ontsluiting (minstens 4 uur voor de geboorte) tot de geboorte |
|
middel route startdosis onderhoud |
|
voorkeur: benzylpenicilline i.v. 2 milj. IE 1 milj.IE elke 4 uur |
|
bij penicilline-allergie: |
|
voorkeur: clindamycine i.v. 900 mg 900 mg elke 8 uur |
*Ontleend aan de richtlijn GBS-ziekte (2008).
Onderbouwing
Achtergrond
Het doel van deze uitgangsvraag is het vaststellen van de indicaties voor profylactische behandeling met antibiotica van zwangere vrouwen vlak voor of tijdens de bevalling om early-onset neonatale infectie te voorkomen. De uitgangsvraag omvat ook de effectiviteit van antibiotica kort voordat de bevalling begint, bijvoorbeeld bij vrouwen met gebroken vliezen zonder weeënactiviteit. Aandachtspunten bij deze vraag zijn: de effectiviteit van profylactische antibiotische behandeling in vergelijking met geen behandeling, welke soort antibioticum als profylaxe te gebruiken (smal of breed) en de timing, wijze van toediening, frequentie en dosering.
Samenvatting literatuur
Aanbevelingen NICE richtlijn
- Biedt intrapartum profylactische behandeling met intraveneuze benzylpenicilline aan om een early-onset neonatale infectie te voorkomen bij de volgende moeders:
- een eerder kind met invasieve groep B streptokokken infectie;
- groep B streptokokken kolonisatie, bacteriurie of urineweginfectie in de huidige zwangerschap.
- Als de moeder besluit om intrapartum profylactische behandeling met antibiotica te nemen, geef dan de eerste dosis zo spoedig mogelijk en blijf profylactische behandeling geven tot de geboorte.
- Overweeg bij moeders met een preterme bevalling en voortijdig gebroken vliezen, ongeacht de duur daarvan, een intrapartum profylactische behandeling met intraveneuze benzylpenicilline ter voorkoming van een early-onset neonatale infectie.
- Overweeg bij moeders met een preterme bevalling waarbij de vliezen (mogelijk) langer dan 18 uur zijn gebroken een intrapartum profylactische behandeling met intraveneuze benzylpenicilline ter voorkoming van een early-onset neonatale infectie.
- De eerste keus voor intrapartum antibiotische profylaxe is benzylpenicilline. Indien er sprake is van penicilline allergie, wordt clindamycine aanbevolen tenzij groep B streptokokken sensitiviteitsgegevens of lokale microbiologische gegevens aangeven dat een alternatief beter is.
Zoeken en selecteren
De NICE richtlijn is als uitgangspunt gebruikt.
Referenties
- Agarwal G, Rastogi A, Pyati S, Wilks A, Pildes RS. Comparison of once-daily versus twice-daily gentamicin dosing regimens in infants > or = 2500 g. J Perinatol. 2002;22(4):268-74.
- AGREE Next Stepts Consortium. Appraisal of Guidelines for Research & Evaluation (AGREE) II Instrument. 2013.
- Ansong AK, Smith PB, Benjamin DK, Clark RH, Li JS, Cotten CM, et al. Group B streptococcal meningitis: cerebrospinal fluid parameters in the era of intrapartum antibiotic prophylaxis. Early Hum Dev. 2009;85(10 Suppl):S5-7.
- Auriti C, Rava L, Di Ciommo V, Ronchetti MP, Orzalesi M. Short antibiotic prophylaxis for bacterial infections in a neonatal intensive care unit: a randomized controlled trial. J Hosp Infect. 2005;59(4):292-8.
- Bekker V, Bijisma MW, van de Beek D, Kuijpers TW, van der Ende A. Incidence of invasive group B streptococcal disease and pathogen genotype distribution in newborn babies in the Netherlands over 25 years: a nationwide surveillance study. Lancet Infect Dis. 2014;14(11):1083-9.
- Biondi EA, Mischler M, Jerardi KE, Statile AM, French J, Evans R, et al. Blood culture time to positivity in febrile infants with bacteremia. JAMA Pediatr. 2014;168(9):844-9.
- Campbell D, Halpern S, Muir H, Breen T, Blanchard W. Maternal intrapartum fever and neonatal sepsis. Society for Obstetric Anesthesia and Perinatology 2009. p. 9905:A9.
- Chiesa C, Signore F, Assumma M, Buffone E, Tramontozzi P, Osborn JF, et al. Serial measurements of C-reactive protein and interleukin-6 in the immediate postnatal period: reference intervals and analysis of maternal and perinatal confounders. Clin Chem. 2001;47(6):1016-22.
- Colicchia LC, Lauderdale DS, Du H, Adams M, Hirsch E. Recurrence of group B streptococcus colonization in successive pregnancies. J Perinatol. 2015;35(3):173-6.
- Daniels J, Gray J, Pattison H, Roberts T, Edwards E, Milner P, et al. Rapid testing for group B streptococcus during labour: a test accuracy study with evaluation of acceptability and cost-effectiveness. Health Technol Assess. 2009;13(42):1-154, iii-iv.
- de Alba Romero C, Gomez Castillo E, Manzanares Secades C, Rodriguez Lopez J, Arreaza Lopez L, Saenz Valiente P. Once daily gentamicin dosing in neonates. Pediatr Infect Dis J. 1998;17(12):1169-71.
- de Hoog M, Mouton JW, Schoemaker RC, Verduin CM, van den Anker JN. Extended-interval dosing of tobramycin in neonates: implications for therapeutic drug monitoring. Clin Pharmacol Ther. 2002;71(5):349-58.
- de Hoog M, Schoemaker RC, Mouton JW, van den Anker JN. Tobramycin population pharmacokinetics in neonates. Clin Pharmacol Ther. 1997;62(4):392-9.
- Di Renzo GC, Melin P, Berardi A, Blennow M, Carbonell-Estrany X, Donzelli GP, et al. Intrapartum GBS screening and antibiotic prophylaxis: a European consensus conference. J Matern Fetal Neonatal Med. 2014:1-17.
- El Helali N, Giovangrandi Y, Guyot K, Chevet K, Gutmann L, Durand-Zaleski I. Cost and effectiveness of intrapartum group B streptococcus polymerase chain reaction screening for term deliveries. Obstet Gynecol. 2012;119(4):822-9.
- Engle WD, Jackson GL, Sendelbach D, Ford D, Olesen B, Burton KM, et al. Neonatal pneumonia: comparison of 4 vs 7 days of antibiotic therapy in term and near-term infants. J Perinatol. 2000;20(7):421-6.
- Engle WD, Jackson GL, Sendelbach DM, Stehel EK, Ford DM, McHugh KM, et al. Pneumonia in term neonates: laboratory studies and duration of antibiotic therapy. J Perinatol. 2003;23(5):372-7.
- Escobar GJ, Li DK, Armstrong MA, Gardner MN, Folck BF, Verdi JE, et al. Neonatal sepsis workups in infants >/=2000 grams at birth: A population-based study. Pediatrics. 2000;106(2 Pt 1):256-63.
- Escobar GJ, Puopolo KM, Wi S, Turk BJ, Kuzniewicz MW, Walsh EM, et al. Stratification of risk of early-onset sepsis in newborns >/= 34 weeks' gestation. Pediatrics. 2014;133(1):30-6.
- Garges HP, Moody MA, Cotten CM, Smith PB, Tiffany KF, Lenfestey R, et al. Neonatal meningitis: what is the correlation among cerebrospinal fluid cultures, blood cultures, and cerebrospinal fluid parameters? Pediatrics. 2006;117(4):1094-100.
- Gerard P, Verghote-D'Hulst M, Bachy A, Duhaut G. Group B streptococcal colonization of pregnant women and their neonates. Epidemiological study and controlled trial of prophylactic treatment of the newborn. Acta Paediatr Scand. 1979;68(6):819-23.
- Gonen R, Korobochka R, Degani S, Gaitini L. Association between epidural analgesia and intrapartum fever. Am J Perinatol. 2000;17(3):127-30.
- Guerti K, Devos H, Ieven MM, Mahieu LM. Time to positivity of neonatal blood cultures: fast and furious? J Med Microbiol. 2011;60(Pt 4):446-53.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336(7650):924-6.
- Haberland CA, Benitz WE, Sanders GD, Pietzsch JB, Yamada S, Nguyen L, et al. Perinatal screening for group B streptococci: cost-benefit analysis of rapid polymerase chain reaction. Pediatrics. 2002;110(3):471-80.
- Hammerberg O, Kurnitzki C, Watts J, Rosenbloom D. Randomized trial using piperacillin versus ampicillin and amikacin for treatment of premature neonates with risk factors for sepsis. Eur J Clin Microbiol Infect Dis. 1989;8(3):241-4.
- Hammerschlag MR, Chandler JW, Alexander ER, English M, Chiang WT, Koutsky L, et al. Erythromycin ointment for ocular prophylaxis of neonatal chlamydial infection. JAMA. 1980;244(20):2291-3.
- Hayani KC, Hatzopoulos FK, Frank AL, Thummala MR, Hantsch MJ, Schatz BM, et al. Pharmacokinetics of once-daily dosing of gentamicin in neonates. J Pediatr. 1997;131(1 Pt 1):76-80.
- Heath PT, Jardine LA. Neonatal infections: group B streptococcus. Clin Evid (Online). 2014;2014.
- Heesen M, Klor S, Rossaint R, Straube S, Van de Velde M. Labour epidural analgesia and anti-infectious management of the neonate: a meta-analysis. J Perinat Med. 2012.
- Isemann BT, Kotagal UR, Mashni SM, Luckhaupt EJ, Johnson CJ. Optimal gentamicin therapy in preterm neonates includes loading doses and early monitoring. Ther Drug Monit. 1996;18(5):549-55.
- Itsarayoungyuen S, Riff L, Schauf V, Hamilton L, Otrembiak J, Vidyasagar D. Tobramycin and gentamicin are equally safe for neonates: results of a double-blind randomized trial with quantitative assessment of renal function. Pediatr Pharmacol (New York). 1982;2(2):143-55.
- Jardine L, Davies MW, Faoagali J. Incubation time required for neonatal blood cultures to become positive. J Paediatr Child Health. 2006;42(12):797-802.
- Kaul B, Vallejo M, Ramanathan S, Mandell G. Epidural labor analgesia and neonatal sepsis evaluation rate: a quality improvement study. Anesth Analg. 2001;93(4):986-90.
- Kenyon SL, Taylor DJ, Tarnow-Mordi W, Group OC. Broad-spectrum antibiotics for preterm, prelabour rupture of fetal membranes: the ORACLE I randomised trial. ORACLE Collaborative Group. Lancet. 2001;357(9261):979-88.
- Kuppala VS, Meinzen-Derr J, Morrow AL, Schibler KR. Prolonged initial empirical antibiotic treatment is associated with adverse outcomes in premature infants. J Pediatr. 2011;159(5):720-5.
- Langhendries JP, Battisti O, Bertrand JM, Francois A, Darimont J, Ibrahim S, et al. Once-a-day administration of amikacin in neonates: assessment of nephrotoxicity and ototoxicity. Dev Pharmacol Ther. 1993;20(3-4):220-30.
- Lieberman E, Lang JM, Frigoletto F, Jr., Richardson DK, Ringer SA, Cohen A. Epidural analgesia, intrapartum fever, and neonatal sepsis evaluation. Pediatrics. 1997;99(3):415-9.
- Lin FY, Brenner RA, Johnson YR, Azimi PH, Philips JB, 3rd, Regan JA, et al. The effectiveness of risk-based intrapartum chemoprophylaxis for the prevention of early-onset neonatal group B streptococcal disease. Am J Obstet Gynecol. 2001;184(6):1204-10.
- Mercado MC, Brodsky NL, McGuire MK, Hurt H. Extended interval dosing of gentamicin in preterm infants. Am J Perinatol. 2004;21(2):73-7.
- Metsala J, Lundqvist A, Virta LJ, Kaila M, Gissler M, Virtanen SM. Prenatal and post-natal exposure to antibiotics and risk of asthma in childhood. Clin Exp Allergy. 2015;45(1):137-45.
- Metsvaht T, Ilmoja ML, Parm U, Maipuu L, Merila M, Lutsar I. Comparison of ampicillin plus gentamicin vs. penicillin plus gentamicin in empiric treatment of neonates at risk of early onset sepsis. Acta Paediatr. 2010;99(5):665-72.
- Metsvaht T, Ilmoja ML, Parm U, Merila M, Maipuu L, Muursepp P, et al. Ampicillin versus penicillin in the empiric therapy of extremely low-birthweight neonates at risk of early onset sepsis. Pediatr Int. 2011;53(6):873-80.
- Metsvaht T, Oselin K, Ilmoja ML, Anier K, Lutsar I. Pharmacokinetics of penicillin g in very-low-birth-weight neonates. Antimicrob Agents Chemother. 2007;51(6):1995-2000.
- Miall-Allen VM, Whitelaw AG, Darrell JH. Ticarcillin plus clavulanic acid (Timentin) compared with standard antibiotic regimes in the treatment of early and late neonatal infections. Br J Clin Pract. 1988;42(7):273-9.
- Mukherjee A, Ramalingaiah B, Kennea N, Duffy DA. Management of neonatal early onset sepsis (CG149): compliance of neonatal units in the UK with NICE recommendations. Arch Dis Child Fetal Neonatal Ed. 2015;100(2):F185.
- Muller AE, DeJongh J, Bult Y, Goessens WH, Mouton JW, Danhof M, et al. Pharmacokinetics of penicillin G in infants with a gestational age of less than 32 weeks. Antimicrob Agents Chemother. 2007;51(10):3720-5.
- Muller-Pebody B, Johnson AP, Heath PT, Gilbert RE, Henderson KL, Sharland M. Empirical treatment of neonatal sepsis: are the current guidelines adequate? Arch Dis Child Fetal Neonatal Ed. 2011;96(1):F4-8.
- National Collaborating Centre for Women's and Children's Health. Antibiotics for early-onset neonatal infection. Antibiotics for the prevention and treatment of early-onset neonatal infection. 2012.
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) en Nederlandse Vereniging voor Kindergeneeskunde (NVK). Richtlijn: perinatale groep-B-streptokokken (GBS-)ziekte. 2012.
- Parm U, Metsvaht T, Sepp E, Ilmoja ML, Pisarev H, Pauskar M, et al. Impact of empiric antibiotic regimen on bowel colonization in neonates with suspected early onset sepsis. Eur J Clin Microbiol Infect Dis. 2010;29(7):807-16.
- Patel DM, Rhodes PG, LeBlanc MH, Graves GR, Glick C, Morrison J. Role of postnatal penicillin prophylaxis in prevention of neonatal group B streptococcus infection. Acta Paediatr. 1999;88(8):874-9.
- Philip J, Alexander JM, Sharma SK, Leveno KJ, McIntire DD, Wiley J. Epidural analgesia during labor and maternal fever. Anesthesiology. 1999;90(5):1271-5.
- Puopolo KM, Draper D, Wi S, Newman TB, Zupancic J, Lieberman E, et al. Estimating the probability of neonatal early-onset infection on the basis of maternal risk factors. Pediatrics. 2011;128(5):e1155-63.
- Pyati SP, Pildes RS, Jacobs NM, Ramamurthy RS, Yeh TF, Raval DS, et al. Penicillin in infants weighing two kilograms or less with early-onset Group B streptococcal disease. N Engl J Med. 1983;308(23):1383-9.
- Rastogi A, Agarwal G, Pyati S, Pildes RS. Comparison of two gentamicin dosing schedules in very low birth weight infants. Pediatr Infect Dis J. 2002;21(3):234-40.
- Saari A, Virta LJ, Sankilampi U, Dunkel L, Saxen H. Antibiotic exposure in infancy and risk of being overweight in the first 24 months of life. Pediatrics. 2015;135(4):617-26.
- Schrag SJ, Verani JR. Intrapartum antibiotic prophylaxis for the prevention of perinatal group B streptococcal disease: experience in the United States and implications for a potential group B streptococcal vaccine. Vaccine. 2013;31 Suppl 4:D20-6.
- Sharma SK, Rogers BB, Alexander JM, McIntire DD, Leveno KJ. A randomized trial of the effects of antibiotic prophylaxis on epidural-related fever in labor. Anesth Analg. 2014;118(3):604-10.
- Siegel JD, McCracken GH, Jr., Threlkeld N, DePasse BM, Rosenfeld CR. Single-dose penicillin prophylaxis of neonatal group-B-streptococcal disease. Lancet. 1982;1(8287):1426-30.
- Skopnik H, Wallraf R, Nies B, Troster K, Heimann G. Pharmacokinetics and antibacterial activity of daily gentamicin. Arch Dis Child. 1992;67(1 Spec No):57-61.
- Snelling S, Hart CA, Cooke RW. Ceftazidime or gentamicin plus benzylpenicillin in neonates less than forty-eight hours old. J Antimicrob Chemother. 1983;12 Suppl A:353-6.
- Stocker M, Fontana M, El Helou S, Wegscheider K, Berger TM. Use of procalcitonin-guided decision-making to shorten antibiotic therapy in suspected neonatal early-onset sepsis: prospective randomized intervention trial. Neonatology. 2010;97(2):165-74. (a)
- Stocker M, Hop WC, van Rossum AM. Neonatal Procalcitonin Intervention Study (NeoPInS): Effect of Procalcitonin-guided decision making on duration of antibiotic therapy in suspected neonatal early-onset sepsis: A multi-centre randomized superiority and non-inferiority Intervention Study. BMC Pediatr. 2010;10:89. (b)
- Stoll BJ, Hansen N, Fanaroff AA, Wright LL, Carlo WA, Ehrenkranz RA, et al. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med. 2002;347(4):240-7.
- Stoll BJ, Hansen NI, Sanchez PJ, Faix RG, Poindexter BB, Van Meurs KP, et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 2011;127(5):817-26.
- The Netherlands Perinatal Registry Trends 1999-2012. Utrecht: Stichting Perinatale Registratie Nederland, 2013.
- Trijbels-Smeulders M, de Jonge GA, Pasker-de Jong PC, Gerards LJ, Adriaanse AH, van Lingen RA, et al. Epidemiology of neonatal group B streptococcal disease in the Netherlands before and after introduction of guidelines for prevention. Arch Dis Child Fetal Neonatal Ed. 2007;92(4):F271-6.
- Ungerer RL, Lincetto O, McGuire W, Saloojee H, Gulmezoglu AM. Prophylactic versus selective antibiotics for term newborn infants of mothers with risk factors for neonatal infection. Cochrane Database Syst Rev. 2004(4):CD003957.
- Valitalo PA, van den Anker JN, Allegaert K, de Cock RF, de Hoog M, Simons SH, et al. Novel model-based dosing guidelines for gentamicin and tobramycin in preterm and term neonates. J Antimicrob Chemother. 2015;70(7):2074-7.
- van den Hoogen A, Gerards LJ, Verboon-Maciolek MA, Fleer A, Krediet TG. Long-term trends in the epidemiology of neonatal sepsis and antibiotic susceptibility of causative agents. Neonatology. 2010;97(1):22-8.
- Vergnano S, Menson E, Kennea N, Embleton N, Russell AB, Watts T, et al. Neonatal infections in England: the NeonIN surveillance network. Arch Dis Child Fetal Neonatal Ed. 2011;96(1):F9-F14.
- Wassen MM, Winkens B, Dorssers EM, Marcus MA, Moonen RM, Roumen FJ. Neonatal sepsis is mediated by maternal fever in labour epidural analgesia. J Obstet Gynaecol. 2014;34(8):679-83.
- Wolf RL, Olinsky A. Prolonged rupture of fetal membranes and neonatal infections. S Afr Med J. 1976;50(15):574-6.
- Woodgate P, Flenady V, Steer P. Intramuscular penicillin for the prevention of early onset group B streptococcal infection in newborn infants. Cochrane Database Syst Rev. 2004(3):CD003667.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 07-06-2017
Deze richtlijn dient door de sectie Neonatologie van de NVK elke 5 jaar herzien te worden. Hiervan kan worden afgeweken als nieuwe belangrijke inzichten naar voren komen. Indien herziening noodzakelijk wordt geacht, spant de sectie zich, met de commissie R&I van de NVK, in om hiervoor de benodigde middelen te verkrijgen.
Algemene gegevens
Deze richtlijn is tot stand gekomen door financiering van de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is uniforme, evidence-based, diagnostiek en behandeling van early-onset neonatale infecties. Daartoe behoort ook het zorgvuldig inzetten van antibiotica waarbij rekening wordt gehouden met resistentieontwikkeling. Om hierover gefundeerde aanbevelingen te kunnen doen, wordt een samenvatting gegeven van de wetenschappelijke stand van zaken betreffende early-onset sepsis volgens de methode van evidence-based richtlijnontwikkeling.
Het uiteindelijke doel is dat dit leidt tot gezondheidswinst voor de patiënt (reductie mortaliteit en morbiditeit) maar ook tot besparingen in zorgkosten door het vermijden van onnodige diagnostiek en behandelingen, en mogelijk ook het verminderen van complicaties.
De richtlijn is bedoeld voor alle zorgverleners, maar met name kinderartsen, gynaecologen, verloskundigen en huisartsen die betrokken zijn bij de zorg voor neonaten gedurende de eerste levensdagen.
Doelgroep
De doelgroep omvat zwangeren en pasgeborenen ongeacht zwangerschapsduur die gedurende met name de eerste drie levensdagen een verhoogd risico hebben op of verdacht worden van een early-onset neonatale infectie.
Samenstelling werkgroep
- Dhr. dr. R.F. Kornelisse (projectleider), NVK sectie neonatologie, kinderarts-neonatoloog, Erasmus MC-Sophia, Rotterdam
- Mw. drs. M.K. Tuut, epidemioloog, projectadviseur, PROVA
- Mw. dr. L.M.A.J. Venmans, epidemioloog NVK
- Mw. dr. M.A.C. Hemels, NVK sectie neonatologie, kinderarts-neonatoloog, Isala Klinieken, Zwolle
- Mw. Prof. dr. Y.B de Rijke, NVKC, klinisch chemicus Erasmus MC-Sophia, Rotterdam
- Dhr. dr. T.B.Y. Liem, NVZA, ziekenhuisapotheker, UMC Utrecht - Wilhelmina Kinderziekenhuis
- Dhr. dr. T. van der Bruggen, NVMM, medisch microbioloog, UMC Utrecht,
- Mw. drs. G.E. Kolkman, KNOV, verloskundige-onderzoeker, coördinator richtlijnontwikkeling KNOV, Utrecht tot 1 juli 2015
- Mw. dr. J.B. de Boer, KNOV, psycholoog en beleidsmedewerker richtlijnontwikkeling KNOV, Utrecht vanaf 2 december 2015
- Mw. M. Estourgie, OGBS, oudervertegenwoordiger
- Dhr. drs. T. Njo, OGBS, oudervertegenwoordiger, arts klinische chemie, Saltro, Utrecht
- Dhr. dr. J.J. Duvekot, NVOG, gynaecoloog, Erasmus MC, Rotterdam
- Mw. drs. C.J. Miedema, NVK sectie infectieziekten en immunologie, kinderarts-infectioloog, Catharina Ziekenhuis, Eindhoven
- Mw. dr. M. Trijbels-Smeulders, persoonlijke titel, kinderarts Heideheuvel, Hilversum
Belangenverklaringen
De werkgroepleden hebben een belangenverklaring ingevuld. De verklaringen liggen ter inzage bij de NVK. Er zijn geen werkgroepleden uitgesloten van deelname aan discussies vanwege belangenverstrengeling.
Inbreng patiëntenperspectief
Het perspectief van patiënten/ouders is gewaarborgd doordat in de werkgroep de stichting Ouders Groep B Streptokokken (OGBS) vertegenwoordigd was.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De definitieve richtlijn is onder de verenigingen verspreid en via de website van de NVK (www.nvk.nl) elektronisch beschikbaar gesteld. Verder is er ter ondersteuning van de richtlijn een samenvatting voor ouders/verzorgers van patiënten gemaakt.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zijn interne indicatoren ontwikkeld aan de hand waarvan de implementatie steekproefsgewijs kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren. De interne indicatoren die bij onderhavige richtlijn zijn ontwikkeld worden behandeld bij de aanverwante producten van deze richtlijn.
Werkwijze
De ontwikkeling van deze richtlijn is gefinancierd door Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Gedurende de periode van februari 2014 tot juni 2017 is aan de ontwikkeling van deze richtlijn door leden van de werkgroep gewerkt.
De uiteindelijke tekst van de richtlijn is in juli 2015 ter commentaar voorgelegd aan de leden van de sectie neonatologie, sectie infectieziekten en immunologie, overige leden van de Nederlandse Vereniging voor Kindergeneeskunde (NVK) en aan andere wetenschappelijke verenigingen (NVOG, KNOV, NHG, NVMM, NVKC, NVZA) en de stichting Ouders groep B Streptokokken (OGBS)-patiënten/Patiëntenfederatie. Het commentaar is in de richtlijn verwerkt. De definitieve richtlijn is op 7 juni 2017 door de Nederlandse Vereniging voor Kindergeneeskunde geautoriseerd.
Zoeken (inter)nationale richtlijnen
In eerste instantie werd gezocht naar evidence-based richtlijnen gericht op de preventie en behandeling van early-onset infecties. Hierbij werd gebruik gemaakt van de volgende databases: Medline, SUMSEARCH, Clinical evidence van BMJ, Scottish Intercollegiate Guidelines Network en de TRIP DATABASE. De gevonden richtlijnen werden op kwaliteit beoordeeld met behulp van AGREE II (AGREE Next Stepts Consortium. Appraisal of Guidelines for Research & Evaluation (AGREE) II Instrument. 2013). Bij de beoordeling van de gevonden richtlijnen, kwam de in 2012 verschenen internationale richtlijn van NICE “Antibiotics for early-onset neonatal infection: antibiotics for the prevention and treatment of early-onset neonatal infection” als beste naar voren (National Collaborating Centre for Women's and Children's Health, 2012). Vanwege de goede kwaliteit van deze richtlijn, is deze nieuwe richtlijn hierop grotendeels gebaseerd, zonodig geactualiseerd (evidence) en aangepast (van bewijs naar aanbeveling) aan de Nederlandse situatie. Tevens is ervoor gezorgd dat deze richtlijn goed aansluit bij andere NVK-richtlijnen.
Knelpunten en aanvullende vragen
Er werd door de leden van de werkgroep een knelpuntenanalyse uitgevoerd om de huidige werkwijze ten aanzien van de diagnostiek en behandeling bij neonatale sepsis in Nederland in kaart te brengen. Hiertoe werden de werkgroepleden gevraagd om een top 3 van knelpunten aan te leveren. Een compleet overzicht van de aangedragen knelpunten is opgenomen in de aanverwante producten (Kennislacunes). De resultaten werden besproken tijdens een werkgroepvergadering. Op basis hiervan werden de uitgangsvragen opgesteld. Vervolgens werd per vraag bekeken of gebruik gemaakt kon worden van informatie uit de NICE richtlijn en werd zonodig een (aanvullend) literatuuronderzoek uitgevoerd. Er zijn een aantal aanvullende searches gedaan op de NICE richtlijn. Het betreft searches naar maternale koorts bij epidurale analgesie als risicofactor voor neonatale sepsis (vraag 3), de inzet van een lumbaalpunctie (vraag 7b) en de optimale empirische behandeling met antibiotica waarbij rekening wordt gehouden met de ontwikkeling van antibiotica resistentie (zie vraag 8).
Ten opzichte van de NICE richtlijn zijn twee aanvullende vragen geformuleerd die niet in de NICE richtlijn terugkomen. De eerste vraag gaat over het gebruik van een GBS-sneltest bij maternale risicofactoren ten aanzien van een early-onset neonatale GBS infectie (vraag 4). De tweede vraag heeft betrekking op het beleid bij de pasgeborene indien de zwangere antepartum of durante partu antibiotica heeft gekregen (vraag 11).
Nadat de evidence was samengevat en gegradeerd, werden door de werkgroep aanbevelingen geformuleerd. Naast de evidence werden hierbij overwegingen uit de praktijk, die expliciet genoemd werden, meegenomen. Voorbeelden hiervan zijn patiëntenvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties, veiligheid en kostenoverwegingen.
Zoeken artikelen
Bij de vragen waarvoor een search werd gedaan wordt beschreven welke databases en zoektermen zijn gebruikt en welke zoekperiode is aangehouden. Bij de literatuurselectie zijn alle relevante studies meegenomen, ongeacht de definitie van infectie, sepsis en early-onset.
Eerst werd gezocht naar de hoogste mate van bewijs: systematische reviews en gerandomiseerd en gecontroleerd onderzoek. Als dat niets opleverde, werd verder gezocht naar observationele artikelen (prospectief en retrospectief cohortonderzoek en patiënt-controle onderzoek). Er werd niet gezocht naar onderzoek van een nog lager niveau van bewijs, zoals case studies en dierexperimenteel onderzoek. De gebruikte literatuur is samengevat in de evidence tabellen. Alleen literatuur die voldoende valide en toepasbaar was, werd meegenomen in de richtlijn.
Beoordeling artikelen
De searches bij interventievragen werden met behulp van de GRADE methodiek uitgewerkt. Hierbij werd uitgegaan van de uitkomstmaten die in de NICE richtlijn werden beschreven. Resultaten werden per uitkomstmaat samengevat, waarbij tevens de ‘overall’ kwaliteit van de onderliggende bewijslast (evidence) werd aangegeven. Bij de beoordeling werd gebruik gemaakt van de software “GRADE-pro”. Met behulp van dit programma werd bij elke uitgangsvraag een tabel met bevindingen (“summary of findings”) en een tabel met de beoordeling van het bewijs (“GRADE evidence profile”) gemaakt (zie de evidence tabellen).
GRADE kent vier niveaus: ‘high’, ‘moderate’, ‘low’ en ‘very low’. Per uitkomst werd een GRADE niveau toegekend. Wanneer een uitkomst als ‘high’ geclassificeerd werd, wil dit zeggen dat het onwaarschijnlijk is dat toekomstig onderzoek de schatting van de uitkomst zal veranderen. Met andere woorden, er is veel vertrouwen in de juistheid van de schatting van de uitkomst. Een ‘very low’ classificatie wil zeggen dat er veel onzekerheid is over de juistheid van de uitkomst. Voor een uitgebreidere beschrijving van GRADE verwijzen we naar www.gradeworkinggroup.nl en het artikel van Guyatt (Guyatt, 2008).
Uitgangsvragen
De uitgangsvragen en aanbevelingen in de huidige richtlijn zijn gebaseerd op de NICE richtlijn. In deze nieuwe richtlijn is de indeling enigszins aangepast. Toegevoegd zijn 2 hiervoorgenoemde uitgangsvragen, te weten vraag 4 en 11. Uiteindelijk zijn de volgende uitgangsvragen uitgewerkt:
1. Welke informatie en ondersteuning dienen ouders en/of zorgverleners te krijgen bij (de verdenking op) een early-onset neonatale infectie?
2. Wat zijn indicaties voor intrapartum profylactische behandeling met antibiotica ter preventie van early-onset neonatale infecties?
3. Is maternale koorts bij epidurale analgesie een risicofactor voor early-onset neonatale infectie?
4. Wat is de indicatie voor het uitvoeren van een GBS-sneltest bij de moeder?
5. Wat zijn de maternale en foetale risicofactoren op een early-onset neonatale infectie? Welke neonatale symptomen geven een verhoogd risico op een daadwerkelijke early-onset infectie?
6. Is routinematige antibiotische profylaxe geïndiceerd bij neonaten met maternale risicofactoren om een early-onset infectie te voorkomen?
7a. Welk laboratoriumonderzoek kan beleidsbepalend zijn of een asymptomatische neonaat met risicofactoren of een neonaat met klinische symptomen met antibiotica moet worden behandeld?
7b. Dient een lumbaalpunctie (LP) te worden gedaan voorafgaand aan de behandeling van neonaten met symptomen en neonaten met significante risicofactoren zonder symptomen? En wanneer dient een LP te worden gedaan bij neonaten die behandeld worden?
8. Wat is de meest effectieve en veilige behandeling met antibiotica bij een (verdenking op) early-onset neonatale infectie?
9. Wat is de optimale behandelingsduur met antibiotica bij neonaten:
- met een bewezen early-onset infectie (bloedkweek positief)?
- met een verdenking op early-onset infectie op basis van klinische symptomen zonder dat er een bacteriële oorzaak is vastgesteld?
- die antibiotische profylaxe op basis van maternale risicofactoren krijgen maar asymptomatisch zijn?
10. Therapeutic drug monitoring (TDM) van aminoglycosiden
11. Hoe dient een neonaat met een verdenking op early-onset infectie behandeld te worden indien antepartum antibiotica is gegeven?
Kostenimplicaties
Door de toenemende aandacht voor de kosten in de gezondheidszorg neemt het belang van richtlijnen die doelmatig handelen bevorderen toe. In deze richtlijn is geen analyse gemaakt van de verwachte effecten op de kosten.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence’ gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien deze aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt’, kunnen zorgverleners op basis van hun professionele autonomie zonodig afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.


