Logistiek rondom ROP screening
Uitgangsvraag
Welke logistieke aspecten ten aanzien van prematuren retinopathie (ROP) screening zijn van belang om het kind optimaal te kunnen begeleiden en het proces efficiënt te laten verlopen?
- Randvoorwaarden afdeling/ ziekenhuis voor screening:
- Verpleegkundig personeel
- Materialen
- Screenende oogartsen
- Wat is het effect van (interventies voor optimaal comfort?
- Hoe wordt de eerste screeningsafspraak geregeld?
- Hoe wordt gezorgd voor optimale mydriasis en lokale pijnbestrijding?
Aanbeveling
A. Randvoorwaarden voor screening.
Beperk de belasting voor het kind op de dag van ROP screening. Houd rekening met het plannen van andere interventies.
Een ervaren zorgverlener assisteert de oogarts zodat tijdens de screening het kind goed gepositioneerd wordt.
Zorg voor maximaal comfort tijdens screening, door middel van sucrose, speen, moedermelk en/of inbakeren van het kind.
Bespreek met ouders/verzorgers en assisterende zorgverlener hoe optimale efficiëntie bereikt en comfort geboden kan worden, bepaal samen welke maatregelen worden ingezet voor kind en ouders en bespreek de rolverdeling bij uitvoeren van het onderzoek.
Monitor de saturatie en hartslag tijdens het onderzoek als dit plaatsvindt tijdens klinische opname en overweeg extra maatregelen voor comfort bij instabiliteit.
B. Inzet van interventies voor optimaal comfort
Gebruik bij voorkeur niet-medicamenteuze interventies voor optimaal comfort van het kind.
C. Hoe wordt de eerste screeningsafspraak geregeld?
Maak lokale afspraken over de logistiek voor het regelen van de eerste- en de vervolg screening en het opvangen van acute situaties.
Plan direct een nieuwe afspraak als een screeningsonderzoek niet door kan gaan.
Leg deze afspraken schriftelijk vast.
D. Druppelen voor mydriasis en lokale pijnbestrijding
Dien vanaf 1 uur voor screening mydriatica toe. Geef beiderzijds 1 druppel tropicamide 0.5% en 1 druppel fenylefrine 2.5%. Herhaal dit na 15 minuten en doe dit in totaal 2 of 3 keer.
Informeer de oogarts als de pupil niet wijd wordt bij druppelen.
Houd gedurende 2-3 uur na druppelen van mydriatica rekening met meer lichtgevoeligheid.
Dien tenminste 30 seconden voor het plaatsen van de ooglidspreider een lokaal anestheticum toe.
Overwegingen
A. Randvoorwaarden afdeling /ziekenhuis voor screening.
Maatregelen dienen genomen te worden om ervoor te zorgen dat het onderzoek zo efficiënt en snel mogelijk uitgevoerd kan worden. Het is belangrijk dat de oogarts vakkundig geassisteerd wordt bij het onderzoek. Betrek zo mogelijk een NIDCAP specialist om een individueel zorgplan te maken.
Het is aan de zorgverlener om samen met de ouders in te schatten of ouders kunnen assisteren tijdens de screening. Als ouders bij het onderzoek aanwezig willen zijn, mogen zij hun kind troosten. Door de zorgverleners kan comfort geboden worden door middel van sucrose, inbakeren of een speen.
Het toedienen van een lokaal anestheticum vermindert de pijn tijdens het plaatsen van de ooglidspreider.
Een addendum over positionering en aandacht voor het kind is toegevoegd (bijlage Comfort maatregelen tijdens screening.
Screeningen vinden zowel plaats in een klinische als een poliklinische setting. De logistiek en het personeel kunnen dan ook verschillen.
Verpleegkundig personeel:
Afdeling Neonatologie:
De verpleegkundige met de zorg voor het betreffende kind geeft pupil verwijdende druppels (zie overweging bij D. Druppelen voor mydriasis en lokale pijnbestrijding) en zorgt ervoor dat het kind zo gepresenteerd wordt dat optimaal onderzoek mogelijk is en dat het kind het tijdens het onderzoek zo comfortabel mogelijk heeft. De verpleegkundige zorgt ervoor dat het kind zo gepositioneerd wordt dat het oogheelkundig onderzoek naar behoren uitgevoerd kan worden.
De verpleegkundige meet de zuurstofsaturatie en hartfrequentie tijdens screeningen stabiliseert het kind bij een daling van de hartfrequentie of saturatie volgens de richtlijn van het eigen ziekenhuis.
Poliklinische controle:
Het is aan de zorgverlener om samen met de ouders in te schatten of en op welke wijze ouders kunnen assisteren tijdens de screening. Ondersteuning tijdens de screening kan gedaan worden door technisch oogheelkundig assistent of verpleegkundige/doktersassistente van de polikliniek, die druppelt, hulp biedt bij positionering tijdens het spiegelen en het kind en de ouders ondersteunt.
Materiaal;
1. Druppels:
- mydriatica (tropicamide 0.5% en fenylephrine 2.5%)
- lokaal anaestheticum bijvoorbeeld oxybuprocaine
2. Ooglidspreider; 1 steriele spreider per kind of disposable (door verschillende firma’s leverbaar)
3. Indirecte opthalmoscoop of funduscamera
4. Indentator om oog te draaien, alleen indien noodzakelijk voor vervolg beleid
5. Materiaal om kind te ondersteunen: speen, sucrose, inbakerdoek, moedermelk
6. Lokale afspraken over hoe te handelen in geval van acuut (levensbedreigend) probleem tijdens of ten gevolge van de screening
Screenende oogartsen
Oogartsen die screening verrichten zullen over de juiste competenties en kennis moeten beschikken. Dit betekent dat de screenende oogarts in staat is om het netvlies van een prematuur geborene te beoordelen, ROP kan classificeren volgens de ICROP3 en op de hoogte moet zijn van het geldende screeningsprotocol en de behandelindicaties. Wanneer de screening wordt uitgevoerd door een oogarts in opleiding dient deze te beschikken over een ‘objective structured assessment of technical skills (OSATS)’, waarbij vastgesteld is dat de ROP screening zelfstandig uitgevoerd kan worden. Als de oogarts inschat dat de aangeboden problematiek de eigen competenties overstijgt, dient advies gevraagd te worden aan een collega of centrum met meer expertise.
B. Inzet van interventies voor optimaal comfort
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het is tot op heden onduidelijk of er verschillen zijn in saturatie, pijn, hartslag en bloeddruk bij het gebruik van niet-medicamenteuze pijnmanagement versus medicamenteuze pijnmanagement bij kinderen die screening voor prematuren retinopathie (ROP) ondergaan. Er is daarom literatuuronderzoek verricht. In totaal zijn er 8 studies gevonden die vijf verschillende vergelijkingen in pijnmanagement vergelijken, namelijk:
- moedermelk versus sucrose (Mirlashari, 2021; Turan, 2021; Sener Taplak, 2017);
- inbakeren met moedermelk versus inbakeren met sucrose (Dolgun, 2017);
- huid-op-huid contact versus standaard zorg (Sun, 2020; Kristoffersen, 2019);
- moedermelk versus moedermelk en paracetamol (Naik, 2021);
- moedermelk met standaard zorg versus standaard zorg alleen (Rosali, 2015).
Er zijn klinisch relevante verschillen gevonden voor de cruciale uitkomstmaat pijn in drie vergelijkingen, namelijk voor moedermelk versus sucrose, huid-op-huid contact versus standaard zorg en moedermelk met standaard zorg versus standaard zorg alleen. De totale bewijskracht, de laagste bewijskracht voor de cruciale uitkomstmaat, is laag door studie limitatie en de geringe patiënten aantallen. Op basis van dit resultaat is er geen duidelijke voorkeur voor niet-medicamenteuze pijnmanagement of medicamenteuze pijnmanagement. Er zijn echter ook andere overwegingen die bijdragen aan de keuze voor type pijnmanagement. Eerste voorkeur is niet-medicamenteus vanwege lage kans op bijwerkingen en lokale toediening werkt sneller dan systemische medicatie. Er is geen bewijs dat paracetamol een toegevoegde waarde heeft bij ROP screening.
Voor een optimaal verlopende screening is het comfort van een kind heel belangrijk. Daarom wordt geadviseerd om maatregelen nemen die zorgen voor optimaal comfort, zoals inbakeren, sucrose, moedermelk en een speen. Er zijn verschillende mogelijkheden, die in combinatie gebruikt kunnen worden, waarbij uit literatuuranalyse blijkt dat er in effectiviteit geen duidelijke verschillen zijn tussen de verschillende technieken.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De manier waarop aan het kind comfort wordt geboden tijdens de screening dient in samenspraak met de ouders bepaald te worden. Goede uitleg en comfort aan ouders heeft effect op de ontspanning van hen en daarmee op het kind. Op deze wijze kunnen de ouders bijdragen aan comfort van het kind, waardoor de zorgverleners zich op hun rol kunnen richten. Daarnaast zijn ook praktische overwegingen belangrijk om mee te nemen zodat de screening niet alleen zo comfortabel mogelijk maar ook zo efficiënt mogelijk kan verlopen. Dit is voor zowel kind, ouders, verpleging als oogarts belangrijk.
Kosten (middelenbeslag)
De kosten van medicamenteuze of niet-medicamenteuze ondersteuning ontlopen elkaar niet veel. Borstvoeding is hierbij het goedkoopste, maar sucrose of paracetamol zijn geen dure middelen en zijn aanwezig op de afdeling.
Aanvaardbaarheid, haalbaarheid en implementatie
De hierboven genoemde interventies zijn haalbaar in de dagelijkse praktijk omdat ze veelal al worden toegepast en/of al aanwezig zijn op de afdeling. Het is vooral belangrijk dat er een bewustwording is voor het comfort van het kind tijdens de screening en welke middelen hiervoor te gebruiken zijn.
C. Hoe wordt de eerste screeningsafspraak geregeld?
Omdat er veel verschillen zijn per ziekenhuis, is het belangrijk dat er goede lokale afspraken gemaakt worden. Deze afspraken dienen bij voorkeur schriftelijk te worden vastgelegd.
Bij opgenomen patiënten: afdelingsarts geeft opdracht, bv aan afdelingssecretaresse, om consult aan te vragen bij oogarts.
De kinderarts-neonatoloog is ervoor verantwoordelijk dat het moment van eerste screeningsonderzoek bij de geboorte wordt ingepland en overgedragen bij overplaatsing.
Zodra een kind eenmaal door de oogarts is gezien, is de oogarts verantwoordelijk voor
- schriftelijk terugkoppelen aan de aanvrager van het consult van de bevindingen en de datum waarop vervolg controle geïndiceerd is.
- het regelen van eventuele vervolg afspraken zolang het kind opgenomen is in het eigen ziekenhuis.
De hoofdbehandelaar (kinderarts-neonatoloog) is verantwoordelijk voor:
- het opnieuw in consult vragen van de oogarts als een kind na ontslag weer opgenomen wordt
- de garantie dat bij overplaatsing naar een ander ziekenhuis de oogheelkundige follow-up kan plaats vinden.
- het opnemen van specifieke informatie over de bevindingen van de oogarts en de datum/week van volgende controle in de overplaatsingsbrief.
- vermelden in de overplaatsingsbrief dat ROP-screening nog niet heeft plaats gevonden.
- het regelen van een poliklinische controle afspraak bij de oogarts op de afgesproken termijn als het kind ontslagen wordt naar huis.
D. Druppelen voor mydriasis en lokale pijnbestrijding
- De afdelingsverpleegkundige druppelt de nog opgenomen kinderen. Kinderen die poliklinisch zijn komen 1 uur voor afspraak om te druppelen conform voorschrift oogarts. De lokale situatie bepaalt waar dit gebeurt.
- Beiderzijds wordt 1 druppel tropicamide 0.5% en 1 druppel fenylefrine 2.5% gedruppeld.
- Het druppelen begint 1 uur voordat screening zal plaatsvinden. Maak lokaal afspraken over communicatie over start druppelen. Beiderzijds 1 druppel tropicamide 0.5% en 1 druppel fenylefrine 2.5%; na 15 minuten herhalen, dit dient 2 of 3 keer herhaald te worden (bij kinderen met donker gekleurde iris in elk geval 3 keer). Het is belangrijk dat de druppel in aanraking met het oog komt voor optimale werking. Bij twijfel wordt een extra druppel gegeven. Als er geen mydriasis optreedt en er wel goed gedruppeld is, dient de oogarts op de hoogte gebracht te worden.
- Tenminste 30 seconden voordat de ooglidspreider wordt geplaatst wordt er gedruppeld met een lokaal anestheticum: Oxybuprocaine 0,4% (minim).
- Mydriasis duurt ongeveer 2-3 uur, tijdens deze tijd is een kind meer gevoelig voor licht.
Onderbouwing
Achtergrond
Het soepel laten verlopen van alle aspecten van de prematuren retinopathie (ROP) screening is heel erg belangrijk. Door duidelijke richtlijnen te geven voor dit proces, moet de kans dat kinderen niet worden gescreend of geen follow-up krijgen geminimaliseerd worden. Geen enkel ziekenhuis is hetzelfde georganiseerd; de lokale situatie zal dus altijd meegewogen moeten worden om ervoor te zorgen dat de volledige logistiek rondom het screenen goed geregeld is. Daarnaast is het belangrijk dat de screening zo min mogelijk belastend is voor het kind doordat het efficiënt verloopt.
Conclusies / Summary of Findings
- Randvoorwaarden afdeling/ziekenhuis voor screening
|
Niveau 2 |
ROP screening kan kortdurend effect hebben op hartslag en ademhaling bij de prematuur geborene. Het onderzoek dient zo kort mogelijk te duren en voorzorg maatregelen voor acute interventie moeten genomen zijn. |
|
Niveau 2 |
Voor pijnvermindering zou een lokaal anestheticum moeten worden toegediend 30 seconden voordat de ooglidspreider geplaatst wordt. |
B. Inzet van interventies voor optimaal comfort
Expressed breastmilk versus sucrose
Heart rate
|
Low GRADE |
Expressed breastmilk may result in little to no difference in the heart rate when compared with sucrose in children undergoing ROP screening.
Sources: Mirlashari, 2021; Turan, 2021; Sener Taplak, 2017 |
Blood pressure
|
No GRADE |
No evidence was found regarding the effect of expressed breastmilk on blood pressure when compared with sucrose in children undergoing ROP screening.
Sources: - |
Saturation
|
Moderate GRADE |
Expressed breastmilk likely results in little to no difference in saturation when compared with sucrose in children undergoing ROP screening.
Sources: Mirlashari, 2021; Turan, 2021; Sener Taplak, 2017 |
Pain
|
Low GRADE |
Expressed breastmilk may results in little to no difference in pain when compared to sucrose in children undergoing ROP screening.
Sources: Mirlashari, 2021; Turan, 2021; Sener Taplak, 2017 |
Swaddling with breast milk versus swaddling with sucrose
Heart rate, blood pressure, saturation
|
No GRADE |
No evidence was found regarding the effect of swaddling with breast milk on heart rate, blood pressure and saturation when compared with swaddling with sucrose in children undergoing ROP screening.
Sources: - |
Pain
|
Moderate GRADE |
Swaddling with breast milk likely results in little to no difference in pain when compared with swaddling with sucrose in children undergoing ROP screening.
Sources: Dolgun, 2017 |
Gentle Human Touch/skin-to-skin versus standard care
Heart rate
|
Low GRADE |
Standard care may result in little to no difference in heart rate when compared with Gentle Human Touch/skin-to-skin in children undergoing ROP screening.
Sources: Sun, 2020 |
Blood pressure
|
No GRADE |
No evidence was found regarding the effect of Gentle Human Touch/skin-to-skin on blood pressure when compared with standard care in children undergoing ROP screening.
Sources: - |
Saturation
|
Low GRADE |
Standard care may result in little to no difference in saturation when compared with Gentle Human Touch/skin-to-skin in children undergoing ROP screening.
Sources: Sun, 2020 |
Pain
|
Low GRADE |
Standard care may reduce the pain when compared with Gentle Human Touch/skin-to-skin in children undergoing ROP screening.
Sources: Sun, 2020; Kristoffersen, 2019 |
Expressed breastmilk versus expressed breastmilk and paracetamol
Heart rate, blood pressure, saturation
|
No GRADE |
No evidence was found regarding the effect of expressed breastmilk on heart rate, blood pressure and saturation when compared with expressed breastmilk and paracetamol in children undergoing ROP screening.
Sources: - |
Pain
|
Moderate GRADE |
Expressed breastmilk likely results in little to no difference in pain when compared with expressed breastmilk and paracetamol in children undergoing ROP screening.
Sources: Naik, 2021 |
Expressed breastmilk and standard care versus standard care alone
Heart rate, blood pressure, saturation
|
No GRADE |
No evidence was found regarding the effect of expressed breastmilk and standard care on heart rate, blood pressure and saturation when compared with standard care alone in children undergoing ROP screening.
Sources: - |
Pain
|
Moderate GRADE |
Expressed breastmilk and standard care likely reduces pain when compared with standard care alone in children undergoing ROP screening.
Sources: Rosali, 2015 |
Samenvatting literatuur
A systematic review of the literature was performed to answer the following question:
What is the effect of non-pharmacological pain management on the heart rate, blood pressure, saturation and pain in children undergoing retinopathy of pre-maturity (ROP) screening, compared to pharmacological pain management?
P: children undergoing ROP screening
I: non- pharmacological pain management (expressed breast milk, skin-to-skin
contact, swaddling and the use of a pacifier)
C: pharmacological pain management (local anesthesia eye drops, , topical
anesthesia) or sucrose
O: saturation, pain, heart rate and blood pressure
Relevant outcome measures
The guideline development group considered saturation and pain as a critical outcome measure for decision making; and heart rate and blood pressure as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
- Saturation: before and during screening
- Pain: measured with the PIPP- score, before and during screening
- Heart rate: before and during screening
- Blood pressure: before and during screening
The working group used the GRADE standard limit of 25% as a minimal clinically (patient) important difference for dichotomous outcomes and 10% for continuous variables.
Search and select (Methods)
The databases Embase.com and Ovid/Medline were searched with relevant search terms until 29-06-2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 208 hits. Studies were selected based on the following criteria: effect of non-pharmacological pain management on the optimal guidance of children undergoing ROP screening. 11 studies were initially selected based on title and abstract screening. After reading the full text, 3 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 8 studies were included.
Results
Eight studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Blood pressure
None of the included studies reported the outcome measure “Blood pressure” for the comparison expressed breast milk versus sucrose.
Saturation
Mirlashari (2021) did not report exact numbers but stated that there was no significant difference between the mean SpO2 and respiratory rate in the breast milk and sucrose group.
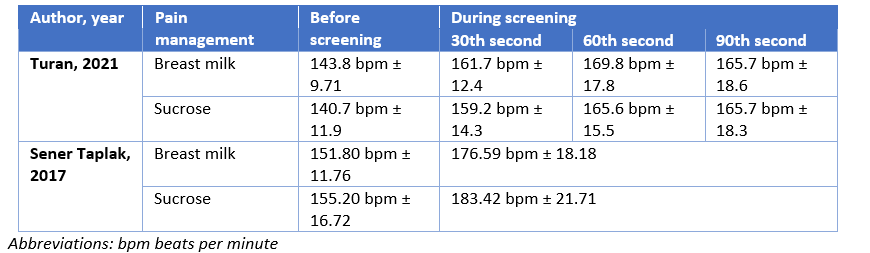
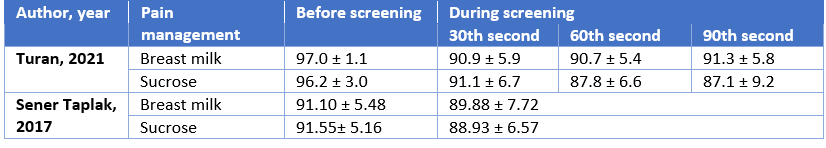
Turan (2021) reported a mean saturation of 97.0 ± 1.1 and 96.2 ± 3.0 before the examination in the breast milk (n=17) and sucrose group (n=17), respectively.
During the 30th second of the examination a mean saturation of 90.9 ± 5.9 and 91.1 ± 6.7 was reported in the breast milk and sucrose group, respectively.
During the 60th second of the examination a mean saturation of 90.7 ± 5.4 and 87.8 ± 6.6 was reported in the breast milk and sucrose group, respectively.
During the 90th second of the examination a mean saturation of 91.3 ± 5.8 and 87.1 ± 9.2 was reported in the breast milk and sucrose group, respectively.
30 seconds after examination a mean saturation of 94.1 ± 5.6 and 89.1 ± 9.5 was reported in the breast milk and sucrose group, respectively.
The mean difference at the 60th second was 2.90 (95% CI −1.15 to 6.95) favoring breast milk, which is not clinically relevant.
Sener Taplak (2017) reported a mean saturation of 91.10 ± 5.48 and 91.55 ± 5.16 before screening in the breast milk (n=20) and sucrose group (n=20), respectively.
During screening a mean saturation of 89.88 ± 7.72 and 88.93 ± 6.57 was reported in the breast milk and sucrose group, respectively.
After screening and mean saturation of 91.05 ± 7.88 and 88.30 ± 8.73 was reported in the breast milk and sucrose group, respectively.
The mean difference during screening was 0.95 (95% CI −3.58 to 5.48) favoring breast milk, which is not clinically relevant.
Table 2. Overview of results for the outcome measure saturation for the comparison expressed breastmilk versus sucrose.
Pain
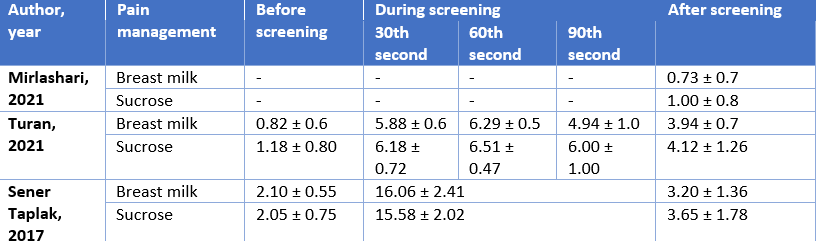
Mirlashari (2021) reported a mean PIPP score of 0.73 ± 0.7 and 1.00 ± 0.8 15 minutes after examination in the breast milk (n=21) and sucrose group (n=21), respectively. The mean difference after screening was -0.27 (95% CI −0.72 to 0.18) favoring breast milk, which is clinically relevant.
Turan (2021) reported a mean NIPS score of 0.82 ± 0.6 and 1.18 ± 0.80 before the examination in the breast milk (n=17) and sucrose group (n=17), respectively.
During the 30th second of the examination a mean NIPS score of 5.88 ± 0.6 and 6.18 ± 0.72 was reported in the breast milk and sucrose group, respectively.
During the 60th second of the examination a mean NIPS score of 6.29 ± 0.5 and 6.51 ± 0.47 was reported in the breast milk and sucrose group, respectively.
During the 90th second of the examination a mean NIPS score of 4.94 ± 1.0 and 6.00 ± 1.00 was reported in the breast milk and sucrose group, respectively.
30 seconds after examination a mean NIPS score of 3.94 ± 0.7 and 4.12 ± 1.26 was reported in the breast milk and sucrose group, respectively.
The mean difference at the 60th second was -0.22 (95% CI −0.55 to 0.11) favoring breast milk, which is not clinically relevant.
Sener Taplak (2017) reported a mean PIPP score of 2.10 ± 0.55 and 2.05 ± 0.75 before screening in the breast milk (n=20) and sucrose group (n=20), respectively.
During screening a mean PIPP score of 16.06 ± 2.41 and 15.58 ± 2.02 was reported in the breast milk and sucrose group, respectively.
After screening a mean PIPP score of 3.20 ± 1.36 and 3.65 ± 1.78 was reported in the breast milk and sucrose group, respectively.
The mean difference during screening was 0.48 (95% CI −0.90 to 1.86) favoring sucrose, which is not clinically relevant.
Table 3. Overview of results for the outcome measure pain for the comparison expressed breastmilk versus sucrose.
Swaddling with breast milk versus swaddling with sucrose
Heart rate
None of the included studies reported the outcome measure “heart rate” for the comparison swaddling with breast milk versus swaddling with sucrose.
Blood pressure
None of the included studies reported the outcome measure “blood pressure” for the comparison swaddling with breast milk versus swaddling with sucrose.
Saturation
None of the included studies reported the outcome measure “saturation” for the comparison swaddling with breast milk versus swaddling with sucrose.
Pain
Dolgun (2017) reported a mean PIPP score of 3.41 ± 0.63 and 3.00 ± 1.10 before screening in the swaddling with breast milk (n=29) and swaddling with sucrose group (n=29), respectively.
During screening a mean PIPP score of 8.45± 1.38 and 9.10 ± 1.82 was reported in the swaddling with breast milk and swaddling with sucrose group, respectively.
After screening a mean PIPP score of 4.86 ± 1.27 and 4.59 ± 1.64 was reported in the swaddling with breast milk and swaddling with sucrose group, respectively.
The mean difference during screening was -0.65 (95% CI –1.48 to 0.18) favoring swaddling with breast milk, which is not clinically relevant.
Gentle Human Touch/skin-to-skin versus standard care
Heart rate
Sun (2020) reported a maximum heart rate during examination of 182.64 bpm ± 18.49
and 170.79 bpm ± 22.18 in the Gentle Human Touch (n=28) and standard care group (n=38), respectively. The mean difference was 11.85 (95%CI 2.02 to 21.68) favoring standard care, which is not clinically relevant.
Blood pressure
None of the included studies reported the outcome measure “blood pressure” for the comparison Gentle Human Touch/skin-to-skin versus standard care.
Saturation
Sun (2020) reported a mean saturation during examination of 85.68 ± 8.31 and 91.89 ± 6.43 in the Gentle Human Touch (n=28) and standard care group (n=38), respectively. The mean difference was -6.21 (95%CI -9.91 to -2.51) favoring standard care, which is not clinically relevant.
Pain
Sun (2020) reported a mean reduction of the PIPP score from baseline of 6.29 ± 2.98 and 11.82 ± 3.47 in the Gentle Human Touch and standard care group, respectively.
In addition, a mean PIPP score during screening of 9.29 ± 2.89 and 14.82 ± 3.22 was reported in the Gentle Human Touch and standard care group, respectively.
The mean difference during screening was -5.53 (95%CI -7.01 to -4.05) favoring Gentle Human Touch, which is clinically relevant.
Kristoffersen (2019) reported a mean PIPP score of 10.2 and 10.3 during screening in the skin-to-skin and standard care group, respectively. A mean difference of 0.1 (95% CI 1.568 to 1.396) was reported. The difference was not clinically relevant.
After screening a mean PIPP score of 7.0 and 6.8 was reported in the skin-to-skin and standard care group, respectively. A mean difference of 0.2 (95% CI 1.09 to 1.49) was reported. The difference was not clinically relevant.
Expressed breast milk versus expressed breast milk and paracetamol
Heart rate
None of the included studies reported the outcome measure “heart rate” for the comparison expressed breast milk versus expressed breast milk and paracetamol.
Blood pressure
None of the included studies reported the outcome measure “blood pressure” for the comparison expressed breast milk versus expressed breast milk and paracetamol.
Saturation
None of the included studies reported the outcome measure “saturation” for the comparison expressed breast milk versus expressed breast milk and paracetamol.
Pain
Naik (2021) reported a mean PIPP score of 3.25 ± 1.71 and 3.45 ± 2.20 before screening in the expressed breast milk (n=30) and expressed breast milk plus paracetamol group (n=31), respectively.
In addition, a mean PIPP score after screening of 15.44 ± 2.05 and 15.83 ± 1.36 was reported in the expressed breast milk and expressed breast milk plus paracetamol group, respectively.
The mean difference after screening was -0.39 (95%CI -1.26 to 0.48) favoring expressed breast milk, which is not clinically relevant.
Expressed breast milk and standard care versus standard care alone
Heart rate
None of the included studies reported the outcome measure “heart rate” for the comparison expressed breast milk and standard care standard care alone.
Blood pressure
None of the included studies reported the outcome measure “blood pressure” for the comparison expressed breast milk and standard care standard care alone.
Saturation
None of the included studies reported the outcome measure “saturation” for the comparison expressed breast milk and standard care standard care alone.
Pain
Rosali (2015) reported a mean PIPP score of 3.85 ± 1.9 and 5.25 ± 1.78 at baseline in the expressed breast milk plus standard care (n=20) and standard care alone group (n=20), respectively.
During screening a mean PIPP score of 12.7 ± 1.7 and 15.3 ± 1.78 was reported in the
expressed breast milk plus standard care and standard care alone group, respectively.
One minute after screening a mean PIPP score of 6.2 ± 1.98 and 12.4 ± 2.41 was reported in the expressed breast milk plus standard care and standard care alone group, respectively.
Five minutes after screening a mean PIPP score of 3.2 ± 1.58 and 6.85 ± 2.41 was reported in the expressed breast milk plus standard care and standard care alone group, respectively.
The mean difference during screening was -2.60 (95%CI -3.68 to -1.52) favoring expressed breast milk plus standard care, which is clinically relevant.
Level of evidence of the literature
Expressed breastmilk versus sucrose
Heart rate
The level of evidence regarding the outcome measure heart rate comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels due to conflicting results and low number of included patients (imprecision), resulting in a level of evidence of low.
Blood pressure
The level of evidence regarding the outcome measure blood pressure could not be assessed.
Saturation
The level of evidence regarding the outcome measure saturation comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by one level due to low number of included patients (imprecision), resulting in a level of evidence of moderate.
Pain
The level of evidence regarding the outcome measure heart rate comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels due to conflicting results and low number of included patients (imprecision), resulting in a level of evidence of low.
Swaddling with breast milk versus swaddling with sucrose
Heart rate
The level of evidence regarding the outcome measure heart rate could not be assessed.
Blood pressure
The level of evidence regarding the outcome measure blood pressure could not be assessed.
Saturation
The level of evidence regarding the outcome measure saturation could not be assessed.
Pain
The level of evidence regarding the outcome measure pain comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by one level due to low number of included patients (imprecision), resulting in a level of evidence of moderate.
Gentle Human Touch/skin-to-skin versus standard care
Heart rate
The level of evidence regarding the outcome measure heart rate comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels due to study limitations (risk of bias) and low number of included patients (imprecision), resulting in a level of evidence of low.
Blood pressure
The level of evidence regarding the outcome measure blood pressure could not be assessed.
Saturation
The level of evidence regarding the outcome measure saturation comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels due to study limitations (risk of bias) and low number of included patients (imprecision), resulting in a level of evidence of low.
Pain
The level of evidence regarding the outcome measure pain comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels due to study limitations (risk of bias) and low number of included patients (imprecision), resulting in a level of evidence of low.
Expressed breastmilk versus expressed breastmilk and paracetamol
Heart rate
The level of evidence regarding the outcome measure heart rate could not be assessed.
Blood pressure
The level of evidence regarding the outcome measure blood pressure could not be assessed.
Saturation
The level of evidence regarding the outcome measure saturation could not be assessed.
Pain
The level of evidence regarding the outcome measure pain comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by one level due to low number of included patients (imprecision), resulting in a level of evidence of moderate.
Expressed breastmilk and standard care versus standard care alone
Heart rate
The level of evidence regarding the outcome measure heart rate could not be assessed.
Blood pressure
The level of evidence regarding the outcome measure blood pressure could not be assessed.
Saturation
The level of evidence regarding the outcome measure saturation could not be assessed.
Pain
The level of evidence regarding the outcome measure pain comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by one level due to low number of included patients (imprecision), resulting in a level of evidence of moderate.
C. Over het regelen van de eerste screeningsafspraak is geen literatuur gevonden.
D. Hoe wordt gezorgd voor optimale mydriasis en lokale pijnbestrijding?
Verschillende studies bestudeerden de effectiviteit en de veiligheid van diverse druppelprotocollen. Om goede mydriasis te krijgen wordt een combinatie toegediend van een parasympathicolyticum (tropicamide, cyclopentolaat) en een sympatheticomimeticum (fenylefrine). De verschillende combinaties zorgen voor goede mydriasis zonder significante systemische bijwerkingen (Wilkinson, 2009). In een artikel van Rush uit 2004 (Rush, 2004) wordt beschreven dat er geen systemische effecten te zien waren door het toedienen van Tropicamide 0,5 en Fenylefrine 2,5%. Voor het gebruik van cycloplentolaat is geen leeftijdsgrens meer van toepassing, maar er zijn bij prematuren betere alternatieven en daarom hiervoor kiezen (Tropicamide 0.5% en Fenylefrine 2.5%). Er gelden ook een aantal waarschuwingen zoals vermeld in het kinderformularium.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of non-pharmacological pain management on the heart rate, blood pressure, saturation and pain in children undergoing retinopathy of pre-maturity (ROP) screening, compared to pharmacological pain management?
P: children undergoing ROP screening
I: non- pharmacological pain management (expressed breast milk, skin-to-skin
contact, swaddling and the use of a pacifier)
C: pharmacological pain management (local anesthesia eye drops, , topical
anesthesia) or sucrose
O: saturation, pain, heart rate and blood pressure
Relevant outcome measures
The guideline development group considered saturation and pain as a critical outcome measure for decision making; and heart rate and blood pressure as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
- Saturation: before and during screening
- Pain: measured with the PIPP- score, before and during screening
- Heart rate: before and during screening
- Blood pressure: before and during screening
The working group used the GRADE standard limit of 25% as a minimal clinically (patient) important difference for dichotomous outcomes and 10% for continuous variables.
Search and select (Methods)
The databases Embase.com and Ovid/Medline were searched with relevant search terms until 29-06-2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 208 hits. Studies were selected based on the following criteria: effect of non-pharmacological pain management on the optimal guidance of children undergoing ROP screening. 11 studies were initially selected based on title and abstract screening. After reading the full text, 3 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 8 studies were included.
Results
Eight studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bates, J. H., & Burnstine, R. A. (1987). Consequences of retinopathy of prematurity examinations. Archives of Ophthalmology, 105(5), 618-619.
- Boyle, E. M., Freer, Y., Khan-Orakzai, Z., Watkinson, M., Wright, E., Ainsworth, J. R., & McIntosh, N. (2006). Sucrose and non-nutritive sucking for the relief of pain in screening for retinopathy of prematurity: a randomised controlled trial. Archives of Disease in Childhood-Fetal and Neonatal Edition, 91(3), F166-F168.
- Belda, S., Pallás, C. R., De la Cruz, J., & Tejada, P. (2004). Screening for retinopathy of prematurity: is it painful?. Neonatology, 86(3), 195-200.
- Bozlak ?, Dolgun G. Effect of Nonpharmacologic Pain Control During Examination for Retinopathy of Prematurity. J Obstet Gynecol Neonatal Nurs. 2017 Sep-Oct;46(5):709-715. doi: 10.1016/j.jogn.2017.06.008. Epub 2017 Jul 29. Erratum in: J Obstet Gynecol Neonatal Nurs. 2018 Jan;47(1):e3. PMID: 28765032.
- Clarke, W. N., Hodges, E., Noel, L. P., Roberts, D., & Coneys, M. (1985). The oculocardiac reflex during ophthalmoscopy in premature infants. American journal of ophthalmology, 99(6), 649-651.
- Dempsey, E., & McCreery, K. (2011). Local anaesthetic eye drops for prevention of pain in preterm infants undergoing screening for retinopathy of prematurity. Cochrane Database of Systematic Reviews, (9).
- Dhillon, B., Wright, E., & Fleck, B. W. (1993). Screening for retinopathy of prematurity: are a lid speculum and scleral indentation necessary?. Journal of Pediatric Ophthalmology & Strabismus, 30(6), 377-381.
- Gal, P., Kissling, G. E., Young, W. O., Dunaway, K. K., Marsh, V. A., Jones, S. M., ... & Ransom, J. L. (2005). Efficacy of sucrose to reduce pain in premature infants during eye examinations for retinopathy of prematurity. Annals of Pharmacotherapy, 39(6), 1029-1033.
- Grabska, J., Walden, P., Lerer, T., Kelly, C., Hussain, N., Donovan, T., & Herson, V. (2005). Can oral sucrose reduce the pain and distress associated with screening for retinopathy of prematurity?. Journal of Perinatology, 25(1), 33-35.
- Kristoffersen L, Støen R, Bergseng H, Follestad T, Theodorsson E, Vederhus B, Adde L, Austeng D. Skin-to-skin contact during eye examination did not reduce pain compared to standard care with parental support in preterm infants. Acta Paediatr. 2019 Aug;108(8):1434-1440. doi: 10.1111/apa.14699. Epub 2019 Jan 18. PMID: 30561825.
- Laws, D. E., Morton, C., Weindling, M., & Clark, D. (1996). Systemic effects of screening for retinopathy of prematurity. British journal of ophthalmology, 80(5), 425-428.
- Mitchell, A., Stevens, B., Mungan, N., Johnson, W., Lobert, S., & Boss, B. (2004). Analgesic effects of oral sucrose and pacifier during eye examinations for retinopathy of prematurity. Pain Management Nursing, 5(4), 160-168.
- Mirlashari, J., Holsti, L., Roohipoor, R., Kasaeian, A., & Safaiee Fakhr, A. (2021). Comparison of Breast Milk and Sucrose in Neonatal Pain Relief and Coping with Stress of ROP Examination Using ALPS-Neo. Iranian Journal of Neonatology IJN, 12(2), 46-55.
- Naik, A., D'Lima, A., Sreekumar, K., & Silveira, M. P. (2021). Efficacy of expressed breast milk alone or in combination with paracetamol in reducing pain during ROP screening: A randomized controlled trial. Journal of Clinical Neonatology, 10(2), 73.
- O'Sullivan, A., O'Connor, M., Brosnahan, D., McCreery, K., & Dempsey, E. M. (2010). Sweeten, soother and swaddle for retinopathy of prematurity screening: a randomised placebo controlled trial. Archives of Disease in Childhood-Fetal and Neonatal Edition, 95(6), F419-F422.
- Rosali, L., Nesargi, S., Mathew, S., Vasu, U., Rao, S. P., & Bhat, S. (2015). Efficacy of expressed breast milk in reducing pain during ROP screeninga randomized controlled trial. Journal of tropical pediatrics, 61(2), 135-138.
- Rush, R., Rush, S., Nicolau, J., Chapman, K., & Naqvi, M. (2004). Systemic manifestations in response to mydriasis and physical examination during screening for retinopathy of prematurity. American Journal of Ophthalmology, 138(5), 901-902.
- Rush, R., Rush, S., Ighani, F., Anderson, B., Irwin, M., & Naqvi, M. (2005). The effects of comfort care on the pain response in preterm infants undergoing screening for retinopathy of prematurity. Retina, 25(1), 59-62.
- Samra, H. A., & McGrath, J. M. (2009). Pain management during retinopathy of prematurity eye examinations: a systematic review. Advances in Neonatal Care, 9(3), 99-110.
- Sun, Y., Zhang, J., Chen, X., Yang, Y., Qiu, J., Lu, K. Y., & Cheng, R. (2020). Effectiveness of Gentle Human Touch for Pain Control During Examination for Retinopathy of Pre-maturity: A Randomized Controlled Trial. Frontiers in Pediatrics, 8.
- ?ener Taplak, A., & Erdem, E. (2017). A comparison of breast milk and sucrose in reducing neonatal pain during eye exam for retinopathy of prematurity. Breastfeeding Medicine, 12(5), 305-310.
- Turan, O., Akkoyun, I., Ince, D. A., Doganay, B., Tugcu, A. U., & Ecevit, A. (2021). Effect of breast milk and sucrose on pain and perfusion index during examination for retinopathy of prematurity. The Journal of Maternal-Fetal & Neonatal Medicine, 34(7), 1138-1142.
- Wilkinson, A. R., Haines, L., Head, K., & Fielder, A. R. (2009). UK retinopathy of prematurity guideline. Eye, 23(11), 2137-2139.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Mirlashari, 2021 |
Type of study: Double-blind randomized controlled trial
Setting and country: Single-centre, Iran
Funding and conflicts of interest: This project was funded by the School of Nursing and Midwifery, Tehran University of Medical Sciences, Tehran, Iran.
The authors declare that there is no conflict of interest in this study. |
Inclusion criteria: preterm neonates with a gestational age of ≤ 32 weeks and birth weight of ≤ 2,000 g
Exclusion criteria: neonatal need for cardiopulmonary resuscitation during ROP examinations.
N total at baseline: Intervention: 21 Control: 21
Important prognostic factors2: Gestational age (week) ± SD: Intervention: 30.3 ± 0.3 Control: 30.2 ± 0.3
Sex, male (%): Intervention: 9 (42.9) Control: 9 (42.9)
Groups comparable at baseline? Yes
|
Describe intervention:
0.5 ml/kg of breast milk 2 min before the examination
|
Describe control :
0.5 ml/kg of sucrose 2 min before the examination
|
Length of follow-up: 15 minutes
Loss-to-follow-up: None
Incomplete outcome data: None
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Heart rate The mean heart rate was significantly lower in the breast milk group in comparison to those reported for the other two groups (P<0.05; figure 4)
2. Blood pressure Not reported
3. Saturation There was no significant difference between the mean SpO2 and respiratory rate in the three groups (P>0.05; figures 2)
4. PIPP, 15 min after examination, mean ± SD: I: 0.73 ± 0.7 C: 1.00 ± 0.8
|
Author’s conclusion: Breast milk was more effective in the reduction of pain and stress after ROP examinations, compared to sucrose or distilled water. |
|
Turan, 2021 |
Type of study: randomized controlled trial
Setting and country: single centre, Turkey
Funding and conflicts of interest:
No potential conflict of interest was reported by the authors.
|
Inclusion criteria: preterm infants who were hospitalized in the neonatal intensive care unit and whose gestational week was <32 weeks and birth weight were <1500 g.
Exclusion criteria: major congenital anomalies, chromosomal abnormality, intraventricular hemorrhage, and on ventilator support.
N total at baseline: Intervention: 17 Control: 17
Important prognostic factors2: Gestational age (weeks) ± SD: I: 30.12 ± 2.20 C: 28.47 ± 2.21
Sex, female/male (n/%): I: 9 (52.9)/8 (47.1) C: 7 (41.2)/10 (58.2)
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
proparacaine HCl ophthalmic solution 0.5% plus breast milk
|
Describe control (treatment/procedure/test):
proparacaine HCl ophthalmic solution 0.5% plus sucrose 24%. |
Length of follow-up: 90 seconds
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Heart rate, mean ± SD: Before the examination I: 143.8 ± 9.71 C: 140.7 ± 11.9
30th s I: 161.7 ± 12.4 C: 159.2 ± 14.3
60th s I: 169.8 ± 17.8 C: 165.6 ± 15.5
90th s I: 165.7 ± 18.6 C: 165.7 ± 18.3
30 s after examination I: 159.6 ± 14.4 C: 160.8 ± 17.8
2. Blood pressure Not reported
3. Saturation, mean ± SD: Before the examination I: 97.0 ± 1.1 C: 96.2 ± 3.0
30th s I: 90.9 ± 5.9 C: 91.1 ± 6.7
60th s I: 90.7 ± 5.4 C: 87.8 ± 6.6
90th s I: 91.3 ± 5.8 C: 87.1 ± 9.2
30 s after examination I: 94.1 ± 5.6 C: 89.1 ± 9.5
4. NIPS, 15 mean ± SD: Before the examination I: 0.82 ± 0.6 C: 1.18 ± 0.80
30th s I: 5.88 ± 0.6 C: 6.18 ± 0.72
60th s I: 6.29 ± 0.5 C: 6.51 ± 0.47
90th s I: 4.94 ± 1.0 C: 6.00 ± 1.00
30 s after examination I: 3.94 ± 0.7 C: 4.12 ± 1.26
|
Author’s conclusion: The present study indicates that alterations may be seen in PI during the ROP examination: in other words, peripheral tissue perfusion could be affected. We consider that eye examination is a very painful procedure, and administering breast milk, sucrose or local anesthetic is not sufficient for reducing pain. |
|
Dolgun, 2017 |
Type of study: randomized controlled trial
Setting and country: single centre, Turkey
Funding and conflicts of interest:
The authors report no con- flict of interest or relevant financial relationships.
|
Inclusion criteria: gestational age less than 32 weeks and body weight less than 1,500 g, parent approval on the consent form, no requirement for invasive or noninvasive mechanical ventilator support during the procedure, no intake of analgesic or sedative drug in the past 24 hours, no contra- indications to oral feeding, and no congenital abnormalities.
Exclusion criteria: Not reported
N total at baseline: Intervention: 29 Control: 29
Important prognostic factors2: Gestational age, weeks ± SD: I: 30.2 ± 1.6 C: 29.9 ± 2.1
Birth weight, grams ± SD: I: 1048.3 ± 293.9 C: 1045.8 ± 372.6
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Swaddling with orally administered breast milk
|
Describe control (treatment/procedure/test):
Swaddling with orally administered 0.2 ml of 24% sucrose
|
Length of follow-up: Not reported
Loss-to-follow-up: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Heart rate Not reported
2. Blood pressure Not reported
3. Saturation Not reported
4. PIPP Before the examination I: 3.41 ± 0.63 C: 3.00 ± 1.10
During examination I: 8.45 ± 1.38 C: 9.10 ± 1.82
After examination I: 4.86 ± 1.27 C: 4.59 ± 1.64
|
Author’s conclusion: Infant swaddlings with oral administration of sucrose or breast milk were no more effective than swaddling with oral administration of distilled water to reduce pain in premature infants during ROP examinations.
|
|
Sun. 2020 |
Type of study: randomized controlled trial
Setting and country: single centre, China
Funding and conflicts of interest: This work was supported by the Project of Nanjing Special Fund for Health Science and Technology Development (grant no. 201723007). The Foundation only provided experimental financial support and does not interfere with experimental conduct and data.
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest. |
Inclusion criteria: pre-mature birth with a gestational age of ≤34 weeks or a birth weight of ≤2,000g, no prior history of fundus screening, and screening at 4–6 weeks of age after birth or a corrected gestational age of 31–32 weeks.
Exclusion criteria: administration of non-steroidal anti- inflammatory drugs or sedative and anti-epileptic drugs such as chloral hydrate, phenobarbital, and diazepam within 24h before ROP screening; intolerance to screening because of critical conditions such as severe respiratory diseases, central nervous system infections, sepsis, and other organic diseases such as severe congenital heart malformation and pulmonary insufficiency.
N total at baseline: Intervention: 41 Control: 41
Important prognostic factors2: Gestational age, weeks ± SD: I: 29.88 ± 0.40 C: 30.03 ± 0.40
Sex ratio m/f: I: 20/18 C: 14/14
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Receiving Gentle Human Touch during screening
|
Describe control (treatment/procedure/test):
screened according to the routine procedure.
|
Length of follow-up: Not reported
Loss-to-follow-up: Intervention: 13 (37.7%) Reasons (describe) Withdrew consent (n=9) Withdrew due to intolerance of examination
Control: 3 (7.3%) Reasons (describe) Withdrew consent (n=3)
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Heart rate changes before and after examination, time/min: I: 170.80 ± 3.50 C: 182.60 ± 3.50
2. Blood pressure Not reported
3. Saturation during examination: I: 85.68 ± 8.31 C: 1.89 ± 6.43
4. PIPP: Reduction from baseline I: 6.29 ± 2.98 C: 11.82 ± 3.47
During screening I: 9.29 ± 2.89 C: 14.82 ± 3.22
|
Authors conclusion: In conclusion, the findings of this study suggest that Gentle
|
|
Kristoffersen, 2019 |
Type of study: randomized controlled trial
Setting and country: single centre, Norway
Funding and conflicts of interest:
This study was funded by the Liaison Committee between the Central Norway Regional Health Authority and the Norwegian University of Science and Technology.
None of the authors have any conflicts of interest to disclose. |
Inclusion criteria: preterm infants with a GA of less than 32 weeks who were eligible for ROP screening and admitted to St Olavs University Hospital, Trondheim, Norway, between January 2014 and June 2016
Exclusion criteria: - They were given any sedative or analgesic medication at the time of the ROP screening or had a severe intraventricular haemor- rhage (grade 3–4) - examined only with an indirect ophthalmoscopy and not with digital imaging by RetCam - Infants with insufficient data recordings
N total at baseline: Intervention: 21 Control:25
Important prognostic factors2: Gestational age, median ± SD: 28+6weeks
Groups comparable at baseline? Unknown
|
Describe intervention (treatment/procedure/test): Skin-to-skin with one of the parents
|
Describe control (treatment/procedure/test):
standard care with supportive positioning by parents
|
Length of follow-up: Up to 17 days
Loss-to-follow-up: Intervention: 5 (23.8%) Reasons: Not assessable (n=5)
Control: 6 (24%) Reasons: Withdrew consent after first eye-examination (n=1) Not assessable (n=5)
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Heart rate: Not reported
2. Blood pressure Not reported
3. Saturation: Not reported
4. PIPP, mean: During screening I: 10.2 C: 10.3 mean difference of 0.1 and a 95% confidence interval (95% CI) of 1.568 to 1.396, p = 0.91
After screening I: 7.0 C: 6.8 mean difference 0.2, 95% CI: 1.09 to 1.49, p = 0.76
|
Authors conclusion: Skin-to-skin contact during ROP examination did not give additional pain relief compared to standard care with parental support in preterm infants. The pain scores were lower than in comparable studies, and we speculate whether active parental involvement had a pain reducing effect in both groups. Further studies are needed to determine the most efficient multidimensional approach to reduce pain in preterm infants undergoing ROP screen- ing.
|
|
Naik, 2021 |
Type of study: randomized controlled trial
Setting and country: single centre, India
Funding and conflicts of interest: Financial support and sponsorship Nil.
There are no conflicts of interest.
|
Inclusion criteria: gestational age (assessed using New Ballard Score) <34 weeks and/or birth weight <1500 gm
Exclusion criteria: Infants requiring mechanical ventilation at the time of ROP screening or receiving sedatives or narcotics, neonates not receiving oral feeds, and neonates with congenital anomalies
N total at baseline: Intervention: 31 Control: 30
Important prognostic factors2: Gestational age (weeks) ± SD: I: 33.35 ± 2.12 C:33.46 ± 2.11
Sex: I: 54.8% M C: 56.7% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
2 ml expressed breast milk (EBM) through a sterile syringe orally 2 min prior to procedure
|
Describe control (treatment/procedure/test):
syrup paracetamol, 15 mg/kg 30 min prior to procedure and EBM
|
Length of follow-up: Not reported
Loss-to-follow-up: None
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Heart rate: Not reported
2. Blood pressure Not reported
3. Saturation: Not reported
4. PIPP, mean: Before screening I: 3.25 ± 1.71 C: 3.45 ± 2.20
After screening I: 15.44 ± 2.05 C: 15.83 ± 1.36 |
Authors conclusion: The procedure of ROP screening causes significant pain in premature neonates which is demonstrated by PIPP scores of >12 across all groups. There were no significant statistical differences noted in the PIPP scores between the control groups and the intervention groups, Group B and Group C. This indicates that breastmilk alone or in combination with paracetamol is inadequate to relieve the severe pain associated with the procedure of ROP screening. The PIPP score following the procedure in all the three groups was >7, and this indicates that there was the persistence of slight to moderate pain which lasted for up to 2 min following the procedure.
|
|
Rosali, 2015 |
Type of study: randomized controlled trial
Setting and country: single centre, India
Funding and conflicts of interest: Not reported
|
Inclusion criteria: Babies with a gestational age of less than 35 weeks (as assessed by New Ballard Score), birth weight less than 2000g, requiring an ROP screening and who were on at least partial oral feeds
Exclusion criteria: Newborns on opioid analgesics, sedatives, anticonvulsants or on mechanical ventilation
N total at baseline: Intervention: 20 Control: 20
Important prognostic factors2: Gestational age (weeks) ± SD: I: 31.5 6 2.4 C: 30.3 6 1.89
Birth weight (grams) ± SD: I: 1426 .7 6 366.7 C: 1285.2 6 245.6
Sex: I: 35% M C: 50% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
2ml of EBM orally by paladai, (a small cup used to feed neonates) 2 min prior to the procedure along with standard practice.
|
Describe control (treatment/procedure/test):
nested, swaddled and received topical proparacaine which is the standard practice in the unit.
|
Length of follow-up: 5 min
Loss-to-follow-up: None
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available): 1. Heart rate: Not reported
2. Blood pressure Not reported
3. Saturation: Not reported
4. PIPP, mean: Baseline I: 3.85 ± 1.9 C: 5.25 ± 2.3
During screening I: 12.7 ± 1.7 C: 15.3 ± 1.78
1 min after screening I: 6.2 ± 1.98 C: 12.4 ± 2.54
5 min after screening I: 3.2 ± 1.58 C: 6.85 ± 2.41 |
Authors conclusion: The severe pain of ROP screening is significantly reduced by the use of EBM. This analgesic effect lasts even at 5 min after the procedure.
|
|
Sener Taplak, 2017 |
Type of study: randomized controlled trial
Setting and country: Single centre, Turkey
Funding and conflicts of interest: No competing financial interests exist.
|
Inclusion criteria: Preterm infants with a birth weight £1,500 g and gestational age of £32 weeks.
Exclusion criteria: Preterm infants diagnosed with a congenital anomaly, hydrocephalus, necrotizan enterocolitis, indirect hyperbilirubinemia, and receiving ventilatory sup- port or analgesic drug treatment.
N total at baseline: Intervention: 20 Control: 20
Important prognostic factors2: Gestational age (weeks), n (%): £ 27.6 I: 1 (5) C: 5 (25)
>28 I: 19 (95) C: 15 (75)
Sex: I: 45% M C: 30% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test): The preterm infants were provided with 1mL of breast milk before ROP examination.
|
Describe control (treatment/procedure/test): The preterm infants were provided with 1mL of sucrose before ROP examination
|
Length of follow-up: 15 min
Loss-to-follow-up: None
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available): 1. Heart rate: Before screening I: 151.80 ± 11.76 C: 155.20 ± 16.72 During screening I: 176.59 ± 18.18 C: 183.42 ± 21.71
After screening I: 159.70 ± 12.86 C: 165.70 ± 9.99
2. Blood pressure Not reported
3. Saturation: Before screening I: 91.10 ± 5.48 C: 91.55 ± 5.16
During screening I: 89.88 ± 7.72 C: 88.93 ± 6.57
After screening I: 91.05 ± 7.88 C: 88.30 ± 8.73
4. PIPP, mean: Before screening I: 2.10 ± 0.55 C: 2.05 ± 0.75
During screening I: 16.06 ± 2.41 C: 15.58 ± 2.02
After screening I: 3.20 ± 1.36 C: 3.65 ± 1.78 |
Authors conclusion: conclusion, based on the finding that the breast milk group recovered and reached their initial physiological and behavioral values more quickly after the ROP examination, and due to the superiority of breast milk as being a safe, effective, available, and natural analgesic at no cost, breast milk is better than sucrose during the ROP examination. It is recommended that similar studies should be conducted pro- viding repetitive doses of breast milk and sucrose due to the long and painful nature of the ROP examination.
|
Risk of bias tables bij B. Inzet van interventies voor optimaal comfort
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Mirlashari, 2021 |
Probably yes;
Reason: Randomization was performed using closed letters. Accordingly, one of the letters was randomly selected and the infants were assigned to one of the three groups, namely breast milk, sucrose, or distilled water.
|
Definitely yes;
Reason: Randomization was performed using closed letters.
|
Definitely yes;
Reason: Double-blind RCT, videos evaluated by blinded video coders. |
Definitely yes;
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW |
|
Sener Taplak, 2017 |
Probably yes;
Reason: The preterm infants were randomly assigned to the breast milk, sucrose, and control groups.
|
Probably no:
Reason: Not reported |
Definitely yes;
Reason: Double-blind RCT, videos were evaluated by three observers blinded to the study
|
Definitely yes;
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
Some concerns |
|
Turan, 2021 |
Probably yes;
Reason: The preterm infants who would undergo ROP examination were allocated to three groups according to simple randomization method
|
Probably no:
Reason: Not reported |
Probably no:
Reason: Not reported |
Definitely yes;
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
Some concerns |
|
Dolgun, 2017 |
Definitely yes; Reason: For randomization, numbers 1 to 87 were ran-domized with no number repetition into three groups through the use of the Random Assignment computer program
|
Probably no:
Reason: Not reported |
Probably yes:
Reason: Nurses were blinded to the group’s assignments of the infants
|
Definitely yes;
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
Some concerns |
|
Sun, 2020 |
Definitely yes; Reason: Using the random number table, we assigned 41 pre-term infants to each group.
|
Probably no:
Reason: Not reported |
Definitely no;
Reason: Not reported |
Definitely yes;
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
HIGH |
|
Kristoffersens, 2019 |
Definitely yes; Reason: For randomisation, we applied a web-based randomisa- tion and data collection system developed and adminis- tered by the Unit of Applied Clinical Research, Faculty of Medicine and Health Sciences, Norwegian University of Science and Technology, Trondheim, Norway.
|
Probably no:
Reason: Not reported |
Definitely no;
Reason: Not reported |
Definitely yes;
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
HIGH |
|
Naik, 2021 |
Definitely yes;
Reason: The neonates were allocated into three groups using a computer‐based randomization process according to their ophthalmologic examination sequence using sealed opaque envelopes.
|
Definitely yes;
Reason: The neonates were allocated into three groups using a computer‐based randomization process according to their ophthalmologic examination sequence using sealed opaque envelopes.
|
Probably yes;
Reason: The video recorder and analyzer were both blinded to the intervention.
|
Definitely yes;
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
LOW |
|
Rosali, 2015 |
Definitely yes;
Reason: The eligible babies were randomly allocated to the intervention and control groups using computer- generated random numbers.
|
Definitely yes;
Reason: Allocation concealment was done by using sequentially numbered opaque sealed envelopes containing the codes for interven- tion.
|
Probably yes;
Reason: Both these observers were blinded.
|
Definitely yes;
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
LOW |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Dili, 2014 |
Did not meet the PICO criteria |
|
Disher, 2018 |
Did not meet the PICO criteria |
|
Nesargi, 2015 |
Did not meet the PICO criteria |
Algemene informatie
|
Richtlijn: Herziening Richtlijn Prematurenretinopathie (ROP) |
|
|
Uitgangsvraag: Welke logistieke aspecten ten aanzien van ROP screening zijn van belang om het kind optimaal te kunnen begeleiden en het proces efficiënt te laten verlopen? |
|
|
Zoekvraag: Wat is het effect van niet-medicamenteuze pijnmanagement (borstvoeding, huid-op-huid contact, inbakening, speen) op de hartfrequentie, saturatie, bloeddruk en PIPP-R in kinderen die ROP screening ondergaan, in vergelijking met medicamenteuze pijnmanagement (pijnstillende-oogdruppels, sucrose, pijnstillers)? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 29-06-2021 |
|
Periode: 2011 – heden |
Talen: Geen restrictie |
|
Literatuurspecialist: Miriam van der Maten |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
|
|
|
In de databases Embase.com en Ovid/Medline is op 29 juni 2021 met relevante zoektermen gezocht naar literatuur over het effect van niet-medicamenteuze pijnmanagement op het optimaal begeleiden van kinderen die ROP screening ondergaan. De literatuurzoekactie leverde 208 unieke treffers op. |
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-11-2023
Beoordeeld op geldigheid : 13-11-2023
Algemene gegevens
De herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met prematurenretinopathie (ROP).
Samenstelling van de werkgroep
Werkgroep
- Prof. dr. N.E. (Nicoline) Schalij-Delfos, hoogleraar oogheelkunde, Leids Universitair Medisch Centrum, Leiden (NOG)
- Dr. A.J. (Arlette) van Sorge, oogarts, Koninklijke Visio, Amsterdam (NOG)
- Drs. I.L.A. (Irene) van Liempt, oogarts, Amphia Ziekenhuis, Breda (NOG)
- Dr. F.T. (Frank) Kerkhoff, oogarts, Máxima Medisch Centrum, Veldhoven (NOG)
- Drs. S.J.R. (Stefan) de Geus, oogarts, Máxima Medisch Centrum, Veldhoven (NOG)
- Drs. K. (Kasia) Trzcionkowska, oogarts in opleiding, Leids Universitair Medisch Centrum, Leiden (NOG)
- Drs. E. (Elke) Kraal-Biezen, oogarts, Amsterdam Universitair Medisch Centrum, Amsterdam (NOG)
- Dr. J.U.M. (Jacqueline) Termote, neonatoloog, Universitair Medisch Centrum Utrecht, Utrecht (NVK)
- Drs. J.L.A.M. (Jacqueline) van Hillegersberg-Schilder, kinderarts-neonatoloog, Antonius Ziekenhuis, Nieuwegein (NVK)
- Dr. G.J. (Gert Jan) van Steenbrugge, patiëntvertegenwoordiger (Care4Neo)
Klankbordgroep
- Drs. I. (Irma) Endeman, neonatologie verpleegkundige, Alrijne Zorggroep, Leiden (V&VN)
Met ondersteuning van
- Dr. A. (Anja) van der Hout, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. B.L. (Babette) Gal-de Geest, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schalij-Delfos |
Oogarts LUMC |
Geen |
Data Monitoring Committee Rainbouwstucie (gebruik ranibizumab bij ROP). Geen betrokkenheid bij publicaties, geen actieve deelname met patiënten aan studie. Alleen data safety monitoring. Vergoeding naar afdeling Oogheelkunde, niet naar mij persoonlijk |
Geen restricties |
|
Trzcionkowska |
AIOS Oogheelkunde/Promovenda LUMC |
Geen |
Geen |
Geen restricties |
|
Kraal-Biezen |
Oogarts, Amsterdam UMC |
Geen |
Geen |
Geen restricties |
|
Termote |
Neonatoloog, UMC Utrecht |
Geen |
Geen |
Geen restricties |
|
Van Sorge |
- Oogarts Koninklijke Visio (3 dagen/week) - Kinderoogarts (1 dag/week) Amsterdam UMC, locatie AMC Amsterdam |
Wetenschappelijke nul-aanstelling (onbetaald) bij het AmsterdamUMC tot 01-01-2021
Richtlijn visusstoornissen (vacatiegelden)
Stuurgroeplid cluster Oog van het NOG (vacatiegelden).
Voorzitter van de Vereniging voor Revalidatie bij Slechtziendheid (VRS) (onbetaald) |
Geen |
Geen restricties |
|
Van Hillegersberg |
Kinderarts-neonatoloog st. Antonius Ziekenhuis |
Geen |
Geen |
Geen restricties |
|
Van Steenbrugge |
Ervaringsdeskundige, ouder van twee ex-couveusekinderen. Voormalig directeur bij de patiënten-ouderorganisatie, Ver. van Ouders van Couveusekinderen, thans Care4Neo. Gepensioneerd en op vrijwillige basis betrokken bij Care4Neo als belangenbehartiger onderzoek en medische issues.
|
Lid cliëntenraad Erasmus MC (vrijwillig met vacatie vergoeding) Bestuurslid Hoormij-NVVS, de organisatie voor mensen met een auditieve beperking (november 2020 aftredend). Onbetaald. Vertegenwoordiger Care4Neo in de EFCNI (European Foundation tor the Care of Newborn lnfants). Onbetaald. |
Geen |
Geen restricties |
|
Van Liempt |
- Oogarts Amphia Ziekenhuis Breda - Oogarts (consulent) Koninklijke VISIO (1dag/3wk) |
Voorzitter beroepsbelangen commissie van wetenschappelijke vereniging NOG (betaald) |
Geen |
Geen restricties |
|
Kerkhoff |
Werkzaamheden als oogarts in MMC per 31-1-2023 gestopt, werkzaam als oogarts en medisch directeur bij FYEO en loop van het jaar voor de ROP werkzaam in UMC Radboud. |
Medisch Directeur FYEO Medical |
Geen |
Geen restricties |
|
De Geus |
Oogarts, Maxima Medisch Centrum (MMC) |
Geen |
PI namens MMC bij "Firefleye" onderzoek (Eylea bij ROP). Onderzoek wordt gefinancierd door Bayer (Financiële vergoeding naar MMC). |
Geen restricties, betrokkenheid bij het Firefleye onderzoek betreft slechts de inclusie van een proefpersoon. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland, de Oogvereniging, en Care4Neo voor de schriftelijke knelpuntenanalyse, een afgevaardigde patiëntenvereniging in de werkgroep en klankbordgroep en een enquête uitgezet door Care4Neo. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Stichting Kind en Ziekenhuis en de Oogvereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Inclusiecriteria screening |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Screeningsschema ROP |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Logistiek rondom ROP screening |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Behandelcriteria en -opties ROP |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Invloed van zuurstof op progressie ROP |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Invloed van Hb op het beloop van ROP |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Overplaatsing en verwijzing bij ROP |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Het informeren van ouders over ROP |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Lange termijn follow-up |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met prematurenretinopatie (ROP). De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Nederlands Oogheelkundig Gezelschap, 2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de IGJ, V&VN bij een schriftelijke knelpunteninventarisatie en door NOG leden via een enquête.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht. De literatuursamenvatting (met de bijbehorende zoekcriteria) is in het Engels geschreven, om internationale uitwisseling van kennis te faciliteren.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J [corrected to Schünemann, Holger J]. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Literature search strategy
Embase
|
No. |
Query |
Results |
|
#5 |
#3 AND #4 AND ([english]/lim OR [dutch]/lim) AND [2011-2021]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
176 |
|
#4 |
'analgesia'/exp/mj OR 'stress assessment'/exp OR 'pain assessment'/exp OR 'breast feeding'/exp OR 'breast milk'/exp OR 'sucking'/exp OR breastfeeding:ti,ab,kw OR 'breast* feeding':ti,ab,kw OR 'breast-fed':ti,ab,kw OR breastfed:ti,ab,kw OR 'breast milk':ti,ab,kw OR 'human milk':ti,ab,kw OR 'milk sharing':ti,ab,kw OR 'wet nursing':ti,ab,kw OR 'pacifier'/exp OR 'kangaroo care'/exp OR 'touch'/exp OR 'therapeutic touch'/exp OR 'comfort'/exp OR pacifier*:ti,ab,kw OR swaddl*:ti,ab,kw OR kangaroo:ti,ab,kw OR 'skin to skin':ti,ab,kw OR 'skin condunctance':ti,ab,kw OR ((parent* NEAR/2 (support* OR presence OR present)):ti,ab,kw) OR ((pain NEAR/3 (management OR relief OR assessment)):ti,ab,kw) |
482177 |
|
#3 |
#1 AND #2 OR rop:ti,ab,kw OR 'retrolental fibroplasia'/exp/mj |
13455 |
|
#2 |
'prematurity'/exp OR prematur*:ti,ab,kw OR 'pre-matur*':ti,ab,kw OR preterm*:ti,ab,kw OR 'pre-term*':ti,ab,kw |
325527 |
|
#1 |
'retinopathy'/mj OR retinopath*:ti,ab,kw OR retrolental:ti,ab,kw OR retrolenticular:ti,ab,kw OR retinosis:ti,ab,kw |
71824 |
Ovid/Medline
|
# |
Searches |
Results |
|
7 |
limit 6 to yr="2011 -Current" |
153 |
|
6 |
4 and 5 |
213 |
|
5 |
Exp* Analgesia/ or Pain Measurement/ or exp Breast Feeding/ or Milk, Human/ or Sucking Behavior/ or Pacifiers/ or breastfeeding.ti,ab,kf. or 'breast* feeding'.ti,ab,kf. or 'breast-fed'.ti,ab,kf. or breastfed.ti,ab,kf. or 'breast milk'.ti,ab,kf. or 'human milk'.ti,ab,kf. or 'milk sharing'.ti,ab,kf. or 'wet nursing'.ti,ab,kf. or "Kangaroo-Mother Care Method"/ or Touch/ or Therapeutic Touch/ or Patient Comfort/ or pacifier*.ti,ab,kf. or swaddl*.ti,ab,kf. or kangaroo.ti,ab,kf. or 'skin to skin'.ti,ab,kf. or 'skin condunctance'.ti,ab,kf. or (parent* adj2 (support* or presence or present)).ti,ab,kf. or (pain adj3 (management or relief or assessment)).ti,ab,kf. |
265778 |
|
4 |
1 or (2 and 3) |
10989 |
|
3 |
exp Infant, Premature/ or prematur*.ti,ab,kf. or 'pre-matur*'.ti,ab,kf. or preterm*.ti,ab,kf. or 'pre-term*'.ti,ab,kf. |
233135 |
|
2 |
Retinal Diseases/ or retinopath*.ti,ab,kf. or retrolental.ti,ab,kf. or retrolenticular.ti,ab,kf. or retinosis.ti,ab,kf. |
66792 |
|
1 |
Retinopathy of Prematurity/ or ROP.ti,ab,kf. |
8804 |