Transitionele pijn service
Uitgangsvraag
Wat is de plaats van een Transitionele Pijn Service (TPS) bij postoperatieve pijn?
Aanbeveling
Implementeer een TPS voor operatieve patiënten met daarin tenminste de volgende elementen:
- Afspraken over de identificatie en het doorverwijzen van risicopatiënten die voor begeleiding door de TPS in aanmerking komen.
- Identificatie vindt bij voorkeur preoperatief plaats maar kan ook in een latere fase (postoperatief) gebeuren.
- Multidimensionele invulling van de TPS: naast aandacht voor adequate pijnmedicatie, juist ook psychosociale begeleiding en advies over niet-medicamenteuze behandelingen
- Organiseer regelmatig vervolgmomenten voor TPS-patiënten na ontslag om het proces te kunnen bijsturen indien nodig.
- Indien nodig, verwijs door naar de chronische pijnpoli.
- TPS is in nauw contact met huisarts en hoofdbehandelaar.
- Een PDCA-cyclus om intern en extern de TPS te blijven optimaliseren
- Afstemming met opioïdenprogramma
Zie bijlage voor een voorbeeld over hoe TPS op lokaal niveau zou kunnen worden toegepast.
Samenstelling TPS
De samenstelling van de TPS is multidisciplinair en omvat tenminste een anesthesioloog/pijnspecialist en een verpleegkundige (pijnconsulent) met ervaring in de behandeling van acute én chronische pijn.
Zorg voor laagdrempelig overleg met psycholoog, fysiotherapeut en apotheker.
Leg de taken en verantwoordelijkheden vast van zowel de APS en TPS en streef naar een intensieve samenwerking tussen beide pijn services.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is geen systematische literatuuranalyse uitgevoerd naar de effectiviteit van TPS. TPS is een nieuw concept en nog niet onderzocht in vergelijkende studies. Echter, in een oriënterende search zijn er wel enkele studies gevonden die de uitvoerbaarheid van TPS hebben geëvalueerd in niet-vergelijkend onderzoek. De conclusies en beschrijvingen van deze onderzoeken heeft de werkgroep meegenomen in de uitwerking van deze module.
Plaats van TPS in het ziekenhuis
Het is momenteel nog niet goed onderzocht wat het precieze effect is van een TPS op patiënt relevante uitkomsten zoals pijnreductie, het afbouwen van opioïdengebruik en de terugkeer van de patiënt naar het niveau van voor de operatie. Dit is een kennislacune.
Er zijn veelbelovende multidisciplinaire strategieën gepubliceerd om de overgang van acute naar chronische postoperatieve pijn te voorkomen, die allemaal pleiten voor continue zorg gedurende de hele perioperatieve fase en na ontslag uit het ziekenhuis. De weinige onderzoeken die probeerden de effectiviteit te bepalen, zijn echter van laag niveau en dus van minder hoge bewijslast. Goed opgezette, pragmatische, gerandomiseerde gecontroleerde onderzoeken zijn wenselijk om te bepalen of deze nieuwe benaderingen succesvol zijn in het voorkomen van de overgang van acute naar chronische pijn.
Verwijzing naar de TPS en identificatie van patiënten
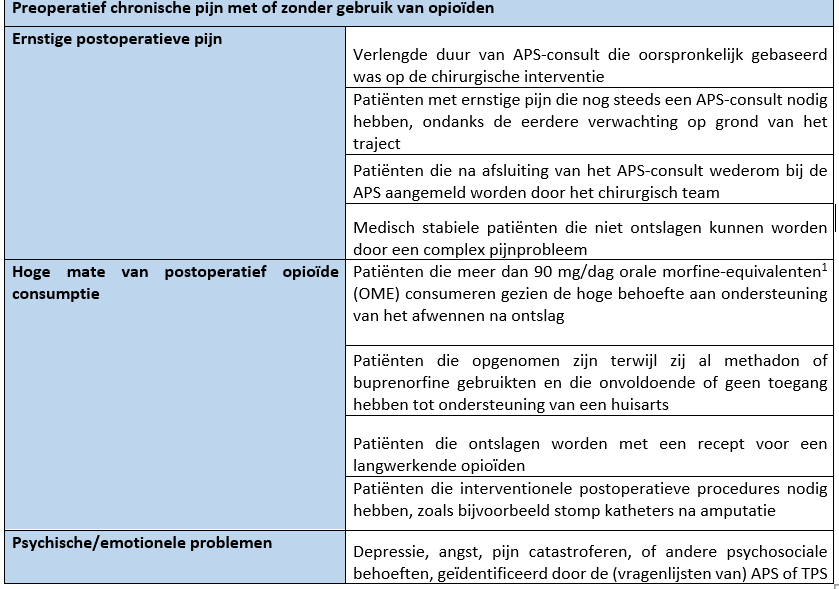
Het is belangrijk dat risicopatiënten zowel pre- als postoperatief worden geïdentificeerd en dat ze zo vroeg mogelijk worden beoordeeld om door hun chirurgisch team te worden doorverwezen naar de TPS of door het Acute Pain Service (APS)-team. In veel gevallen zullen de APS en TPS worden vormgegeven door hetzelfde team. Een preoperatief niet-geïdentificeerde patiënt kan postoperatief geïdentificeerd worden door bijvoorbeeld een hoge opioïdenconsumptie. In tabel 1 vatten Katz en collega's (2015) de verwijscriteria voor TPS samen.
Tabel 1. Verwijscriteria TPS.
Patiënten met een reeds bestaande pijnaandoening of ernstige postoperatieve pijn na een operatie hebben een veel nauwere follow-up nodig. Deze patiënten met complexe pijn moeten preoperatief worden geïdentificeerd en zorgvuldig worden gevolgd tijdens hun acute postoperatieve beloop. Ook patiënten die gedurende hun verblijf in het ziekenhuis blijk geven van moeilijk te behandelen pijn of telkens weer een consult van de APS nodig hebben kunnen aangemeld worden bij de TPS. Patiënten met een preoperatief pijnprobleem/opioïdengebruik en patiënten die uit het ziekenhuis worden ontslagen met opioïdenvoorschriften (vooral langwerkende opioïden) dienen door de TPS te worden benaderd.
Tabel 2 geeft een overzicht van de risicofactoren voor het ontwikkelen van chronische postoperatieve pijn volgens het Australian and New Zealand College of Anesthetists (Schug, 2020).
Tabel 2. Risico factoren voor de ontwikkeling van chronische postoperatieve pijn.
Ondanks alle voorzorgen blijft postoperatieve pijn afhankelijk van de ervaring van de patiënt, zelfs als de patiënt geen van de eerdergenoemde risicofactoren heeft. Vaak kan deze ervaring leiden tot het ontwikkelen van chronische postoperatieve pijn die de kwaliteit van leven verstoort na de verwachte tijd tot herstel. Maar liefst 14% van de patiënten die een operatie ondergaan zonder enige voorgeschiedenis van opioïdengebruik, ontwikkelt chronisch opioïdengebruik dat aanhoudt na herstel van hun operatie (Buys, 2020b).
De reden hiervoor kan te wijten zijn aan het type operatie dat de patiënt heeft ondergaan en de anatomische structuren die hierdoor zijn aangetast. Verder had 41% van de patiënten die TPS bezochten een thoracale operatie ondergaan, en 66% van hen had aanhoudende neuropathische pijn (op basis van een klinisch onderzoek) tijdens de subacute fase (Tiippana, 2016).
Organisatie van TPS
TPS-programma
De meeste auteurs zijn het erover eens dat de interventie van de TPS al bij het chirurgische of anesthesiologische spreekuur moet beginnen (Katz, 2015; Buys, 2020b). De auteurs van Buys (2020b) suggereren dat de multidisciplinaire TPS een betere continue zorg van preoperatief tot postoperatief betekent voor chirurgische patiënten. Hun patiënten kregen preoperatieve pijneducatie, pijnbehandeling werd geoptimaliseerd en patiënten werden gedurende ten minste zes maanden na de operatie nauwlettend gevolgd. Deze inspanning kan leiden tot een betere voorbereiding van de patiënt vóór de operatie en een betere coördinatie van de zorg na de operatie, specifiek wat betreft het juiste gebruik van opioïden en een soepele overgang van zorg voor patiënten met aanhoudende en complexe behoeften.
Beschreven is hoe een procedure eruit kan zien voor identificatie en follow-up waarbij patiënten al voor de opname worden geïdentificeerd als kandidaten voor de TPS (Katz, 2015). De patiënten worden na de operatie beoordeeld door de TPS, met bijzondere aandacht voor hun behoeften als "acute-chronische" pijnpatiënten met hoge opioïdenbehoeften.
Patiënten die voorafgaand aan de operatie niet geïdentificeerd zijn door screening in de pre-opnamekliniek of door hun chirurgisch team, kunnen ook na de operatie door de APS of hun chirurgisch team naar de TPS worden verwezen, waarna een multidisciplinair pijnbehandelplan kan worden afgesproken dat is afgestemd op de behoeften van de patiënt. Dit pijnplan kan eventueel een verwijzing naar een TPS-psycholoog of fysiotherapeut omvatten, die vervolgens een gepersonaliseerde interventie begint terwijl de patiënt nog in het ziekenhuis ligt.
Samenstelling TPS-team
De beschreven soorten TPS over de hele wereld zijn zeer heterogeen, omdat dit over het algemeen een service is die multidisciplinair is ingericht. Buys (2020b) benadrukken het belang van de nurse practitioners (verpleegkundig specialisten (VS)) en de verpleegkundig consulenten, aangezien zij degenen zijn die de nauwste relatie met de patiënten onderhouden (Buys, 2020a). De meeste auteurs zijn het er echter over eens dat er ten minste één anesthesist met geavanceerde opleiding in acute en/of chronische interventionele pijnbehandeling moet worden betrokken (Katz, 2015, Tiippana 2016, Vetter, 2017; Buys, 2020a). Verder is de aanwezigheid van minstens één klinisch psycholoog, een psychiater of in pijn gespecialiseerde psycholoog essentieel.
Ook moeten volgens Tiippana (2016) en Katz (2015) één of meer fysiotherapeuten deel uitmaken van de TPS en deelnemen aan de revalidatie van de patiënt (Katz, 2015; Tiippana, 2016). Andere door de auteurs genoemde beroepen waren specialist in palliatieve zorg, huisarts, inspanningsfysioloog, coördinator patiëntenzorg, administratief medewerker (Katz, 2015), internist, specialist verslavingszorg en gediplomeerd maatschappelijk werker (Vetter, 2017).
In Nederland zijn in alle ziekenhuizen APS-teams werkzaam die ook veelal multidisciplinair ingericht zijn. Het lijkt zodoende in de Nederlandse situatie het meest logisch dat de werkzaamheden van de APS uitgebreid worden met een TPS-programma. De VS en physician assistant (PA) kunnen hierin als zelfstandige beroepsbeoefenaren naast de anesthesioloog/pijnarts een superviserende en uitvoerende rol hebben.
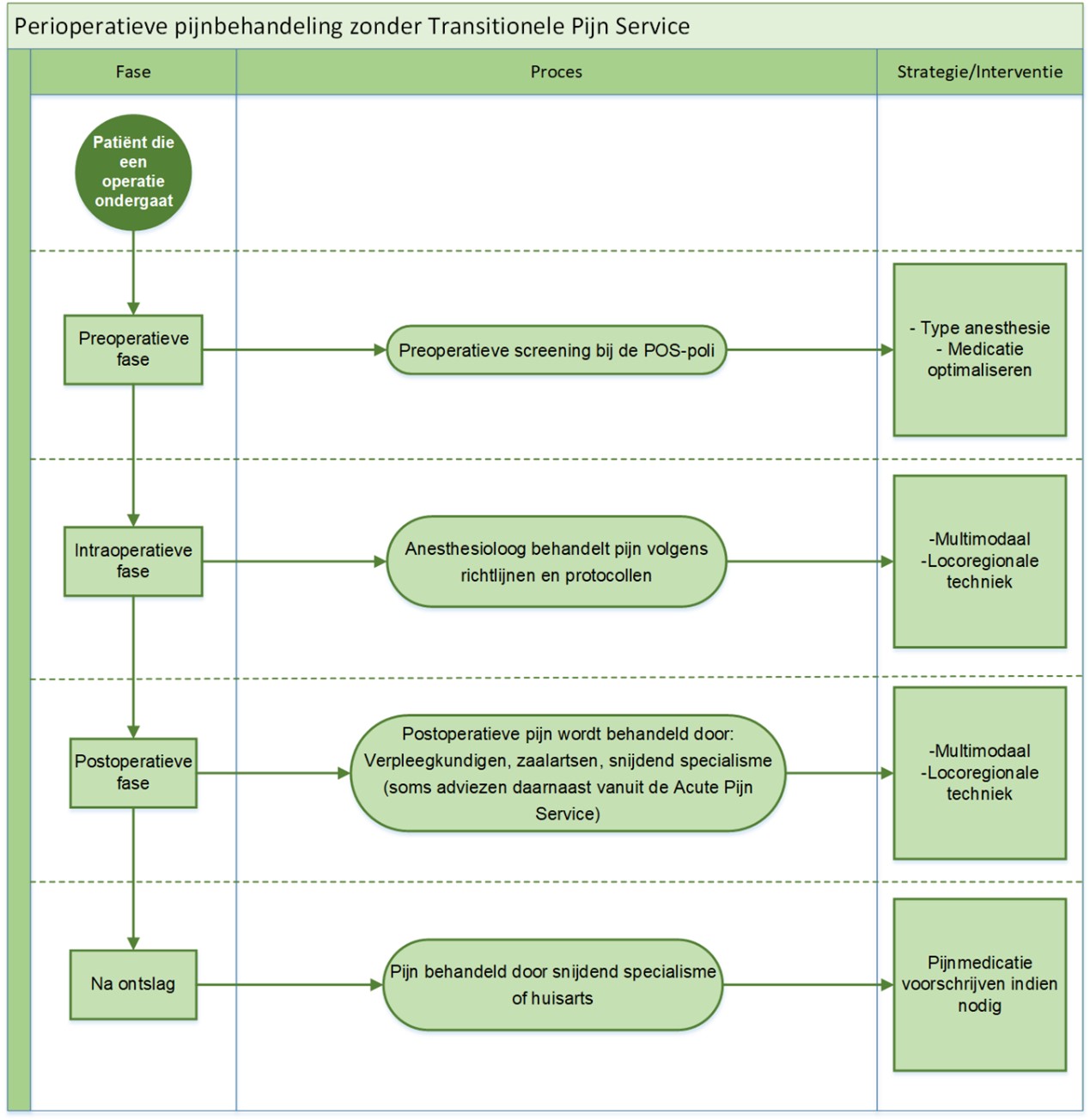
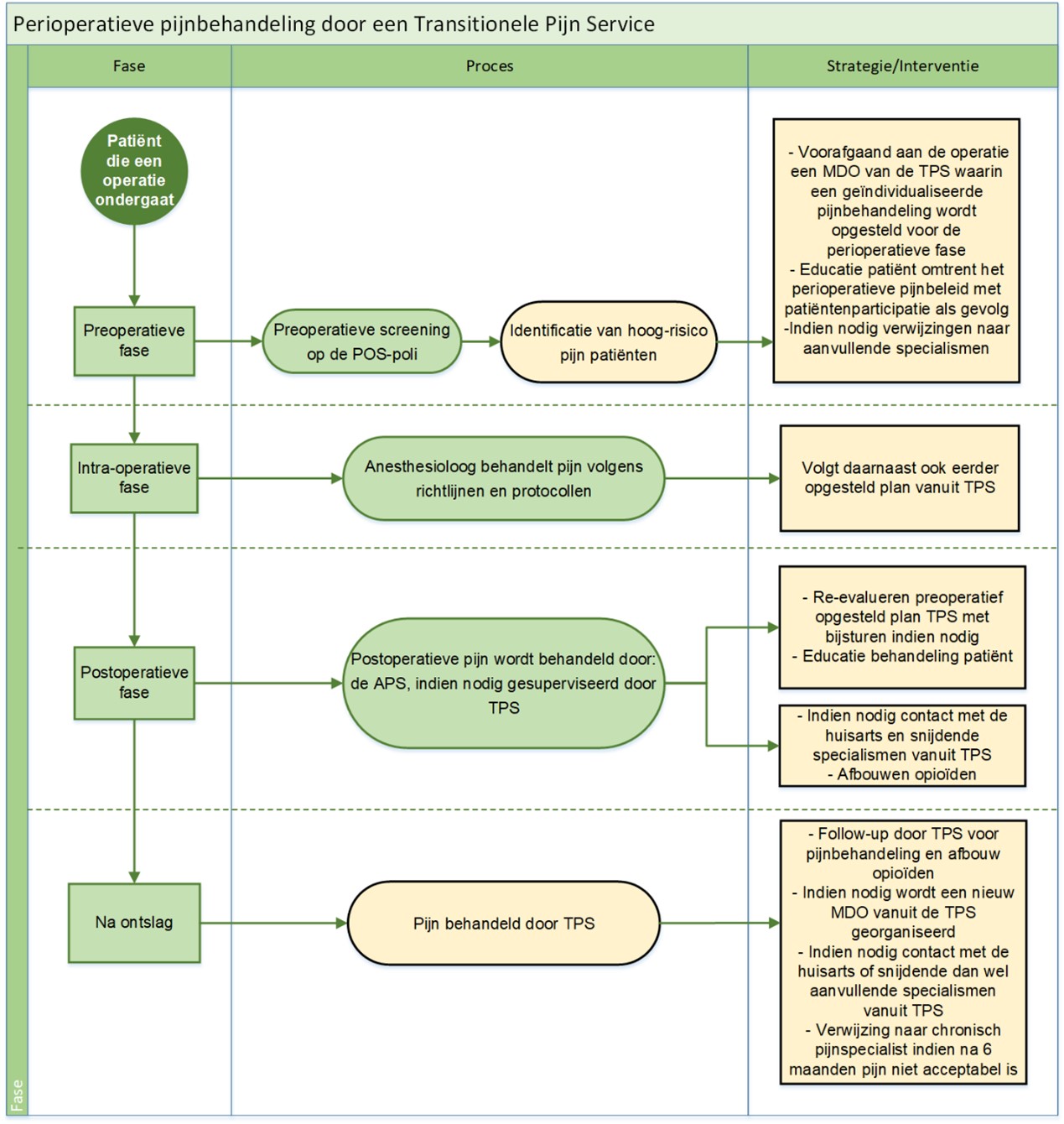
Een basisconcept van een volledig TPS-programma welke reeds in Nederland is geïmplementeerd, wordt getoond in figuur 2a en b.
Figuur 2a. Stroomschema perioperatieve pijnbehandeling zonder Transitionele Pijn Service.
Figuur 2b. Stroomschema perioperatieve pijnbehandeling door een Transitionele Pijn Service.
Resources en tools
Verschillende onderzoeken bevelen het gebruik van op maat gemaakte gezondheidsinformatietechnologie of mobiele apps aan om nauwkeurige follow-up en gegevensverzameling voor pijnbeheer en gegevensgestuurde verbeteringen van de zorg mogelijk te maken.
In een aantal onderzoeken uit de groep van Buys (2020b) werd geconcludeerd dat één van de fundamentele onderdelen van TPS de frequente menselijke interactie met een zorgzaam persoon was, zoals verpleegkundigen of verpleegkundigen in opleiding. Dit kwam omdat zij degenen waren die zorgden voor de effectiviteit van een TPS door preoperatieve educatie, individuele planning van pijnbehandeling te integreren en directe en gedetailleerde communicatie te onderhouden met zowel de chirurgen als de huisartsen. Het managen van de verwachtingen van de patiënt vóór de operatie kan de angst van de patiënt, het perioperatieve gebruik van opioïden en de verblijfsduur in het ziekenhuis verminderen.
De TPS dient zorg te dragen voor een goede administratie van patiëntengegevens. Het kan ingewikkeld zijn om al deze informatie te beheren, aangezien de follow-up van elke patiënt sterk varieert. Om deze reden onderstrepen Buys (2020b) het belang van het ontwikkelen van geavanceerde gezondheidsinformatietechnologie die nauwkeurige opvolging en gegevensverzameling voor kwaliteitsverbetering mogelijk maakt. Andere auteurs zoals van Slepian (2020) bevelen ook het gebruik aan van mobiele apps, die gebruikt kunnen worden door patiënten bij TPS om een pijnregistratie bij te houden en de communicatie van deze informatie met clinici te ondersteunen (Slepian, 2020).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Vanuit het patiëntenperspectief is hier zeker ook behoefte aan, zodat er een beter aanspreekpunt voor de patiënt is.
Kosten (middelenbeslag)
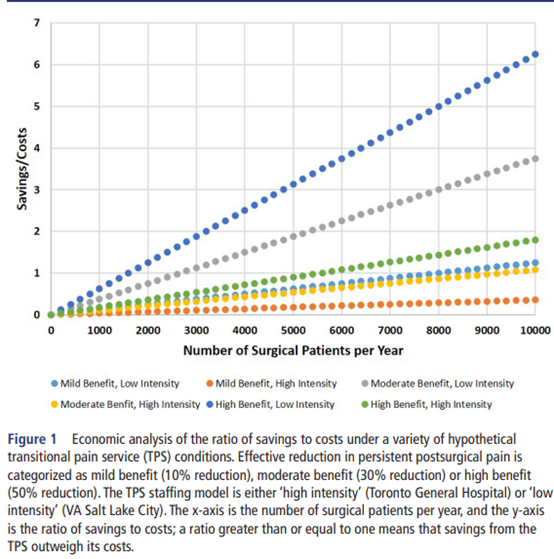
Er zijn nog weinig gegevens beschikbaar over de kosteneffectiviteit van een TPS. In een artikel van Sun (2021) worden diverse scenario’s van typen TPS, gebaseerd op intensiteit van de inspanningen en de vermindering van chronische postoperatieve pijn als uitkomsten, gepresenteerd. (Sun, 2021) Hieruit blijkt dat een kostenbesparing in bijna alle scenario’s plaatsvindt, zelfs bij de hoogste TPS-inspanningen en de laagste uitkomst (zie figuur 1 Sun, 2021). Als TPS het risico van chronische postoperatieve pijn met 30% vermindert, dan zal de besparing US$480-US$750 per patiënt zijn. De kostenbesparing is uiteraard groter bij meer chirurgische patiënten per jaar ten opzichte van lagere kosten van de TPS. Ook presenteren zij een economische analyse en bespreken ze belangrijke overwegingen bij het ontwikkelen van een businessplan voor een TPS. Dit is echter volledig gebaseerd op het gezondheidszorgsysteem van de Verenigde Staten. Over hoe dit in de Nederlandse situatie vertaald kan worden, zijn nog geen gegevens bekend.
Aanvaardbaarheid, haalbaarheid en implementatie
Dit TPS-model vereist een aanzienlijke investering in personeel en tijd, dus het kan moeilijk zijn om het bij andere ziekenhuizen te reproduceren zonder een wijziging van de vergoedingsnormen.
In Nederland zijn verschillende ziekenhuizen bezig met de implementatie van een TPS, meestal voortkomend als een uitbreiding van de APS. Onderstaande punten benadrukken het belang van het ondersteunen van de totstandkoming van nieuwe TPS'en of de verbetering van de bestaande in Nederland.
Een aanzienlijk percentage van de patiënten na de operatie worstelt met aanhoudende pijn en het gebruik van opioïden. Deze risico’s kunnen nog groter worden bij patiënten met een voorgeschiedenis van middelenmisbruik, opioïdengebruik, hoge angstgevoelens, aanzienlijke catastrofale gedachten over pijn en patiënten die eerdere negatieve ervaringen met chirurgie hebben gehad. Er is onvoldoende preoperatieve planning of postoperatieve coördinatie van de zorg voor deze patiënten. Strategieën om deze risicopatiënten te identificeren, zullen de patiënten, maar ook het gezondheidszorgsysteem, helpen door vroege en agressieve interventies te bieden met als doel het postoperatieve pijntraject te verbeteren en verdere escalatie te voorkomen (Huang, 2016). Een toekomstige uitdaging is dus om een risico-evaluatietool voor aanhoudende postoperatieve pijn in de klinische praktijk te implementeren en om alle patiënten systematisch te screenen (Tiippana, 2016).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De werkgroep constateert dat er op dit moment lage bewijskrachtniveau bestaat voor de voordelige effecten van een TPS op acute postoperatieve pijn, de transitie van acute naar chronische pijn en de opioïdenconsumptie (inclusief verkeerd gebruik en misbruik van opioïden). De studies die uitgevoerd zijn, laten zien dat vroegtijdige en intensieve aandacht voor perioperatieve pijn en opioïdenconsumptie door een multidisciplinair team gunstige effecten heeft op onder andere de ervaren pijn en het opioïdengebruik na de operatie. Ook lijkt de implementatie van een TPS kosteneffectief te zijn.
Op basis van deze overwegingen adviseert de werkgroep de implementatie van een TPS om in potentie de transitie van acute naar chronische postoperatieve pijn te verminderen en het chronisch postoperatieve opioïdengebruik te beperken.
De precieze invulling en implementatie van TPS is aan de ziekenhuizen. In de bijlage is een voorbeeld toegevoegd uit een Nederlands ziekenhuis waar TPS al in onderzoeksverband wordt toegepast.
Onderbouwing
Achtergrond
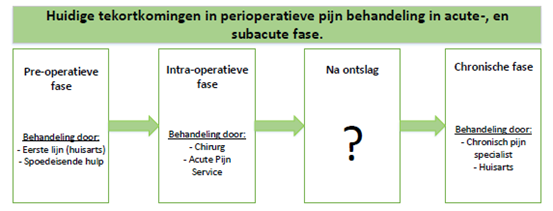
In het afgelopen decennium is er een toenemende afhankelijkheid van sterke opioïden voor de behandeling van acute en chronische pijn. Een groot gedeelte van de patiënten start het gebruik van een opioïde rondom een operatie. Gerelateerd aan de toename van het gebruik is er een toename opioïdenmisbruik, intoxicaties en sterfgevallen als gevolg van een overdosis (Glare, 2019). Het gebruik van opioïden door patiënten die een operatie ondergaan, presenteert een bijzonder uitdagend probleem waarbij clinici en apothekers moeten balanceren tussen twee concurrerende belangen: omgaan met acute pijn in de acute postoperatieve periode en het minimaliseren van de risico's van aanhoudend opioïdengebruik na ontslag. Chronische postoperatieve pijn, die optreedt bij ongeveer 10% van de patiënten die een operatie hebben ondergaan, begint doorgaans als acuut postoperatieve pijn die moeilijk onder controle te houden is, maar al snel overgaat in een aanhoudende pijnaandoening met neuropathische kenmerken die niet reageren op opioïden, met desastreuze gevolgen voor de patiënt en samenleving (Parsons, 2013). Ondanks de preoperatieve screening die in de meeste ziekenhuizen plaatsvindt, worden patiënten met een hoog risico op chronisch postoperatieve pijn op dit moment niet altijd tijdig geïdentificeerd, waardoor er geen vroege, optimale behandeling van acute, en subacute pijn kan plaatsvinden. Bovendien wordt de behandeling van pijn vaak gefragmenteerd verzorgd door zowel de huisarts, operateur en pas in de laatste fase een pijnspecialist (zie figuur 1).
Figuur 1. Huidige tekortkomingen in perioperatieve pijnbehandeling.
Zoals bij vele andere chronische aandoeningen zal een vroege identificatie van risicopatiënten en daarmee een vroege interventie en preventie, die goed begeleid wordt waarschijnlijk wel leiden tot betere uitkomsten, zoals minder chronische postoperatieve pijn, minder gebruik van opioïden en zodoende ook minder kans op opioïdenverslaving (Katz, 2015; Huang, 2015). In de literatuur wordt de Transitional Pain Service (TPS) beschreven, als een innovatieve brug tussen preoperatieve screening van risicopatiënten, het behandelen van acute postoperatieve pijn en de begeleiding na ontslag (Katz, 2015; Tiippana 2016; Jensen, 2016; Vetter, 2017; Admiraal, 2021). In het kort betekent dit dat patiënten preoperatief herkend worden als een patiënt die bovengemiddeld risico loopt op acute en/of chronische postoperatieve pijn, dan wel risico op bovengemiddeld lang gebruik van opioïden, waarna een persoonlijk behandelplan volgt dat voortgezet en bijgesteld wordt tot een behoorlijke tijd na het ontslag uit het ziekenhuis. Het uiteindelijke doel van TPS is de transitie van acute naar chronische pijn te voorkomen en het gebruik van opioïden te begeleiden. De gezondheidswinst voor de patiënt is dat deze eerder in beeld is voor de juiste medicatie, begeleiding en ondersteuning.
Over het algemeen lijkt de TPS een effectieve en veilige manier om multidimensionale postoperatieve analgesie uit te breiden van de ziekenhuisomgeving naar de thuisomgeving. Hierbij wordt in veel gevallen ook de kritieke subacute fase bestreken en worden er strategieën gevolgd die voornamelijk gericht zijn op pijnvermindering, het afbouwen van opioïden en het terugbrengen van patiënten naar hun niveau voor de operatie (Huang, 2015; Tiippana, 2016).
Er is nog geen erkende standaard voor een specifieke structuur van TPS. De TPS zal over het algemeen voortkomen uit een uitbreiding van de reeds bestaande APS, of toch in ieder geval zeer nauw samenwerken met de APS, afhankelijk van hoe de lokale inbedding vormgegeven wordt. TPS kan zodoende ook gelezen worden als TPS-programma.
TPS omvat een multidisciplinaire teambenadering die chirurgische patiënten ondersteunt van de preoperatieve tot de postoperatieve periode, waarbij gebruik wordt gemaakt van gestandaardiseerde pijnmeetinstrumenten om pijn, functie en psychologische comorbiditeiten te monitoren. Het TPS-team onderhoudt directe en gedetailleerde communicatie met zowel de chirurgen van de patiënt, huisartsen als andere zorgverleners die mogelijk betrokken zijn bij het herstel van de patiënt (Tiippana, 2016).
Het onderzoek naar TPS laat tot nu toe veelbelovende uitkomsten zien op verscheidene gebieden zoals pijnintensiteit, functioneren, opioïdenconsumptie en zorgkosten. Na behandeling van een TPS nam de pijn af (NRS-score daalde 17%), verbeterde het functioneren (BPI interference score verbeterde gemiddeld met 21%) en daalde de dagelijkse opioïdenconsumptie met 44-69% (morfine-equivalenten per dag) (Schug, 2020). Daarnaast hadden door een TPS behandelde patiënten een lagere kans op nieuw chronisch opioïdengebruik of, indien zij al pre-existent chronisch opioïden gebruikten, een grotere kans om te stoppen of te minderen dan patiënten die niet behandeld waren door een TPS (Buys, 2020b). Bovendien is het zeer aannemelijk dat een TPS kosteneffectief zal zijn (Slepian, 2020). Het onderzoek dat gedaan is, is echter nog niet van hoge kwaliteit. Gerandomiseerde studies met een controlegroep ontbreken. Onderzoek naar de invloed van TPS op de precieze incidentie van chronisch postoperatieve pijn is nog niet gepubliceerd (Katz, 2015).
De werkgroep beschrijft in deze module in hoeverre TPS een rol kan hebben bij het postoperatieve pijn beleid en welke patiënten hiervoor in aanmerking zouden komen.
Zoeken en selecteren
Er is geen systematische literatuur analyse uitgevoerd gezien het organisatorische karakter van deze module en de specifieke Nederlandse setting. Er is wel een oriënterende search uitgevoerd naar alle gepubliceerde literatuur over TPS. Een samenvatting van deze studies kan worden teruggevonden in de evidence tabellen.
Referenties
- Admiraal, M., et al., Current multidisciplinary approaches to preventing chronic postoperative pain. Br J Anaesth, 2021. 127(3): p. 331-335.
- Buys, M.J., et al., Multidisciplinary Transitional Pain Service for the Veteran Population. Fed Pract, 2020a. 37(10): p. 472-478.
- Buys, M.J., et al., Opioid use among veterans undergoing major joint surgery managed by a multidisciplinary transitional pain service. Reg Anesth Pain Med, 2020b. 45(11): p. 847-852.
- Glare, P., K.R. Aubrey, and P.S. Myles, Transition from acute to chronic pain after surgery. Lancet, 2019. 393(10180): p. 1537-1546.
- Huang, A., J. Katz, and H. Clarke, Ensuring safe prescribing of controlled substances for pain following surgery by developing a transitional pain service. Pain Manag, 2015. 5(2): p. 97-105.
- Huang, A., et al., Chronic postsurgical pain and persistent opioid use following surgery: the need for a transitional pain service. Pain Manag, 2016. 6(5): p. 435-43.
- Jensen, T.S., A. Stubhaug, and H. Breivik, Important development: Extended Acute Pain Service for patients at high risk of chronic pain after surgery. Scand J Pain, 2016. 12: p. 58-59.
- Katz, J., et al., The Toronto General Hospital Transitional Pain Service: development and implementation of a multidisciplinary program to prevent chronic postsurgical pain. J Pain Res, 2015. 8: p. 695-702.
- Parsons, B., et al., Economic and humanistic burden of post-trauma and post-surgical neuropathic pain among adults in the United States. J Pain Res, 2013. 6: p. 459-69.
- Schug SA, P.G., Scott DA, Halliwell R, Trinca J; APM: SE Working Group of the Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine, Acute Pain Management: Scientific Evidence (5th edition). 2020 Melbourne: ANZCA & FPM.
- Slepian, P.M., et al., Engagement with Manage My Pain mobile health application among patients at the Transitional Pain Service. Digit Health, 2020. 6: p. 2055207620962297.
- Sun, E.C., et al., Making a business plan for starting a transitional pain service within the US healthcare system. Reg Anesth Pain Med, 2021. 46(8): p. 727-731.
- Tiippana, E., et al., New approach for treatment of prolonged postoperative pain: APS Out-Patient Clinic. Scand J Pain, 2016. 12: p. 19-24.
- Vetter, T.R. and Z.N. Kain, Role of the Perioperative Surgical Home in Optimizing the Perioperative Use of Opioids. Anesth Analg, 2017. 125(5): p. 1653-1657.
Evidence tabellen
Evidence tables
|
Study reference |
Type of study |
Characteristics (study/participants) |
Intervention (I) |
Control (I) |
Outcome and length of follow up |
Results |
Assessment of study quality |
Level of evidence |
|
(M. Buys et al., 2020) |
Interrupted time series without a control group
n=213 |
Inclusion criteria: patients scheduled for elective primary or revision knee, hip, or shoulder replacement as well as rotator cuff repair surgery and risk factors of OUD having other type of surgery. Exclusion criteria:? Age: 63 (14) Sex: 88%M, 12%F |
we developed the Transitional Pain Service (TPS) to identify at-risk patients as soon as they were indicated for surgery, to allow time for evaluation, education, and developing an individualized pain plan, and opioid taper prior to surgery if indicated. An electronic dashboard registry of surgical episodes provided data to TPS providers and including outcomes. |
No controls |
Primary: baseline history, morphine equivalent daily dose, and patient-reported pain outcomes, using measures from the Patient-Reported Outcome Measurement System for pain intensity, pain interference, and physical function, and a pain-catastrophizing scale score. |
Nearly all (99%) patients had ≥ 1 successful follow-up within 14 days after discharge; 96% had ≥ 1 follow-up between 14 and 30 days after surgery; and 72% had completed personal follow-up 90 days after discharge. The overall use of opioids after orthopedic surgery decreased by > 40% from the previous year. |
Randomization* (+/-/?): -
Allocation concealment* (+/- /?): +
Blinding care provider* (+/-/?): -
Blinding patient * (+/-/?): -
Blinding outcome assessor * (+/-/?): -
Intervention- and control group equal at baseline * (+/-/?): -
Acceptable dropout rate (< 20%) (+/- /?):+
Intention to treat analysis * (+/-/?): + Funding: VA Whole Health Initiative, the VA Cen- ter of Innovation, the VA Office of Rural Health, and National Institutes of Health Grant UL1TR002538
|
Level B n=213
Prospective cohort study, but not with all the characteristics listed under A2 |
|
(Tiippana et al., 2016) |
Observational study n=200 |
Inclusion criteria: Patients from a wide range of surgical specialities Exclusion criteria: ? Age: 46 (15–83) Sex: 42%M 58%F |
Patient characteristics, known risk factors, and details of treatment of PPP for the first 200 patients referred to our APS-OPC were retrospectively collected from the medical records. The APS-OPC clinic functions in close collaboration with the Multidisciplinary Pain Clinic (MPC), and the number of patients in need of physiotherapist, psychologist or psychiatrist counselling was recorded, as well as the number of patients referred to the MPC for further PPP management. |
No controls |
Primary: patients at high risk of developing persistent post operative pain Secondary: to create a targeted care pathway to ensure effective and safe pain treatment especially in the subacute postoperative phase at home |
The patients had, on average, five risk factors for PPP. The median time from surgery to the first contact to the APS-OPC was two months, and the median duration of follow-up was 2.8 months (0–16 months). The median number of contacts with APS-OPC was 3 (range 1–14). Every fourth patient needed only one contact to the APS-OPC. Nineteen per cent of the patients had an appointment with the physiotherapist and 20% with a psychologist or psychiatrist. At discharge after surgery, 54% of the patients were using weak opioids, 32% strong opioids and 71% gabapentinoids; at discharge from the APS-OPC, these numbers were 20%, 6% and 43%, respectively. |
Randomization* (+/-/?): -
Allocation concealment* (+/- /?): ?
Blinding care provider* (+/-/?): -
Blinding patient * (+/-/?): -
Blinding outcome assessor * (+/-/?): -
Intervention- and control group equal at baseline * (+/-/?): -
Acceptable dropout rate (< 20%) (+/- /?):+
Intention to treat analysis * (+/-/?): +
Funding: No external funding
|
Level C n=200
Non-comparative study |
|
(M. J. Buys et al., 2020) |
Retrospective cohort study n=336 |
Inclusion criteria: Patients in the TPS cohort had opioid use history and MEDD documented in TPS clinic notes using patient report as well as medical record and controlled substance database verification prior to surgery and at 90 days after discharge. Exclusion criteria:? Age: 65.7 (9.9) No TPS group, 64.2 (12.0) TPS group Sex: 92.4%M No TPS group, 88.4% M TPS group
|
This retrospective cohort study was conducted at the Salt Lake City VA Medical Center to compare patients undergoing elective primary or revision total knee, hip, or shoulder replacement or rotator cuff repair in the year before (2017) and after (2018) implementation of a TPS. |
No controls |
Primary: the proportion of patients taking opioids 90 days after surgery. Secondary: new chronic opioid use (COU) after surgery as well as the proportion of previous chronic opioid users who stopped or decreased opioid use after surgery. |
At 90 days after surgery, patients enrolled in TPS were significantly less likely to be taking opioids (13.4% TPS vs 27.3% pre- TPS; p=0.002). This relationship remained statistically significant in a multivariable logistic regression analysis, where the TPS group had 69% lower odds of postoperative COU compared with the preintervention group (OR: 0.31; 95% CI: 0.14 to 0.66; p=0.03). |
Randomization* (+/-/?): -
Allocation concealment* (+/- /?): ?
Blinding care provider* (+/-/?): -
Blinding patient * (+/-/?): -
Blinding outcome assessor * (+/-/?): -
Intervention- and control group equal at baseline * (+/-/?): -
Acceptable dropout rate (< 20%) (+/- /?):+
Intention to treat analysis * (+/-/?): +
Funding: VA Whole Health Initiative, the VA Center of Innovation, the VA Office of Rural Health, and the National Institutes of Health Grant (UL1TR002538) |
Level B n=336
Retrospective cohort study |
|
(Slepian et al., 2020) |
Observational study n=132 |
Inclusion criteria: having a pain condition requiring management in the TPS and sufficient English fluency to engage with the app Exclusion criteria: people that did not give consent. Age: 47.6 (13.3) Sex: 53.4% F |
Patients at the TPS were encouraged to register on Manage My Pain as one component of a larger, non- randomized prospective study of treatment predictors and treatment enhancement. Uptake of the application and rates of registration, use, and retention were tracked for 90 days. |
No controls |
Primary: user engagement of Manage My Pain among patients at the Transitional Pain Service (TPS) at Toronto General Hospital |
Of the 196 patients who consented to the larger study, 132 (67%) also provided consent to the Manage My Pain component, indicating that they found this to be an acceptable treatment adjunct, and 119 (61%) completed registration. Of those who used the app, 67.9% and 43.2% continued to use Manage My Pain beyond 30 and 90 days, respectively. On average, users engaged with the app for 93.14 days (SD=151.9 days) logged an average of 47.39 total records (SD=136.1). |
Randomization* (+/-/?): -
Allocation concealment* (+/- /?): ?
Blinding care provider* (+/-/?): -
Blinding patient * (+/-/?): -
Blinding outcome assessor * (+/-/?): -
Intervention- and control group equal at baseline * (+/-/?): -
Acceptable dropout rate (< 20%) (+/- /?):+
Intention to treat analysis * (+/-/?): +
Funding: Ontario Centres of Excellence Advancing Health Grant awarded to TJ, JK, and HC. |
Level C n=132
Non-comparative study |
|
(Huang et al., 2016) |
Observational study n=200 |
Inclusion criteria: Patients from the Department of Anesthesia and Pain Management’s Acute Pain Service (APS) between September 2013 and April 2014 Exclusion criteria:? Age: 58.7 Sex: 98M; 102 F |
200 consecutive patients presenting for elective major surgery completed standardized questionnaires by telephone at 3 months after surgery. |
No controls |
Primary: identify the 3-month incidence of chronic postsurgical pain and long-term opioid use in patients at the Toronto General Hospital. |
51 patients reported a preoperative chronic pain condition, with 12 taking opioids preoperatively. 3 months after surgery 35% of patients reported having surgical site pain and 13.5% continued to use opioids for postsurgical pain relief. Postoperative opioid use was associated with interference with walking and work, and lower mood. |
Randomization* (+/-/?): -
Allocation concealment* (+/- /?): ?
Blinding care provider* (+/-/?): -
Blinding patient * (+/-/?): -
Blinding outcome assessor * (+/-/?): -
Intervention- and control group equal at baseline * (+/-/?): -
Acceptable dropout rate (< 20%) (+/- /?):+
Intention to treat analysis * (+/-/?): +
Funding: ? |
Level C n=200
Non-comparative study |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-09-2023
Beoordeeld op geldigheid : 01-09-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met postoperatieve pijn.
Samenstelling van de werkgroep
Werkgroep
Prof. dr. J. (Jörgen) Bruhn, anesthesioloog, (voorzitter) NVA
Prof. dr. dr. M.W. (Markus) Hollmann, anesthesioloog, NVA
Dr. M.F. (Markus) Stevens, anesthesioloog, NVA
Drs. L.J.H. (Lea) van Wersch, anesthesioloog, NVA
Dr. M.H.J. (Margot) Roozekrans, anesthesioloog, NVA
Dr. S.A.S. (Sandra) van den Heuvel, anesthesioloog/pijnspecialist, NVA
Drs. S.J. (Stijn) Westerbos, orthopeed, NOV
Drs. W.L. (Wilson) Li, cardiothoracaal chirurg, NVT
S.F. (Cedric) Lau MSc, ziekenhuisapotheker, NVZA
Dr. R.L.M. (Rianne) van Boekel, verpleegkundig pijnconsulent, V&VN
Drs. I.L. (Ilona) Thomassen-Hilgersom, patiëntvertegenwoordiger, Samenwerkingverband Pijnpatiënten naar één stem
Klankbordgroep
Drs. N.C. (Niels) Gritters van den Oever, intensivist, NVIC
J.P. (Patrick) Rensink, anesthesiemedewerker/pijnconsulent, NVAM
Dr. G. (Gijs) Helmerhorst, orthopeed, NOV
Dr. C.D. (Cor) de Kroon, gynaecoloog-oncoloog, NVOG
Dr. W.J. (Wietse) Eshuis, chirurg, NVvH
Dr. D. (Daphne) Roos, chirurg, NVvH
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M. van Leeuwen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bruhn, voorzitter |
Professor & Afdelingshoofd afdeling Anesthesiologie, Radboud UMC |
Editorial Board Journal of Clinical Monitoring and Computing, onbetaald |
Geen |
Geen actie |
|
Hollmann |
Professor & Afdelingshoofd afdeling Anesthesiologie, Amsterdam UMC, locatie AMC |
|
Geen |
Restricties t.a.v. modules over ketamine en lidocaïne. |
|
Lau |
|
Nationale Werkgroep morbide obesitas en bariatrische chirurgie (KNMP), vergoeding voor bestede uren |
Geen belangenverstrengeling, promotie-onderzoek is op een ander vlak dan waar beoogde werkgroep zich over buigt
|
Geen actie |
|
Boekel, van |
|
|
Geen |
Geen actie |
|
Thomassen-Hilgersom |
Voorzitter Samenwerkingsverband Pijnpatiënten naar één stem vrijwilliger en geen werkgever |
|
Geen |
Geen actie |
|
Li |
Cardiothoracaal chirurg (Radboudumc, Nijmegen) |
Bestuurslid NVT (Nederlandse Vereniging voor Thoraxchirurgie) |
Radboudumc zal in 2021 meedoen aan een RCT naar de optimale vorm van pijnstilling ten tijde van longchirugie (epiduraal versus paravertebraal) OPtriAL - met ZonMw subsidie, geïniteerd vanuit het MMC |
Geen actie |
|
Roozekrans |
Anesthesioloog - Pijnspecialist - Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen actie |
|
Stevens |
Chef de Clinique kinderanesthesie AUMC locatie AMC |
|
Geen |
Geen actie |
|
Heuvel, van den |
Anesthesioloog-pijnarts, Radboud UMC |
Geen |
Geen |
Geen actie |
|
Wersch, van |
Anesthesioloog, Maasziekenhuis Pantein |
Geen |
Geen |
Geen actie |
|
Westerbos |
Orthopeed, Alrijne ziekenhuis |
Geen |
Geen |
Geen actie |
|
Gritters van den Oever |
Anesthesioloog-intensivist Treant Zorggroep |
|
Geen |
Geen actie |
|
Rensink |
|
|
Geen |
Geen actie |
|
Kroon, de |
Gynaecoloog-oncoloog Leids Univesitair Medisch Centrum (1.0 fte) |
|
Geen |
Geen actie |
|
Roos |
Chirurg |
Geen |
Geen |
Geen actie |
|
Eshuis |
Chirurg, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Willeboordse |
Senior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Partner werkzaam bij Janssen Vaccines, onderdeel van Johnsson &Johnsson, via partner ook financiële belangen (aandelen J&J) |
Geen actie |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Leeuwen, van |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Dijk, van |
Junior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door zitting van een afgevaardigde van de patiëntenvereniging (Pijnpatiënten naar één stem) in de werkgroep. De Patiëntenfederatie Nederland en Pijnpatiënten naar één stem werden uitgenodigd voor de invitational conference. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en Pijnpatiënten naar één stem en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Organisatie van Zorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Transitionele Pijn Service (TPS) |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten). Hoewel de aanbeveling aangeeft dat een andere of nieuwe manier van zorgverlening gewenst is (i.e. andere manier van samenwerking/afstemming tussen zorgverleners) waarbij een TPS-model met TPS-team geïnitieerd wordt, laten eerste kosten-effectiviteitsstudies kostenbesparingen zien. De verwachting is dat TPS leidt tot betere zorg-op-maat, waarbij chronische postoperatieve pijn zorg doelmatiger wordt behandeld. Per ziekenhuis zal de vorm, intensiteit en organisatie van het TPS-model variëren. Zo kunnen ziekenhuizen ook kiezen voor een minder uitgebreid TPS. De aanbeveling geeft relatief veel ruimte voor de precieze invulling. Alle overwegingen tezamen, worden er geen substantiële financiële gevolgen verwacht. |
|
Module Pijnmeting |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Niet-medicamenteuze interventies |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Buikwandblokken |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken bij mammachirurgie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken intrathoracaal |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Continue Wond infusie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cryoanalgesie |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Dexmethason |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Gabapentinoïden |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Ketamine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Magnesium |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Methadon |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Beta blokkers -Esmolol |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist - Clonidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist – Dexmedetomidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Lidocaïne |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Multimodale pijnbestrijding |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met postoperatieve pijn.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Postoperatieve pijn (NVA, 2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door relevante partijen middels een invitational conference.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
De beoordelingen van de literatuur en de conclusies zijn gedaan op basis van de GRADE systematiek. De werkgroep vindt het belangrijk om relevante beperkingen hiervan aan te geven.
De klinische vraag gaat vaak over een reductie van ernstige postoperatieve pijn en opioïdenconsumptie in een aantal patiënten met resp. over een klinisch relevante reductie van ernstige postoperatieve pijn opioïdenconsumptie bij een individuele patiënt. Hetzelfde geldt voor opioïdenconsumptie; de keuze van een absolute drempelwaarde in mg (i.p.v. een relatieve drempelwaarde in %) maakt dit afhankelijk van tijdstip, ingreep en ernst van de pijn: vroege postoperatieve tijdstippen en (studies met) ingrepen met relatief lage opioïdconsumptie kunnen vaak de MCID niet bereiken.
De keuze van de MCID heeft een bepaalde mate van willekeurigheid en is niet absoluut te zien. Ook zijn de conclusies zo geformuleerd (en geven alleen beperkt antwoord op het effect op een individuele patiënt voor een specifieke ingreep).
In de literatuur worden de eindpunten pijnscores en opioïdenconsumptie separaat van elkaar weer gegeven, suggererend dat deze onafhankelijk van elkaar zijn. Echter kunnen deze twee eindpunten niet onafhankelijk van elkaar beoordeeld worden; in ieder protocol is opgenomen dat pijn behandeld moet worden. Deze separate beoordeling geeft niet altijd een adequaat antwoord op de klinische vraag naar het analgetische effect van een interventie.
Daarnaast worden multimodale componenten als aparte interventies beoordeeld, echter de klinische vraag is naar de effectiviteit als bouwsteen van een multimodale werkwijze.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.