Esmolol
Uitgangsvraag
Wat is de meerwaarde van de toevoeging van peroperatieve bètablokkers (esmolol) bij patiënten die een chirurgische ingreep ondergaan op postoperatieve pijn?
Aanbeveling
Overweeg esmolol intra-operatief toe te voegen aan de anesthesie bij hemodynamisch stabiele patiënten.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematische literatuuranalyse uitgevoerd naar de effectiviteit van intra-operatief esmolol vergeleken met standaard analgesie bij patiënten die een chirurgische ingreep ondergingen. Postoperatieve pijn was de cruciale uitkomstmaat en het postoperatieve gebruik van opioïden was een belangrijke uitkomstmaat voor klinische besluitvorming.
Voor postoperatieve pijn is er geconcludeerd dat bij aankomst in de PACU en op 6 uur postoperatief pijnscores mogelijk lager zijn bij gebruik van esmolol vergeleken met standaard analgesie. De bewijskracht hiervoor is laag (GRADE) vanwege kleine studiepopulaties, risico op bias en inconsistente resultaten. Er werd wel een klinisch relevant verschil gevonden in het voordeel van esmolol.
Over postoperatieve pijn op 12 en 24 uur is ook een lage bewijskracht (GRADE) gevonden vanwege dezelfde redenen, maar hierbij is geen klinisch relevant verschil gevonden tussen de groepen.
Postoperatieve pijn op 48 uur geeft waarschijnlijk geen verschil tussen esmolol en standaard analgesie. De bewijskracht daarvoor is redelijk (GRADE).
Voor postoperatief gebruik van opioïden gedurende het verblijf in de verkoeverkamer en in de totale postoperatieve periode is er waarschijnlijk geen pijn verlagend effect voor esmolol t.o.v. standaard analgesie. De studies waren erg klein en niet altijd geblindeerd.
Voor opioïdengebruik 24 uur na de ingreep is er waarschijnlijk een effect van esmolol ten opzichte van standaard analgesie. Er is een klinisch relevant verschil in het voordeel van esmolol. De bewijskracht is redelijk (GRADE) vanwege een klein aantal studies met weinig patiënten.
De bijwerkingen en mogelijke complicaties van het toevoegen van perioperatief esmolol werden niet als absolute data gepresenteerd in de geïncludeerde studies. Bradycardie en hypotensie zijn vanuit het werkingsmechanisme van esmolol bekende bijwerkingen. Uit de systematische review blijkt dat de gebruikte doseringen van esmolol intra-operatief niet leidden tot klinisch relevante hemodynamische verschillen in hartslag en bloeddruk (Gelineau 2018).
Een argument om esmolol toe te voegen zou zijn om postoperatief minder opiaten toe te passen. Er is onzekerheid rondom het effect op de pijnscore op de verkoever na toevoeging van esmolol. De benodigde opiaathoeveelheid in de eerste 24 uur postoperatief lijkt af te nemen. Hoewel postoperatieve misselijkheid en braken buiten de scope van deze PICO valt, lijkt de toevoeging van esmolol mogelijk het risico hierop te verminderen (Gelineau 2018).
In deze PICO is gekeken naar patiënten die hemodynamisch stabiel zijn en veelal geen bètablokkers gebruiken. De resultaten van deze PICO kunnen daarom niet zomaar doorgetrokken worden naar patiënten die preoperatief hemodynamisch instabiel zijn en al reeds bètablokkers gebruiken.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten is het belangrijk om een adequate pijnstilling postoperatief te hebben. De voorkeur gaat ernaar uit om dat te bereiken met minder gebruik van opioïden. Daardoor zal het risico op de bijwerkingen door opioïden afnemen, zoals obstipatie, sufheid en postoperatieve misselijkheid en braken. Het toevoegen van esmolol intra-operatief aan de standaardzorg lijkt te leiden tot een lager verbruik van opiaten. Hoewel dit niet expliciet meegenomen is, lijkt toevoeging van esmolol ook het intra-operatief gebruik van opiaten te verminderen.
Uit de literatuuranalyse is er geen verschil aangetoond in postoperatieve pijnbeleving bij patiënten die esmolol intra-operatief toegediend hebben gekregen. Omdat esmolol relatief kort werkt, is het niet te verwachten dat patiënten postoperatief last hebben van bijwerkingen van esmolol.
Kosten (middelenbeslag)
De algehele kosteneffectiviteit van esmolol intra-operatief zijn nog niet in kaart gebracht. Uitgaande van een standaarddosering esmolol zal de totale tijd van het klaarmaken en toedienen van een extra middel iets langer zijn. Esmolol is een middel dat al reeds op de operatiekamer wordt toegediend. Er is daardoor geen extra scholing of kwalificatie van personeel nodig. Als er minder opiaten perioperatief of kort postoperatief gegeven worden, zal dat administratietijd schelen die verbonden is aan de opiumwetgeving. Waarschijnlijk zal de implementatie van esmolol tot een vergelijkbare perioperatieve tijdsbesteding leiden.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen procesevaluatie gedaan die de implementatie van esmolol in de Nederlandse setting beschrijft. Daarentegen zijn er meer dan twintig studies die de toepassing van esmolol intra-operatief hebben beschreven. Hieruit kan afgeleid worden dat de toepassing haalbaar moet zijn.
Een bezwaar zou zijn om dat bètablokkers tot hemodynamische instabiliteit zouden kunnen leiden. Echter, dat is in de toepassing bij hemodynamisch stabiele patiënten niet gebleken. Omdat niet onderzocht is in hemodynamisch instabiele patiënten, is het advies om terughoudend te zijn om esmolol toe te passen bij kwetsbare patiënten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Esmolol in aanvulling op de algehele anesthesie veroorzaakt mogelijk een verlagend effect op de pijnscores op de verkoever en de eerste uren na de operatie. Volgens de literatuur kan esmolol de hoeveelheid opiaten die benodigd is in 24 uur na de operatie mogelijk verlagen. Intra-operatief esmolol lijkt niet te leiden tot klinische verschillen in hemodynamiek. Toevoeging van esmolol als een bekend middel op de operatiekamer kan opwegen ten opzichte van het totaal toe te dienen opiaten en de bijwerkingen van deze opiaten.
Onderbouwing
Achtergrond
Multimodale pijnbestrijding wordt gezien als perioperatieve standaardzorg. Verschillende niet-opioïden worden hiervoor gebruikt. In het bijzonder door de toenemende aandacht voor opioïdsparende dan wel opioïdvrije anesthesie zijn ook bètablokkers in de afgelopen jaren als potentieel analgetisch werkzame medicatie perioperatief gebruikt. Toch is het uitdagend in de kliniek de effecten van bètablokker op nociceptie te beoordelen omdat hypertensie en tachycardie de primaire klinische symptomen zijn die op verhoogde nociceptieve input duiden. Bètablokkers leiden wel tot reductie van bloeddruk en hartfrequentie maar dit hoeft niet op een analgetisch effect te berusten. Esmolol is de meest gebruikte en onderzochte bètablokker.
Conclusies / Summary of Findings
Postoperative pain
|
Low GRADE |
The use of intraoperative esmolol may reduce postoperative pain scores at PACU arrival and 6 hours post-surgery when compared to standard analgesics in surgical patients.
Sources: Bhawna, 2012; Celebi, 2014; Collard, 2007; Dhir, 2015; Elokda, 2015; Gelineau, 2018; Haghighi, 2015; Hwang, 2013; Kamal, 2015; Lee, 2014; López-Álvarez, 2012; Mahrose, 2020; Moon, 2011; Said-Ahmed, 2009; Vahabi, 2018. |
|
Low GRADE |
The use of intraoperative esmolol may result in little to no difference in postoperative pain scores at 12 and 24 hours post-surgery when compared to standard analgesics in surgical patients.
Sources: Celebi, 2014; Chia, 2004; Collard, 2007; Dhir, 2015; Elokda, 2015; Gelineau, 2018; Haghighi, 2015; Hwang, 2013; Kamal, 2015; Kavak Akelma, 2014; Lee, 2014; Lee, 2010; López-Álvarez, 2012; Mahrose, 2020; Said-Ahmed, 2009; Smith, 1991; Vahabi, 2018. |
|
Moderate GRADE |
The use of intraoperative esmolol likely results in little to no difference in postoperative pain scores at 48 hours post-surgery when compared to standard analgesics in surgical patients.
Sources: Celebi, 2014; Chia, 2004. |
Postoperative opioid consumption
|
Moderate GRADE |
The use of intraoperative esmolol likely results in reduced opioid consumption in 24 hours after surgery when compared to standard analgesics in surgical patients.
Sources: Bajracharya 2019; Coloma, 2001; Elokda, 2015; Haghighi, 2015; Kavak Akelma, 2014. |
|
Low GRADE |
The use of intraoperative esmolol may result in little no difference in opioid consumption in PACU and the total postoperative period when compared to standard analgesics in surgical patients.
Sources: Bajracharya 2019; Celebi, 2014; Chia, 2004; Collard, 2007; Hamed, 2019; Hwang, 2013; Kavak Akelma, 2014; López-Álvarez, 2012; Moon, 2011; Said-Ahmed, 2009; Sultan, 2015; Valjus, 2006. |
Adverse events
|
No GRADE |
No evidence was found regarding the effect of intraoperative esmolol on hypotension and bradycardia when compared with standard analgesics in surgical patients.
Sources: - |
Samenvatting literatuur
Description of studies
As shown in table 1, different controls were used, in various surgeries and using different scales to assess postoperative pain. The number of patients per arm ranged from 15 to 50. All studies were single-centered RCTs.
Table 1. Characteristics of included studies.
|
Author, year |
N (I/C) |
Surgery type |
Intervention |
Control |
|
RCTs included from Gelineau, 2018 |
||||
|
Collard, 2007 |
30/28/271 |
Laparoscopic cholecystectomy |
Esmolol, 1.0 mg·kg−1 then 5–15 μg·kg−1·min−1 |
Remifentanil 1.0 µg·kg-1 then 0.1–0.50 µg·kg-1 ·min-1 or fentanyl 1.0 µg·kg-1 then 50 µg boluses |
|
Kavak Akelma, 2014 |
16/16/162 |
Laparoscopic cholecystectomy |
Esmolol, 1.0 mg·kg−1 then 50 μg·kg−1·min−1
|
Prior to induction: lidocaine 1.5 mg kg-1 or remifentanil 10 µg. During surgery: 2 mg kg-1min-1 lidocaine i.v. or 10 mL ·h-1 placebo |
|
30/30 |
Laparoscopic cholecystectomy |
Esmolol, 0.5 mg·kg−1 then 5–15 μg·kg−1·min−1 |
Ketamine 0.5 mg·kg-1 and remifentanil 0.5 µg·kg-1 then 0.1–0.5 µg·kg-1 ·min-1 |
|
|
Said-Ahmed, 2009 |
30/30 |
Laparoscopic inguinal hernia repair |
Esmolol, 1.0 mg·kg−1 then 5–15 μg·kg−1·min−1 |
Fentanyl 1.0 µg·kg-1 then scheduled fentanyl boluses 50 µg·kg-1 30 min |
|
Coloma, 2001 |
27/26 |
Gynaecologic laparoscopic surgery |
Esmolol, 1.0 mg·kg−1 then 5–15 μg·kg−1·min−1 |
Remifentanil 1.0 µg·kg-1 then 0.025–0.125 µg·kg-1 ·min-1 |
|
Smith, 1991 |
47/50 |
Ambulatory Surgery |
Esmolol, 2.0 mg·kg−1 2 min then 100 μg·kg−1·min−1 then 25 μg·kg−1·min−1 after induction |
Alfentanil (16 µg·kg-1 ) then 0.80 µg·kg-1 ·min-1 until intubation then 0.20 µg·kg-1 ·min-1 |
|
Valjus, 2006 |
25/25 |
Gynaecological laparoscopy |
Esmolol, 1.0 mg·kg−1 then 20 μg·kg−1·min−1 |
Remifentanil 1 mg·kg-1 then remifentanil 0.2 µg·kg-1 ·min-1 |
|
Kamal, 2005 |
30/30 |
Inguinal herniotomy |
Esmolol, 0.5 mg·kg−1 then 5–15 μg·kg−1·min−1 |
Ropivacaine wound infiltration |
|
Celebi, 2014 |
30/30 |
Septorhinoplasty |
Esmolol, 0.5 mg·kg−1 then 0.05 μg·kg−1·min−1 + remifentanil i.v. 0.05-0.5 µg·kg-1 ·min-1 |
Placebo; + remifentanil i.v. 0.05-0.5 µg·kg-1 ·min-1 infusion during the procedure |
|
Lee, 2014 |
20/20 |
Laparoscopic cholecystectomy |
Esmolol, 0.5 mg·kg−1 then 10 μg·kg−1·min−1 |
Placebo; + Anesthesia maintenance with 1.5-2.0 vol% sevoflurane, with the effect-site target concentration of 4 ng·ml-1 remifentanil in all groups |
|
Öztürk, 2008 |
20/20 |
Laparoscopic cholecystectomy |
Esmolol, 1.0 mg·kg−1 then 5–10 μg·kg−1·min−1 |
Placebo; + premedicated with 2 mg of midazolam i.v. Presurgery: diclofenac, and 4 mg of dexamethasone i.v. Anaesthesia was induced with alfentanil and propofol. |
|
Moon, 2011 |
27/27 |
Laparoscopic gynaecological surgery |
Esmolol, 0.5 mg·kg−1 then 30 μg·kg−1·min−1 |
Placebo; + Anesthesia maintenance with sevoflurane and 1 ng·ml-1 remifentanil |
|
White, 20031 |
15/15 |
Ambulatory Surgery |
Esmolol, 50 mg then 0.005 mg·kg−1·min−1 |
Placebo; + induction of anesthesia with fentanyl 1.5 µg·kg-1, and propofol 2 mg·kg−1 i.v. |
|
Haghighi, 2015 |
41/41 |
Lower limb orthopedic surgery |
Esmolol, 0.5 mg·kg−1 30 min before induction then 5 μg·kg−1·min−1 |
Placebo; + induction with fentanyl (2 μg·kg−1), midazolam (2 mg), sodium thiopental (3-5 mg·kg−1), and atracurium (0.5 mg·kg−1). Anesthesia maintenance with isoflurane, nitrous oxide, and oxygen. |
|
Hwang, 2013 |
28/28 |
Laparoscopic gynaecologic surgery |
Esmolol, 0.5 mg·kg−1 then 30 μg·kg−1·min−1 |
placebo; + anesthesia induction with 2.0 mg·kg−1 propofol and 0.5 mg·kg−1 atracurium. Anesthesia maintenance with sevoflurane and 2.0 ng·mL−1 of remifentanil + 4 mg of ondansetron end of surgery |
|
Chia, 2004 |
49/48 |
Hysterectomy |
Esmolol, 0.5 mg·kg−1 30 min before induction then 0.05 mg·kg−1·min−1 |
Placebo; + induction with fentanyl (3 µg·kg−1), thiopental (5 mg·kg−1), and succinylcholine (2 mg·kg−1). After surgery PCA. |
|
Dhir, 2015 |
30/30 |
Laparoscopic cholecystectomy |
Esmolol, 0.5 mg·kg−1 then 0.05 μg·kg−1·min−1 |
Placebo; + premedicated as per departmental protocol: Prior to induction fentanyl 1.5 μg·kg−1 i.v. Anesthesia was induced with i.v. propofol 1-2 mg·kg−1. |
|
Bhawna, 2012 |
25/25 |
Lower abdominal surgery |
Esmolol, 0.5 mg·kg−1 20 min before induction then 0.5 μg·kg−1·min−1 |
Placebo; + induced by fentanyl (3.0 μg·kg−1) and propofol (1.25-2.0 mg·kg−1), and Atracurium (0.5 mg·kg−1) i.v. Analgesia maintained by fentanyl (1.0 μg·kg−1) every 60 min. |
|
Elokda, 2015 |
40/40 |
Arthroscopic shoulder surgery |
Esmolol, 1.0 mg·kg−1 then 15 μg·kg−1·min−1 |
Placebo; + anesthesia induction by fentanyl (2 μg·kg−1), followed by propofol (1.5–2 mg·kg−1) i.v. Maintenance of anesthesia was carried out by continuous infusion of propofol (5–8 mg·kg·−1h−1). |
|
Lee, 2010 |
30/30 |
Laparoscopic Appendectomy |
Esmolol, 1.0 mg·kg−1 then 10 μg·kg−1·min−1 then 1.0 mg·kg−1 before extubation |
Placebo; + propofol 2 mg·kg−1 and rocuronium 0.8 mg·kg−1 i.v. for induction. Anesthesia maintained with a continuous infusion of remifentanil 0.2-0.5 μg·kg−1·min−1 and propofol 75-85 μg·kg−1·min−1. |
|
Sultan, 2015 |
30/30 |
Gynecologic laparoscopic surgery |
Esmolol, 1.0 mg·kg−1 then 30 μg·kg−1·min−1 |
Placebo; + Anesthesia was induced by fentanyl (1 μg·kg−1) and propofol (2 mg·kg−1). Anesthesia was maintained by fixed-dose sevoflurane. |
|
Additional RCTs |
||||
|
30/30 |
Laparoscopic bariatric surgery |
Esmolol, 1.0 mg·kg−1 then 10 μg·kg−1·min−1 |
Placebo; + Sevoflurane and fentanyl during maintenance of anesthesia |
|
|
Vahabi, 2018 |
28/28 |
Rhinoplasty |
Esmolol, 5.0–10 μg·kg−1·min−1 |
Placebo + propofol (50–100 μg·kg−1·min−1) and remifentanil (0.2–0.5 μg·kg−1) infusion |
|
Hamed, 2019 |
44/44 |
Fertility Preserving Myomectomy |
Esmolol-induced hypotensive anesthesia, 0.5 μg·kg−1 then 50-300 µg.kg-1.min-1 |
Fentanyl was used as intraoperative analgesia/normotensive anesthesia |
|
Bajracharya, 2019 |
45/45 |
Laparoscopic cholecystectomy |
Esmolol, 0.5 μg·kg−1 during induction, then 5-15 μg·kg−1·min−1 |
1.5 mg·kg−1 lidocaine i.v. bolus followed by an infusion |
I: intervention, C: control, i.v.: intravenous
1remifentanil/fentanyl
2remifentanil/lidocaine
Results
Esmolol versus standard care
1. Postoperative pain
Postoperative pain was assessed at PACU arrival, 6 hours, 12 hours, 24 hours and 48 hours post-surgery. Multiple studies reported pain on other time points as shown in the evidence tables. For these analyses, the most widely used time points are included as predefined in the PICO.
A lower score indicated less pain for all scales. In case data could not be pooled, results were summarized.
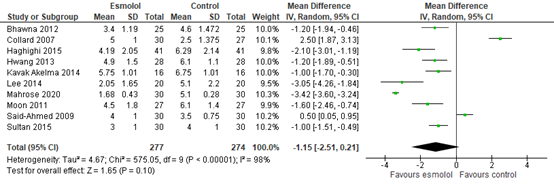
1.1 Postoperative pain at PACU arrival
In total, ten studies reported postoperative pain at PACU arrival or at 0 to 5 minutes post-surgery (from now on defined as ‘at PACU arrival’). As shown in figure 1, a mean difference (MD) of -1.15 (95% Confidence Interval (CI) -2.51 to 0.21) was found in favour of esmolol. This difference is considered clinically relevant.
Figure 1. Pain scores at PACU arrival.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
In addition to the pooled data, additional data reporting pain scores at PACU arrival were found in three studies. These studies could not be included in the meta-analysis due to the following reasons: no absolute data were presented or data were only presented in medians. For all scales, a lower score indicated less pain.
Dhir (2015) reported VAS pain scores (0-10 cm) in means without SD. The esmolol group had a pain score of 1.8 and the control group of 4.77.
Elokda (2015) presented VAS pain scores (0-100 mm) in figures without absolute data. The esmolol group had a pain score of 38 and the control group of 57.
Celebi (2014) reported VAS (0-10) and VRS (0-4) scores for the control group in figures. The esmolol group had a pain score of 2.35 and the control group 4.8.
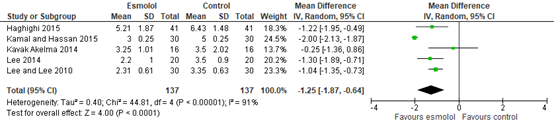
1.2 Postoperative pain at 6 hours post-surgery
Pain scores at 6 hours post-surgery were reported by four studies. As shown in figure 2, a MD of -1.25 (95% CI -1.87, -0.64) was found in favour of esmolol. This difference was considered clinically relevant.
Figure 2. Pain scores at 6 hours post-surgery.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
In addition to the pooled data, one study reported pain scores that could not be pooled.
Elokda (2015) presented mean VAS scores from 0 to 100 mm in figures. Pain score in the esmolol group was 50 and in the control group 53. This is not in line with the pooled data.
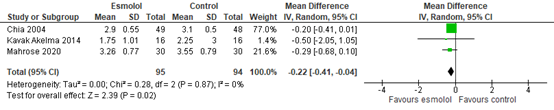
1.3 Postoperative pain at 12 hours post-surgery
Three studies reported complete data of postoperative pain at 12 hours post-surgery. As shown in figure 3, a MD of -0.22 (95% CI -0.41, -0.04) was found in favour of esmolol. This difference was considered not clinically relevant.
Figure 3. Pain scores at 12 hours post-surgery.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
Celebi (2014) reported mean VAS scores in figures. The esmolol group had a pain score of 1.15 and the control group 1.3.
Dhir (2015) presented mean pain scores in figures. Pain scores were 3.47 in the esmolol group and 2.6 in the control group.
Elokda (2015) presented mean VAS scores from 0 to 100 mm in figures. The pain score in the esmolol group was 52 in the control group and 66.
Bajracharya (2019) presented median postoperative pain scores at rest in figures. At 12 hours post-surgery, the VAS scores were similar in the esmolol group and the lidocaine group (both around 1).
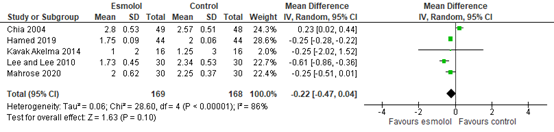
1.4 Postoperative pain at 24 hours post-surgery
In total, four studies reported pain scores at 24 hours post-surgery. As shown in figure 4, a MD of -0.22 (95% CI -0.47, 0.04) was found in favour of esmolol. This difference was considered not clinically relevant.
Figure 4. Pain scores at 24 hours post-surgery.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
Besides the pooled data, pain scores reported by three additional studies could not be pooled and are described below.
Celebi (2014) presented mean pain scores in figures. They reported a VAS score of 1.15 in the esmolol group and 1.4 in the control group.
Dhir (2015) presented mean pain scores in figures. At 24 hours, the esmolol group had a pain score of 1.13 and the control group 1.93.
Elokda (2015) reported mean VAS pain scores from 0 to 100 mm in figures. In the esmolol group, a pain score of 57 was found and in the control group 64.
1.5 Postoperative pain at 48 hours post-surgery
Pain scores at 48 hours postoperatively were reported by Chia (2004) and Celebi (2014) in figures.
Chia (2004) reported a mean VAS score of 3.6 (SD 0.65) in the esmolol group and 3.46 (SD 0.57) in the control group. This difference was considered not clinically relevant.
Celebi (2014) reported a mean VAS of 1.65 in the esmolol group and 1.2 in the control group. This difference was considered not clinically relevant.
2. Postoperative opioid consumption
The consumption of rescue analgesics (opioids) is reported in a very heterogeneous manner in the included studies. Opioid doses were either reported as or converted to morphine milligram equivalent (MME) i.v. Postoperative opioid consumption was most commonly reported in PACU, 24 hours post-surgery and in the total postoperative period.
In PACU
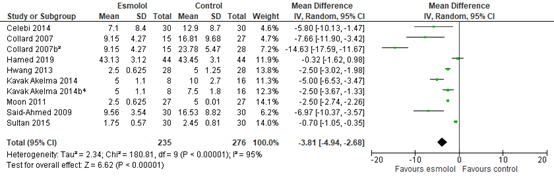
Eight studies reported postoperative opioid consumption in PACU. As shown in figure 5, a MD of -3.81 (95% CI -4.94 to -2.68) was found in favour of esmolol. This difference is not clinically relevant.
Figure 5. Postoperative opioid consumption in PACU.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
1 Esmolol vs fentanyl
2 Esmolol vs remifentanil
3 Esmolol vs lidocaine
Additionally, postoperative opioid consumption from one study could not be pooled due to limited (absolute) data.
López-Álvarez (2012) presented postoperative morphine consumption in figures. The total consumption in PACU was lower in the esmolol group, which is in line with the pooled data.
In 24 hours
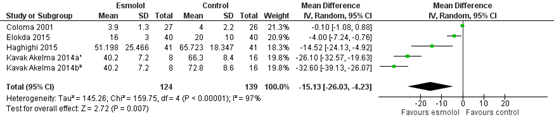
Four studies reported postoperative opioid consumption in 24 hours. As shown in figure 6, a MD of -15.13 (95% CI -26.03 to -4.23) was found in favour of esmolol. This difference is considered clinically relevant.
Figure 6. Postoperative opioid consumption 24 hrs.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
1 Esmolol vs remifentanil
2 Esmolol vs lidocaine
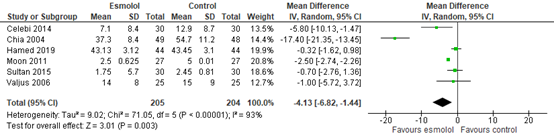
Total postoperative period
Six studies reported total postoperative opioid consumption. As shown in figure 7, a MD of -4.13 (95% CI -6.82, -1.44) was found in favour of esmolol. This difference is considered not clinically relevant.
Figure 7. Opioid consumption in total postoperative period.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
3. Adverse events
Data on the adverse events of interest -hypotension and bradycardia- were not provided. However, Gelineau (2018) did report additional information on change in heart rate and blood pressure in the included studies.
Gelineau (2018) stated that five studies noted no significant difference in heart rate between groups. In three studies, the intraoperative heart rate was lower compared to control at those time points and in one study, it was higher. Four studies noted a lower heart rate in the esmolol group at the majority or all of the time points measured intraoperatively. Two studies noted a higher heart rate in the esmolol group at most or all of the time points measured intraoperatively.
Gelineau (2018) reported that eight studies had no significant difference in the mean blood pressure between groups. Three studies noted significant lower blood pressure within the esmolol group only at some time points intraoperatively. Two studies noted a lower blood pressure in the esmolol group at the majority or all time points measured intraoperatively. Two studies noted a higher blood pressure in the esmolol group at most or all time points measured intraoperatively.
Gelineau (2018) concludes that no studies reported an increased incidence of clinically significant episodes of bradycardia or hypotension in the esmolol group.
Level of evidence of the literature
The level of evidence regarding all outcome measures started as high, because the studies were RCTs.
The level of evidence regarding the outcome measure postoperative pain at PACU arrival was downgraded by two levels because of conflicting results (inconsistency, -1) number of included patients and the pooled effect crossing the border of clinical relevance (imprecision -1). The level of evidence is low (GRADE).
The level of evidence regarding the outcome measure postoperative pain at 6 hours post-surgery was downgraded by two levels because of study limitations (risk of bias -1), and number of included patients and the pooled effect crossing the border of clinical relevance (imprecision -1). The level of evidence is low (GRADE).
The level of evidence regarding the outcome measure postoperative pain at 12 hours post-surgery was downgraded by two levels because of the number of included patients (imprecision -2). The level of evidence is low (GRADE).
The level of evidence regarding the outcome measure postoperative pain at 24 hours post-surgery was downgraded by two levels because of conflicting results (inconsistency -1), and number of included patients and the pooled effect crossing the border of clinical relevance (imprecision -1). The level of evidence is low (GRADE).
The level of evidence regarding the outcome measure postoperative pain at 48 hours post-surgery was downgraded by one level because of the number of included patients (imprecision -1). The level of evidence is moderate (GRADE).
The level of evidence regarding the outcome measure postoperative opioid consumption in PACU was downgraded by two levels because of study limitations (risk of bias: lack of blinding -1), number of included patients (imprecision -1). The level of evidence is low (GRADE).
The level of evidence regarding the outcome measure postoperative opioid consumption in 24 hours was downgraded by one level because of and number of included patients and the pooled effect crossing the border of clinical relevance (imprecision -1). The level of evidence is moderate (GRADE).
The level of evidence regarding the outcome measure total postoperative opioid consumption was downgraded by two levels because of study limitations (risk of bias, -1), and the number of included patients and the pooled effect crossing the border of clinical relevance (imprecision -1). The level of evidence is low (GRADE).
The level of evidence regarding the adverse events (hypotension and bradycardia) could not be graded.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of adding esmolol perioperatively to standard care in surgical patients on postoperative pain and postoperative opioid consumption?
P: patients Surgical patients
I: intervention Adding esmolol to standard analgesic methods (multimodal analgesia, opioid or local anesthesia)
C: control Standard care
O: outcome measure 1 . Postoperative pain
2. Postoperative opioid consumption
3. Adverse events
Relevant outcome measures
The guideline development group considered postoperative pain as a critical outcome measure for decision making; and adverse events and opioid consumption as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
Postoperative pain at rest: Validated pain scale (Visual Analogue Scale (VAS), Numeric Rating Scale (NRS) or Verbal Rating Scale (VRS)) at post-anesthesia care unit (PACU) arrival, 6, 12, 24 and 48 hours post-surgery.
Opioid consumption was assessed in PACU, in 24 hours post-surgery in the total postoperative period.
Adverse events of interest were hypotension and bradycardia (as defined by the studies).
A priori, the working group did not define the other outcome measures listed above but used the definitions used in the studies.
The working group defined one point as a minimal clinically (patient) important difference on a 10-point pain score and 10 mm on a 100 mm pain scale. Regarding postoperative opioid consumption, a difference of 10 mg was considered clinically relevant. For dichotomous variables, a difference of 10% was considered clinically relevant (RR <0.91 or >1.10).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 9-12-2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 304 hits. Studies were selected based on the following criteria:
- Systematic review or RCT
- Published ≥ 2000
- Patients ≥ 18 years
- Conform PICO
Thirty-eight studies were initially selected based on title and abstract screening. After reading the full text, 13 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 5 studies were included.
Results
Twenty-five studies (of which 21 studies originated from one systematic review; Gelineau (2018) and 4 single RCTs (Mahrose, 2020; Vahabi, 2018; Hamed, 2019; Bajracharya, 2019) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bajracharya, J. L., Subedi, A., Pokharel, K., & Bhattarai, B. (2019). The effect of intraoperative lidocaine versus esmolol infusion on postoperative analgesia in laparoscopic cholecystectomy: a randomized clinical trial. BMC anesthesiology, 19(1), 1-9.
- Gelineau, A. M., King, M. R., Ladha, K. S., Burns, S. M., Houle, T., & Anderson, T. A. (2018). Intraoperative esmolol as an adjunct for perioperative opioid and postoperative pain reduction: a systematic review, meta-analysis, and meta-regression. Anesthesia & Analgesia, 126(3), 1035-1049.
- Hamed, J. M. E., & Ataalla, W. M. (2019). Esmolol infusion reduces blood loss and opiate consumption during fertility preserving myomectomy. Anesthesia, essays and researches, 13(3), 423.
- Mahrose, R., & Elgharabawy, W. (2020). Role of intraoperative beta blocker for morbid obese patients undergoing laparoscopic bariatric surgery. Sri Lankan Journal of Anaesthesiology, 28(2).
- Vahabi, S., Rafieian, Y., & Abbas Zadeh, A. (2018). The effects of intraoperative esmolol infusion on the postoperative pain and hemodynamic stability after rhinoplasty. Journal of Investigative Surgery, 31(2), 82-88.
Evidence tabellen
Evidence tables
Evidence table for systematic reviews
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Gelineau, 2018 |
SR, meta-analysis, and meta-regression of 23 RCTs
Literature search up to March 2016
A: Bhawna 2012 B: Celebi 2014 C: Chia 2004 D: Collard 2007 E: Coloma 2001 F: Dhir 2015 G: Elokda 2015 H: Gokce 2009 I: Haghighi 2015 J: Hwang 2013 K: Kamal 2015 L: Kavak Akelma 2014 M: Lee 2014 N: Lee 2010 O: López-Álvarez 2012 P: Moon 2011 Q: Ozturk 2008 R: Qureshi 2014 S: Said-Ahmed 2009 T: Smith 1991 U: Sultan 2015 V: Valjus 2006 W: White 2003
Source of funding: ? |
Inclusion criteria Gelineau
- randomized - placebo, opioid, or local anesthetic controlled - written in English - intervention group received an intraoperative esmolol infusion - reported postoperative opioid dose, postoperative pain scores, or intraoperative opioid dose
Exclusion criteria Gelineau - studies that reported only hemodynamic changes, depth of anesthesia comparisons or intraoperative anesthetic requirements - Unpublished abstracts or reports
Type of surgery A: lower abdominal surgery B/H: Septorhinoplasty C: Total abdominal hysterectomy D/Q: Ambulatory laparoscopic cholecystectomy E: Laparoscopic tubal ligation F/L/M/O/R: Laporascopic cholecystectomy G: Arthroscopic shoulder surgery I: Lower limb orthopedic surgery J: Laparoscopic gynecologic surgery K: Inguinal herniotomy N: Laparoscopic appendectomy P/U/W: Ambulatory laparoscopic gynecologic surgery S: Ambulatory laparoscopic inguinal hernia repair T: Arthroscopy V: Elective gynecologic laparoscopic daycase surgery due to endometriosis and/or an ovarian cyst
|
Esmolol
Dose (n) A: 0.5 mg·kg−1 20 min before induction then 0.5 μg·kg−1·min−1 (25) B/F: 0.5 mg·kg−1 then 0.05 μg·kg−1·min−1 (30/30) C: 0.5 mg·kg−1 30 min before induction then 0.05 mg·kg−1·min−1 (49) D/E/S: 1.0 mg·kg−1 then 5–15 μg·kg−1·min−1 (30/27/30) G: 1 mg·kg−1 then 15 μg·kg−1·min−1 (40) H: 0.5 mg·kg−1 then 100–300 μg·kg−1·min−1 (20) I: 0.5 mg·kg−1 30 min before induction then 5 μg·kg−1·min−1 (41) J/P: 0.5 mg·kg−1 then 30 μg·kg−1·min−1 (28/27) K/O: 0.5 mg·kg−1 then 5–15 μg·kg−1·min−1 (30/30) L: 1 mg·kg−1 then 50 μg·kg−1·min−1 (16) M: 0.5 mg·kg−1 then 10 μg·kg−1·min−1 (20) N: 1.0 mg·kg−1 then 10 μg·kg−1·min−1 then 1.0 mg·kg−1 before extubation (30) Q/R: 1.0 mg·kg−1 then 5–10 μg·kg−1·min−1 (20/30) T: 2 mg·kg−1 2 min then 100 μg·kg−1·min−1 then decreased to 25 μg·kg−1·min−1 after induction (47) U: 1 mg·kg−1 then 30 μg·kg−1·min−1 (30) V: 1 mg·kg−1 then 20 μg·kg−1·min−1 (25) W: 50 mg then 0.005 mg·kg−1·min−1 (15) OR esmolol 50 mg + nicardipine 1 mg iv (15) |
A/B/C/F/G/I/J/M/N/P/U/W: Normal saline (n=25/30/48/30/ 40/41/28/20/30/27/30/15) D: Remifentanil 1.0 μg·kg−1 then 0.1–0.50 μg·kg−1·min−1 (28) or fentanyl (27) [3 treatment arms] E: Remifentanil 1.0 μg·kg−1 then 0.025–0.125 μg·kg−1·min−1 (26) H: Remifentanil 1 mg·kg−1 then 0.1–0.5 μg·kg−1·min−1 titrated to MAP of 50–65 (20) K: Ropivacaine wound infiltration (30) L: Remifentanil 10 μg then NS infusion (16) O: Ketamine 0.5 mg·kg−1 and remifentanil 0.5 μg·kg−1 then 0.1–0. μg·kg−1·min−1 (30) Q/R: Ringer’s lactate (20/30) S: Fentanyl 1.0 μg·kg−1 then scheduled fentanyl boluses 50 μg q 30 min (30) T: Alfentanil (16 μg·kg−1) then 0.80 μg·kg−1·min−1 until intubation then 0.20 μg·kg−1·min−1 (50) V: Remifentanil 1 mg·kg−1 then remifentanil 0.2 μg·kg−1·min−1 (25) |
Endpoint of follow-up:
A: 30 min B: 48 h C: 72 h D: 24 h from hospital discharge E/F/G/L/N/Q/R: 24 h H/J/P/T: up until discharge I/M: 6 h K: 9 h O: 180 min S: 2 h V: up until post-operative day 1 U/W: ?
Loss to follow-up or incomplete data: NR |
Postoperative pain score with and without movement presented as mean (± SD) or median (IQR); p-value, dose morphine equivalent, time to first analgesic, required rescue analgesic (%),
Postoperative pain score (at rest or no movement reported [I vs C]) 0 min: B: 2.35 vs 4.8; p<0.05 [median VAS 0-10] D: 5 vs 2.5 vs 3; NS [median VRS 0-10 esmolol vs remifentanil vs fentanyl] F: 1.8 vs 4.77; p<0.001 [mean VAS 0-10] G: 38 vs 57; NR [mean VAS 0-100] I: 4.19 (±2.05) vs 6.29 (±2.14); p=0.02 [mean VAS 0-10] J: 4.9 (±1.5) vs 6.1 (±1.1); p<0.005 [mean NRS 0-10] M: 2.05 (± 1.65) vs 5.1 (±2.2); p<0.05 [mean VAS 0-10] P: 4.5 (±1.8) vs 6.1 (±1.4); p<0.05 [mean NRS 0-10] S: 4 (2-6) vs 3.5 (2-5); NS [median VAS 0-10] U: 3 vs 4; p=0.000
60 min: B: 2.6 vs 3.6; p<0.05 [median VAS 0-10] D: 3 (2-4) vs 3 (1-4) vs 3 (1-5); NS [median VRS 0-10] F: 1.27 vs 1.63; NR [mean VAS 0-10] G: 45 vs 57; NR [mean VAS 0-100] K: 2 (2-2) vs 3 (2-3); p=0.008 [median VAS 0-10] M: 3.2 (±1.45) vs 3.4 (±1.6) [mean VAS 0-10] O: 2 (2-2) vs 3 (2-4); NS [median VNRS 0-10] S: 3.5 (2-5) vs 3 (1-5); NS [median VAS 0-10] T: 38 (±4) vs 36 (±3]; NS [VAS 0-100 mean±SEM]
6h: G: 50 vs 53; NR [mean VAS 0-100] I: 5.21 (±1.87) vs 6.43 (±1.48); p=0.001 [mean VAS 0-10] K: 3 (3-4) vs 5 (4-5); p<0.001 [median VAS 0-10] L: 3 (3-4) vs 3 (2-3); 0.454 [median VAS 0-10] M: 2.2 (±1.0) vs 3.5 (±0.9); NS [mean VAS 0-10] N: 23.1 (±6.1) vs 33.5 (±6.3); NS [mean VAS 0-100]
24h: B: 1.15 vs 1.4; NS [median VAS 0-10] C: 2.8 (±0.53) vs 2.57 (±0.51); NS [mean VAS 0-10] D: 2 vs 3 vs 3; NS [median VRS 0-10] F: 1.13 vs 1.93; NR [mean VAS 0-10] G: 57 vs 64; NR [mean VAS 0-100] L: 1 (0-2) vs 1 (0-3) ; p=0.357 [median VAS 0-10] N: 17.3 (±4.5) vs 23.4 (±5.3); NS [mean VAS 0-100]
48h: B: 1.65 vs 1.2; NS [median VAS 0-10] C: 2.15 (±0.45) vs 1.85 (±0.37); NS [mean VAS 0-10]
Mean dose morphine equivalent A: 3.72 (±1.308) vs 7.20 (±1.732); p=0 (mg morphine used in 30min) B: 7.1 (±8.4) vs 12.9 (±8.7); p=0.001 (mg morphine used in PACU) C: 37.3 (± 8.4) vs 54.7 (± 11.2); p=0.005 (mg morphine for POD 0–3) D: i. 91.5 (±42.7) vs 247.7 (±54.77) vs 168.1 (±96.8); p<0.0001 (µg fentanyl in PACU [esmolol vs remifentanil vs fentanyl]) ii. 40 (20–63) vs 50 (36-80) vs 60 (30-80); NS (median mg morphine equivalent POD1) E: 39 (±13) vs 40 (±22); NS (µg fentanyl in 24h) G: i. mg morphine at 1 h: 3.5 (±1) vs 6 (±2); p=0.023 ii. mg morphine at 6 h: 7.1 (±3) vs 13 (±3); p=0.0001 iii. mg morphine at 12 h: 8.7 (±3) vs 15 (±3); p=0.0000 iv. mg morphine at 24 h: 16 (±3) vs 20 (±10); p=0.000516 I: mg meperidine in 24 h: 73.14 (±36.38) vs 93.89 (±26.21); p=0.004 J: 50 (±11) vs 100 (±27); p=0.000 (µg fentanyl in PACU) K: µg fentanyl in PACU: 25 vs 50; p=0.008 L: i. µg fentanyl in PACU: 50 (±11) vs 100 (±27); p=0.000 ii. µg fentanyl in 24h: 402 (±72) vs 663 (±84); p=0.000 M: 37 (±32) vs 66 (±40); p<0.05 (µg fentanyl in first hour after surgery) P: 25 (0-25) vs 50 (50-50); P<0.005 (µg fentanyl in PACU) S: 95.6 (±35.4) vs 165.3 (±88.2); p=0.001 (µg fentanyl in PACU) U: 17.5 (±5.7) vs 24.5 (±8.1); p=0.0002 (µg fentanyl in PACU) V: 0.14 (±0.08) vs 0.15 (±0.09); NS (mg fentanyl in PACU)
Required rescue analgesic I vs C (%): B: morphine 53.3 vs 86.7; p=0.005 E: fentanyl: 26 vs 19 J: fentanyl: 82 vs 96; p=0.096 O: morphine: 23 vs 83 P: fentanyl: 56 vs 89; p<0.05 Q: morphine: 65 vs 30; p<0.05 T: opioids: 57 vs 34; P<0.05 W: fentanyl: 80 vs 47; p<0.05
Heart rate (HR) and blood pressure (BP): No absolute data reported, but: - 15 studies (A/B/C/E/G/H/K/L/M /N/O/R/T/U/W) quantitatively compared and reported changes in intraoperative HR and/or BP between the esmolol and control groups. - 5 studies (E/K/L/M/W) noted no significant difference in the HR between groups. - 4 studies noted significant changes in the HR within the esmolol group only at some time points intraoperatively; in 3 studies (A/H/N), the HR was lower compared to control at those time points, and in 1 study (B), it was higher. - 8 studies (B/C/K/L/M/R/T/W) noted no significant difference in the mean BP between groups - 3 studies (A/H/N) noted significant changes in the BP within the esmolol group only at some time points intraoperatively; the BP was lower compared to control at those time points - 2 studies (G/U) noted a lower BP in the esmolol group at most or all of the time points measured intraoperatively; the control group received a crystalloid solution in both studies
Other adverse effects: No absolute data were presented “No studies reported an increased incidence of clinically significant episodes of bradycardia or hypotension in the esmolol group.”
Meta-analysis Standard. mean difference (SMD) [95% CI] SMD <0 favors I (esmolol) SMD >0 favors C (control)
Included: all studies that reported a standardized outcome measure of interest.
Effect postoperative opioid consumption in the PACU (MME) A: -2.232 [-2.950; -1.514] B: -0.669 [-1.190; -0.148] D: -0.382 [-0.907; 0.143] G: -1.566 [-2.070; -1.062] J: -0.842 [-1.390; -0.294] L: -2.364 [-3.293; -1.435] M: -0.785 [-1.430; -0.139] O: -3.332 [-4.130; -2.534] P: -0.841 [-1.400; -0.283] S: -1.024 [-1.564; -0483] U: -0.987 [-1.525; -0.449] V: -0.116 [-0.670; 0.439] Overall: -1.214 [-1.660; -0.769] Heterogeneity: I2= 85.2% Variance: τ2 = 0.5199; p<0.0001
Effect postoperative VAS pain scores in the first hour post-surgery A: -1.309 [-1.925; -0.694] C: -0.323 [-0.723; 0.078] I: -0.993 [-1.453; -0.533] K: -1.334 [-1.897; -0.771] L: -1.317 [-2.091; -0.543] M: -0.618 [-1.254; -0.018] N: -4.357 [-5.309; -3.405] S: 0.189 [-0.319; -0.696] T: 3.307 [2.687; 3.926] U: -0.333 [-0.843; 0.176] V: 0.225 [-0.331; 0.781] Overall: -0.599 [-1.440; 0.242] Heterogeneity: I2= 95.9% Variance: τ2 = 1.927; p<0.0001
|
Author’s conclusion: Intraoperative esmolol (1) decreases intraoperative opioid use compared to both remifentanil and nonremifentanil opioid controls, (2) decreases immediate postoperative pain scores compared to a crystalloid control, (3) results in equivalent immediate postoperative pain scores compared to an opioid control, (4) decreases PACU opioid consumption compared to a crystalloid control, and (5) decreases PACU opioid consumption compared to an opioid control.
|
Evidence table for RCTs
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Vahabi, 2018 |
Type of study: RCT
Setting and country: Patients from Shohada–e Ashayer hospital in Iran undergoing rhinoplasty
Funding and conflicts of interest: None |
Inclusion criteria: Age between 18 and 60 years, ASA class 1 and 2, Rhinoplasty performed under general anesthesia, and no history of allergy to esmolol.
Exclusion criteria: Drug addiction, presence of underlying cardiovascular disease, pregnancy or breast feeding, receiving analgesic or any medications since 48 hours before the surgery, surgery time >3 hours, and underlying asthma and other respiratory disease, renal, liver, metabolic and neurologic disease
N total at baseline: N=56 rhinoplasty patients Intervention: 28 Control: 28
Important prognostic factors2: age ± SD: I: 27.2 ± 4.5 C: 25.8 ± 3.7
Sex: I: 49.9% M C: 35.7% M
Groups comparable at baseline? Demographics at group comparable at baseline
|
Rhinoplasty with administration of 5– 10 µg/kg/min of esmolol in combination with propofol and remifentanil titrated to hemodynamic response.
|
Rhinoplasty with administration of normal saline, having same volume as the esmolol in addition to propofol and remifentanil. |
Length of follow-up: 30 minutes, 1 hour and 3 hours post-surgery
Loss-to-follow-up: None
Incomplete outcome data: NR |
Data presented as mean ± SD
1h post-operative pain score (VAS 0-10) I: 1.67 ± 1.2 P=0.001
Morphine used at 30 min post-op (mg) I: 0.17 ± 94 C: 0.57 ± 1.689
Morphine used at 1h post-op (mg) I: 1.13 ± 0.21 C: 0.67 ± 2.03
Morphine used at 3h post-op (mg) I: 1.35 ± 2.6 C: 5.7 ± 2.2
|
- |
|
Hamed, 2019 |
Type of study: RCT
Setting and country: Patients undergoing myomectomy at a tertiary referral hospital in Saudi Arabia
Funding and conflicts of interest: None |
Inclusion criteria: Women in the childbearing period; large or multiple myomas presenting by infertility or dysfunctional uterine bleeding; assigned for fertility-preserving myomectomy.
Exclusion criteria: gynaecological malignancy; kidney or liver dysfunctions
N total at baseline: N=88 myomectomy patients Intervention: 44 Control: 44
Important prognostic factors2: age ± SD: I: 34.4±6.7 C: 35.3±5.8
BMI ± SD: I: 29.6±2.2 C: 29.8±2.3
ASA (I/II): I: 25/11 C: 39/10
Groups comparable at baseline? Demographics of groups comparable at baseline
|
Myomectomy with administration of 0.5 mg.kg-1 esmolol-induced hypotensive anaesthesia as priming dose without uterine tourniquet and an esmolol infusion at rate of 0.05-0.3 mg.kg-1.min-1 during myomectomy. |
Myomectomy with normotensive anaesthesia with uterine tourniquet |
Length of follow-up: 24 h post-surgery
Loss to follow-up: None
Incomplete outcome data: NR |
Data presented as mean ± SD unless stated otherwise
24h post-operative pain score (NRS 0-10) Median (IQR) I: 1.75 (1.625-2) C: 2 (1.875-2.125) P=0.0022
Total post-operative Fentanyl dose (µg) I: 431.3 ± 31.2 C: 434.5 ± 31 P=0.628
|
Control group underwent surgery with a uterine tourniquet, while the intervention had surgery without. This might have influenced other outcome measures. |
|
Bajracharya, 2019 |
Type of study: RCT
Setting and country: Study conducted at the BP Koirala Institute of Health Sciences in Nepal.
Funding and conflicts of interest: None |
Inclusion criteria: Female patients aged 18 to 60 years; general anesthesia for elective laparoscopic cholecystectomy
Exclusion criteria: Inability to comprehend VAS or severe mental impairment; difficult intubation, pregnancy, morbid obesity; history of epilepsy or allergy to any drugs used in the study; antagonists; baseline heart rate < 50 beats/min; acute cholecystitis, and chronic pain other than cholelithiasis.
N total at baseline: N=90 patients Intervention: 45 Control: 45
Important prognostic factors2: Age median (IQR): I: 40 (27–48) C: 35 (30–49)
BMI: I: 22.5 ± 2.5 C: 22.4 ± 3.1
ASA (I/II): I: 34/9 C: 35/8
Groups comparable at baseline? Both groups were similar with respect to baseline demographic characteristics, duration of surgery and anaesthesia time |
Laparoscopic cholecystectomy patients in the Esmolol group received an IV bolus of esmolol (0.5 mg/kg) during induction followed by an infusion titrated between 5 and 15 μg/kg/min to maintain the HR within 25% of the baseline value. In both groups, 1 g of IV paracetamol was infused over 15 min after the induction of anaesthesia. |
Laparoscopic cholecystectomy patients in the Lidocaine group received 1.5 mg/kg of lidocaine IV bolus followed by an infusion at 1.5 mg/kg/h. In both groups, 1 g of IV paracetamol was infused over 15 min after the induction of anaesthesia. |
Length of follow-up: Pain score: 15 min, 30 min, 1 h, 2, 6, 12, 24 h
Loss to follow-up: 4 (2 intervention, 2 comparison) Reason: conversion to open cholecystectomy
Incomplete outcome data: NR |
PACU morphine usage (mg): Median (IQR) I: 1(0–1.5) C: 1 (0–1.5) P=0.50
24h total morphine equivalent consumed (mg): Median (IQR) I: 1 (0–1.5) C: 1.5 (1–2) p = 0.27
Post-operative pain scores (VAS 0-10) No absolute values are presented. “Mixed model analysis revealed no difference in postoperative VAS scores for pain at rest (group time interaction effect, p=0.38; Fig. 4) or with movement (group time interaction effect, p=0.25; Fig. 5) between the two groups.”
|
Only female patients included, hence potentially impaired external validity. |
|
Mahrose, 2020 |
Type of study: RCT
Setting and country: Patients scheduled for elective abdominal laparoscopic bariatric surgeries under general anaesthesia in Ain Shams University Hospitals in Cairo, Egypt.
Funding and conflicts of interest: NR |
Inclusion criteria: ASA II patients, with age between 18-59 years, of both genders, with BMI 40-50kg/m2
Exclusion criteria: Patients with hepatic impairment, renal impairment, cardiac failure, or respiratory failure and patients with a history of any drug abuse or who were already drug abusers
N total at baseline: N=60 patients I: 30
Important prognostic factors2: Age ± SD I: 31.21±8.11 C: 32.4±6.92
BMI I: 47.9±13.3 C: 45.9±9.2
Sex I: 36.7% M C: 30% M
ASA (I/II): I: 0/30 C: 0/30
Groups comparable at baseline? Both the groups were similar with respect to baseline demographic characteristics |
Patients scheduled for laparoscopic bariatric surgeries received propofol, fentanyl and rocuronium for induction. The intervention group also received an esmolol loading dose of 1mg/kg diluted in 50ml isotonic saline over 30 minutes before anaesthesia induction, then esmolol 10μg/kg/min infusion until the end of the surgery. Patients were monitored during the intraoperative period and postoperatively for 24 h for analgesic requirements and PONV, and VAS pain scores were assessed.
Anaesthesia induction was the same for both groups by using propofol 2mg/kg mixed with lidocaine 20mg over 20 seconds, fentanyl 1μg/kg, and rocuronium 0.8mg/kg to facilitate tracheal intubation. Maintenance of anaesthesia was done by using fentanyl infusion of 0.025 - 0.25 μg/kg/min of ideal body weight (IBW) and sevoflurane (2-4)% in 100% oxygen and muscle relaxation was maintained with boluses of rocuronium 10 mg and adjusted to provide complete depression of the first twitch of train of four (TOF) stimulation |
Patients scheduled for laparoscopic bariatric surgeries received propofol, fentanyl and rocuronium for induction. The control group received 50ml of isotonic saline over 30min, followed by an infusion of isotonic saline at same rate of the intervention group till end of surgery. Monitoring intra-and postoperatively and assessing pain scores were done identically to the intervention group. |
Length of follow-up: 30min after recovery, 1h, 2h, 3h, 4h, 8h, 12h, 16h, 20h, and 24h.
Loss to follow-up: None
Incomplete outcome data: NR |
Data presented as mean ± SD
Pain score (VAS 0-10) Immediate postoperative I: 1.68±0.43 C: 5.10±0.28 p<0.0001
1 hour I: 2.15±0.44 C: 5.53±0.66 P<0.0001
24 hour I: 2.00±0.62 C: 2.25±0.37 P=0.0629
Analgesia requirement in postoperative 24h, n(%) I: 4/30 (13.3) C: 13/30 (43.3) P=0.0219
|
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Gelineau, 2018 |
Yes Research question corresponds to question of our review
|
Yes
|
Yes Included studies are described. Excluded studies as well, although the frequency for each reason of exclusion is not mentioned. |
No Lacks absolute data |
NA |
Yes |
No Pooled data for post-operative opioid dose was from various time points (0 to 2h). |
No |
Yes however individual studies are not discussed
|
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Vahabi, 2018 |
Definitely no
Reason: Randomization based on the medical record number (even and odd numbers). |
Definitely no
Reason: Inadequate randomization method |
Probably no;
Reason: Patients and data collectors who took the questionnaires and were responsible for the evaluation and follow-up were blinded. Blinding of health care providers and data analysts was not reported |
Probably yes;
Reason: No loss to follow-up or missing data reported |
Probably yes;
Reason: No study registration or protocol reported. Relevant outcomes were reported. |
Probably yes;
Reason: no problems with conflict of interest, no premature ending etc. |
HIGH
Reason: possible randomization problems, lack of blinding |
|
Hamed, 2019 |
Definitely yes;
Reason: Randomization was conducted using sealed envelopes containing cards carrying the group label |
Definitely yes;
Reason: Randomization was conducted using sealed envelopes containing cards carrying the group label |
Definitely no;
Reason: Patients and health care providers could not be blinded. The research assistant responsible for the allocation was blinded. The blinding of data analysts was not reported. |
Probably yes;
Reason: No loss to follow-up or missing data reported |
Probably yes;
Reason: No study registration or protocol reported. Relevant outcomes were reported. |
Probably no;
Reason: Difference between groups in uterine tourniquet use. No other problems. |
Some concerns
Reason: lack of blinding, different intervention procedures performed (tourniquet) |
|
Bajracharya, 2019 |
Definitely yes;
Reason: Randomization according to a computer generated random number table |
Definitely yes;
Reason: Allocation was kept in sealed opaque envelopes |
Probably yes;
Reason: Both the patient and the investigator observing the outcome were blinded to the patient group assignment. The attending anaesthesiologist not involved in the study managed the case intraoperatively. The blinding of health care provider and data analysts was not reported. |
Probably yes;
Reason: Loss to follow-up was infrequent and even in intervention and control group (2 patients for each group). No missing data was reported. |
Probably no;
Reason: Study registration is reported, but protocol is not. The secondary outcome ‘Time to first analgesic request’ is not reported, although this is not relevant for our study. Events of bradycardia and hypotension were reported but not described as outcome measures in the methods.
ClinicalTrials.gov Identifier: NCT02327923 |
Probably yes;
No problems regarding sponsor, premature ending, no conflicts of interest etc. |
LOW |
|
Mahrose, 2020 |
Definitely yes;
Reason: Randomization by computer generated random numbers using numbered sealed envelopes in a double blind manner. |
Definitely yes;
Reason: Randomization by computer generated random numbers using numbered sealed envelopes in a double blind manner. |
Probably yes;
Reason: Patients, medical staff member preparing the infusion and anaesthesiologist managing the study were blinded, as well as the person doing the post-operative evaluation. The blinding of data analysts was not reported. |
Probably yes;
Reason: No loss to follow-up or missing data reported |
Probably yes;
Reason: No protocol or study registration reported. Relevant outcomes were reported.
|
No information;
No details on funding and possible competing interests were reported. However, esmolol is a generic betablocker and studies are generally not sponsored by the pharmaceutical industry. |
LOW |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Gökce 2009 |
A priori defined outcomes do not correspond |
|
Qureshi 2014 |
A priori defined outcomes do not correspond |
|
Kadoi 2010 |
No original research |
|
Bahr 2018 |
No original research |
|
Kim 2021 |
No original research |
|
Härkänen 2015 |
PICO does not correspond |
|
Li 2020 |
Article unavailable |
|
Watts 2017 |
Wrong comparator |
|
Bajwa 2016 |
Wrong outcomes |
|
Srivastava 2015 |
Wrong outcomes |
|
Shams 2013 |
Wrong outcomes |
|
Nazir 2016 |
Wrong outcomes |
|
Liu 2020 |
PICO does not correspond |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-09-2023
Beoordeeld op geldigheid : 01-09-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met postoperatieve pijn.
Samenstelling van de werkgroep
Werkgroep
Prof. dr. J. (Jörgen) Bruhn, anesthesioloog, (voorzitter) NVA
Prof. dr. dr. M.W. (Markus) Hollmann, anesthesioloog, NVA
Dr. M.F. (Markus) Stevens, anesthesioloog, NVA
Drs. L.J.H. (Lea) van Wersch, anesthesioloog, NVA
Dr. M.H.J. (Margot) Roozekrans, anesthesioloog, NVA
Dr. S.A.S. (Sandra) van den Heuvel, anesthesioloog/pijnspecialist, NVA
Drs. S.J. (Stijn) Westerbos, orthopeed, NOV
Drs. W.L. (Wilson) Li, cardiothoracaal chirurg, NVT
S.F. (Cedric) Lau MSc, ziekenhuisapotheker, NVZA
Dr. R.L.M. (Rianne) van Boekel, verpleegkundig pijnconsulent, V&VN
Drs. I.L. (Ilona) Thomassen-Hilgersom, patiëntvertegenwoordiger, Samenwerkingverband Pijnpatiënten naar één stem
Klankbordgroep
Drs. N.C. (Niels) Gritters van den Oever, intensivist, NVIC
J.P. (Patrick) Rensink, anesthesiemedewerker/pijnconsulent, NVAM
Dr. G. (Gijs) Helmerhorst, orthopeed, NOV
Dr. C.D. (Cor) de Kroon, gynaecoloog-oncoloog, NVOG
Dr. W.J. (Wietse) Eshuis, chirurg, NVvH
Dr. D. (Daphne) Roos, chirurg, NVvH
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M. van Leeuwen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bruhn, voorzitter |
Professor & Afdelingshoofd afdeling Anesthesiologie, Radboud UMC |
Editorial Board Journal of Clinical Monitoring and Computing, onbetaald |
Geen |
Geen actie |
|
Hollmann |
Professor & Afdelingshoofd afdeling Anesthesiologie, Amsterdam UMC, locatie AMC |
|
Geen |
Restricties t.a.v. modules over ketamine en lidocaïne. |
|
Lau |
|
Nationale Werkgroep morbide obesitas en bariatrische chirurgie (KNMP), vergoeding voor bestede uren |
Geen belangenverstrengeling, promotie-onderzoek is op een ander vlak dan waar beoogde werkgroep zich over buigt
|
Geen actie |
|
Boekel, van |
|
|
Geen |
Geen actie |
|
Thomassen-Hilgersom |
Voorzitter Samenwerkingsverband Pijnpatiënten naar één stem vrijwilliger en geen werkgever |
|
Geen |
Geen actie |
|
Li |
Cardiothoracaal chirurg (Radboudumc, Nijmegen) |
Bestuurslid NVT (Nederlandse Vereniging voor Thoraxchirurgie) |
Radboudumc zal in 2021 meedoen aan een RCT naar de optimale vorm van pijnstilling ten tijde van longchirugie (epiduraal versus paravertebraal) OPtriAL - met ZonMw subsidie, geïniteerd vanuit het MMC |
Geen actie |
|
Roozekrans |
Anesthesioloog - Pijnspecialist - Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen actie |
|
Stevens |
Chef de Clinique kinderanesthesie AUMC locatie AMC |
|
Geen |
Geen actie |
|
Heuvel, van den |
Anesthesioloog-pijnarts, Radboud UMC |
Geen |
Geen |
Geen actie |
|
Wersch, van |
Anesthesioloog, Maasziekenhuis Pantein |
Geen |
Geen |
Geen actie |
|
Westerbos |
Orthopeed, Alrijne ziekenhuis |
Geen |
Geen |
Geen actie |
|
Gritters van den Oever |
Anesthesioloog-intensivist Treant Zorggroep |
|
Geen |
Geen actie |
|
Rensink |
|
|
Geen |
Geen actie |
|
Kroon, de |
Gynaecoloog-oncoloog Leids Univesitair Medisch Centrum (1.0 fte) |
|
Geen |
Geen actie |
|
Roos |
Chirurg |
Geen |
Geen |
Geen actie |
|
Eshuis |
Chirurg, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Willeboordse |
Senior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Partner werkzaam bij Janssen Vaccines, onderdeel van Johnsson &Johnsson, via partner ook financiële belangen (aandelen J&J) |
Geen actie |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Leeuwen, van |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Dijk, van |
Junior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door zitting van een afgevaardigde van de patiëntenvereniging (Pijnpatiënten naar één stem) in de werkgroep. De Patiëntenfederatie Nederland en Pijnpatiënten naar één stem werden uitgenodigd voor de invitational conference. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en Pijnpatiënten naar één stem en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Organisatie van Zorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Transitionele Pijn Service (TPS) |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten). Hoewel de aanbeveling aangeeft dat een andere of nieuwe manier van zorgverlening gewenst is (i.e. andere manier van samenwerking/afstemming tussen zorgverleners) waarbij een TPS-model met TPS-team geïnitieerd wordt, laten eerste kosten-effectiviteitsstudies kostenbesparingen zien. De verwachting is dat TPS leidt tot betere zorg-op-maat, waarbij chronische postoperatieve pijn zorg doelmatiger wordt behandeld. Per ziekenhuis zal de vorm, intensiteit en organisatie van het TPS-model variëren. Zo kunnen ziekenhuizen ook kiezen voor een minder uitgebreid TPS. De aanbeveling geeft relatief veel ruimte voor de precieze invulling. Alle overwegingen tezamen, worden er geen substantiële financiële gevolgen verwacht. |
|
Module Pijnmeting |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Niet-medicamenteuze interventies |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Buikwandblokken |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken bij mammachirurgie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken intrathoracaal |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Continue Wond infusie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cryoanalgesie |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Dexmethason |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Gabapentinoïden |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Ketamine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Magnesium |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Methadon |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Beta blokkers -Esmolol |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist - Clonidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist – Dexmedetomidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Lidocaïne |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Multimodale pijnbestrijding |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met postoperatieve pijn.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Postoperatieve pijn (NVA, 2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door relevante partijen middels een invitational conference.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
De beoordelingen van de literatuur en de conclusies zijn gedaan op basis van de GRADE systematiek. De werkgroep vindt het belangrijk om relevante beperkingen hiervan aan te geven.
De klinische vraag gaat vaak over een reductie van ernstige postoperatieve pijn en opioïdenconsumptie in een aantal patiënten met resp. over een klinisch relevante reductie van ernstige postoperatieve pijn opioïdenconsumptie bij een individuele patiënt. Hetzelfde geldt voor opioïdenconsumptie; de keuze van een absolute drempelwaarde in mg (i.p.v. een relatieve drempelwaarde in %) maakt dit afhankelijk van tijdstip, ingreep en ernst van de pijn: vroege postoperatieve tijdstippen en (studies met) ingrepen met relatief lage opioïdconsumptie kunnen vaak de MCID niet bereiken.
De keuze van de MCID heeft een bepaalde mate van willekeurigheid en is niet absoluut te zien. Ook zijn de conclusies zo geformuleerd (en geven alleen beperkt antwoord op het effect op een individuele patiënt voor een specifieke ingreep).
In de literatuur worden de eindpunten pijnscores en opioïdenconsumptie separaat van elkaar weer gegeven, suggererend dat deze onafhankelijk van elkaar zijn. Echter kunnen deze twee eindpunten niet onafhankelijk van elkaar beoordeeld worden; in ieder protocol is opgenomen dat pijn behandeld moet worden. Deze separate beoordeling geeft niet altijd een adequaat antwoord op de klinische vraag naar het analgetische effect van een interventie.
Daarnaast worden multimodale componenten als aparte interventies beoordeeld, echter de klinische vraag is naar de effectiviteit als bouwsteen van een multimodale werkwijze.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
Update Embase 29-06-2021
|
No. |
Query |
Results |
|
#11 |
#9 AND #10 |
2 |
|
#10 |
29028742:ui OR 32555939:ui |
2 |
|
#9 |
#5 AND #8 |
150 |
|
#8 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3320409 |
|
#7 |
#5 AND #6 |
17 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
741057 |
|
#5 |
#4 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
426 |
|
#4 |
#1 AND #2 AND #3 |
566 |
|
#3 |
'intraoperative period'/de OR 'intra operati*':ti,ab,kw OR peroperati*:ti,ab,kw OR 'per operati*':ti,ab,kw OR intraoperati*:ti,ab,kw |
250709 |
|
#2 |
'analgesic agent'/exp OR 'analgesic':ti,ab,kw OR 'analgesic agent':ti,ab,kw OR 'analgesic drug':ti,ab,kw OR 'analgesic evaluation':ti,ab,kw OR 'analgesic tv 393':ti,ab,kw OR 'analgesics':ti,ab,kw OR 'analgetic':ti,ab,kw OR 'analgetic agent':ti,ab,kw OR 'analgetic drug':ti,ab,kw OR 'anodyne':ti,ab,kw OR 'antalgic agent':ti,ab,kw OR 'non narcotic analgesic':ti,ab,kw OR 'non narcotic analgesic agent':ti,ab,kw OR 'nonnarcotic analgesic':ti,ab,kw OR 'nonnarcotic analgesic agent':ti,ab,kw OR 'analgesia'/exp OR 'analgesia':ti,ab,kw OR 'pain relief':ti,ab,kw OR 'sequential analgetic analgesia':ti,ab,kw OR 'surgical analgesia':ti,ab,kw OR 'postoperative pain'/exp OR 'postoperative pain':ti,ab,kw OR (('post operat*' NEAR/2 pain):ti,ab,kw) OR ('postoperative period'/exp AND 'pain'/exp) |
1231192 |
|
#1 |
'beta 1 adrenergic receptor blocking agent'/exp OR 'beta 1 adrenergic receptor blocking agent' OR 'adrenergic beta 1 antagonist*':ti,ab,kw OR 'adrenergic beta 1 receptor antagonist*':ti,ab,kw OR 'adrenergic beta-1 antagonist*':ti,ab,kw OR 'adrenergic beta-1 receptor antagonist*':ti,ab,kw OR 'beta 1 adrenergic antagonist*':ti,ab,kw OR 'beta 1 adrenergic blocker*':ti,ab,kw OR 'beta 1 adrenergic blocking agent*':ti,ab,kw OR 'beta 1 adrenergic receptor antagonist*':ti,ab,kw OR 'beta 1 adrenergic receptor blocker*':ti,ab,kw OR 'beta 1 adrenergic receptor blocking agent*':ti,ab,kw OR 'beta 1 adrenoceptor blocker*':ti,ab,kw OR 'beta 1 adrenoceptor blocking agent*':ti,ab,kw OR 'beta 1 blocker*':ti,ab,kw OR 'beta 1 blocking agent*':ti,ab,kw OR esmolol:ti,ab,kw OR 'beta blocker*':ti,ab,kw |
114809 |
Update Pubmed 29-06-2021
|
Search |
Query |
Results |
|
#10 |
Search: #5 AND #8 Sort by: Most Recent |
|
|
#9 |
Search: #5 AND #6 Sort by: Most Recent |
|
|
#8 |
Search: ("Meta-Analysis" [Publication Type] OR "Meta-Analysis as Topic"[Mesh] OR metaanaly*[tiab] OR meta-analy*[tiab] or metanaly*[tiab] OR "Systematic Review" [Publication Type] OR systematic[sb] OR "Cochrane Database Syst Rev"[Journal] or prisma[tiab] OR preferred reporting items[tiab] OR prospero[tiab] OR ((systemati*[ti] OR scoping[ti] OR umbrella[ti] OR structured literature[ti]) AND (review*[ti] OR overview*[ti])) OR systematic review*[tiab] OR scoping review*[tiab] OR umbrella review*[tiab] OR structured literature review*[tiab] OR systematic qualitative review*[tiab] OR systematic quantitative review*[tiab] OR systematic search and review[tiab] OR systematized review[tiab] OR systematised review[tiab] OR systemic review[tiab] OR systematic literature review*[tiab] OR systematic integrative literature review*[tiab] OR systematically review*[tiab] OR scoping literature review*[tiab] OR systematic critical review[tiab] OR systematic integrative review*[tiab] OR systematic evidence review[tiab] OR Systematic integrative literature review*[tiab] OR Systematic mixed studies review*[tiab] OR Systematized literature review*[tiab] OR Systematic overview*[tiab] OR Systematic narrative review*[tiab] OR ((systemati*[tiab] OR literature[tiab] OR database*[tiab] OR data-base*[tiab] OR structured[tiab] OR comprehensive*[tiab] OR systemic*[tiab]) AND search*[tiab]) OR (Literature[ti] AND review[ti] AND (database*[tiab] OR data-base*[tiab] OR search*[tiab])) OR ((data extraction[tiab] OR data source*[tiab]) AND study selection[tiab]) OR (search strategy[tiab] AND selection criteria[tiab]) OR (data source*[tiab] AND data synthesis[tiab]) OR medline[tiab] OR pubmed[tiab] OR embase[tiab] OR Cochrane[tiab] OR ((critical[ti] OR rapid[ti]) AND (review*[ti] OR overview*[ti] OR synthes*[ti])) OR (((critical*[tiab] OR rapid*[tiab]) AND (review*[tiab] OR overview*[tiab] OR synthes*[tiab]) AND (search*[tiab] OR database*[tiab] OR data-base*[tiab]))) OR metasynthes*[tiab] OR meta-synthes*[tiab]) NOT ("Comment" [Publication Type] OR "Letter" [Publication Type] OR "Editorial" [Publication Type] OR (("Animals"[Mesh] OR "Models, Animal"[Mesh]) NOT "Humans"[Mesh])) Sort by: Most Recent |
|
|
#6 |
Search: ((random*[tiab] AND (controlled[tiab] OR control[tiab] OR placebo[tiab] OR versus[tiab] OR vs[tiab] OR group[tiab] OR groups[tiab] OR comparison[tiab] OR compared[tiab] OR arm[tiab] OR arms[tiab] OR crossover[tiab] OR cross-over[tiab]) AND (trial[tiab] OR study[tiab])) OR ((single[tiab] OR double[tiab] OR triple[tiab]) AND (masked[tiab] OR blind*[tiab]))) Sort by: Most Recent |
|
|
#5 |
Search: #4 AND ("2000/01"[Date - Entrez] : "3000"[Date - Entrez]) Sort by: Most Recent |
|
|
#4 |
Search: #1 AND #2 AND #3 Sort by: Most Recent |
|
|
#3 |
Search: "Intraoperative Period"[Majr] OR intraoperati*[tiab] OR "intra operati*"[tiab] OR peroperati*[tiab] OR "per operati*"[tiab] Sort by: Most Recent |
|
|
#2 |
Search: "Analgesia"[Mesh] OR "Anesthesia"[Mesh] OR "Analgesics"[Mesh] OR "Analgesics" [Pharmacological Action] OR "Anesthetics"[Mesh] OR "Anesthetics"[Pharmacological Action] OR "Pain Management"[Mesh] OR analgesia[tiab] OR "pain management"[tiab] OR "pain relief"[tiab] OR "sequential analgetic analgesia"[tiab] OR "surgical analgesia"[tiab] OR anaesthe*[tiab] OR "anaesthetic action"[tiab] OR anesthe*[tiab] OR "anesthetic action"[tiab] OR anesthetization[tiab] OR autoanaesthe*[tiab] OR autoanesthe*[tiab] OR "drop mask anaesthe*"[tiab] OR "drop mask anesthe*"[tiab] OR narcosis[tiab] OR neuroanaesthe*[tiab] OR neuroanesthe*[tiab] OR "short anaesthe*"[tiab] OR "short anesthe*"[tiab] OR "short duration anaesthe*"[tiab] OR "short duration anesthe*"[tiab] OR analgesic*[tiab] OR "analgesic agent*"[tiab] OR "analgesic drug*"[tiab] OR "analgesic evaluation"[tiab] OR "analgesic tv 393"[tiab] OR analgetic[tiab] OR "analgetic agent*"[tiab] OR "analgetic drug*"[tiab] OR "antalgic agent*"[tiab] OR "anesthetic agent*"[tiab] OR anaesthetic[tiab] OR "anaesthetic agent"[tiab] OR "anaesthetic drug*"[tiab] OR anaesthetics[tiab] OR anesthetic[tiab] OR "anesthetic agent"[tiab] OR "anesthetic drug*"[tiab] OR anesthetics[tiab] OR "general anaesthetic*"[tiab] OR "general anaesthetic agent*"[tiab] OR "general anesthetic*"[tiab] OR "general anesthetic agent*"[tiab] OR preanaesthetics[tiab] OR preanesthetics[tiab] OR "pain management*"[tiab] OR opioid*[tiab] OR "local anesthe*"[tiab] OR local anaesthe*[tiab] OR nerve block*[tiab] OR pca[tiab] OR epidural*[tiab] OR "pain relie*"[tiab] OR "pain management"[tiab] Sort by: Most Recent |
|
|
#1 |
Search: "Adrenergic beta-1 Receptor Antagonists"[Mesh] OR "Adrenergic beta-1 Receptor Antagonists" [Pharmacological Action] OR "Adrenergic beta-1 Antagonist*"[tiab] OR "adrenergic beta-1 receptor antagonist*"[tiab] OR "beta 1 adrenergic antagonist*"[tiab] OR "beta 1 adrenergic blocker*"[tiab] OR "beta 1 adrenergic blocking agent*"[tiab] OR "beta 1 adrenergic receptor antagonist*"[tiab] OR "beta 1 adrenergic receptor blocker*"[tiab] OR "beta 1 adrenergic receptor blocking agent*"[tiab] OR "beta 1 adrenoceptor blocker*"[tiab] OR "beta 1 adrenoceptor blocking agent*"[tiab] OR "beta 1 blocker*"[tiab] OR "beta 1 blocking agent*"[tiab] OR esmolol[tiab] OR "beta blocker*"[tiab] Sort by: Most Recent |