Dipyron (metamizol) bij postoperatieve pijn
Uitgangsvraag
Dipyron (metamizol)
Aanbeveling
Dipyron is een goed alternatief voor NSAID’s en aan te bevelen bij patiënten met een relatieve of absolute contra-indicatie voor NSAID’s. Doseringsadvies bij volwassenen: viermaal daags 1 gram intraveneus.
Overwegingen
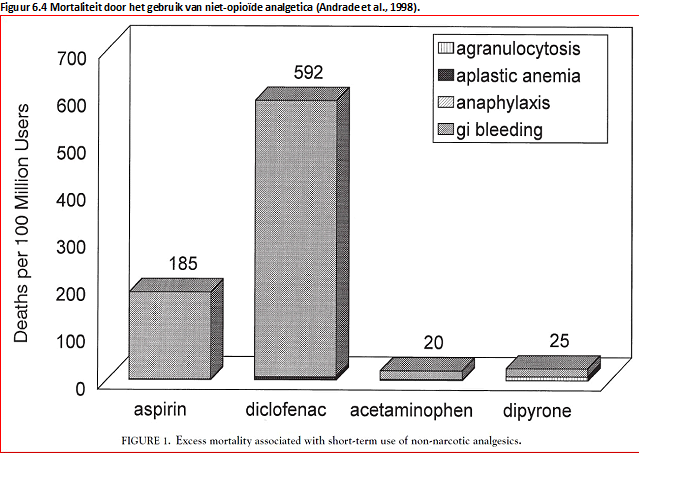
De werkgroep is van mening dat angst voor agranulocytose als bijwerking van dipyron ertoe heeft geleid dat dit middel van de markt werd gehaald in Nederland (Koster et al., 2012). De gerapporteerde incidenties van agranulocytose door dipyron verschillen sterk in de verschillende studies (Shapiro; Ibanez; Maj; Hedenmalm). Echter, er zijn geen aanwijzingen dat agranulocytose een contra-indicatie is voor gebruik van dipyron. De mortaliteit als gevolg van ernstige bijwerkingen door dipyron lijkt niet te verschillen ten opzichte van die van paracetamol en ligt lager dan die van diclofenac (Andrade).
Wetenschappelijke onderbouwing
Een meta-analyse, door Edwards et al., (2010), onderzocht het effect van eenmalige toediening van zowel oraal, intraveneus, intramusculair als rectaal dipyron op pijnintensiteitsscores bij matige tot ernstige postoperatieve pijn (n = 433). 15 Studies testen voornamelijk 500 mg oraal dipyron, 2,5 g intraveneus dipyron en 2,5 gram intramusculaire dipyron. Slechts 60 patiënten kregen andere doseringen. In alle studies kregen de controle patiënten andere pijnmedicatie, acht studies onderzochten het effect in vergelijking met placebo. Meer dan 70% van de patiënten in de dipyrongroep had een 50% reductie van de pijnintensiteit met 500 mg oraal dipyron in vergelijking met 30% in de placebogroep met een NNT van 2.4 en er was minder rescue-medicatie nodig in de dipyrongroep. Het effect van 500 mg oraal dipyron was vergelijkbaar met het effect van 2,5 gram dipyron intraveneus en 100 mg intraveneus tramadol. Er werden geen ernstige bijwerkingen beschreven. De methodologische kwaliteit van de meeste studies was echter matig. De randomisatie of blinderingscriteria waren in veel gevallen niet beschreven en de grootte van de behandelingsgroepen in de meeste studies was klein. Bijwerkingen werden slecht beschreven en er was geen informatie of de data van pijnintensiteitscores verzameld zijn voor of na rescue-medicatie. De power van de meta-analyse was bovendien te laag om conclusies te trekken over de veiligheid van dipyrone.
Korkmaz Dilmen et al., (2010) vond een gereduceerde VAS-score voor dipyron ten opzichte van placebo en een vergelijkbaar effect van dipyron en paracetamol bij lumbale hernia chirurgie. De incidentie van misselijkheid, braken, het geven van anti-emetische rescue-medicatie, pruritis en de ademhalingsfrequentie waren vergelijkbaar met placebo.
De orale toedieningvorm van dipyron is in Nederland niet geregistreerd. In dat perspectief lijkt het verstandig om het gebruik hiervan te documenteren.
Onderbouwing
Achtergrond
Dipyron is een anti-pyretisch analgeticum en behoort tot de chemische groep van de phenazonen (phenylpyrazolonen). Het exacte werkingsmechanisme van dipyron is onduidelijk. Dipyron is in Nederland geregistreerd als intraveneus preparaat; er is in Nederland geen metamizol voor orale toediening geregistreerd.
Conclusies / Summary of Findings
|
Niveau 1 |
Dipyron is een effectief analgeticum bij milde tot matige postoperatieve pijn, bijwerkingen zijn zeldzamer dan bij de NSAID’S.
Bronnen (Andrade et al., 1998; Edwards et al., 2010; Korkmaz Dilmen et al., 2010) |
Samenvatting literatuur
Bijwerkingen
Dipyron lijkt niet gepaard te gaan met de gastro-intestinale en renale bijwerkingen van andere NSAID’s (Laporte et al., 1991). Het snel parenteraal toedienen van dipyron kan in zeldzame gevallen gepaard gaan met hypotensie (Hoigne et al., 1986).
De meest bediscussieerde bijwerking van dipyron is echter het risico op agranulocytose wat er toe geleid heeft dat dit middel van de markt is gehaald in diverse landen waaronder Nederland (Sadusk, 1965; Koster et al., 2012). De zorgen waren gebaseerd op twee studies (Discombe, 1952; Huguley, 1964) die een incidentie vonden voor agranulocytose van 0.79-0.86% met een mortaliteit van 0,57%. Een vervolgstudie (Kelly et al., 1991) vond een incidentiestijging van één geval per één miljoen dipyron gebruikers met een groter regionale variabiliteit die bevestigd werd in andere studies (Shapiro et al., 1999; Ibanez et al., 2005; Maj et al., 2004). Een Zweedse studie (Hedenmalm et al., 2002) vond een hoge incidentie van 700 per één miljoen gebruikers na registratie van het middel in Zweden. Een Spaanse case-control studie (Ibanez et al., 2005) vond echter 0,56 gevallen van dipyron geïnduceerd agranulocytose per één miljoen inwoners met een lager risico op agranulocytose als dipyron kortdurend wordt gebruikt in lage doseringen van één tot twee gram/dag. Een Poolse studie (Maj et al., 2004) vond geen gevallen van dipyron geïnduceerde agranulocytose bij een gebruik van 110 miljoen tabletten dipyron per jaar in Polen. Mogelijk speelt genetische variatie een rol bij de regionale verschillen in de incidentie van agranulocytose.
Het risico op agranulocytose door dipyron moet geplaatst worden in de context van de risico’s op bijwerkingen van andere analgetica. Een meta-analyse door Andrade et al., (1998) vond een toegenomen mortaliteit door serieuze bijwerkingen van 185 per 100 miljoen gebruikers voor aspirine en 592 per 100 miljoen gebruikers voor diclofenac; voor paracetamol en dipyron waren de getallen 20 en 25 per 100 miljoen gebruikers.
Evidence tabellen
Metamizol
Uitgangsvraag: Wat is bij geopereerde patiënten (P) het effect behandeling met metamizol (I) in vergelijking behandeling zonder metamizol (C) op pijn (O1) gemeten met VAS en is er een verschil in de bijwerkingen er van (O2)?
|
Study reference |
Type of study |
Characteristics (study/ participants) |
Intervention (I) |
Control (C)
|
Outcomes and length of follow-up |
Results |
Assessment of study quality
|
Level of evidence |
|
Brodner et al., 2011 |
randomised, doubleblind trial
Patients, all care providers and the clinical observer.s who scored were blinded to the study allocation.
N=80 |
Inclusion criteria: patients aged 18–75 years undergoing elective minor-to-intermediate surgery under general anaesthesia, including: plastic surgery (breast surgery, inguinal or axillary dissections), oral and maxillofacial surgery (correction of retrognathism and prognathism), gynaecological (laparoscopy, breast surgery) and urological (cystoscopy, transurethral prostratectomy) surgery and orthopaedic surgery (hip endoprosthesis for Coxarthrosis)
Exclusion criteria: Primary exclusion criteria were any contraindication for non-opioïd analgesics (significant coronary artery stenosis, pulmonary disorders, liver or kidney dysfunction, haematological disorders); increased intracranial pressure; history of alcohol or drug abuse; hypersensitivity to any of the study drugs; the American Society of Anesthesiologists (ASA) class status more than 3; pregnancy or breast feeding; intake of any non-opioïd within 24 h before administration of the study drugs and reduced understanding due to mental disorders or poor language comprehension. Secondary exclusion criteria were difficulty with immediate postoperative extubation, need for postoperative intensive therapy and insufficient postoperative analgesia: that is, pain scores more than 40 on a visual analogue scale (VAS) with endpoints 0 meaning no pain and 100 meaning worst pain imaginable.
Sex: % M/ % F Paracetamol 26.5/73.5 Dipyrone 44.9/55.1 PareCoxib 26.5/73.5 placebo 49.0/51.0 P<0.05
Age: 42.8-50.5 varying per group |
N=41
Dipyrone (1 g every 6 h)
N=41 PareCoxib (40 mg every 12 h) for at least 48 h.
N=40
intravenous paracetamol (1 g every 6 h) for at least 48 h
|
N=39 Placebo |
Primary: Surgical and associated pain was scored as the primary outcome on a Visual Analogue Scale (VAS),
Secondary: timeto first dose and total piritramide dosage, satisfaction, respiratory depression, nausea, vomiting, sedation, itching and sweating
Length of follow-up: Dependent variables were recorded 1, 6, 18, 30 and 42 h after extubation and 1 week after surgery.
|
A total of 196 patients were recruited. The efficacy of paracetamol was similar to that of the other non-opioïd analgesics. Surgical pain was reduced with all non-opioïds compared to placebo; there was no effect on associated pain. Piritramide dosage and incidence of side effects were not reduced.
Conclusion Intravenous paracetamol has equivalent efficacy to non-opioïds dipyrone and pareCoxib that improves postoperative pain therapy when used as part of a multimodal concept after minor-to-intermediate surgery.
This is study does see an increased improvement over time for all analgetics. |
Randomisation* (+/-/?): +
Allocation concealment* (+/-/?): +
Blinding care provider* (+/-/?):+
Blinding patient* (+/-/?):+
Blinding outcome assessor* (+/-/?): +
Intervention- and control group equal at baseline* (+/-/?): - S intraoperative Sufentanil; Duration of anaesthesia; gender distribution
Acceptable dropout rate (< 20%) (+/-/?): + (35/196; 18%)
Intention-to-treat analysis* (+/-/?): +
Funding: ?
|
A2 A2: A randomized, double-blind trial with good study quality and a adequate number of study participants
Remark:
Under the assumption that a difference of 2 units on a VAS from 0 to 10 in postoperative pain scores is clinically relevant, wij carefully defined the effect size to be 2, with an estimated SD of ±2. |
|
Dilmen, 2010
|
placebo-controlled, randomized, double-blind study
N=77 |
Inclusion criteria: patients scheduled for elective lumbar disc surgery under general anaesthesia were included in the study. All patients were of American Society of Anesthesiologists (ASA) status 1 or 2.
Exclusion criteria: Patients were not eligible for the study if they had known or suspected spinal tumours, allergies to any of the drugs used in this study, hepatic dysfunction or emergency surgery or if they were unable to give consent (e.g. dementia).
Sex: 55% M/ 45% F
Age: 45-52, varying per group
A comparison of four groups with respect to age, sex, height, body weight, BMI, nonsmoking status and other preoperative characteristics showed no statistically significant difference. |
N=18 intravenous 1mg metamizol, N=20 1mg paracetamol N=20 8mg lornoxicam
At the time of wound closure, the first bolus i.v. injections of metamizol, paracetamol and lornoxicam were given and then repeated every 6 h in the paracetamol and metamizol group and every 12 h in the lornoxicam group. |
N=19
Intravenous 0.9% isotonic saline |
Primary: Visual Analogue Scale (VAS),
Secondary: total morphine consumption, Ramsay score, adverse effects (including rash, pruritus, urinary retention, nausea and vomiting), blood pressure, heart rate and respiratory rate
Length of follow-up: 1, 2, 6, 12 and 24 h postoperatively |
During the 24 h study period, pain was reduced in the metamizol (P=0.001) and paracetamol (P=0.04) groups, but not in the lornoxicam (P¼0.20) group compared with the control group. Further analysis revealed that pain scores in the metamizol group were significantly lower than in the lornoxicam group (P=0.031). Although the rate of morphine consumption in the paracetamol group was decreased over time (P<0.001), the total amounts of morphine consumed in 24 h were not different between groups. No significant differences with respect to morphine-related side effects were observed between groups. Conclusion Metamizol or paracetamol, but not lornoxicam, provides effective analgesia following lumbar disc surgery.
Postoperative nausea, vomiting, antiemetic rescue medication, pruritus and respiratory rate were similar between the groups (P>0.05 for all comparisons). |
Randomisation* (+/-/?): +
Allocation concealment* (+/-/?):+/- (patients were randomized to one in four groups using opaque envelopes)
Blinding care provider* (+/-/?):+
Blinding patient* (+/-/?):+
Blinding outcome assessor* (+/-/?): ?
Intervention- and control group equal at baseline* (+/-/?): +
Acceptable dropout rate (< 20%) (+/-/?): + (3/80)
Intention-to-treat analysis* (+/-/?): ?
Funding: ?
|
A2 A2: A randomized, double-blind trial with good study quality and a adequate number of study participants
Remark:
|
|
Edwards, 2010 |
Cochrane systematic review
All studies dipyrone use N=433 |
Single dose, randomised, double-blind, placebo or active controlled trials of dipyrone for relief of established moderate to severe postoperative pain in adults. wij included oral, rectal, intramuscular or intravenous administration of study drugs.
Reports were included if they were published randomised placebo or active controlled, double blind studies of a single dose of dipyrone, with aminimum of 10 participants per treatment arm. Multiple dose studies were included if appropriate data from the first dose were available, and cross-over studies were included provided that data from the first arm were presented separately.
Inclusion criteria: Male or female patients (aged 15 years and above) experiencing postoperative pain ofmoderate to severe intensity, which is defined as ≥3 on a 4 point categorical scale or ≥30 mm on a 100 mm Visual Analogue Scale (VAS).
Exclusion criteria: older people, pregnant women, and those with contraindications were excluded form the studies.
Sex: % M/ % F
Age: averaging between 23 and 65 |
Fifteen studies tested mainly 500 mg oral dipyrone (173 participants), 2.5 g intravenous dipyrone (101), 2.5 g intramuscular dipyrone (99); fewer than 60 participants received any other dose.
All studies N=433
500 mg oral dipyrone (pain relief over 4 to 6 hrs): 143
|
All studies used active controls (ibuprofen, paracetamol, aspirin, flurbiprofen, ketoprofen, dexketoprofen, ketorolac, pethidine, tramadol, suprofen); eight used placebo controls.
Placebo (pain relief over 4 to 6 hrs): 145
|
patient-reported pain relief and/or pain intensity expressed hourly over four to six hours using validated pain scales (pain intensity and pain relief in the form of - visual analogue scales (VAS) or - categorical scales, - or both), - or reported total pain relief (TOTPAR) - or summed pain intensity difference (SPID)
Secondary: -
Length of follow-up: at four to six hours; |
Over 70% of participants experienced at least 50% pain relief over 4 to 6 hours with oral dipyrone 500 mg compared to 30% with placebo in five studies (288 participants; NNT 2.4 (1.9 to 3.2)). Fewer participants needed rescue medication with dipyrone (7%) than with placebo (34%; four studies, 248 participants). There was no difference in participants experiencing at least 50% pain relief with 2.5 g intravenous dipyrone and 100 mg intravenous tramadol (70% vs 65%; two studies, 200 participants). No serious adverse events were reported.
|
Randomisation* (+/-/?): +
Allocation concealment* (+/-/?):?
Blinding care provider* (+/-/?):+
Blinding patient* (+/-/?): +
Blinding outcome assessor* (+/-/?):?
Intervention- and control group equal at baseline* (+/-/?):?
Acceptable dropout rate (< 20%) (+/-/?): ?
Intention-to-treat analysis* (+/-/?): ?
Funding: ?
|
A1 A1: A systematic review of at least two randomized, double-blind trial with good study quality and a adequate number of study participants.
Remark: Overall the methodological quality of the studies was moderate; all studies had to be randomised and double blind to satisfy inclusion criteria, but half did not report on withdrawals, and few gave details of the randomisation and blinding procedures, or of how missing data were handled. Treatment group sizes were small, so that even when several studies contributed data for an outcome, the number of events was small, and confidence in the result must therefore be limited. All studies enrolled participants with established pain following surgery, with pain levels sufficient to demonstrate reduction, or otherwise, due to treatment. Adverse event data were not well reported, with no information on whether data were collected after use of rescue medication (which may cause its own adverse events). The small size of each treatment arm and small number of studies means that this review is underpowered to address the safety of dipyrone.
Other pain measurements than VAS were used in the review |
|
|
|
|
|
|||||
|
Karaman, 2010
|
prospective, double-blind, randomized study
N=60
Exclusion: not placebo controlled |
Inclusion criteria: Written consent, aged between 18-65 years undergoing elective ENT surgery
Exclusion criteria: Patients were excluded if they had received any analgesic medication within 12 h before surgery, were pregnant, breast-feeding, were allergic to any of the medications used in the study, had a history of drug abuse, or clinically significant cardiovascular, renal, hepatic, or gastrointestinal disease.
There were no significant differences between the groups regarding age, body weight, gender and duration of surgery (p>0.05)
Sex: 51% M/ 49% F
Age: 48.5 ± 12.1 tot 54.8±8.6 |
N=30
Group D received 50 mg dexketoprofen trometamol (three times daily), |
N=30
Group P received 1 gr paracetamol (four times daily)
N=30 Group M received 1 gr metamizole (three times daily) intravenously. |
Primary: Visual Analogue Scale (VAS),
Secondary: presence of adverse events such as nausea, vomiting, dyspepsia, skin rash, headache
Length of follow-up: 1 h, 2 h, 3 h, 4 h, 5 h, 6 h, 12 h, and 24 hours after surgery |
There were significant differences in VAS and VRS scores at postoperative 1., 2., 3., 4., 5.,.and 6. h in Group D with Groups P and M (p<0.05). VAS and VRS scores at 1., 2., 3., 4., 5., and 6. h in Group D was lower than Groups P and M, while there was no significant difference in VAS-scores at 12. h and 24. h between groups Pethidine requirement was found to be significantly higher in the Groups P and M (p<0.05). No significant difference was observed in sedation scores and adverse effects among the groups (p>0.05). |
Randomisation* (+/-/?): +/- (how is unknown)
Allocation concealment* (+/-/?): +
Blinding care provider* (+/-/?): +
Blinding patient* (+/-/?): +
Blinding outcome assessor* (+/-/?):+
Intervention- and control group equal at baseline* (+/-/?): +
Acceptable dropout rate (< 20%) (+/-/?): +(0)
Intention-to-treat analysis* (+/-/?): ?
Funding: ?
|
A2 A2: A randomized, double-blind trial with good study quality and a adequate number of study participants
Remark:
|
|
Korkmaz, 2010
|
prospective, placebo-controlled, randomized, double-blind study
N=77 |
Inclusion criteria: Patients with written consent scheduled for elective lumbar disc surgery under general anaesthesia were included in the study. All patients were of American Society of Anesthesiologists (ASA) status 1 or 2.
Exclusion criteria: Patients were not eligible for the study if they had known or suspected spinal tumours, allergies to any of the drugs used in this study, hepatic dysfunction or emergency surgery or if they were unable to give consent (e.g. dementia).
A comparison of four groups with respect to age, sex, height, body weight, BMI, nonsmoking status and other preoperative characteristics showed no statistically significant difference (P>0.05 for all comparisons)
N=80 Sex: 52% M/ 48% F
Age: 44.5±14.4 to 52.6±12.6 |
N=18 supplemental i.v. injections of 1mg metamizol
|
N=20 1mg paracetamol
N=20 8mg lornoxicam
N=19 0.9% isotonic saline |
Primary: Visual Analogue Scale (VAS),
Secondary: Morphine consumption and side effects
Length of follow-up: 24 hrs post operation |
During the 24 h study period, pain was reduced in the metamizol (P¼0.001) and paracetamol (P¼0.04) groups, but not in the lornoxicam (P¼0.20) group compared with the control group. Further analysis revealed that pain scores in the metamizol group were significantly lower than in the lornoxicam group (P¼0.031). Although the rate of morphine consumption in the paracetamol group was decreased over time (P<0.001), the total amounts of morphine consumed in 24 h were not different between groups. No significant differences with respect to morphine-related side effects were observed between groups. |
Randomisation* (+/-/?): +
Allocation concealment* (+/-/?):+
Blinding care provider* (+/-/?):+
Blinding patient* (+/-/?):+
Blinding outcome assessor* (+/-/?):?
Intervention- and control group equal at baseline* (+/-/?):+
Acceptable dropout rate (< 20%) (+/-/?): + (3/80)
Intention-to-treat analysis* (+/-/?): ?
Funding: ?
|
A2 A2: A randomized, double-blind trial with good study quality and a adequate number of study participants
Remark:
|
|
Uzun, 2010
|
RCT
Exclusion: Pain was assessed by the numerical pain rating scale (NRS, 0-3) |
Inclusion criteria:
Exclusion criteria:
Sex: % M/ % F
Age: ±
|
N=
|
N=
|
Primary:
Secondary:
Length of follow-up: |
|
Randomisation* (+/-/?):
Allocation concealment* (+/-/?):
Blinding care provider* (+/-/?):
Blinding patient* (+/-/?):
Blinding outcome assessor* (+/-/?):
Intervention- and control group equal at baseline* (+/-/?):
Acceptable dropout rate (< 20%) (+/-/?):
Intention-to-treat analysis* (+/-/?):
Funding: |
A2 A2: A randomized, double-blind trial with good study quality and a adequate number of study participants
Remark:
|
* randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
* allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
* blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding the outcome assessor prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
* intention-to-treat: all randomised patients have to be included in the analysis and kept in the originally assigned groups, regardless of their adherence to the study protocol (for example early stopping of trial medication). An intention to treat analysis is an analysis based on the initial treatment intent, not on the treatment eventually administered. Intention to treat analyses are done to avoid the effects of crossover and drop-out, which may break the randomisation to the treatment groups in a study.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 05-09-2013
Beoordeeld op geldigheid : 01-09-2023
Uiterlijk in 2018 bepaalt het bestuur van de NVA of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVA is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Met ondersteuning van de Orde van Medisch Specialisten. De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
De huidige richtlijn moet de accuratesse van de volgende punten weergeven:
- de organisatie van de postoperatieve pijnbehandeling. Wie is op welk moment van de pijnbehandeling verantwoordelijk?
- wat is het effect van nieuwe pijnmedicatie en hoe staat dat in verhouding tot de reeds bestaande medicatie?
- welke toedieningsvormen zijn optimaal?
- kosteneffectiviteit van postoperatieve pijnbestrijding;
- postoperatieve pijnbehandeling bij kinderen.
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij postoperatieve pijnbehandeling.
Samenstelling werkgroep
Voor het herzien van de richtlijn is in 2010 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die met postoperatieve pijnbehandeling te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden werden door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
- Dr. P.L. Houweling, voorzitter, anesthesioloog, NVA
- Dhr. P.M. Ruikes, verpleegkundig specialist, (NVAM)
- Dr. M.I. van Berge Henegouwen, chirurg (NVvH)
- Dr. S.J.C. Verbrugge, anesthesioloog/intensivist, (NVIC)
- Drs. A. Tjon, cardiothoracale chirurg, (NVT)
- Drs. D.B.M. van der Werff, kinderanesthesioloog, WKZ/UMCU
- Drs. I.M.M. van Haelst, ziekenhuisapotheker, (NVZA)
- Drs. H. Verburg, orthopedisch chirurg, (NOV)
- Mw. R. van Boekel, verpleegkundig pijnconsulent (V&VN Pijnverpleegkundigen)
- Prof. dr. D. Tibboel, kinderarts, (NVK)
- Prof. dr. dr. M.W. Hollmann, anesthesioloog (NvA)
Met ondersteuning van:
- Ir. T.A. van Barneveld, senior adviseur, afdeling Ondersteuning Professionele Kwaliteit, Orde van Medisch Specialisten
- Dr. M.L. Molag, adviseur, afdeling Ondersteuning Professionele Kwaliteit, Orde van Medisch Specialisten
Met dank aan:
- Dr. M.F. Stevens, anesthesioloog (NVA)
- Dr. J.H. Vranken, anesthesioloog (NVA)
Belangenverklaringen
Werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Een overzicht hiervan is hieronder te vinden. De belangenverklaringen zijn op te vragen bij het secretariaat van OMS.
|
Verklaring omtrent mogelijke belangenverstrengeling en embargo met betrekking tot de richtlijn ‘Postoperatieve pijn'
Werkgroeplid in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhield met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp |
||
|
Werkgroeplid |
Belangen afgelopen vijf jaar en/of gedurende looptijd van het project ja /nee |
Zo ja, welke |
|
Berge Henegouwen, dr. M.I. van |
Nee |
|
|
Boekel, mw. R. van |
Ja |
Gastdocent bij HAN-vdo: cursus 'Assistent Pijnbehandeling' |
|
Haelst, mw. Drs. I.M.M. van |
Nee |
|
|
Hollmann, M.W. |
Ja |
Eurocept - lecturer over Peri-op pijnbestrijding |
|
Houweling, dr. P. |
Nee |
|
|
Ruikes, P.M. |
Nee |
|
|
Tibboel, prof. dr. D. |
Nee |
|
|
Tjon Joek Tjien, A |
Nee |
|
|
Verburg, H. |
Nee |
|
|
Verbrugge, dr. S.J.C. |
Nee |
|
|
Werff, D.B.M. van der |
Nee |
|
Inbreng patiëntenperspectief
De inbreng van patiënten werd meegenomen door te kijken naar de uitkomstmaat ‘pijn’. Daarnaast werd een oriënterende literatuursearch uitgevoerd gericht op het patiëntenperspectief. Dit leverde drie mogelijk interessante artikelen op, waarvan uiteindelijk één werd gebruikt in de tekst organisatie van zorg.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn is/wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Daarnaast is/wordt er een samenvatting van de richtlijn geschreven voor het Nederlands Tijdschrift voor Geneeskunde en in tijdschriften van de deelnemende wetenschappelijke verenigingen.
Werkwijze
AGREE
Deze richtlijn is opgesteld aan de hand van het “Appraisal of Guidelines for Research & Evaluation II” (AGREE II) instrument. Dit is een internationaal breed geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Vaststellen van de uitkomstmaten en klinische relevantie
In de voorbereidende fase van de richtlijnontwikkeling zijn de uitkomstmaten geïnventariseerd en geordend naar mate van belangrijkheid voor de patiënt. Voor het evalueren van invasieve behandelmogelijkheden achtte de werkgroep de uitkomstmaten pijn, functionaliteit en kwaliteit van leven van belang. Op basis van een artikel van Ostelo et al. (2008) werd het klinisch relevante verschil voor pijn en functionaliteit vastgesteld (zie tabel 1.).
Tabel 1. Drempelwaardes klinisch relevant verschil pijn en functionaliteit bij lage rugpijn
|
Vragenlijst* (range) |
Absolute drempel |
Relatieve drempel t.o.v. uitgangswaarde |
|
VAS (0-100) |
15 |
30% |
|
NRS (0-10) |
2 |
30% |
|
RDQ (0-24) |
5 |
30% |
|
ODI (0-100) |
10 |
30% |
|
QBPQ (0-100) |
20 |
30% |
*VAS = visual analogue scale, NRS = numerical rating scale, RDQ = Roland Morris Disability Questionnaire, ODI = Oswestry Disability Index, QBDQ = Quebec Back Pain Disability Questionnaire
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar klinisch relevante verschillen bij rugpijn bij uitkomsten als pijn (gemeten met Visual Analogue Scale, VAS of numerical rating scale, NRS), kwaliteit van leven (gemeten met EQ-5D) en functionaliteit (gemeten met Roland Morris Disability Questionnaire, Oswestry Disability Index of Quebec Back Pain Disability Questionnaire). Vervolgens werd er voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in het Engels en Nederlands in de elektronische databases Medline (OVID) en Embase (Embase.com) over de periode 1990- juni 2011. De zoekstrategieën zijn te vinden in bijlage 1. Tevens werd er aanvullend handmatig gezocht naar studies in de referentielijsten van de geïncludeerde artikelen. In eerste instantie werd gezocht naar (systematische reviews of meta-analyses van) gerandomiseerde gecontroleerde onderzoeken (RCTs). In afwezigheid van RCTs werd verder gezocht naar prospectieve gecontroleerde onderzoeken, vergelijkende onderzoeken en prospectieve niet-vergelijkende onderzoeken. Voor het identificeren van mogelijke systematische reviews en randomized controlled trials werd gebruik gemaakt van methodologische zoekfilters gebaseerd op die van het Scottish Intercollegiate Guidelines Network.
De sluitingsdatum voor het includeren van studies is juni 2011, de studies van na juni 2011 zijn niet meegenomen in deze richtlijn.
Rapportage
Omdat de diagnoses niet algemeen geaccepteerd zijn, is er voor gekozen per diagnose een evidence-based beschrijving te geven van de definitie, de epidemiologie, de etiologie, de diagnostiek en de interventies.
Beoordelen van therapeutische interventiestudies
Beoordeling van studies werd gedaan aan de hand van de GRADE methodiek (http://www.gradeworkinggroup.org/). Per uitkomstmaat werd het niveau van de bewijslast bepaald op basis van alle beoordeelde studies samen. Naar aanleiding van deze beoordeling werd het bewijsniveau bepaald volgens de classificatie in tabel 2. GRADE kent vier bewijsniveaus: hoog, matig, laag en zeer laag. Het onderzoeksdesign bepaalt het startniveau van de bewijskracht: systematische literatuuranalyses van RCTs starten hoog en systematische literatuuranalyses van observationele onderzoeken starten laag. Er zijn vijf factoren (beperkingen in de onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatiebias) die de bewijskracht met één of twee niveaus kunnen verlagen. De werkgroep bepaalde hoe belangrijk deze factoren waren.
Daarnaast zijn er drie factoren die de bewijslast van een systematische literatuuranalyse van observationeel onderzoek kunnen verhogen (groot effect, dosisrespons relatie, confounding die het werkelijke effect onderschat of een in werkelijkheid niet bestaand effect overschat).
Tabel 2. GRADE-indeling van kwaliteit van studies per uitkomstmaat
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
1. Studiebeperkingen -1 ernstig -2 zeer ernstig
2. Inconsistentie -1 ernstig -2 zeer ernstig
3. Indirectheid -1 ernstig -2 zeer ernstig
4. Imprecisie -1 ernstig -2 zeer ernstig
5. Publicatiebias -1 waarschijnlijk -2 zeer waarschijnlijk |
1. Groot effect +1 groot +2 zeer groot
2. Dosis-respons relatie +1 bewijs voor relatie
3. Plausibele confounding +1 zou het effect onderschatten +1 zou het effect overschatten als er geen effect was aangetoond
|
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkende studie (vb. patientcontrole onderzoek, cohortonderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (vb. case series of case reports) |
||
|
|
|
RCTs beginnen ‘hoog’ (4), observationele studies beginnen ‘laag’ (2)
Bij RCTs: vb. totaal 1 punt downgraden: dan van hoog (4) naar matig (3); bij RCTs: vb. totaal 2 punten downgraden: dan van hoog (4) naar laag (2); bij RCTs: in totaal ≥ 3 punten downgraden: dan van hoog (4) naar zeer laag (1)
Bij observationele studies: vb. 1 punt upgraden: dan van laag (2) naar matig (3)
Een samenvatting van de literatuur en het bewijsniveau van de relevante studies zijn in de richtlijntekst terug te vinden onder de kopjes ‘samenvatting van de literatuur’ en ‘conclusie’.
Beoordelen van diagnostisch accuratesse onderzoek en studies naar schade of bijwerkingen, etiologie en prognose
Beoordeling van dit soort onderzoeken werd gedaan aan de hand van de EBRO methodiek (GRADE is hier momenteel nog niet geschikt voor, omdat voor deze studies de relatie tussen de kwaliteit van het onderzoek en de vertekening van het resultaat nog onvoldoende duidelijk is). De studies werden individueel beoordeeld op onderzoeksopzet/design. Naar aanleiding van deze beoordeling werd het bewijsniveau van studies bepaald volgens de classificatie in tabel 3.
Tabel 3. EBRO indeling van de kwaliteit van individuele studies
|
Bewijs niveau |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose |
|
A1 |
Meta-analyse van min. 2 onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
|
|
A2 |
Onderzoek t.o.v. een referentietest (‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van resultaten, met voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohort onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Onderzoek t.o.v. een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohort onderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohort onderzoek of patiëntcontrole onderzoek |
|
C |
Niet-vergelijkend onderzoek |
|
Een samenvatting van de literatuur en het bewijsniveau van de relevante studies zijn in de richtlijntekst terug te vinden onder de kopjes ‘samenvatting van de literatuur’ en ‘conclusie’. Individuele studies waarop conclusies gebaseerd zijn, zijn samengevat in evidencetabellen (zie kopje Evidencetabellen).
Werkwijze werkgroep
De keuze van de onderwerpen en de interventies is gebaseerd op datgene wat te doen gebruikelijk is in de verschillende beroepsgroepen. De richtlijn probeert antwoord te geven op klinisch relevante problematiek.
De richtlijn beperkt zich tot interventionele therapieën. In een latere richtlijn moet de conservatieve behandeling meegenomen worden.
De werkgroep heeft anderhalf jaar aan de totstandkoming van de richtlijn gewerkt. De werkgroepleden hebben de knelpunten en uitgangsvragen vastgesteld. Met behulp van de informatiespecialist van de Orde van Medisch Specialisten is literatuur gezocht bij de uitgangsvragen. De leden van de werkgroep hebben samen met de adviseur van de Orde de gevonden literatuur geselecteerd en beoordeeld op kwaliteit en inhoud. De werkgroepleden hebben conceptteksten voor de uitgangsvragen geschreven. De conceptrichtlijn is in september 2011 aan alle betrokken wetenschappelijke verenigingen aangeboden. De ontvangen commentaren zijn, waar relevant bevonden, verwerkt in de definitieve richtlijn.
Overwegingen
Voor een aanbeveling zijn er naast het wetenschappelijke bewijs nog andere aspecten van belang, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische facetten. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op zowel het beschikbare wetenschappelijke bewijs als op de belangrijkste overwegingen.
In de aanbevelingen wordt voor een aantal interventies aangegeven dat deze bij voorkeur of uitsluitend in studieverband uitgevoerd moeten worden. Met studieverband bedoelt de werkgroep dat er sprake is van het systematisch registreren en rapporteren van patiëntkenmerken, diagnostiek, behandeling en uitkomst.
Indicatorontwikkeling
Een indicator is een meetbaar kenmerk van de gezondheidszorg met een signaalfunctie voor (een aspect van) de kwaliteit van zorg. Indicatoren maken het de zorgverleners mogelijk om te meten of zij de gewenste zorg leveren en om onderwerpen voor verbeteringen te identificeren. Bij deze richtlijn zullen nog indicatoren ontwikkeld worden.
Zoekverantwoording
|
Onderwerp |
Database |
Omschrijving zoekactie |
|
Bijwerkingen en contraindicaties NSAID’s: hematologische effecten |
Pubmed 1996 t/m 2001 |
Trefwoorden: blood loss postoperative NSAID, bleeding time postoperative NSAID. Limitatie: randomized controlled trial/practice guideline/review/clinical trial, human. Taal: Engels. |
|
Bijwerkingen en contraindicaties NSAID’s: effecten op de nier |
Pubmed 1996 t/m 2001 |
Trefwoorden: renal function postoperative NSAID. Limitatie: english, randomized controlled trial/practice guideline/review/clinical trial, human. |
|
Tramadol |
MEDLINE, PubMed |
Trefwoorden: pain, postoperative, analgesics, opioïd, morphine, tramadol. Publicatietype: Review, Meta-Analysis, Practice Guideline en Randomized Controlled Trial. Limitatie: human. Publicatiedatum: 1 januari 1992-1 december 2000. Taal: Engels. |
|
Buprenorphine |
MEDLINE, PubMed |
Trefwoorden: pain, postoperative, analgesics, opioïd, morphine, buprenorphine. Publicatietype: Review, Meta-Analysis, Practice Guideline en Randomized Controlled Trial. Limiatie: human. Publicatiedatum: 1 januari 1992-1 december 2000. Taal: Engels. N.B. opvallend is dat er weinig onderzoek gedaan is naar de postoperatieve pijnbehandeling en effecten van buprenorfine. Relatief veel artikelen komen uit landen waar angst is voor het gebruik van morfine (opiophobie). Wel zijn er veel artikelen over buprenorfine bij het ontwennen c.q. afkicken van drugsverslaafden. De firma vindt de postoperatieve pijnbehandeling d.m.v. buprenorfine zeker geen aandachtspunt meer. |
|
Opioïden |
Medline, Pubmed, Cochrane Library |
Trefwoorden: Opioïds, Analgesics, postoperative (analgesia), pain, VAS, morphine, mepridine, methadon, piritramide, nicomorphine, potency, interindividual, individual, variability, effect, dose-respons, placebo, NSAID, paracetamol/acetaminophen, pre-emptive, elderly, monitoring, respiratory depression, hypoxaemia, constipation, pruritus, urine retention, PONV, intravenous, PCA, intramuscular, subcutanaous, transdermal, oral, rectal, intrathecal, intra-articular, peripheral. Publicatietype: meta-analysis, review, randomised controlled trial, practice guideline. Limitatie: human, adults (> 19 yrs). Publicatiedatum: 1 januari 1985 –2001. Taal: Engels.
|
|
Opioïden; bijwerkingen |
Medline 52 SR Cochrane |
Zoektermen zie boven bij Opioïden Search geactualiseerd mei 2011 Vanaf 2000 Limitering: systematic reviews |
|
POMB
|
MEDLINE, PubMed |
Trefwoorden: Postoperative Nausea and Vomiting, Ondansetron, Granisetron, Tropisetron, Metoclopramide, Droperidol, Dexamethasone, Prophylaxis, Therapy. Publicatie-types: Review, Meta-Analysis, Practice Guideline en Randomized Controlled Trial. Limitatie: Publicatiedatum: 1 januari 1995 - 1 december 2000. Taal: Engels. |
|
Als boven naar Haloperidol: enkele case reports bij palliatieve zorg en chemotherapie; niet postoperatief. |
||
|
Als boven naar Domperidon en Alizapride. Alleen enkele kleine RCT’s gevonden, geen reviews. Belangrijkste zijn vermeld in referenties. |
||
|
Nieuwe searches Algemene zoekstrategie voor postoperatieve pijn ontleend zoekstrategieën van de Cochrane reviews 1: Moore RA, Derry S, McQuay HJ. Single dose oral aceclofenac for postoperative pain in adults. Cochrane Database Syst Rev. 2009 Jul 8;(3):CD007588. Review. PubMed PMID: 19588436.
2: Straube S, Derry S, Moore RA, Wiffen PJ, McQuay HJ. Single dose oral gabapentin for established acute postoperative pain in adults. Cochrane Database Syst Rev. 2010 May 12;(5):CD008183. Review. PubMed PMID: 20464764. |
|
1 Pain, Postoperative/ 2 (postoperative adj3 pain).ti,ab. 3 1 or 2 4 ((postoperative adj4 pain$) or (post-operative adj4 pain$) or post-operative-pain$ or post$ NEAR pain$ or (postoperative adj4 analgesi$) or (post-operative adj4 analgesi$) or "post-operative analgesi$").ti,ab. 5 ((post-surgical adj4 pain$) or ("post surgical" adj4 pain$) or (post-surgery adj4 pain$)).ti,ab. 6 ("pain-relief after surg$" or "pain following surg$" or "pain control after").ti,ab. 7 (("post surg$" or post-surg$) and (pain$ or discomfort)).ti,ab,kw. (785) 8 ((pain$ adj4 "after surg$") or (pain$ adj4 "after operat$") or (pain$ adj4 "follow$ operat$") or (pain$ adj4 "follow$ surg$")).ti,ab. 9 ((analgesi$ adj4 "after surg$") or (analgesi$ adj4 "after operat$") or (analgesi$ adj4 "follow$ operat$") or (analgesi$ adj4 "follow$ surg$")).ti,ab. 10 1 or 4 or 5 or 6 or 7 or 8 or 9 |
|
Algemene zoekstrategie voor uitkomsten pijn (gemeten met VAS) en bijwerkingen |
|
Trefwoorden: *"Pain, Postoperative"/ or [medicatie]/ae [Adverse Effects] or adverse effects.fs. Tekstwoorden: pain, "adverse effect*", vas or "visual analogue scale".
|
|
Methodologische filters |
|
Systematische reviews (SR) en randomized controlled trials (RCT) in Embase major clinical studies (MCS) gecombineerd met filter voor RCTS of publicatietype RCT. |
|
Taal
|
|
Nederlands, Engels tenzij anders aangegeven |
|
COX-2 |
Medline (OVID) 19 SR, 80 RCT
Cochrane Library 4 SR-Cochrane, 8 dare reviews, 69 RCT Na ontdubbeling > 37 nieuw
Embase – vanaf 2009 – 6 SR, 19 RCTs MCSl studies – na ontdubbeling > 16 nieuw |
Cyclooxygenase Inhibitors"/ or exp Cyclooxygenase 2 Inhibitors/ or (COX-2 or "Cyclooxygenase Inhibitor*").ti.
Limitering: Trefwoorden: *"Pain, Postoperative"/ or exp Cyclooxygenase 2 Inhibitors/ae [Adverse Effects] En tekstwoorden: pain, "adverse effect*", vas or "visual analogue scale".
Gezocht maart 2011 Embase – vanaf 2009
|
|
Gabapentine |
Medline (OVID) 18 SR, 80 RCT
Cochrane Library 4 Cochrane SR, 6 DARE SR, 83 RCT Na ontdubbeling 24 nieuw
Embase 7 SR, 75 RCT > na ontdubbeling 40 nieuw |
(gabapentin or Neurontin or neurotonin*).af. or exp gamma-Aminobutyric Acid/ or (Pregabalin or lyrica or gabrika).af.
Gezocht maart 2011
|
|
Ketamine |
Medline(OVID) 6 SR 132 RCT
Cochrane Library 1 SR, 2 Dare-review, 135 RCT > na ontdubbeling 45 nieuw
Embase: 20 referenties Na ontdubbeling 11 nieuw |
Ketamine/ or Receptors, N-Methyl-D-Aspartate/ or (ketamine or calipsol or ketalar or ci-581 or ci581 or ketanest or ketaset or calypsol or 2-cyclohexanone or kalipsol or ci 581 or ketamine or N-methyl-D-aspartate receptor antagonist* or NMDA antagonist*)
Limitering: Trefwoorden: *"Pain, Postoperative"/ or exp Ketamine/ae [Adverse Effects] En tekstwoorden: pain, "adverse effect*", vas or "visual analogue scale". Taal: Engels, Duits, Frans, Nederlands
Gezocht maart 2011 Embase: 2008-maart 2011 |
|
Metamizol |
Medline (OVID) 3 SR, 66 RCT
Cochrane Library 40 referenties, na ontdubbeling 19 nieuw
Embase 17 referenties, na ontdubbeling 7 nieuw
|
Dipyrone"/ or metamizol*.ti,ab. or (adolkin or afebrin or aminopyrine sulphonate or anador or analgin or analginum or ascorfebrina or baralgin or dolemicin or dolo buscopan or huberdor or inalgon or lasain or lisalgil or metamizol or metamizole or metamizole sodium or methampyrone or minalgin or natrium novaminsulfonicum or neo meubrina or neu novalgin or neu novalgine or neuro-brachont or neuro-formatin S or nolotil or noramidaophenum or noraminophenazonum or norgesic or novalgina or novalgine or novamidazofen or optalgin or pirenil or sulpyrinepyrethane or trisalgina).af. or Dipyrone.ti,ab.
Geen verdere limitering op uitkomstmaat.
Publicatiedatum: 1990-maart 2011 Embase: vanaf 2009-maart 2011 |
|
IV morfine vs transdermaal morfine
|
Medline (OVID) 5 SR, 61 RCT
Cochrane Library 21 RCT,clinical trials, na ontdubbeling 9 nieuw
Embase (2008-2010): 12 refs, na ontdubbeling 6 nieuw
|
((*"Pain, Postoperative"/ or pain.ti,ab.) and (vas or "visual analogue scale") "adverse effect*".ti,ab. or Morphine/ae [Adverse Effects]) and
(exp Morphine/ad [Administration & Dosage] or morphine.ti.)
and (transdermal or its) or (intravenous or (IV adj PCA) or exp administration, cutaneous/ or exp transdermal patch/ or patch*.ab,ti. or infusions, intravenous/ or injections, intravenous/ or (systemic or parenteral).ti,ab
Publicatiedatum: 1990-maart 2011 Embase: vanaf 2008-maart 2011 |
|
Orale opiaten vs systemische morfine |
Medline 8 SR, 80 RCT
Cochrane library 1 SR, 1 DARE, 107 RCT Na ontdubbeling 71 nieuw
Embase 1 SR, 32 RCT, na ontdubbeling 13 nieuw |
(morphine/ or morphine.ti,ab.) and (dihydrone or oxycone or ihydrohydroxycodeinone or oxiconum or purdue frederick brand or oxycontin or theocodin or dinarkon or oxycodeinon or pancodine or eucodal).ti,ab. or "Oxycodone"/
Publicatiedatum: 1990-maart 2011
|
