Ilioinguinaal blok
Uitgangsvraag
Wat is de plaats van het ilioinguinaal blok bij zorg voor kinderen die een chirurgische ingreep ondergaan?
Aanbeveling
Overweeg het gebruik van additionele regionale techniek ter pijnbestrijding bij kinderen na een liesbreukoperatie of orchidoplexie. Dit kan zowel een locoregionaal ilioinguinaal blok als caudale analgesie betreffen, gebaseerd op de technische expertise van de kinderanesthesioloog.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de gunstige en ongunstige effecten van het ilioinguinaal blok bij kinderen die een chirurgische ingreep ondergaan. Eén systematic review met vijf randomized controlled trials (RCT’s) uit 2020 werd geïncludeerd, en twee RCT’s die recenter gepubliceerd zijn.
Postoperatieve pijn was gedefinieerd als cruciale uitkomstmaat en postoperatief opioïdengebruik, complicaties en angst als belangrijke uitkomstmaten.
Voor postoperatieve pijn was de bewijskracht op alle tijdspunten (0-2 uur, 4-6 uur en 24 uur) zeer laag. Er werd voornamelijk afgewaardeerd vanwege beperkingen in het studiedesign en kleine patiëntenpopulaties. Daarmee komt de totale bewijskracht uit op zeer laag. Op basis van de literatuur kunnen daarom geen eenduidige conclusies worden getrokken. Hier bestaat een kennislacune.
Ook de belangrijke uitkomstmaat postoperatief opioïdengebruik komt uit op een zeer lage bewijskracht. De vooraf gedefinieerde complicaties en angst werden niet gerapporteerd in de studies.
De literatuur kan onvoldoende richting geven aan de besluitvorming. De aanbeveling is daarom gebaseerd op aanvullende argumenten waaronder expert opinie, waar mogelijk aangevuld met (indirecte) literatuur.
In deze module is specifiek naar het ilioinguinaal blok gekeken. In de studies was de locaties waar het ilioinguinaal blok geplaatst werd niet consistent. Er lijkt geen verschil te zijn in de precieze locatie van het ilioinguinaal blok voor het uiteindelijke effect. Er zijn velen vormen van buikwandblokken mogelijk. Afhankelijk van het type ingreep, moet overwogen worden welke specifieke buikwandblok het beste het operatiegebied verdooft.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Ouders moeten worden voorgelicht betreft de voor- en nadelen van de neuraxiale techniek (caudaal blok) versus een perifeer blok. Bij nadelen van een caudaal blok kan gedacht worden aan een epiduraal hematoom, zenuwschade of de kans op durale punctie. De kans op deze complicaties is zeer laag, maar moeten wel worden meegenomen in de afweging. Bij adolescenten kan een blok onder lichte (of zonder) sedatie worden overwogen, afhankelijk van de coöperatie van het kind en de inschatting van anesthesioloog en ouders/kind.
Kosten (middelenbeslag)
Het verschil in kosten tussen het ilioinguinaal blok en caudale analgesie zal minimaal zijn. Beiden worden gezet met een naald en vergelijkbare medicatie, waardoor kosten geen rol zullen spelen in de uiteindelijke besluitvorming.
Caudale analgesie wordt op basis van anatomische markers geprikt. Het ilioinguinaal blok wordt tegenwoordig vooral onder echogeleide geprikt. Gezien het standaard gebruik van echo is deze apparatuur hoogstwaarschijnlijk aanwezig op de afdelingen waar de ingrepen uitgevoerd worden. De werkgroep voorziet hierdoor geen problemen rondom gebruik van echo bij ilioinguinaal blok en buikwandblokken in het algemeen.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn tot op heden geen evaluaties gedaan naar de verschillende interventies met betrekking tot de implementatie danwel de haalbaarheid. Voor het implementeren van een ilioinguinaal blok zal, behoudens scholing en het beschikbaar zijn van materialen, een korte tijdsinvestering vragen van de operateur, OK-team en anesthesioloog. Indien de anesthesioloog ervaren is in het plaatsen van een buikwandblok zal dit bij de gemiddelde patiënt weinig tijd innemen (< 5 minuten).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De literatuur kan onvoldoende richting geven aan de aanbeveling. Op basis van expert opinie wordt aanbevolen dat afhankelijk van het type ingreep, moet overwogen worden of caudale analgesie of een ilioinguinaal blok het beste het operatiegebied verdooft. Het caudale blok brengt mogelijke (zeldzame) nadelen met zich mee, zoals een epiduraal hematoom, zenuwschade of de kans op durale punctie. Aanvullend moet de ervaring van de anesthesioloog worden meegenomen in de keuze tussen de technieken.
Onderbouwing
Achtergrond
Voor het uitvoeren van abdominale ingrepen bij kinderen bestaan er een groot aantal mogelijkheden voor locoregionale danwel neuraxiale technieken voor postoperatieve pijnstilling. Veel gebruikte technieken naast de epidurale of caudale analgesie zijn onder andere TAP/ilioinguinaal blokken en de redelijk nieuwe quadratus lumborum blokken. Actueel worden met name de caudale analgesie en de ilioinguinaal blokken veel gebruikt, echter is er een grote diversiteit aan ingrepen en de blokken die theoretisch ook vaak dieper gelegen structuren verdoven. Daarom is het van grote meerwaarde om na te gaan welk wetenschappelijk bewijs er is voor de effectiviteit van de pijnstilling.
Binnen deze module willen we onderzoeken wat de meerwaarde, effectiviteit en het complicatierisico is van het ilioinguinaal blok voor de postoperatieve pijnstilling bij kinderen.
Conclusies / Summary of Findings
Postoperative pain
|
Very low GRADE |
The evidence is very uncertain about the effect of the use of ilioinguinal block compared with caudal analgesia for postoperative pain at 0 to 2 hours in children undergoing surgical procedures.
Source: Abdellatif, 2012; Desai, 2022; Sahin, 2017; Somri, 2002; Toker, 2016; Varsha, 2021 |
|
The evidence is very uncertain about the effect of the use of ilioinguinal block compared with caudal analgesia for postoperative pain at 4 to 6 hours in children undergoing surgical procedures.
Source: Desai, 2022; Sahin, 2017; Toker, 2016; Varsha, 2021 |
|
|
The evidence is very uncertain about the effect of the use of ilioinguinal block compared with caudal analgesia for postoperative pain at 24 hours in children undergoing surgical procedures.
Source: Caetano, 2006; Sahin, 2017; Varsha, 2021 |
Postoperative opioid consumption
|
Very low GRADE |
The evidence is very uncertain about the effect of the use of ilioinguinal block compared with caudal analgesia for postoperative opioid consumption in PACU in children undergoing surgical procedures.
Source: Somri, 2002 |
|
No GRADE |
No evidence was found regarding the effect of the use of ilioinguinal block compared with caudal analgesia for postoperative opioid consumption in 24 hours period in children undergoing surgical procedures.
Source : - |
|
Very low GRADE |
The evidence is very uncertain about the effect of the use of ilioinguinal block compared with caudal analgesia for postoperative opioid consumption in the total postoperative period in children undergoing surgical procedures.
Source: Desai, 2022; Sahin, 2017 |
Complications
|
No GRADE |
The evidence is very uncertain about the effect of the use of ilioinguinal block compared with caudal analgesia for the complications epidural hematoma, nerve damage, and infection in children undergoing surgical procedures.
Source: - |
Anxiety
|
No GRADE |
The evidence is very uncertain about the effect of the use of ilioinguinal block compared with caudal analgesia for the complications anxiety in children undergoing surgical procedures.
Source: - |
Samenvatting literatuur
Description of studies
The systematic review by Desai (2020) comprised 23 RCTs in total comparing ilioinguinal–iliohypogastric (II-IH) and transversus abdominis plane (TAP) blocks with caudal techniques. Out of the 23 RCTs, five met our inclusion criteria and were included in the current analysis. After publication of the systematic review, two RCTs were published and included in the analysis (Desai, 2022; Varsha, 2021).
As shown in table 1, studies were conducted in patients undergoing various surgeries. Patients per arm varied from 15 to 55. Mean age ranged from 3 months to five years.
|
Author, year
|
Population (I/C), |
Surgical procedure |
II-IH block technique |
Local anesthetic administered for II-IH block |
Caudal technique |
Local anesthetic administered for caudal technique |
|
From the systematic review by Desai (2020) |
||||||
|
Abdellatif, 2012 |
23/24 Mean age: 3.47±1.54 months 89% M |
Inguinal hernia repair, hydrocelectomy or orchidopexy |
USG, unilateral single-shot injection
|
0.1 mL/kg bupivacaine 0.25% bolus injection
|
Landmark, single-shot injection
|
0.7 mL/kg bupivacaine 0.25% bolus injection |
|
Caetano, 2006 |
29/29 Mean age: 39.48 ± 17.36 months
|
Inguinal herniotomy
|
Method of localization not specified, unilateral single-shot injection
|
0.6 mL/kg ropivacaine 0.2% bolus injection
|
Method of localization not specified, single-shot injection
|
1 mL/kg ropivacaine 0.2% bolus injection |
|
Sahin, 2017 |
30/30/30* Mean age: 36.40 ± 23.98 months |
Inguinal herniotomy or orchidopexy |
USG, unilateral, lateral approach single-shot injection
|
0.3 mL/kg levobupivacaine 0.25% with epinephrine 1:200 000 bolus injection for the II-IH block |
Landmark, single-shot injection
|
0.7 mL/kg levobupivacaine 0.25% with epinephrine 1:200 000 bolus injection |
|
Somri, 2002 |
15/15 Mean age: 4.9±1.7 y
|
Orchidopexy |
Landmark, unilateral II-IH block and surgical site infiltration, single-shot injection
|
0.5 and 0.25 mL/kg bupivacaine 0.25% bolus injection for the II-IH block and the surgical site infiltration, respectively |
Landmark, single-shot injection
|
1 mL/kg bupivacaine 0.25% bolus injection |
|
Toker, 2016 |
25/25 Mean age: 4.08±1.61 y 76% M |
Inguinal herniorrhaphy
|
Landmark, unilateral single-shot injection |
0.3 mL/kg bupivacaine 0.25% bolus injection |
Landmark, single-shot injection
|
0.5 mL/kg bupivacaine 0.25% bolus injection |
|
Additional RCTs |
||||||
|
Desai, 2022 |
55/45, Mean age: 3.88±1.77 y 91% M |
Elective unilateral inguinal herniotomy |
Landmark unilateral II-IH block |
0.3 mL/kg of 0.25% concentration of bupivacaine |
Caudal epidural, single-shot injection |
0.75 mL/kg of 0.25% concentration of bupivacaine |
|
Varsha, 2021 |
23/23 Mean age: 3.7±2.3 y 91% M |
Unilateral herniotomy |
USG‑IL/IH block
|
25 mL/kg body weight of 0.25% bupivacaine with 1 μg/kg of dexmedetomidine |
Landmark, single-shot injection |
0.75 mL/kg body weight of 0.25% bupivacaine and 1 μg/kg of dexmedetomidine |
*Third arm (TAP block) not included in the current analysis
Results
1. Postoperative pain
1.1 At 0 to 2 hours
Four studies reported postoperative pain at 0 to 2 hours post-surgery. The pooled analysis revealed a standardized mean difference (SMD) of -0.23 (95% confidence interval (CI) -0.81 to 0.35) in favor of II-IH block. This difference was not clinically relevant.
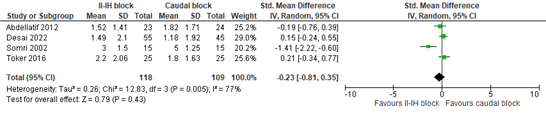
Figure 1
In addition to the pooled analysis, Varsha (2021) reported Face, Legs, Activity, Cry, Consolability (FLACC) pain scores graphically. From 0 to 2 hours post-surgery, no clinically relevant difference was found between the groups. All pain scores up to 2 hours were relatively low (<2 on FLACC scale). This result is in line with the pooled analysis.
Sahin (2017) reported modified Children’s Hospital of Eastern Ontario Pain Scores (mCHEOPS, range 1-10) scores graphically. At 1-hour post-surgery, the pain scores were significantly higher in the II-IH group, but this difference was not clinically relevant.
1.2 At 4 to 6 hours
Desai (2022) reported FLACC (range 0-10) pain scores at 4-hours post-surgery. In the II-IH group, the mean pain score was 0.31±0.96 and in the caudal group 0.44±1.01 (MD -0.13, 95% CI -0.52 to 0.26). This difference was not clinically relevant in favor of II-IH block.
Sahin (2017) reported mCHEOPS (range 1-10) scores graphically. At 4-hours post-surgery, the pain scores were significantly higher in the II-IH group. This difference was clinically relevant in favor of caudal block. Both scores were below 3.
Toker (2016) reported pain scores on the Children’s and infants’ postoperative pain scale (CHIPPS, range 0-10). At 6 hours post-surgery in the II-IH group, the mean pain score was 0.88 ± 1.27 and in the caudal group 1.00±1.58 (MD -0.12, 95% CI -0.91 to 0.67). This difference was not clinically relevant in favor of II-IH block.
Varsha (2021) reported FLACC (range 0-10) pain scores graphically. At 6-hours post-surgery, no clinically relevant difference was found between the groups. The pain scores in both groups were close to 3.
1.3 At 24 hours
Caetano (2006) reported that all patients were pain free after 12 hours.
Sahin (2017) reported mCHEOPS (range 1-10) scores graphically. At 24-hours post-surgery, the pain scores were significantly higher in the II-IH group, but this difference was not clinically relevant. Both scores were relatively low (<2 on mCHEOPS).
Varsha (2021) reported FLACC (range 0-10) pain scores graphically. At 6-hours post-surgery, no clinically relevant difference was found between the groups. The pain scores in both groups were between 2 and 3.
2. Postoperative opioid consumption
2.1 In PACU
Somri (2002) reported the mean dose of fentanyl IV administered in the PACU. In the II-IH block group, five patients required fentanyl due to high pain scores, with a mean dose of 18.5 µg (range 5-25). In the caudal group, three patients 14.5 required fentanyl, with a dose of 14.5 µg (range 5-30). This difference is clinically relevant in favor of caudal block.
2.2 In 24 hours
None of the included studies reported the outcome ‘postoperative opioid consumption in 24 hours’.
2.3 In total postoperative period
Sahin (2017) reported that none of the patients included in the study groups needed morphine post-surgery.
Desai (2022) reported that there were no opioid related treatment requiring side-effects or block related complications in cases during the postoperative follow-up.
3. Complications
3.1 Epidural hematoma, nerve damage, infection
None of the included studies reported the complications ‘epidural hematoma, nerve damage, and infection’.
4. Anxiety
None of the included studies reported the outcome ‘anxiety’.
Level of evidence of the literature
The level of evidence regarding the outcome measure postoperative pain at 0 to 2 hours was downgraded by three levels because of study limitations (risk of bias due to inadequate randomization and blinding, -1); number of included patients (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure postoperative pain at 4 to 6 hours was downgraded by three levels because of study limitations (risk of bias due to inadequate randomization and blinding, -1); conflicting results (inconsistency, -1) and number of included patients (imprecision, -1). The level of evidence is very low.
The level of evidence regarding the outcome measure postoperative pain at 24 hours was downgraded by three levels because of study limitations (risk of bias due to inadequate randomization and blinding, -1); number of included patients (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure postoperative opioid consumption in PACU was downgraded by three levels because of study limitations (risk of bias due to inadequate randomization and blinding, -1); number of included patients (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure postoperative opioid consumption in 24 hours could not be assessed, since none of the included studies reported this outcome measure.
The level of evidence regarding the outcome measure postoperative opioid consumption in total was downgraded by three levels because of study limitations (risk of bias due to inadequate randomization and blinding, -1); number of included patients (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure complications could not be assessed, since none of the included studies reported this outcome measure.
The level of evidence regarding the outcome measure anxiety could not be assessed, since none of the included studies reported this outcome measure.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the (in)effectiveness of ilioinguinal block when compared with caudal analgesia in children undergoing a surgical procedure?
| P: | Children undergoing a surgical procedure |
| I: | Ilioinguinal block + standard care |
| C: | Caudal analgesia (epidural nerve block) + standard care |
| O: |
Postoperative pain Postoperative opioid consumption Complications Anxiety |
Relevant outcome measures
The guideline development group considered postoperative pain as a critical outcome measure for decision making; and postoperative opioid consumption and adverse events as important outcome measures for decision making.
The working group defined the outcome measures as follows:
- Postoperative pain à PACU / 0 hours, 6 and 24 hours (at rest; if nothing was reported about the condition in which pain was assessed (at rest or during mobilization) it was assumed pain was measured at rest)
- Postoperative opioid consumption à PACU, 24 hours and total
- Adverse events à epidural hematoma, nerve damage, infection
A priori, the working group did not define the outcome measure anxiety but used the definitions used in the studies.
The working group defined one point as a minimal clinically (patient) important difference on a 10-point pain scale and 10 mm on a 100 mm pain scale. Regarding postoperative opioid consumption, a difference of 20% was considered clinically relevant. Regarding length of stay, a difference of one day was considered clinically relevant. For dichotomous variables, a difference of 10% was considered clinically relevant (RR ≤0.91 or ≥1.10; RD 0.10). For standardized mean differences (SMD), 0.5 was considered clinically relevant.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 23rd July, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 195 hits. Studies were selected based on the following criteria:
- Randomized controlled trial (RCT) or systematic review of RCTs
- Published ≥ 2000
- Conform PICO
Nine studies were initially selected based on title and abstract screening. After reading the full text, six studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
One systematic review and two additional RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Desai N, Chan E, El-Boghdadly K, Albrecht E. Caudal analgesia versus abdominal wall blocks for pediatric genitourinary surgery: systematic review and meta-analysis. Reg Anesth Pain Med. 2020 Nov;45(11):924-933. doi: 10.1136/rapm-2020-101726. Epub 2020 Sep 14. PMID: 32928996.
- Desai U, Sontakke AY. Assessment of Postoperative Analgesic Efficacy of Ilioinguinal-Iliohypogastric Block as Compared to Caudal Block in Children Undergoing Inguinal Herniotomy: A Randomised Clinical Study. Journal of Clinical & Diagnostic Research. 2022 Jul 1;16(7).
- Varsha R, Desai SN, Mudakanagoudar MS, Annigeri VM. Comparison between caudal epidural and ultrasound-guided ilioinguinal-iliohypogastric block with bupivacaine and dexmedetomidine for postoperative analgesia following pediatric inguinal hernia surgeries: A prospective randomized, double-blind study. J Anaesthesiol Clin Pharmacol. 2021 Jul-Sep;37(3):389-394. doi: 10.4103/joacp.JOACP_175_19. Epub 2021 Oct 12. PMID: 34759549; PMCID: PMC8562458.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Desai, 2020
[individual study characteristics deduced from [1st author, year of publication ]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to December 2019
A: Abdellatif, 2012 C: Caetano, 2006 H: Sahin, 2017 K: Somri, 2002 N: Toker, 2016
Study design: RCT
Setting and Country: not reported
Source of funding and conflicts of interest: The authors have not declared a specific grant for this research from any funding agency in the public, commercial or not-for-profit sectors. |
Inclusion criteria SR: RCTs that included pediatric patients having genitourinary surgery with II-IH or TAP block as the intervention and caudal analgesia as the comparator, and published in the English language
Exclusion criteria SR:
23 studies included, of which 5 included for the current literature analysis
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: 23/24 patients C: 29/29 H: 30/30 K: 15/15 N: 25/25
Groups comparable at baseline? Yes |
Describe intervention:
II(-IH) block
A: 0.1 mL/kg bupivacaine 0.25% unilateral single-shot bolus injection C: 0.6 mL/kg ropivacaine unilateral single-shot bolus injection H: single-shot Injection 0.3 mL/kg levobupivacaine 0.25% with epinephrine 1:200 000 bolus injection for the II-IH block K: Landmark, unilateral II-IH block and surgical site infiltration, single-shot injection 0.5 and 0.25 mL/kg bupivacaine 0.25% bolus injection for the II-IH block and the surgical site infiltration, respectively N: Landmark, unilateral single-shot injection 0.3 mL/kg bupivacaine 0.25% bolus injection
|
Describe control:
Caudal technique
A: 0.7 mL/kg bupivacaine 0.25% single-shot bolus injection H: Landmark, single-shot Injection 0.7 mL/kg levobupivacaine 0.25% with epinephrine 1:200 000 bolus injection K: Landmark, single-shot Injection 1 mL/kg bupivacaine 0.25% bolus injection N: Landmark, single-shot Injection 0.5 mL/kg bupivacaine 0.25% bolus injection
|
End-point of follow-up: Not reported
For how many participants were no complete outcome data available? (intervention/control) Not reported
|
pain score at 0–2 hours
Pooled effect (random effects model): SMD -0.09 [95% CI -0.47 to 0.29] favoring .II-IH Heterogeneity (I2): 65%
Pain scores at other time points combined II-IH and TAP block in one group
|
Risk of bias (high, some concerns or low): Tool used by authors: Cochranes ’collaboration tool
A: Some concerns C: Some concerns H: High K: Some concerns N: Low
Facultative:
Brief description of author’s conclusion
In conclusion, II-IH block, TAP block and caudal analgesia result in similar postoperative analgesia in pediatric patients undergoing genitourinary surgery. The quality of evidence was graded as high for the postoperative pain score at 0–2 hours and moderate secondary to publication bias for the need for in-hospital rescue analgesia. Compared with caudal analgesia, II-IH and TAP block are less invasive as they do not penetrate the neuraxis, and decrease the incidence of postoperative motor blockade and the time to micturition. In view of this, II-IH and TAP block might be considered in preference to caudal analgesia.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Only combined GRADE for TAP and II-IH block available
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Desai, 2022 |
Type of study: single-centre, randomised clinical study
Setting and country: Tertiary Medical College and Hospital, India
Funding and conflicts of interest:
|
Inclusion criteria: Children aged 6 months to 6 years of age, of both gender, belonging to American Society of Anaesthesiology (ASA)- Physical Status grade I and II, posted for elective unilateral Inguinal herniotomy
Exclusion criteria: Patients with lack of parental consent, coagulopathy, infection at the site of puncture, congenital anomaly of spine, known allergy to drug used in the study
N total at baseline: Intervention: 55 Control: 55
Important prognostic factors2: For example age ± SD: I: 3.88±1.77 C: 3.28±2.06
Sex: I: 91% M C: 96% M
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Landmark II-IH block Local anaesthetic used was 0.3 mL/kg of 0.25% concentration of bupivacaine. |
Describe control (treatment/procedure/test):
Caudal epidural Drug used was 0.75 mL/kg of 0.25% concentration of bupivacaine. |
Length of follow-up: Until discharge (about 6 hours)
Loss-to-follow-up: Intervention: N =0 (0%)
Control: N=10 (18%) Reasons (describe): inadequate patients’ data
Incomplete outcome data: See above
|
Outcome measures and effect size (include 95%CI and p-value if available):
FLACC score at 0 min I: 1.25±1.85 C: 1.13±2.05
FLACC at 4 hours I: 0.31±0.96 C: 0.44±1.01
There were no opioid related treatment requiring side-effects or block related complications in cases during the postoperative follow-up. |
Conclusion:
Hernia block was more effective than caudal block based on duration of postoperative analgesia. There was higher margin of safety with lower volume of local anaesthetic used. |
|
Varsha, 2021 |
Type of study: randomised double-blind study
Setting and country: India
Funding and conflicts of interest: No financial support or conflicts of interest |
Inclusion criteria: ASA class I and II, aged between 1 and 10 years scheduled to undergo unilateral herniotomy
Exclusion criteria: active respiratory tract infection, bleeding disorders, neuromuscular abnormalities, deformities of the caudal space, and those allergic to nonsteroidal anti‑inflammatory drugs or any of the study drugs
N total at baseline: Intervention: 23 Control: 23
Important prognostic factors2: For example age ± SD: I: 3.7±2.3 C: 4.5±2.9
Sex: I: 91% M C: 91% M
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
USG‑IL/IH block with 0.25 mL/kg body weight of 0.25% bupivacaine with 1 μg/kg of dexmedetomidine. 50 μg of dexmedetomidine was diluted in 1 mL syringe (0.5 mL of dexmedetomidine and 0.5 mL normal saline, resulting in 5 μg/0.1 mL). |
Describe control (treatment/procedure/test):
the caudal block was performed by identifying the landmarks and after loss of resistance to the needle. They received 0.75 mL/kg body weight of 0.25% bupivacaine and 1 μg/kg of dexmedetomidine as an additive. |
Length of follow-up: 24 hours
Loss-to-follow-up: Intervention: N =0 (0%)
Control: N =0 (0%)
Incomplete outcome data: See above
|
Outcome measures and effect size (include 95%CI and p-value if available):
FLACC scores shown graphically.
There was no significant difference in the FLACC scores throughout the postoperative duration of 24 h.
Three children in the caudal group and none in USG‑IL/IH had pain in the first 2 postoperative hours. |
Conclusion:
Both caudal epidural and USG‑IL/IH block with dexmedetomidine as additive provide the comparable duration of postoperative analgesia with no significant side effects. |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Desai, 2022 |
Probably no
Reason: study is randomized, but method is not described |
Probably no;
Reason: not described |
Probably no;
Reason: not described
|
Probably yes
Reason: inadequate patients data in the control group led to loss to follow-up |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
HIGH:
Unknown randomization method, lack of blinding |
|
Varsha, 2021 |
Probably yes;
Reason: a computer-generated table was used |
Probably no;
Reason: not described |
Probably yes;
Reason: Patient and outcome assessor were blinded |
Definitely yes;
Reason: no loss to follow-up reported |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Coşarcan SK, Mahli A. Çocuklarda unilateral inguinal herni operasyonlarında ilioinguinal/iliohipogastrik ve sakral epidural bloğun intraoperatif ve postoperatif analjezik özelliklerinin karşılaştırılması [Comparison of intraoperative and postoperative analgesic properties of ilioinguinal/iliohypogastric and sacral epidural block in pediatric unilateral inguinal hernia operations]. Agri. 2022 Jan;34(1):38-46. Turkish. doi: 10.14744/agri.2021.48254. PMID: 34988963. |
foreign language |
|
Hamill JK, Rahiri JL, Liley A, Hill AG. Rectus sheath and transversus abdominis plane blocks in children: a systematic review and meta-analysis of randomized trials. Paediatr Anaesth. 2016 Apr;26(4):363-71. doi: 10.1111/pan.12855. Epub 2016 Feb 4. PMID: 26846889. |
wrong intervention and comparator |
|
Diyaolu M, Taylor J, Austin J, Gibson M, Ramamurthi RJ, Tsui B, Chao S. Laparoscopic versus ultrasound-guided visualization of transversus abdominis plane blocks. J Pediatr Surg. 2021 Jun;56(6):1190-1195. doi: 10.1016/j.jpedsurg.2021.02.025. Epub 2021 Feb 20. PMID: 33771368. |
Wrong intervention and comparator |
|
Seyedhejazi M, Motarabbesoun S, Eslampoor Y, Taghizadieh N, Hazhir N. Appendectomy Pain Control by Transversus Abdominis Plane (TAP) Block in Children. Anesth Pain Med. 2019 Feb 20;9(1):e83975. doi: 10.5812/aapm.83975. PMID: 30881907; PMCID: PMC6412316. |
Wrong intervention |
|
Hung TY, Bai GH, Tsai MC, Lin YC. Analgesic Effects of Regional Analgesic Techniques in Pediatric Inguinal Surgeries: A Systematic Review and Network Meta-Analysis of Randomized Controlled Trials. Anesth Analg. 2024 Jan 1;138(1):108-122. doi: 10.1213/ANE.0000000000006341. Epub 2023 Dec 15. PMID: 36571797. |
various interventions |
|
Atta NM. Ultrasound guided ilioinguinal/iliohypogastric nerve block versus caudal block during surgical inguinal hernia repair in children. Egyptian journal of anaesthesia. 2008; 24(2), 101‐107. |
no fulltext available |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-12-2024
Beoordeeld op geldigheid : 17-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met postoperatieve pijn.
Werkgroep
Dr. L.M.E. (Lonneke) Staals, anesthesioloog, voorzitter, NVA
Dr. C.M.A. (Caroline) van den Bosch, anesthesioloog-pijnspecialist, NVA
Drs. A.W. (Alinde) Hindriks-Keegstra, anesthesioloog, NVA
Drs. G.A.J. (Geranne) Hopman, anesthesioloog, NVA
Drs. L.J.H. (Lea) van Wersch, anesthesioloog, NVA
Dr. C.M.G. (Claudia) Keyzer-Dekker, kinderchirurg, NVvH
Drs. F.L. (Femke) van Erp Taalman Kip, orthopedisch kinderchirurg, NOV
Dr. L.M.A. (Laurent) Favié, ziekenhuisapotheker, NVZA
J. (Jantine) Boerrigter-van Ginkel, verpleegkundig specialist kinderpijn, V&VN
S. (Sharine) van Rees-Florentina, recovery verpleegkundige, BRV
E.C. (Esen) Doganer en M. (Marjolein) Jager, beleidsmedewerker, Kind & Ziekenhuis
Klankbordgroep
Dr. L.M. (Léon) Putman, cardiothoracaal chirurg, NVT
R. (Remko) ter Riet, MSc, anesthesiemedewerker/physician assistant, NVAM
Drs. L.I.M. (Laura) Meltzer, KNO-arts, NVKNO
Met ondersteuning van
Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
L.M.E. Staals (voorzitter) |
Anesthesioloog Sectorhoofd Kinder- en Obstetrische anesthesiologie Universitair Docent Erasmus MC Sophia Kinderziekenhuis, Rotterdam |
Lid wetenschapcommissie Sectie Kinderanesthesiologie (NVA) (onbetaald) Lid scientific forum ESAIC/Devices abd Technology (onbetaald) Lid werkgroep Landelijke Kwaliteitsregistratie Amandeloperaties (NVKNO/NVA) (onbetaald) |
MSD/ Merck: i.v.m. een clinical trial naar sugammadex bij kinderen: Consultant of Global Clinical Trial Operations in the Netherlands. Betaald (inkomsten gaan op onderzoekskostenplaats van de afdeling Anesthesiologie Erasmus MC Sophia). Dit onderzoek gaat over sugammadex (antagonist voor spierverslapping). Klinisch onderzoek gedaan naar postoperatieve pijnstilling bij kinderen na buikchirurgie, d.m.v. wondcatheter met lokaal anestheticum (nog niet gepubliceerd, daarom niet meegenomen in search van de richtlijn). Er is geen belang bij het advies van de richtlijn. |
Geen restricties |
|
C.M.A. van den Bosch |
Anesthesioloog - pijnspecialist Prinses Maxima Centrum |
Geen |
Geen |
Geen restricties |
|
A.W. Hindriks-Keegstra |
Anesthesioloog UMC Utrecht
|
Geen |
VR ter behandeling van postoperatieve pijn en angst bij kinderen. |
Geen restricties. Extern gefinancierd onderzoek valt buiten bestek van de richtlijn |
|
G.A.J. Hopman |
Anesthesioloog, Radboud UMC, Nijmegen |
Geen |
Geen |
Geen restricties |
|
L.J.H. van Wersch |
Anesthesioloog, Maasziekenhuis Pantein |
Geen |
Geen |
Geen restricties |
|
C.M.G. Keyzer-Dekker |
Kinderchirurg, Erasmus MC Sophia. |
Geen |
Geen |
Geen restricties |
|
F.L. van Erp Taalman Kip |
Orthopedisch kinderchirurg, Erasmus Medisch Centrum Rotterdam |
-Docent Fontys Hogeschool Eindhoven, curriculum kinder- podotherapie -Docent TNO Leiden, onderwijs Jeugdartsen, - Trainer stichting Skills4Comfort |
Geen |
Geen restricties |
|
L.M.A. Favié |
Ziekenhuisapotheker Erasmus MC |
Geen |
Geen |
Geen restricties |
|
J.Boerrigter-van Ginkel |
Verpleegkundig Specialist Kinderpijn, Wilhelmina Ziekenhuis Utrecht. |
Geen |
Geen |
Geen restricties |
|
S. van Rees-Florentina |
Recovery verpleegkundige Flevoziekenhuis Almere |
Bestuurslid BRV BRN Nederland
|
Geen |
Geen restricties |
|
E.C. Doganer |
Stichting Kind&Ziekenhuis Junior Projectmanager/beleidsmedewerker |
Geen |
Geen |
Geen restricties |
|
M. Jager |
Stichting Kind&Ziekenhuis Junior Projectmanager/beleidsmedewerker |
Begeleider C bij Sherpa, betaald |
Geen |
Geen restricties |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
L.M. Putman |
Congenitaal cardio-thoracaal chirurg, Leids Universitair Medisch Centrum & Amsterdam UMC, voltijd functie |
Geen |
Geen |
Geen restricties |
|
R. ter Riet |
Anesthesiemedewerker/Physician Assistant Anesthesiologie/Pijngeneeskunde |
Voorzitter NVAM, Voorzitter commissie (acute) pijn NVAM/V&VN |
Geen |
Geen restricties |
|
L.I.M. Meltzer |
Beatrix ziekenhuis Gorinchem, Rivas zorggroep |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door zitting van een afgevaardigde van de patiëntenvereniging (Stichting Kind & Ziekenhuis) in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en Stichting Kind & Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Ilioinguinaal blok |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor kinderen met postoperatieve pijn. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Postoperatieve pijn (NVA, 2013) op noodzaak tot revisie. Het raamwerk van de richtlijn voor volwassenen is ook kritisch bekeken als uitgangspunt. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
De beoordelingen van de literatuur en de conclusies zijn gedaan op basis van de GRADE systematiek. De werkgroep vindt het belangrijk om relevante beperkingen hiervan aan te geven.
De klinische vragen in deze richtlijn gaan veelal over een reductie van postoperatieve pijn en opioïdenconsumptie bij een individuele patiënt. Onderzoeken beschrijven de verschillen op groepsniveau, over studies met verschillende patiëntpopulaties en operaties heen. Opioïdenconsumptie is sterk afhankelijk van tijdstip, ingreep en ernst van de pijn. Door het werken met een absolute drempelwaarde in mg (i.p.v. een relatieve drempelwaarde in %) bereiken resultaten gemeten op vroege postoperatieve tijdstippen en in studies met ingrepen met relatief lage opioïdenconsumptie vaak niet de MCID. Daarbij komt ook dat de doelgroep van de huidige richtlijn enorm varieert in lengte en gewicht (van prematuur tot adolescent). Lengte en gewicht heeft grote invloed op het analgetische effect van een specifieke dosering, waardoor alleen kijken naar milligrammen niet volstaat. Waar mogelijk is ook de relatieve reductie in procenten beschreven.
De keuze van de MCID (absoluut verschil in pijnscore of opioïdenconsumptie) heeft een bepaalde mate van willekeurigheid en is niet absoluut te zien. Ook zijn de conclusies zo geformuleerd (en geven alleen beperkt antwoord op het effect op een individuele patiënt voor een specifieke ingreep). In de literatuur worden de eindpunten pijnscores en opioïdenconsumptie separaat van elkaar weer gegeven, suggererend dat deze onafhankelijk van elkaar zijn. Echter kunnen deze twee eindpunten niet onafhankelijk van elkaar beoordeeld worden; in ieder protocol is opgenomen dat pijn behandeld moet worden. Deze separate beoordeling geeft niet altijd een adequaat antwoord op de klinische vraag naar het analgetische effect van een interventie.
Daarnaast worden multimodale componenten als aparte interventies beoordeeld, echter de klinische vraag is naar de effectiviteit als bouwsteen van een multimodale werkwijze.
Voor doseringsadviezen wordt er verwezen naar betrouwbare bronnen, zoals het farmacotherapeutisch kompas of het kinderformularium.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
|
Richtlijn: Postoperatieve pijn bij kinderen |
|
|
Uitgangsvraag: UV15 - Wat is de plaats van buikwandblokken bij zorg voor kinderen die een chirurgische ingreep ondergaan? |
|
|
Database(s): Embase, Medline (Ovid) |
Datum: 17-07-2023, 23-7-2023 |
|
Periode: 2000-heden |
Talen: nvt |
Zoekopbrengst
|
|
EMBASE |
OVID/Medline |
Ontdubbeld |
|
SRs |
18 |
7 |
19 |
|
RCTs |
146 |
43 |
140 |
|
OBS |
166 |
32 |
36 |
|
Totaal |
330 |
82 |
195 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#17 |
#11 AND #14 |
166 |
|
#16 |
#11 AND #13 |
146 |
|
#15 |
#11 AND #12 |
18 |
|
#14 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14273794 |
|
#13 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3837371 |
|
#12 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
946979 |
|
#11 |
#10 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
262 |
|
#10 |
#3 AND #9 |
481 |
|
#9 |
#4 OR #5 OR #6 OR #7 OR #8 |
6000 |
|
#8 |
('erector spinae' NEAR/4 block*):ti,ab,kw |
1617 |
|
#7 |
('rectus sheath' NEAR/4 block*):ti,ab,kw |
409 |
|
#6 |
'ilioinguinal nerve block'/exp OR 'iliohypogastric nerve block'/exp OR (((ilioinguinal OR iliohypogastric) NEAR/4 block*):ti,ab,kw) |
568 |
|
#5 |
'quadratus lumborum block'/exp OR 'ql block*':ti,ab,kw OR 'quadratus lumborum block*':ti,ab,kw |
757 |
|
#4 |
'transversus abdominis plane block'/exp OR 'tap block*':ti,ab,kw OR 'transverse abdominal plane block*':ti,ab,kw OR 'transverse abdominis plane block*':ti,ab,kw OR 'transverse abdominus plane block*':ti,ab,kw OR 'transverses abdominis plane block*':ti,ab,kw OR 'transversus abdominal plane block*':ti,ab,kw OR 'transversus abdominis plane block*':ti,ab,kw OR 'transversus abdominus plane block*':ti,ab,kw |
3221 |
|
#3 |
#1 AND #2 |
143064 |
|
#2 |
'adolescent'/exp OR 'baby'/exp OR 'boy'/exp OR 'child'/exp OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab |
5736525 |
|
#1 |
'abdominal surgery'/exp OR 'abdominal surger*' OR 'abdomen surger*':ti,ab,kw OR 'abdominal operation*':ti,ab,kw OR 'upper abdomen surger*':ti,ab,kw OR (('abdominal wall'/exp OR 'abdominal wall*':ti,ab,kw) AND ('surgery'/exp OR 'surgical patient'/exp OR 'surgical risk'/exp OR 'perioperative period'/exp OR 'surgery'/lnk OR surgic*:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR presurg*:ti,ab,kw OR preoperati*:ti,ab,kw OR perisurg*:ti,ab,kw OR perioperati*:ti,ab,kw OR postsurg*:ti,ab,kw OR postoperati*:ti,ab,kw OR nonsurg*:ti,ab,kw OR nonoperatic*:ti,ab,kw OR laparoscop*:ti,ab,kw OR intraoperati*:ti,ab,kw)) |
1024828 |
Ovid/Medline
|
# |
Searches |
Results |
|
20 |
14 and 17 |
32 |
|
19 |
14 and 16 |
43 |
|
18 |
14 and 15 |
7 |
|
17 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort*.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
4535387 |
|
16 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2614348 |
|
15 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
682744 |
|
14 |
limit 13 to yr="2000-Current" |
77 |
|
13 |
12 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
78 |
|
12 |
5 and 11 |
86 |
|
11 |
6 or 7 or 8 or 9 or 10 |
3626 |
|
10 |
('rectus sheat*' adj4 block*).ti,ab,kf. |
252 |
|
9 |
('erector spinae' adj4 block*).ti,ab,kf. |
1327 |
|
8 |
('ilioinguinal nerve block' or 'iliohypogastric nerve block' or ((ilioinguinal or iliohypogastric) adj4 block*)).ti,ab,kf. |
309 |
|
7 |
('quadratus lumborum block' or 'ql block*' or 'quadratus lumborum block*').ti,ab,kf. |
494 |
|
6 |
('transversus abdominis plane block' or 'tap block*' or 'transverse abdominal plane block*' or 'transverse abdominis plane block*' or 'transverse abdominus plane block*' or 'transverses abdominis plane block*' or 'transversus abdominal plane block*' or 'transversus abdominis plane block*' or 'transversus abdominus plane block*').ti,ab,kf. |
1509 |
|
5 |
3 and 4 |
5669 |
|
4 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2918084 |
|
3 |
1 or 2 |
60232 |
|
2 |
(abdominal surger* or abdomen surger* or abdominal operation* or upper abdomen surger* or abdominal wall*).ti,ab,kf. |
43715 |
|
1 |
exp Abdomen/su [Surgery] |
25260 |
