Lidocaïne
Uitgangsvraag
Wat is de plaats van lidocaïne iv bij zorg voor kinderen die een chirurgische ingreep ondergaan?
Aanbeveling
Dien lidocaïne iv niet toe als onderdeel van standaard multimodale postoperatieve pijnstilling.
Overweeg de toediening van lidocaïne iv voor individuele patiënten indien er limitaties zijn in de standaard pijnstilling.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematisch literatuuronderzoek uitgevoerd naar het effect van lidocaïne als toevoeging aan een multimodaal anesthesieregime bij kinderen die een chirurgische ingreep ondergaan. Er werden vijf RCT’s geïncludeerd. De cruciale uitkomstmaten waren postoperatieve pijn en postoperatief opioïdengebruik. De belangrijke uitkomstmaat was systemische toxiciteit.
Voor de uitkomstmaat postoperatieve pijn op 0 uur/op de verkoever zien we mogelijk een positief effect van lidocaïne (GRADE: laag). Er werd twee punten afgewaardeerd, omdat het gepoolde betrouwbaarheidsinterval een grens van klinische besluitvorming doorkruist en vanwege een kleine studiepopulatie. Het verschil tussen de groepen was klinisch relevant in het voordeel van de interventiegroep die lidocaïne kreeg.
Voor de uitkomstmaat postoperatieve pijn op 6 uur en op 24 uur kunnen geen eenduidige conclusies getrokken worden (GRADE: zeer laag). Er werd drie punten afgewaardeerd, omdat de uitkomstmaten slechts in één studie werden gerapporteerd met kleine studiepopulaties. Het bewijs is te onzeker om een uitspraak te doen over de toevoeging van lidocaïne aan standaardzorg.
Hetzelfde geldt voor postoperatief opioïdengebruik in 24 uur en in de totale postoperatieve periode (GRADE: zeer laag). Omdat er slechts weinig studies waren die deze uitkomstmaten rapporteerden, met een kleine studiepopulatie en methodologische beperkingen van de studie (risico op bias), zijn we ook hierbij onzeker over het bewijs. De overall bewijskracht van de cruciale uitkomstmaten is daarmee zeer laag.
De belangrijke uitkomstmaat systemische toxiciteit is de bewijskracht zeer laag, omdat er geen events werden gerapporteerd en er was een mogelijk risico op bias vanwege een open-label studie. Daarmee kon deze uitkomstmaat dus geen verdere richting geven aan de besluitvorming.
Bijwerkingen die vaak voorkomen bij het gebruik van lidocaïne zijn duizeligheid, misselijkheid, bradycardie, licht gevoel in het hoofd, gevoelloosheid van de tong en tinnitus. Deze bijwerkingen kunnen voorkomen bij gebruikelijke dosering. In geval van overdosering kunnen er toxische reacties optreden, dit is vanaf een plasmaconcentratie vanaf 5-9 mg/liter (farmacotherapeutisch kompas). De eerste symptomen zijn een doof gevoel van de mond en tong, een licht gevoel in het hoofd, tinnitus en visusstoornissen. Spierverschijnselen kunnen voorafgaan aan convulsies. Cardiale verschijnselen zijn hypotensie, bradycardie, aritmieën en hartstilstand (farmacotherapeutisch kompas). Doordat er sprake is van kleine patiëntenpopulaties, is het niet zinvol om naar subgroepen te kijken aangezien de aantallen dan nog kleiner uitvallen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiëntkarakteristieken kunnen een rol spelen in voorkeur om al dan niet lidocaïne te gebruiken als onderdeel van multimodale pijnstilling. Er is geen duidelijke evidents voor het gebruik van lidocaïne bij kinderen, maar slechts een mogelijk positief effect op vroeg postoperatieve pijn. Lidocaïne zou gebruikt kunnen worden als er duidelijke contra-indicaties of bekende hevige bijwerkingen zijn voor de voorkeurspijnstilling. De beslissing hiervoor ligt bij de behandelend arts en niet bij de patiënt, de ouders of de verzorgers van de patiënt.
Kosten (middelenbeslag)
De kosten van het middel lidocaïne zijn laag. Het is niet in kaart gebracht of het toedienen van lidocaïne invloed heeft op opname-gerelateerde kosten. Kosten spelen geen significante rol bij de keuze om lidocaïne wel of niet toe te dienen.
Aanvaardbaarheid, haalbaarheid en implementatie
Lidocaïne is een goed beschikbaar middel dat laag in de kosten is waardoor het haalbaar is om gebruikt te worden als onderdeel van multimodale pijnstilling. Aangezien lidocaïne ook topicaal wordt toegepast in zalf en pleisters dient men goed te berekenen wat de toegestane dosering is om overdosering te voorkomen. Lidocaïne wordt ook toegepast als lokaal anestheticum, waardoor er ook weer een grotere kans op overdosering bestaat en kans daarmee op toxiciteit. Door de meerdere toepassingen dienen hulpverleners van elkaar op de hoogte zijn als er op een manier lidocaïne is toegepast. Jonge patiënten kunnen de symptomen van toxiciteit niet goed aangeven, waardoor de eerste tekenen van toxiciteit dan ook makkelijk gemist kunnen worden. Wanneer er sprake is van een overgevoeligheid of allergie voor lidocaïne dan wel ander lokaalanestheticum dient het uiteraard niet gebruikt te worden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Uit de literatuuranalyse komt er geen sterke aanwijzing naar voren om lidocaïne toe te voegen aan de standaard zorg bij kinderen die een chirurgische procedure ondergaan. De onderzoekspopulaties zijn klein en er is geen sprake van klinisch relevante verschillen in pijn in de interventiepopulatie. Het mogelijk kleine positieve verschil in vroege pijnscores maakt dat het in een individuele patiënt overwogen zou kunnen worden mits er limitaties zijn in de gebruikelijke pijnstillingsmethode. De werkgroep is van mening dat er verder onderzoek met grote studiepopulaties nodig zijn om de vraagstelling in de toekomst met een hogere mate van evidence te kunnen beantwoorden.
Onderbouwing
Achtergrond
Lidocaïne is een pijnstillend middel wat reeds lange tijd als lokale verdoving in gebruik is. In 1948 werd het middel als synthetisch afgeleid amide van het lokaal anestheticum cocaïne geïntroduceerd. Het wordt gebruikt voor infiltratie en geleidingsanesthesie, epidurale anesthesie en sympathische zenuwblokkade. Daarnaast kan het ook gebruikt worden in de behandeling van ventriculaire tachyaritmie. Gezien de onwenselijke effecten van opioïden is een multimodale analgesie strategie steeds meer gebruikelijk in de volwassen patiëntenpopulatie. In therapeutische concentraties blokkeert het muscarinic (M1, M3) en N-methyl-D-aspartate (NMDA) receptoren. Bijwerkingen zijn zeldzaam, maar kunnen voorkomen als gevolg van overdosering en kunnen ernstig zijn.
Conclusies / Summary of Findings
|
Low GRADE |
Lidocaine may result in reduced postoperative pain at PACU arrival / 0 hours when compared with standard care in children undergoing a surgical procedure.
Sources: Batko, 2020; Kheirabadi, 2020; Lee, 2019. |
|
Very low GRADE |
The evidence is very uncertain about the effect of lidocaine on postoperative pain at 6 hours when compared with standard care in children undergoing a surgical procedure.
Source: Batko, 2020. |
|
The evidence is very uncertain about the effect of lidocaine on postoperative pain at 24 hours when compared with standard care in children undergoing a surgical procedure.
Source: Lee, 2019. |
|
Very low GRADE |
The evidence is very uncertain about the effect of lidocaine on postoperative opioid consumption in 24 hours when compared with standard care in children undergoing a surgical procedure.
Sources: El-Deeb, 2013; Kaszynski, 2021. |
|
The evidence is very uncertain about the effect of lidocaine on postoperative opioid consumption in the total postoperative period when compared with standard care in children undergoing a surgical procedure.
Source: Batko, 2020. |
|
Low GRADE |
Lidocaine may result in little to no difference in lidocaine-induced toxicity when compared with standard care in children undergoing a surgical procedure.
Sources: Batko, 2020; El-Deeb, 2013; Kaszynski, 2021; Lee, 2019. |
Samenvatting literatuur
Description of studies
As shown in table 1, studies were conducted in patients undergoing various surgeries. Different control conditions were used. Patients per arm varied from 19 to 44. The mean age of studies varied from 16 months to 13 years and the percentage of males 42 to 69.
Table 1. Characteristics of included studies.
|
Author, year
|
Population (I/C), mean age; % male |
Surgical procedure |
Intervention |
Control |
|
Batko, 2020 |
N: 22/19, Age 13 yr (range 8-15); 42% M |
major spine surgery |
Bolus dose: 1.5mg/kg over 30 minutes prior to surgery; Infusion dose: 1 mg/kg up to 6 hours post-op |
Placebo, same regimen |
|
El-Deeb, 2013 |
N: 40/40, Age 3.5 yr (range 1.5-5); 60% M |
major abdominal surgery |
Bolus dose: 1.5mg/kg 20 minutes before induction; Infusion dose: 1.5 mg/kg/h up to 6 hours post-op |
Placebo, same regimen |
|
Kaszynski, 2021 |
N: 36/35, age 12 yr (range 9-13.5); 69% M |
laparoscopic appendectomy |
Bolus dose: 1.5mg/kg over 5 minutes prior to induction; Infusion dose: 1 mg/kg/h until PACU admission |
No lidocaine infusion (standard general anesthesia regimen that the intervention group also received) |
|
Kheirabadi, 2020 |
N: 28/29, Age 16.39 months; 55% M |
cleft palate repair surgery |
Prior to anesthesia, IV lidocaine 1 mg/kg was administered |
Placebo, same regimen |
|
Lee, 2019 |
N: 33/33, Age 36 months (IQR 25-47); 66.7% M |
laparoscopic inguinal hernia repair surgery |
Bolus dose: 1 mg/kg over 1 minute prior to propofol administration; Infusion dose: 1.5 mg/kg/h at least until extubation |
Placebo, same regimen |
IQR: interquartile range; IV: intravenous; PACU: post-anesthesia care unit.
Results
1. Postoperative pain
1.1 Postoperative pain at PACU arrival / 0 hours
Three studies reported early postoperative pain scores. Pain was reported at 0 hours (Batko, 2020; Lee, 2019) and at recovery time (Kheirabadi, 2020). Figure 1 shows a mean difference (MD) of -1.78 (95% confidence interval (CI) -4.06 to 0.50) in favor of the intervention group. This difference is considered clinically relevant.
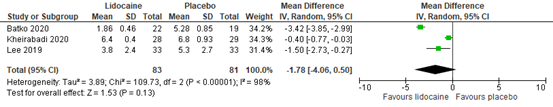
Figure 1. Postoperative pain at PACU arrival / 0 hours.
1.2 Postoperative pain at 6 hours
One study reported postoperative pain at 6 hours.
Batko (2020) reported mean pain scores on a numeric rating scale (NRS) ranging from 1 to 11. A pain score of 1.3 (±0.22) and 2.4 (±0.41) was found in the intervention and control group, respectively (MD -1.10; 95% CI -1.31 to -0.89).
1.3 Postoperative pain at 24 hours
No absolute data on postoperative pain at 24 hours was reported in the included studies.
Lee (2019) presented face, legs, activity, crying and consolability (FLACC) pain scores ranging from 0 to 10 in a figure. At 24 hours post-surgery, pain scores were similar in both groups and close to zero.
2. Postoperative opioid consumption
2.1 Postoperative opioid consumption at 24 hours
Two studies reported postoperative opioid consumption at 24 hours. Since these data are too limited, results were not pooled.
El-Deeb (2013) reported postoperative fentanyl on postoperative day 1. The mean fentanyl dose was 5.4 mcg/kg/d (±2.9) and 14.4 mcg/kg/d (±2.5) in the intervention and control group, respectively (MD -9.00; 95% CI -10.19 to -7.81). This difference is clinically relevant in favor of the intervention group.
Kaszynski (2021) reported median nalbuphine requirement during the first 24 hours after surgery. A median nalbuphine dose of 0.1061 (IQR 0.0962–0.2222) mg/kg in the lidocaine
group, compared to the control group median of 0.1325 (IQR 0.0899–0.22020) mg/kg. This difference in not clinically relevant.
2.2 Postoperative opioid consumption in total postoperative period
Batko (2020) reported median morphine doses in the total postoperative period. Cumulative morphine requirement was 1.1 mg (IQR 0.7–1.2) and 1.7 mg (IQR 1.2–2.4) in the intervention and control group, respectively. This difference is clinically relevant in favor of the intervention group.
3. Lidocaine-induced toxicity
Four studies reported on lidocaine-induced toxicity (Batko, 2020; El-Deeb, 2013; Kaszynski, 2021; Lee, 2019). All studies reported no signs of lidocaine-induced toxicity in any of the patients. Since there were no events, results were not pooled.
Level of evidence of the literature
The level of evidence for all outcome measures started as high, since the included studies were RCTs.
The level of evidence regarding the outcome measure postoperative pain at PACU arrival / 0 hours was downgraded by two levels because of a confidence interval crossing the border of clinical relevance and the number of included patients (imprecision, -2). The level of evidence is low.
The level of evidence regarding the outcome measure postoperative pain at 6 hours was downgraded by three levels because of number of included patients (imprecision, -3). The level of evidence is very low.
The level of evidence regarding the outcome measure postoperative pain at 24 hours was downgraded by three levels because of study limitations (risk of bias, -1) and the number of included patients (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure postoperative opioid consumption in 24 hours was downgraded by three levels because of study limitations (risk of bias, -1); because of a confidence interval crossing the border of clinical relevance and number of included patients (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure postoperative opioid consumption in total postoperative period was downgraded by three levels because of because of a confidence interval crossing the border of clinical relevance and number of included patients (imprecision, -3). The level of evidence is very low.
The level of evidence regarding the outcome measure lidocaine-induced toxicity was downgraded by two levels because of study limitations (risk of bias, -1); a low number of events (imprecision, -1). The level of evidence is low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the (in)effectiveness of adding lidocaine to standard care in children undergoing a surgical procedure?
P: Children undergoing a surgical procedure
I: Lidocaine IV and standard care as part of multimodal analgesic regimen
C: Standard care
O: Postoperative pain, postoperative opioid consumption, lidocaine-induced toxicity
Relevant outcome measures
The guideline development group considered postoperative pain as a critical outcome measure for decision making; and lidocaine-induced toxicity as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
- Postoperative pain à PACU / 0 hours, 6 and 24 hours (at rest; if nothing was reported about the condition in which pain was assessed (at rest or during mobilization) it was assumed pain was measured at rest)
- Postoperative opioid consumption à 24 hours and total
- Lidocaine-induced toxicity à cardiotoxicity (hypotension, arrhythmia) and neurotoxicity (altered mental status, slurred speech)
The working group defined one point as a minimal clinically (patient) important difference on a 10-point pain scale and 10 mm on a 100 mm pain scale. Regarding postoperative opioid consumption, a difference of 20% between groups was considered clinically relevant. For dichotomous variables, a difference of 10% was considered clinically relevant (RR ≤0.91 or ≥1.10).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 8-1-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1,110 hits. Studies were selected based on the following criteria:
- RCT or systematic review
- Comparing lidocaine with standard care
- Study population children undergoing a surgical procedure
- Reporting at least one outcome as defined in the PICO
- Published ≥ 2000
Seventeen studies were initially selected based on title and abstract screening. After reading the full text, twelve studies were excluded (see the table with reasons for exclusion under the tab Methods), and five studies were included.
Results
Five studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Batko I, Kościelniak-Merak B, Tomasik PJ, Kobylarz K, Wordliczek J. Lidocaine as an element of multimodal analgesic therapy in major spine surgical procedures in children: a prospective, randomized, double-blind study. Pharmacol Rep. 2020 Jun;72(3):744-755. doi: 10.1007/s43440-020-00100-7. Epub 2020 Apr 15. PMID: 32297162; PMCID: PMC7329801.
- Echevarría GC, Altermatt FR, Paredes S, Puga V, Auad H, Veloso AM, Elgueta MF. Intra-operative lidocaine in the prevention of vomiting after elective tonsillectomy in children: A randomised controlled trial. Eur J Anaesthesiol. 2018 May;35(5):343-348. doi: 10.1097/EJA.0000000000000807. PMID: 29570108.
- El-Deeb, A, El-Morsy, GZ, Ghanem, AAA, Elsharkawy, AA, & Elmetwally, AS. The effects of intravenous lidocaine infusion on hospital stay after major abdominal pediatric surgery. A randomized double-blinded study. Egyptian Journal of Anaesthesia. 2013;29(3), 225-230.
- Farmacotherapeutisch Kompas. Accessed on 1-5-2024: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/l/lidocaine__parenteraal
- Kaszyński M, Lewandowska D, Sawicki P, Wojcieszak P, P?gowska-Klimek I. Efficacy of intravenous lidocaine infusions for pain relief in children undergoing laparoscopic appendectomy: a randomized controlled trial. BMC Anesthesiol. 2021 Jan 5;21(1):2. doi: 10.1186/s12871-020-01218-0. PMID: 33397287; PMCID: PMC7784324.
- Kheirabadi D, Shafa A, Hirmanpour A, Zareh F. Prophylactic Effects of Intravenous Dexamethasone and Lidocaine on Attenuating Hemodynamic-Respiratory and Pain Complications in Children Undergoing Cleft Palate Repair Surgery With General Anesthesia. J Pain Palliat Care Pharmacother. 2020 Jun;34(2):63-68. doi: 10.1080/15360288.2019.1706691. Epub 2020 Jan 10. PMID: 31922432.
- Lee HM, Choi KW, Byon HJ, Lee JM, Lee JR. Systemic Lidocaine Infusion for Post-Operative Analgesia in Children Undergoing Laparoscopic Inguinal Hernia Repair: A Randomized Double-Blind Controlled Trial. J Clin Med. 2019 Nov 18;8(11):2014. doi: 10.3390/jcm8112014. PMID: 31752236; PMCID: PMC6912688.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
Research question: what are the (un)favorable effects of perioperative lidocaine iv in children undergoing a surgical procedure?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Batko, 2020 |
Type of study: |
Inclusion criteria: |
Thirty minutes before skin incision, acetaminophen 15 mg/kg, dexamethasone 0.1 mg/kg and lidocaine 1.5 mg/kg/30 min were applied. Other perioperative management was identical for all patients. |
Thirty minutes before skin incision, acetaminophen 15 mg/kg, dexamethasone 0.1 mg/kg and a placebo infusion were applied. Other perioperative management was identical for all patients. |
Duration of follow-up: Duration of follow-up: 48 hrs |
Pain immediately after surgery: 1.86 (±0.46) vs. 5.28 (±0.85)
Pain at 6h: 1.3 (±0.22) vs. 2.4 (±0.41)
"Lidocaine-induced toxicity: "No signs of local anesthetic systemic toxicity or serious neurological and cardiac disturbances, like dizziness, convulsions, prolonged/refractory hypotension or arrhythmias, respiratory and cardiac arrest were noted in any of patients receiving lidocaine.”
Morphine consumption total period, mg/kg: 1.1 (IQR 0.7–1.2) vs. 1.7 (1.2–2.4)
|
Author’s conclusion: Perioperative lidocaine administration, as a part of the applied analgesic therapy regimen, may decrease postoperative opioid demand and accelerates convalescence of children undergoing major surgery.
|
|
El-Deeb, 2013 |
Type of study: |
Inclusion criteria: |
Twenty minutes before induction lidocaine 1.5 mg/kg intravenously then infusion of 1.5 mg/kg/h up to 6 h postoperatively |
Twenty minutes before induction saline in a rate of 1.5 ml/kg/h |
Duration of follow-up: Duration of follow-up: 48 hrs |
Postoperative fentanyl POD1 5.4 ± 2.9 vs 14.4 ± 2.5
Pain: FLACC scale did not show any significant differences
Toxicity: "no serious lidocaine related side effects were reported" |
Author’s conclusion: Intravenous lidocaine infusion, started preoperatively and continued for 6 h postoperatively, attenuated stress response to major abdominal pediatric surgery. It also decreased hospital stay, opioid requirement and hastened return of bowel function.
|
|
Kaszynski, 2021 |
Type of study: |
Inclusion criteria: |
children receiving standard general anesthesia with intravenous lidocaine infusion 1,5 mg/kg for 5 minutes before induction of anesthesia. After 5 minutes, lidocaine infusion continued at rate of 1.5 mg/kg/h during operation, and discontinued before move the patients to PACU |
children receiving standard general anesthesia (involving fentanyl and sevoflurane) without lidocaine infusion |
Duration of follow-up: Duration of follow-up: 24 hrs I: 0, NA; |
nalbuphine requirement (mg/kg): I:0.1061 (IQR: 0.0962–0.2222) C: 0.1325 (IQR: 0.0899–0.22020)
Systemic toxicity: "No lidocaine related incidence of anaphylaxis, systemic toxicity, circulatory disturbances or neurological impairment was reported, during anaesthesia or 24 h after removal of the endotracheal tube." |
Author’s conclusion: Intraoperative systemic lidocaine administration reduced the intraoperative requirement for opioids in children undergoing laparoscopic appendectomy. This effect was time limited, and hence did not affect opioid consumption in the first 24 h following discontinuation of lidocaine infusion.
|
|
Kheirabadi, 2020 |
Type of study: |
Inclusion criteria: |
Prior to anesthesia, IV lidocaine 1 mg/kg was administered |
Prior to anesthesia, distilled water as placebo was administered |
Duration of follow-up: Duration of follow-up: 1 hr |
Pain score at recovery time: 6.4 ± 0.4 vs 6.8 ± 0.93 |
Author’s conclusion: Lidocaine significantly lessened postoperative pain compared to the placebo group during recovery time.
Third group (dexamethasone) was excluded from the current analysis.
|
|
Lee, 2019 |
Type of study: |
Inclusion criteria: |
Children in both groups were administered 1% lidocaine 1 mg kg−1 , over 1 min immediately prior to the administration of Propofol, to attenuate the pain upon injection of Propofol. Thereafter, patients in Group L received a continuous infusion of 1% lidocaine at a rate of 1.5 mg kg−1 h −1 , which was started intraoperatively prior to incision and continued at least until extubation |
Patients in Group C received a similar volume of 0.9% saline over the same time period |
Duration of follow-up: Duration of follow-up: 48 hrs |
Pain at 0h: 3.8 ± 2.4 vs 5.3 ± 2.7
Pain at 24 hours was presented in figures. Pain scores were similar in both groups and close to 0
Toxicity: "None of the cases reported adverse effects, such as nausea, vomiting, seizure, or arrhythmia, after using lidocaine." |
Author’s conclusion: Systemic lidocaine did not reduce the number of children who received rescue analgesia in PACU.
|
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Batko, 2020 |
Definitely yes;
Reason: computer-generated random table and an allocation ratio of 1:1. The randomization sequence was generated by a hospital pharmacist who was not involved in the study |
No information;
Reason: Not described |
Probably yes;
Reason: Patients, health care providers and outcome assessors blinded (blinding of data analysts not reported) |
Probably yes;
Reason: No loss to follow-up reported and none assumed |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW (all outcomes) |
|
Kaszynski, 2021 |
Definitely yes;
Reason: computer-generated permuted block randomization list prepared by a statistician with no clinical involvement in the trial |
Definitely yes;
Reason: Information about the participant’s allocation was concealed in a sealed envelope |
Probably no
Reason: Single-blinded trial (only patients were blinded). “During the informed consent process, the researchers, attending anesthesia teams and the children’s families were blinded to treatment allocation. After the consent had been obtained, the investigator opened the envelope.” “The attending care team at the PACU was not informed about the patients’ treatment allocation, but information about the drugs administered during anesthesia (including lidocaine) was accessible in medical record.” |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: Study protocol available. All relevant outcomes were reported; |
Probably no;
Reason: Source of funding and competing interests are not mentioned |
Some concerns (all outcomes)
Reason: lack of blinding |
|
El-Deeb, 2013 |
Probably yes;
Reason: Patients were randomly assigned into two groups based on a computer-generated sequence |
Definitely yes;
Reason: sealed envelopes were used. Immediately before surgery, the envelope was opened by a pharmacist; who had no role in the data collection or analysis. |
Probably yes;
Reason: Patients, anesthetists, surgeons, and nurses were completely blinded about the patients’ allocation. (blinding of data collectors and analysts not reported) |
Probably yes;
Reason: No loss to follow-up reported and none assumed |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW (all outcomes) |
|
Kheirabadi, 2020 |
Probably yes;
Reason: sealed envelopes were drawn. No additional information |
Probably yes;
Reason: Sealed envelopes were used. |
Probably yes;
Reason: Patients and anesthetists were blinded. Others not mentioned. |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: Study protocol available. All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
LOW (all outcomes) |
|
Lee, 2019 |
Probably no;
Reason: A randomization table was used. No additional information |
No information
Reason: Not described |
Probably yes;
Reason: Patients and anesthetists were blinded. Others not mentioned. |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: Study protocol available. All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
Some concerns (all outcomes)
Reason: unclear randomization and blinding |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Hall EA, Sauer HE, Davis MS, Anghelescu DL. Lidocaine Infusions for Pain Management in Pediatrics. Paediatr Drugs. 2021 Jul;23(4):349-359. doi: 10.1007/s40272-021-00454-2. Epub 2021 May 26. PMID: 34036532; PMCID: PMC8609473. |
wrong publication type (narrative review) |
|
Heath C, Hii J, Thalayasingam P, von Ungern-Sternberg BS, Sommerfield D. Perioperative intravenous lidocaine use in children. Paediatr Anaesth. 2023 May;33(5):336-346. doi: 10.1111/pan.14608. Epub 2022 Dec 4. PMID: 36424875. |
wrong publication type |
|
Licina A, Silvers A, Laughlin H, Russell J, Wan C. Pathway for enhanced recovery after spinal surgery-a systematic review of evidence for use of individual components. BMC Anesthesiol. 2021 Mar 10;21(1):74. doi: 10.1186/s12871-021-01281-1. PMID: 33691620; PMCID: PMC7944908. |
not conform PICO (P,I,C) |
|
Sridhar P, Sistla SC, Ali SM, Karthikeyan VS, Badhe AS, Ananthanarayanan PH. Effect of intravenous lignocaine on perioperative stress response and post-surgical ileus in elective open abdominal surgeries: a double-blind randomized controlled trial. ANZ J Surg. 2015 Jun;85(6):425-9. doi: 10.1111/ans.12783. Epub 2014 Jul 31. PMID: 25078385. |
Wrong population |
|
Licina A, Silvers A. Perioperative Intravenous Lidocaine Infusion for Postoperative Analgesia in Patients Undergoing Surgery of the Spine: Systematic Review and Meta-Analysis. Pain Med. 2022 Jan 3;23(1):45-56. doi: 10.1093/pm/pnab210. PMID: 34196720. |
Wrong population |
|
Batko I, Kościelniak-Merak B, Tomasik PJ, Kobylarz K. Lidocaine Reduces Sevoflurane Consumption and Improves Recovery Profile in Children Undergoing Major Spine Surgery. Med Sci Monit. 2020 Mar 21;26:e919971. doi: 10.12659/MSM.919971. PMID: 32198342; PMCID: PMC7111102. |
wrong outcomes |
|
Kaszyński M, Stankiewicz B, Pałko KJ, Darowski M, Pągowska-Klimek I. Impact of lidocaine on hemodynamic and respiratory parameters during laparoscopic appendectomy in children. Sci Rep. 2022 Aug 18;12(1):14038. doi: 10.1038/s41598-022-18243-3. PMID: 35982198; PMCID: PMC9388633. |
wrong outcomes |
|
Dewinter G, Moens P, Fieuws S, Vanaudenaerde B, Van de Velde M, Rex S. Systemic lidocaine fails to improve postoperative morphine consumption, postoperative recovery and quality of life in patients undergoing posterior spinal arthrodesis. A double-blind, randomized, placebo-controlled trial. Br J Anaesth. 2017 Apr 1;118(4):576-585. doi: 10.1093/bja/aex038. PMID: 28403408. |
Wrong population |
|
Zouche I, Salem AB, Ketata S, Keskes M, Karoui A. Intravenous lidocaine versus dexamethasone to prevent postoperative vomiting in children tonsillectomy: a prospective randomized controlled trial. Pan Afr Med J. 2022 Jul 8;42:190. doi: 10.11604/pamj.2022.42.190.32171. PMID: 36212931; PMCID: PMC9508376. |
wrong comparator |
|
Fattah Kamel AA, Abdel Naby SM, Elmesallamy WARA & Salem DAE. Opioid sparing analgesia: Continuous intraoperative infusion of dexmedetomidine versus lidocaine for intracranial surgeries in children: A double-blind randomized clinical trial. Egyptian Journal of Anaesthesia. 2022; 38:1, 158-165, DOI: 10.1080/11101849.2022.2048580 |
wrong comparator |
|
Kościelniak-Merak B, Batko I, Kobylarz K, Sztefko K, Kocot-Kępska M, Tomasik PJ. Impact of Intravenous, Perioperative-Administrated Lidocaine on Postoperative Serum Levels of Endogenous Opioids in Children. Curr Pharm Des. 2019;25(30):3209-3215. doi: 10.2174/1381612825666190718153209. PMID: 31317834. |
wrong study design |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-12-2024
Beoordeeld op geldigheid : 17-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met postoperatieve pijn.
Werkgroep
Dr. L.M.E. (Lonneke) Staals, anesthesioloog, voorzitter, NVA
Dr. C.M.A. (Caroline) van den Bosch, anesthesioloog-pijnspecialist, NVA
Drs. A.W. (Alinde) Hindriks-Keegstra, anesthesioloog, NVA
Drs. G.A.J. (Geranne) Hopman, anesthesioloog, NVA
Drs. L.J.H. (Lea) van Wersch, anesthesioloog, NVA
Dr. C.M.G. (Claudia) Keyzer-Dekker, kinderchirurg, NVvH
Drs. F.L. (Femke) van Erp Taalman Kip, orthopedisch kinderchirurg, NOV
Dr. L.M.A. (Laurent) Favié, ziekenhuisapotheker, NVZA
J. (Jantine) Boerrigter-van Ginkel, verpleegkundig specialist kinderpijn, V&VN
S. (Sharine) van Rees-Florentina, recovery verpleegkundige, BRV
E.C. (Esen) Doganer en M. (Marjolein) Jager, beleidsmedewerker, Kind & Ziekenhuis
Klankbordgroep
Dr. L.M. (Léon) Putman, cardiothoracaal chirurg, NVT
R. (Remko) ter Riet, MSc, anesthesiemedewerker/physician assistant, NVAM
Drs. L.I.M. (Laura) Meltzer, KNO-arts, NVKNO
Met ondersteuning van
Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
L.M.E. Staals (voorzitter) |
Anesthesioloog Sectorhoofd Kinder- en Obstetrische anesthesiologie Universitair Docent Erasmus MC Sophia Kinderziekenhuis, Rotterdam |
Lid wetenschapcommissie Sectie Kinderanesthesiologie (NVA) (onbetaald) Lid scientific forum ESAIC/Devices abd Technology (onbetaald) Lid werkgroep Landelijke Kwaliteitsregistratie Amandeloperaties (NVKNO/NVA) (onbetaald) |
MSD/ Merck: i.v.m. een clinical trial naar sugammadex bij kinderen: Consultant of Global Clinical Trial Operations in the Netherlands. Betaald (inkomsten gaan op onderzoekskostenplaats van de afdeling Anesthesiologie Erasmus MC Sophia). Dit onderzoek gaat over sugammadex (antagonist voor spierverslapping). Klinisch onderzoek gedaan naar postoperatieve pijnstilling bij kinderen na buikchirurgie, d.m.v. wondcatheter met lokaal anestheticum (nog niet gepubliceerd, daarom niet meegenomen in search van de richtlijn). Er is geen belang bij het advies van de richtlijn. |
Geen restricties |
|
C.M.A. van den Bosch |
Anesthesioloog - pijnspecialist Prinses Maxima Centrum |
Geen |
Geen |
Geen restricties |
|
A.W. Hindriks-Keegstra |
Anesthesioloog UMC Utrecht
|
Geen |
VR ter behandeling van postoperatieve pijn en angst bij kinderen. |
Geen restricties. Extern gefinancierd onderzoek valt buiten bestek van de richtlijn |
|
G.A.J. Hopman |
Anesthesioloog, Radboud UMC, Nijmegen |
Geen |
Geen |
Geen restricties |
|
L.J.H. van Wersch |
Anesthesioloog, Maasziekenhuis Pantein |
Geen |
Geen |
Geen restricties |
|
C.M.G. Keyzer-Dekker |
Kinderchirurg, Erasmus MC Sophia. |
Geen |
Geen |
Geen restricties |
|
F.L. van Erp Taalman Kip |
Orthopedisch kinderchirurg, Erasmus Medisch Centrum Rotterdam |
-Docent Fontys Hogeschool Eindhoven, curriculum kinder- podotherapie -Docent TNO Leiden, onderwijs Jeugdartsen, - Trainer stichting Skills4Comfort |
Geen |
Geen restricties |
|
L.M.A. Favié |
Ziekenhuisapotheker Erasmus MC |
Geen |
Geen |
Geen restricties |
|
J.Boerrigter-van Ginkel |
Verpleegkundig Specialist Kinderpijn, Wilhelmina Ziekenhuis Utrecht. |
Geen |
Geen |
Geen restricties |
|
S. van Rees-Florentina |
Recovery verpleegkundige Flevoziekenhuis Almere |
Bestuurslid BRV BRN Nederland
|
Geen |
Geen restricties |
|
E.C. Doganer |
Stichting Kind&Ziekenhuis Junior Projectmanager/beleidsmedewerker |
Geen |
Geen |
Geen restricties |
|
M. Jager |
Stichting Kind&Ziekenhuis Junior Projectmanager/beleidsmedewerker |
Begeleider C bij Sherpa, betaald |
Geen |
Geen restricties |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
L.M. Putman |
Congenitaal cardio-thoracaal chirurg, Leids Universitair Medisch Centrum & Amsterdam UMC, voltijd functie |
Geen |
Geen |
Geen restricties |
|
R. ter Riet |
Anesthesiemedewerker/Physician Assistant Anesthesiologie/Pijngeneeskunde |
Voorzitter NVAM, Voorzitter commissie (acute) pijn NVAM/V&VN |
Geen |
Geen restricties |
|
L.I.M. Meltzer |
Beatrix ziekenhuis Gorinchem, Rivas zorggroep |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door zitting van een afgevaardigde van de patiëntenvereniging (Stichting Kind & Ziekenhuis) in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en Stichting Kind & Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Lidocaïne |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor kinderen met postoperatieve pijn. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Postoperatieve pijn (NVA, 2013) op noodzaak tot revisie. Het raamwerk van de richtlijn voor volwassenen is ook kritisch bekeken als uitgangspunt. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
De beoordelingen van de literatuur en de conclusies zijn gedaan op basis van de GRADE systematiek. De werkgroep vindt het belangrijk om relevante beperkingen hiervan aan te geven.
De klinische vragen in deze richtlijn gaan veelal over een reductie van postoperatieve pijn en opioïdenconsumptie bij een individuele patiënt. Onderzoeken beschrijven de verschillen op groepsniveau, over studies met verschillende patiëntpopulaties en operaties heen. Opioïdenconsumptie is sterk afhankelijk van tijdstip, ingreep en ernst van de pijn. Door het werken met een absolute drempelwaarde in mg (i.p.v. een relatieve drempelwaarde in %) bereiken resultaten gemeten op vroege postoperatieve tijdstippen en in studies met ingrepen met relatief lage opioïdenconsumptie vaak niet de MCID. Daarbij komt ook dat de doelgroep van de huidige richtlijn enorm varieert in lengte en gewicht (van prematuur tot adolescent). Lengte en gewicht heeft grote invloed op het analgetische effect van een specifieke dosering, waardoor alleen kijken naar milligrammen niet volstaat. Waar mogelijk is ook de relatieve reductie in procenten beschreven.
De keuze van de MCID (absoluut verschil in pijnscore of opioïdenconsumptie) heeft een bepaalde mate van willekeurigheid en is niet absoluut te zien. Ook zijn de conclusies zo geformuleerd (en geven alleen beperkt antwoord op het effect op een individuele patiënt voor een specifieke ingreep). In de literatuur worden de eindpunten pijnscores en opioïdenconsumptie separaat van elkaar weer gegeven, suggererend dat deze onafhankelijk van elkaar zijn. Echter kunnen deze twee eindpunten niet onafhankelijk van elkaar beoordeeld worden; in ieder protocol is opgenomen dat pijn behandeld moet worden. Deze separate beoordeling geeft niet altijd een adequaat antwoord op de klinische vraag naar het analgetische effect van een interventie.
Daarnaast worden multimodale componenten als aparte interventies beoordeeld, echter de klinische vraag is naar de effectiviteit als bouwsteen van een multimodale werkwijze.
Voor doseringsadviezen wordt er verwezen naar betrouwbare bronnen, zoals het farmacotherapeutisch kompas of het kinderformularium.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
|
Database(s): Embase, Medline (Ovid) |
Datum: 4-1-2023 en 8-1-2023 |
|
Periode: 2000-heden |
Talen: nvt |
Zoekopbrengst
|
|
EMBASE |
OVID/Medline |
Ontdubbeld |
|
SRs |
57 |
59 |
80 |
|
RCTs |
499 |
397 |
615 |
|
OBS |
844 |
278 |
415 |
|
Totaal |
1400 |
734 |
1110 |
Embase
|
No. |
Query |
Results |
|
#13 |
#5 AND #10 |
844 |
|
#12 |
#5 AND #7 |
499 |
|
#11 |
#5 AND #6 |
57 |
|
#10 |
#8 OR #9 |
15615912 |
|
#9 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13755893 |
|
#8 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR cohort*:ab,ti OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6953721 |
|
#7 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
2002967 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
891508 |
|
#5 |
#4 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1186 |
|
#4 |
#1 AND #2 AND #3 |
2485 |
|
#3 |
'adolescent'/exp OR 'baby'/exp OR 'boy'/exp OR 'child'/exp OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab |
5593184 |
|
#2 |
'lidocaine'/mj OR lidocaine:ti,ab,kw OR lignocaine:ti,ab,kw |
50708 |
|
#1 |
'surgery'/mj OR 'surgery' OR 'surgical patient'/mj OR 'surgical patient' OR 'surgical risk'/mj OR 'surgical risk' OR 'perioperative period'/exp OR 'perioperative period' OR surgic*:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR presurg*:ti,ab,kw OR preoperati*:ti,ab,kw OR 'pre-surg*':ti,ab,kw OR 'pre-operati*':ti,ab,kw OR perisurg*:ti,ab,kw OR perioperati*:ti,ab,kw OR 'peri-surg*':ti,ab,kw OR 'peri-operati*':ti,ab,kw OR postsurg*:ti,ab,kw OR postoperati*:ti,ab,kw OR 'post-surg*':ti,ab,kw OR 'post-operati*':ti,ab,kw OR laparoscop*:ti,ab,kw |
7006087 |
Ovid/Medline
|
# |
Searches |
Results |
|
12 |
6 and 9 |
278 |
|
11 |
6 and 8 |
397 |
|
10 |
6 and 7 |
59 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort*.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
4369214 |
|
8 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2537635 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
639972 |
|
6 |
limit 5 to yr="2000-Current" |
760 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
1239 |
|
4 |
1 and 2 and 3 |
1314 |
|
3 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2837771 |
|
2 |
exp Lidocaine/ or lidocaine.ti,ab,kf. or lignocaine.ti,ab,kf. |
35727 |
|
1 |
exp Surgical Procedures, Operative/ or exp Specialties, Surgical/ or su.fs. or exp Perioperative Period/ or surgic*.ti,ab,kf. or surger*.ti,ab,kf. or operation*.ti,ab,kf. or operative.ti,ab,kf. or presurg*.ti,ab,kf. or preoperati*.ti,ab,kf. or pre-surg*.ti,ab,kf. or pre-operati*.ti,ab,kf. or perisurg*.ti,ab,kf. or perioperati*.ti,ab,kf. or peri-surg*.ti,ab,kf. or peri-operati*.ti,ab,kf. or postsurg*.ti,ab,kf. or postoperati*.ti,ab,kf. or post-surg*.ti,ab,kf. or post-operati*.ti,ab,kf. or nonsurg*.ti,ab,kf. or nonoperatic*.ti,ab,kf. or non-surg*.ti,ab,kf. or non-operati*.ti,ab,kf. or laparoscop*.ti,ab,kf. |
5442390 |
