Continue wond infusie voor abdominale ingrepen
Uitgangsvraag
Wat is de meerwaarde van continue wond infusie (CWI) met lokale anesthetica bij patiënten die een abdominale chirurgische procedure ondergaan ten opzichte van andere regionale anesthesie technieken?
Aanbeveling
Overweeg continue wond infusie (CWI) als eerste keuze voor abdominale ingrepen in plaats van epidurale anesthesie.
Overweeg voorkeur te geven aan een pre-peritoneale / pre-fasciale plaatsing van een CWI door de operateur.
Overweeg voorkeur te geven aan een epiduraal voor patiënten met chronische pijn.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematische literatuur analyse uitgevoerd naar de effectiviteit van CWI met lokaal anesthetica vergeleken met EA bij patiënten met abdominale chirurgie. Postoperatieve pijn was de kritische uitkomstmaat en complicaties en het gebruik van opioïden waren belangrijke uitkomstmaten voor klinische besluitvorming.
Voor postoperatieve pijn is geconcludeerd dat er mogelijk geen verschil is tussen beide behandelingen op verschillende tijdstippen (12, 24 en 48 uur postoperatief) zowel in rust als in beweging of tijdens hoesten. Er lijkt een klein voordeel te zijn voor EA vergeleken met het gebruik van CWI, maar dat verschil achten wij als niet klinisch relevant. De bewijskracht is redelijk (GRADE) doordat de studies niet waren geblindeerd. Alle geïncludeerde studies betroffen abdominale chirurgie.
De uitkomstmaat, opioïden consumptie heeft een zeer lage GRADE, waardoor er geen duidelijke conclusie getrokken kan worden. Het is van belang om te realiseren dat de opzet van de studies, de opioïden consumptie beïnvloedt. Als in de EA-groep continu opioïden epiduraal worden toegediend, dan is de opioïden consumptie altijd hoger dan in de CWI-groep. Echter misschien hebben patiënten niet om deze opioïden hebben gevraagd, dit is mogelijk anders in de CWI-groep waar opioïden meestal via PCA op verzoek van de patiënt worden toegediend. In studies met EA zonder opioïden lijkt de opioïden consumptie in de CWI-groep hoger dan in de EA groep. In de meerderheid van de studies lijken er geen grote verschillen te zijn in opioïden consumptie, maar de resultaten zijn niet consistent. Verschillen in opioïden consumptie zijn waarschijnlijk niet klinisch relevant. Studies rapporteren deze uitkomstmaat op verschillende manieren, waardoor het lastig is om de resultaten te vergelijken.
Voor de belangrijk uitkomstmaat, hypotensie is de incidentie van hypotensie mogelijk lager in de CWI groep vergeleken met EA, echter dit bereikt net niet de grens van klinische relevantie (laag GRADE). De studies zijn over het algemeen erg klein, dus er zijn maar weinig complicaties gemeld per studie, bovendien is hierover zeer heterogeen gerapporteerd.
Voor de laatste belangrijk uitkomstmaat, pruritus is er erg veel onzekerheid (zeer laag GRADE) en kunnen er geen conclusies worden getrokken. De studies zijn over het algemeen erg klein, dus er zijn maar weinig complicaties gemeld per studie, bovendien is hierover zeer heterogeen gerapporteerd.
Er zijn in de verschillende studies geen grote verschillen gevonden in bijwerkingen van de twee interventies. De belangrijkste bijwerking van epiduraal lijkt hypotensie en jeuk te zijn. Bij het gebruik van CWI worden niet meer bijwerkingen gezien en springen er ook geen belangrijke bijwerkingen uit. Er wordt geen toename in wondinfecties gezien bij CWI. Door beperkingen in de studieopzet kunnen er vanuit de literatuur geen eenduidige conclusies worden gemaakt over bijwerkingen en complicaties.
Desalniettemin reflecteert de literatuur wat de fysiologie leert. EA is geassocieerd met sympathicolyse en dus hypotensie. Dit geldt niet voor CWI. Pruritus komt ook vaker voor bij EA als EA met LA en opioïden wordt uitgevoerd. Neuraxiale opioïden hebben als bijwerking pruritus wat voor patiënten zeer vervelend kan zijn (en noodzaakt tot verwijderen van opioïden uit de EA). Dan kunnen alsnog LA worden toegediend via EA (Boekel, 2016). Zowel de met EA geassocieerde hypotensie als ook pruritus spreken bij afwezigheid van een klinisch relevant verschil in pijn voor het gebruik van CWI.
Bij EA is hypotensie mogelijk een beperkende factor in het mobiliseren. Snel en veilig mobiliseren is van belang gezien dit een gunstig effect heeft op herstel en vermindering van andere complicaties. Het gebruik van een CWI heeft mogelijk een toegevoegde waarde in de postoperatieve pijnbehandeling zonder de nadelige effecten van hypotensie. Het versneld mobiliseren wordt ook teruggevonden in de review van Mungroop 2018.
In deze analyse is niet gekeken naar andere bijwerkingen zoals urineretentie of postdurale hoofdpijn, maar ook niet naar mogelijke gunstige effecten op incidentie van pneumonie en duur ziekenhuisopname. Vergelijkende data voor CWI en EA qua complicaties en mortaliteit kunnen op dit moment als kennislacune gezien worden.
In kleine studies worden zeldzame ernstige complicaties niet gevonden, echter voor de bekende potentieel serieuze neurologische complicaties voor centrale neuraxiale regionale anesthesie worden wel meegenomen in de overwegingen door de werkgroep.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
CWI en EA worden beide gebruikt om patiënten na de operatie comfortabel te maken wat betreft pijn zonder onnodige bijwerkingen. EA is een techniek die voor de operatie bij de wakkere patiënt geplaatst wordt ten opzichte van CWI die tijdens de operatie door de operateur bij de patiënt onder narcose geplaatst wordt. Zowel EA als ook CWI leiden tot een adequate pijnbehandeling. CWI is hierbij mogelijk geassocieerd met minder bijwerkingen, en kan zeldzame serieuze neurologische bijwerkingen van EA (dwarslaesies) doen vermijden.
Uit de literatuuranalyse blijkt dat er geen verschil is in pijnbeleving bij het gebruik van lokaal anesthesie door middel van een CWI vergeleken met de standaardbehandeling. Echter zijn er mogelijk wel de voordelen van versnelde mobilisatie (dit is niet in de literatuuranalyse voor de module onderzocht). (Mungroop, 2019).
Er is niet onderzocht of het gebruik van een CWI met lokaal anesthesie meer handelingen voor de verzorgers geeft danwel meer ongemak voor de patiënt, vergeleken met de standaardbehandeling. Een CWI moet op een zeker moment verwijderd worden, wat mogelijk met ongemak gepaard gaat, echter geldt dit ook voor een epiduraal.
Kosten (middelenbeslag)
EA is een tijdsintensievere procedure voor de anesthesioloog dan het plaatsen van CWI. Echter, de operateur moet ook een CWI plaatsen. Het gebruik van een CWI zal nieuwe scholing met zich meebrengen, ook zal de operateur getraind moeten worden in het adequaat plaatsen van de CWI. Deze training zal extra kosten met zich meebrengen. De materialen zullen geen grote kostenpost met zich meebrengen omdat het hier om een standaard medische CWI gaat met de standaard infusiepompen die reeds gebruikt worden.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is nog geen procesevaluatie gedaan die de implementatie van CWI beschrijft dan wel onderzoekt. Bij implementatie van CWI voor pijnbehandeling zal er aandacht moeten zijn voor scholing van de verschillende disciplines zoals verpleging, operateur en anesthesie. Mogelijk zullen operateurs nadelen zoals de verhoogde kans op wondinfectie benoemen ondanks dat deze nadelen niet uit de literatuur blijken. Men zou CWI als een extra handeling kunnen zien, echter is het plaatsen van een epiduraal dit ook. Om de implementatie van CWI door te voeren zal dit door een brede groep in het ziekenhuis gedragen moeten worden en zal men met name de voordelen van eventueel sneller mobiliseren in moeten zien.
In de afgelopen jaren is er een duidelijk teruggang van het gebruik van EA perioperatief te zien. Binnen de anesthesiologie heerst bij sommigen nog het gevoel dat EA de beste manier van pijnbehandeling is en daarnaast ook positieve effecten op morbiditeit en mortaliteit heeft wat door literatuur niet bevestigd wordt. Bovendien maakt men zich binnen de anesthesiologie zorgen dat de blootstelling en dus opleiding rondom EA door de forse afname van EA in het geding komt. Niet alle anesthesiologen zullen deze aanbevelingen omarmen.
Bij chronische pijnpatiënten is pijn meestal moeilijk te bestrijden en naar verwachting worden hier grotere hoeveelheden opioïden gebruikt.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
CWI leidt tot vergelijkbare postoperatieve pijn en opioïdengebruik dan EA bij abdominale chirurgie. De literatuur is onduidelijk over het effect op bijwerkingen, maar vanuit de fysiologie en de klinische ervaringen zou kunnen worden gezegd dat CWI is geassocieerd met minder bijwerkingen (hypotensie, pruritus) en vooral zonder het risico op serieuze neurologische complicaties zoals epiduraal hematoom/abces. CWI is mogelijk niet geassocieerd met een toename van wondinfecties.
CWI kost minder tijd en bespaart de patiënt de plaatsing van EA preoperatief. De werkgroep commissie geeft de voorkeur aan om het gebruik van CWI aan boven het gebruik van EA. Deze aanbeveling wordt gegeven op basis van de bekende potentieel serieuze neurologische complicaties voor centrale neuraxiale regionale anesthesie.
Wondkatheters voor CWI kunnen of in de wond (subcutaan) zelf of preperitoneaal/pre-fasciaal (voor abdominale ingrepen of paravertebraal (voor thoracale ingrepen) geplaatst worden. Alhoewel de werkgroep niet specifiek naar de verschillen gezocht heeft is naar algemene analyse de werkgroep van mening dat voor subcutane plaatsing van wondkatheters beperkte evidentie voor efficiëntie beschikbaar is, terwijl de literatuur voor preperitoneale/pre-fasciale of paravertebrale plaatsing toch een duidelijk pijnverminderd en opioïdsparend effect laat zien en zelf non-inferieur t.o.v een epidurale plaatsing laat zien. De werkgroep is daarom van mening dat wondkatheters bij voorkeur preperitoneaal/pre-fasciaal of paravertebraal geplaatst zouden moeten worden.
Bij chronische pijnpatiënten is pijn meestal moeilijk te bestrijden en naar verwachting worden hier grotere hoeveelheden opioïden gebruikt. Het gebruik van een epiduraal heeft bij deze groep patiënten dan soms toch de voorkeur.
Onderbouwing
Achtergrond
In het kader van multimodale pijnbehandeling kan continue toediening van lokale anesthetica (LA) een belangrijk onderdeel zijn. De korte werkduur van LA (4 tot 12 uur) maakt een continue toediening noodzakelijk. Hiervoor kan een katheter op verschillende plekken in het lichaam geplaatst worden. Er moet een onderscheiding gemaakt worden tussen wondkatheters die subcutaan ter plekke van de wond geplaatst worden en katheter die in toenemende mate door chirurgen intra-operatief in diverse lichaamsholtes geplaatst worden. Bijvoorbeeld een peri-/subpleurale wondkatheter voor thoracale chirurgie/oesofaguschirurgie of een preperitoneale wondkatheter voor hepato-pancreato- biliaire (HPB) chirurgie.
Binnen de multimodale pijnbehandeling wordt er steeds meer gebruik van continue LA, toegediend via continue wond infusie (CWI), met als doel opioïden consumptie perioperatief te beperken en de effectiviteit van de pijnbehandeling te verbeteren. Deze wondkatheter worden subcutaan of in diverse lichaamsholtes geplaatst, deels ter vervanging van neuraxiale toedieningsvormen (epidurale/spinale toediening van LA via katheter), of perifere zenuwblokkades/fascial plane blocks).
In de kliniek wordt CWI vooral na abdominale chirurgie gebruikt. Dit blijkt effectief en veilig ten opzichte van placebo. Behandeling met CWI lijkt effectief in pijnverlichting, het reduceren van opioïdconsumptie, patiënttevredenheid, herstel van de darmfunctie en postoperatieve misselijkheid en braken vergeleken met placebo in laparotomie. Het effect op postoperatieve pijn lijkt minder duidelijk bij laparoscopische chirurgie (Huang 2021) In de praktijk is de vraag hoe CWI het doet ten opzichte van locoregionale interventies, met name de epidurale anesthesie (EA). Belangrijk is te benoemen dat wondpijn na abdominale chirurgie met name de eerste 24-48 uur het hevigst is en daarna van nature al afneemt.
Omdat er een overlap is met betrekking tot CWI bij borstwand blokken heeft de werkgroep besloten in deze module alleen een uitspraak te doen over de effectiviteit bij abdominale ingrepen.
Conclusies / Summary of Findings
Conclusions
Postoperative pain
|
Moderate GRADE |
The use of continuous wound infusions (CWI) probably results in little to no difference in postoperative pain at 12, 24, and 48 hours at rest and in mobility/coughing when compared with those receiving epidural analgesia (EA) in abdominal surgery.
Sources: Mungroop 2019; Ball, 2016; ElShamaa, 2016; Kilic, 2014; O’Neill, 2012; Renghi, 2013; Ranta, 2006; Bell, 2019; Klotz, 2020; Othman, 2019; Elsharkawy, 2020; Gathege, 2021; Ammianickal, 2018; Narayan, 2021 Thangavel, 2019; Mouawad, 2018; Araújo, 2017; Capdevila, 2017; Renghi 2013; Ranta 2006 |
Opioid consumption
|
Very low GRADE |
The evidence is very uncertain about the effect of the use of CWI on the opioids consumption (total and 24 hrs) when compared with those receiving epidural analgesia (EA) in abdominal surgery.
Sources: Kilic, 2014; Ranta, 2006; Bell, 2019; Othman, 2019; Elsharkawy, 2020; Ammianickal, 2018; Narayan, 2021; Thangavel, 2019; Capdevila, 2017; Bertoglio, 2012; Niraj, 2011; Revie, 2012; Wong, 2014; Ranta, 2006; Mungroop 2016 |
Adverse events
|
The use of CWI may result in little to no difference in hypotension when compared with those receiving epidural analgesia (EA) in abdominal surgery.
Sources: Mungroop 2019; Narayan 2021; Othman 2019; Capdevila 2017; ELShamaa 2016; Bell 2019; Klotz, 2020; Ranta 2006 |
|
Very low GRADE |
The evidence is very uncertain about the effect of the use of CWI on pruritis when compared with those receiving epidural analgesia (EA) in abdominal surgery.
Sources: Narayan 2021; ELShamaa 2016; Araújo 2017; O’Neill 2012; Almeida 2011 |
Samenvatting literatuur
Description of studies: comparison with EA
In total 30 RCTs were found that fulfilled the inclusion criteria, of which 13 studies originated from the systematic literature review of Mungroop (2019). Mungroop focused on abdominal surgeries and the search strategy was until April 2017.
As shown in table 1, different placements of wound catheters were used, in various surgeries was studied and different pain scales were used. The number of participants per arm ranged from 14-53, most were single-center studies. Some of the studies were designed as a non-inferiority trial.
Table 1. Characteristics of included studies.
|
Author, year |
Population (I/C) |
Surgical procedure type |
Intervention |
Control |
|
Almeida, 20111 |
19/19 |
Open surgery (abdominal) |
CWI subcutaneous |
EA |
|
Ammianickal, 2018 |
51/51 |
Abdominal hysterectomy pfannenstiel |
CWI preperitoneal |
EA |
|
Araújo, 2017 |
37/33 |
Open surgery (abdominal) |
CWI preperitoneal |
EA |
|
Ball, 2016 |
27/26 |
Open surgery (abdominal) |
CWI preperitoneal |
EA |
|
Bell, 2019 |
42/41 |
Open surgery (abdominal) |
CWI rectus abdominus and rectus transversus + PCA |
Thoracic EA |
|
Bertoglio, 20121 |
53/53 |
Open surgery ERAS (Abdominal) |
CWI preperitoneal |
EA |
|
Boulind, 20121 |
17/14 |
Laparoscopy, ERAS (abdominal) |
CWI preperitoneal |
EA |
|
Capdevila, 2017 |
20/20 |
Open surgery (abdominal) |
CWI in the rectus and subcutaneous |
EA and PCA morphine |
|
ElShamaa, 2016 |
30/30 |
Pfannenstiel
|
CWI preperitoneal |
EA |
|
Elsharkawy, 2020 |
50/50 |
Open surgery (abdominal) |
CWI preperitoneal |
EA |
|
Ganapathy, 20151 |
26/24 |
Open surgery (abdominal) |
CWI preperitoneal |
EA |
|
Gathege, 2021 |
19/19 |
Open surgery Abdominal |
CWI subfascial |
EA |
|
Hughes, 20151 |
44/49 |
Open surgery, ERAS (abdominal) |
CWI preperitoneal |
EA |
|
Jouve, 20131 |
26/24 |
Open surgery, ERAS (abdominal) |
CWI preperitoneal |
EA |
|
Klotz, 2020 |
36/35 |
Open surgery (abdominal) |
CWI subfascial |
EA |
|
Kilic, 2014 |
25/25 |
Pfannenstiel |
CWI subfascial levobupivacaine |
EA |
|
Mouawad, 2018 |
46/44 |
Open and endoscopic surgery (abdominal) |
CWI preperitoneal |
EA |
|
Mungroop, 20161 |
55/47 |
Open surgery, ERAS (abdominal) |
CWI preperitoneal |
EA |
|
Narayan, 2021 |
21/21 |
Open surgery (abdominal) |
CWI preperitoneal |
EA |
|
Niraj, 20111 |
27/31 |
Open surgery (abdominal) |
CWI preperitoneal |
EA |
|
Niraj, 20141 |
30/31 |
Laparoscopy, ERAS (abdominal) |
CWI preperitoneal |
EA |
|
O’Neill, 2012 |
35/32 |
Pfannenstiel |
CWI subfascial |
EA |
|
Othman, 2019 |
22/20 |
Open surgery (abdominal) |
CWI preperitoneal |
EA |
|
Ranta,2006 |
20/20 |
Pfannenstiel |
CWI subfascial levobupivacaine |
EA |
|
Rao Kadam, 20131 |
22/19 |
Open surgery (abdominal) |
CWI preperitoneal |
EA |
|
Renghi,2013 |
30/29 |
Open surgery (abdominal) |
CWI subfascial and subcutaneous |
EA |
|
Revie, 20121 |
33/31 |
Open surgery ERAS (abdominal) |
CWI preperitoneal |
EA |
|
Thangavel, 2019 |
20/20 |
Open surgery (abdominal) |
CWI subcutaneous |
EA |
|
Wahba, 20141 |
22/22 |
Open surgery (upper abdominal) |
CWI preperitoneal |
EA |
|
Zheng, 20161 |
25/25 |
Open surgery (gastrectomy) |
CWI preperitoneal |
EA and PCA |
1 Included in the review of Mungroop, 2019
CWI=Continuous Wound Infusion; EA=Epidural analgesia/anaesthesia; ERAS protocol = Enhanced Recovery After Surgery protocol; PCA=patient-controlled analgesia; PCEA=patient-controlled epidural analgesia; NRS=Numeric Rating Scale; VAS=Visual Analogue Scale; VRS=Verbal Rating Scale
Results
1. Postoperative pain
1.1 Postoperative pain at 12 hours
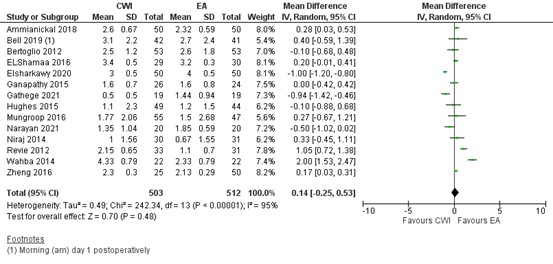
Fourteen studies reported on pain at rest 12 hours postoperatively. In most studies the pain score was below 3 (out of 10) in both groups. As shown in figure 1, a mean difference (MD) of 0.14 (95% Confidence Interval (CI) 0.04 to 0.66) was found in favour of EA. This difference is not clinically relevant.
Median pain scores at 12 hours in rest postoperatively were reported by ElSharkawy (2020) and Gathege (2021). Means and standard deviations were estimated from the medians and interquartile ranges using the method by Hozo (2005).
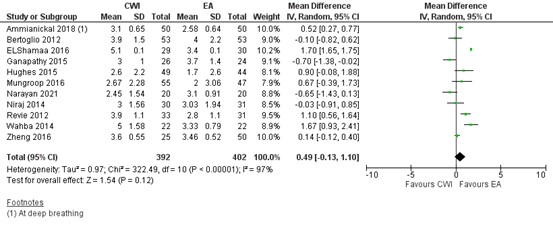
Eleven studies reported on pain during mobility/cough 12 hours postoperatively. In most studies the pain score was below 4 (out of 10) in both groups. As shown in figure 2, a MD of 0.49 (95% CI -0.13 to 1.10) was found in favour of EA. This difference is not clinically relevant.
Figure 1. Postoperative pain at rest at 12 hours: CWI versus EA.
Pain in the first 12 hours postoperatively at rest assessed by VAS or NRS scale; random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia
Figure 2. Postoperative pain during mobility/cough at 12 hours: CWI versus EA.
Pain in the first 12 hours during mobility/cough postoperatively assessed by VAS or NRS scale; random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia
1.2 Postoperative pain at 24 hours
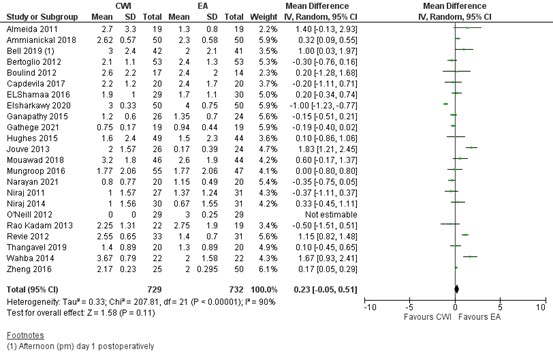
Twenty three studies reported on pain at rest 24 hours postoperatively. In most studies the pain score was below 3 (out of 10) in both groups. As shown in figure 3, a MD of 0.23 (95% CI -0.05 to 0.51) was found in favour of EA. This difference is not clinically relevant.
Median pain scores at 24 hours at rest postoperatively were reported by ElSharkawy (2020), O’Neill (2012) and Gathege (2021). Means and standard deviations were estimated from the medians and interquartile ranges using the method by Hozo (2005).
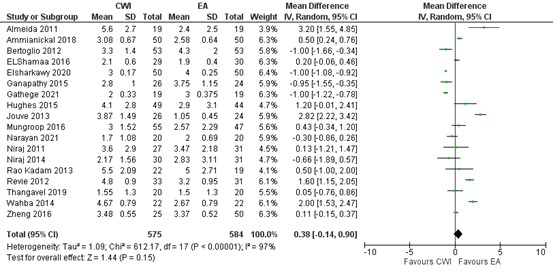
Eighteen studies reported on pain during mobility/cough 24 hours postoperatively. In most studies the pain score was below 4 (out of 10) in both groups. As shown in the meta-analyses in figure 4, a MD of 0.38 (95% CI 0.14 to 0.90) was found in favour of EA. This difference is not clinically relevant.
Median pain scores at 24 hours during mobility/cough postoperatively were reported by ElSharkawy (2020). Means and standard deviations were estimated from the medians and interquartile ranges using the method by Hozo (2005).
Figure 3. Postoperative pain at rest at 24 hours: CWI versus EA.
Pain in the first 24 hours postoperatively at rest assessed by VAS or NRS scale; random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia
Figure 4. Postoperative pain during mobility/cough at 24 hours: CWI versus EA.
Pain in the first 24 hours postoperatively during mobility/cough assessed by VAS or NRS scale; random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia
1.3 Postoperative pain at 48 hours
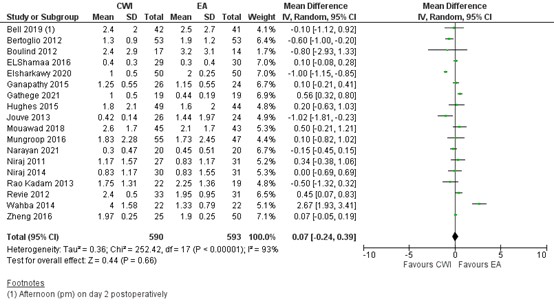
Eighteen studies reported on pain at rest 48 hours postoperatively. In most studies the pain score was below 2 (out of 10) in both groups. As shown in figure 5, a MD of 0.07 (95% CI -0.24 to 0.39) was found in favour of EA. This difference is not clinically relevant.
Median pain scores at 48 hours at rest were reported by ElSharkawy (2020) and Gathege (2021). Means and standard deviations were estimated from the medians and interquartile ranges using the method by Hozo (2005).
Fifteen studies reported on pain during mobility/cough 48 hours postoperatively. In most studies the pain score was below 3 (out of 10) in both groups. As shown in the meta-analyses in figure 6, a MD of 0.04 (95% CI -0.44 to 0.52) was found in favour of EA. This difference is not clinically relevant.
Median pain scores at 48 hours during mobility/cough postoperatively were reported by Gathege (2021). Means and standard deviations were estimated from the medians and interquartile ranges using the method by Hozo (2005).
Figure 5. Postoperative pain at rest at 48 hours: CWI versus EA
Pain in the first 48 hours postoperatively at rest assessed by VAS or NRS scale; random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia
Figure 6. Postoperative pain during mobility/cough at 48 hours: CWI versus EA
Pain in the first 48 hours during mobility/cough postoperatively assessed by VAS or NRS scale; random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia
2. Opioid consumption
The consumption of opioids is reported in a very heterogeneous manner in the included studies.
2.1 Opioid consumption at 24 hours
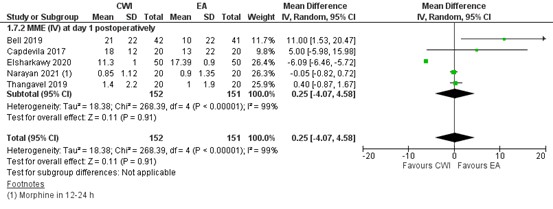
Morphine milligram equivalents (MME) at day one (24 hrs) postoperatively was reported in five studies. These are shown in figure 7.
The MD for MME (i.v.) at day 1 postoperatively was 0.25 (95% CI - 4.07 to 4.25). This is not a clinically relevant difference.
Figure 7. Opioid consumption (in MME) 24 hours postoperatively: EA versus CWI.
random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia; MME=morphine milligram equivalents
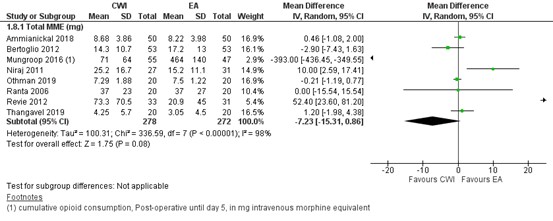
2.2 Total opioid consumption
Total morphine milligram equivalents (MME) were most commonly reported (in eight studies). These are shown in figure 8. The MD for total MME consumption was -7.23 (95% CI -15.31 to 0.86) in favour of CWI.
Figure 8. Total opioid consumption (in MME) postoperatively: EA versus CWI.
random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia; MME=morphine milligram equivalents
Two additional studies presented this outcome in different ways that could not be pooled. A description of the results per study is given below.
Wong (2014) presented cumulative opioid consumption, mg, median (range). The wound catheter group (n=429) consumed less cumulative opioids 24 hours postoperatively than the EA group (n=69). Opioid consumption was 91.2 (5.0–1546.4) in the EA group and 43.0 (0.0–1225.0) in the CWI group.
Kilic (2014) presented the cumulative morphine consumption in a figure. Overall morphine consumption was less in the wound catheter group (n=24) than in the EA group (n=23). This difference was clinically relevant starting 4 h postoperatively (16.8 ± 7.2 mg vs. 28.7 ± 10.3 mg respectively, MD -11.9 (95% CI -17.1 to -6.7). Absolute numbers could not be derived from the figure at the time point of 24 hours postoperatively.
It is important to realize that in most studies (and clinical practice) EA are run with opioids, this means patients receive opioids not on demand in contrast to the CWI group. Patients in the EA group received opioids although they may not have asked for them, thus it is difficult to judge opioid consumption or rescue opioids for this comparison.
3. Adverse events
Adverse events are reported in a very heterogeneous manner in the included studies. Many studies are small and report little to no adverse events per category.
Hypotension
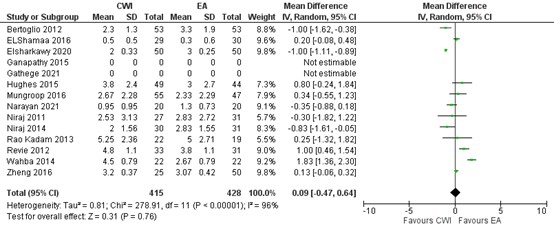
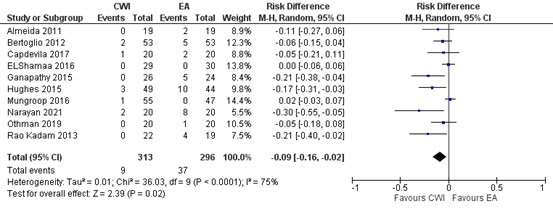
In figure 9, a forest plot is presented on hypotension in 10 studies. Total events of hypotension in the wound catheter group is 9/313 (2.9%) and 37/296 (12.5%) EA group. The risk difference (RD) is -0.09 (95% CI -0.16 to -0.02) in favour of wound catheter. This difference is not clinically relevant.
Figure 9. Hypotension: CWI versus EA.
random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia; MME=morphine milligram equivalents
Pruritus
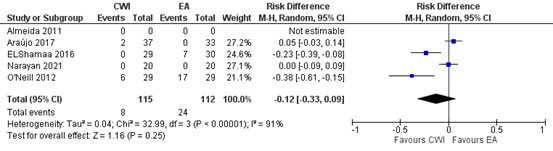
In figure 10, a forest plot is presented on pruritus in 5 studies. Total events of pruritus in the wound catheter group is 8/115 (7%) and 24/112 (21%) in the EA group. The risk difference (RD) is -0.12 (95% CI -0.33 to -0.09) in favour of wound catheter.
Figure 10. Pruritus: CWI versus EA.
random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect. CWI=Continuous Wound Infusion; EA=epidural analgesia/anesthesia; MME=morphine milligram equivalents
Several other studies report a range of complications. Overall, the complications rate in both groups is low. Definitions differ and general complication rates cannot be used to systematically present all adverse outcomes in this summary.
In the review of Mungroop (2016) five studies (n=421) reported on the frequency of pain
treatment related complications (wound infection, dehiscence, etc., definitions differed between studies) in preperitoneal wound catheters compared with active control. No clinical difference was demonstrated between preperitoneal wound catheters and active
control (i.e., EA or PCA) (16/218 (7.3%) vs. 24/203 (11.8%)); (RR 0.65, 95% CI: 0.29 to 1.49). (Hughes 2015; Mungroop 2016; Bertoglio 2012; Jouve 2013; Cheong 2001).
Level of evidence of the literature
The level of evidence regarding the outcome measure postoperative pain at rest 12, 24 and 48 hours started as high, because the studies were RCTs. The level of evidence regarding the outcome measure postoperative pain at rest 12, 24 and 48 hours postoperatively was downgraded by one level because of study limitations (risk of bias, -1). The level of evidence for the outcome postoperative pain at rest 12, 24 and 48 hours is moderate (GRADE).
The level of evidence regarding the outcome measure postoperative pain at mobility or after coughing started as high, because the studies were RCTs. The level of evidence regarding the outcome measure postoperative pain at mobility or after coughing 12, 24 and 48 hours postoperatively was downgraded by one level because of study limitations (risk of bias, -1). The level of evidence for the outcome postoperative pain at mobility or after coughing 12, 24 and 48 hours is moderate.
The level of evidence regarding the outcome measure opioid consumption started as high, because the studies were RCTs. The level of evidence regarding the outcome measure rescue medication (opioid use) was downgraded by 3 levels because of study limitations (risk of bias; -1) and conflicting results (inconsistency -1) and other bias (-1). The level of evidence is very low (GRADE).
The level of evidence regarding the outcome measure hypotension started as high, because the studies were RCTs. The level of evidence regarding the outcome measure hypotension was downgraded by 2 levels because of study limitations (risk of bias; -1) and imprecision (very low number of events and crossing of borders of clinical relevancy; -1). The level of evidence is low (GRADE).
The level of evidence regarding the outcome measure pruritis started as high, because the studies were RCTs. The level of evidence regarding the outcome measure pruritus was downgraded by 3 levels because of study limitations (risk of bias; -1) and imprecision (very low number of events and patients and crossing of borders of clinical relevancy; -2). The level of evidence is very low (GRADE).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the (in)effectiveness and safety of continuous wound infusion (CWI) in abdominal surgical patients compared to epidural analgesia/anesthesia (EA)?
P: patients Patient with abdominal surgical procedures
I: intervention Continuous Wound Infusion (CWI)
C: control Epidural analgesia/anesthesia
O: outcome measure 1. Postoperative pain 12, 24 and 48 hours
2. Opioid consumption 24 hours and total
3. Adverse events: wound healing, infections, pruritus, hemodynamic complications, neurological complications
Relevant outcome measures
The guideline development group considered postoperative pain as a critical outcome measure for decision making; and adverse outcomes and rescue analgesic consumption as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
Postoperative pain at rest and during mobilization/cough: Validated pain scale (VAS or NRS) at 12, 24 and 48 hours in rest or at mobilization.
A priori, the working group did not define the other outcome measures listed above but used the definitions used in the studies.
The working group defined one point as a minimal clinically (patient) important difference on a 10-point pain scale and 10 mm on a 100 mm pain scale. Regarding postoperative opioid consumption, a difference of 10 mg was considered clinically relevant. For dichotomous variables, a difference of 10% was considered clinically relevant (RR ≤0.91 or ≥1.10; RD 0.10).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms on wound catheters and local anesthesia for RCTs and systematic reviews until 12-6-2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1258 hits.
Studies were selected based on the following criteria:
Inclusion criteria:
- Systematic review or RCT
- Published ≥ 2000
- Patients ≥18 years
- Major abdominal surgery regardless of approach
- Scopic and open procedures
- Conform PICO
Exclusion criteria:
- Other surgery (e.g. orthopedic and plastic surgery)
- Single injection
- Compared with placebo
- Comparison with intrathecal morphine with intravenous fentanyl or spinal anesthesia
- No original research
- N≤10 per arm
A total of 81 studies were initially selected based on title and abstract screening. After reading the full text, 62 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 18 studies (of which one systematic review (Mungroop (2019) with 13 relevant studies) were included.
Results
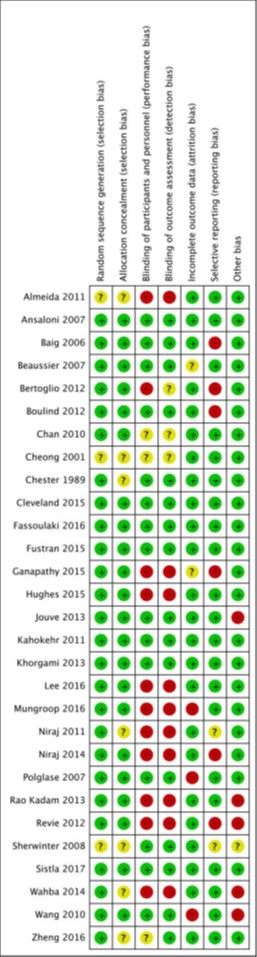
A total of 30 studies (of which 13 studies originated from one systematic review Mungroop (2019)) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Although ten studies were initially included that compared CWI with standard analgesic policy without the use of epidural anesthesia (EA). The PICO and summary of the literature focuses now solely on the comparison of CWI and EA. This is because after consultation in the committee and review of the literature it was concluded that EA is already the golden standard for analgesia and no added value for a comparison between standard analgesic policy and CWI.
Referenties
- Ammianickal, P. L., Thangaswamy, C. R., Balachander, H., Subbaiah, M., & Kumar, N. P. (2018). Comparing epidural and wound infiltration analgesia for total abdominal hysterectomy: A �andomized controlled study. Indian journal of anaesthesia, 62(10), 759.
- Araújo, R., Marques, C., Fernandes, D., Almeida, E., Alves, J., Rodrigues, M., & Neves, I. (2017). Pain management, local infection, satisfaction, adverse effects and residual pain after major open abdominal surgery: epidural versus continuous wound infusion (PAMA trial). Acta medica portuguesa, 30(10), 683-690.
- Ball, L., Pellerano, G., Corsi, L., Giudici, N., Pellegrino, A., Cannata, D.,& Gratarola, A. (2016). Continuous epidural versus wound infusion plus single morphine bolus as postoperative analgesia in open abdominal aortic aneurysm repair: a randomized non-inferiority trial. Minerva anestesiologica, 82(12), 1296-1305.
- Bell, R., Ward, D., Jeffery, J., Toogood, G. J., Lodge, J. A., Rao, K., & Hidalgo, E. (2019). A randomized controlled trial comparing epidural analgesia versus continuous local anesthetic infiltration via abdominal wound catheter in open liver resection. Annals of surgery, 269(3), 413-419.
- van Boekel RL, Vissers KC, van de Vossenberg G, de Baat-Ananta M, van der Sande R, Scheffer GJ, et al. Comparison of Epidural or Regional Analgesia and Patient-controlled Analgesia: A Critical Analysis of Patient Data by the Acute Pain Service in a University Hospital. Clin J Pain. 2016;32(8):681-8.
- Capdevila, X., Moulard, S., Plasse, C., Peshaud, J. L., Molinari, N., Dadure, C., & Bringuier, S. (2017). Effectiveness of epidural analgesia, continuous surgical site analgesia, and patient-controlled analgesic morphine for postoperative pain management and hyperalgesia, rehabilitation, and health-related quality of life after open nephrectomy: a prospective, randomized, controlled study. Anesthesia & Analgesia, 124(1), 336-345.
- ELShamaa, H. A., & Ibrahim, M. (2016). Bupivacaine constant continuous surgical wound infusion versus continuous epidural infusion for post cesarean section pain, randomized placebo-controlled study. Egyptian Journal of Anaesthesia, 32(4), 541-547.
- ElSharkawy, R. A., Farahat, T. E., & Abdelwahab, K. (2020). Continuous preperitoneal infusion of ropivacaine for postoperative analgesia in patients undergoing major abdominal or pelvic surgeries. A prospective controlled randomized study. Journal of Anaesthesiology, Clinical Pharmacology, 36(2), 195.
- Gathege, D., Abdulkarim, A., Odaba, D., & Mugambi, S. (2021). Effectiveness of Pain Control of Local Anaesthetic Wound Infusion Following Elective Midline Laparotomy: A Randomized Trial. World Journal of Surgery, 45(7), 2100-2107.
- Hozo SP, Djulbegovic B, Hozo I. Estimating the mean and variance from the median, range, and the size of a sample. BMC Med Res Methodol. 2005 Apr 20;5:13. doi: 10.1186/1471-2288-5-13. PMID: 15840177; PMCID: PMC1097734.
- Kilic, M., Ozkan Seyhan, T., Orhan Sungur, M., Ekiz, N., Bastu, E., & Senturk, M. (2014). The effects of subfascial wound versus epidural levobupivacaine infusion on postoperative pain following hysterectomy. Minerva anestesiol, 80(7), 769-778.
- Klotz, R., Seide, S. E., Knebel, P., Probst, P., Bruckner, T., Motsch, J., & Mihaljevic, A. L. (2020). Continuous wound infiltration versus epidural analgesia for midline abdominal incisionsa randomized-controlled pilot trial (Painless-Pilot trial; DRKS Number: DRKS00008023). PloS one, 15(3), e0229898.
- Mouawad, N. J., Leichtle, S. W., Kaoutzanis, C., Welch, K., Winter, S., Lampman, R., & Cleary, R. K. (2018). Pain control with continuous infusion preperitoneal wound catheters versus continuous epidural analgesia in colon and rectal surgery: a randomized controlled trial. The American Journal of Surgery, 215(4), 570-576.
- Mungroop, T. H., Bond, M. J., Lirk, P., Busch, O. R., Hollmann, M. W., Veelo, D. P., & Besselink, M. G. (2019). Preperitoneal or subcutaneous wound catheters as alternative for epidural analgesia in abdominal surgery: a systematic review and meta-analysis. Annals of surgery, 269(2), 252-260.
- Narayan, V., Sethi, S., Kajal, K., & Singh, S. (2021). Continuous wound infusion as an alternative to continuous epidural infusion for postoperative analgesia in renal transplant surgery: A prospective randomized controlled trial. Indian Journal of Transplantation, 15(1), 45.
- O'Neill, P., Duarte, F., Ribeiro, I., Centeno, M. J., & Moreira, J. (2012). Ropivacaine continuous wound infusion versus epidural morphine for postoperative analgesia after cesarean delivery: a randomized controlled trial. Anesthesia & Analgesia, 114(1), 179-185.
- Othman, A. H., Ahmed, D. G., Abd El-Rahman, A. M., El Sherif, F. A., Mansour, S., & Aboeleuon, E. (2019). Effect of preperitoneal versus epidural analgesia on postoperative inflammatory response and pain following radical cystectomy: A prospective, randomized trial. The Clinical journal of pain, 35(4), 328-334.
- Ranta, P. O., Ala-Kokko, T. I., Kukkonen, J. E., Ohtonen, P. P., Raudaskoski, T. H., Reponen, P. K., & Rawal, N. (2006). Incisional and epidural analgesia after caesarean delivery: a prospective, placebo-controlled, randomised clinical study. International journal of obstetric anesthesia, 15(3), 189-194.
- Renghi, A., Gramaglia, L., Casella, F., Moniaci, D., Gaboli, K., & Brustia, P. (2013). Local versus epidural anesthesia in fast-track abdominal aortic surgery. Journal of cardiothoracic and vascular anesthesia, 27(3), 451-458.
- Thangavel, A. R., Sethi, S., & Gupta, V. (2019). Comparison of continuous wound infusion versus continuous epidural infusion in upper abdominal surgery: Noninferiority randomized controlled trial. Anesthesia, essays and researches, 13(4), 676.
Evidence tabellen
Evidence tables
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Mungroop, 2018 |
Yes
The question of our review differs, therefore some studies were excluded (comparison with placebo) and additional studies are added. |
Yes |
No |
No
Not all individual characteristics are described, when relevant this is looked for in the original studies. |
NA |
Yes |
Yes |
No |
Yes, however not for the included studies |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Kilic, 2014 |
Definitely yes
Reason: computer-generated list of random numbers |
Definitely yes
Reason: opaque sealed envelopes |
Probably no
Reason: patients were not blinded (no catheter in placebo group). Clinicians were not blinded. Outcome assessors for pain (nurses) were blinded. Unknown for data collectors and data analysts. |
Probably no
Reason: Infrequent loss of follow-up. 1 in intervention group and 2 in control group. |
Probably yes
Reason: All outcomes were reported |
Probably no
Reason: There was a lack of opioids in the epidural infusion, this is not a fair comparison. |
HIGH
Reason: Lack of blinding and lack of opioids in the epidural infusion |
|
Ball, 2016 |
Definitely yes
Reason: Assignment of each patient to either CEI or CWI-M treatment was performed by the anesthesiology researcher, using a third party web-based randomization system |
Definitely yes
Reason: a third party web-based randomization system revealed the treatment arm only at the arrival of the patient at the operating suite. |
Definitely no
Reason: The surgical ward staff could not be blinded, therefore an open-label design was chosen, and the outcome variables were collected by medical and trained nursing staff, informed on the treatment arm but not involved in the study design. |
Probably no
Reason: Infrequent loss of follow-up. 1 in control group. |
Probably yes
Reason: All outcomes were reported |
Probably no
Reason: infiltration and infusion rates were not maximal, therefore the efficacy of CWI-M might have been under-estimated. The rescue systemic opiate bolus, used in both arms of our study, might not reflect the current clinical practice |
HIGH
Reason: Lack of blinding and see ‘other biases’ |
|
ElShamaa, 2016 |
Definitely yes
Reason: computer-conducted |
Definitely yes
Reason: concealed envelope method |
Probably yes
Reason: patients as well as the anesthesiologist and the surgeon were blinded to the type of the medications infused and the master codes were kept with a person that does not share in the collection or analysis of the results. |
Probably no
Reason: Infrequent loss of follow-up. 1 in intervention group (reason unknown) |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
LOW |
|
O’Neill, 2012 |
Definitely yes
Reason: computer-generated random number list |
Definitely yes
Reason: concealed in an opaque envelope |
Probably no
Reason: patient and nurse and surgeon were not blinded. Assessors were blinded. |
Probably yes
Reason: lost to follow-up 3/35 (8.6%) in intervention group and 5/32 (15.6) in control group |
Probably yes
Reason: All outcomes were reported |
Probably no
Reason: absence of a patient-controlled analgesic system to assess parenteral morphine consumption, NSAIDs were used |
HIGH
Reason: Lack of blinding, loss to follow-up |
|
Renghi, 2013 |
Definitely yes
Reason: randomization, which was created by a computer |
Definitely yes
Reason: opaque envelopes that were opened upon the patients’ arrival in the operating room |
Probably no
Reason: intraoperative caregivers were not blinded, unlike the postoperative ones. Patients were not blinded |
Probably no
Reason: no lost to follow-up reported |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
Some concerns
Reason: lack of blinding |
|
Ranta, 2006 |
Unclear
Reason: not reported |
Unclear
Reason: not reported |
Patients and staff were blinded to the study groups, also nurses that collected data on pain.
Reason: Probably yes |
Probably no
Reason: no lost to follow-up reported |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
Some concerns
Reason: unclear randomisation process |
|
Bell, 2019 |
Definitely yes
Reason: computer generated random sequence |
Definitely yes
Reason: concealed allocation |
Definitely no
Reason: No blinding took place as this was felt not to be practical |
Probably no
Reason: Infrequent loss of follow-up. In both groups one perioperative death. |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
Some concerns
Reason: lack of blinding |
|
Klotz, 2020 |
Definitely yes
Reason: Through randomizer.at, a web based tool |
Probably yes
Reason: block-randomization with a block length of four was implemented. Randomization was performed block wise (permuted blocks) the day before or at the day of surgery by the responsible study nurse. |
Definitely no
Reason: Blinding of patients, anaesthesiologists and outcome assessors to the intervention was not implemented as the insertion of the epidural catheter is performed when the patient is awake. |
Probably yes
Reason: lost to follow-up was 4/35 )11.4%) in control group and 5/36 (13.9%) in intervention group |
Probably yes
Reason: All outcomes were reported |
Probably no
Reason: high rate of PCA use in the EDA and especially the CWI group |
HIGH
Reason: lack of blinding, some lost to follow-up and pilot setting with high rate of PCA use |
|
Othman, 2019 |
Probably no
Reason: nothing mentioned about the exact randomization method only that patients were randomly assigned using sealed envelopes |
Probably no
Reason: sealed envelopes, unclear by who or exact proces |
Probably no
Reason: patients and directly involved clinicians were not blinded, observers were blinded |
Probably yes
Reason: lost to follow-up was 2/22 (9.1%) in intervention group (did not receive intervention) and 0% in control group |
Probably yes
Reason: All outcomes were reported |
Probably no
Reason: short follow-up |
HIGH
Reason: possible randomization problems, lack of blinding, short follow-up |
|
Elsharkawy, 2020 |
Definitely yes
Reason: computer generated randomization sequence by a staff member not involved in the study |
Definitely yes
Reason: opaque and sealed envelope |
Probably no
Reason: nothing reported on blinding, probably not |
Definitely no
Reason: no lost to follow-up |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
Some concerns
Reason: lack of blinding |
|
Gathege, 2021 |
Definitely yes
Reason: computer-generated algorithm |
Definitely yes
Reason: Opaque envelopes with the group allocation, opened at the pre-operative unit, were used for participant group assignment |
Probably no
Reason: patients were not blinded, assessor-blinded |
Probably no
Reason: Infrequent loss of follow-up. 2 in intervention and 1 in control group |
Probably yes
Reason: All outcomes were reported |
Probably no
Reason: the use of different midline incisions could have influenced perception of pain among patients despite both arms having similar mean incision lengths. |
Some concerns
Reason: lack of blinding |
|
Ammianickal, 2018 |
Definitely yes
Reason: computer-generated random numbers |
Definitely yes
Reason: serially numbered opaque-sealed envelope Technique. On the day of surgery, randomisation was done in the preoperative patient waiting area. |
Probably no
Reason: only observers were blinded |
Probably no
Reason: Infrequent loss of follow-up. In both groups one. |
Probably yes
Reason: All outcomes were reported |
Probably no
Reason: short follow-up |
Some concerns
Reason: lack of blinding |
|
Narayan, 2021 |
Definitely yes
Reason: computer‑generated sequence |
Unclear
Reason: not reported |
Definitely no
Reason: open-label |
Probably no
Reason: Infrequent loss of follow-up. In both groups one. |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
Some concerns
Reason: lack of blinding |
|
Thangavel, 2019 |
Definitely yes
Reason: computerized randomization |
Unclear
Reason: not reported |
Definitely no
Reason: open-label |
Definitely no
Reason: no lost to follow-up |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
Some concerns
Reason: lack of blinding |
|
Mouawad, 2018 |
Definitely yes
Reason: computer-generated random numbers table |
Unclear
Reason: not reported |
Definitely no
Reason: open-label |
Probably no
Reason: no lost to follow-up, however 2 discontinued intervention, they needed a second surgery |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
Some concerns
Reason: lack of blinding |
|
Araújo, 2017 |
Probably yes
Reason: electronically generated list |
Probably yes
Reason: individual envelopes |
Definitely no
Reason: open-label |
Definitely yes
Reason: lost to follow-up was 7/33 (21.2%) in control group and 3/37 (8.1%) in intervention group |
Probably yes
Reason: All outcomes were reported |
Probably no
Reason: lack of use of PCA |
HIGH
Reason: lack of blinding, infrequent loss of follow-up |
|
Capdevila, 2017 |
Definitely yes
Reason: computer-generated randomization table |
Unclear
Reason: not reported |
Definitely no
Reason: Both the patient and the investigator were not blinded at least up to the first 72 postoperative hours. all parameters were recorded by 2 research physicians not involved in the primary phase of the study and intraoperative patient care |
Probably no
Reason: Infrequent loss of follow-up. Only 1 in CSSA group. |
Probably yes
Reason: All outcomes were reported |
Probably yes
Reason: No other remarks |
Some concerns
Reason: lack of blinding |
- Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
- If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
- Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the methods section of an article can be compared with those whose results are reported.
- Problems may include: a potential source of bias related to the specific study design used (e.g. lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behavior; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body. Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
- Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favors experimental, or favors comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Table of excluded studies
|
Author |
year |
Reason for exclusion |
|
Telletxea |
2016 |
Voldoet niet aan PICO, geen EA |
|
Abadir |
2009 |
Compared with opioid |
|
Gómez RÃos |
2009 |
Compared with opioid |
|
Kong |
2014 |
Compared with opioid |
|
Chaykovska |
2014 |
Compared with opioid |
|
Lalmand |
2017 |
Verkeerde vergelijking vs intrathecal morphine |
|
Lee |
2013 |
Verkeerde vergelijking vs intrathecal morphine |
|
Sistla |
2009 |
Voldoet niet aan PICO, geen EA |
|
Dutilleux |
2010 |
Geen CWI |
|
Leong |
2002 |
Compared with opioid |
|
Rosetti |
2021 |
compared with placebo |
|
Beaussier |
2018 |
compared with placebo |
|
Grape |
2021 |
voldoet niet aan PICO; versus TAP block |
|
Bell |
2015 |
Andere SR is completer, deze niet bruikbaar (1 unieke studie Soliz was niet gerandomiseerd) |
|
Gavriilidis |
2019 |
Andere SR is completer, deze niet bruikbaar |
|
Fassoulaki |
2014 |
in mungroop SR |
|
Mungroop |
2016 |
in mungroop SR |
|
Barr |
2015 |
post-hoc: stress gemeten and van cortisol niveau geen pijn gemeten |
|
Giordano |
2013 |
Onduidelijk wat control group inhoudt. Verouderde review, slechts klein deel geincludeerde studies is een gerandomiseerde studie |
|
Huang |
2021 |
grotendeels compared with placebo, SR niet bruikbaar, geen afzonderlijke data; gebruiken voor inleiding en onderbouwing |
|
Raghavendra |
2011 |
grotendeels compared with placebo, verouderde SR, zere kleine studies |
|
Li |
2015 |
Verouderde review, overlapt met Adescope |
|
Andersen |
2014 |
Orthopedic |
|
Scarfe |
2016 |
slechts weinig studies voldoen aan PICO Continuous paravertebral block vs wound infiltration, los meenemen (fortier, fibla) |
|
Detterbeck |
2005 |
Verouderde review, slechts klein deel geincludeerde studies voldoet aan PICO |
|
Sultan |
2020 |
Niet bruikbare netwerk meta-analyse, voldoet niet aan PICO |
|
Ventham |
2013 |
Gedateerde SR, bijna alle studies komen terug in Li et al. 2018 |
|
Liu |
2006 |
verouderde SR |
|
Shiatis |
2015 |
compared with placebo + slechts klein deel voldeed aan 'I' |
|
Roy |
2019 |
Plastic surgery; Groot deel van studies voldoet niet aan PICO (vs placebo of standard regime(?)) of is geen RCT |
|
Groen, |
2019 |
Slechts 1 studie in review voldoet aan PICO (los meenemen=Mungroop) |
|
Hughes, |
2015 |
geen bruikbare review, ook niet RCTs en vs placebo |
|
Joshi, |
2012 |
Zeer brede SR over alle type pijnbehandeling bij open inguinal hernia, niet bruikbaar |
|
Karthikesalingam, |
2008 |
niet bruikbare SR, onvoldoende data. Bovendien onduidelijk wat control group is (wrs placebo) |
|
Matek, |
2020 |
Wrong outcome measure, wrong intervention |
|
Axelsson, |
2003 |
Type of surgery |
|
Bansal, |
2012 |
Type of surgery |
|
O'Scanaill, |
2018 |
Type of surgery |
|
Baskan, |
2017 |
Type of surgery |
|
Campbell, |
2008 |
Type of surgery |
|
Ansaloni, |
2007 |
in SR Mungroop |
|
Salama, |
2018 |
Onjuiste vergelijking |
|
Dowidar, |
2016 |
Onjuiste vergelijking |
|
Chandon, |
2014 |
Onjuiste vergelijking |
|
Fibla, |
2015 |
Onjuiste vergelijking |
|
Klasen, |
2016 |
Onjuiste vergelijking |
|
Omar, |
2013 |
Onjuiste vergelijking |
|
Hotta, |
2016 |
Onjuiste vergelijking |
|
Sidiropoulou, |
2008 |
Onjuiste vergelijking |
|
Khorgami, |
2013 |
in mungroop SR |
|
Fortier, |
2012 |
Onjuiste vergelijking |
|
Lockwood, |
2017 |
Onjuiste vergelijking |
|
Cowlishaw, |
2017 |
Onjuiste vergelijking |
|
Kristek, |
2007 |
Onjuiste vergelijking |
|
Argiriadou, |
2011 |
Onjuiste vergelijking: paraverebral block |
|
Groeger, |
2016 |
Onjuiste vergelijking: plaatsing kathether |
|
Kanazi, |
2012 |
is geen wond katheter is subpleuraal vs epiduraal |
|
Zheng, |
2016 |
in mungroop SR |
|
Gupta, |
2011 |
compared with placebo/verouderde SR |
|
Raines, |
2014 |
compared with placebo |
|
Liang, |
2019 |
compared with placebo |
|
Adesope, |
2016 |
compared with placebo |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-09-2023
Beoordeeld op geldigheid : 01-09-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met postoperatieve pijn.
Samenstelling van de werkgroep
Werkgroep
Prof. dr. J. (Jörgen) Bruhn, anesthesioloog, (voorzitter) NVA
Prof. dr. dr. M.W. (Markus) Hollmann, anesthesioloog, NVA
Dr. M.F. (Markus) Stevens, anesthesioloog, NVA
Drs. L.J.H. (Lea) van Wersch, anesthesioloog, NVA
Dr. M.H.J. (Margot) Roozekrans, anesthesioloog, NVA
Dr. S.A.S. (Sandra) van den Heuvel, anesthesioloog/pijnspecialist, NVA
Drs. S.J. (Stijn) Westerbos, orthopeed, NOV
Drs. W.L. (Wilson) Li, cardiothoracaal chirurg, NVT
S.F. (Cedric) Lau MSc, ziekenhuisapotheker, NVZA
Dr. R.L.M. (Rianne) van Boekel, verpleegkundig pijnconsulent, V&VN
Drs. I.L. (Ilona) Thomassen-Hilgersom, patiëntvertegenwoordiger, Samenwerkingverband Pijnpatiënten naar één stem
Klankbordgroep
Drs. N.C. (Niels) Gritters van den Oever, intensivist, NVIC
J.P. (Patrick) Rensink, anesthesiemedewerker/pijnconsulent, NVAM
Dr. G. (Gijs) Helmerhorst, orthopeed, NOV
Dr. C.D. (Cor) de Kroon, gynaecoloog-oncoloog, NVOG
Dr. W.J. (Wietse) Eshuis, chirurg, NVvH
Dr. D. (Daphne) Roos, chirurg, NVvH
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M. van Leeuwen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bruhn, voorzitter |
Professor & Afdelingshoofd afdeling Anesthesiologie, Radboud UMC |
Editorial Board Journal of Clinical Monitoring and Computing, onbetaald |
Geen |
Geen actie |
|
Hollmann |
Professor & Afdelingshoofd afdeling Anesthesiologie, Amsterdam UMC, locatie AMC |
|
Geen |
Restricties t.a.v. modules over ketamine en lidocaïne. |
|
Lau |
|
Nationale Werkgroep morbide obesitas en bariatrische chirurgie (KNMP), vergoeding voor bestede uren |
Geen belangenverstrengeling, promotie-onderzoek is op een ander vlak dan waar beoogde werkgroep zich over buigt
|
Geen actie |
|
Boekel, van |
|
|
Geen |
Geen actie |
|
Thomassen-Hilgersom |
Voorzitter Samenwerkingsverband Pijnpatiënten naar één stem vrijwilliger en geen werkgever |
|
Geen |
Geen actie |
|
Li |
Cardiothoracaal chirurg (Radboudumc, Nijmegen) |
Bestuurslid NVT (Nederlandse Vereniging voor Thoraxchirurgie) |
Radboudumc zal in 2021 meedoen aan een RCT naar de optimale vorm van pijnstilling ten tijde van longchirugie (epiduraal versus paravertebraal) OPtriAL - met ZonMw subsidie, geïniteerd vanuit het MMC |
Geen actie |
|
Roozekrans |
Anesthesioloog - Pijnspecialist - Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen actie |
|
Stevens |
Chef de Clinique kinderanesthesie AUMC locatie AMC |
|
Geen |
Geen actie |
|
Heuvel, van den |
Anesthesioloog-pijnarts, Radboud UMC |
Geen |
Geen |
Geen actie |
|
Wersch, van |
Anesthesioloog, Maasziekenhuis Pantein |
Geen |
Geen |
Geen actie |
|
Westerbos |
Orthopeed, Alrijne ziekenhuis |
Geen |
Geen |
Geen actie |
|
Gritters van den Oever |
Anesthesioloog-intensivist Treant Zorggroep |
|
Geen |
Geen actie |
|
Rensink |
|
|
Geen |
Geen actie |
|
Kroon, de |
Gynaecoloog-oncoloog Leids Univesitair Medisch Centrum (1.0 fte) |
|
Geen |
Geen actie |
|
Roos |
Chirurg |
Geen |
Geen |
Geen actie |
|
Eshuis |
Chirurg, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Willeboordse |
Senior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Partner werkzaam bij Janssen Vaccines, onderdeel van Johnsson &Johnsson, via partner ook financiële belangen (aandelen J&J) |
Geen actie |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Leeuwen, van |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Dijk, van |
Junior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door zitting van een afgevaardigde van de patiëntenvereniging (Pijnpatiënten naar één stem) in de werkgroep. De Patiëntenfederatie Nederland en Pijnpatiënten naar één stem werden uitgenodigd voor de invitational conference. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en Pijnpatiënten naar één stem en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Organisatie van Zorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Transitionele Pijn Service (TPS) |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten). Hoewel de aanbeveling aangeeft dat een andere of nieuwe manier van zorgverlening gewenst is (i.e. andere manier van samenwerking/afstemming tussen zorgverleners) waarbij een TPS-model met TPS-team geïnitieerd wordt, laten eerste kosten-effectiviteitsstudies kostenbesparingen zien. De verwachting is dat TPS leidt tot betere zorg-op-maat, waarbij chronische postoperatieve pijn zorg doelmatiger wordt behandeld. Per ziekenhuis zal de vorm, intensiteit en organisatie van het TPS-model variëren. Zo kunnen ziekenhuizen ook kiezen voor een minder uitgebreid TPS. De aanbeveling geeft relatief veel ruimte voor de precieze invulling. Alle overwegingen tezamen, worden er geen substantiële financiële gevolgen verwacht. |
|
Module Pijnmeting |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Niet-medicamenteuze interventies |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Buikwandblokken |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken bij mammachirurgie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken intrathoracaal |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Continue Wond infusie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cryoanalgesie |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Dexmethason |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Gabapentinoïden |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Ketamine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Magnesium |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Methadon |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Beta blokkers -Esmolol |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist - Clonidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist – Dexmedetomidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Lidocaïne |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Multimodale pijnbestrijding |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met postoperatieve pijn.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Postoperatieve pijn (NVA, 2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door relevante partijen middels een invitational conference.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
De beoordelingen van de literatuur en de conclusies zijn gedaan op basis van de GRADE systematiek. De werkgroep vindt het belangrijk om relevante beperkingen hiervan aan te geven.
De klinische vraag gaat vaak over een reductie van ernstige postoperatieve pijn en opioïdenconsumptie in een aantal patiënten met resp. over een klinisch relevante reductie van ernstige postoperatieve pijn opioïdenconsumptie bij een individuele patiënt. Hetzelfde geldt voor opioïdenconsumptie; de keuze van een absolute drempelwaarde in mg (i.p.v. een relatieve drempelwaarde in %) maakt dit afhankelijk van tijdstip, ingreep en ernst van de pijn: vroege postoperatieve tijdstippen en (studies met) ingrepen met relatief lage opioïdconsumptie kunnen vaak de MCID niet bereiken.
De keuze van de MCID heeft een bepaalde mate van willekeurigheid en is niet absoluut te zien. Ook zijn de conclusies zo geformuleerd (en geven alleen beperkt antwoord op het effect op een individuele patiënt voor een specifieke ingreep).
In de literatuur worden de eindpunten pijnscores en opioïdenconsumptie separaat van elkaar weer gegeven, suggererend dat deze onafhankelijk van elkaar zijn. Echter kunnen deze twee eindpunten niet onafhankelijk van elkaar beoordeeld worden; in ieder protocol is opgenomen dat pijn behandeld moet worden. Deze separate beoordeling geeft niet altijd een adequaat antwoord op de klinische vraag naar het analgetische effect van een interventie.
Daarnaast worden multimodale componenten als aparte interventies beoordeeld, echter de klinische vraag is naar de effectiviteit als bouwsteen van een multimodale werkwijze.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
Embase, 11-06-2021
|
No. |
Query |
Results |
|
#8 |
#4 AND #6 |
1046 |
|
#7 |
#4 AND #5 |
164 |
|
#6 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2579360 |
|
#5 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
566170 |
|
#4 |
#3 AND (2000:py OR 2001:py OR 2002:py OR 2003:py OR 2004:py OR 2005:py OR 2006:py OR 2007:py OR 2008:py OR 2009:py OR 2010:py OR 2011:py OR 2012:py OR 2013:py OR 2014:py OR 2015:py OR 2016:py OR 2017:py OR 2018:py OR 2019:py OR 2020:py OR 2021:py) |
4254 |
|
#3 |
#1 AND #2 |
4883 |
|
#2 |
'wound catheter'/exp OR 'wound infusi*':ti,ab,kw OR 'pain catheter*':ti,ab,kw OR 'wound infiltrat*':ti,ab,kw OR (('wound'/exp OR 'wound*':ti,ab,kw OR 'subpleural':ti,ab,kw OR 'peripleural*':ti,ab,kw OR 'preperitoneal*':ti,ab,kw OR 'subcutan*':ti,ab,kw) AND ('catheter'/exp OR 'continuous infusion'/exp OR 'aerostat':ti,ab,kw OR 'duplocath':ti,ab,kw OR 'kumpe' OR 'catheter*':ti,ab,kw)) |
19349 |
|
#1 |
'analgesia'/exp OR 'analgesia':ti,ab,kw OR 'pain management':ti,ab,kw OR 'pain relief':ti,ab,kw OR 'sequential analgetic analgesia':ti,ab,kw OR 'surgical analgesia':ti,ab,kw OR 'anesthesia'/exp OR 'anaesthe*':ti,ab,kw OR 'anaesthetic action':ti,ab,kw OR 'anesthe*':ti,ab,kw OR 'anesthetic action':ti,ab,kw OR 'anesthetization':ti,ab,kw OR 'autoanaesthe*':ti,ab,kw OR 'autoanesthe*':ti,ab,kw OR 'drop mask anaesthe*':ti,ab,kw OR 'drop mask anesthe*':ti,ab,kw OR 'narcosis':ti,ab,kw OR 'neuroanaesthe*':ti,ab,kw OR 'neuroanesthe*':ti,ab,kw OR 'short anaesthe*':ti,ab,kw OR 'short anesthe*':ti,ab,kw OR 'short duration anaesthe*':ti,ab,kw OR 'short duration anesthe*':ti,ab,kw OR 'analgesic agent'/exp OR 'analgesic':ti,ab,kw OR 'analgesic agent*':ti,ab,kw OR 'analgesic drug*':ti,ab,kw OR 'analgesic evaluation':ti,ab,kw OR 'analgesic tv 393':ti,ab,kw OR 'analgesics':ti,ab,kw OR 'analgetic':ti,ab,kw OR 'analgetic agent*':ti,ab,kw OR 'analgetic drug*':ti,ab,kw OR 'antalgic agent*':ti,ab,kw OR 'anesthetic agent'/exp OR 'anaesthetic':ti,ab,kw OR 'anaesthetic agent':ti,ab,kw OR 'anaesthetic drug':ti,ab,kw OR 'anaesthetics':ti,ab,kw OR 'anesthetic':ti,ab,kw OR 'anesthetic agent':ti,ab,kw OR 'anesthetic drug':ti,ab,kw OR 'anesthetics':ti,ab,kw OR 'general anaesthetic*':ti,ab,kw OR 'general anaesthetic agent*':ti,ab,kw OR 'general anesthetic*':ti,ab,kw OR 'general anesthetic agent*':ti,ab,kw OR 'preanaesthetics':ti,ab,kw OR 'preanesthetics':ti,ab,kw OR 'bupivacaine'/exp OR 'lidocaine'/exp OR 'mepivacaine'/exp OR 'ropivacaine'/exp OR 'bupivacain*':ti,ab,kw OR 'lidocain*':ti,ab,kw OR 'mepivacain*':ti,ab,kw OR 'carbocain*':ti,ab,kw OR 'ropivacain*':ti,ab,kw |
2,057,181 |
Embase, 9-4-2021
|
No. |
Query |
Results |
|
#14 |
#10 AND #12 |
702 |
|
#13 |
#10 AND #11 |
108 |
|
#12 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2552170 |
|
#11 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
554557 |
|
#10 |
#3 AND (2000:py OR 2001:py OR 2002:py OR 2003:py OR 2004:py OR 2005:py OR 2006:py OR 2007:py OR 2008:py OR 2009:py OR 2010:py OR 2011:py OR 2012:py OR 2013:py OR 2014:py OR 2015:py OR 2016:py OR 2017:py OR 2018:py OR 2019:py OR 2020:py OR 2021:py) |
2216 |
|
#9 |
#3 AND #8 |
1 |
|
#8 |
31627242:ui |
1 |
|
#7 |
#3 AND #6 |
1 |
|
#6 |
28404067:ui |
1 |
|
#5 |
#3 AND #4 |
1 |
|
#4 |
'10.1002/bjs.9204':do |
1 |
|
#3 |
#1 AND #2 |
2512 |
|
#2 |
'wound catheter'/exp OR 'wound infusi*':ti,ab,kw OR 'pain catheter*':ti,ab,kw OR 'wound infiltrat*':ti,ab,kw OR (('wound'/exp OR 'wound*':ti,ab,kw OR 'subpleural':ti,ab,kw OR 'peripleural*':ti,ab,kw OR 'preperitoneal*':ti,ab,kw OR 'subcutan*':ti,ab,kw) AND ('catheter'/exp OR 'continuous infusion'/exp OR 'aerostat':ti,ab,kw OR 'duplocath':ti,ab,kw OR 'kumpe' OR 'catheter*':ti,ab,kw)) |
19095 |
|
#1 |
'local anesthesia'/exp OR 'epidural anesthesia'/exp OR 'spinal anesthesia'/exp OR 'bupivacaine'/exp OR 'lidocaine'/exp OR 'mepivacaine'/exp OR 'ropivacaine'/exp OR 'regional anesthesia'/exp OR 'local anaesthe*':ti,ab,kw OR 'local anesthe*':ti,ab,kw OR 'dural block*':ti,ab,kw OR 'epidural anaesthe*':ti,ab,kw OR 'epidural anesthe*':ti,ab,kw OR 'epidural block*':ti,ab,kw OR 'extradural anaesthe*':ti,ab,kw OR 'extradural anesthe*':ti,ab,kw OR 'extradural block*':ti,ab,kw OR 'peridural block*':ti,ab,kw OR 'peridural anaesthe*':ti,ab,kw OR 'peridural anesthe*':ti,ab,kw OR 'analgesia spinal*':ti,ab,kw OR 'analgaesia spinal*':ti,ab,kw OR 'lumbar anaesthe*':ti,ab,kw OR 'lumbar anesthe*':ti,ab,kw OR 'rachianaesthe*':ti,ab,kw OR 'rachianesthe*':ti,ab,kw OR 'spinal anaesthe*':ti,ab,kw OR 'spinal anaesthetic*':ti,ab,kw OR 'spinal analgesia*':ti,ab,kw OR 'spinal anesthe*':ti,ab,kw OR 'spinal block*':ti,ab,kw OR 'spinal cord anaesthe*':ti,ab,kw OR 'spinal cord anesthe*':ti,ab,kw OR 'subarachnoid anaesthe*':ti,ab,kw OR 'subarachnoid anesthe*':ti,ab,kw OR 'subarachnoid block*':ti,ab,kw OR 'subarachnoidal block*':ti,ab,kw OR 'subarachnoidal anaesthe*':ti,ab,kw OR 'subarachnoidal anesthe*':ti,ab,kw OR 'neuraxial analgesia*':ti,ab,kw OR 'neuraxial analgaesia*':ti,ab,kw OR 'bupivacain*':ti,ab,kw OR 'lidocain*':ti,ab,kw OR 'mepivacain*':ti,ab,kw OR 'carbocain*':ti,ab,kw OR 'anaesthesia regionalis*':ti,ab,kw OR 'conduction anaesthe*':ti,ab,kw OR 'conduction anesthe*':ti,ab,kw OR 'region anaesthe*':ti,ab,kw OR 'region anesthe*':ti,ab,kw OR 'regional anaesthe*':ti,ab,kw OR 'regional anesthe*':ti,ab,kw OR 'nerve block*':ti,ab,kw |
239032 |
Pubmed, 12-06-2021
|
Search |
Query |
Results |
|
#8 |
Search: #4 AND #6 Sort by: Most Recent |
|
|
#7 |
Search: #4 AND #5 Sort by: Most Recent |
|
|
#6 |
Search: ("Meta-Analysis" [Publication Type] OR "Meta-Analysis as Topic"[Mesh] OR metaanaly*[tiab] OR meta-analy*[tiab] or metanaly*[tiab] OR "Systematic Review" [Publication Type] OR systematic[sb] OR "Cochrane Database Syst Rev"[Journal] or prisma[tiab] OR preferred reporting items[tiab] OR prospero[tiab] OR ((systemati*[ti] OR scoping[ti] OR umbrella[ti] OR structured literature[ti]) AND (review*[ti] OR overview*[ti])) OR systematic review*[tiab] OR scoping review*[tiab] OR umbrella review*[tiab] OR structured literature review*[tiab] OR systematic qualitative review*[tiab] OR systematic quantitative review*[tiab] OR systematic search and review[tiab] OR systematized review[tiab] OR systematised review[tiab] OR systemic review[tiab] OR systematic literature review*[tiab] OR systematic integrative literature review*[tiab] OR systematically review*[tiab] OR scoping literature review*[tiab] OR systematic critical review[tiab] OR systematic integrative review*[tiab] OR systematic evidence review[tiab] OR Systematic integrative literature review*[tiab] OR Systematic mixed studies review*[tiab] OR Systematized literature review*[tiab] OR Systematic overview*[tiab] OR Systematic narrative review*[tiab] OR ((systemati*[tiab] OR literature[tiab] OR database*[tiab] OR data-base*[tiab] OR structured[tiab] OR comprehensive*[tiab] OR systemic*[tiab]) AND search*[tiab]) OR (Literature[ti] AND review[ti] AND (database*[tiab] OR data-base*[tiab] OR search*[tiab])) OR ((data extraction[tiab] OR data source*[tiab]) AND study selection[tiab]) OR (search strategy[tiab] AND selection criteria[tiab]) OR (data source*[tiab] AND data synthesis[tiab]) OR medline[tiab] OR pubmed[tiab] OR embase[tiab] OR Cochrane[tiab] OR ((critical[ti] OR rapid[ti]) AND (review*[ti] OR overview*[ti] OR synthes*[ti])) OR (((critical*[tiab] OR rapid*[tiab]) AND (review*[tiab] OR overview*[tiab] OR synthes*[tiab]) AND (search*[tiab] OR database*[tiab] OR data-base*[tiab]))) OR metasynthes*[tiab] OR meta-synthes*[tiab]) NOT ("Comment" [Publication Type] OR "Letter" [Publication Type] OR "Editorial" [Publication Type] OR (("Animals"[Mesh] OR "Models, Animal"[Mesh]) NOT "Humans"[Mesh])) Sort by: Most Recent |
|
|
#5 |
Search: ((random*[tiab] AND (controlled[tiab] OR control[tiab] OR placebo[tiab] OR versus[tiab] OR vs[tiab] OR group[tiab] OR groups[tiab] OR comparison[tiab] OR compared[tiab] OR arm[tiab] OR arms[tiab] OR crossover[tiab] OR cross-over[tiab]) AND (trial[tiab] OR study[tiab])) OR ((single[tiab] OR double[tiab] OR triple[tiab]) AND (masked[tiab] OR blind*[tiab]))) Sort by: Most Recent |
|
|
#4 |
Search: #3 AND ("2000/01"[Date - Entrez] : "3000"[Date - Entrez]) Sort by: Most Recent |
|
|
#3 |
Search: #1 AND #2 Sort by: Most Recent |
|
|
#2 |
Search: "wound infusi*"[tiab] OR "pain catheter*"[tiab] OR "wound infiltrat*"[tiab] OR (("Wounds and Injuries"[Mesh] OR wound*[tiab] OR subpleural[tiab] OR peripleural*[tiab] OR preperitoneal*[tiab] OR subcutan*[tiab]) AND ("Catheters"[Mesh] OR "Infusions, Intra-Arterial"[Mesh] OR aerostat[tiab] OR duplocath[tiab] OR kumpe[tiab] OR catheter*[tiab])) Sort by: Most Recent |
|
|
#1 |
Search: "Analgesia"[Mesh] OR "Anesthesia"[Mesh] OR "Analgesics"[Mesh] OR "Analgesics" [Pharmacological Action] OR "Anesthetics"[Mesh] OR "Anesthetics" [Pharmacological Action] OR analgesia[tiab] OR "pain management"[tiab] OR "pain relief"[tiab] OR "sequential analgetic analgesia"[tiab] OR "surgical analgesia"[tiab] OR 'anesthesia'/exp OR anaesthe*[tiab] OR "anaesthetic action"[tiab] OR anesthe*[tiab] OR "anesthetic action"[tiab] OR anesthetization[tiab] OR autoanaesthe*[tiab] OR autoanesthe*[tiab] OR "drop mask anaesthe*"[tiab] OR "drop mask anesthe*"[tiab] OR narcosis[tiab] OR neuroanaesthe*[tiab] OR neuroanesthe*[tiab] OR "short anaesthe*"[tiab] OR "short anesthe*"[tiab] OR "short duration anaesthe*"[tiab] OR "short duration anesthe*"[tiab] OR analgesic*[tiab] OR "analgesic agent*"[tiab] OR "analgesic drug*"[tiab] OR "analgesic evaluation"[tiab] OR "analgesic tv 393"[tiab] OR analgetic[tiab] OR "analgetic agent*"[tiab] OR "analgetic drug*"[tiab] OR "antalgic agent*"[tiab] OR "anesthetic agent*"[tiab] OR anaesthetic[tiab] OR "anaesthetic agent"[tiab] OR "anaesthetic drug"[tiab] OR anaesthetics[tiab] OR anesthetic[tiab] OR "anesthetic agent"[tiab] OR "anesthetic drug"[tiab] OR anesthetics[tiab] OR "general anaesthetic*"[tiab] OR "general anaesthetic agent*"[tiab] OR "general anesthetic*"[tiab] OR "general anesthetic agent*"[tiab] OR preanaesthetics[tiab] OR preanesthetics[tiab] OR "bupivacain*"[tiab] OR "lidocain*"[tiab] OR "mepivacain*"[tiab] OR "carbocain*"[tiab] OR ropivacain*[tiab] Sort by: Most Recent |
Pubmed, 09-04-2021
|
Search |
Query |
Results |
|
#8 |
Search: #4 AND #6 Sort by: Publication Date |
|
|
#7 |
Search: #4 AND #5 Sort by: Publication Date |
|
|
#6 |
Search: ("Meta-Analysis" [Publication Type] OR "Meta-Analysis as Topic"[Mesh] OR metaanaly*[tiab] OR meta-analy*[tiab] or metanaly*[tiab] OR "Systematic Review" [Publication Type] OR systematic[sb] OR "Cochrane Database Syst Rev"[Journal] or prisma[tiab] OR preferred reporting items[tiab] OR prospero[tiab] OR ((systemati*[ti] OR scoping[ti] OR umbrella[ti] OR structured literature[ti]) AND (review*[ti] OR overview*[ti])) OR systematic review*[tiab] OR scoping review*[tiab] OR umbrella review*[tiab] OR structured literature review*[tiab] OR systematic qualitative review*[tiab] OR systematic quantitative review*[tiab] OR systematic search and review[tiab] OR systematized review[tiab] OR systematised review[tiab] OR systemic review[tiab] OR systematic literature review*[tiab] OR systematic integrative literature review*[tiab] OR systematically review*[tiab] OR scoping literature review*[tiab] OR systematic critical review[tiab] OR systematic integrative review*[tiab] OR systematic evidence review[tiab] OR Systematic integrative literature review*[tiab] OR Systematic mixed studies review*[tiab] OR Systematized literature review*[tiab] OR Systematic overview*[tiab] OR Systematic narrative review*[tiab] OR ((systemati*[tiab] OR literature[tiab] OR database*[tiab] OR data-base*[tiab] OR structured[tiab] OR comprehensive*[tiab] OR systemic*[tiab]) AND search*[tiab]) OR (Literature[ti] AND review[ti] AND (database*[tiab] OR data-base*[tiab] OR search*[tiab])) OR ((data extraction[tiab] OR data source*[tiab]) AND study selection[tiab]) OR (search strategy[tiab] AND selection criteria[tiab]) OR (data source*[tiab] AND data synthesis[tiab]) OR medline[tiab] OR pubmed[tiab] OR embase[tiab] OR Cochrane[tiab] OR ((critical[ti] OR rapid[ti]) AND (review*[ti] OR overview*[ti] OR synthes*[ti])) OR (((critical*[tiab] OR rapid*[tiab]) AND (review*[tiab] OR overview*[tiab] OR synthes*[tiab]) AND (search*[tiab] OR database*[tiab] OR data-base*[tiab]))) OR metasynthes*[tiab] OR meta-synthes*[tiab]) NOT ("Comment" [Publication Type] OR "Letter" [Publication Type] OR "Editorial" [Publication Type] OR (("Animals"[Mesh] OR "Models, Animal"[Mesh]) NOT "Humans"[Mesh])) Sort by: Publication Date |
|
|
#5 |
Search: ((random*[tiab] AND (controlled[tiab] OR control[tiab] OR placebo[tiab] OR versus[tiab] OR vs[tiab] OR group[tiab] OR groups[tiab] OR comparison[tiab] OR compared[tiab] OR arm[tiab] OR arms[tiab] OR crossover[tiab] OR cross-over[tiab]) AND (trial[tiab] OR study[tiab])) OR ((single[tiab] OR double[tiab] OR triple[tiab]) AND (masked[tiab] OR blind*[tiab]))) Sort by: Publication Date |
|
|
#4 |
Search: #3 AND ("2000/01"[Date - Entrez] : "3000"[Date - Entrez]) Sort by: Publication Date |
|
|
#3 |
Search: #1 AND #2 Sort by: Publication Date |
|
|
#2 |
Search: "wound infusi*"[tiab] OR "pain catheter*"[tiab] OR "wound infiltrat*"[tiab] OR (("Wounds and Injuries"[Mesh] OR wound*[tiab] OR subpleural[tiab] OR peripleural*[tiab] OR preperitoneal*[tiab] OR subcutan*[tiab]) AND ("Catheters"[Mesh] OR "Infusions, Intra-Arterial"[Mesh] OR aerostat[tiab] OR duplocath[tiab] OR kumpe[tiab] OR catheter*[tiab])) Sort by: Publication Date |
|
|
#1 |
Search: "Anesthesia, Local"[Mesh] OR "Anesthesia, Epidural"[Mesh] OR "Anesthesia, Spinal"[Mesh] OR "Bupivacaine"[Mesh] OR "Lidocaine"[Mesh] OR "Mepivacaine"[Mesh] OR "Ropivacaine"[Mesh] OR "Anesthesia, Conduction"[Mesh] OR "local anaesthe*"[tiab] OR "local anesthe*"[tiab] OR "dural block"[tiab] OR "epidural anaesthe*"[tiab] OR "epidural anesthe*"[tiab] OR "epidural block*"[tiab] OR "extradural anaesthe*"[tiab] OR "extradural anesthe*"[tiab] OR "extradural block*"[tiab] OR "peridural block*"[tiab] OR "peridural anaesthe*"[tiab] OR "peridural anesthe*"[tiab] OR "analgesia spinal*"[tiab] OR "lumbar anaesthe*"[tiab] OR "lumbar anesthe*"[tiab] OR "rachianaesthe*"[tiab] OR "rachianesthe*"[tiab] OR "spinal anaesthe*"[tiab] OR "spinal anaesthetic*"[tiab] OR "spinal analgesia*"[tiab] OR "spinal anesthe*"[tiab] OR "spinal block*"[tiab] OR "spinal cord anaesthe*"[tiab] OR "spinal cord anesthe*"[tiab] OR "subarachnoid anaesthe*"[tiab] OR "subarachnoid anesthe*"[tiab] OR "subarachnoid block*"[tiab] OR "subarachnoidal block*"[tiab] OR "subarachnoidal anaesthe*"[tiab] OR "subarachnoidal anesthe*"[tiab] OR "neuraxial analgesia*"[tiab] OR "bupivacain*"[tiab] OR "lidocain*"[tiab] OR "mepivacain*"[tiab] OR "carbocain*"[tiab] OR "anaesthesia regional*"[tiab] OR "anesthesia regional"[tiab] OR "conduction anaesthe*"[tiab] OR "conduction anesthe*"[tiab] OR "regional anaesthe*"[tiab] OR "regional anesthe*"[tiab] OR "nerve block*"[tiab] Sort by: Publication Date |