Dunnevezelneuropathie
Uitgangsvraag
Hoe dient het diagnostisch traject van patiënten die verdacht worden van
dunnevezelneuropathie eruit te zien?
De uitgangsvraag omvat de volgende deelvragen:
- Wat zijn de meest voorkomende klachten en symptomen bij dunnevezelneuropathie?
- Welke diagnostische testen zijn beschikbaar voor het stellen van de diagnose dunnevezelneuropathie?
- Welke onderliggende aandoeningen zijn geassocieerd met dunnevezelneuropathie?
Aanbeveling
Overweeg de diagnose dunnevezelneuropathie indien er sprake is van een typisch klinisch beeld, bestaande uit de combinatie van de volgende drie aspecten:
- neuropathische pijn (brandend, prikkelend, schietend), doorgaans in een lengte-afhankelijke verdeling;
- andere sensibele verschijnselen van disfunctie van de dunne zenuwvezels (verminderde pijnzin (pinprick), allodynie en/of hyperalgesie);
- normale functie van de dikke zenuwvezels (kracht, reflexen, vibratiezin, zenuwgeleidingsonderzoek).
Autonome stoornissen kunnen hierbij voorkomen.
Verricht bij verdenking op dunnevezelneuropathie als eerste zenuwgeleidingsonderzoek. Indien dit afwijkend is, is er sprake van een polyneuropathie (met mogelijk tevens betrokkenheid van dunne zenuwvezels); verdere diagnostiek naar dunnevezelneuropathie heeft in dat geval geen toegevoegde waarde.
Kwantitatieve testen
- Overweeg om bij patiënten met een duidelijke klinische verdenking op een dunnevezelneuropathie een huidbiopt voor bepaling van de intra-epidermale zenuwvezeldichtheid te (laten) verrichten. Dit is op dit moment de best onderzochte en meest betrouwbare test voor het stellen van de zekere diagnose dunnevezelneuropathie (in combinatie met het klinisch beeld). Een normaal huidbiopt sluit de diagnose niet uit.
- Verricht geen corneaconfocale microscopie.
Functionele testen
- Verricht alleen een temperatuurdrempelonderzoek (QST) bij patiënten met een typisch klinisch beeld van dunnevezelneuropathie (neuropathische pijn, lengte-afhankelijke verdeling, verminderde pijnzin, allodynie en/of hyperalgesia); een afwijkend QST ondersteunt de diagnose dunnevezelneuropathie, hiermee kan hooguit een waarschijnlijkheidsdiagnose dunnevezelneuropathie worden gesteld.
- Verricht geen nociceptieve evoked potentials, huidrimpeltest of Sudoscan.
Zet bij patiënten met een vastgestelde dunnevezelneuropathie, indien nog niet verricht, minimaal aanvullend onderzoek in naar auto-immuunziekten (ANA, ENA, SolIL2 of ACE, afhankelijk van lokale beschikbaarheid en gebruik van ACE-remmers), diabetes mellitus en vitamine B12 deficiëntie; dit geldt ook voor patiënten die al bekend zijn met een mogelijke onderliggende aandoening.
Overweeg DNA-onderzoek naar natriumkanaalmutaties bij patiënten met de diagnose DVN.
Overwegingen
Deelvraag 1
Wat zijn de meest voorkomende klachten en symptomen bij dunnevezelneuropathie?
Dunnevezelneuropathie is een perifere neuropathie waarbij overwegend de dun-gemyeliniseerde Aδ-vezels en ongemyeliniseerde C-vezels zijn aangedaan. De aandoening leidt tot neuropathische pijn en autonome disfunctie (tabel 1). Het beloop is meestal langzaam progressief, maar soms kunnen de klachten ook subacuut ontstaan Devigili, 2008).
Tabel 1 Symptomen van dunnevezelneuropathie
|
Sensibel |
Autonoom |
|
Pijn (brandend, prikkelend, schietend) |
Sicca klachten (droge ogen, droge mond) |
|
Allodynie |
Accommodatiestoornissen |
|
Hyperalgesie |
Hyper- of hypohidrosis |
|
Verminderde temperatuurzin |
Mictiestoornissen |
|
Verminderde pijnzin |
Impotentie/ejaculatiestoornissen |
|
Jeuk |
Gastroparese |
|
|
Diarree of obstipatie |
|
|
Opvliegers |
|
|
Orthostatische klachten |
|
|
Palpitaties (hartkloppingen) |
Er bestaat een klinische verdenking op dunnevezelneuropathie wanneer er sprake is van pijn, vaak brandend of schietend van karakter, met daarbij tekenen van disfunctie van de dunne zenuwvezels: verminderde pijnzin (pinprick), allodynie en/of hyperalgesie (Devigili, 2008; Cazzato, 2017; Blackmore, 2017). Bij een geïsoleerde of pure dunnevezelneuropathie zijn er geen tekenen van disfunctie van dikke zenuwvezels (normale kracht, coördinatie, vibratiezin, fijne tast, positie- en bewegingszin, peesrekkingsreflexen, zenuwgeleidingsonderzoek). De sensibele klachten komen meestal tot uiting in een lengte-afhankelijk patroon. Vlekkerige patronen met betrokkenheid van de romp en het gelaat zijn echter ook beschreven (Gemignani, 2010; Gorson, 2008). Daarnaast komen vaak autonome klachten voor (tabel 1). Soms kan ook erythermalgie worden gezien, een rode tot paarse verkleuring van de handen en/of voeten, die gepaard gaat met hevige brandende pijn. Erythermalgie kan secundair zijn aan andere aandoeningen (zoals trombocytose), maar kan ook een uiting zijn van dunnevezelneuropathie, soms op basis van een onderliggende natriumkanaalmutatie (Hoeijmakers, 2015).
Bij het uitvragen van de symptomen kan gebruik worden gemaakt van de gevalideerde Small Fiber Neuropathy Symptom Inventory Questionnaire (SFN-SIQ), waarin de belangrijkste klachten van dunnevezelneuropathie aan bod komen (Brouwer, 2015).
Deelvraag 2
Welke diagnostische testen zijn beschikbaar voor het stellen van de diagnose dunnevezelneuropathie?
Kwantificeren van dunne zenuwvezels
Huidbiopt
Het aantal intra-epidermale vezels kan worden gekwantificeerd met een huidbiopt ter plaatse van de enkel, op basis van leeftijds- en geslachtsafhankelijke normaalwaardes (Bakkers, 2009; Lauria, 2010a). De intra-epidermale zenuwvezeldichtheid neemt af met de leeftijd en verschilt tussen mannen en vrouwen. De telling van de intra-epidermale zenuwvezels is zeer goed reproduceerbaar (Lauria, 2015), heeft een hoge specificiteit en een redelijke sensitiviteit Devigili, 2008; Bakkers, 2009; Hlubocky, 2010; Saperstein, 2013). De diagnostische waarde van het huidbiopt bij patiënten met dunnevezelneuropathie is in een richtlijn van de Peripheral Nerve Society beschreven (Lauria, 2010b).
Cornea confocale microscopie
In vivo cornea confocale microscopie (CCM) is een techniek die zich de laatste jaren heeft ontwikkeld en die inmiddels wordt toegepast bij verschillende oogheelkundige en neurologische aandoeningen. CCM is een niet-invasieve test, waarmee verschillende microstructuren van de cornea, waaronder de sub-basale zenuwplexus, in beeld kunnen worden gebracht. Vaak wordt gebruik gemaakt van een semi-automatische foto-analyse om de sub-basale zenuwdichtheid te bepalen, wat zeer arbeidsintensief is. Inmiddels zijn ook automatische analysemethodes ontwikkeld, waarbij helaas ook onderlinge verschillen bestaan.
Er zijn normaalwaarden gepubliceerd, waarbij een afname van zenuwdichtheid wordt gezien bij toenemende leeftijd (Tavakoli, 2015).
Afname van cornea zenuwdichtheid is vooral aangetoond bij diabetische neuropathie, maar ook bij andere neuropathieë zoals Charcot-Marie-Tooth type 1A, hereditaire sensore en autonome neuropathie, immuungemedieerde neuropathie, de ziekte van Fabry en chemotherapie-geïnduceerde neuropathie (Tavakoli, 2010). Het feit dat bij verschillende oogheelkundige, neurologische of systemische aandoeningen een afname van cornea zenuwvezeldichtheid is gevonden, heeft geleid tot veel discussie over de specificiteit van de test.
Een voordeel van de cornea confocale microscopie ten opzichte van het huidbiopt is dat het een non-invasieve methode betreft. De waarde van de test bij de diagnose dunnevezelneuropathie is nog onzeker.
Onderzoeken van de functie van de dunne zenuwvezels
Temperatuurdrempelonderzoek
Quantitative sensory testing (QST) is een onderzoek van sensibele functies, waarbij stimuli van verschillende sterkte worden gebruikt (threshold en suprathreshold stimuli, bijvoorbeeld mechanisch, druk, vibratie, koude, warmte, hitte, koude-pijn en hitte-pijn). Met QST kunnen ook zogenaamde gain-of-function fenomenen worden getest, zoals allodynie en hyperalgesie.
QST kan een bruikbare test zijn bij de diagnose van dunnevezelneuropathie (Devigili, 2008; Hoitsma, 2003; Hoeijmakers, 2012). Verschillende studies hebben een relatie gevonden tussen intra-epidermale zenuwvezeldichtheid en warmte- en koudedrempels, maar de correlatie met specifieke modaliteiten is onduidelijk (Devigili, 2008; Lauria, 2010b). Ook zijn er een aantal studies die op basis van specifieke patronen bij QST bepaalde fenotypes hebben onderscheiden (Vollert, 2017).
QST heeft echter ook een aantal nadelen. Voor een betrouwbaar resultaat van het onderzoek moet de patiënt alert en coöperatief zijn. De test is niet specifiek voor aandoeningen van het perifere zenuwstelsel; dit betekent dat ook bij aandoeningen van het centraal zenuwstelsel (zoals herseninfarct, multipele sclerose) een afwijkend QST kan voorkomen. Met QST kan de schade in het somatosensore systeem niet worden gelokaliseerd (Maier, 2010), en de test kan beïnvloed kan worden door verschillende andere factoren (Yarnitsky, 1994a; Shy, 2003).
Er bestaan consensuscriteria van de International Association for the Study of Pain (IASP) voor het gebruik en de interpretatie van QST in de klinische praktijk (Backonja, 2013). De IASP benadrukt de noodzaak van een gestandaardiseerd protocol, training van staf en het gebruik van normaalwaarden. Voor temperatuurdrempelonderzoek worden doorgaans twee methoden (de methode van levels en de methode van limits) gebruikt, waarbij er een voorkeur is voor de methode van levels, aangezien er daarbij geen afhankelijkheid is van de snelheid van temperatuurverandering (Pertovaara, 1996; Yarnitsky, 1991), en deze methode ook kan worden gebruikt bij kinderen en personen met een mentale beperking (Yarnitsky, 1991; Defrin, 2004). De reproduceerbaarheid van de levelsmethode is vergelijkbaar of beter dan de methode van limits (Yarnitsky, 1994b; Kemler, 2000; Claus, 1990). Het is gebleken dat het combineren van bilaterale warmte- en koude drempels aan handen en voeten bepaald met de ‘method of levels’ tot de hoogste sensitiviteit en specificiteit leidt (Bakkers, 2015).
QST moet worden gebruikt in relatie tot de klinische context en samen met andere testen (Hansson, 2007).
Evoked potentials
Nociceptieve evoked potentials zijn ontwikkeld als testen die onafhankelijk zijn van aandacht en medewerking van de patiënt, en zouden daarom meer objectieve methoden zijn om de geleidingseigenschappen van de dunne zenuwvezels te onderzoeken (Casanova-Molla, 2011; Le Pera, 2002). Bij de laser-evoked potentials (LEPs) en de contact heat-evoked potentials (CHEPs) worden selectief de Aδ- en de C-vezels geactiveerd. Afwijkende LEPS kunnen voorkomen bij afwijkingen op ieder niveau in de pijn-temperatuur-pathway, inclusief de perifere zenuwen, plexus, zenuwwortels, ruggenmerg of hersenstam (Cruccu, 2008). LEPs kunnen weliswaar een bijdrage leveren aan de diagnose sensibele neuropathie, maar door het gebrek aan localiserend vermogen is de test hooguit een ondersteuning voor de diagnose.
Er zijn normaalwaarden beschreven van de CHEPS, waarbij duidelijk werd dat niet bij alle gezonde proefpersonen CHEPSs kunnen worden opgewekt (Lagerburg, 2014). Of verdere technische aanpassingen in bijvoorbeeld basistemperatuur en aantal stimuli de testresultaten kunnen verbeteren, dient nog verder onderzocht te worden (Lagerburg, 2014).
Pain-related evoked potentials (PREPs) kunnen worden opgewekt door transcutane elektrische stimulatie boven de pijndrempel, waarbij de oppervlakkige nociceptieve Aδ-vezels worden geactiveerd (Katsarava, 2006). Bij intra-epidermale elektrische stimulatie zouden selectief de Aδ-vezels worden gestimuleerd. Deze Aδ-selectiviteit kan echter verdwijnen bij stimulus-intensiteiten in de nociceptieve range, wat de klinische toepasbaarheid van de methode beperkt (Mouraux, 2010). Tenslotte bestaat nog de intra-epidermale elektrische stimulatie (IES) waarmee functionele veranderingen in Aδ- en C-vezels bij dunnevezelneuropathie kunnen worden aangetoond (Katsarava, 2006; Inui, 2012; Kodaira, 2014).
Huidrimpeltest
Een gemakkelijk uitvoerbare techniek is de huidrimpeltest om de sympathische zenuwvezelfuncties van handen en voeten te onderzoeken. De huisrimpeltest is gebaseerd op het gegeven dat activatie van de sympathische zenuwvezels in de huid van de vingertoppen tot vasoconstrictie van de vaten leidt, met als gevolg een negatieve druk van het onderliggende weefsel waardoor er rimpels ontstaan (Wilder-Smith, 2015). Zowel onderdompeling in water als applicatie van EMLA (eutectic mixture of local anesthetics) crème zijn een trigger voor deze activatie. Op dit moment wordt de rimpeling van de vingertoppen gegradeerd op een vijf-puntsschaal (Teoh, 2008). Deze gradering is echter subjectief, er zijn nog geen betrouwbare en reproduceerbare normaalwaarden beschikbaar en in de huidige vorm is de interobserver-betrouwbaarheid erg laag (expert opinion). Voor het stellen van de diagnose dunnevezelneuropathie is de test in zijn huidige vorm daarom niet bruikbaar.
Sudoscan
De elektrochemische geleiding (ESC), gemeten met de Sudoscan is een eenvoudige, snelle en niet-invasieve kwantitatieve test die de C-vezel postganglionaire sympathische functie meet van zweetklieren van de handpalmen en voetzolen. De handen en voeten worden geplaatst op een grote plaatelektrode, waarna via een laag voltage op de elektrodes aan chloride stroom door de zweetklieren wordt geïnduceerd. De meeste studies over de Sudoscan werden verricht bij diabetische neuropathie, hoewel ook inconsistente associaties tussen autonome functies en ESC werden beschreven (Ang, 2017). Er is één studie verricht bij 81 patiënten met DVN (waarvan 4 patiënten een gemengde dikke- en dunnevezelneuropathie hadden). In deze studie was de ESC van de voeten verminderd bij patiënten met een verminderde intra-epidermale zenuwvezeldichtheid (IENFD), en bleek er tevens een correlatie te zijn tussen de ESC en de IENFD (Novak, 2016). De waarde van de Sudoscan als een diagnostische test voor dunnevezelneuropathie is nog niet onderzocht.
Deelvraag 3
Welke onderliggende aandoeningen zijn geassocieerd met dunnevezelneuropathie?
Verschillende aandoeningen worden in de literatuur geassocieerd met dunnevezelneuropathie, echter een causaal verband is niet altijd duidelijk. Er kan onderscheid worden gemaakt tussen metabole aandoeningen, immuungemedieerde ziekten, infecties, toxische middelen, medicatie en erfelijke aandoeningen (Devigili, 2008; Peters, 2013; Cazzato, 2017).
In een recente studie werd in een cohort van 921 patiënten met dunnevezelneuropathie een onderliggende aandoening gevonden bij 433 patiënten (47%) (de Greef, 2018). In de standaard diagnostiek was laboratoriumonderzoek voor de volgende aandoeningen opgenomen: diabetes mellitus, glucose-intolerantie, hypercholesterolemie, leverfalen, nierinsufficiëntie, schildklierlijden, vitamine B1 en B12 deficiëntie, vitamine B6 intoxicatie, Coeliakie, morbus Sjögren, overige auto-immuunaandoeningen (positieve ANA, ANCA of verhoogd Soluble Interleukine-2 receptor), monoclonale gammopathie van onbekende significantie (MGUS), ziekte van Lyme, HIV, de ziekte van Fabry en natriumkanaalmutaties. Daarnaast werd in de anamnese gevraagd naar alcoholgebruik, het gebruik van toxische medicatie en de aanwezigheid van andere onderliggende aandoeningen, zoals een maligniteit of hemochromatose. Bij 175 patiënten (19%) was sprake van immunologische aandoeningen, waaronder sarcoïdose (3%), ziekte van Sjögren (1.3%), coeliakie (0.5%), andere auto-immuun aandoeningen (8.8%) en niet-specifieke immunologische laboratorium afwijkingen (6.1%). Bij 8 patiënten was er sprake van twee of meer immunologische aandoeningen. De andere geassocieerde aandoeningen waren natriumkanaal-mutaties (SCN9A (8,5%), SCN10A (4,8%), en SCN11A (3,4%)), diabetes mellitus (7,7%), gestoorde glucosetolerantie (9,7%), vitamine-B12-deficiëntie (4,7%), alcohol-abusus (3,0%), chemotherapie (2,2%), MGUS (1,4%), en hemochromatose (0,3%).
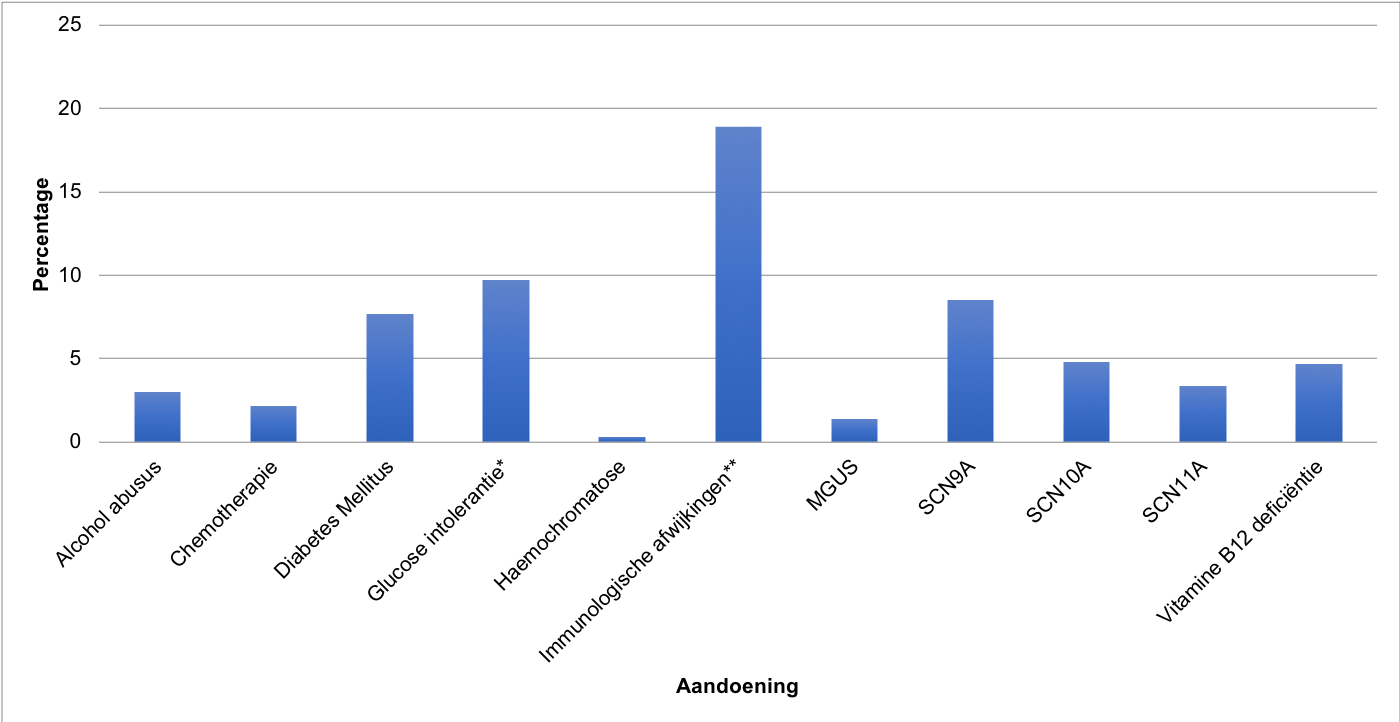
Figuur 1. Prevalentie van mogelijke onderliggende aandoeningen bij patiënten met dunnevezelneuropathie (n=921) (Figuur aangepast uit de Greef, 2018).
* Glucose intolerantie is bij 493 patienten getest.
** Immunologische afwijkingen: sarcoïdose, Sjogren’s disease, coeliakie, andere auto-immuunaandoeningen, en afwijkende immunologische laboratorische bevindingen (antinucleare antistoffen, anti-neutrofiele cytoplasmitische antilichamen, soluble interleukin-2 receptor, anti-tissue transglutaminase en anti-Extractable Nuclear Antigen antilichamen).
MGUS: monoclonal gammopathy of undetermined significance; SCN: sodium voltage-gated channels
Bij 696 patiënten (75,6%) was er geen onderliggende aandoening bekend ten tijde van de verwijzing. In de groep patiënten die al wel bekend waren met één of meer onderliggende aandoeningen ten tijde van de verwijzing (n=225, werden afwijkingen gevonden: afwijkende immunologische laboratorium bevindingen (5,8%), varianten in SCN9A (4,9%), SCN10A (5,8%), SCN11A (3,1%), gestoorde glucosetolerantie (11,4%) en diabetes mellitus (2,7%). In totaal werden bij 60 patiënten (26,7%) uit deze groep aanvullende onderliggende aandoeningen gevonden. Screening voor immunologische aandoeningen zonder specifieke klachten is in het algemeen weinig specifiek. Gezien de zeer lage prevalentie van coeliakie is besloten om niet routinematig hiernaar te screenen. Uit recent onderzoek bij uveitis en huid sarcoïdose blijkt interleukin-2 receptor iets sensitiever en specifieker dan angiotensine converting enzyme (ACE) (Groen-Hakan, 2017). Daarentegen is de bepaling van interleukin-2 receptor niet overal beschikbaar en veel duurder dan bepaling van ACE. Het is daarom te overwegen om interleukin-2 receptor te bepalen bij lokale beschikbaarheid of bij gebruik van ACE-remmers. Een gering verhoogde waarde van beide bepalingen is niet specifiek.
Bij 725 patiënten die zich presenteerden met enkel klachten van een dunnevezelneuropathie werd nooit de ziekte van Fabry aangetoond (de Greef, 2016). Waarschijnlijk is bij volwassen met de ziekte van Fabry een dunnevezelneuropathie slechts zelden de eerste klinische uiting. Cardiaal lijden of renale betrokkenheid zal eerder gezien worden. In de literatuur zijn aanwijzingen dat kinderen met de ziekte van Fabry zich juist wel als eerste kunnen presenteren met het klinisch beeld van een dunnevezelneuropathie.
Onderbouwing
Achtergrond
Dunnevezelneuropathie is geen zeldzame aandoening: een minimum incidentie van 12 per 100.000 inwoners per jaar (gemeten tussen 2010 en 2011) en een minimum prevalentie van 53 per 100.000 personen werd gevonden in een epidemiologische studie in Zuid-Nederland (Peters, 2013). De aandoening kan ook voorkomen bij kinderen, maar wordt daar mogelijk minder goed herkend.
Dunnevezelneuropathie heeft een grote impact op de kwaliteit van leven (Bakkers, 2014). Daarnaast zijn de kosten van chronische neuropathische pijn hoog, en gerelateerd aan de ernst van de pijn (Hlubocky, 2010; Schaefer, 2014a; Schaefer, 2014b).
Met dunnevezelneuropathie wordt een geïsoleerde dunnevezelneuropathie bedoeld, wat betekent dat er geen betrokkenheid is van dikke zenuwvezels. Als dat wel het geval is, is er sprake van een polyneuropathie. Bij een polyneuropathie kunnen ook dunne zenuwvezels zijn betrokken, wat kan blijken uit bijvoorbeeld pijnklachten (zoals bij pijnlijke diabetische polyneuropathie). Indien er al sprake is van een (dikke zenuwvezel) polyneuropathie (afwezige reflexen, spierzwakte, afwijkend zenuwgeleidingsonderzoek) voegt onderzoek naar intra-epidermale zenuwvezeldichtheid niets meer toe, aangezien dit de diagnose of het beleid niet meer zal veranderen. Daarom is zenuwgeleidingsonderzoek de eerste stap bij verdenking op een dunnevezelneuropathie. Bij een geïsoleerde dunnevezelneuropathie is zenuwgeleidingsonderzoek niet afwijkend.
Een echte gouden standaard voor het stellen van de diagnose dunnevezelneuropathie ontbreekt, hoewel het huidbiopt vaak wordt beschouwd als een surrogaat gouden standaard. Volgens de huidige internationale criteria wordt de diagnose gesteld op basis van het klinische beeld (pijn met daarbij tekenen van disfunctie van de dunne zenuwvezels: verminderde pijnzin (pinprick), allodynie en/of hyperalgesie) in combinatie met een verlaagde intra-epidermale zenuwvezeldichtheid in het huidbiopt. Met de combinatie van een typisch klinisch beeld en een afwijkend QST kan een waarschijnlijkheidsdiagnose dunnevezelpolyneuropathie worden gesteld (CONCEPPT meeting 2018, publicatie in voorbereiding) (Hansson, 2007; Cazzato, 2017).
Samenvatting literatuur
Er is geen systematische literatuuranalyse verricht.
Zoeken en selecteren
Voor deze vraag is geen systematische literatuuranalyse verricht. Wel is een literatuursearch uitgevoerd naar de volgende vragen:
- Wat is de waarde van diverse diagnostische testen bij het vaststellen van dunnevezelneuropathie?
- Welk laboratoriumonderzoek is geïndiceerd bij dunnevezelneuropathie om onderliggende aandoeningen op te sporen?
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 6 maart 2018 met relevante zoektermen gezocht naar artikelen vanaf 2005 over de diagnostiek van dunnevezelneuropathie. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 354 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: 1. Patiënten met een verdenking op dunnevezelneuropathie; 2. diagnostische testen; 3. diagnostische waarde: sensitiviteit en specificiteit. Deze studies zijn aangevuld met achtergrondartikelen welke reeds bij de werkgroep bekend waren.
Referenties
- Ang L, Jaiswal M, Callaghan B, Raffel D, M BB, Pop-Busui R. Sudomotor dysfunction as a measure of small fiber neuropathy in type 1 diabetes. Auton Neurosci 2017;205:87-92.
- Backonja MM, Attal N, Baron R, et al. Value of quantitative sensory testing in neurological and pain disorders: NeuPSIG consensus. Pain 2013;154:1807-19.
- Bakkers M, Faber CG, Hoeijmakers JG, Lauria G, Merkies IS. Small fibers, large impact: quality of life in small-fiber neuropathy. Muscle & nerve 2014;49:329-36.
- Bakkers M, Merkies IS, Lauria G, et al. Intraepidermal nerve fiber density and its application in sarcoidosis. Neurology 2009;73:1142-8.
- Bakkers M, Faber CG, Reulen JP, Hoeijmakers JG, Vanhoutte EK, Merkies IS. Optimizing temperature threshold testing in small-fiber neuropathy. Muscle & nerve 2015;51:870-6.
- Blackmore D, Siddiqi ZA. Diagnostic Criteria for Small Fiber Neuropathy. J Clin Neuromuscul Dis 2017;18:125-31.
- Brouwer BA, Bakkers M, Hoeijmakers JG, Faber CG, Merkies IS. Improving assessment in small fiber neuropathy. J Peripher Nerv Syst 2015;20:333-40.
- Casanova-Molla J, Grau-Junyent JM, Morales M, Valls-Sole J. On the relationship between nociceptive evoked potentials and intraepidermal nerve fiber density in painful sensory polyneuropathies. Pain 2011;152:410-8.
- Cazzato D, Lauria G. Small fibre neuropathy. Current Opinion in Neurology 2017;30:490-9.
- Claus D, Hilz MJ, Neundorfer B. Thermal discrimination thresholds: a comparison of different methods. Acta neurologica Scandinavica 1990;81:533-40.
- Cruccu G, Aminoff MJ, Curio G, et al. Recommendations for the clinical use of somatosensory-evoked potentials. Clin Neurophysiol 2008;119:1705-19.
- Defrin R, Pick CG, Peretz C, Carmeli E. A quantitative somatosensory testing of pain threshold in individuals with mental retardation. Pain 2004;108:58-66.
- Devigili G, Tugnoli V, Penza P, et al. The diagnostic criteria for small fibre neuropathy: from symptoms to neuropathology. Brain 2008;131:1912-25.
- Gemignani F, Ferrari G, Vitetta F, Giovanelli M, Macaluso C, Marbini A. Non-length-dependent small fibre neuropathy. Confocal microscopy study of the corneal innervation. Journal of neurology, neurosurgery, and psychiatry 2010;81:731-3.
- Gorson KC, Herrmann DN, Thiagarajan R, et al. Non-length dependent small fibre neuropathy/ganglionopathy. Journal of neurology, neurosurgery, and psychiatry 2008;79:163-9.
- Greef BTA de, Hoeijmakers JGJ, Gorissen-Brouwers CML, Geerts M, Faber CG, Merkies ISJ. Associated conditions in small fiber neuropathy - a large cohort study and review of the literature. Eur J Neurol 2018;25:348-55.
- Greef BT de, Hoeijmakers JG, Wolters EE, et al. No Fabry Disease in Patients Presenting with Isolated Small Fiber Neuropathy. PLoS One 2016;11:e0148316.
- Hansson P, Backonja M, Bouhassira D. Usefulness and limitations of quantitative sensory testing: clinical and research application in neuropathic pain states. Pain 2007;129:256-9.
- Groen-Hakan F, Eurelings L, ten Berge JC, van Laar J, Ramakers CRB, Dik WA, Rothova A. Diagnostic Value of Serum-Soluble Interleukin 2 Receptor Levels vs Angiotensin-Converting Enzyme in Patients With Sarcoidosis-Associated Uveitis. JAMA Ophthalmol. 2017 Dec 1;135(12):1352-1358. doi: 10.1001/jamaophthalmol.2017.4771. PubMed PMID: 29121154.
- Hlubocky A, Wellik K, Ross MA, et al. Skin biopsy for diagnosis of small fiber neuropathy: a critically appraised topic. Neurologist 2010;16:61-3.
- Hoeijmakers JG, Faber CG, Lauria G, Merkies IS, Waxman SG. Small-fibre neuropathies--advances in diagnosis, pathophysiology and management. Nature reviews Neurology 2012;8:369-79.
- Hoeijmakers JG, Faber CG, Merkies IS, Waxman SG. Painful peripheral neuropathy and sodium channel mutations. Neurosci Lett 2015;596:51-9.
- Hoitsma E, Drent M, Verstraete E, et al. Abnormal warm and cold sensation thresholds suggestive of small-fiber neuropathy in sarcoidosis. Clin Neurophysiol 2003;114:2326-33.
- Inui K, Kakigi R. Pain perception in humans: use of intraepidermal electrical stimulation. Journal of neurology, neurosurgery, and psychiatry 2012;83:551-6.
- Katsarava Z, Ayzenberg I, Sack F, Limmroth V, Diener HC, Kaube H. A novel method of eliciting pain-related potentials by transcutaneous electrical stimulation. Headache 2006;46:1511-7.
- Kemler MA, Reulen JP, van Kleef M, Barendse GA, van den Wildenberg FA, Spaans F. Thermal thresholds in complex regional pain syndrome type I: sensitivity and repeatability of the methods of limits and levels. Clin Neurophysiol 2000;111:1561-8.
- Kodaira M, Inui K, Kakigi R. Evaluation of nociceptive Adelta- and C-fiber dysfunction with lidocaine using intraepidermal electrical stimulation. Clin Neurophysiol 2014;125:1870-7.
- Lagerburg V, Bakkers M, Bouwhuis A, et al. Contact heat evoked potentials: Normal values and use in small fiber neuropathy. Muscle & nerve 2014.
- Lauria G, Bakkers M, Schmitz C, et al. Intraepidermal nerve fiber density at the distal leg: a worldwide normative reference study. J Peripher Nerv Syst 2010;15:202-7.
- Lauria G, Dacci P, Lombardi R, et al. Side and time variability of intraepidermal nerve fiber density. Neurology 2015;84:2368-71.
- Lauria G, Hsieh ST, Johansson O, et al. European Federation of Neurological Societies/Peripheral Nerve Society Guideline on the use of skin biopsy in the diagnosis of small fiber neuropathy. Report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society. Eur J Neurol 2010;17:903-12, e44-9.
- Le Pera D, Valeriani M, Niddam D, Chen AC, Arendt-Nielsen L. Contact heat evoked potentials to painful and non-painful stimuli: effect of attention towards stimulus properties. Brain Topogr 2002;15:115-23.
- Maier C, Baron R, Tölle TR, et al. Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS): Somatosensory abnormalities in 1236 patients with different neuropathic pain syndromes. PAIN 2010;150:439-50.
- Mouraux A, Iannetti GD, Plaghki L. Low intensity intra-epidermal electrical stimulation can activate Adelta-nociceptors selectively. Pain 2010;150:199-207.
- Novak P. Electrochemical Skin Conductance Correlates with Skin Nerve Fiber Density. Front Aging Neurosci 2016;8:199.
- Pertovaara A, Kauppila T, Hamalainen MM. Influence of skin temperature on heat pain threshold in humans. Experimental brain research 1996;107:497-503.
- Peters MJ, Bakkers M, Merkies IS, Hoeijmakers JG, van Raak EP, Faber CG. Incidence and prevalence of small-fiber neuropathy: a survey in the Netherlands. Neurology 2013;81:1356-60.
- Saperstein DS, Levine TD, Levine M, Hank N. Usefulness of skin biopsies in the evaluation and management of patients with suspected small fiber neuropathy. Int J Neurosci 2013;123:38-41.
- Schaefer C, Mann R, Sadosky A, et al. Health status, function, productivity, and costs among individuals with idiopathic painful peripheral neuropathy with small fiber involvement in the United States: results from a retrospective chart review and cross-sectional survey. Journal of medical economics 2014;17:394-407.
- Schaefer C, Sadosky A, Mann R, et al. Pain severity and the economic burden of neuropathic pain in the United States: BEAT Neuropathic Pain Observational Study. ClinicoEconomics and outcomes research : CEOR 2014;6:483-96.
- Shy ME, Frohman EM, So YT, et al. Quantitative sensory testing: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2003;60:898-904.
- Tavakoli M, Ferdousi M, Petropoulos IN, et al. Normative values for corneal nerve morphology assessed using corneal confocal microscopy: a multinational normative data set. Diabetes Care 2015;38:838-43.
- Tavakoli M, Marshall A, Pitceathly R, et al. Corneal confocal microscopy: a novel means to detect nerve fibre damage in idiopathic small fibre neuropathy. Exp Neurol 2010;223:245-50.
- Teoh HL, Chow A, Wilder-Smith EP. Skin wrinkling for diagnosing small fibre neuropathy: comparison with epidermal nerve density and sympathetic skin response. Journal of neurology, neurosurgery, and psychiatry 2008;79:835-7.
- Vollert J, Maier C, Attal N, et al. Stratifying patients with peripheral neuropathic pain based on sensory profiles: algorithm and sample size recommendations. PAIN 2017.
- Wilder-Smith EP. Stimulated skin wrinkling as an indicator of limb sympathetic function. Clin Neurophysiol 2015;126:10-6.
- Yarnitsky D, Ochoa JL. Warm and cold specific somatosensory systems. Psychophysical thresholds, reaction times and peripheral conduction velocities. Brain 1991;114 ( Pt 4):1819-26.
- Yarnitsky D, Sprecher E, Tamir A, Zaslansky R, Hemli JA. Variance of sensory threshold measurements: discrimination of feigners from trustworthy performers. J Neurol Sci 1994a;125:186-9.
- Yarnitsky D, Sprecher E. Thermal testing: normative data and repeatability for various test algorithms. J Neurol Sci 1994b;125:39-45.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 05-07-2019
Beoordeeld op geldigheid : 23-08-2019
Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Neurologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Neurologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is het verbeteren van de zorg voor patiënten met polyneuropathie, met name betere diagnostiek naar de oorzaak van subacute en chronische polyneuropathie.
Doelgroep
De richtlijn is primair bedoeld voor neurologen en patiënten, maar kan ook gebruikt worden door huisartsen en andere beroepsgroepen die te maken hebben met patiënten met polyneuropathie, zoals internisten, anesthesiologen en revalidatieartsen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is een werkgroep ingesteld, bestaande uit neurologen, AIOS neurologie en een patiëntenvertegenwoordiger.
De werkgroepleden zijn door hun beroepsvereniging gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Prof. dr. N.C. (Nicolette) Notermans, neuroloog, Universitair Medisch Centrum Utrecht, NVN (voorzitter)
- C. (Charlotte) van Esch, MSc, medewerker kwaliteit van zorg, Spierziekten Nederland
- Dr. C. (Camiel) Verhamme, neuroloog/klinisch neurofysioloog, Academisch Medisch Centrum Amsterdam, NVN
- Prof. dr. P.A. (Pieter) van Doorn, neuroloog, Erasmus MC Rotterdam, NVN
- Prof. dr. C.G. (Karin) Faber, neuroloog, Maastricht UMC+, NVN
- Drs. X.L. (Xenia) Stalpers, neuroloog, Máxima Medisch Centrum, Eindhoven/Veldhoven, NVN
- Dr. M. (Marijke) Eurelings, neuroloog, Spaarnegasthuis Haarlem/Hoofddorp, NVN
- Dr. F. (Filip) Eftimov, neuroloog, Academisch Medisch Centrum, Amsterdam, NVN
- Dr. A.F.J.E. (Alexander) Vrancken, neuroloog, Universitair Medisch Centrum Utrecht, persoonlijke titel
- Dr. I.W.M. (Inge) van Uden, AIOS neurologie, Radboud Universitair Medisch Centrum Nijmegen, NVN
- Dr. K. (Karlien) Mul, AIOS neurologie, Radboud Universitair Medisch Centrum Nijmegen, NVN
- I.J.T. (Ingrid) Herraets, MSc, AIOS neurologie, Elisabeth-Tweesteden ziekenhuis Tilburg , NVN
Met dank aan:
- Dr. H.S. (Stephan) Goedee, neuroloog en klinisch neurofysioloog, UMC Utrecht
- Dr. W.G.M. (Wim) Jansen, revalidatiearts, Erasmus MC Rotterdam
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten. Aangezien de richtlijn met name diagnostiek van polyneuropathie en de behandeling van onderliggende oorzaken van polyneuropathie omvat, werden genoemde nevenfuncties niet als conflicterende belangen beschouwd en is er geen actie ondernomen.
|
Werkgroeplid |
Gemelde nevenfuncties en mogelijke belangen |
|
van Doorn |
|
|
Eftimov |
|
|
van Esch |
|
|
Eurelings |
|
|
Faber |
|
|
Herraets |
|
|
Mul |
|
|
Notermans |
|
|
Stalpers |
Geen |
|
van Uden |
Geen |
|
Verhamme |
|
|
Vrancken |
|
Inbreng patiëntenperspectief
Patiënten met diverse typen polyneuropathieën waren aanwezig bij de invitational conference bij de initiatie van de huidige richtlijn. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tevens heeft een medewerker van Spierziekten Nederland actief geparticipeerd in de werkgroep en waar nodig ruggenspraak gehouden met de achterban. Dit lid van de werkgroep heeft tevens het module Organisatie van Zorg gecoördineerd.
Patiëntenvertegenwoordigers hebben tijdens de invitational conference aangegeven dat zij de volgende aspecten van belang vinden:
- Vaststellen van behandelbare oorzaken van polyneuropathie
- De behandeling van neuropathische pijn. Tijdens de invitational conference werd besproken dat neuropathische pijn niet binnen de herziening van de richtlijn valt. Wel zal in de module over behandeling een korte samenvatting van de behandeling van neuropathische pijn worden gegeven
- Beschrijven wanneer verwijzing naar de revalidatiearts zinvol is;
- Bijdragen aan kennis over dunnevezelneuropathie en de onderliggende oorzaken, zodat een behandelplan kan worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de afzonderlijke modules.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen in de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Niet alle uitgangsvragen leenden zich voor een systematische literatuuranalyse. Voor de vragen waarvoor wel een systematische literatuuranalyse is gedaan, zijn de individuele studies systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. Voor beoordeling van de RoB zijn de ACROBAT-NRS – voor observationeel onderzoek en QUADAS II – voor diagnostisch onderzoek gebruikt.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en de generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken wetenschappelijke vereniging en patiëntenorganisatie voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2005 – maart 2018
|
1 exp Small Fiber Neuropathy/ or 'small fiber neuropath*'.ab,ti. or 'small fibre neuropath*'.ab,ti. (686) 2 limit 1 to (yr="2005 -Current" and english language) (555) 3 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (345438) 4 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1731411) 5 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2924067) 6 2 and 3 (15) 7 2 and 4 (55) 8 2 and 5 (169) 9 6 or 7 or 8 (213)
= 213 (202 uniek)
|
354 |
|
Embase (Elsevier) |
('small fiber neuropathy'/exp OR 'small fiber neuropath*':ab,ti OR 'small fibre neuropath*':ab,ti)
AND [2005-2018]/py AND [english]/lim
AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) OR ((('small fiber neuropathy'/exp OR 'small fiber neuropath*':ab,ti OR 'small fibre neuropath*':ab,ti) AND [2005-2018]/py) AND (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)) OR ((('small fiber neuropathy'/exp OR 'small fiber neuropath*':ab,ti OR 'small fibre neuropath*':ab,ti) AND [2005-2018]/py) AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)))
= 245 (242 uniek) |
