Pijn- en revalidatiebehandeling bij polyneuropathie
Uitgangsvraag
Wanneer is pijn- en/of revalidatiebehandeling voor patiënten met een polyneuropathie geïndiceerd?
Aanbeveling
Revalidatie
- Verwijs patiënten met enkelvoudig lichte problematiek naar therapeuten in de eerste lijn en overweeg een verwijzing naar een revalidatiearts voor nader advies.
- Verwijs patiënten met complexere problemen naar een revalidatiearts met kennis van neuromusculaire aandoeningen.
Pijnbehandeling
- Ga voor de behandeling van chronische pijn bij polyneuropathie uit van het biopsychosociale model, en besteed daarbij ook aandacht aan het verwachtingsmanagement. Zie ook Zorgstandaard Chronisch pijn.
- Volg voor medicamenteuze behandeling van chronische pijn bij polyneuropathie de pijnladder zoals aangegeven in deze module. Wees terughoudend met voorschrijven met (langwerkende) opioïden.
- Overweeg op indicatie om patiënten te verwijzen naar de revalidatiearts.
- Overweeg op indicatie om patiënten te verwijzen naar de psychiater.
Overwegingen
Revalidatiebehandeling bij polyneuropathieën
Indien patiënten met een polyneuropathie problemen ervaren die invloed hebben op de participatie in de maatschappij, op autonomie en op het zelfstandig functioneren, dan kan revalidatiezorg geïndiceerd zijn. Bijvoorbeeld bij balans- en valproblemen, omgaan met vermoeidheid en pijn en/of problemen met het lopen of als gevolg van toenemende spierzwakte. De revalidatiearts kan naast directe adviezen en het voorschrijven van hulpmiddelen zoals orthesen, ook een revalidatieteam inschakelen en aansturen en chronische pijn begeleiden. De eisen die aan het revalidatie behandelaanbod worden gesteld bij polyneuropathieën wordt enerzijds bepaald door de veelheid van problemen op de verschillende functionele domeinen die hieronder zijn beschreven en de ernst van de problematiek per domein. Tevens wordt dit bepaald door het al dan niet aanwezig zijn (en de ernst en complexiteit) van de multi-orgaansysteemproblematiek (multimorbiditeit) zoals hart-/longproblemen, maag-/darmproblemen, slik-/spraakstoornissen), vitale functies en andere somatische problemen. Daarnaast speelt de mate van progressie van de spierziekte een rol en de te verwachten problematiek als gevolg van de spierziekte.
Functionele domeinen:
- Medische problematiek (orgaanproblemen)
- Mobiliteit
- Communicatie
- Persoonlijke verzorging
- Dagbesteding
- Cognitie en psychosociale aspecten
- Relaties
Patiënten met enkelvoudige lichte problematiek kunnen verwezen worden naar therapeuten in de eerste lijn of er kan worden overwogen te verwijzen naar een revalidatiearts voor nader advies. Patiënten die complexe problemen ervaren als gevolg van een polyneuropathie wordt geadviseerd de revalidatiearts met kennis van neuromusculaire aandoeningen te consulteren. Indien matig complexe tot ernstige problemen zich voordoen kunnen overige disciplines worden ingeschakeld zoals de fysiotherapeut, ergotherapeut, logopedist, maatschappelijk werker, psycholoog etc.
Meer informatie: https://revalidatiegeneeskunde.nl/behandelkaders.
Verscheidene revalidatie-instellingen beschikken over een multidisciplinair spierziekterevalidatieteam met expertise in de behandeling en begeleiding van patiënten met een spierziekte. Voor advies en met vragen over polyneuropathieën rondom problemen in het dagelijks leven als gevolg van een polyneuropathie kunt u contact opnemen met de spierziekterevalidatieteams. Zie https://www.spierziekten.nl/zorgwijzer/ voor de adressen.
Behandeling van neuropathische pijn
Voor het behandelen van chronische neuropathische pijn wordt uitgegaan van het biopsychosociale model (zie figuur 1) en wordt gewerkt volgens de zorgstandaard chronische pijn (integrale, multidisciplinaire aanpak volgens stepped care principe) (Zorgstandaard chronische pijn 2017). Na het stellen van de diagnose en voor het starten van de behandeling is het essentieel om te werken aan het verwachtingsmanagement samen met de patiënt (tools hiervoor worden verderop in het document besproken). Voor meer informatie: https://www.ntvg.nl/system/files/publications/2004125350001a.pdf
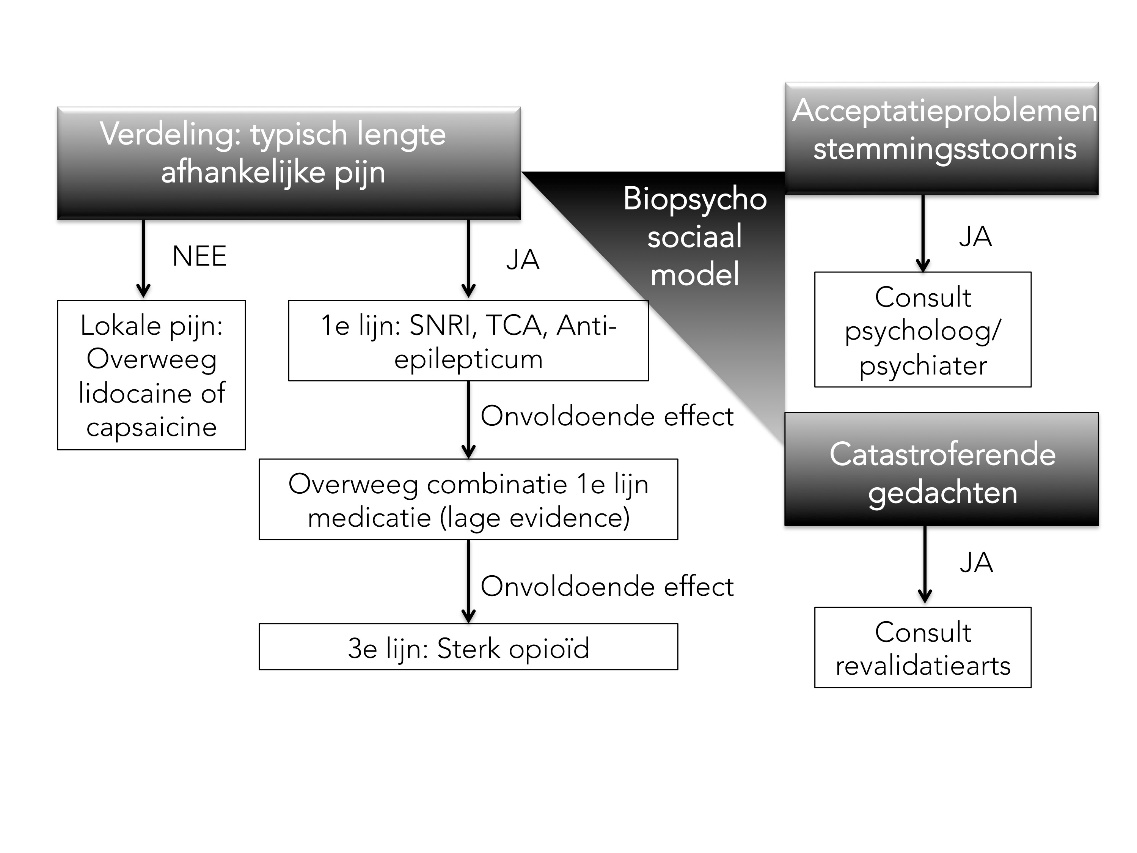
Figuur 1. Behandeling volgens het biopsychosociale model
Bron: Zorgstandaard chronische pijn, 2017. Afkortingen: SNRI: serotonine-noradrenalin reuptake inhibitors; TCA: tricyclische antidepressiva.
Naast lichamelijke factoren kunnen ook psychologische, socio-economische en culturele factoren de pijnbeleving en het voortbestaan van de pijn beïnvloeden. Om de behandeling voor de individuele patiënt te optimaliseren is een multidisciplinaire benadering conform het bio-psychosociale model noodzakelijk (Abdulla, 2013).
Medicamenteuze behandeling
Het effect van medicamenteuze behandeling is beperkt: minder dan 50% van de patiënten zal maximaal 50% pijnvermindering ervaren (Attal, 2010; Finnerup, 2015). Voor de medicamenteuze behandeling van neuropathische pijn zijn er drie typen middelen beschikbaar: antidepressiva (serotonine-noradrenalin reuptake inhibitors (SNRIs) en tricyclische antidepressiva (TCAs)), anti-epileptica (gabapentine en pregabaline) en opioïden. Het effect van de meeste middelen kan pas goed na enkele weken worden beoordeeld. De behandeling kan men pas als niet-effectief beschouwen indien het middel meerdere malen is opgehoogd en voldoende lang is geprobeerd in adequate dosering (minimaal 3 weken). Bedenk dat in de opbouwfase de bijwerkingen op de voorgrond staan en het effect nog beperkt is.
Eerstelijnmiddelen: antidepressiva of anti-epileptica
De eerstelijnkeuzes zijn antidepressiva (TCA of SNRI) of anti-epileptica (gabapentine of pregabaline). Welk middel er als eerste middel gestart wordt is met name afhankelijk van de mogelijke interacties en bijwerkingen (zie figuur 2). Voorts kan de number-needed-to-treat meegenomen worden in de overweging (Finnerup, 2015; zie tabel 1). Start de behandeling met een lage dosering, en bouw de dosis geleidelijk op, op geleide van het effect en de bijwerkingen.
Indien dit onvoldoende is, kan worden gekozen voor een combinatie van middelen (figuur 1)
De eerstelijns medicamenteuze behandeling kan zowel door de huisarts als door de neuroloog worden opgestart. Als de huisarts de medicamenteuze behandeling op zich neemt, wordt wel geadviseerd dat de neuroloog een behandelplan meegeeft voor de huisarts.
Tweedelijn: combinatie van middelen
Indien de eerstelijnsbehandeling onvoldoende is en starten van opioïden wordt overwogen, dient patiënt te worden verwezen naar een chronische-pijnpoli.
Derdelijn: opioïden
Indien de antidepressiva en anti-epileptica niet toereikend zijn kan overwogen worden om te starten met langwerkende opioïden. Gezien de problemen op langere termijn (gewenning, morbiditeit en mortaliteit) wordt geadviseerd om dit alleen in gespecialiseerde centra voor te schrijven en continu bewust te zijn van de mogelijke (ernstige) nadelen (Labianca, 2012; Christie, 2008; Chou, 2015). Kortwerkende opioïden dienen te worden vermeden en patiënten moeten door de voorschrijver opgevolgd worden zolang ze opioïden gebruiken.
Een dosisequivalent vanaf 90 mg morfine is geassocieerd met verhoogde kans op mortaliteit (Garg, 2017) en dient daarom voor de indicatie chronisch neuropathische pijn niet overschreden te worden (dit staat gelijk aan een equivalent van bijvoorbeeld fentanylpleister 50 microgram per uur en oxycodon 2dd 40mg). Wanneer een patiënt geen effect heeft van een lage dosering opioïden, dan is de verwachting dat deze ook geen effect heeft van hogere doseringen.
Lokale behandeling
Indien lokale pijn overweeg TENS/capsaïcine/lidocainezalf.
De evidence hiervoor is laag, echter de kans op complicaties/bijwerkingen is ook laag.
Tabel 1 NNT (50% pijnreductie) neuropathische pijnstilling Bron: Finnerup, 2015
|
Middel |
Number-needed-to-treat |
Voor- en nadelen |
|
TCA |
3.6 |
Voorzichtigheid is geboden bij glaucoom, orthostase, ECG-afwijkingen zoals AV-geleidingsstoornissen en QT-verlenging, recent myocardinfarct, nierfunctiestoornissen, leverfunctiestoornissen, suïcidale gedachten, gebruik van andere antidepressiva en leeftijd > 65 jaar. Verhoogd risico op valincidenten. |
|
SNRI (duloxetine of venlafaxine) |
6.4 |
Contra-indicaties zijn ernstige nierfunctiestoornissen, leverfunctiestoornissen, ongecontroleerde hypertensie. Voorzichtig met combinatie andere antidepressiva en tramadol, en met middelen die de bloedstolling verminderen. |
|
gabapentine |
7.2 |
Voordeel: weinig interacties, geen invloed op leverenzymen. Pas op met oedeem in benen. Kan angst verminderen, maar soms ook verergeren. Soms myoclonieën en andere bewegingsstoornissen |
|
pregabaline |
7.7 |
|
|
Zwakke opioïden |
4.7 |
Relatief veel bijwerkingen, matig effect. Veel interacties, onder andere met antidepressiva. |
|
Sterke opioïden |
4.3
|
In principe te vermijden bij chronische niet-maligne pijn; indien dit wordt overwogen, verwijs patiënt naar een centrum met ervaring. Uitleg aan patiënt bijwerkingen op lange termijn: verslaving, depressie, osteoporose, erectiestoornissen, allodynie; bij hogere doseringen verhoogde kans op mortaliteit. |
Behandelprincipes
- Start met lage doseringen, bijvoorbeeld Amitriptyline 10 mg, bij Duloxetine 30mg, Pregabaline 2dd75 mg, Gabapentine 3dd100mg.
- Streef een gemiddelde pijnscore (NRS) <4 na en vraag of de pijn te accepteren is. Volledig pijnvrij is meestal niet haalbaar (voorlichting).
- Vervolg de patiënt met behulp van de NRS-score, bijvoorbeeld 1 keer per 2-3 weken, waarbij medicatie stapsgewijs getitreerd of gewijzigd wordt.
- Vraag structureel naar bijwerkingen.
De behandeling kan men als niet-effectief beschouwen indien het middel meerdere malen is opgehoogd, en voldoende lang is geprobeerd in adequate dosering (minimaal 3 weken).
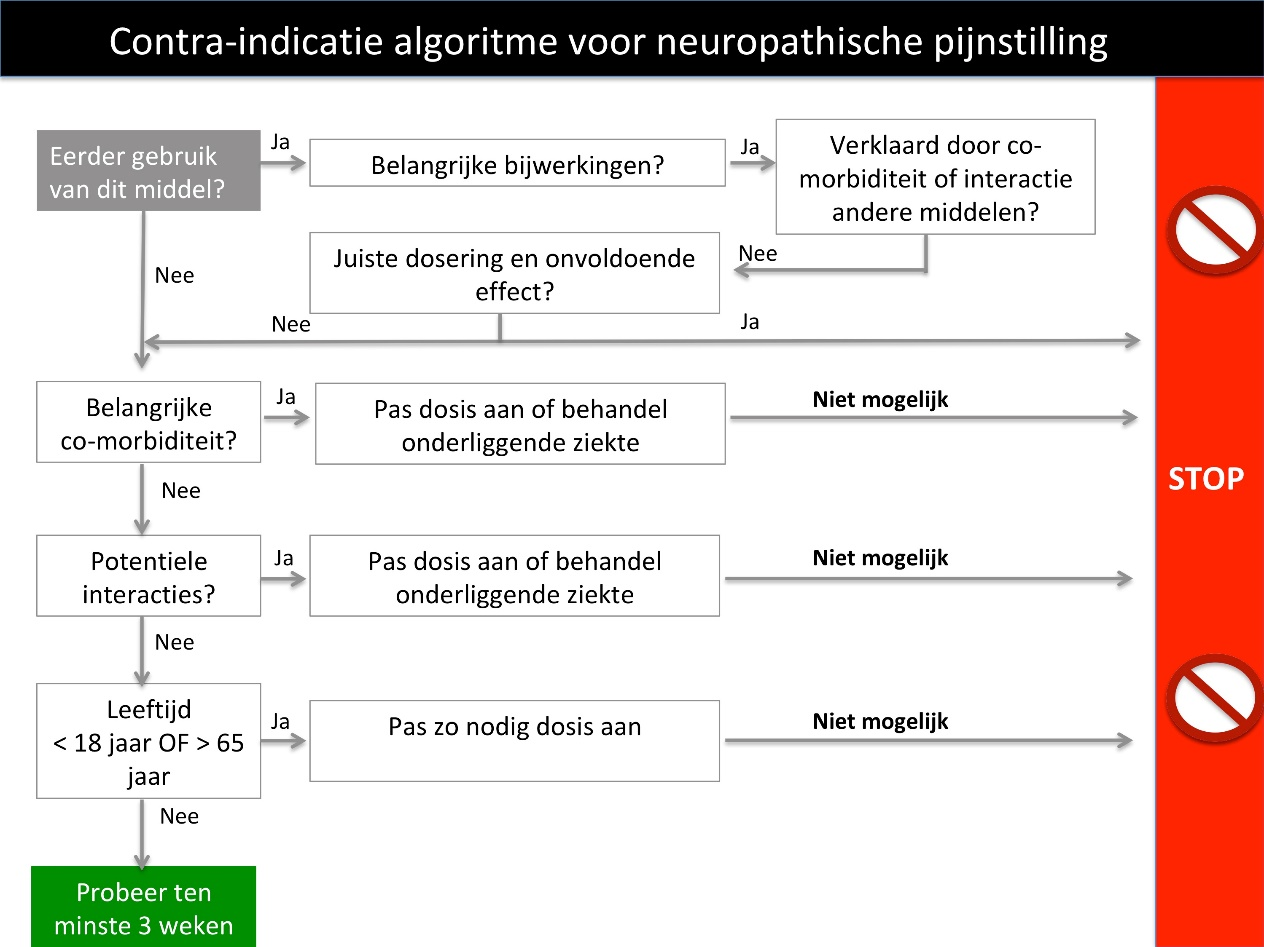
Figuur 2 Algoritme voor neuropathische pijnstilling op basis van contra-indicaties
Bron: Brouwer, B. A., de Greef, B. T. A., Hoeijmakers, J. G. J., Geerts, M., van Kleef, M., Merkies, I. S. J., & Faber, C. G. (2015). Neuropathic Pain due to Small Fiber Neuropathy in Aging: Current Management and Future Prospects. Drugs & Aging, 32(8), 611–621.
Bij patiënten ouder dan 65 jaar dienen tricyclische antidepressiva in principe te worden vermeden, vanwege het risico op bijwerkingen/complicaties (ritmestoornissen, sufheid, hypotensie met verhoogd valrisico, cognitieve effecten, anticholinergische bijwerkingen (American Geriatrics Society, 2009). Wees alert op comorbiditeit zoals lever- en nierfunctiestoornissen en cardiale aandoeningen.
Niet-medicamenteuze behandelingen
Verwijzing psychiater:
Indien verdenking op stemmingsstoornis en/of tekenen van suïcidaliteit.
Bruikbare screeningstool: Hospital Anxiety and Depression scale (HADS)
Indicaties voor verwijzing: Score 11 of hoger op de depressie- of angst-subschaal (http://www.meetinstrumentenzorg.nl)
Verwijzing naar revalidatiearts:
Indien patiënt catastroferende gedachten heeft over de pijn en patiënt doelen kan formuleren ten aanzien van onder andere werkhervatting/ activiteiten/ participatie.
Bruikbare screeningstool: Pain Catastrophizing Scale (PCS)
(http://www.meetinstrumentenzorg.nl)
Indicaties voor verwijzing naar revalidatiearts: Score 31 of hoger (PCS)
Verwijzing naar gespecialiseerd fysiotherapeut:
Indien angst voor bewegen een rol speelt, kan Graded activity en Graded Exposure behandeling zinvol zijn. Dit kan via een gespecialiseerd fysiotherapeut of via de revalidatiearts
Verwijzing naar psycholoog:
Indicaties: acceptatieproblematiek of relatieproblemen (veranderde rolpatronen, etc.)
Verwijzing naar multidisciplinair pijnteam
Indien eerstelijns middelen onvoldoende effect hebben en opioïden overwogen worden.
Indien er een indicatie is voor neuromodulatie (pijnlijke diabetische polyneuropathie met overwegend pijn in de benen)
Verwachtingsmanagement
Voordat de behandeling gestart wordt, moet er aandacht besteed worden aan het verwachtingsmanagement van de patiënt en educatie over de verschillende behandelopties, waarbij de verschillende aspecten worden uitgelegd aan de hand van figuur 3. Ook dit kan via de huisarts plaatsvinden, mits de goede informatie aan de huisarts wordt verstrekt.
Aan bod moet in elk geval komen:
- dat minder dan 50% van de patiënten meer dan 50% pijnreductie ervaart door medicamenteuze behandeling;
- dat chronische pijn een multifactorieel probleem is (biopsychosociaal) en dat deze factoren elkaar beïnvloeden;
- dat voor de individuele patiënt verschillende factoren invloed kunnen hebben op de pijnervaring, met hierbij aandacht voor eigen rol en zelfmanagement;
- de mogelijkheden tot neuropathische pijnstilling met medicatieschema (met mogelijke risico’s en voordelen per medicatie voor deze individuele patiënt.
Handige links om aan de patiënt mee te geven:
https://www.spieracademie.nl/ (e-learning: omgaan met pijn), de themapagina https://www.spierziekten.nl/themas/pijn/ of https://www.retrainpain.org/.
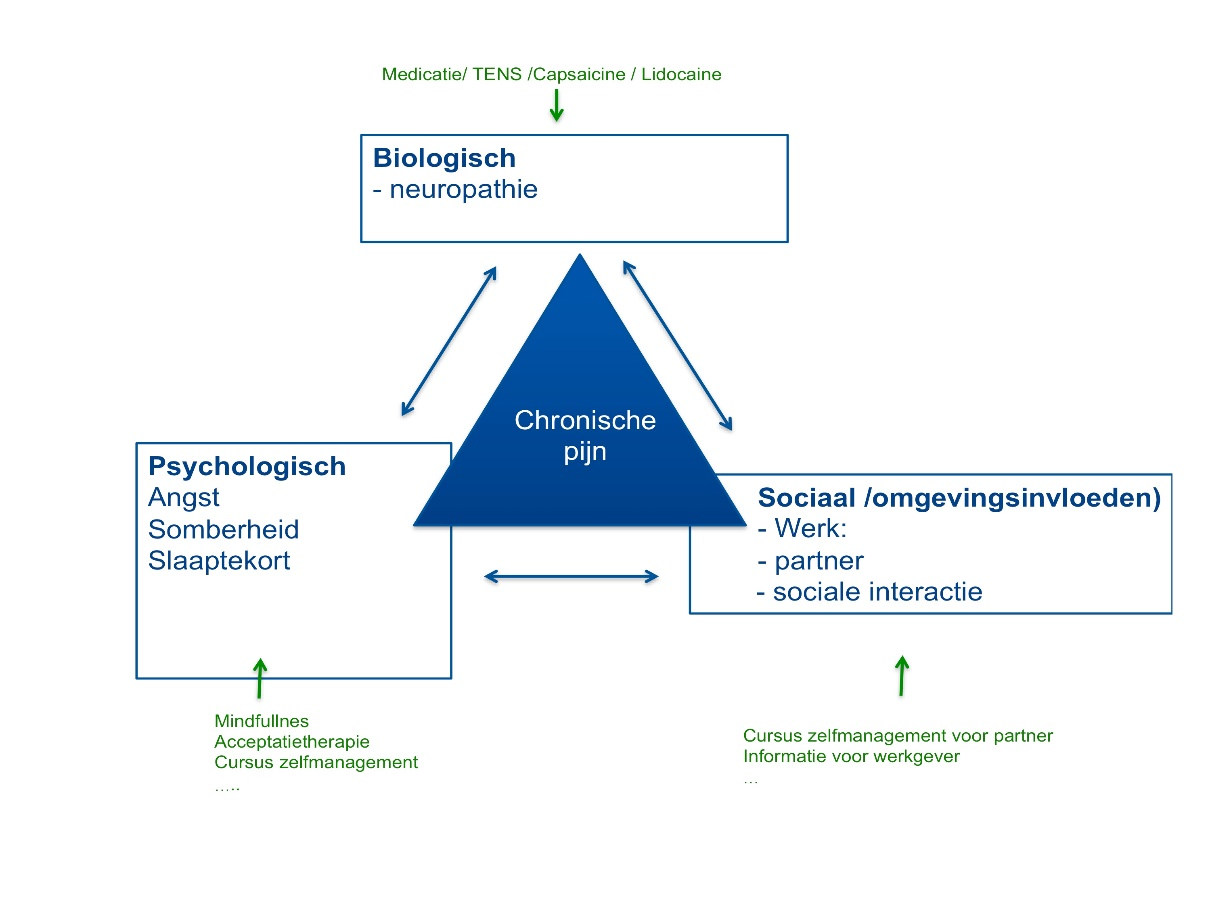
Figuur 3 Instrument voor educatie en shared-decision making bij patiënten met chronische neuropathische pijn.
Bron: Brigitte Brouwer, neuroloog, Maastricht UMC+. Omdat chronische pijn veel impact heeft op de kwaliteit van leven en de medische behandeling vaak onvoldoende blijkt, is het van belang tijdig diagnostiek en behandeling in te zetten op basis van het biopsychosociale pijnmodel. Vanaf de start van het behandelproces moet hierbij het bevorderen en begeleiden van zelfmanagement dienen als rode draad (Zorgstandaard Chronische pijn, 2017). Uitleg die hierbij aan de patiënt gegeven kan worden: De somatische (=lichamelijke) oorzaak, in dit geval de neuropathische pijn is (mogelijk) de bron van de pijn. De pijn kan invloed hebben op de andere factoren, waardoor bijvoorbeeld stemmingsproblemen en/of slaapstoornissen ontstaan (psychische factoren). Vaak is er ook sprake van isolatie van vrienden en familie, of op het werk. Hierbij kan aan de patiënt worden gevraagd wat deze wel of niet herkent. Zo kunnen ook de sterke factoren van de patiënt en omgeving genoemd worden en kan de patiënt zelf aangeven wat belangrijke factoren zijn waaraan hij/zij zelf een bijdrage aan kan leveren. Hiermee kan het schema individueel ingevuld worden met voor de patiënt belangrijke positieve en negatieve factoren. In het groen worden per factor mogelijke behandelingen beschreven.
Onderbouwing
Achtergrond
Naast de behandeling van een mogelijke onderliggende oorzaak bestaat de behandeling van polyneuropathie vooral uit revalidatie en het verlichten van de symptomen (met name pijn).
In deze module wordt ingegaan op de indicatie en verwijzing voor revalidatiebehandeling en op de behandeling van pijn.
Samenvatting literatuur
Er is geen systematische literatuuranalyse verricht.
Zoeken en selecteren
Er is geen systematische literatuuranalyse voor deze vraag uitgevoerd. Er is gebruik gemaakt van bij de werkgroep bekende literatuur, van de Zorgstandaard chronische pijn 2017 en van externe expertise.
Referenties
- Abdulla A, Adams N, Bone M, et al. Guidance on the management of pain in older people. Age Ageing 2013;42 Suppl 1:i1-57.
- American Geriatrics Society Panel on the Pharmacological Management of Persistent Pain in Older Persons. Pharmacological management of persistent pain in older persons. Pain Med 2009;10:1062-83.
- Attal N, Cruccu G, Baron R, et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Eur J Neurol 2010;17:1113-e88.
- Christie MJ. Cellular neuroadaptations to chronic opioids: tolerance, withdrawal and addiction. Br J Pharmacol 2008;154:384-96.
- Chou R, Turner JA, Devine EB, et al. The effectiveness and risks of long-term opioid therapy for chronic pain: a systematic review for a National Institutes of Health Pathways to Prevention Workshop. Ann Intern Med 2015;162:276-86.
- Finnerup NB, Attal N, Haroutounian S, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. The Lancet Neurology 2015.
- Garg RK, Fulton-Kehoe D, Franklin GM. Patterns of Opioid Use and Risk of Opioid Overdose Death Among Medicaid Patients. Med Care 2017;55:661-8.
- Jensen TS, Madsen CS, Finnerup NB. Pharmacology and treatment of neuropathic pains. Current opinion in neurology 2009;22:467-74.
- Labianca R, Sarzi-Puttini P, Zuccaro SM, Cherubino P, Vellucci R, Fornasari D. Adverse effects associated with non-opioid and opioid treatment in patients with chronic pain. Clin Drug Investig 2012;32 Suppl 1:53-63.
- Nederlandse Vereniging van Revalidatieartsen (VRA): https://revalidatiegeneeskunde.nl/behandelkaders.
- Zorgstandaard chronische pijn. 2017. (Beoordeeld op 3 januari 2018, 2018, http://www.dutchpainsociety.nl/index.php?page=zorgstandaard_chronische_pijn)
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 05-07-2019
Beoordeeld op geldigheid : 23-08-2019
Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Neurologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Neurologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is het verbeteren van de zorg voor patiënten met polyneuropathie, met name betere diagnostiek naar de oorzaak van subacute en chronische polyneuropathie.
Doelgroep
De richtlijn is primair bedoeld voor neurologen en patiënten, maar kan ook gebruikt worden door huisartsen en andere beroepsgroepen die te maken hebben met patiënten met polyneuropathie, zoals internisten, anesthesiologen en revalidatieartsen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is een werkgroep ingesteld, bestaande uit neurologen, AIOS neurologie en een patiëntenvertegenwoordiger.
De werkgroepleden zijn door hun beroepsvereniging gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Prof. dr. N.C. (Nicolette) Notermans, neuroloog, Universitair Medisch Centrum Utrecht, NVN (voorzitter)
- C. (Charlotte) van Esch, MSc, medewerker kwaliteit van zorg, Spierziekten Nederland
- Dr. C. (Camiel) Verhamme, neuroloog/klinisch neurofysioloog, Academisch Medisch Centrum Amsterdam, NVN
- Prof. dr. P.A. (Pieter) van Doorn, neuroloog, Erasmus MC Rotterdam, NVN
- Prof. dr. C.G. (Karin) Faber, neuroloog, Maastricht UMC+, NVN
- Drs. X.L. (Xenia) Stalpers, neuroloog, Máxima Medisch Centrum, Eindhoven/Veldhoven, NVN
- Dr. M. (Marijke) Eurelings, neuroloog, Spaarnegasthuis Haarlem/Hoofddorp, NVN
- Dr. F. (Filip) Eftimov, neuroloog, Academisch Medisch Centrum, Amsterdam, NVN
- Dr. A.F.J.E. (Alexander) Vrancken, neuroloog, Universitair Medisch Centrum Utrecht, persoonlijke titel
- Dr. I.W.M. (Inge) van Uden, AIOS neurologie, Radboud Universitair Medisch Centrum Nijmegen, NVN
- Dr. K. (Karlien) Mul, AIOS neurologie, Radboud Universitair Medisch Centrum Nijmegen, NVN
- I.J.T. (Ingrid) Herraets, MSc, AIOS neurologie, Elisabeth-Tweesteden ziekenhuis Tilburg , NVN
Met dank aan:
- Dr. H.S. (Stephan) Goedee, neuroloog en klinisch neurofysioloog, UMC Utrecht
- Dr. W.G.M. (Wim) Jansen, revalidatiearts, Erasmus MC Rotterdam
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten. Aangezien de richtlijn met name diagnostiek van polyneuropathie en de behandeling van onderliggende oorzaken van polyneuropathie omvat, werden genoemde nevenfuncties niet als conflicterende belangen beschouwd en is er geen actie ondernomen.
|
Werkgroeplid |
Gemelde nevenfuncties en mogelijke belangen |
|
van Doorn |
|
|
Eftimov |
|
|
van Esch |
|
|
Eurelings |
|
|
Faber |
|
|
Herraets |
|
|
Mul |
|
|
Notermans |
|
|
Stalpers |
Geen |
|
van Uden |
Geen |
|
Verhamme |
|
|
Vrancken |
|
Inbreng patiëntenperspectief
Patiënten met diverse typen polyneuropathieën waren aanwezig bij de invitational conference bij de initiatie van de huidige richtlijn. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tevens heeft een medewerker van Spierziekten Nederland actief geparticipeerd in de werkgroep en waar nodig ruggenspraak gehouden met de achterban. Dit lid van de werkgroep heeft tevens het module Organisatie van Zorg gecoördineerd.
Patiëntenvertegenwoordigers hebben tijdens de invitational conference aangegeven dat zij de volgende aspecten van belang vinden:
- Vaststellen van behandelbare oorzaken van polyneuropathie
- De behandeling van neuropathische pijn. Tijdens de invitational conference werd besproken dat neuropathische pijn niet binnen de herziening van de richtlijn valt. Wel zal in de module over behandeling een korte samenvatting van de behandeling van neuropathische pijn worden gegeven
- Beschrijven wanneer verwijzing naar de revalidatiearts zinvol is;
- Bijdragen aan kennis over dunnevezelneuropathie en de onderliggende oorzaken, zodat een behandelplan kan worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de afzonderlijke modules.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen in de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Niet alle uitgangsvragen leenden zich voor een systematische literatuuranalyse. Voor de vragen waarvoor wel een systematische literatuuranalyse is gedaan, zijn de individuele studies systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. Voor beoordeling van de RoB zijn de ACROBAT-NRS – voor observationeel onderzoek en QUADAS II – voor diagnostisch onderzoek gebruikt.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en de generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken wetenschappelijke vereniging en patiëntenorganisatie voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
