Sessiele en vlakke poliepen > 20 mm bij poliepectomie
Uitgangsvraag
Wat is de optimale behandeling voor sessiele en vlakke poliepen > 20 mm zonder verdenking op submucosale invasie?
Deze vraag bestaat uit de volgende deelvragen:
- Welke techniek heeft de voorkeur voor de behandeling van sessiele en vlakke poliepen > 20 mm zonder verdenking op submucosale invasie in het colon?
- Welke techniek heeft de voorkeur voor de behandeling van sessiele en vlakke poliepen > 20 mm zonder verdenking op submucosale invasie in het rectum?
Aanbeveling
Verwijder sessiele of vlakke poliepen > 20 mm zonder verdenking op submucosale invasie in het colon door middel van een (piecemeal) EMR.
Overweeg sessiele of vlakke poliepen > 20 mm in het rectum zonder verdenking op submucosale invasie, uitgezonderd de homogeen granulaire poliepen, met een en bloc resectie techniek te verwijderen, met aandacht voor vrije snijvlakken.
De poliep dient in een sessie compleet te worden verwijderd gezien de verlaagde kans op klinisch succes bij non-lifting ten gevolge van een eerdere behandeling.
Beoordeel de poliep voorafgaand aan een complete resectie op complexiteit (grootte > 40 mm, locatie, SMSA score 4), en registreer dit in het endoscopieverslag.
Indien het een complexe resectie betreft, verwijs naar een expert endoscopist met aangetoonde ervaring in de verwijdering van complexe poliepen.
Alvorens een poliep voor chirurgische resectie te verwijzen op basis van een andere reden dan verdenking op diepe invasie in de submucosa, dient overleg plaats te vinden met een expert endoscopist met aangetoonde ervaring in het verwijderen van complexe poliepen.
Overweeg het gebruik een visceuze vloeistof (gelofusine, venofundin, oogdruppels) voor submucosale injectie, deze is geassocieerd met meer en bloc en oligo-piecemeal resecties, en derhalve minder kans op lokaal recidief dan bij het gebruik van 0.9%NaCl.
Overweeg het gebruik van adrenaline in de injectievloeistof bij EMR. Dit kan de kans op intraprocedurele bloedingen verlagen, wat bijdraagt aan een beter overzicht tijdens EMR.
Overweeg het gebruik van een blauwe kleurstof in de injectievloeistof voor het beoordelen van de randen als ook de kans op thermale beschadiging van de m. propria.
Gebruik bij voorkeur optisch diagnostiek boven non-lifting op zichzelf. Non-lifting zonder optische verdenking op maligniteit is geen reden voor verwijzing voor chirurgische resectie maar kan beter worden overlegd met een endoscopist, of centrum, met meer ervaring in verwijdering van complexe poliepen.
Het wordt aangeraden, nadat al het zichtbare neoplastische weefsel is verwijderd, de randen van het EMR wondvlak adjuvant na te behandelen. Hierbij gaat de eerste keus uit naar snaar tip soft coagulatie (STSC). APC is in enkele gevallen ook te overwegen.
Verricht fotodocumentatie voor en na een poliepectomie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Gezien het retro-/prospectieve design van de observationele studies worden er verschillen tussen de groepen patiënten (dat wil zeggen interventie/controle behandeling) waargenomen bij aanvang van de studie. Voor deze verschillen wordt niet gecorrigeerd in de beschreven analyses. Dit gegeven verhoogt het risico op bias. Daarnaast rapporteren de studies geen eenduidige resultaten. Door deze beperkingen is de overall bewijskracht zeer laag. De bewijskracht voor de cruciale en belangrijke uitkomstmaten is ook zeer laag. Om deze reden kan er op basis van de samenvatting van de literatuur geen éénduidig besluit worden genomen welke behandeling de voorkeur heeft. De aanbevelingen zijn gebaseerd op de onderstaande overwegingen en expert opinie van de werkgroep.
Wel of geen en bloc resectie in het colon
Een viertal andere systematische reviews hebben ook ESD met EMR bij patiënten met sessiele en vlakke poliepen vergeleken (Tabel 1). Echter, deze reviews includeerden alle poliepen > 10 mm en hebben dus niet specifiek naar poliepen > 20 mm gekeken en ook geen subgroep analyses uitgevoerd. In de verschillende meta-analyses komt duidelijk naar voren dat ESD effectiever is in het weghalen van de primaire afwijking met een lagere kans op recidief. Echter blijkt na EMR, 89% van de recidieven adequaat te kunnen worden weggehaald met een tweede endoscopische procedure. De effectiviteit op de lange termijn lijkt daarbij vergelijkbaar tussen EMR en ESD. Het percentage complicaties tussen beide behandelingen lijkt vergelijkbaar te zijn. Perforatie trad vaker op in de ESD-groep vergeleken met de EMR-groep (De Ceglie, 2016; Russo, 2018; Zhao, 2020). Echter, in de meta-analyse van Russo (2018) bleek er een vergelijkbaar percentage te bestaan voor aanvullende chirurgie vanwege complicaties (0.5%, 95%CI 0.3 tot 0.7). Het hogere percentage perforaties vertaalt zich in deze studie niet in een toegenomen percentage aanvullende chirurgie voor complicaties. In de studie van Arezzo (2016), werd een hoger percentage gezien van aanvullende chirurgie voor complicaties in ESD versus de EMR-groep (3.0% versus 0.4%).
Omdat het percentage gemiste (of covert) T1 carcinomen in proximale poliepen klein is (Burgess, 2017; Backes, 2019; D’Amico, 2020), is de werkgroep van mening dat met het huidige bewijs (piecemeal) EMR, de eerste keus zou moeten zijn voor vlakke of sessiele poliepen> 20 mm poliepen in het colon proximaal van het sigmoid zonder verdenking op submucosale invasie. Alhoewel piecemeal EMR met meer recidieven gepaard gaat, is het merendeel van deze recidieven met 1 tot 2 aanvullende behandelingen te verwijderen met een cumulatief succespercentage van 97% (Moss, 2015). Dit weegt derhalve niet op tegen de hogere kosten, langere procedure tijd en verhoogde complexiteit van ESD. Ook kosteneffectiviteit-analyses tonen aan dat een selectieve inzet van en bloc resectie technieken bij verdenking op submucosale invasie het meest kosteneffectief is (Bahin, 2019; Ham, 2020).
In verschillende studies blijkt het percentage gemiste T1 carcinomen in het sigmoid beduidend hoger te liggen dan in de rest van het colon (Burgess, 2017). Gezien de locatie, en de lage mortaliteit van aanvullende sigmoidresectie zijn zowel EMR als ESD een goed alternatief en kan de keuze worden afgewogen naar lokale beschikbaarheid van de verschillende technieken en de keuze van de patiënt.
Tabel 1 EMR versus ESD
|
Studie |
Number of patients (EMR;ESD) |
En bloc resection (EMR versus ESD) |
Recurrence (EMR versus ESD) |
Adverse events (EMR versus ESD) |
Polyp free (EMR versus ESD) |
|
Zhao (2020) |
3062 (1906;1156) |
42% versus 95% |
16% versus 1% |
4% versus 4% |
72% versus 93% |
|
Russo (2018) |
- |
38% versus 94% |
13% versus 1% |
12% versus 9% |
99% versus 99% |
|
De Ceglie (2016) |
17950 (11.873; 6077) |
63% versus 91% |
10% versus 1% |
4.1% versus 6.8% |
Not reported |
|
Wang (2014) |
1642 (866;776) |
44% versus 89% |
13% versus 1% |
6% versus 9% |
Not reported |
|
Arezzo (2016 |
4678 (3161;1517) |
35% versus 90% |
13% versus 1% |
3% versus 6.8% |
Not reported |
Wel of geen en bloc resecties in het rectum
Voor het rectum is deze afweging anders. Een RCT tussen EMR en TEM toonde dat er geen klinisch relevant verschil is tussen de twee technieken in het optreden/voorkomen van recidieven. Wel leidt EMR mogelijk tot minder complicaties dan TEM (18 versus 26%) (Barendse, 2018). Ondanks het inclusiecriterium poliepen zonder verdenking op een T1 rectum carcinoom, bleek 13% een niet onderkend T1 CRC te bevatten. Dit is later bevestigt in meer cohorten. De kans op een gemist carcinoom in het rectum van alle > 20 mm poliepen blijkt tussen de 10% en 16% te liggen (Burgess, 2017; D’Amico, 2020; Bronzwaer, 2017). Dit kan worden gestratificeerd voor omvang en poliep morfologie. Poliepen met een sessiele component, mixed granulaire poliepen, of non-granulaire poliepen hebben een hoger risico op en gemist carcinoom, waarbij homogeen granulaire poliepen een aanzienlijk lager risico blijken te hebben (Vosko, 2021). In deze laatste groep kan ook met grotere betrouwbaarheid de afwezigheid van kanker worden voorspeld (Vosko, 2021). Daarnaast is de impact van een oncologische resectie van het rectum groot, en zijn er bij een R0 resectie meerdere opties voor rectum sparende behandelingen mogelijk. In een studie van D’Amico (2020), bleek vooral bij poliepen groter dan 40 mm, en locatie in het rectum het risico op een gemist T1 CRC groot met een number needed to treat van 1:5. In een sub-analyse van de T1 CRC’s in de TREND-studie, bleek 78% van de T1 CRC’s endoscopisch curatief te behandelen door de afwezigheid van risicofactoren (Bronzwaer, 2017). Uit een kosteneffectiviteit-analyse bleek tevens dat een en bloc excisie van > 20 mm non-granulaire poliepen de meest effectieve en tevens goedkoopste methode was (Bahin, 2019). Een en bloc resectie van een grote rectum poliep kan dus grote meerwaarde hebben ten opzichte van een piecemeal resectie op een eindpunt waarop geen van de studies is gepowerd. Al met al is de werkgroep van mening dat een sessiele of vlakke poliep in het rectum, zeker indien groter dan 40 mm, uitgezonderd de homogeen granulaire poliepen, en bloc zou moeten worden verwijderd. Er kan op basis van de beschikbare literatuur geen voorkeur worden uitgesproken voor het type en bloc resectie (ESD, EID, TEM of TAMIS).
Inschatting van de complexiteit van de EMR
De werkgroep is van mening dat het belangrijk is de term “complexe poliep” te gebruiken om laesies te beschrijven met een hoger dan gemiddeld risico op incomplete resectie, optreden recidief en/of complicaties. Hoewel de ervaring van de endoscopist een belangrijke rol speelt bij het succes van het verwijderen van deze poliepen, zijn er een aantal kenmerken die een poliep complex maken.
Uit meerdere studies die lokaal recidief na pEMR onderzochten, bleek dat poliepgrootte een belangrijke risicofactor is voor optreden van een lokaal recidief (Buchner, 2012; Moss, 2011; Moss, 2015; Longcroft-Wheaton, 2013). Met name is er bij pEMR van laesies > 40 mm een hoger risico op incomplete resectie en recidief (Moss, 2015; Oka, 2015). Ook eerdere pogingen tot endoscopische resectie zijn aangetoond geassocieerd met incomplete resectie, onder andere in de prospectieve grote Australische ACE studie (Moss, 2015).
De wanddikte van het colon, distributie van bloedvaten, ruimte in het lumen van het colon, ligging van de endoscoop ten opzichte van de poliep, kunnen per segment verschillen (Angarita, 2018; Monkemuller, 2008). Complexe poliepen liggen frequenter in het proximale colon (Alder, 2006; Bertelson, 2012; Buchner, 2012; Bronzwaer, 2017). Locatie van een poliep op de ileocoecaal klep bleek ook geassocieerd met incomplete resectie in de ACE-studie (OR 2.61) (Moss, 2015). Betrokkenheid van appendix of divertikel opening en betrokkenheid van de linea dentata zijn eveneens aangetoond uitdagend voor succesvolle endoscopische resectie (Angarita, 2018; Ferlitsch, 2007; Holt, 2014).
Een UK werkgroep heeft aangetoond dat de inschatting van de complexiteit van de poliepectomie aan de hand van omvang, morfologie, locatie en toegang (size, morphology, site and acces SMSA classification) is gerelateerd aan de kans op technisch succes op een complete verwijdering en complicaties. Aan de hand van dit SMSA scoringssysteem (Tabel 2) wordt de complexiteit van een poliep ingedeeld in 4 niveaus. In totaal werden 220 poliepen > 20 mm ingedeeld volgens deze classificatie, waarbij er een duidelijke relatie was met het percentage complete resecties (97.5% voor niveau 1 poliepen ten opzichte van 87.5% voor niveau 4 poliepen) en complicaties (0% niveau groep 1 versus 8.6% in niveau groep 4). Deze classificatie is inmiddels in twee onafhankelijke groepen gevalideerd en vormt dus een relatief simpele methode om de complexiteit van een poliep te stratificeren (Sidhu, 2018).
Tabel 2 SMSA Scoringssysteem
|
SMSA parameter |
Stratificatie |
Score |
|
Omvang van de poliep |
20-29 mm |
5 |
|
|
30-39 mm |
7 |
|
|
>40 mm |
9 |
|
Morfologie |
Gesteeld |
1 |
|
|
Sessiel |
2 |
|
|
Vlak |
3 |
|
Locatie in het colon |
Links |
1 |
|
|
Rechts |
2 |
|
Positie ten opzichte van de poliep |
Makkelijk |
1 |
|
|
Moeilijk |
3 |
Tabel 3
|
SMSA Polyp niveau |
Spreiding van de scores |
Technisch succes |
complicaties |
Lokaal recidief |
|
1 |
5 |
100% |
0% |
- |
|
2 |
6-8 |
97-99% |
4% |
5.5% |
|
3 |
9-12 |
97-98% |
6% |
9.2% |
|
4 |
>12 |
87.5-92% |
10 |
23.5% |
*De huidige tabel is gebaseerd op de publicaties van Longcroft-Wheaton (2013) and Sidhu (2018)
Tabel 4 Een complexe poliep voldoet aan tenminste 1 van onderstaande karakteristieken
|
Grootte ≥ 40 mm |
|
SMSA niveau 4 poliep |
|
Eerdere incomplete resectie |
|
Moeilijke locatie (ileocoecaal klep, appendix, divertikel, linea dentata) |
Gebruik van injectievloeistof
In een meta-analyse van vijf gerandomiseerde studies naar het gebruik van 0.9%NaCl versus een meer visceuze vloeistof werd een hoger percentage en bloc resecties (OR=1.91; 95% CI, 1.11 tot 3.29) en een lager percentage lokaal recidief (OR=0.54; 95% CI, 0.32 tot 0.91) waargenomen wanneer een meer visceuze vloeistof werd gebruikt (Yandrapu, 2017). Er is geen verder onderscheid te maken voor een specifieke visceuze vloeistof.
Het toevoegen van een blauwe kleurstof (indigo karmijn of methyleen blauw) in de injectievloeistof kan ondersteunen bij de herkenning van thermale beschadiging van de m. propria en ter bevestiging van het juiste resectievlak (Burgess, 2017; Holt, 2013; Swan, 2011). Een juist herkenning en behandeling van thermische beschadiging van de spierlaag kan late perforatie voorkomen (Burgess, 2017).
Het toevoegen van adrenaline (1:10.000 of 1:100.000) zou mogelijk de kans op intraprocedurele bloedingen of late nabloedingen kunnen verlagen. Verschillende studies hebben aangetoond dat het toevoegen van 1:10.000 adrenaline aan de injectievloeistof het aantal intraprocedurele bloedingen kan verlagen en daarmee het overzicht kan behouden. Het toevoegen van adrenaline aan de injectievloeistof had geen effect op het aantal late nabloedingen (> 24 uur). In een gerandomiseerde studie van Lee (2007) werden 486 patiënten gerandomiseerd voor injectie met alleen fysiologisch zout versus toevoeging van 1:10.000 adrenaline. Er kon geen verschil worden aangetoond in zowel vroege als late nabloedingen (4.9% (12/244) in de adrenalinegroep en 10.3% (25/242) in de groep met fysiologisch zout). Een recente meta-analyse van 6 studies met in totaal 1388 patiënten naar het effect van de toevoeging van adrenaline (1:10.000) op nabloedingen toonde aan dat adrenaline wel een significant effect had op het verlagen van het percentage intraprocedurele bloedingen (OR=0.38, 95% CI: 0.21, 0.66), maar geen effect had op late nabloedingen.
Adjuvante behandeling ter preventie van een lokaal recidief
Omdat de behandeling van recidieven gepaard gaat met wisselende succespercentages tussen de 60 en 80%, is preventie van het lokaal recidief aan te raden. Er zijn twee studies die hebben aangetoond dat het adjuvant behandelen van de resectieranden ondanks dat al de zichtbare neoplasie reeds is verwijderd, de kans op lokaal recidief kan verlagen. De oudste studie betreft een studie met APC waarbij patiënten werden gerandomiseerd tussen het behandelen van de rand van het EMR wondgebied met APC of niet. In deze studie bleek de kans op lokaal recidief te kunnen worden verlaagd van 7/11 (63%) in de controle-arm naar 1/10 (10%) in de groep met een APC behandeling van de randen (Brooker, 2002) Er was echter veel kritiek op deze studie met een heel hoog percentage recidieven in de controle-arm, welke suggereerde dat de kwaliteit van de EMR bij aanvang erg laag was, en dat er mogelijk toch zichtbare neoplasie met APC zou zijn behandeld. Een hele recente studie betrof een multicentrische, gerandomiseerde studie waarbij het preventief behandelen van de randen van het wondgebied met snaar tip contactcoagulatie (snaar tip soft coagulatie; STSC)(n=210) na een macroscopisch radicale resectie werd vergeleken met EMR zonder adjuvante behandeling (n=206). Het percentage lokaal recidief in de interventie-arm bleek met 10/192 (5.2%) veel lager dan in de controle-arm 37/176 (21%) (Klein, 2019). Tevens bleek met deze behandeling ook de kans op lokaal recidief bij en bloc resecties te kunnen worden verlaagd (Klein, 2019). Op basis van beide studies lijkt het zeer aannemelijk dat een adjuvante behandeling van de randen van het resectievlak de kans op een lokaal recidief kan verlagen. Gezien het verschil in kwaliteit in de beide studies, en dat voor STSC geen aanvullend materiaal voor nodig is, lijkt er een voorkeur uit te gaan naar STSC als modaliteit voor adjuvante behandeling van de randen. STSC kan echter bij lastige ligging soms moeilijk uit te voeren zijn, en derhalve kan APC die gevallen ook worden overwogen.
Ervaring van de endoscopist
De ervaring en training van de endoscopist, en het feit dat hij/zij toegewijd is aan het verwijderen van grote en complexe poliepen speelt zeer waarschijnlijk een belangrijke rol bij de uitkomst op de korte (technisch succes, complicaties) en lange termijn (kans op lokaal recidief). In het prospectieve cohort van Oka (2015) bleek een ervaring van > 10 jaar een belangrijke voorspeller voor de kans op lokaal recidief na pEMR. In een recente studie van Meulen (2021) bleek ervaring en toewijding in belangrijke mate effect te hebben op het technisch succes en lokaal recidief na een pEMR van poliepen > 30 mm. In de studie van Bhurwal (2016) naar de leercurve van pEMR, bleek er pas een afvlakking te ontstaan bij 100 procedures. In een meer recente studie naar de leercurve van colorectale EMR werd aangetoond dat fellows in training, na pas 12 maanden training competent werden op basis van een gestandaardiseerde beoordelingslijst na minimaal 25 gesuperviseerde procedures (Yang, 2021). Er zijn op dit moment nog geen objectieve criteria te benoemen die de mate van ervaring en kundigheid toetst. Om deze reden is een expert endoscopist nu omschreven als iemand die aantoonbaar veel ervaring heeft in het verwijderen van complexe poliepen, zijn uitkomsten op de korte en lange termijn bijhoudt en desgevraagd kan overleggen. Het lijkt derhalve raadzaam de colorectale endoscopische resecties (EMR,ESD, eFTR, TEM/TAMIS) te laten verrichten door een beperkt aantal mensen binnen het ziekenhuis of regio, zodat voldoende expertise kan worden opgebouwd, en er voldoende jaarlijkse blootstelling bestaat in het onderhouden en verbeteren van de vaardigheden. Met name voor pEMR van poliepen > 40 mm of een hoge mate van complexiteit, en in alle gevallen van eFTR, TEM/TAMIS, of ESD/EID.
Inktmarkering
Omdat er na een piecemeal poliepectomie altijd een controle van het litteken dient plaats te vinden en deze niet altijd makkelijk is terug te vinden, en omdat er een persisterende kans op een onverwachte maligniteit is waarvoor aanvullende chirurgie noodzakelijk is, valt het te overwegen om een submucosale inktmarkering te plaatsen na complexe poliepectomie. (Ferlitsch, 2017; Moss, 2011). Inktmarkering wordt bij voorkeur op een afstand van de laesie geplaatst. Tenminste 30 mm distaal van de laesie, voorafgaand door eerst enkele milliliter Nacl 0.9% te injecteren op twee tot drie plaatsen circumferentieel om intra-abdominale injectie te voorkomen. Deze stap wordt gevolgd door 2 ml Oost-Indische inkt te spuiten in de bleb die gevormd is. Volgens expert opinion bij voorkeur 30 mm distaal van de laesie (niet te dichtbij) in verband met de kans op fibrosering en daarmee verhoging van de complexiteit van een eventuele aanvullende endoscopische behandeling als de inkt onder het litteken komt.
Foto- en/of videodocumentatie
Foto- en/of videodocumentatie van een poliepectomie is een kwaliteitseis in het bevolkingsonderzoeksonderzoek naar dikke darmkanker. Foto- of videodocumentatie leidt tot het toetsbaar opstellen van de endoscopist en biedt mogelijkheden voor feedback en daarmee mogelijkheden tot het verbeteren van de poliepectomietechniek. Aangezien de optische diagnostiek bepalend is voor de keuze van endoscopische resectietechniek, en een foto van het resectievlak op het eind van de endoscopische resectie de macroscopische radicaliteit van de endoscopische resectie reflecteert, wordt aangeraden om foto’s te maken van de poliep voorafgaand aan de endoscopische resectie, en indien mogelijk, een zoom foto van het gebied waarop de beslissing is gebaseerd, evenals een foto van het resectievlak aan het eind van de endoscopische resectie. Met name op het eind dient een inspectie plaats te vinden op de aanwezigheid van thermisch letsel van de m. propria (Burgess, 2017; Ferlitsch, 2017; Swan, 2011). Dit dient te worden vastgelegd door middel van een foto.
Kosten (middelenbeslag)
De strategie van een en bloc resectie versus een piecemeal EMR beïnvloedt de kans op een lokaal recidief na de initiële behandeling, en daarmee mogelijk de kosten die gepaard gaan met aanvullende behandelingen en meer frequente follow-up. Daarentegen zijn de kosten bij aanvang groter voor een en bloc resectie (ESD, of TEM-TAMIS) gezien de langere tijdsduur en hogere materiaalkosten. Een retrospectieve kosteneffectiviteit studie van 429 ESD´s versus 115 piecemeal EMR´s, toonde aan dat het en bloc percentage inderdaad hoger was voor ESD (84% versus 32%), de recidief kans lager was bij ESD (0,5 % versus 7%), het aantal aanvullende endoscopieën in de pEMR-groep hoger was (1.7 +/- 1.5 versus 1.3 +/- 1.1, p = 0.003), maar dat de cumulatieve kosten op 3 jaar vergelijkbaar waren, met een vergelijkbaar klinisch succes (Ham, 2020). Een markov model analyse, vergeleek een strategie met altijd een en bloc resectie (ESD), met een strategie met altijd piecemeal EMR, en een strategie met selectief ESD bij poliepen met een verdenking op een submucosaal invasief carcinoom. In dit model bleek de selectieve inzet van ESD het meest kosteneffectief, en was de strategie met ESD voor alle poliepen groter dan 20 mm het minst effectief (Bahin, 2019). Uitgezonderd voor het rectum, waar een ESD van non-granulaire poliepen zowel de meest effectieve als ook de goedkoopste optie was. In een kosteneffectiviteits-analyse op basis van de TREND-studie, waren de QALY vergelijkbaar tussen beide ingrepen (EMR 1.73 (1.65 tot 1.80), TEM 1.73 (1.64 tot 1.81), p = 0.96), maar was EMR €3000 goedkoper dan TEM (Barendse, 2018). De kosten voor de oncologische behandeling van de 13% niet-ontdekte T1 CRC’s zijn hierin echter niet meegenomen. Op basis van deze gegevens lijkt de inzet van een en bloc resectie techniek bij een verdenking op submucosaal invasief carcinoom invasief kosteneffectief, maar een strategie met altijd een en bloc resectie niet. Voor poliepen in het colon zonder kenmerken van submucosale invasie is het risico op T1 CRC laag, en derhalve is pEMR de meest kosteneffectieve benadering. Voor het rectum is dit nog niet geheel duidelijk, alhoewel de studie van Bahin (2019) pleit voor een en bloc excisie van poliepen met een hoger risico op een niet onderkend T1 CRC zoals non-granulaire poliepen. Mogelijk dat de kosteneffectiviteit analyse volgend op de Matilda-studie hier in de toekomst antwoord op kan geven.
Onderbouwing
Achtergrond
Waar voor poliepen met een verdenking op submucosale invasie het belang van een en bloc resectie voorop staat, is dat bij poliepen zonder verdenking op submucosale invasie allerminst duidelijk. Alhoewel een en bloc resectie een duidelijk lager risico geeft op een lokaal recidief, en curatief kan zijn bij een niet herkend T1 colorectaal carcinoom, wordt dit positief effect deels teniet gedaan door hogere kosten, hogere complexiteit, en de grotere kans op complicaties van een en bloc resectie. Hierbij dient onderscheid te worden gemaakt voor sessiele en vlakke poliepen in het rectum, versus het colon, vanwege de kans op het missen van een colorectaal carcinoom en de impact van aanvullende chirurgie. Deze module gaat over de meerwaarde van een en bloc resectie van sessiele en vlakke poliepen > 20 mm zonder verdenking op submucosale invasie.
Conclusies / Summary of Findings
R0 resection
|
Very low GRADE |
The evidence is very uncertain about the effect of endoscopic submucosal dissection on R0 resection, compared to endoscopic mucosal resection in patients with sessile and flat polyps (> 20 mm) of the colon, without suspicion of submucosal invasive carcinoma.
Sources: Arezzo, 2016 |
Percentage of malignancy
|
No GRADE |
No conclusions could be drawn about the effect of ESD on percentage of malignancy compared to EMR in patients with polyps of the colon > 20 mm without suspicion of submucosal invasive carcinoma due to the absence of relevant comparative studies. |
Curative resection
|
Very low GRADE |
The evidence is very uncertain about the effect of endoscopic submucosal dissection on curative resection, compared to endoscopic mucosal resection in patients with sessile and flat polyps (> 20 mm) of the colon, without suspicion of submucosal invasive carcinoma.
Sources: Arezzo, 2016 |
Need for additional surgical intervention
|
Very low GRADE |
The evidence is very uncertain about the effect of endoscopic submucosal dissection on need for additional surgical intervention, compared to endoscopic mucosal resection in patients with sessile and flat polyps (>20 mm) of the colon, without suspicion of submucosal invasive carcinoma.
Sources: Arezzo, 2016 |
Recurrence rate
|
Very low GRADE |
ESD versus EMR The evidence is very uncertain about the effect of endoscopic submucosal dissection on recurrence rate, compared to endoscopic mucosal resection in patients with sessile and flat polyps (> 20 mm) of the colon, without suspicion of submucosal invasive carcinoma.
Sources: Arezzo, 2016 |
|
Low GRADE |
TEM versus EMR Transanal endoscopic microsurgery compared to endoscopic mucosal resection may result in lower recurrence rate in patients with sessile and flat polyps (> 20 mm) of the rectum.
Sources: Barendse, 2018 |
Postpolypectomy bleeding
|
Very low GRADE |
ESD versus EMR The evidence is very uncertain about the effect of endoscopic submucosal dissection on postpolypectomy bleeding, compared to endoscopic mucosal resection in patients with sessile and flat polyps (> 20 mm) of the colon, without suspicion of submucosal invasive carcinoma.
Sources: Arezzo, 2016 |
|
Low GRADE |
TEM versus EMR Transanal endoscopic microsurgery compared to endoscopic mucosal resection may result in lower postpolypectomy bleeding in patients with sessile and flat polyps (> 20 mm) of the rectum.
Sources: Barendse, 2018 |
Perforation
|
Very low GRADE |
The evidence is very uncertain about the effect of endoscopic submucosal dissection on perforation, compared to endoscopic mucosal resection in patients with sessile and flat polyps (> 20 mm) of the colon, without suspicion of submucosal invasive carcinoma.
Sources: Arezzo, 2016 |
Mortality
|
No GRADE |
No conclusions could be drawn about the effect of ESD on mortality compared to EMR in patients with polyps of the colon > 20 mm without suspicion of submucosal invasive carcinoma due to the absence of relevant comparative studies. |
Samenvatting literatuur
Description of studies
Endoscopic submucosal dissection versus endoscopic mucosal resection for colon lesions
Arezzo (2016) performed a systematic review (SR) with meta-analysis to investigate the safety and effectiveness of endoscopic submucosal dissection (ESD) compared to endoscopic mucosal resection (EMR) in treatment of flat and sessile colorectal lesions > 20mm preoperatively. The literature search was performed between January 2000 and September 2014. The primary outcome was effectiveness of resection, measured as en bloc resection rate, defined as the rate of lesions excised in a single specimen, and R0 resection, defined as the rate of lesions excised with margins free of disease. Secondary outcomes were postprocedural complications (i.e., bleeding and perforations), and recurrence rate.
In total 11 studies (5 full text and 6 conference abstracts) met the inclusion criteria. All studies were retrospective cohort studies. An important difference at baseline between treatment by ESD (n=1517, 32.4%) and by EMR (n=3161, 67.6%), was shown for mean polyp size (ESD versus EMR; 33.7 mm versus 27.4 mm). The risk of bias, as reported by Arezzo (2016), was moderate. Furthermore, heterogeneity was present in some analyses, and no adjustments were made for baseline differences. No subgroup analyses were performed per location of the lesions. The number of patients with lesions of the rectum were not described in this paper.
Transanal endoscopic microsurgery versus endoscopic mucosal resection for rectum lesions
Barendse (2018) performed a randomized controlled trial to compare the clinical outcome and cost-effectiveness of transanal endoscopic microsurgery (TEM) and endoscopic mucosal resection (EMR) for large rectal adenomas. In total, 204 patients with rectal adenomas ≥ 30 mm, without malignant features, were randomised to EMR (n=103) or TEM (n= 01). The primary outcome was recurrence of neoplasia (adenoma remnants at 3 months were not considered as recurrence), and the number of days a patient was alive, outside the hospital and free of recurrence during the 2-year follow-up period. Secondary outcomes were complication rates, health-related and disease-specific quality of life and costs. In the EMR group, five patients underwent TEM because of EMR failure. In the TEM group, three patients underwent EMR because of TEM failure. Twenty-seven patients (13%; EMR 15; TEM 12) had an unexpected malignancy and were excluded. One additional patient withdrew consent. Eventually, 176 patients were included in the long-term analyses.
Results
Results are described per outcome and pooled where possible.
R0 resection rates
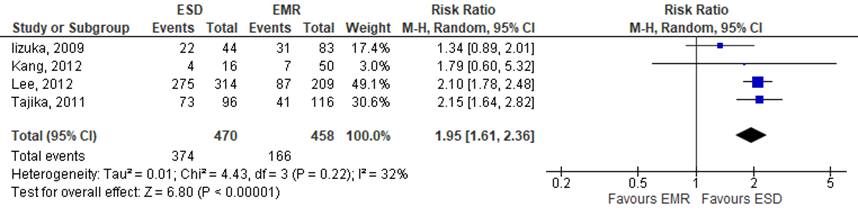
Arezzo (2016) defined the outcome ‘R0 resection rate’ as the rate of lesions excised with margins free of disease, as assessed by the pathologist. This outcome was assessed in 4 individual studies. The pooled RR resulted in 1.95 (95%CI 1.61 to 2.36), indicating that R0 resection rates were higher in the intervention group (treated by ESD), see figure 1. The risk difference was 0.30 (95%CI 0.13 to 0.46).
Figure 1 Forest plot for R0 resection rates
Percentage of malignancy
This outcome was not reported in the included studies.
Need for additional surgical intervention
Arezzo (2016) defined the outcome ‘need for additional surgical intervention’ as the need for abdominal surgery for oncologic reasons and surgery to manage complications.
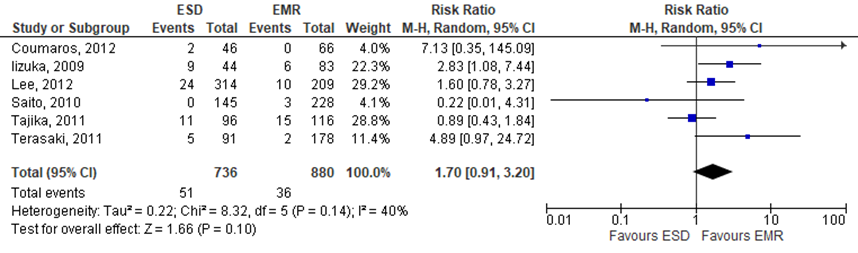
Six of the included studies reported on the need for abdominal surgery for oncologic reasons. The pooled RR resulted in 1.70 (95%CI 0.92 to 3.20), indicating that the need for abdominal surgery for oncologic reasons were higher in the intervention group (treated by ESD) compared to the control group (treated by EMR), see figure 2. The risk difference was 0.03 (95%CI -0.02 to 0.07).
Figure 2 Forest plot for curative resection rate
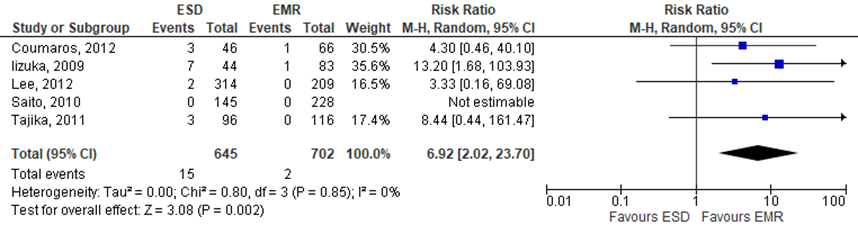
Five of the included studies reported on surgery for complications. The pooled RR resulted in 6.92 (95%CI 2.02 to 23.70), indicating that additional surgery due to complication rates were higher in the intervention group (treated by ESD) compared to the control group (treated by EMR), see figure 3. The risk difference was 0.02 (95%CI -0.01 to 0.06).
Figure 3 Forest plot for rate for additional surgical intervention due to complications
Recurrence rates
ESD versus EMR
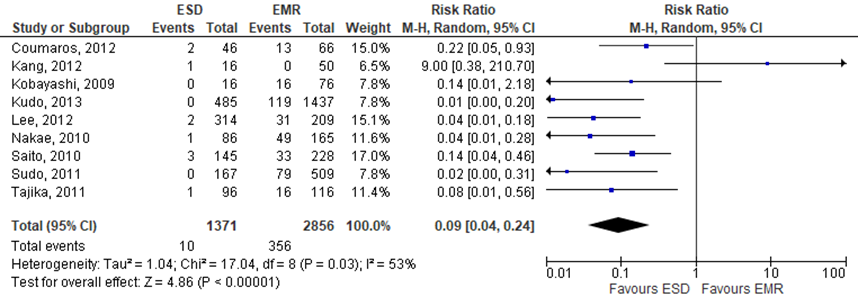
Arezzo (2016) reported the outcome ‘recurrence rate’, but not the duration of the follow-up. In total 9 studies in the SR reported this outcome. The pooled RR resulted in 0.09 (95%CI 0.04 to 0.24), indicating that recurrence rates were lower in the intervention group (treated by ESD) compared to the control group (treated by EMR), see figure 4. The risk difference was -0.14 (95%CI -0.19 to -0.09).
Figure 4 Forest plot for recurrence rate
TEM versus EMR
Barendse (2018) reported on the recurrence of neoplasia (adenoma remnants at 3 months were not considered as recurrence). In the TEM-group, 10/89 patients (11%) had recurrence, compared to 13/87 patients (15%) in the EMR-group. The RR is 0.72 (95%CI 0.20 to 1.74). The median time to recurrence was 12 months (IQR 7 to 21) after TEM and 7 months (IQR 6 to 12) after EMR.
Postpolypectomy bleeding
ESD versus EMR
Arezzo (2016) reported the ‘bleeding risk’ as postprocedural complication. In total 8 studies included in the SR reported this outcome. The pooled RR was 0.64 (95%CI 0.39 to 1.06), indicating lower rates in the intervention group (treated by ESD) compared to the control group, see figure 5. The risk difference was -0.01 (95%CI -0.02 to 0.00).
Figure 5 Forest plot for bleeding rate
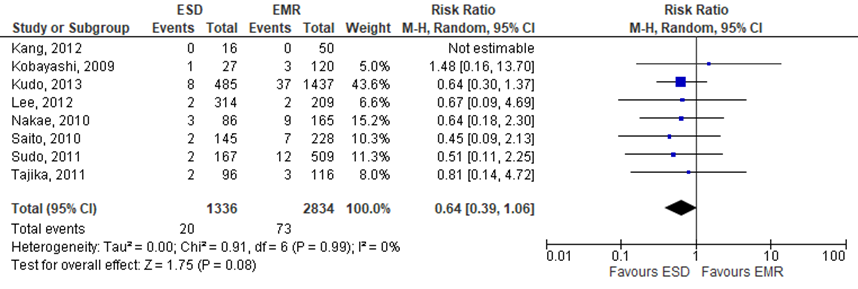
TEM versus EMR
Barendse (2018) reported on the outcome hemorrhage. In the TEM-group, bleeding occurred in 15/89 patients (17%), compared to 19/87 patients (22%) in the EMR-group. The RR is 0.73 (95%CI 0.34 to 1.54).
Perforation
Arezzo (2016) reported ‘perforation risk’ as postprocedural complication. This outcome was reported in all included studies. The pooled RR was 2.76 (95%CI 1.83 to 4.17), indicating higher rates in the intervention group (treated by ESD) compared to the control group, see figure 6. The risk difference was 0.03 (95%CI 0.01 to 0.05).
Figure 6 Forest plot for perforation rate
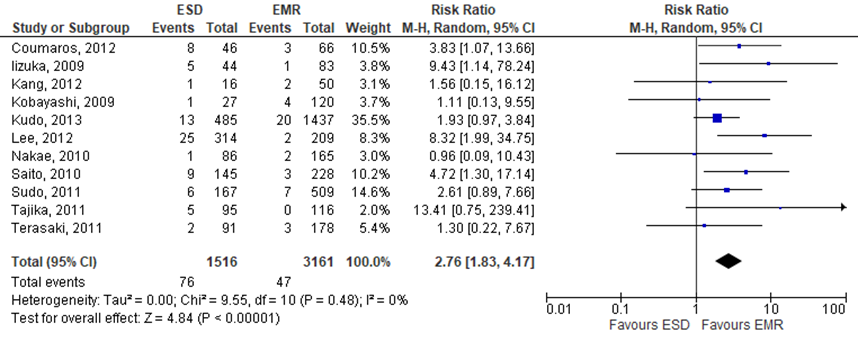
Mortality
This outcome was not reported in the included studies.
Level of evidence of the literature
The level of evidence (GRADE-method) is determined per comparison and outcome measure. The comparison of ESD and EMR is based on results from cohort studies and therefore starts at level “low”; the comparison of TEM and EMR is based on results from a RCT and therefore starts at level “high”. Subsequently, the level of evidence was downgraded if there were relevant shortcomings in one of the several GRADE-domains: risk of bias, inconsistency, indirectness, imprecision, and publication bias. It was upgraded if there was a strong association, or a dose-response relation, and/or plausible (residual) confounding.
The level of evidence regarding the outcome measures percentage of malignancy and mortality could not be assessed with GRADE. The outcome measures were not studied in the included studies.
The level of evidence regarding the outcome measure R0 resection rates was downgraded to very low because of risk of bias (no adjustments were made for baseline differences between de groups; -1)
The level of evidence regarding the outcome measure need for additional surgical intervention was downgraded to very low because of risk of bias (no adjustments were made for baseline differences between de groups; -1).
The level of evidence regarding the outcome measure recurrence rate for ESD versus EMR was downgraded to very low because of risk of bias (no adjustments were made for baseline differences between de groups; -1) and inconsistency (conflicting results; -1).
The level of evidence regarding the outcome measure recurrence rate for TEM versus EMR was downgraded to low because of risk of bias (no concealment of allocation and loss to follow-up; -1) and imprecision (crossing borders of clinical relevance; -1).
The level of evidence regarding the outcome measure postpolypectomy bleeding for ESD versus EMR was downgraded to very low because of risk of bias (no adjustments were made for baseline differences between de groups; -1) and inconsistency (conflicting results; -1).
The level of evidence regarding the outcome measure postpolypectomy bleeding for TEM versus EMR was downgraded to low because of risk of bias (no concealment of allocation and loss to follow-up; -1) and imprecision (crossing borders of clinical relevance; -1).
The level of evidence regarding the outcome measure perforation was downgraded to very low because of risk of bias (no adjustments were made for baseline differences between de groups; -1).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
- What are the (un)favorable effects of endoscopic submucosal dissection (ESD) compared to endoscopic mucosal resection (EMR) in patients with a sessile and flat polyps in the colon > 20 mm, without suspicion of submucosal invasive carcinoma, on R0 resection rates, percentage of malignancy, curative resection, need for additional surgical intervention, recurrence rates within 3 and 6 months, postpolypectomy bleeding, mortality?
- What are the (un)favorable effects of endoscopic submucosal dissection (ESD), transanal endoscopic microsurgery (TEM) and transanal minimally invasive surgery (TAMIS) compared to endoscopic mucosal resection (EMR) in patients with sessile and flat polyps of the rectum > 20 mm, without suspicion of submucosal invasive carcinoma (LST), on R0 resection rates, percentage of malignancy, curative resection, need for additional surgical intervention, recurrence rates within 3 and 6 months, (significant) delayed bleeding, postpolypectomy bleeding, mortality?
PICO 1
P (patients): patients with sessile and flat polyps of the colon > 20mm without suspicion of submucosal invasive carcinoma;
I (intervention): endoscopic submucosal dissection (ESD);
C (control): endoscopic mucosal resection (EMR);
O (outcomes): R0 resection rates, percentage of malignancy, need for additional surgical intervention, recurrence rates within 3 or 6 months, delayed bleeding, postpolypectomy bleeding, mortality.
PICO 2
P (patients): patients with sessile and flat polyps of the rectum > 20mm without suspicion of submucosal invasive carcinoma;
I (intervention): endoscopic submucosal dissection (ESD), transanal endoscopic microsurgery (TEM) or transanal minimally invasive surgery (TAMIS);
C (control): endoscopic mucosal resection (EMR);
O (outcomes): R0 resection rates, percentage of malignancy, need for additional surgical intervention, recurrence rates within 3 or 6 months, postpolypectomy bleeding, mortality.
Relevant outcome measures
The guideline development group considered R0 resection rates, percentage of malignancy, curative resection, recurrence rates within 3 or 6 months, mortality as critical outcome measures for decision making; and need for additional surgical intervention, postpolypectomy bleeding, perforation as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The limits for clinical relevance were the default limits proposed by the international GRADE working group: a difference in relative risk of 25% for dichotomous outcome measures, and a difference of half a standard deviation (reported as SMD) for continuous outcome measures.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from January 1st, 2000 until May 6th, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 247 hits. The search was extended updated on July, 23rd, 2021. This update resulted in 185 hits, of which 14 systematic reviews, 53 RCTs and 118 observational studies. Studies were selected based on the following criteria: systematic reviews and meta-analyses, randomized controlled trials (RCT’s) and comparative observational studies, which included all elements of the PICO:
- Patients with sessile and flat polyps of the colon or rectum > 20 mm, without suspicion of submucosal invasive carcinoma.
- Endoscopic submucosal dissection (for polyps of the colon and rectum), transanal endoscopic microsurgery, transanal minimally invasive surgery (for rectal polyps).
- Comparison with endoscopic mucosal resection.
- Investigated at least one of the outcomes as reported in the PICO.
From the first search, nine studies were initially selected based on title and abstract screening. After reading the full text, eight studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study in patients with polyps of the colon (colorectal) was included. From the updated search, we initially screened the systematic reviews and RCTs. From these studies, six were selected based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study in patients with polyps of the rectum was included.
Results
One systematic review in patients with sessile and flat polyps of the colon > 20 mm without suspicion of submucosal invasive carcinoma and one randomized controlled trial in patients with sessile and flat polyps of the rectum > 20 mm were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Angarita, F. A., Feinberg, A. E., Feinberg, S. M., Riddell, R. H., & McCart, J. A. (2018). Management of complex polyps of the colon and rectum. International journal of colorectal disease, 33(2), 115-129.
- Arezzo A, Passera R, Marchese N, Galloro G, Manta R, Cirocchi R. Systematic review and meta-analysis of endoscopic submucosal dissection versus endoscopic mucosal resection for colorectal lesions. United European Gastroenterol J. 2016 Feb;4(1):18-29. doi: 10.1177/2050640615585470. Epub 2015 May 5. PMID: 26966519; PMCID: PMC4766548.
- Backes, Y., Schwartz, M. P., Ter Borg, F., Wolfhagen, F. H., Groen, J. N., tot Nederveen, W. H. D. V.,... & Moons, L. M. (2019). Multicentre prospective evaluation of real-time optical diagnosis of T1 colorectal cancer in large non-pedunculated colorectal polyps using narrow band imaging (the OPTICAL study). Gut, 68(2), 271-279.
- Bahin, F. F., Heitman, S. J., Rasouli, K. N., Mahajan, H., McLeod, D., Lee, E. Y.,... & Bourke, M. J. (2018). Wide-field endoscopic mucosal resection versus endoscopic submucosal dissection for laterally spreading colorectal lesions: a cost-effectiveness analysis. Gut, 67(11), 1965-1973.
- Barendse, R. M., Musters, G. D., de Graaf, E. J., van den Broek, F. J., Consten, E. C., Doornebosch, P. G.,... & Dekker, E. (2018). Randomised controlled trial of transanal endoscopic microsurgery versus endoscopic mucosal resection for large rectal adenomas (TREND Study). Gut, 67(5), 837-846.
- Bertelson, N. L., Kalkbrenner, K. A., Merchea, A., Dozois, E. J., Landmann, R. G., De Petris, G.,... & Etzioni, D. A. (2012). Colectomy for endoscopically unresectable polyps: how often is it cancer?. Diseases of the colon & rectum, 55(11), 1111-1116.
- Bhurwal, A., Bartel, M. J., Heckman, M. G., Diehl, N. N., Raimondo, M., Wallace, M. B., & Woodward, T. A. (2016). Endoscopic mucosal resection: learning curve for large nonpolypoid colorectal neoplasia. Gastrointestinal endoscopy, 84(6), 959-968.
- Bronzwaer, M. E., Musters, G. D., Barendse, R. M., Koens, L., de Graaf, E. J., Doornebosch, P. G.,... & Wolthuis, A. (2018). The occurrence and characteristics of endoscopically unexpected malignant degeneration in large rectal adenomas. Gastrointestinal endoscopy, 87(3), 862-871.
- Brooker, J. C., Saunders, B. P., Shah, S. G., Thapar, C. J., Suzuki, N., & Williams, C. B. (2002). Treatment with argon plasma coagulation reduces recurrence after piecemeal resection of large sessile colonic polyps: a randomized trial and recommendations. Gastrointestinal endoscopy, 55(3), 371-375.
- Burgess, N. G., Hourigan, L. F., Zanati, S. A., Brown, G. J., Singh, R., Williams, S. J.,... & Bourke, M. J. (2017). Risk stratification for covert invasive cancer among patients referred for colonic endoscopic mucosal resection: a large multicenter cohort. astroenterology, 153(3), 732-742.
- D’Amico, F., Amato, A., Iannone, A., Trovato, C., Romana, C., Angeletti, S.,... & Group, B. (2021). Risk of covert submucosal cancer in patients with granular mixed laterally spreading tumors. Clinical Gastroenterology and Hepatology, 19(7), 1395-1401.
- De Ceglie, A., Hassan, C., Mangiavillano, B., Matsuda, T., Saito, Y., Ridola, L.,... & Conio, M. (2016). Endoscopic mucosal resection and endoscopic submucosal dissection for colorectal lesions: a systematic review. Critical reviews in oncology/hematology, 104, 138-155.
- Ferlitsch, M., Moss, A., Hassan, C., Bhandari, P., Dumonceau, J. M., Paspatis, G.,... & Bourke, M. J. (2017). Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) clinical guideline. Endoscopy, 49(03), 270-297.
- Ham, N. S., Kim, J., Oh, E. H., Hwang, S. W., Park, S. H., Yang, D. H.,... & Byeon, J. S. (2019). Cost of endoscopic submucosal dissection versus endoscopic piecemeal mucosal resection in the colorectum. Digestive diseases and sciences, 1-9.
- Holt, B. A., Jayasekeran, V., Sonson, R., & Bourke, M. J. (2013). Topical submucosal chromoendoscopy defines the level of resection in colonic EMR and may improve procedural safety (with video). Gastrointestinal endoscopy, 77(6), 949-953.
- Holt, B. A., Bassan, M. S., Sexton, A., Williams, S. J., & Bourke, M. J. (2014). Advanced mucosal neoplasia of the anorectal junction: endoscopic resection technique and outcomes (with videos). Gastrointestinal endoscopy, 79(1), 119-126.
- Klein, A., Tate, D. J., Jayasekeran, V., Hourigan, L., Singh, R., Brown, G.,... & Bourke, M. J. (2019). Thermal ablation of mucosal defect margins reduces adenoma recurrence after colonic endoscopic mucosal resection. Gastroenterology, 156(3), 604-613.
- Lee, S. H., Chung, I. K., Kim, S. J., Kim, J. O., Ko, B. M., Kim, W. H.,... & Song, J. S. (2007). Comparison of postpolypectomy bleeding between epinephrine and saline submucosal injection for large colon polyps by conventional polypectomy: a prospective randomized, multicenter study. World journal of gastroenterology: WJG, 13(21), 2973.
- Longcroft-Wheaton, G., Duku, M., Mead, R., Basford, P., & Bhandari, P. (2013). Risk stratification system for evaluation of complex polyps can predict outcomes of endoscopic mucosal resection. Diseases of the colon & rectum, 56(8), 960-966.
- Mönkemüller, K., Neumann, H., Fry, L. C., Ivekovic, H., & Malfertheiner, P. (2008). Polypectomy techniques for difficult colon polyps. Digestive Diseases, 26(4), 342-346.
- Moss, A., Bourke, M. J., & Pathmanathan, N. (2011). Safety of colonic tattoo with sterile carbon particle suspension: a proposed guideline with illustrative cases. Gastrointestinal endoscopy, 74(1), 214-218.
- Moss, A., Bourke, M. J., Williams, S. J., Hourigan, L. F., Brown, G., Tam, W.,... & Byth, K. (2011). Endoscopic mucosal resection outcomes and prediction of submucosal cancer from advanced colonic mucosal neoplasia. Gastroenterology, 140(7), 1909-1918.
- Moss, A., Williams, S. J., Hourigan, L. F., Brown, G., Tam, W., Singh, R.,... & Bourke, M. J. (2015). Long-term adenoma recurrence following wide-field endoscopic mucosal resection (WF-EMR) for advanced colonic mucosal neoplasia is infrequent: results and risk factors in 1000 cases from the Australian Colonic EMR (ACE) study. Gut, 64(1), 57-65.
- Meulen, L. W., van der Zander, Q. E., Bogie, R. M., Keulen, E. T., van Nunen, A. B., Winkens, B.,... & Masclee, A. A. (2021). Evaluation of polypectomy quality indicators of large, nonpedunculated colorectal polyps in a nonexpert, bowel cancer screening cohort. Gastrointestinal Endoscopy.
- Oka, S., Tanaka, S., Saito, Y., Iishi, H., Kudo, S. E., Ikematsu, H.,... & Sugihara, K. (2015). Local recurrence after endoscopic resection for large colorectal neoplasia: a multicenter prospective study in Japan. Official journal of the American College of Gastroenterology| ACG, 110(5), 697-707.
- Russo, P., Barbeiro, S., Awadie, H., Libânio, D., Dinis-Ribeiro, M., & Bourke, M. (2019). Management of colorectal laterally spreading tumors: a systematic review and meta-analysis. Endoscopy international open, 7(02), E239-E259.
- Sidhu, M., Tate, D. J., Desomer, L., Brown, G., Hourigan, L. F., Lee, E. Y.,... & Bourke, M. J. (2018). The size, morphology, site, and access score predicts critical outcomes of endoscopic mucosal resection in the colon. Endoscopy, 50(07), 684-692.
- Swan, M. P., Bourke, M. J., Moss, A., Williams, S. J., Hopper, A., & Metz, A. (2011). The target sign: an endoscopic marker for the resection of the muscularis propria and potential perforation during colonic endoscopic mucosal resection. Gastrointestinal endoscopy, 73(1), 79-85.
- Vosko, S., Shahidi, N., Sidhu, M., van Hattem, W. A., Bar-Yishay, I., Schoeman, S.,... & Bourke, M. J. (2021). Optical Evaluation for Predicting Cancer in Large Nonpedunculated Colorectal Polyps Is Accurate for Flat Lesions. Clinical Gastroenterology and Hepatology.
- Wang, J., Zhang, X. H., Ge, J., Yang, C. M., Liu, J. Y., & Zhao, S. L. (2014). Endoscopic submucosal dissection vs endoscopic mucosal resection for colorectal tumors: a meta-analysis. World journal of gastroenterology: WJG, 20(25), 8282.
- Yandrapu, H., Desai, M., Siddique, S., Vennalganti, P., Vennalaganti, S., Parasa, S.,... & Choudhary, A. (2017). Normal saline solution versus other viscous solutions for submucosal injection during endoscopic mucosal resection: a systematic review and meta-analysis. Gastrointestinal endoscopy, 85(4), 693-699.
- Yang, D., Perbtani, Y. B., Wang, Y., Rumman, A., Wang, A. Y., Kumta, N. A.,... & C-EMR STAT Study Group. (2021). Evaluating learning curves and competence in colorectal EMR among advanced endoscopy fellows: a pilot multicenter prospective trial using cumulative sum analysis. Gastrointestinal endoscopy, 93(3), 682-690.
- Zhao, H. J., Yin, J., Ji, C. Y., Wang, X., & Wang, N. (2020). Endoscopic mucosal resection versus endoscopic submucosal dissection for colorectal laterally spreading tumors: a meta-analysis. Revista Espanola de Enfermedades Digestivas: Organo Oficial de la Sociedad Espanola de Patologia Digestiva.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What are the effects of endoscopic submucosal dissection compared to endoscopic mucosal resection in patients with sessile and flat polyps of the colon > 20mm, without suspicion of submucosal invasive carcinoma, on R0 resection rates, percentage of malignancy, curative resection, need for additional surgical intervention, recurrence rates within 3 or 6 months, (significant) delayed bleeding, postpolypectomy bleeding, mortality?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Arezzo, 2016
|
SR and meta-analysis of RCTs and cohort studies.
Literature searches up to September 2024
A: Lizuka, 2009 B: Kobayashi, 2009 C: Nakae, 2010 D: Saito, 2010 E: Taijka, 2011 F: Terasaki, 2011 G: Sudo, 2011 H: Lee, 2012 I: Coumaros, 2012 J: Kang, 2012 K: Kudo, 2013
Study design: all studies were retrospective observational cohort studies.
Setting and Country:
A: Japan B: Japan C: Japan D: Japan E: Japan F: Japan G: Japan H: Korea I: France J: Korea K: Japan
Source of funding and conflicts of interest: None.
|
In- and exclusion criteria SR:
According to population, interventions, comparators, outcome measures, and setting (PICOS) criteria, we included patients from randomized or quasi-randomized studies, prospective and retrospective series that directly compared EMR and ESD for treatment of non-pedunculated colorectal lesions >20mm preoperatively assessed as non-invasive according to Kudo classification8 and by the ability to lift when the submucosal layer was injected below the lesion. Exclusion criteria were the carcinoid nature of the lesion and the impossibility to hive-off data from mixed series. EMR had to be performed en bloc when possible, or piecemeal when necessary. ESD could be performed by any of the techniques described in the literature, includ ingusing the different knives available.
11 studies included
Important patient characteristics at baseline: The mean polyp size in the ESD series was 33.7mm versus 27.4mm in the EMR series (p<0.001). The operating time in the ESD series was 66.5 minutes versus 29.1 minutes in the EMR series (p 0.001).
Groups comparable at baseline? No, see above. |
Describe intervention:
Endoscopic submucosal dissection (ESD)
ESD, n
A: 44 B: 27 C: 86 D: 145 E: 96 F: 91 G: 167 H: 314 I: 46 J: 16 K: 485
|
Describe control:
Endoscopic mucosal resection (EMR)
EMR, n
A: 83 B: 120 C: 165 D: 228 E: 116 F: 178 G: 509 H: 209 I:66 J: 50 K: 1437
|
End-point of follow-up:
A: N.A. B: N.A. C: N.A. D: 20 months (i)/ 26 months (c) E: 14 months (i)/ 54 months (c) F: N.A. G: N.A. H: N.A. I: 5 months (i)/ 6 months (c) J: N.A. K: N.A.
For how many participants were no complete outcome data available? Not mentioned
|
Outcome measure-1: en bloc rate Defined as the rate of lesions excised in a single specimen.
* 8 studies
Effect measure: RR, RD, mean difference (95% CI): A: 0.96 (0.68 to 1.36) B: 2.88 (2.05 to 4.03) C: 2.35 (1.90 to 2.90) D: 2.59 (2.12 to 3.17) H: 1.84 (1.61 to 2.12) I: 1.31 (0.96 to 1.78) J: 1.17 (0.70 to 1.97) K: 3.14 (2.90 to 3.40)
Pooled effect (random effects model): 1.96 (95% CI 1.46 to 2.54) favoring ESD Heterogeneity (I2): 93.5%
Outcome measure-2: R0 resection rate Defines as the rate of lesions excised with margins free of disease, as assessed by the pathologist.
* 4 studies
Effect measure: RR, RD, mean difference (95% CI): A: 1.34 (0.89 to 2.01) E: 2.15 (1.64 to 2.82) H: 2.10 (1.78 to 2.48) J: 1.79 (0.60 to 5.32)
Pooled effect (random effects model): 1.95 (95% CI 1.61 to 2.36) favoring ESD Heterogeneity (I2): 32.2%
Outcome measure-3: perforation rate *11 studies Pooled effect (random effects model): 2.76 (95% CI 1.83 to 4.16) favoring EMR Heterogeneity (I2): 0%
Outcome measure-4: bleeding rate * 10 studies Pooled effect (random effects model): 0.69 (95% CI 0.45 to 1.06) favoring ESD Heterogeneity (I2): 0%
Outcome measure-5: complication rate * 5 studies Pooled effect (random effects model): 6.92 (95% CI 2.02 to 23.70) favoring EMR Heterogeneity (I2): 0%
Outcome measure-5: recurrence rate * 10 studies Pooled effect (random effects model): 0.09 (95% CI 0.04 to 0.21) favoring ESD Heterogeneity (I2): 49%
|
Facultative:
Brief description of author’s conclusion: ESD achieves a higher rate of en bloc and R0 resection compared to EMR, at the cost of a higher risk of complications. This, added to an increased need for surgery for oncologic reasons for a plausible tendency to extend indication for endoscopic excision, increases the risk of further surgery after ESD.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question: * Difference in patients characteristics at baseline.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading: Not mentioned, risk of bias is moderate (average 5.6, range 4-6). There is some heterogeneity within studies.
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question; Sensitivity analyses for studies reporting results in full text versus abstract only.
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) Sensitivity analyses for fulltext and abstract results. |
Evidence table for intervention studies
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
|
Barendse, 2018 |
Type of study: RCT
Setting and country: 17 Dutch centres and 1 Belgian centre
Funding and conflicts of interest: The trial was sponsored by the Netherlands Organization for Health Research and Development (ZonMw, file number 17092201). No conflicting interests. |
Inclusion criteria: - patients above 17 years of age - who had a large (≥ 30 mm) non-pedunculated rectal adenoma
Exclusion criteria: Patients with: - suspicion of malignancy based on endoscopic features, biopsies or EUS - a life-threatening systemic disease or moribund clinical condition (ASA classification IV–V) - a non-correctable Coagulopathy - or other contraindications for rectal surgery.
N total at baseline: Intervention: 103 Control: 106
Important prognostic factors2: age ± SD: I: 67.5 ±10.0 years C:67.4 ±11.3 years
Sex: I: 53% M C: 54% M
Adenoma size mm ± SD: I: 45 ± 17 C: 48 ± 15
Groups were comparable at baseline. |
Transanal endoscopic microsurgery (TEM)
|
Endoscopic mucosal resection (EMR) |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: N (%): 14 (13.6%) Reasons: - 2 withdrew consent - 12 had adenocarcinoma
Control: N (%): 19 (17.9%) Reasons: - 1 protocol violation - 3 withdrew consent - 15 had adenocarcinoma
Incomplete outcome data: Intervention: N (%): 4 (4.5%) Reasons: - 1 related death - 1 unrelated death - 2 refused further endoscopies
Control: N (%); 11 (12.6%) Reasons: - 3 unrelated deaths - 3 refused further endoscopies - 3 developed adenocarcinoma in recurrence - 1 discontinued follow-up for breast cancer treatment
|
Recurrence rate: I: 10/89 (11%) C: 13/87 (15%)
Postpolypectomy bleeding: I: 15/89 (17%) C: 19/87 (22%)
|
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Arezzo, 2016 |
Yes, described in methods section |
Yes, described in method section |
Yes, showed in figure. |
Yes, described in tables. |
No, no adjustments for differences in baseline characteristics. Heterogeneity is present |
Yes, risk of bias table and funnel plot for publication bias. |
Yes, random effects model is used, but heterogeneity is present in some comparisons |
Yes, showed in funnel plot. |
Unclear, only reported from SR. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Barendse, 2018 |
Definitely yes;
Reason: Randomisation was done by the central study coordinator using a web-based randomisation module. Computer-generated block randomisation with a 1:1 allocation ratio and concealed random block sizes of two, four and six patients were used. |
Definitely yes;
Reason: Randomisation was done by the central study coordinator using a web-based randomisation module. Computer-generated block randomisation with a 1:1 allocation ratio and concealed random block sizes of two, four and six patients were used. |
Definitely no
Reason: Open-label trial |
Probably no;
Reason: Loss to follow-up was higher in the control group than in the intervention group. Intention-to-treat analyses were performed, but imputation method was not described. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
Some concerns |
- Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
- If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
- Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the methods section of an article can be compared with those whose results are reported.
- Problems may include: a potential source of bias related to the specific study design used (for example lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behavior; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body. Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
- Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favors experimental, or favors comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Thoguluva Chandrasekar, 2020 |
Not in line with PICO |
|
Mangira, 2020 |
No comparison |
|
Urban, 2018 |
sessile and flat polyps >10mm, not 20 mm. |
|
Sauer, 2016 |
No comparison |
|
Moss, 2011 |
No comparison |
|
Jameel, 2006 |
Not in line with PICO |
|
Mehta, 2021 |
CEA, option for considerations |
|
Van Hattem, 2020 |
Not in line with PICO |
|
Bronzwear, 2018 |
Not in line with PICO |
|
Li, 2021 |
No comparison |
|
Russo, 2018 |
Not specifically in polyps >20 mm |
|
Zhao, 2020 |
Not specifically in polyps >20 mm |
|
De Ceglie, 2016 |
Not specifically in polyps >20 mm |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 02-02-2022
Uiterlijk in 2026 bepaalt het bestuur van de NVMDL of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVMDL is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De voorliggende richtlijn betreft een herziening van de NVMDL richtlijn Endoscopische poliepectomie van het colon uit 2019. Alle modules zijn beoordeeld op actualiteit. Vervolgens is een prioritering aangebracht welke modules een daadwerkelijke update zouden moeten krijgen. Hieronder staan de modules genoemd met de wijzigingen. Tevens is per module een inschatting gemaakt voor de beoordeling voor herziening.
|
Uitgangsvraag/onderwerpen |
Wijzigingen richtlijn 2021 |
Uiterlijk jaar voor herziening |
|
Randvoorwaarden voor poliepectomie |
Minimale (tekstuele) aanpassingen |
2026 |
|
Minuscule poliepen ≤ 5 mm en poliepen tussen 10 en 20 mm |
Minimale (tekstuele) aanpassingen |
2026 |
|
Poliepen 6 – 9 mm |
Gereviseerd |
2026 |
|
Sessiele en vlakke poliepen > 20 mm |
Gereviseerd |
2026 |
|
Herkenning van een potentieel maligne poliep |
Gereviseerd |
2026 |
|
Verwijdering van een potentieel maligne poliep |
Wordt behandeld in de CRC richtlijn |
- |
|
Behandeling en preventie van complicaties |
Minimale (tekstuele) aanpassingen |
2026 |
|
Preventief dichtclippen van wondvlak |
Nieuw ontwikkeld |
2026 |
|
Lokaal recidief na poliepectomie |
Gereviseerd |
2026 |
|
Behandeling van lokaal recidief |
Nieuw ontwikkeld |
2026 |
|
Pathologie: biopteren |
Nieuw ontwikkeld |
2026 |
|
Pathologie: weefselverwerking |
Minimale (tekstuele) aanpassingen |
2026 |
|
Prestatie indicatoren |
Minimale (tekstuele) aanpassingen |
2026 |
Belangrijkste wijzigingen ten opzichte van vorige versie
In de gereviseerde modules is de literatuur opnieuw systematisch gezocht en/of is de literatuursamenvatting aangepast. De strekking van de aanbevelingen is nagenoeg hetzelfde gebleven. Tevens zijn er drie nieuwe modules aan de richtlijn toegevoegd. De overige modules zijn opnieuw beoordeeld waarbij er minimale (tekstuele) aanpassingen gedaan. De module 'Verwijderen van een potentieel maligne poliep' is teruggetrokken. Dit onderwerp komt terug in de richtlijn Colorectaal carcinoom.
Algemene gegevens
De ontwikkeling en herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in het voorjaar van 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die direct betrokken zijn bij de zorg voor patiënten met poliepen in het rectum en colon.
Werkgroep
- Dr. L.M.G. (Leon) Moons (voorzitter), MDL-arts UMC Utrecht, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. T. (Tom) Seerden (vice-voorzitter), MDL-arts Amphia Breda, Nederlandse Vereniging van Maag-Darm-Leverartsen
- B.A.J. (Barbara) Bastiaansen, MDL-arts Amsterdam UMC, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. J.J. (Jurjen) Boonstra, MDL-arts, LUMC Leiden, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. A.D. (Arjun) Koch, MDL-arts, Erasmus MC Rotterdam, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. B.W.M. (Marcel) Spanier, MDL-arts, Rijnstate ziekenhuis, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. Y. (Yara) Backes, MDL-arts i.o., Meander Medisch Centrum Amersfoort, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. L. (Lindsey) Oudijk, patholoog Erasmus MC Rotterdam, Nederlandse Vereniging voor Pathologie
- Dr. M.M. (Miangela) Laclé, patholoog UMC Utrecht, Nederlandse Vereniging voor Pathologie
- C. (Christiaan) Hoff, chirurg Medisch Centrum Leeuwarden, Nederlandse Vereniging voor Heelkunde
- R. (Ruud) Blankenburgh, Internist-Oncoloog Saxenburgh Hardenberg, Nederlandse Internisten Vereniging
Klankbordgroep
- J.J. (Jan) Meeuse, NIV
- S. (Silvie) Dronkers, Stichting Darmkanker
- J. (Jannie) Verheij - van der Wiel, Stomavereniging
- J.H.M.A. (Ans) Dietvorst, Stichting Lynch Polyposis
Met ondersteuning van
- Dr. A.N. (Anh Nhi) Nguyen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. E.V. (Ekaterina) van Dorp-Baranova, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Restrictie (zie ook tekst onder de tabel) |
|
Moons (voorzitter) |
MDL-arts, interventie endoscopist, UMC Utrecht, Utrecht, Nederland |
Geen |
Consultant Boston Scientific |
Geen |
|
Seerden (vice-voorzitter) |
MDL arts, Medisch specialistisch bedrijf Amphia te Breda |
Geen |
Geen |
Geen |
|
Bastiaansen |
MDL-arts Amsterdam UMC |
Geen |
Geen |
Geen |
|
Boonstra |
MDL-arts, LUMC, Leiden |
Geen |
Consultant Boston Scientific |
Geen |
|
Koch |
MDL-arts, Erasmus MC, Universitair Medisch Centrum Rotterdam |
Geen |
Consultant Boston Scientific. Pentax Medical, ERBE Elektromedizin, DrFalk Pharma |
Geen |
|
Spanier |
Als vrijgevestigd MDL-arts in dienst bij Cooperatie Medisch Specialisten Rijnstate u.a. (CMSR) |
Bestuurslid CMSR, 4 dagdelen, betaald, vergoeding naar vakgroep MDL Rijnstate |
Geen |
Geen |
|
Backes |
aios MDL, Meander Medisch Centrum Amersfoort |
Geen |
Geen |
Geen |
|
Oudijk |
Patholoog, Erasmus MC Rotterdam |
PPM patholoog Palga: Motiveren gebruik PALGA protocollen, contactpersoon voor PALGA rapportage gebruik protocollen, mede-pathologen en MDO-leden, clinici. Onbetaald. Lid wetenschappelijke commissie Dutch Thyroid Cancer Group: onbetaald. Lid wetenschappelijke adviescommissie Stichting Bijniernetwerk Nederland: onbetaald |
Geen |
Geen |
|
Laclé |
Patholoog UMC Utrecht |
Geen |
Geen |
Geen |
|
Hoff |
Chirurg Medisch Centrum Leeuwarden (via Heelkunde Friesland Groep) (0,6) medisch cobestuurder MCL 0,4) |
Geen |
Geen |
Geen |
|
Blankenburgh |
Internist-Oncoloog, Saxenburgh te Hardenberg |
Geen |
Geen |
Geen |
Het Kennisinstituut in zijn rol als methodologisch ondersteuner, de NVMDL als initiërende vereniging en de richtlijnwerkgroep zijn zich bewust van de belangen die spelen binnen de richtlijnwerkgroep, maar het werd toch noodzakelijk geacht om de betreffende inhoudelijk experts op dit gebied bij de richtlijn te betrekken. Tijdens de commentaarfase werd de NVMDL verzocht om bij het aanleveren van commentaar kritisch te zijn op de gemelde belangen en geformuleerde aanbevelingen en onderbouwing en om experts, vrij van belangen, expliciet te verzoeken om de richtlijn te beoordelen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden vanuit patiëntenverenigingen in de klankbordgroep met de conceptrichtlijn mee te laten lezen. De commentaren zijn besproken in de werkgroep en verwerkt. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Stichting Darmkanker, Stomavereniging en Stichting Lynch Polyposis.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen. De werkgroep heeft ook interne kwaliteitsindicatoren ontwikkeld.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging van Maag-Darm-Leverartsen, 2019) op noodzaak tot revisie. Op basis van de geprioriteerde knelpunten zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, en bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
