Lokaal recidief na poliepectomie
Uitgangsvraag
Wat is het beste beleid ter voorkoming en ten aanzien van lokaal recidief na endoscopische resectie van colon adenomen en sessiel serrated laesies?
Aanbeveling
Overweeg om 6 maanden na piecemeal endoscopische mucosale resectie van poliepen > 20 mm het litteken van pEMR endoscopisch te inspecteren.
Streef bij een EMR of ESD resectie naar een en bloc resectie.
Bij piecemeal EMR dient men te streven naar complete snaarresectie van de laesie waarbij adequate resectiemarges (rand van 1 tot 2 mm endoscopisch normale mucosa) worden aangehouden. Hierbij dient veilige resectie met minimumaantal resectie fragmenten te worden nagestreefd.
Overweeg bij onvolledige snaar poliepectomie adjunctieve behandelingen om het risico op een lokaal recidief te verlagen.
Het is aanbevolen het poliepectomie litteken zorgvuldig endoscopisch te inspecteren inclusief het gebruik van imaging modaliteiten (NBI en zoomfunctie) om het lokaal recidief op te sporen.
Snaar resectie heeft de voorkeur als resectie techniek van lokale recidieven. Indien snaar resectie niet mogelijk is, kan geopteerd worden voor ablatieve behandelingen, ESD, eFTR of chirurgische resectie.
Het wordt aangeraden, nadat al het zichtbare adenomateus weefsel is verwijderd, de randen van het pEMR wondvlak na te behandelen met STSC.
Het is aannemelijk indien endoscopische resectie van recidief faalt en chirurgische resectie wordt overwogen eerst overleg te hebben met endoscopist met ervaring in complexe poliepectomie.
Overwegingen
Poliepen < 20 mm
Literatuur omtrent lokaal recidief risico na en bloc en piecemeal poliepectomie van kleine poliepen (< 20 mm) is beperkt. Veelal werd de aanwezigheid van residueel weefsel na poliepectomie onderzocht maar niet het lokaal recidief bij surveillance colonoscopie (Pohl, 2013; Ferlitsch, 2017; Kawamura, 2017). Ten tweede rapporteren de meeste studies de lokaal recidief data na piecemeal poliepectomie (poliepen 10 tot 20 mm) niet apart, worden de data gepoold met data van grotere poliepen en zijn de intervallen van surveillance tussen de studies verschillend waardoor het moeilijk is om objectief beeld te krijgen naar werkelijk lokaal recidief percentage in deze groep. Voor aanbevelingen omtrent surveillance interval na een en bloc poliepectomie in het kader van opsporing van lokale recidieven verwijzen we naar de richtlijn colonoscopie surveillance.
Omdat algemeen wordt aangenomen dat uit het residueel adenomateus weefsel na poliepectomie later lokaal recidief ontstaat, zijn endoscopische resectie technieken aan te bevelen waarbij de kans op complete resectie het hoogst is en kans op complicaties het laagst is. Daarnaast blijft het onduidelijk in hoeverre residueel weefsel/recidief in deze groep leidt tot hogere colorectale kanker incidentie en mortaliteit in de follow-up (Hassan, 2020). Op basis van bovenstaande overwegingen volgen we de ESGE-richtlijnen om vervroegde endoscopische surveillance 6 maanden na pEMR van 10 tot 20 mm poliepen alleen te verrichten indien er twijfel bestaat over de kwaliteit/radicaliteit van de pEMR resectie bij de index scopie en dus niet meer standaard aan te bieden aan alle pEMR van poliepen tussen de 10 en 20 mm.
Poliepen > 20 mm
De werkgroep sluit aan bij de ESGE en BSG richtlijnen dat piecemeal resectie van sessiele > 20 mm poliepen een onafhankelijke risicofactor op lokaal recidief is (Rutter, 2015; Ferlitsch, 2017). Daarnaast lijkt het lokaal recidief risico hoger te liggen bij poliepen > 40 mm grootte, lokalisatie ter hoogte van klep van Bauhin, eerder mislukte resectiepogingen en poliepen met size, morphology, site, access (SMSA) level 4. Poliepectomie van dergelijke poliepen is complex en de kans op residueel weefsel dat later uitgroeit tot lokaal recidief ligt hoger. Als behandeling van het residueel weefsel kan adjunctieve behandeling met APC van residueel adenomateus weefsel bij onvolledige endoscopische snaar resectie overwogen worden ter preventie van later lokaal recidief (Regula, 2003; Neneman, 2006). Echter de studies die de toegevoegde waarde hiervan onderzochten zijn single center en retrospectief van opzet, waarbij sommige kleine aantallen patiënten includeren. Gezien het ontbreken van prospectieve gerandomiseerde en vergelijkende studies tussen verschillende adjunctieve behandelingen bij incomplete poliepectomie kan er daarom geen aanbeveling worden gedaan welke techniek de voorkeur geniet. De werkgroep is van mening dat wanneer complete snaar resectie onmogelijk is, adjunctieve behandeling van het residueel weefsel sterk te overwegen valt om het lokaal recidief risico te verminderen. Het is ook aanbevolen aanvullende behandeling met STSC van de randen van het EMR vlak na macroscopisch complete resectie van al het zichtbaar poliepweefsel uit te voeren zodat het risico op lokaal recidief potentieel verkleint (Klein, 2019).
7 tot 10% van de lokale recidieven worden gevonden bij het biopteren van macroscopisch normale postpoliepectomie littekens. Dit suggereert dat standaard endoscopische detectie van lokaal recidieven onvoldoende is. Een mogelijke reden is dat vlakke en serrated recidieven worden gemist. Dit wordt bevestigd door recente studies waarbij toegevoegde waarde van NBI en near focus in detectie van lokaal recidief werden onderzocht (Desomer, 2017; Kandal, 2019). Echter door zorgvuldige endoscopische inspectie inclusief NBI en zoomfunctie kon zeer hoge NPV verkregen worden voor lokaal recidief. Samenvattend pleiten deze bevindingen voor zorgvuldige endoscopische inspectie van postpoliepectomie litteken met advanced imaging modaliteiten (zoomfunctie en NBI) bij surveillance colonoscopie en voor het biopteren van het postpoliepectomie litteken bij twijfel. Indien het endoscopiecentrum geen coloscopen heeft met advanced imaging modaliteiten (zoomfunctie en NBI) is standaard biopteren van het litteken bij surveillance colonoscopie aanbevolen.
Recentere data omtrent het optreden van lokale recidieven na piecemeal resectie suggereren dat er een hogere opbrengst is voor detectie van lokale recidieven 6 maanden na pEMR in vergelijking met de huidig aanbevolen 4 maanden. We stellen daarom voor om de eerste endoscopische surveillance na pEMR na 6 maanden uit te voeren, ook in geval van HGD. Hierbij dienen we in beschouwing te nemen dat correct histologisch onderscheid tussen invasief carcinoom en hooggradige dysplasie niet altijd kan worden gegarandeerd na pEMR. Daarom kan in individuele gevallen van HGD gekozen worden voor een verkorte surveillance termijn van 3 maanden. De keuze om het surveillance interval in geval van HGD te verkorten naar 3 maanden ligt in principe bij de endoscopist van index pEMR en hangt onder andere af van de histologische beoordeling op radicaliteit van de HGD alsmede de endoscopische beoordeling op radicaliteit (complexiteit procedure, noodzaak adjunctieve ablatieve therapie et cetera). Op basis van literatuur, bovenstaande overwegingen en bij het ontbreken van prospectieve validatie van het SERT-model stellen we volgend algoritme voor als leidraad voor de endoscopische surveillance na piecemeal endoscopische mucosale resectie.
Figuur 1 Endoscopische surveillance na pEMR van > 20 mm poliepen
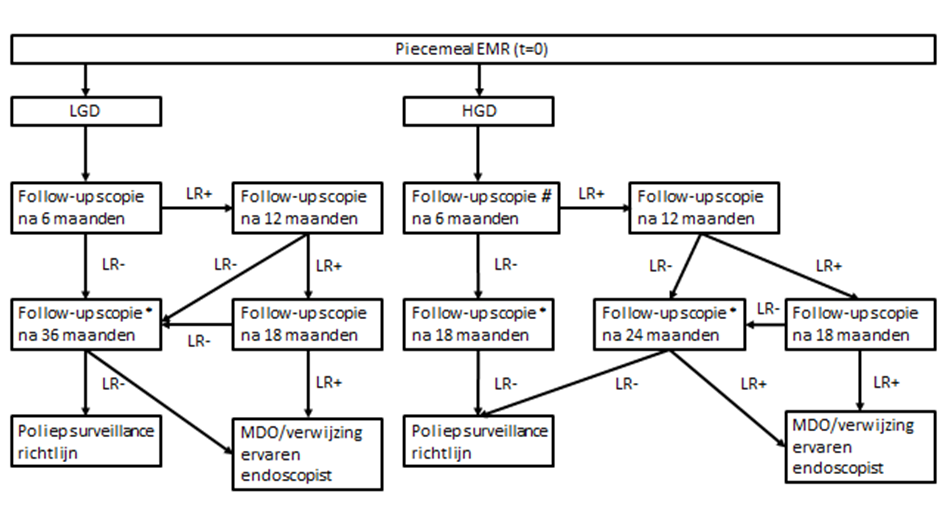
Legenda: Flowchart na een piecemeal EMR. Follow-up wordt gedifferentieerd tussen de histologie van de poliep die werd verwijderd. Dit betreft laaggradige dysplasie (LGD) en hooggradige dysplasie (HGD). Dit omvat alle subtypen (tubulair, tubulovilleus, villeus en sessiel serrated). De tijdstermijnen betreffen tijden ten opzichte van de baseline coloscopie met de piecemeal EMR.
LR-: Geen aanwijzingen voor lokaal recidief
LR+: Lokaal recidief welke in dezelfde sessie behandeld is.
Poliep surveillance richtlijn betreft de richtlijn surveillance na coloscopie 2013.
MD)/verwijzing ervaren endoscopist: In het MDO moet worden gekeken naar alternatieven voor de lokale behandeling van het 3e recidief dan re-EMR of ablatieve behandeling (APC/STSC). Hierbij dient aan te beve- len contact te leggen met een endoscopist met veel ervaring in de behandeling van lokale recidieven.
* Het wordt aanbevolen de inspectie van het litteken te combineren met een volledige coloscopie.
# Overweeg interval te verkorten naar 3 maanden indien er evident risico bestaat op lokale irradicaliteit van de hooggradige component, zoals persisterende twijfel tussen HGD danwel T1 CRC
Als laatste valt te vermelden dat meeste studies aantonen dat de meeste lokale recidieven klein zijn en endoscopisch succesvol behandeld kunnen worden met snaar resectie (Moss, 2015; Ferlitsch, 2017). In de situatie dat dit niet het geval is, kunnen ablatieve technieken, ESD, full thickness resectie of onderwater EMR overwogen worden. Deze technieken zijn echter nooit prospectief gerandomiseerd met elkaar vergeleken, waardoor er geen bewijs is ten aanzien van eventuele superioriteit van de ene behandeling ten opzichte van de andere.
Serrated Poliepen (SP)
Prospectieve studies naar het lokaal recidief risico na poliepectomie van SP zijn schaars en de resultaten zijn op meerdere fronten tegenstrijdig. De werkgroep kan daarom geen aanbevelingen doen.
Onderbouwing
Achtergrond
Poliepectomie van het colon reduceert de incidentie en mortaliteit van het colorectaal carcinoom, maar desondanks blijft er een risico op colorectaal carcinoom bestaan en treden er intervalscarcinomen op na poliepectomie (Leung, 2010; Zauber, 2012). Een van de voornaamste reden voor dit laatste is onvolledige endoscopische resectie van colonpoliepen (Paddy, 2005; Robertson, 2005; Huang, 2012). Hieruit kan een lokaal recidief groeien waaruit later een colorectaal carcinoom kan ontstaan. Een tweetal studies hebben aangetoond dat ongeveer een kwart van alle intervalcarcinomen na colonoscopie mogelijk het gevolg zijn van incomplete poliepectomieën (Robertson, 2005; Farrar, 2006).
De meeste bezorgdheid hierbij gaat uit naar endoscopische resectie van grotere sessiele en vlakke adenomateuze poliepen. Meestal worden deze laesies met piecemeal endoscopische mucosale resectie (pEMR) verwijderd. Hoewel deze techniek veilig is, blijkt er bij pEMR een relatief hoog lokaal recidief percentage te zijn dat tussen de 12 en 16% ligt, oplopend naar 30% bij pEMR van laesies > 40 mm (Moss, 2011; Margagoni, 2016). Dit heeft er toe geleid dat meerdere richtlijnen versnelde surveillance bij pEMR aanbevelen, endoscopische submucosale dissectie (ESD) opkomt als resectietechniek omwille van zijn lagere recidief percentage en adjuvante behandelingen bij pEMR worden onderzocht om lokaal recidief percentage te doen dalen (Cairns, 2010; Lieberman, 2012; Oka, 2015).
Voor de literatuurstudie heeft de werkgroep zich beperkt tot lokale recidieven van colon adenomen en serrated poliepen. Lokaal recidieven na poliepectomie bij patiënten met inflammatory bowel disease (IBD) of erfelijke poliep syndromen vallen buiten deze module alsook het recidief risico na endoscopische verwijdering van T1 colorectaal carcinomen. Voor aanbevelingen omtrent surveillance interval na een en bloc poliepectomie in het kader van opsporing van lokale recidieven verwijzen we naar de richtlijn colonoscopie surveillance.
Conclusies / Summary of Findings
|
No GRADE |
Lokaal recidief percentage ligt hoger bij piecemeal EMR resecties dan bij en bloc EMR en ESD resectie.
Bronnen: Oka, 2015; Belderbos, 2014 |
|
No GRADE |
Het is aannemelijk om poliep grootte > 40 mm, lastige lokalisatie (klep van Bauhin, appendix, divertikel of linea dentata), eerder mislukte resectiepogingen en poliepen met size, morphology, site, access (SMSA) level 4 als risicofactoren voor lokaal recidief te beschouwen bij pEMR.
Bronnen: Ferlitch, 2017; Rutter, 2015 |
|
No GRADE |
7 tot 10% van de lokale recidieven worden niet gedetecteerd bij standaard routine endoscopische controle van het poliepectomie litteken bij surveillance colonoscopie.
Bronnen: Knabe, 2013; Barendse, 2014 |
|
No GRADE |
De meeste lokale recidieven kunnen met behulp van advanced imaging (zoom + NBI) endoscopisch gedetecteerd worden.
Bronnen: Desomer, 2017; Kandel, 2019 |
|
No GRADE |
De meeste lokale recidieven worden binnen 6 maanden na endoscopische resectie gevonden.
Bronnen: Moss, 2015; Belderbos, 2014 |
|
No GRADE |
De meeste lokale recidieven zijn klein en kunnen endoscopisch behandeld worden.
Bronnen: Moss, 2015; Oka, 2015 |
Samenvatting literatuur
Lokaal recidief na endoscopische resectie van poliepen < 20 mm
Literatuur omtrent lokaal recidief risico na poliepectomie van kleine poliepen is beperkt. Een retrospectieve studie die cold forceps poliepectomie (CFP) bestudeerde als resectietechniek bij poliepen < 5 mm (n=1111) rapporteerde een lokaal recidiefpercentage van 17% bij CFP over periode van 59.7 maanden. Multivariate analyse toonde dat 4 tot 5 mm poliepen en rechtszijdige poliepen risicofactor waren voor lokaal recidief (HR 1.37; 95% CI 1.01 tot 1.86 - HR 1.49; 95% CI 1.08 tot 2.04 respectievelijk). Verder was het lokaal recidief risico voor advanced adenoom 0.5%.(Lee, Park, 2017). Andere onderzoekers die het lokaal recidief risico onderzochten na cold snare polypectomie (CSP) melden een 1.4 % lokaal recidief risico bij < 10 mm poliepen en 5.4 % bij > 10 mm poliepen na 1 jaar (Murakami, 2000). Recentelijk werd het lokaal recidief risico na poliepectomie van < 15 mm adenomateuze poliepen met laaggradige (LGD) en hooggradige (HGD) dysplasie onderzocht. De lokaal recidief risico’s bedroegen respectievelijk 1.3% voor adenoom met LGD en 5.7% voor adenoom met HGD binnen de 3 jaar na resectie (Facciorusso, 2016).
Lokaal recidief bij endoscopische resectie van poliepen > 20 mm
Meerdere studies onderzochten het lokaal recidief na poliepectomie van deze laesies. Deze poliepen worden in de praktijk door middel van en bloc EMR, piecemeal EMR of ESD verwijderd. De meeste studies hebben betrekking tot lokaal recidief risico na pEMR.
Risico op lokaal recidief bij een en bloc EMR
En bloc resectie door middel van EMR wordt in 16 tot 48% van deze laesies gerapporteerd (Tajika, 2011; Buchner, 2012; Lee, 2012; Moss, 2015; Oka, 2015). Twee grote cohort studies rapporteerde lokaal recidief percentage van 2.4 tot 2.8% bij surveillance colonoscopie (Moss, 2015; Oka, 2015). Deze cijfers liggen in de lijn met resultaten van een systematische review en meta- analyse die een percentage van 3% (95%CI 2% tot 5%; P<0.0001) vermeldt (Belderdos, 2014).
Risico op lokaal recidief bij piecemeal EMR
pEMR heeft vergeleken met een en bloc EMR een hoger lokaal recidief percentage dat tussen de 12 tot 16% ligt, oplopend naar 30% bij pEMR van laesies > 40 mm (Moss, 2011; Belderbos, 2014; Margagoni, 2016). Om het risico op lokaal recidief beter in te schatten ontwikkelde Australische onderzoeksgroep de Sydney EMR recurrence Tool (SERT). Door middel van een puntenscore te koppelen aan criteria: grootte > 40 mm (2 punten), intraprocedurele bloeding (1 punt) en HGD (1 punt) konden ze een lage risico groep voor lokaal recidief definiëren. pEMR met SERT 0 score bleek een cumulatieve recidief incidentie te hebben van 9.8 % na 6 maanden opklimmend naar 11.6 % na 18 maanden. Deze recidieven bleken klein en waren endoscopisch goed te behandelen. Daarentegen bedroeg de cumulatieve recidief incidentie voor laesies met SERT 1 tot 4 score respectievelijk 23% na 6 maanden en 36.3 % na 18 maanden. Op basis van deze bevindingen propageren de auteurs dat de eerste surveillance colonoscopie na 18 maanden kan worden overwogen na pEMR van > 20 mm poliep met SERT score 0 (Tate, 2017).
Risico op lokaal recidief na ESD
Op basis van de huidige literatuur lijkt ESD van colorectale grote poliepen een laag lokaal recidief percentage te hebben. De lokaal recidief percentages liggen tussen de 1.4 en 2.9% bij follow-up colonoscopie (Oka, 2015; Shigita, 2017; Yamada, 2017). Vergelijkbare lage lokaal recidief percentage werden ook bij hybrid ESD beschreven (combinatie van ESD met EMR)(Terasaki, 2012; Okamoto, 2017).
Risicofactoren en lokaal recidief
Uit de studies die lokaal recidief na pEMR onderzochten, bleek dat poliepgrootte een belangrijke risicofactor was voor lokaal recidief. Met name was er bij pEMR van laesies > 40 mm een hoger recidief risico (Moss, 2011; Buchner, 2012; Lee, 2013; Longcroft-Wheaton, 2013). Verder toonden meerdere studies aan dat het lokaal recidiefpercentage stijgt bij toename van het aantal resectie fragmenten bij pEMR (Hotta, 2010; Saito, 2010; Sakamoto, 2012; Oka, 2015). Zo bleek uit een grote prospectieve multicenterisch studie dat recidief percentage bij 2 resectie fragmenten 4.9% bedroeg en het verder opliep naar 25.5% bij vier resectie fragmenten bij pEMR (Oka, 2015). Vergelijkbare recidief percentages bij pEMR werden gevonden in studie van Terasaki (2012). Naast het risico op recidief zijn er ook aanwijzingen dat een hoger aantal resectie fragmenten bij pEMR leidt tot sneller ontstaan van een lokaal recidief. Zo bleek het interval tussen resectie en lokaal recidief bij pEMR met 2 tot 3 resectie fragmenten tussen de 9 en 10 maanden te liggen en bij > 4 resectie fragmenten tussen de 3.8 en 5 maanden (Komeda, 2019; Hassan, 2020). Piecemeal karakter van de endoscopische resectie vormt niet alleen bij EMR een risicofactor voor lokaal recidief, maar ook bij ESD. De bovenvermelde multicenter studie rapporteerde dat het lokaal recidief percentage steeg bij en bloc ESD van 1.4% naar 24.9% bij piecemeal resectie met 4 resectie fragmenten (Oka, 2015).
Uit de ACE-studie bleek daarnaast dat buiten de grootte van de poliep ook het gebruik van APC tijdens de EMR, intraprocedurele bloeding gedurende EMR onafhankelijke risicofactoren voor lokaal recidief waren (Moss, 2015). Een tweede studie bevestigde dat het gebruik van APC bij behandeling van adenoom restanten bij onvolledige pEMR een risicofactor voor lokaal recidief was (Margagoni, 2016).Tegenstrijdige associaties werden gerapporteerd tussen dysplasiegraad en het risico van lokaal recidief. Uit een Italiaanse studie bleek dat het risico op lokaal recidief bij endoscopische resectie van poliepen hoger lag bij laesies met hooggradige dysplasie ten opzichte van laesies met laaggradige dysplasie (Facciorusso, 2016). Hooggradige dysplasie werd ook als onafhankelijke risicofactor voor lokaal recidief aangetoond in de Sydney EMR recurrence tool studie (Tate, 2017). Anderzijds kon de ACE-studie hooggradige dysplasie niet als risicofactor voor lokaal recidief bevestigen (Moss, 2015).
Omtrent de relatie tussen morfologie van grote poliepen en het recidief risico na endoscopische resectie zijn er ook tegenstijdige resultaten. Multivariate analyse van een Japanse multicenter cohortstudie toonde aan dat lateraal spreidende tumoren (LST) van het granulaire type een verhoogd risico hadden voor lokaal recidief na resectie (Oka, 2015). Dit kon echter in een Australische grote multicentrische studie niet bevestigd worden (Moss, 2011).
Als laatste valt te vermelden dat naast grootte > 40 mm, moeilijke lokalisatie (klep van Bauhin, appendix, divertikel of linea dentata), eerder mislukte resectiepogingen en poliepen met size, morpholoy, site, access (SMSA) level 4 als risicofactoren voor lokaal recidief worden beschouwd (Ferlitsch, 2017). Bij SMSA level 4 poliepen was lokaal recidief risico 23,5 % vergeleken met 5,5 % voor SMSA level 2 en 13,2 % voor SMSA level 3 poliepen bij eerste follow up colonoscopie (4 tot 6 maanden) na resectie (Sidhu, 2018).
Preventieve maatregelen in verband met voorkomen van lokaal recidief na pEMR
Meerdere opties waaronder verruiming van de laterale resectie randen, adjunctieve en adjuvante behandelingen na pEMR zijn onderzocht om het lokaal recidief bij pEMR te verminderen.
- Verruiming van laterale resectie randen
Tegenstrijdige resultaten zijn gepubliceerd voor de reductie van lokaal recidief risico door verruiming van laterale snijranden bij initiële EMR. Sommige studies suggereren dat dit het risico van lateraal recidief zou kunnen doen dalen, anderzijds toonde een recentelijke prospectieve cohortstudie dat ruimere pEMR geen toegevoegde waarde had om het lokaal recidief percentage te verminderen (lee, 2012; Sakamoto, 2012; Hong, 2015; Bahin, 2016).
- Argon plasma coagulatie (APC) en hot avulsie
Verschillende studies onderzochten de effectiviteit van argon plasma coagulatie en hot avulsie bij poliepectomie om poliep radicaal te verwijderen en recidief te vermijden. Hierbij dient bij evaluatie van de studies onderscheid te worden gemaakt of ze werden ingezet als adjuvante behandeling bij macroscopische radicale pEMR of adjunctieve behandeling bij incomplete pEMR.
- APC en STSC bij macroscopisch radicale pEMR
In een studie van Brooker (2002) werden de randen na pEMR waarbij geen macroscopisch adenomateus restant werd gevisualiseerd met APC nabehandeld. Deze nabehandeling resulteerde in significant lager lokaal recidief percentage (10%) bij surveillance colonoscopie ten opzichte van de laesies die geen APC nabehandeling kregen (63%). Daarentegen kon in een andere kleine studie de toegevoegde waarde van APC niet worden bevestigd (Zlataniz, 1999). Een recente multicenter, prospectieve gerandomiseerde studie onderzocht preventieve behandeling van de randen van het wondgebied met snaar tip contactcoagulatie (snare tip soft coagulation; 80 W soft coagulatie; STSC)(n=210) na een macroscopisch radicale EMR resectie. In deze studie bleek het recidief percentage in de STSC arm met 10/192 (5.2%) veel lager te zijn dan in de controle arm/niet-nabehandelde arm (37/176, 21%) (Klein, 2019). Een retrospectieve monocenter studie onderzocht het lokaal recidief risico na pEMR (n = 101) + adjuvante behandeling van de macroscopische vrije snijranden met APC (50 rechter colon - 70 W linker colon) versus STSC (20 W soft coagulatie). Er was geen significant verschil (P=0.34) tussen het lokaal recidief risico in APC groep (16%) versus de STSC groep (13%) (Katsinelos, 2019).
- APC, hot avulsion, en cold avulsion met soft coagulatie (CAST) bij incomplete macroscopische pEMR
Zlatanic (1999) rapporteerde een 50% reductie in lokaal recidief bij ablatie van adenoom restanten bij incomplete pEMR ten opzichte van onbehandelde restanten bij follow-up colonoscopie (n=77, 100% naar 50%). Deze resultaten worden ondersteund door een studie die 90% eradicatie aantoonde bij adjunctieve APC behandeling bij incomplete piecemeal EMR (Regula, 2003) en de studie van Neneman (2006). Echter, een grotere studie in 2011 toonde aan dat APC ablatie van adenoom restanten na piecemeal EMR het risico op lokaal recidief niet verminderde (n=105; OR=0.46, p=0.29) (Mannath, 2011). Verder valt te vermelden dat hot avulsion met APC werd vergeleken als behandelingsmodaliteit bij het behandelen van residueel adenomateus weefsel bij onvolledige pEMR. Bij surveillance colonoscopie bleek dat het lokaal recidief percentage 59.3% bedroeg voor de APC groep en 10.3% in de hot avulsion groep was (Holmes, 2016). Als laatste valt te vermelden dat recentelijke Australische studie cold avulsion met snare-tip soft coagulation (CAST) onderzocht als aanvullende behandeling bij incomplete pEMR. Lokaal recidief percentage was voor LST laesies die complete pEMR ondergingen 15.3%, 15.2% bij voorbehandelde LST met incomplete pEMR + CAST en 27.5% bij incomplete pEMR + CAST van niet voorbehandelde LST (Tate, 2018).
- Onderwater pEMR
Recente meta-analyse (7 studies, totaal 1237 poliepen, 614 UEMR en 623 CEMR) vergeleek uitkomsten van onderwater EMR en klassieke EMR en rapporteerde een significante reductie in lokaal recidief risico (OR.30; 95% CI, 0.16 tot 0.57; P = 0,0002) met onderwater EMR techniek vergeleken met klassieke EMR. Subgroep analyse wees uit dat de hogere ratio van en bloc resectie bij poliepen > 20 mm met de onderwater EMR techniek vergeleken met klassieke EMR een verklaring kon zijn (Choi, 2021).
Tijdsinterval van lokale recidief na endoscopische resectie
Op basis van de huidige literatuur kan geen uitspraak worden gedaan omtrent het tijdsinterval tussen lokaal recidief en resectie bij poliepen < 20 mm. Bij EMR resectie van poliepen > 20 mm blijkt uit een recente systematisch review en meta-analyse dat 76% van de lokale recidieven optreden 3 maanden na de initiële resectie en dat 96% van de recidieven binnen de 6 maanden na de resectie worden gevonden (Belderbos, 2014). Het kleine aantal latere lokale recidieven kunnen echter tot 36 maanden na EMR optreden (Hotta, 2009; Belderbos, 2014; Moss, 2015). Recent werd in een prospectieve multicentrische gerandomiseerde studie twee surveillance protocollen na pEMR van advanced adenoma vergeleken. In de ene groep bestond de surveillance uit follow-up colonoscopies 3, 6, 12, 24 maanden na pEMR. In de ander groep werden de surveillance colonoscopies verricht na 6, 12, 24 maanden. Uit deze studie bleek de additionele colonoscopie 3 maanden na pEMR geen klinische meerwaarde te bieden (Nakajima, 2021).
Lokaal recidief en serrated poliepen (SP)
Studies omtrent lokaal recidief risico na endoscopische resecties van SP’s betreffen meestal studies die het lokaal risico onderzochten bij grote sessiel serrated laesies (SSL) die endoscopisch werden verwijderd.
Een Japanse studie keek naar het lokaal recidief risico bij koude snaar poliepectomie van serrated poliepen tussen 10 en 20 mm. Ze vonden bij mediane follow-up periode van 18 maanden een lokaal recidief risico van 4,7 % en 6,3 % bij respectievelijk 10 tot 14 mm en 15 tot 20 mm laesies (Yoshida, 2021).
Recentelijk zijn er twee studies verschenen (Rex, 2015; Burgess, 2017). De eerste studie betrof een single center retrospectieve studie (n=362) die het lokale recidief onderzocht na pEMR van SSL > 20 mm. Deze kon geen verschil in lokaal recidief risico aantonen tussen colon adenoom versus SP (Rex, 2015). Daarentegen suggereert de data uit een Australische prospectieve multicenter register (n=2000) dat het lokale recidief percentage voor SSL’s (> 20 tot 25 mm) die met pEMR werden gereseceerd, lager lag dan voor adenomen. Het lokaal recidief percentage 12 maanden na resectie bedroeg 7% voor SSL versus 20% voor sporadisch colon adenoom. Dit verschil was met name sterk uitgesproken bij de SSL tussen de 20 tot 25 mm. Daar lag het recidief risico 8 keer lager dan bij sporadisch colon adenoom. Bij de grotere SSL’s bleek het recidief risico echter niet te verschillen van colon adenoom (Pellise, 2017).
Endoscopische detectie van lokaal recidief bij surveillance colonoscopie
Meerdere studies hebben gekeken naar endoscopische detectie van lokaal recidief na poliepectomie. Een retrospectieve studie rapporteerde dat bij 7.2% van de histologisch bewezen lokale adenomateuze recidieven ter hoogte van poliepectomie litteken er geen macroscopisch zichtbaar adenoom werd opgemerkt (Khashab, 2009). In studie van Knabe (2014) werd in 7% van de endoscopisch onverdachte post EMR littekens lokaal adenomateus weefsel in biopten aangetoond. Verder bleek uit Nederlandse observationele prospectieve multicentrische studie bij pEMR van grote rectale adenomen dat 10% van de histologisch bewezen lokale recidieven in normaal endoscopisch uitziende post EMR littekens bij surveillance colonoscopie werd teruggevonden (Barendse, 2014).
De afwezigheid van lokaal recidief bij eerste surveillance colonoscopie bleek voorspellend te zijn voor het uitblijven van eventuele late recidieven. De studie van Kashab (2009) toonde dat 97.9% van littekens zonder lokaal recidief bij vroegtijdige surveillance colonoscopie (3 tot 6 maanden na endoscopisch resectie) na 1 jaar vrij bleven van recidief. Dit percentage ligt in lijn met de bevindingen van de ACE-studie waar 4% late lokale recidieven (16 maanden na resectie) optraden bij patiënten die geen aanwijzingen hadden bij hun eerste surveillance colonoscopie 6 maanden na de resectie (Moss, 2015). Iets hogere percentages werden gerapporteerd door studie van Knabe (2014) Daarin werd een laat recidief percentage gerapporteerd van 10.5%.
Om de diagnostische accuraatheid van endoscopie te verbeteren bij de detectie van lokaal recidieven zijn verschillende imaging modaliteiten zoals virtuele chromoendoscopie met confocal laser endomicroscopie en narrow band imaging (NBI) onderzocht. De combinatie van de virtuele chromoendoscopie met confocal laser endomicroscopie bleek een accuraatheid, sensitiviteit, specificiteit, positieve predictieve waarde en negatieve predictieve waarde (NPV) te hebben van 90%, 100%, 87%, 67%, en 100%, respectievelijk (Shabid, 2012). NBI bleek uit een prospectieve single center studie endoscopische inspectie voor een significant betere detectie van lokaal recidief te zorgen. NPV bedroeg voor endoscopische inspectie 93.6% en voor endoscopische inspectie met NBI 98.6% (Desomer, 2017). In deze studie bleek dat 75% van de vlakke lokale adenomateuze recidieven alleen door NBI werden gedetecteerd. In recente multicentrische prospectieve ESCAPE trial werd tevens met combinatie van near focus en NBI een zeer hoge NPV van ³ 97% voor lokaal recidief ter hoogte van litteken na EMR gevonden bij surveillance colonoscopie (Kandel, 2019).
Behandeling van lokaal recidief
Lokale recidieven die bij surveillance colonoscopie worden gedetecteerd, zijn veelal klein, unifocaal en kunnen effectief endoscopisch met snaar resectie worden behandeld (Makazu, 2015; Moss, 2015; Oka, 2015; Ferlitsch, 2017). Na behandeling van het eerste recidief blijkt dat tussen de 20 en 33% een tweede recidief krijgt (Knabe, 2014; Moss, 2015). Snaar resectie lijkt superieur te zijn vergeleken met andere endoscopische modaliteiten (Moss, 2015). Indien het recidief niet in aanmerking komt voor snaar resectie door bijvoorbeeld non-lifting sign of fibrose kunnen andere endoscopische modaliteiten overwogen worden. Hot avulsie techniek bleek voor kleine adenomateuze recidieven effectief te zijn (Andrawes, 2014; Veerappan, 2014). Koude avulsie met CAST lijkt veelbelovend (Tate, 2018). Argon plasma coagulatie kan ook worden ingezet bij behandeling van lokale recidieven. Een kleine retrospectieve studie rapporteerde dat bij lokale recidieven met submucosale fibrose dat submucosale injectie met argon plasma coagulatie in 82% van de recidieven succesvol kon behandeld worden (Tsiamoulos, 2012). Als alternatief kan ESD overwogen worden voor en bloc resectie bij lokale recidieven, maar percentage R0 resectie ligt lager dan ESD van niet voorbehandelde adenomateuze laesies (Sakamoto, 2011). Onderwater EMR werd ook als een alternatieve resectie techniek bij lokale recidieven na eerdere EMR geëvalueerd in een kleine single center studie. In deze studie bleek dat en bloc resectie ratio voor onderwater EMR 47.2% bedroeg versus 15.9% voor standaard EMR (Kim, 2014). Verder valt te vermelden dat recentelijk over the scope clip instrumenten zijn ontwikkeld die de mogelijkheid bieden om full tickness colorectale wand resectie uit te voeren ter hoogte van non lifting lokale adenomateuze recidieven (Schmidt, 2015; Backes, 2017).
Als laatste valt nog te vermelden dat chirurgie als behandeloptie wordt aanbevolen indien het lokaal recidief niet endoscopisch te reseceren is (Rutter, 2015). Op basis van de literatuur lijkt 1 tot 2% van de lokale recidieven te moeten worden doorverwezen voor chirurgie (Moss, 2011; Belderbos, 2014). Uit de ACE-studie bleek verder dat lokale recidieven die verwezen werden voor chirurgie, laesies betroffen met uitgebreide submucosale fibrose, ingroei in de appendix opening, circumferentiële betrokkenheid van de klep van Bauhin en ileale betrokkenheid (Moss, 2015; Nanda, 2015). Internationale richtlijnen raden daarnaast aan dat de beslissing voor chirurgische resectie wordt genomen na multidisciplinair overleg waarin endoscopist met ervaring in resectie van endoscopische complexe poliepen en gastro-intestinaal chirurg met laparoscopisch ervaring participeren (Rutter, 2015; Ferlitsch, 2017).
Surveillance en lokaal recidief bij piecemeal EMR
Tot 2013 werd in het algemeen aanbevolen om 4 maanden na piecemeal verwijdering van grote poliepen een surveillance endoscopie te verrichten. Dit was onafhankelijk van de histologie. In de laatste jaren echter zijn er nieuwe data beschikbaar gekomen die betere inschatting geven van het lokaal recidief risico. Uit een systematische review en meta-analysis bleek dat 76% van de lokale recidieven zich binnen de 3 maanden, 96% na 6 maanden, 98% zich na 12 maanden presenteren (Belderbos, 2014). Recentelijk werd ook SERT-model naar voorgeschoven als predictie model om surveillance intervallen te stratificeren na pEMR. Hierbij worden 3 risicofactoren gebruikt: aanwezigheid van hooggradige dysplasie, > 40 mm grootte en het optreden van intraprocedurele bloeding tijdens piecemeal EMR (Tate, 2017). Met dit model wordt voorgesteld het interval van de eerste surveillance colonoscopie na de pEMR naar 16 maanden op te trekken indien er geen van bovenstaande risicofactoren aanwezig zijn.
Referenties
- Andrawes, S., & Haber, G. (2014). Avulsion: a novel technique to achieve complete resection of difficult colon polyps. Gastrointestinal endoscopy, 80(1), 167-168.
- Backes, Y., Kappelle, W. F., Berk, L., Koch, A. D., Groen, J. N., tot Nederveen, W. H. D. V.,... & T1 CRC Working Group. (2017). Colorectal endoscopic full-thickness resection using a novel, flat-base over-the-scope clip: a prospective study. Endoscopy, 49(11), 1092-1097.
- Bahin, F. F., Pellise, M., Williams, S. J., & Bourke, M. J. (2016). Extended endoscopic mucosal resection does not reduce recurrence compared with standard endoscopic mucosal resection of large laterally spreading colorectal lesions. Gastrointestinal endoscopy, 84(6), 997-1006.
- Barendse, R. M., Musters, G. D., Fockens, P., Bemelman, W. A., de Graaf, E. J., van den Broek, F. J.,... & TREND study group. (2014). Endoscopic mucosal resection of large rectal adenomas in the era of centralization: Results of a multicenter collaboration. United European gastroenterology journal, 2(6), 497-504.
- Belderbos, T. D., Leenders, M., Moons, L. M., & Siersema, P. D. (2014). Local recurrence after endoscopic mucosal resection of nonpedunculated colorectal lesions: systematic review and meta-analysis. Endoscopy, 46(05), 388-402.
- Brooker, J. C., Saunders, B. P., Shah, S. G., Thapar, C. J., Suzuki, N., & Williams, C. B. (2002). Treatment with argon plasma coagulation reduces recurrence after piecemeal resection of large sessile colonic polyps: a randomized trial and recommendations. Gastrointestinal endoscopy, 55(3), 371-375.
- Buchner, A. M., Guarner-Argente, C., & Ginsberg, G. G. (2012). Outcomes of EMR of defiant colorectal lesions directed to an endoscopy referral center. Gastrointestinal endoscopy, 76(2), 255-263.
- Cairns, S. R., Scholefield, J. H., Steele, R. J., Dunlop, M. G., Thomas, H. J., Evans, G. D.,... & Woodhouse, C. R. (2010). Guidelines for colorectal cancer screening and surveillance in moderate and high-risk groups (update from 2002). Gut, 59(5), 666-689.
- Choi, A. Y., Moosvi, Z. M., Shah, S., Roccato, M. K., Wang, A. Y., Hamerski, C. M., & Samarasena, J. B. (2020). Underwater versus conventional endoscopic mucosal resection for colorectal polyps: a systematic review and meta-analysis. Gastrointestinal Endoscopy.
- Desomer, L., Tutticci, N., Tate, D. J., Williams, S. J., McLeod, D., & Bourke, M. J. (2017). A standardized imaging protocol is accurate in detecting recurrence after EMR. Gastrointestinal endoscopy, 85(3), 518-526.
- Facciorusso, A., Di Maso, M., Serviddio, G., Vendemiale, G., Spada, C., Costamagna, G., & Muscatiello, N. (2016). Factors associated with recurrence of advanced colorectal adenoma after endoscopic resection. Clinical Gastroenterology and Hepatology, 14(8), 1148-1154.
- Farrar, W. D., Sawhney, M. S., Nelson, D. B., Lederle, F. A., & Bond, J. H. (2006). Colorectal cancers found after a complete colonoscopy. Clinical Gastroenterology and Hepatology, 4(10), 1259-1264.
- Ferlitsch, M., Moss, A., Hassan, C., Bhandari, P., Dumonceau, J. M., Paspatis, G.,... & Bourke, M. J. (2017). Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) clinical guideline. Endoscopy, 49(03), 270-297.
- Hassan, C., Antonelli, G., Dumonceau, J. M., Regula, J., Bretthauer, M., Chaussade, S.,... & Quintero, E. (2020). Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) guideline–update 2020. Endoscopy, 52(08), 687-700.
- Holmes, I., Kim, H. G., Yang, D. H., & Friedland, S. (2016). Avulsion is superior to argon plasma coagulation for treatment of visible residual neoplasia during EMR of colorectal polyps (with videos). Gastrointestinal endoscopy, 84(5), 822-829.
- Hong, Y. M., Kim, H. W., Park, S. B., Choi, C. W., & Kang, D. H. (2015). Endoscopic mucosal resection with circumferential incision for the treatment of large sessile polyps and laterally spreading tumors of the colorectum. Clinical endoscopy, 48(1), 52.
- Hotta, K., Fujii, T., Saito, Y., & Matsuda, T. (2009). Local recurrence after endoscopic resection of colorectal tumors. International journal of colorectal disease, 24(2), 225-230.
- Hotta, K., Saito, Y., Matsuda, T., Shinohara, T., & Oyama, T. (2010). Local recurrence and surveillance after endoscopic resection of large colorectal tumors. Digestive Endoscopy, 22, S63-S68.
- Huang, Y., Gong, W., Su, B., Zhi, F., Liu, S., & Jiang, B. (2012). Risk and cause of interval colorectal cancer after colonoscopic polypectomy. Digestion, 86(2), 148-154.
- Kandel, P., Brand, E. C., Pelt, J., Ball, C. T., Chen, W. C., Bouras, E. P.,... & Wallace, M. B. (2019). Endoscopic scar assessment after colorectal endoscopic mucosal resection scars: when is biopsy necessary (EMR Scar Assessment Project for Endoscope (ESCAPE) trial). Gut, 68(9), 1633-1641.
- Katsinelos, P., Lazaraki, G., Chatzimavroudis, G., Anastasiadis, S., Georgakis, N., Xanthis, A.,... & Kountouras, J. (2019). A retrospective comparative study of argon plasma versus polypectome snare tip coagulation: effect on recurrence rate after resection of large laterally spreading type lesions. Annals of gastroenterology, 32(2), 178.
- Kawamura, T., Takeuchi, Y., Asai, S., Yokota, I., Akamine, E., Kato, M.,... & Tanaka, K. (2018). A comparison of the resection rate for cold and hot snare polypectomy for 4–9 mm colorectal polyps: a multicentre randomised controlled trial (CRESCENT study). Gut, 67(11), 1950-1957.
- Khashab, M., Eid, E., Rusche, M., & Rex, D. K. (2009). Incidence and predictors of “late” recurrences after endoscopic piecemeal resection of large sessile adenomas. Gastrointestinal endoscopy, 70(2), 344-349.
- Kim, H. G., Thosani, N., Banerjee, S., Chen, A., & Friedland, S. (2014). Underwater endoscopic mucosal resection for recurrences after previous piecemeal resection of colorectal polyps (with video). Gastrointestinal endoscopy, 80(6), 1094-1102.
- Klein, A., Tate, D. J., Jayasekeran, V., Hourigan, L., Singh, R., Brown, G.,... & Bourke, M. J. (2019). Thermal ablation of mucosal defect margins reduces adenoma recurrence after colonic endoscopic mucosal resection. Gastroenterology, 156(3), 604-613.
- Knabe, M., Pohl, J., Gerges, C., Ell, C., Neuhaus, H., & Schumacher, B. (2014). Standardized long-term follow-up after endoscopic resection of large, nonpedunculated colorectal lesions: a prospective two-center study. Official journal of the American College of Gastroenterology| ACG, 109(2), 183-189.
- Komeda, Y., Watanabe, T., Sakurai, T., Kono, M., Okamoto, K., Nagai, T.,... & Kudo, M. (2019). Risk factors for local recurrence and appropriate surveillance interval after endoscopic resection. World journal of gastroenterology, 25(12), 1502.
- Lee, E. J., Lee, J. B., Lee, S. H., & Youk, E. G. (2012). Endoscopic treatment of large colorectal tumors: comparison of endoscopic mucosal resection, endoscopic mucosal resection–precutting, and endoscopic submucosal dissection. Surgical endoscopy, 26(8), 2220-2230.
- Lee, T. J. W., Rees, C. J., Nickerson, C., Stebbing, J., Abercrombie, J. F., McNally, R. J. Q., & Rutter, M. D. (2013). Management of complex colonic polyps in the English Bowel Cancer Screening Programme. Journal of British Surgery, 100(12), 1633-1639.
- Lee, H. S., Park, H. W., Lee, J. S., Kim, J. C., Choe, J., Soh, J. S.,... & Byeon, J. S. (2017). Treatment outcomes and recurrence following standard cold forceps polypectomy for diminutive polyps. Surgical endoscopy, 31(1), 159-169.
- Leung, K., Pinsky, P., Laiyemo, A. O., Lanza, E., Schatzkin, A., & Schoen, R. E. (2010). Ongoing colorectal cancer risk despite surveillance colonoscopy: the Polyp Prevention Trial Continued Follow-up Study. Gastrointestinal endoscopy, 71(1), 111-117.
- Lieberman, D. A., Rex, D. K., Winawer, S. J., Giardiello, F. M., Johnson, D. A., & Levin, T. R. (2012). Guidelines for colonoscopy surveillance after screening and polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology, 143(3), 844-857.
- Longcroft-Wheaton, G., Duku, M., Mead, R., Basford, P., & Bhandari, P. (2013). Risk stratification system for evaluation of complex polyps can predict outcomes of endoscopic mucosal resection. Diseases of the colon & rectum, 56(8), 960-966.
- Makazu, M., Sakamoto, T., So, E., Otake, Y., Nakajima, T., Matsuda, T.,... & Saito, Y. (2015). Relationship between indeterminate or positive lateral margin and local recurrence after endoscopic resection of colorectal polyps. Endoscopy international open, 3(03), E252-E257.
- Mannath, J., Subramanian, V., Singh, R., Telakis, E., & Ragunath, K. (2011). Polyp recurrence after endoscopic mucosal resection of sessile and flat colonic adenomas. Digestive diseases and sciences, 56(8), 2389-2395.
- Margagnoni, G., Angeletti, S., D’Ambra, G., Pagnini, C., Ruggeri, M., Corleto, V. D., & Di Giulio, E. (2016). Outcome and risk of recurrence for endoscopic resection of colonic superficial neoplastic lesions over 2 cm in diameter. Digestive and Liver Disease, 48(4), 399-403.
- Moss, A., Bourke, M. J., Williams, S. J., Hourigan, L. F., Brown, G., Tam, W.,... & Byth, K. (2011). Endoscopic mucosal resection outcomes and prediction of submucosal cancer from advanced colonic mucosal neoplasia. Gastroenterology, 140(7), 1909-1918.
- Moss, A., Williams, S. J., Hourigan, L. F., Brown, G., Tam, W., Singh, R.,... & Bourke, M. J. (2015). Long-term adenoma recurrence following wide-field endoscopic mucosal resection (WF-EMR) for advanced colonic mucosal neoplasia is infrequent: results and risk factors in 1000 cases from the Australian Colonic EMR (ACE) study. Gut, 64(1), 57-65.
- Murakami, T., Yoshida, N., Yasuda, R., Hirose, R., Inoue, K., Dohi, O.,... & Itoh, Y. (2020). Local recurrence and its risk factors after cold snare polypectomy of colorectal polyps. Surgical endoscopy, 34(7), 2918-2925.
- Nakajima, T., Sakamoto, T., Hori, S., Yamada, S., Ikematsu, H., Harada, K.,... & Saito, Y. (2021). Optimal surveillance interval after piecemeal endoscopic mucosal resection for large colorectal neoplasia: a multicenter randomized controlled trial. Surgical Endoscopy, 1-11.
- Nanda, K. S., Tutticci, N., Burgess, N. G., Sonson, R., Williams, S. J., & Bourke, M. J. (2015). Endoscopic mucosal resection of laterally spreading lesions involving the ileocecal valve: technique, risk factors for failure, and outcomes. Endoscopy, 47(08), 710-718.
- Neneman, B., Gasiorowska, A., & Malecka-Panas, E. (2006). The efficacy and safety of argon plasma coagulation (APC) in the management of polyp remnants in stomach and colon. Adv Med Sci, 51(1), 88-92.
- Oka, S., Tanaka, S., Saito, Y., Iishi, H., Kudo, S. E., Ikematsu, H.,... & Sugihara, K. (2015). Local recurrence after endoscopic resection for large colorectal neoplasia: a multicenter prospective study in Japan. Official journal of the American College of Gastroenterology| ACG, 110(5), 697-707.
- Okamoto, K., Muguruma, N., Kagemoto, K., Mitsui, Y., Fujimoto, D., Kitamura, S.,... & Takayama, T. (2017). Efficacy of hybrid endoscopic submucosal dissection (ESD) as a rescue treatment in difficult colorectal ESD cases. Digestive Endoscopy, 29, 45-52.
- Pabby, A., Schoen, R. E., Weissfeld, J. L., Burt, R., Kikendall, J. W., Lance, P.,... & Schatzkin, A. (2005). Analysis of colorectal cancer occurrence during surveillance colonoscopy in the dietary Polyp Prevention Trial. Gastrointestinal endoscopy, 61(3), 385-391.
- Pellise, M., Burgess, N. G., Tutticci, N., Hourigan, L. F., Zanati, S. A., Brown, G. J.,... & Bourke, M. J. (2017). Endoscopic mucosal resection for large, serrated lesions in comparison with adenomas: a prospective multicentre study of 2000 lesions. Gut, 66(4), 644-653.
- Pohl, H., Srivastava, A., Bensen, S. P., Anderson, P., Rothstein, R. I., Gordon, S. R.,... & Robertson, D. J. (2013). Incomplete polyp resection during colonoscopy—results of the complete adenoma resection (CARE) study. Gastroenterology, 144(1), 74-80.
- Regula, J., Wronska, E., Polkowski, M., Nasierowska-Guttmejer, A., Pachlewski, J., Rupinski, M., & Butruk, E. (2003). Argon plasma coagulation after piecemeal polypectomy of sessile colorectal adenomas: long-term follow-up study. Endoscopy, 35(03), 212-218.
- Rex, K. D., Vemulapalli, K. C., & Rex, D. K. (2015). Recurrence rates after EMR of large sessile serrated polyps. Gastrointestinal endoscopy, 82(3), 538-541.
- Robertson, D. J., Greenberg, E. R., Beach, M., Sandler, R. S., Ahnen, D., Haile, R. W.,... & Baron, J. A. (2005). Colorectal cancer in patients under close colonoscopic surveillance. Gastroenterology, 129(1), 34-41.
- Rutter, M. D., Chattree, A., Barbour, J. A., Thomas-Gibson, S., Bhandari, P., Saunders, B. P.,... & Dolwani, S. (2015). British Society of Gastroenterology/Association of Coloproctologists of Great Britain and Ireland guidelines for the management of large non-pedunculated colorectal polyps. Gut, 64(12), 1847-1873.
- Sakamoto, T., Matsuda, T., Otake, Y., Nakajima, T., & Saito, Y. (2012). Predictive factors of local recurrence after endoscopic piecemeal mucosal resection. Journal of gastroenterology, 47(6), 635-640.
- Sakamoto, T., Saito, Y., Matsuda, T., Fukunaga, S., Nakajima, T., & Fujii, T. (2011). Treatment strategy for recurrent or residual colorectal tumors after endoscopic resection. Surgical endoscopy, 25(1), 255-260.
- Schmidt, A., Bauerfeind, P., Gubler, C., Damm, M., Bauder, M., & Caca, K. (2015). Endoscopic full-thickness resection in the colorectum with a novel over-the-scope device: first experience. Endoscopy, 47(08), 719-725.
- Shahid, M. W., Buchner, A. M., Coron, E., Woodward, T. A., Raimondo, M., Dekker, E.,... & Wallace, M. B. (2012). Diagnostic accuracy of probe-based confocal laser endomicroscopy in detecting residual colorectal neoplasia after EMR: a prospective study. Gastrointestinal endoscopy, 75(3), 525-533.
- Shigita, K., Oka, S., Tanaka, S., Sumimoto, K., Hirano, D., Tamaru, Y.,... & Chayama, K. (2017). Long-term outcomes after endoscopic submucosal dissection for superficial colorectal tumors. Gastrointestinal endoscopy, 85(3), 546-553.
- Sidhu, M., Tate, D. J., Desomer, L., Brown, G., Hourigan, L. F., Lee, E. Y.,... & Bourke, M. J. (2018). The size, morphology, site, and access score predicts critical outcomes of endoscopic mucosal resection in the colon. Endoscopy, 50(07), 684-692.
- Tajika, M., Niwa, Y., Bhatia, V., Kondo, S., Tanaka, T., Mizuno, N.,... & Yamao, K. (2011). Comparison of endoscopic submucosal dissection and endoscopic mucosal resection for large colorectal tumors. European journal of gastroenterology & hepatology, 23(11), 1042-1049.
- Tate, D. J., Bahin, F. F., Desomer, L., Sidhu, M., Gupta, V., & Bourke, M. J. (2018). Cold-forceps avulsion with adjuvant snare-tip soft coagulation (CAST) is an effective and safe strategy for the management of non-lifting large laterally spreading colonic lesions. Endoscopy, 41(01), 52-62.
- Tate, D. J., Desomer, L., Klein, A., Brown, G., Hourigan, L. F., Lee, E. Y.,... & Bourke, M. J. (2017). Adenoma recurrence after piecemeal colonic EMR is predictable: the Sydney EMR recurrence tool. Gastrointestinal endoscopy, 85(3), 647-656.
- Terasaki, M., Tanaka, S., Oka, S., Nakadoi, K., Takata, S., Kanao, H.,... & Chayama, K. (2012). Clinical outcomes of endoscopic submucosal dissection and endoscopic mucosal resection for laterally spreading tumors larger than 20 mm. Journal of gastroenterology and hepatology, 27(4), 734-740.
- Tsiamoulos, Z. P., Bourikas, L. A., & Saunders, B. P. (2012). Endoscopic mucosal ablation: a new argon plasma coagulation/injection technique to assist complete resection of recurrent, fibrotic colon polyps (with video). Gastrointestinal endoscopy, 75(2), 400-404.
- Veerappan, S. G., Ormonde, D., Yusoff, I. F., & Raftopoulos, S. C. (2014). Hot avulsion: a modification of an existing technique for management of nonlifting areas of a polyp (with video). Gastrointestinal endoscopy, 80(5), 884-888.
- Yamada, M., Saito, Y., Takamaru, H., Sasaki, H., Yokota, T., Matsuyama, Y.,... & Matsuda, T. (2017). Long-term clinical outcomes of endoscopic submucosal dissection for colorectal neoplasms in 423 cases: a retrospective study. Endoscopy, 49(03), 233-242.
- Yoshida, N., Inoue, K., Tomita, Y., Hashimoto, H., Sugino, S., Hirose, R.,... & Itoh, Y. (2021). Cold snare polypectomy for large sessile serrated lesions is safe but follow‐up is needed: a single‐centre retrospective study. UEG Journal, 9(3), 370-377.
- Zauber, A. G., Winawer, S. J., O'Brien, M. J., Lansdorp-Vogelaar, I., van Ballegooijen, M., Hankey, B. F.,... & Waye, J. D. (2012). Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med, 366, 687-696.
- Zlatanic, J., Waye, J. D., Kim, P. S., Baiocco, P. J., & Gleim, G. W. (1999). Large sessile colonic adenomas: use of argon plasma coagulator to supplement piecemeal snare polypectomy. Gastrointestinal endoscopy, 49(6), 731-735.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-02-2022
Beoordeeld op geldigheid : 02-02-2022
Uiterlijk in 2026 bepaalt het bestuur van de NVMDL of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVMDL is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De voorliggende richtlijn betreft een herziening van de NVMDL richtlijn Endoscopische poliepectomie van het colon uit 2019. Alle modules zijn beoordeeld op actualiteit. Vervolgens is een prioritering aangebracht welke modules een daadwerkelijke update zouden moeten krijgen. Hieronder staan de modules genoemd met de wijzigingen. Tevens is per module een inschatting gemaakt voor de beoordeling voor herziening.
|
Uitgangsvraag/onderwerpen |
Wijzigingen richtlijn 2021 |
Uiterlijk jaar voor herziening |
|
Randvoorwaarden voor poliepectomie |
Minimale (tekstuele) aanpassingen |
2026 |
|
Minuscule poliepen ≤ 5 mm en poliepen tussen 10 en 20 mm |
Minimale (tekstuele) aanpassingen |
2026 |
|
Poliepen 6 – 9 mm |
Gereviseerd |
2026 |
|
Sessiele en vlakke poliepen > 20 mm |
Gereviseerd |
2026 |
|
Herkenning van een potentieel maligne poliep |
Gereviseerd |
2026 |
|
Verwijdering van een potentieel maligne poliep |
Wordt behandeld in de CRC richtlijn |
- |
|
Behandeling en preventie van complicaties |
Minimale (tekstuele) aanpassingen |
2026 |
|
Preventief dichtclippen van wondvlak |
Nieuw ontwikkeld |
2026 |
|
Lokaal recidief na poliepectomie |
Gereviseerd |
2026 |
|
Behandeling van lokaal recidief |
Nieuw ontwikkeld |
2026 |
|
Pathologie: biopteren |
Nieuw ontwikkeld |
2026 |
|
Pathologie: weefselverwerking |
Minimale (tekstuele) aanpassingen |
2026 |
|
Prestatie indicatoren |
Minimale (tekstuele) aanpassingen |
2026 |
Belangrijkste wijzigingen ten opzichte van vorige versie
In de gereviseerde modules is de literatuur opnieuw systematisch gezocht en/of is de literatuursamenvatting aangepast. De strekking van de aanbevelingen is nagenoeg hetzelfde gebleven. Tevens zijn er drie nieuwe modules aan de richtlijn toegevoegd. De overige modules zijn opnieuw beoordeeld waarbij er minimale (tekstuele) aanpassingen gedaan. De module 'Verwijderen van een potentieel maligne poliep' is teruggetrokken. Dit onderwerp komt terug in de richtlijn Colorectaal carcinoom.
Algemene gegevens
De ontwikkeling en herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in het voorjaar van 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die direct betrokken zijn bij de zorg voor patiënten met poliepen in het rectum en colon.
Werkgroep
- Dr. L.M.G. (Leon) Moons (voorzitter), MDL-arts UMC Utrecht, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. T. (Tom) Seerden (vice-voorzitter), MDL-arts Amphia Breda, Nederlandse Vereniging van Maag-Darm-Leverartsen
- B.A.J. (Barbara) Bastiaansen, MDL-arts Amsterdam UMC, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. J.J. (Jurjen) Boonstra, MDL-arts, LUMC Leiden, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. A.D. (Arjun) Koch, MDL-arts, Erasmus MC Rotterdam, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. B.W.M. (Marcel) Spanier, MDL-arts, Rijnstate ziekenhuis, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. Y. (Yara) Backes, MDL-arts i.o., Meander Medisch Centrum Amersfoort, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. L. (Lindsey) Oudijk, patholoog Erasmus MC Rotterdam, Nederlandse Vereniging voor Pathologie
- Dr. M.M. (Miangela) Laclé, patholoog UMC Utrecht, Nederlandse Vereniging voor Pathologie
- C. (Christiaan) Hoff, chirurg Medisch Centrum Leeuwarden, Nederlandse Vereniging voor Heelkunde
- R. (Ruud) Blankenburgh, Internist-Oncoloog Saxenburgh Hardenberg, Nederlandse Internisten Vereniging
Klankbordgroep
- J.J. (Jan) Meeuse, NIV
- S. (Silvie) Dronkers, Stichting Darmkanker
- J. (Jannie) Verheij - van der Wiel, Stomavereniging
- J.H.M.A. (Ans) Dietvorst, Stichting Lynch Polyposis
Met ondersteuning van
- Dr. A.N. (Anh Nhi) Nguyen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. E.V. (Ekaterina) van Dorp-Baranova, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Restrictie (zie ook tekst onder de tabel) |
|
Moons (voorzitter) |
MDL-arts, interventie endoscopist, UMC Utrecht, Utrecht, Nederland |
Geen |
Consultant Boston Scientific |
Geen |
|
Seerden (vice-voorzitter) |
MDL arts, Medisch specialistisch bedrijf Amphia te Breda |
Geen |
Geen |
Geen |
|
Bastiaansen |
MDL-arts Amsterdam UMC |
Geen |
Geen |
Geen |
|
Boonstra |
MDL-arts, LUMC, Leiden |
Geen |
Consultant Boston Scientific |
Geen |
|
Koch |
MDL-arts, Erasmus MC, Universitair Medisch Centrum Rotterdam |
Geen |
Consultant Boston Scientific. Pentax Medical, ERBE Elektromedizin, DrFalk Pharma |
Geen |
|
Spanier |
Als vrijgevestigd MDL-arts in dienst bij Cooperatie Medisch Specialisten Rijnstate u.a. (CMSR) |
Bestuurslid CMSR, 4 dagdelen, betaald, vergoeding naar vakgroep MDL Rijnstate |
Geen |
Geen |
|
Backes |
aios MDL, Meander Medisch Centrum Amersfoort |
Geen |
Geen |
Geen |
|
Oudijk |
Patholoog, Erasmus MC Rotterdam |
PPM patholoog Palga: Motiveren gebruik PALGA protocollen, contactpersoon voor PALGA rapportage gebruik protocollen, mede-pathologen en MDO-leden, clinici. Onbetaald. Lid wetenschappelijke commissie Dutch Thyroid Cancer Group: onbetaald. Lid wetenschappelijke adviescommissie Stichting Bijniernetwerk Nederland: onbetaald |
Geen |
Geen |
|
Laclé |
Patholoog UMC Utrecht |
Geen |
Geen |
Geen |
|
Hoff |
Chirurg Medisch Centrum Leeuwarden (via Heelkunde Friesland Groep) (0,6) medisch cobestuurder MCL 0,4) |
Geen |
Geen |
Geen |
|
Blankenburgh |
Internist-Oncoloog, Saxenburgh te Hardenberg |
Geen |
Geen |
Geen |
Het Kennisinstituut in zijn rol als methodologisch ondersteuner, de NVMDL als initiërende vereniging en de richtlijnwerkgroep zijn zich bewust van de belangen die spelen binnen de richtlijnwerkgroep, maar het werd toch noodzakelijk geacht om de betreffende inhoudelijk experts op dit gebied bij de richtlijn te betrekken. Tijdens de commentaarfase werd de NVMDL verzocht om bij het aanleveren van commentaar kritisch te zijn op de gemelde belangen en geformuleerde aanbevelingen en onderbouwing en om experts, vrij van belangen, expliciet te verzoeken om de richtlijn te beoordelen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden vanuit patiëntenverenigingen in de klankbordgroep met de conceptrichtlijn mee te laten lezen. De commentaren zijn besproken in de werkgroep en verwerkt. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Stichting Darmkanker, Stomavereniging en Stichting Lynch Polyposis.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen. De werkgroep heeft ook interne kwaliteitsindicatoren ontwikkeld.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging van Maag-Darm-Leverartsen, 2019) op noodzaak tot revisie. Op basis van de geprioriteerde knelpunten zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, en bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
