Herkenning van een potentieel maligne poliep bij poliepectomie
Uitgangsvraag
Welke niet-gesteelde poliepen moeten op basis van optische diagnostiek en bloc worden verwijderd vanwege het risico op submucosale invasie?
Deze vraag bestaat uit de volgende deelvragen:
- Heeft geavanceerde beeldvorming toegevoegde waarde op standaard witlicht beoordeling voor de optische diagnostiek van T1 CRC en T1 CRC met diepe submucosale invasie?
- Welke morfologische en geavanceerde beeldvorming kenmerken zijn geassocieerd met de aanwezigheid van een submucosaal invasief carcinoom?
- Welke morfologische en geavanceerde beeldvorming kenmerken zijn geassocieerd met de aanwezigheid van een diep (≥ 1000 µm, Sm2 tot 3) submucosaal invasief carcinoom?
Aanbeveling
Bepaal de kans op submucosale invasie in niet-gesteelde poliepen ≥ 10 mm op basis van een gestandaardiseerde beoordeling gebaseerd op zowel morfologische kenmerken (onder andere granulariteit, locatie, depressie, spontane bloeding) als ook (virtuele) chromoendoscopie en maak hier representatieve foto’s (en/of video) van. Gebruik hiervoor een van de beschikbare predictiemodellen (Figuur 1AB en tabel 2).
Gebruik (virtuele) chromoendoscopie om een inschatting te maken van de invasiediepte. Gebruik hiervoor een van de beschikbare classificatie systemen (tabel 1).
Verricht een lokale en bloc resectie bij een reële kans op submucosale invasie, bij voorkeur in overleg met een toegewijde endoscopist.
Overwegingen
Betere accuratesse bij gebruik van (virtuele) chromoendoscopie
Twee meta-analyses hebben gekeken naar de waarde van (virtuele) chromoendoscopie voor optische diagnostiek van T1 CRC (Backes, 2017; Zhang, 2017). De eerste meta-analyse laat zien dat het gebruik van geavanceerde afbeeldingstechnieken (NBI of MCE) leidt tot een drievoudige betere herkenning van T1 CRC en een bijna tweevoudige betere herkenning van T1 CRC met diepe invasie dan het gebruik van wit-licht kenmerken (Backes, 2017; Zhang, 2017). De diagnostische accuratesse van NBI en MCE was niet significant verschillend. De tweede meta-analyse laat een significant hogere sensitiviteit zien van MCE in vergelijking met NBI voor de herkenning van T1 CRC met diepe invasie, echter zijn hierin alleen studies geïncludeerd waarin met zowel NBI als MCE is gekeken (Zhang, 2017). Omdat NBI vaak voorafgaand aan MCE wordt verricht, zou dit een vertekende hogere sensitiviteit van MCE kunnen geven. Op basis hiervan wordt aangeraden om geavanceerde afbeeldingstechnieken te gebruiken om de aanwezigheid van een T1 CRC en de diepte van invasie te voorspellen. De voorkeur voor de geavanceerde afbeeldingstechniek kan gemaakt worden op basis van lokale expertise en beschikbaarheid. Recente studies hebben aangetoond dat poliepen op eenzelfde wijze (zelfde classificatiesystemen) met BLI als met NBI beoordeeld kunnen worden, resulterend in vergelijkbare diagnostische accuratesse (Huang, 2020; Ito, 2021). Derhalve lijkt het aannemelijk dat ook BLI een goede optie is voor de optische diagnostiek van T1 CRC.
Morfologische kenmerken
Ondanks de inferieure accuratesse, hebben morfologische kenmerken beoordeeld met wit licht wel een belangrijke rol bij optische diagnostiek van T1 CRC. Aan- of afwezigheid van morfologische kenmerken kan helpen de vooraf kans op maligniteit in te schatten en de endoscopist attenderen in dit gebied het vaat- of pitpatroon goed te inspecteren.
- Locatie: het risico op T1 CRC in poliepen ≥ 20 mm is circa 11%. Dit risico is hoger in het distale colon in vergelijking met het proximale colon (OR 2.50) (Bogie, 2018). In niet-gesteelde poliepen ≥ 20 mm is locatie in het rectum en sigmoid een onafhankelijke voorspeller voor de aanwezigheid van een submucosaal invasief carcinoom (Burgess, 2017; D’Amico, 2021). In de huidige literatuur varieert het risico op T1 CRC tussen 4 en 7% in het proximale colon, oplopend naar 10 tot 24% in het distale colon en 11 tot 30% in het rectum (Burgess, 2017; Backes, 2019; Kim, 2011; Miyamoto,2014).
- Omvang van de poliep: het risico op T1 CRC in poliepen 10 tot 19mm is circa 4 tot 5%, oplopend tot 9% in poliepen 20 tot 29 mm en 16 tot 17% in poliepen ≥ 30mm (Bogie, 2018). Echter, het effect van poliepgrootte op de aanwezigheid van T1 CRC is slechts beperkt in poliepen ≥ 20mm (Burgess, 2017; Backes, 2019). Het wordt derhalve afgeraden om in grote poliepen (≥ 20 mm) omvang te gebruiken bij het inschatten van de kans op submucosale invasie, maar juist gebruik te maken van de andere morfologische kenmerken en geavanceerde afbeeldingstechnieken. Van alle T1 CRCs is het merendeel (tot 65%) < 20 mm, waarvan het grootste gedeelte > 10 mm (Puig, 2019; Meulen, 2020). Juist in die groep dient men dus ook bedacht te zijn op de eventuele aanwezigheid van submucosale invasie.
- Depressie: In een grote prospectieve studie uit Australië van 479 niet-gesteelde poliepen ≥ 20 mm, bleek een depressie (IIc of IIa + IIc) geassocieerd te zijn met een invasief carcinoom in 32% van de gevallen (Moss, 2011). Ook in de OPTICAL-1 studie was er in circa 25% van de poliepen met een depressie sprake van submucosale invasie (Backes, 2019). In beide studies vlakt het effect echter af wanneer gecorrigeerd wordt voor andere poliepkenmerken, waaronder Kudo V pit patroon of veranderd vaatpatroon bij NBI. Hieruit kan opgemaakt dat een depressie alleen niet sterk voorspellend is voor de aanwezigheid van een invasief carcinoom, en derhalve gecombineerd dient te worden met geavanceerde afbeeldingstechnieken van het depressieve gebied.
- Makkelijk bloedend slijmvlies: in de aanwezigheid van spontaan bloedend slijmvlies, dat kan ontstaan ten gevolge van angiogenese in het proces van progressie naar kanker, is het risico op T1 CRC circa 35% en het risico op diepe invasie circa 24 tot 72% (Backes, 2019; Horie, 2008; Jang, 2014). Tractie met ischemie van het oppervlak bij grote poliepen of gesteelde poliepen kan echter ook makkelijk bloedend slijmvlies laten zien. Het dient derhalve in combinatie met andere maligne kenmerken geïnterpreteerd te worden.
- Oppervlakte patroon (granulariteit): het risico op T1 CRC is hoger in non-granulaire dan in granulaire poliepen, met risico’s van circa 13 tot 17% versus 1 tot 5% in poliepen < 20 mm en 13 tot 42% versus 5 tot 17% in poliepen ≥ 20 mm (Burgess, 2017; Backes, 2019; Moss, 2011; Uraoka, 2006). In granulaire poliepen is het risico op maligniteit het kleinst in homogeen granulaire laesies (< 4%), oplopend in de aanwezigheid van een grote nodule (~11%) of een erythemateus non-granulair gebied (35 tot 42%) (Bogie, 2018; Backes, 2019; Uraoka, 2006). Als er een invasief gebied aanwezig is in een granulaire poliep, bevindt deze zich in de meerderheid van de gevallen (84%) onder de grote nodule (Uraoka, 2006). Een aanpak waarin de grote nodule en bloc wordt verwijderd en de rest van de poliep middels piecemeal resectie verhoogt derhalve de kans op een R0 resectie als er invasie aanwezig blijkt te zijn.
- Non-lifting: Kato (2001) heeft een classificatiesysteem geïntroduceerd om de mate van lifting te objectiveren. Incomplete lifting (Kato III) is geassocieerd met submucosale invasie, Kato IV lifting met diepe submucosale invasie (Kato, 2001). Echter, het nemen van biopten of een eerdere resectiepoging kan ook non-lifting veroorzaken (Han, 2008). Bovendien is er in slechts 40 tot 50% van de T1 CRC’s met oppervlakkige submucosale invasie sprake van incomplete lifting, en zou dus een groot deel van de T1 CRC’s gemist worden als de keuze voor resectietechniek alleen hierop zou berusten (Kato, 2001; Han, 2008; Park, 2014). Een studie die de lifting test vergeleek met optische diagnostiek liet zien dat de laatste superieur is (Kobayashi, 2007). Samenvattend kan non-lifting het vermoeden op T1 CRC dus versterken als er op basis van optische diagnostiek een verdenking is op maligniteit, echter heeft het lage diagnostische waarde in afwezigheid van optisch maligne kenmerken.
(Virtuele) chromoendoscopie: classificatiesystemen
- Conventionele chromoendoscopie: De Kudo en Tsurata classificatie is een van de eerste classificatiesystemen die poliepen indeelt in verschillende categorieën op basis van het pit patroon (type I tot en met V). Het type V subtype is later verder gespecificeerd in type Vi-low, Vi-high en Vn. Een sterk verstoord oppervlakte patroon (Kudo Vi) is geassocieerd met de aanwezigheid van submucosale invasie, waarbij een totale afwezigheid van een patroon (Kudo Vn) sterk wijst op diepe invasie in de submucosa (Kudo, 1996; Tanaka, 2013).
- Virtuele chromoendoscopie: Hirata (2012) beschreef als eerste dat een variatie van het vaatpatroon naar dikkere, irregulaire vaten en afwezigheid van een vaatpatroon een voorspellende waarde had voor de aanwezigheid van een T1 CRC, maar ook was gerelateerd aan de diepte van invasie in de submucosa (Hirata, 2012). Sindsdien zijn er meerdere classificatiesystemen bedacht en gevalideerd om het risico op T1 CRC te voorspellen (zie tabel 1). Deze classificatiesystemen zijn veelal met NBI ontworpen (zie tabel 2), maar resulteren in vergelijkbare accuratesse wanneer toegepast met BLI (Huang, 2020; Ito, 2021). Op dit moment is er onvoldoende bewijs om een voorkeur uit te spreken voor een van de classificaties, omdat ze nooit direct vergeleken zijn.
Het NBI International Colorectal Endoscopic Classification System (NICE) is in staat om T1 CRC’s met diepe submucosale invasie te onderscheiden met een sensitiviteit van 58% en een specificiteit van 96% (PPV 42%; NPV 98%) (Puig, 2019). Het nadeel van de NICE classificatie is echter dat deze geen onderscheid maakt tussen T1 CRC’s met oppervlakkige en diepe invasie. Het dient derhalve vooral om patiënten te identificeren die in aanmerking komen voor chirurgie (NICE type III). Binnen NICE type II bevindt zich echter geen subtype dat voorspelt of er sprake van een oppervlakkig T1 CRC.
Dit heeft geleid tot de nieuwe Japanese NBI Expert Team (JNET) classificatie die type 2 onderscheidt in Type 2A en Type 2B (Sano, 2016). Type 1, 2A en type 3 hebben aangetoond een goede diagnostische accuratesse te hebben (Komeda, 2017; Hosotani, 2021; Wang, 2021). Type 2B bestaat echter uit een heterogene groep van laesies met hooggradige dysplasie, oppervlakkige en diepe submucosale invasie. Derhalve is het nu onderwerp van studie of het toevoegen van pit patroon analyse middels chromoendoscopie als er sprake is van JNET type 2B de diagnostische accuratesse verhoogt. Recente studies laten zien dat binnen JNET type 2B laesies met een non-V pit patroon met name uit hooggradige dysplasie bestaan, laesies met een V-high pit patroon met name diepe submucosale invasie betreffen en laesies met een V-low pit patroon wederom een gemixte groep betreft (Hosotani, 2021). Dit betreffen echter veelal Aziatische studies met expert endoscopisten, en de waarde van deze aanvullende evaluatie voor de dagelijkse praktijk staat derhalve nog ter discussie in afwachting van multicenter prospectieve (ook Westerse) studies.
Tabel 1 Overzicht van verschillende classificatiesystemen voor het voorspellen van de aanwezigheid van submucosale invasie en het voorspellen van de diepte van invasie in de submucosa
|
Classificatie |
Serrated Poliep |
Adenoom |
Intramucosaal carcinoom / Oppervlakkige invasie submucosa |
Oppervlakkige invasie submucosa naar diep invasief carcinoom |
Diep invasief carcinoom |
|
NICE |
Type 1 |
Type 2 |
Type 2 |
Type 2/Type 3 |
Type 3 |
|
JNET |
Type 1 |
Type 2A |
Type 2B |
Type 2B/type 3 |
Type 3 |
|
Hiroshima |
A |
B |
C1 |
C2 |
C3 |
|
Sano |
I |
II |
IIIA |
IIIA |
IIIB |
Predictiemodellen voor de aanwezigheid van een submucosaal invasief carcinoom
Er zijn verschillende predictiemodellen gemaakt op basis van combinaties van bovenstaande optische kenmerken, welke gebruikt kunnen worden bij de endoscopische inschatting op een invasief carcinoom. Deze modellen zijn onderling niet met elkaar vergeleken:
- Puig (2019): de NICE classificatie in combinatie met morfologische features. Dit predictiemodel is met name nuttig om laesies met diepe submucosale invasie te herkennen, echter in 12% van de laesies > 10 mm kan geen aanbeveling worden gedaan voor een endoscopische dan wel chirurgische resectie (Figuur 1A).
- Burgess (2017): geeft een inschatting van het risico op submucosale invasie op basis van morfologische kenmerken en locatie van de poliep (Figuur 1B).
- Backes (2019): geeft een inschatting van het risico op submucosale invasie op basis van morfologische kenmerken, locatie en NBI kenmerken (Hiroshima classificatie, Tabel 2).
Figuur 1A Risicomodel voor het voorspellen van diepe submucosale invasie en het bijbehorende behandelvoorstel in poliepen ≥ 10 mm* (Puig, 2019)
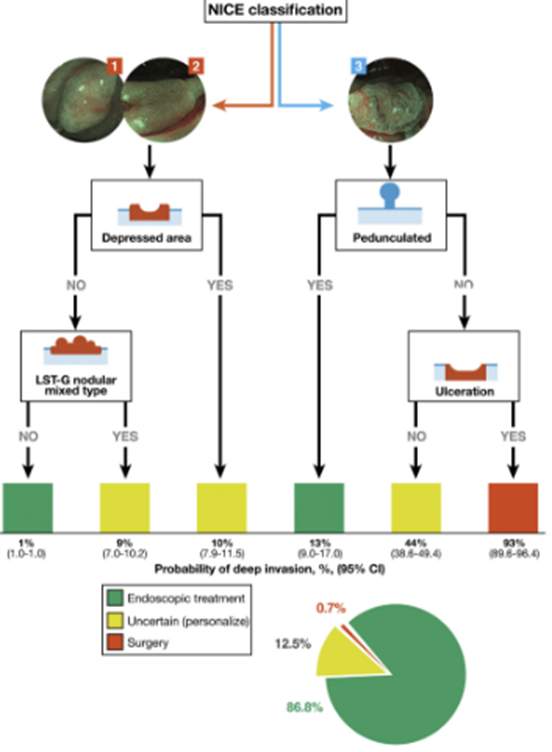
Figuur 1B. Risicomodel voor het voorspellen van de aanwezigheid van een verborgen submucosaal invasief carcinoom (dus niet zichtbaar bij endoscopie op basis van maligne kenmerken als afwijkend pit patroon) in poliepen ≥ 20 mm op basis van morfologische kenmerken en locatie* (Burgess, 2017)
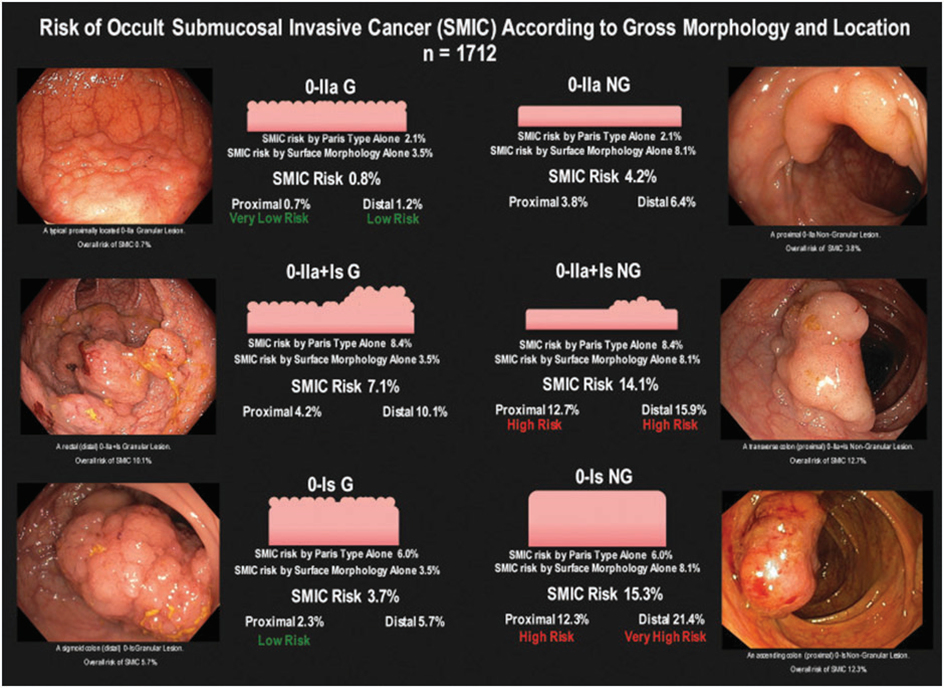
Legenda: Proximaal is alles vanaf en inclusief de flexura lienalis. Distaal betreft ook het rectum. Morfologische kenmerken betreft zowel de Paris classificatie als ook het oppervlaktepatroon (granulariteit). G is granulair, Paris IIa +Is G is derhalve een vlakke poliep met een nodule groter dan 10 mm, waarbij het oppervlakte patroon een granulair aspect heeft. NG betekent non-granulair (glad oppervlakte patroon)
* figuur gebruikt met toestemming van de uitgever
Tabel 2 Risicomodel voor het voorspellen van T1 CRC in poliepen ≥20 mm op basis van locatie, morfologische kenmerken en virtuele chromoendoscopie (gevalideerd met NBI)* (Backes, 2019)
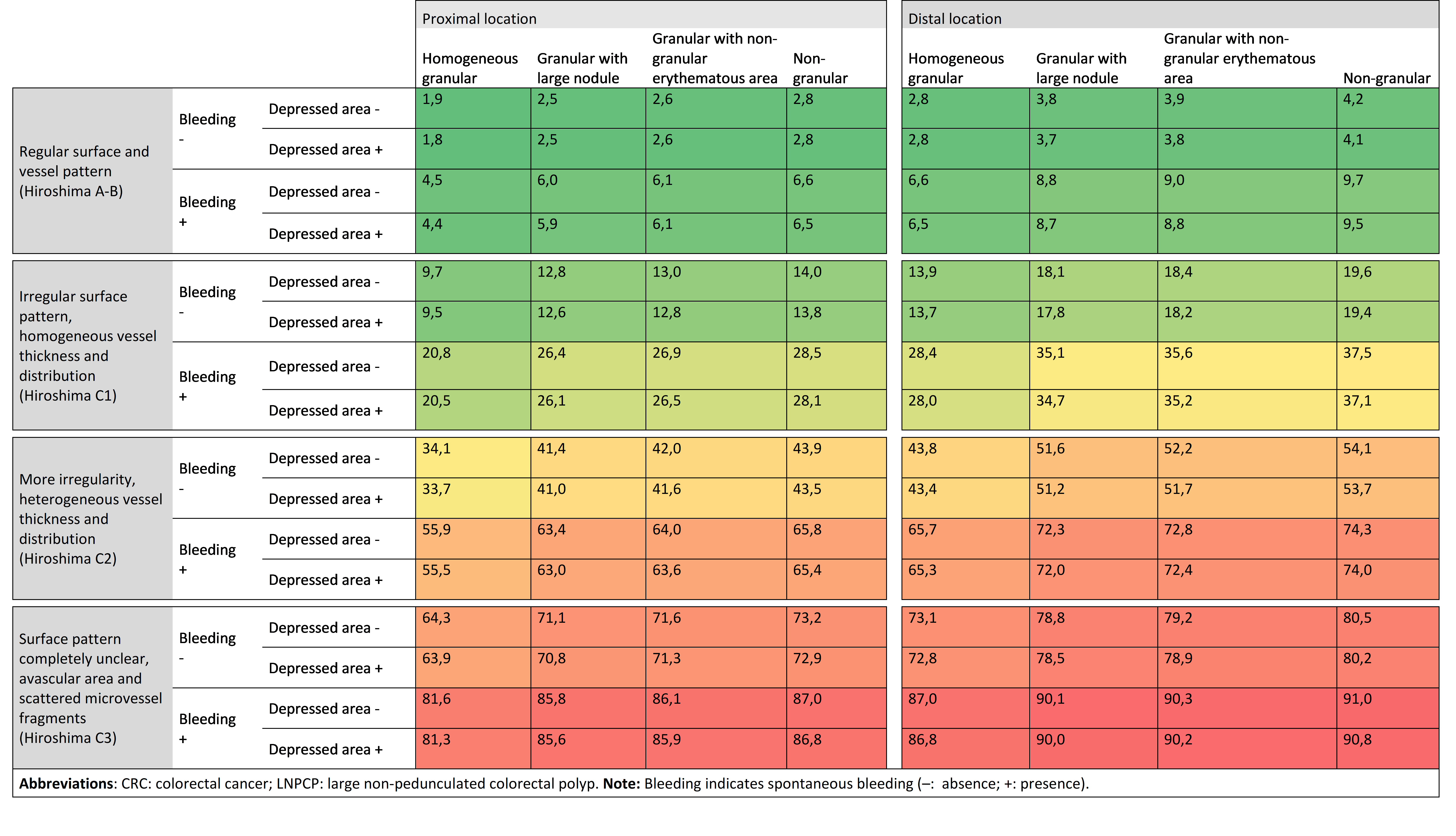
* figuur gebruikt met toestemming van de uitgever
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Gebruik van geavanceerde beeldvorming
Op basis van de huidige literatuur beveelt de werkgroep aan om poliepen ≥ 10 mm met zowel wit licht als geavanceerde beeldvorming te beoordelen, om hiermee het risico op de aanwezigheid van submucosale invasie en de invasiediepte adequaat in te schatten. De grof morfologische kenmerken zoals beoordeeld met wit licht dienen met name om de voorafkans op maligniteit in te schatten. Het gebruik van aansluitend geavanceerde beeldvorming verhoogt de diagnostische accuratesse aanzienlijk. NBI en chromoendoscopie zijn de meest onderzochte beeldvormingstechnieken, echter is op basis van de huidige literatuur geen aanbeveling te doen voor een van beide technieken. Er bestaan verschillende predictiemodellen voor het inschatten van de aanwezigheid van submucosale invasie. Als een centrum niet beschikt over virtuele chromoendoscopie wordt het model van Burgess (2017) geadviseerd (Figuur 1B). Mocht een centrum wel beschikken over virtuele chromoendoscopie (zoals NBI of BLI) wordt het model van de Optical I geadviseerd daar dit model is gevalideerd op de Nederlandse situatie (Tabel 2). Hoewel niet gevalideerd in het model is de Hiroshima classificatie eventueel te vervangen door de JNET of de Sano-classificatie en is het op basis van eerdere studies aannemelijk dat het zowel met NBI als andere virtuele afbeeldingstechnieken zoals BLI te beoordelen is (Huang, 2020; Ito, 2021).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Er bestaan geen studies over de waarden en voorkeuren van patiënten betreffende optische diagnostiek van submucosale invasie. Optische beoordeling wordt niet als belastend beschouwd. Het lijkt aannemelijk dat de belasting van een strategie waarbij therapeutische endoscopie in navolging van een diagnostische coloscopie plaatsvindt bij poliepen >20mm gerechtvaardigd is (met als doel een juiste resectietechniek te kiezen op basis van optische diagnostiek en hier adequaat informed consent voor af te nemen), als dit voor een patiënt tot betere uitkomsten leidt.
Kosten (middelenbeslag)
Afkapwaarde voor en bloc resectie
Het is op dit moment niet goed uitgezocht vanaf welke kans op een T1 CRC een en bloc resectie techniek moet worden toegepast. Bahin (2019) laat zien dat een en bloc resectie kosteneffectief is bij een hoge verdenking op submucosale invasie, echter geeft hier geen percentage voor (Bahin, 2019). Wel geeft deze studie aan dat bij een sensitiviteit van 83% selectieve en bloc resectie kosteneffectief is, wat in het OPTICAL-model overeenkomt met een risico op T1 CRC ≥ 5% (Backes, 2019). In dat geval kan in 71% van de poliepen > 20 mm voor piecemeal EMR gekozen worden en betreft het in 31% van de gevallen waar voor en bloc resectie wordt gekozen inderdaad om kanker te gaan. Wordt de afkapwaarde verhoogd naar 10% (i.e., > 10% kans op submucosale invasie op basis van optische kenmerken), dan kan in 78% van de poliepen ≥ 20 mm voor piecemeal EMR gekozen worden en betreft het in 38% van de gevallen waar voor en bloc resectie wordt gekozen inderdaad om kanker te gaan. Op basis hiervan is de werkgroep van mening dat het bij een ingeschat risico op submucosale invasie > 10% (op basis van optische kenmerken in de voorgestelde risicomodellen, zie figuur 1B en tabel 2) een en bloc resectie een goede keuze lijkt te zijn.
Bij een hoger risico op T1 CRC neemt het aandeel diep invasieve en niet-curatieve resecties toe (Backes, 2019; Bronzwaer, 2018). Helaas biedt zowel het Optical I model als het Burgess-model daar geen handvaten voor. Op basis van huidige literatuur is diepe invasie wel te verwachten bij een Kudo Vn pit patroon, of een Sano IIIB, JNET type 3, NICE 3 of Hiroshima C3 vaatpatroon bij NBI.
Aanvaardbaarheid, haalbaarheid en implementatie
Belang van goede fotoverslaglegging
Uit meerdere studies blijkt dat de diagnostische accuratesse voor het voorspellen van de aanwezigheid van submucosale invasie mede afhankelijk is van de ervaring van de endoscopist (Van der Vlugt, 2016; Wang, 2021). De werkgroep adviseert daarom om tijdens diagnostische coloscopie goede foto’s te maken wanneer poliepen ≥ 10 mm gevonden worden, bestaande uit wit-licht foto’s voor de beoordeling van grof morfologische kenmerken en geavanceerde beeldvorming voor beoordeling van het vaat en/of pitpatroon met detailopname van een eventueel verdacht gebied. Op die manier kan in overleg met een ervaren collega tot een juiste resectietechniek gekozen worden en een therapeutische endoscopie danwel chirurgie ingepland worden, waarvoor de patiënt dan ook gedegen informed consent kan geven.
Onderbouwing
Achtergrond
(overgenomen uit richtlijn 2019)
Met de invoering van het bevolkingsonderzoek is de incidentie van submucosaal invasieve carcinomen (ook wel maligne poliep of T1 CRC) toegenomen (Toes-Zoutendijk, 2018). Omdat de kans op synchrone metastasen als ook het risico op het gelijktijdig voorkomen van lymfkliermetastasen relatief klein is, kan een groot deel van de T1 carcinomen in potentie met een minimaal invasieve methode worden verwijderd. Omdat een van de criteria voor een curatieve resectie negatieve snijranden betreft, moet een endoscopische behandeling van een T1 carcinoom gericht zijn op het verkrijgen van vrije snijranden en een optimale beoordeling van de histologie (invasiediepte en histologische risicofactoren). Omdat niet alle resectietechnieken leiden tot een curatieve resectie, leidt herkenning van het T1 carcinoom vaak tot een aanpassing van de resectietechniek. Optische diagnostiek is noodzakelijk om te besluiten tot een en bloc endoscopische resectie, of te verwijzen voor een primair oncologische resectie. Voor optische diagnostiek kan gebruik gemaakt worden van conventioneel wit licht voor de beoordeling van morfologische kenmerken, als ook van geavanceerde beeldvormingstechnieken zoals virtuele chromoendoscopie (Narrow Band Imaging (NBI) of Blue Light Imaging (BLI)) en conventionele chromo-endoscopie (MCE) voor beoordeling van respectievelijk het vaat- en pitpatroon. Nieuwe technieken zoals endocytoscopie en high frequency probe base EUS zijn wel in studieverband onderzocht. Omdat er echter nog onvoldoende informatie beschikbaar is voor een goede evaluatie en deze in de praktijk weinig gebruikt worden, zijn deze technieken nu niet meegenomen in de evaluatie voor deze richtlijn. Omdat optische diagnostiek voor gesteelde poliepen erg lastig is ten gevolge van de ischemie die kan optreden aan de oppervlakte van de gesteelde poliep ten gevolge van tractie, wordt optische diagnostiek naar het voorspellen van een T1 CRC alleen toegepast op niet-gesteelde poliepen. Daarnaast dienen alle gesteelde poliepen en bloc te worden verwijderd.
Omdat de keuze voor een specifieke resectiemethode vooral gebaseerd zou moeten zijn op de optische inschatting van de histologie van de poliep, is een goede evaluatie van de poliep voorafgaand aan de verwijdering van de poliep een belangrijk onderdeel van de poliepectomie zelf. Recent onderzoek toont aan dat deze inschatting in de praktijk moeizaam verloopt, en frequent leidt tot over- en onderschatting van de kans op een submucosaal invasief carcinoom (Van der Vlugt, 2016; Vosko, 2021; Meulen, 2020). Als gevolg hiervan wordt in Nederland toch een aanzienlijk deel van de niet-invasieve poliepen met chirurgie behandeld, als ook een belangrijk deel van de T1 CRC piecemeal verwijderd welke wel curatief hadden kunnen worden behandeld (Bronzwaer, 2018; Van Nimwegen, 2018; Barendse,2018). Omdat chirurgische resectie gepaard gaat met meer morbiditeit en mortaliteit dan een endoscopische behandeling, is een verlaging van dit percentage gewenst.
In deze module worden de kenmerken samengevat die voorspellend zijn voor de aanwezigheid van een T1 carcinoom, welke kenmerken duiden op diepe invasie in de submucosa, als ook beslismodellen om het risico op een maligne poliep in te schatten.
Conclusies / Summary of Findings
|
No GRADE |
Morfologische beschrijvingen als oppervlaktepatroon (granulariteit), depressie, makkelijk bloedend slijmvlies en aanwezigheid van een grote rode nodule of een erythemateus non-granulair gebied binnen een granulaire poliep zijn geassocieerd met de aanwezigheid van een submucosaal invasief carcinoom.
Bronnen: Backes, 2018; Bogie, 2018 |
|
No GRADE |
Het gebruik van (virtuele) chromoendoscopie heeft een hogere sensitiviteit en specificiteit voor het herkennen van T1 carcinomen dan morfologische kenmerken.
Bronnen: Backes, 2018 |
|
No GRADE |
Het gebruik van (virtuele) chromoendoscopie heeft een hogere sensitiviteit en een vergelijkbare specificiteit voor het herkennen van T1 carcinomen met diepe submucosale invasie dan morfologische kenmerken.
Bronnen: Backes, 2018 |
|
No GRADE |
De diagnostische accuratesse van NBI en MCE voor het herkennen van T1 carcinomen en T1 carcinomen met diepe submucosale invasie is vergelijkbaar.
Bronnen: Backes, 2018; Zhang, 2017 |
Samenvatting literatuur
Description of studies
Backes (2018) conducted a systematic review and meta-analysis in which the diagnostic accuracy of NBI, MCE and gross morphological features seen with conventional white light view for the optical diagnosis of T1 CRC and T1 CRC with deep submucosal invasion. The study was performed according to PRISMA guidelines. The databases Medline, EMBASE and Cochrane were searched for articles published in the English language between January 2000 and July 2015. Diagnostic studies that reported on the accuracy of optical diagnosis of T1 CRC or deep submucosal invasion with histopathology as the reference standard, and for which 2x2 contingency tables based on lesions could be extracted, were included. A total of 33 full-text studies involving 31,568 polyps were included. No randomized trials were included. The studies were conducted in Asia, mostly in Japan, United Kingdom (n=1) and Australia (n=1).
Zhang (2017) conducted a systematic review and meta-analysis in which the diagnostic efficacy of magnifying NBI on the optical diagnosis of deep submucosal invasion was compared with magnifying NBI. The study was performed according to PRISMA guidelines. The databases Medline, EMBASE and Cochrane were searched for articles published in the English language until May 2016, and additionally meeting abstracts were searched. Diagnostic studies that used magnifying NBI to diagnose deep submucosal invasion, using histopathology as the reference standard, and for which 2x2 contingency tables based on lesions could be extracted, were included. A total of 17 studies were included, including 14 full-texts and 3 meeting abstracts. No randomized trials were included. The studies were conducted in Japan (n=14), Korea (n=2) and China (n=1).
Bogie (2018) conducted a systematic review and meta-analysis in which the risk of submucosal invasion in lateral spreading tumors ≥ 10mm was evaluated. The study was performed according to PRISMA guidelines. The databases Medline, EMBASE, Scopus and Cochrane were searched for articles published in the English language until July 2017. Studies in which the prevalence of lateral spreading tumors and/or the risk of submucosal invasion among lateral spreading tumors could be calculated based on histopathology were included. A total of 48 full-text studies were included.
Results
Advanced imaging versus morphological features
The systematic review and meta-analysis by Backes (2018) found that NBI and MCE resulted in a threefold better recognition of T1 CRCs and an almost twofold better recognition of T1 CRC with deep submucosal invasion as compared to gross morphological features as seen with conventional white light.
For the optical diagnosis of T1 CRC, diagnostic performance of gross morphological features was lower as compared to advanced imaging for all studies, with sensitivities ranging between 0.21 to 0.46 and specificities between 0.81 to 1.00. Diagnostic performance of NBI and MCE was comparable (sensitivity RR 0.93; 95%CI 0.79 to 1.09, p=0.39; specificity RR 0.98; 95%CI 0.86 to 1.11, p=0.74). For the optical diagnosis of T1 CRC with deep submucosal invasion, gross morphological features yielded comparable specificity as compared to advanced imaging, ranging between 0.80 to 0.98, however, sensitivity was much lower varying between 0.18 to 0.68. Similarly to optical diagnosis of T1 CRC, a preference for NBI or MCE could not be found (sensitivity RR 0.93; 95%CI 0.76 to 1.11, p=0.36; specificity RR 1.00; 95%CI 0.96 to 1.04, p=0.92) for optical diagnosis of T1 CRC with deep submucosal invasion.
The systematic review and meta-analysis by Zhang (2017) found that magnifying NBI had lower sensitivity (74% versus 84%, P < 0.01) than magnifying chromoendoscopy with similar specificity (98% versus 97%, p=0.32) for optical diagnosis of T1 CRC with deep submucosal invasion. The sensitivity was however equal when only real-time assessment studies were included (84%). Importantly, all studies performed magnifying NBI assessment before magnifying chromoendoscopy, which might have resulted in information bias.
Features associated with the presence of submucosal invasion
The systematic review and meta-analysis by Backes (2018) found non-granularity, any kind of depression, presence of a large nodule, sclerous wall change and surface redness to be associated with the presence of submucosal invasion. Using NBI, Hiroshima type C, an irregular or sparse microvessel pattern and loss of network were also associated with the presence of submucosal invasion. Using MCE, Kudo pit pattern type Vi or Vn were associated with the presence of submucosal invasion.
The systematic review and meta-analysis by Bogie (2018) found that 8.5 % (95 %CI 6.5 % to 10.5 %) of lateral spreading tumors contain submucosal invasion. The risk was higher in non-granular pseudodepressed subtypes (31.6%) as compared to granular nodular mixed lesions (10.5%) and non-granular flat elevated lesions (4.9%). The risk of submucosal invasion was the lowest in homogeneous granular lesions (0.5%). Submucosal invasion was more common in distally rather than in proximally located LSTs (OR 2.50, 95 %CI 1.24 to 5.02). The proportion of SMI increased with lesion size (10 to 19 mm, 4.6 %; 20 to 29 mm, 9.2 %; ≥ 30 mm, 16.5 %).
Features associated with the presence of deep submucosal invasion
The systematic review and meta-analysis by Backes (2018) found non-granularity, any kind of depression, spontaneous bleeding, irregular surface, ulcer or erosion, white spots and exudate to be associated with the presence of deep submucosal invasion. Using NBI, Hiroshima type C3, Sano type IIIB, an irregular or sparse microvessel pattern, and an absent microvessel and microsurface pattern to be associated with the presence of deep submucosal invasion. Using MCE, Kudo type Vi (high-risk) or Vn or an amorphous pit pattern was associated with the presence of deep submucosal invasion.
In the systematic review and meta-analysis by Zhang (2017), the studies evaluating NBI used the Hiroshima classification (n=5), the Sano classification (n=5), and six used other standards, such as the Showa classification and the Jikei classification. the sensitivity of the Hiroshima classification ranged from 38% to 77%, with its specificity ranging from 95% to 100%. The sensitivity of the Sano classification ranged from 61% to 88% and its specificity from 85% to 99%. The sensitivity and specificity of the Showa classification were 91.0% and 79%, respectively. The sensitivity and specificity of the Jikei classification were 88% and 93%, respectively. Of the studies evaluating MCE, the pit pattern was used to assess the invasion depth. In total, nine studies on MCE were included (6 full-text, 3 abstracts). In the full text studies, crystal violet was used to observe all VI -high grade and VN patterns, according to the criteria of Fujii. Sensitivities an specificities as described above were achieved.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
PICO 1
P (patients): patients with a non-pedunculated polyp in colon or rectum ≥ 10 mm;
I (intervention): standardized assessment based on morphological features;
C (control): standardized assessment based on virtual (chromo) endoscopy;
O (outcomes): diagnostic accuracy for the presence of submucosal invasion.
PICO 2
P (patients): patients with a non-pedunculated polyp in colon or rectum ≥ 10 mm;
I (intervention): standardized assessment based on morphological features and/or virtual (chromo) endoscopy;
C (control): white light imaging;
O (outcomes): diagnostic accuracy for the presence of submucosal invasion.
PICO 3
P (patients): patients with a non-pedunculated polyp in colon or rectum ≥ 10 mm;
I (intervention): standardized assessment based on morphological features and/or virtual (chromo) endoscopy;
C (control): white light imaging;
O (outcomes): diagnostic accuracy for the presence of deep ((≥ 1000 µm, Sm2 to 3) submucosal invasion.
Search and select (Methods)
The databases PubMed (https://pubmed.ncbi.nlm.nih.gov/) was searched with relevant search terms from 01/01/2000 until 30/03/2021, using English language as filter. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1397 hits. Studies were selected based on the following criteria:
- Diagnostic studies reporting on the accuracy of optical diagnosis of T1 CRC or T1 CRC with deep submucosal invasion with histopathology as the reference standard.
- At least 20 patients with T1 CRC or T1 CRC with deep submucosal invasion included.
- Focus on morphological features, narrow-band imaging or chromoendoscopy.
Three systematic reviews/meta-analyses were selected.
Results
Three meta-analyses were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables.
Referenties
- Backes, Y., Moss, A., Reitsma, J. B., Siersema, P. D., & Moons, L. M. G. (2017). Narrow band imaging, magnifying chromoendoscopy, and gross morphological features for the optical diagnosis of T1 colorectal cancer and deep submucosal invasion: a systematic review and meta-analysis. Official journal of the American College of Gastroenterology| ACG, 112(1), 54-64.
- Backes, Y., Schwartz, M. P., Ter Borg, F., Wolfhagen, F. H., Groen, J. N., tot Nederveen, W. H. D. V.,... & Moons, L. M. (2019). Multicentre prospective evaluation of real-time optical diagnosis of T1 colorectal cancer in large non-pedunculated colorectal polyps using narrow band imaging (the OPTICAL study). Gut, 68(2), 271-279.
- Bahin, F. F., Heitman, S. J., Rasouli, K. N., Mahajan, H., McLeod, D., Lee, E. Y.,... & Bourke, M. J. (2018). Wide-field endoscopic mucosal resection versus endoscopic submucosal dissection for laterally spreading colorectal lesions: a cost-effectiveness analysis. Gut, 67(11), 1965-1973.
- Barendse, R. M., Musters, G. D., de Graaf, E. J., van den Broek, F. J., Consten, E. C., Doornebosch, P. G.,... & Dekker, E. (2018). Randomised controlled trial of transanal endoscopic microsurgery versus endoscopic mucosal resection for large rectal adenomas (TREND Study). Gut, 67(5), 837-846.
- Bogie, R. M., Veldman, M. H., Snijders, L. A., Winkens, B., Kaltenbach, T., Masclee, A. A.,... & Sanduleanu-Dascalescu, S. (2018). Endoscopic subtypes of colorectal laterally spreading tumors (LSTs) and the risk of submucosal invasion: a meta-analysis. Endoscopy, 50(03), 263-282.
- Bronzwaer, M. E., Koens, L., Bemelman, W. A., Dekker, E., Fockens, P., Beaumont, H.,... & Sonneveld, D. J. A. (2018). Volume of surgery for benign colorectal polyps in the last 11 years. Gastrointestinal endoscopy, 87(2), 552-561.
- Bronzwaer, M. E., Musters, G. D., Barendse, R. M., Koens, L., de Graaf, E. J., Doornebosch, P. G.,... & Wolthuis, A. (2018). The occurrence and characteristics of endoscopically unexpected malignant degeneration in large rectal adenomas. Gastrointestinal endoscopy, 87(3), 862-871.
- Burgess, N. G., Hourigan, L. F., Zanati, S. A., Brown, G. J., Singh, R., Williams, S. J.,... & Bourke, M. J. (2017). Risk stratification for covert invasive cancer among patients referred for colonic endoscopic mucosal resection: a large multicenter cohort. Gastroenterology, 153(3), 732-742.
- D’Amico, F., Amato, A., Iannone, A., Trovato, C., Romana, C., Angeletti, S.,... & Group, B. (2021). Risk of covert submucosal cancer in patients with granular mixed laterally spreading tumors. Clinical Gastroenterology and Hepatology, 19(7), 1395-1401.
- Han, K. S., Sohn, D. K., Choi, D. H., Hong, C. W., Chang, H. J., Lim, S. B.,... & Park, J. G. (2008). Prolongation of the period between biopsy and EMR can influence the nonlifting sign in endoscopically resectable colorectal cancers. Gastrointestinal endoscopy, 67(1), 97-102.
- Hirata, I., Nakagawa, Y., Ohkubo, M., Yahagi, N., & Yao, K. (2012). Usefulness of magnifying narrow-band imaging endoscopy for the diagnosis of gastric and colorectal lesions. Digestion, 85(2), 74-79.
- Horie, H., Togashi, K., Kawamura, Y. J., Ohta, M., Nakajima, Y., Kihara, M.,... & Konishi, F. (2008). Colonoscopic stigmata of 1 mm or deeper submucosal invasion in colorectal cancer. Diseases of the colon & rectum, 51(10), 1529-1534.
- Hosotani, K., Imai, K., Hotta, K., Ito, S., Kishida, Y., Yabuuchi, Y.,... & Ono, H. (2021). Diagnostic performance for T1 cancer in colorectal lesions≥ 10 mm by optical characterization using magnifying narrow‐band imaging combined with magnifying chromoendoscopy; implications for optimized stratification by Japan Narrow‐band Imaging Expert Team classification. Digestive Endoscopy, 33(3), 425-432.
- Huang, S. L., Tan, W. X., Peng, Q., Zhang, W. H., Qing, H. T., Zhang, Q.,... & Qiao, W. G. (2020). Blue laser imaging combined with JNET (Japan NBI Expert Team) classification for pathological prediction of colorectal laterally spreading tumors. Surgical Endoscopy, 1-11.
- Ito, R., Ikematsu, H., Murano, T., Shinmura, K., Kojima, M., Kumahara, K.,... & Yano, T. (2021). Diagnostic ability of Japan Narrow-Band Imaging Expert Team classification for colorectal lesions by magnifying endoscopy with blue laser imaging versus narrow-band imaging. Endoscopy International Open, 9(02), E271-E277.
- Jang, H. W., Park, S. J., Cheon, J. H., Kim, T. I., Kim, W. H., & Hong, S. P. (2014). Does magnifying narrow-band imaging or magnifying chromoendoscopy help experienced endoscopists assess invasion depth of large sessile and flat polyps?. Digestive diseases and sciences, 59(7), 1520-1528.
- Kato, H., Haga, S., Endo, S., Hashimoto, M., Katsube, T., Oi, I.,... & Kajiwara, T. (2001). Lifting of lesions during endoscopic mucosal resection (EMR) of early colorectal cancer: implications for the assessment of resectability. Endoscopy, 33(07), 568-573.
- Kim, B. C., Chang, H. J., Han, K. S., Sohn, D. K., Hong, C. W., Park, J. W.,... & Oh, J. H. (2011). Clinicopathological differences of laterally spreading tumors of the colorectum according to gross appearance. Endoscopy, 43(02), 100-107.
- Kobayashi, N., Saito, Y., Sano, Y., Uragami, N., Michita, T., Nasu, J.,... & Saito, D. (2007). Determining the treatment strategy for colorectal neoplastic lesions: endoscopic assessment or the non-lifting sign for diagnosing invasion depth?. Endoscopy, 39(08), 701-705.
- Komeda, Y., Kashida, H., Sakurai, T., Asakuma, Y., Tribonias, G., Nagai, T.,... & Kudo, M. (2017). Magnifying narrow band imaging (NBI) for the diagnosis of localized colorectal lesions using the Japan NBI Expert Team (JNET) classification. Oncology, 93(Suppl. 1), 49-54.
- Kudo, S. E., Tamura, S., Nakajima, T., Yamano, H. O., Kusaka, H., & Watanabe, H. (1996). Diagnosis of colorectal tumorous lesions by magnifying endoscopy. Gastrointestinal endoscopy, 44(1), 8-14.
- Meulen, L. W., van de Wetering, A. J., Debeuf, M. E. P., Mujagic, Z., & Masclee, A. A. (2020). Optical diagnosis of T1 CRCs and treatment consequences in the Dutch CRC screening programme. Gut, 69(11), 2049-2051.
- Miyamoto, H., Ikematsu, H., Fujii, S., Osera, S., Odagaki, T., Oono, Y.,... & Kaneko, K. (2014). Clinicopathological differences of laterally spreading tumors arising in the colon and rectum. International journal of colorectal disease, 29(9), 1069-1075.
- Moss, A., Bourke, M. J., Williams, S. J., Hourigan, L. F., Brown, G., Tam, W.,... & Byth, K. (2011). Endoscopic mucosal resection outcomes and prediction of submucosal cancer from advanced colonic mucosal neoplasia. Gastroenterology, 140(7), 1909-1918.
- Park, W., Kim, B., Park, S. J., Cheon, J. H., Kim, T. I., Kim, W. H., & Hong, S. P. (2014). Conventional endoscopic features are not sufficient to differentiate small, early colorectal cancer. World journal of gastroenterology: WJG, 20(21), 6586.
- Puig, I., López-Cerón, M., Arnau, A., Rosiñol, Ò., Cuatrecasas, M., Herreros-de-Tejada, A.,... & Ascon, N. (2019). Accuracy of the narrow-band imaging international colorectal endoscopic classification system in identification of deep invasion in colorectal polyps. Gastroenterology, 156(1), 75-87.
- Sano, Y., Tanaka, S., Kudo, S. E., Saito, S., Matsuda, T., Wada, Y.,... & Saito, Y. (2016). Narrow‐band imaging (NBI) magnifying endoscopic classification of colorectal tumors proposed by the Japan NBI Expert Team. Digestive Endoscopy, 28(5), 526-533.
- Tanaka, S., Hayashi, N., Oka, S., & Chayama, K. (2013). Endoscopic assessment of colorectal cancer with superficial or deep submucosal invasion using magnifying colonoscopy. Clinical endoscopy, 46(2), 138.
- Toes-Zoutendijk, E., Kooyker, A. I., Elferink, M. A., Spaander, M. C., Dekker, E., de Koning, H. J.,... & Lansdorp-Vogelaar, I. (2018). Stage distribution of screen-detected colorectal cancers in the Netherlands. Gut, 67(9), 1745-1746.
- Uraoka, T., Saito, Y., Matsuda, T., Ikehara, H., Gotoda, T., Saito, D., & Fujii, T. (2006). Endoscopic indications for endoscopic mucosal resection of laterally spreading tumours in the colorectum. Gut, 55(11), 1592-1597.
- van der Vlugt, M., van Doorn, S. C., Wang, J., Bastiaansen, B. A., Brosens, L. A., Fockens, P., & Dekker, E. (2016). Optical diagnosis of malignant colorectal polyps: is it feasible?. Endoscopy international open, 4(07), E778-E783.
- van Nimwegen, L. J., Moons, L. M., Geesing, J. M., Arensman, L. R., Laclé, M., Broeders, I. A.,... & Schwartz, M. P. (2018). Extent of unnecessary surgery for benign rectal polyps in the Netherlands. Gastrointestinal endoscopy, 87(2), 562-570.
- Vosko, S., Shahidi, N., Sidhu, M., van Hattem, W. A., Bar-Yishay, I., Schoeman, S.,... & Bourke, M. J. (2021). Optical Evaluation for Predicting Cancer in Large Nonpedunculated Colorectal Polyps Is Accurate for Flat Lesions. Clinical Gastroenterology and Hepatology.
- Wang, Y., Li, W. K., Wang, Y. D., Liu, K. L., & Wu, J. (2021). Diagnostic performance of narrow-band imaging international colorectal endoscopic and Japanese narrow-band imaging expert team classification systems for colorectal cancer and precancerous lesions. World Journal of Gastrointestinal Oncology, 13(1), 58.
- Zhang, Q. W., Teng, L. M., Zhang, X. T., Zhang, J. J., Zhou, Y., Zhou, Z. R.,... & Li, X. B. (2017). Narrow-band imaging in the diagnosis of deep submucosal colorectal cancers: a
Evidence tabellen
Overview of systematic reviews and meta-analyses.
|
Reference |
Outcome measure |
Determinant |
Nr of polyps (studies) |
DIagnostic accuracy |
Certainty of the evidence (GRADE) |
Comments |
|
Bogie et al, 2017 |
Presence of T1 CRC |
GMF |
- (48) |
Risk T1 CRC:
|
Pretreatment diagnosis of endoscopic subtype, specifying areas of concern (nodule or depression), determines those LSTs at highest risk of containing SMI, where en bloc resection is the preferred therapy. |
|
|
Backes et al, 2016 |
Presence of T1 CRC |
NBI |
2140 (4) |
Pooled sensitivity 0.85 (95%CI 0.75-0.91) Pooled specificity 0.94 (95%CI 0.82 – 0.98) |
No difference in diagnostic accuracy between NBI and MCE (sensitivity p=0.22; specificity p=0.52). Diagnostic performance of GMF lower for all studies |
|
|
MCE |
8179 (5) |
Pooled sensitivity 0.90 (95%CI 0.83-0.94) Pooled specificity 0.96 (95%CI 0.89 – 0.99) |
||||
|
GMF a |
13511 (3) |
Sensitivity range: 0.21 – 0.46 Specificity range: 0.81 – 1.00 |
||||
|
Presence of T1 CRC with deep submucosal invasion |
NBI |
4943 (13) |
Pooled sensitivity 0.77 (95%CI 0.68-0.84) Pooled specificity 0.98 (95%CI 0.95 – 0.99) |
No difference in diagnostic accuracy between NBI and MCE (sensitivity p=0.41; specificity p=0.09). Diagnostic sensitivity for GMF low as compared to advanced imaging. |
||
|
MCE |
8195 (17) |
Pooled sensitivity 0.81 (95%CI 0.75-0.87) Pooled specificity 0.95 (95%CI 0.89 – 0.97) |
||||
|
GMF b |
13690 (6) |
Sensitivity range: 0.18-0.68 Specificity range: 0.80 – 0.98 |
||||
|
Zhang et al, 2017 |
Presence of T1 CRC with deep submucosal invasion |
NBI |
5352 (17) |
Pooled sensitivity 0.74 (95%CI 0.66-0.81) Pooled specificity 0.98 (95%CI 0.94-0.99) |
M-NBI had lower sensitivity (P < 0.01) than M-CE with similar specificity (P = 0.32).
|
|
|
MCE |
2677 (9) |
Pooled sensitivity 0.84 (95%CI 0.76-0.89) Pooled specificity 0.97 (95%CI 0.94-0.99) |
||||
|
GMF: gross morphological features; NBI: narrow-band imaging; MCE: magnifying chromoendoscopy
|
||||||
Overview of prospective studies in which prediction models are proposed
|
Reference |
Type of study |
Outcome measure |
Imaging technique |
Determinant |
Nr of polyps, size |
DIagnostic accuracy |
Certainty of the evidence (GRADE) |
Comments |
|
Backes et al, 2018 |
Prospective, observational |
Presence of T1 CRC |
White light |
Distal location |
329, ≥ 20 mm |
Sensitivity 69.4% Specificity 57.0% |
A lasso-derived model using white light and NBI features discriminated T1 CRCs from non-invasive polyps with a cross-validation AUC of 0.85 (95%CI 0.80-0.90) |
|
|
Non-granular surface |
Sensitivity 44.4% Specificity 83.3% |
|||||||
|
Granular with a large nodule |
Sensitivity 16.6% Specificity 75.0% |
|||||||
|
Granular with erythematous non-granular area |
Sensitivity 8.3% Specificity 98.6% |
|||||||
|
Depressed area |
Sensitivity 47.2% Specificity 82.6% |
|||||||
|
Excavation |
Sensitivity 8.3% Specificity 99.3% |
|||||||
|
Spontaneous bleeding |
Sensitivity 41.7% Specificity 90.1% |
|||||||
|
NBI |
Hiroshima ≥ C1 |
Sensitivity 77.8% Specificity 82.9% |
||||||
|
Presence of T1 CRC with deep submucosal invasion |
White light |
Distal location |
323, ≥ 20 mm |
Sensitivity 63.2% Specificity 56.3% |
No risk chart was developed to discriminate deep invasive T1 CRC from its precursor lesions |
|||
|
Non-granular surface |
Sensitivity 63.2% Specificity 82.9% |
|||||||
|
Granular with a large nodule |
Sensitivity - Specificity 75.0% |
|||||||
|
Granular with erythematous non-granular area |
Sensitivity 10.5% Specificity 98.7% |
|||||||
|
Depressed area |
Sensitivity 47.4% Specificity 81.9% |
|||||||
|
Excavation |
Sensitivity 15.8% Specificity 99.3% |
|||||||
|
Spontaneous bleeding |
Sensitivity 52.6% Specificity 89.8% |
|||||||
|
NBI |
Hiroshima ≥ C2 |
Sensitivity 68.4% Specificity 96.4% |
||||||
|
Burgess et al, 2017 |
Prospective, observational |
Presence of T1 CRC |
White light |
GMF |
2277, ≥ 20 mm |
rectosigmoid location (OR, 1.87; p=0.01), combined Paris classification, surface morphology (OR 3.96 - 22.5), and increasing size (OR 1.16/10 mm; p=0.01) |
rectosigmoid location, combined Paris classification and surface morphology, and increasing size is associated with increased risk for T1 CRC. Rectosigmoid 0–Is and 0–IIa + Is nongranular lesions have a high risk for malignancy, whereas proximally located 0–Is or 0–IIa granular lesions have a low risk. |
|
|
Puig et al, 2019 |
Prospective, observational |
Presence of T1 CRC with deep submucosal invasion |
NBI |
NICE classification |
2123, > 10 mm |
Sensitivity 58.4% (95% CI, 47.5–68.8) Specificity 96.4% (95% CI, 95.5–97.2) |
a tree algorithm intended to guide therapeutic decisions were provided (also including GMF as polyp morphology, granularity, presence of depression and ulceration)
Of note: study also included pedunculated polyps |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 02-02-2022
Uiterlijk in 2026 bepaalt het bestuur van de NVMDL of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVMDL is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De voorliggende richtlijn betreft een herziening van de NVMDL richtlijn Endoscopische poliepectomie van het colon uit 2019. Alle modules zijn beoordeeld op actualiteit. Vervolgens is een prioritering aangebracht welke modules een daadwerkelijke update zouden moeten krijgen. Hieronder staan de modules genoemd met de wijzigingen. Tevens is per module een inschatting gemaakt voor de beoordeling voor herziening.
|
Uitgangsvraag/onderwerpen |
Wijzigingen richtlijn 2021 |
Uiterlijk jaar voor herziening |
|
Randvoorwaarden voor poliepectomie |
Minimale (tekstuele) aanpassingen |
2026 |
|
Minuscule poliepen ≤ 5 mm en poliepen tussen 10 en 20 mm |
Minimale (tekstuele) aanpassingen |
2026 |
|
Poliepen 6 – 9 mm |
Gereviseerd |
2026 |
|
Sessiele en vlakke poliepen > 20 mm |
Gereviseerd |
2026 |
|
Herkenning van een potentieel maligne poliep |
Gereviseerd |
2026 |
|
Verwijdering van een potentieel maligne poliep |
Wordt behandeld in de CRC richtlijn |
- |
|
Behandeling en preventie van complicaties |
Minimale (tekstuele) aanpassingen |
2026 |
|
Preventief dichtclippen van wondvlak |
Nieuw ontwikkeld |
2026 |
|
Lokaal recidief na poliepectomie |
Gereviseerd |
2026 |
|
Behandeling van lokaal recidief |
Nieuw ontwikkeld |
2026 |
|
Pathologie: biopteren |
Nieuw ontwikkeld |
2026 |
|
Pathologie: weefselverwerking |
Minimale (tekstuele) aanpassingen |
2026 |
|
Prestatie indicatoren |
Minimale (tekstuele) aanpassingen |
2026 |
Belangrijkste wijzigingen ten opzichte van vorige versie
In de gereviseerde modules is de literatuur opnieuw systematisch gezocht en/of is de literatuursamenvatting aangepast. De strekking van de aanbevelingen is nagenoeg hetzelfde gebleven. Tevens zijn er drie nieuwe modules aan de richtlijn toegevoegd. De overige modules zijn opnieuw beoordeeld waarbij er minimale (tekstuele) aanpassingen gedaan. De module 'Verwijderen van een potentieel maligne poliep' is teruggetrokken. Dit onderwerp komt terug in de richtlijn Colorectaal carcinoom.
Algemene gegevens
De ontwikkeling en herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in het voorjaar van 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die direct betrokken zijn bij de zorg voor patiënten met poliepen in het rectum en colon.
Werkgroep
- Dr. L.M.G. (Leon) Moons (voorzitter), MDL-arts UMC Utrecht, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. T. (Tom) Seerden (vice-voorzitter), MDL-arts Amphia Breda, Nederlandse Vereniging van Maag-Darm-Leverartsen
- B.A.J. (Barbara) Bastiaansen, MDL-arts Amsterdam UMC, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. J.J. (Jurjen) Boonstra, MDL-arts, LUMC Leiden, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. A.D. (Arjun) Koch, MDL-arts, Erasmus MC Rotterdam, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. B.W.M. (Marcel) Spanier, MDL-arts, Rijnstate ziekenhuis, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. Y. (Yara) Backes, MDL-arts i.o., Meander Medisch Centrum Amersfoort, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. L. (Lindsey) Oudijk, patholoog Erasmus MC Rotterdam, Nederlandse Vereniging voor Pathologie
- Dr. M.M. (Miangela) Laclé, patholoog UMC Utrecht, Nederlandse Vereniging voor Pathologie
- C. (Christiaan) Hoff, chirurg Medisch Centrum Leeuwarden, Nederlandse Vereniging voor Heelkunde
- R. (Ruud) Blankenburgh, Internist-Oncoloog Saxenburgh Hardenberg, Nederlandse Internisten Vereniging
Klankbordgroep
- J.J. (Jan) Meeuse, NIV
- S. (Silvie) Dronkers, Stichting Darmkanker
- J. (Jannie) Verheij - van der Wiel, Stomavereniging
- J.H.M.A. (Ans) Dietvorst, Stichting Lynch Polyposis
Met ondersteuning van
- Dr. A.N. (Anh Nhi) Nguyen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. E.V. (Ekaterina) van Dorp-Baranova, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Restrictie (zie ook tekst onder de tabel) |
|
Moons (voorzitter) |
MDL-arts, interventie endoscopist, UMC Utrecht, Utrecht, Nederland |
Geen |
Consultant Boston Scientific |
Geen |
|
Seerden (vice-voorzitter) |
MDL arts, Medisch specialistisch bedrijf Amphia te Breda |
Geen |
Geen |
Geen |
|
Bastiaansen |
MDL-arts Amsterdam UMC |
Geen |
Geen |
Geen |
|
Boonstra |
MDL-arts, LUMC, Leiden |
Geen |
Consultant Boston Scientific |
Geen |
|
Koch |
MDL-arts, Erasmus MC, Universitair Medisch Centrum Rotterdam |
Geen |
Consultant Boston Scientific. Pentax Medical, ERBE Elektromedizin, DrFalk Pharma |
Geen |
|
Spanier |
Als vrijgevestigd MDL-arts in dienst bij Cooperatie Medisch Specialisten Rijnstate u.a. (CMSR) |
Bestuurslid CMSR, 4 dagdelen, betaald, vergoeding naar vakgroep MDL Rijnstate |
Geen |
Geen |
|
Backes |
aios MDL, Meander Medisch Centrum Amersfoort |
Geen |
Geen |
Geen |
|
Oudijk |
Patholoog, Erasmus MC Rotterdam |
PPM patholoog Palga: Motiveren gebruik PALGA protocollen, contactpersoon voor PALGA rapportage gebruik protocollen, mede-pathologen en MDO-leden, clinici. Onbetaald. Lid wetenschappelijke commissie Dutch Thyroid Cancer Group: onbetaald. Lid wetenschappelijke adviescommissie Stichting Bijniernetwerk Nederland: onbetaald |
Geen |
Geen |
|
Laclé |
Patholoog UMC Utrecht |
Geen |
Geen |
Geen |
|
Hoff |
Chirurg Medisch Centrum Leeuwarden (via Heelkunde Friesland Groep) (0,6) medisch cobestuurder MCL 0,4) |
Geen |
Geen |
Geen |
|
Blankenburgh |
Internist-Oncoloog, Saxenburgh te Hardenberg |
Geen |
Geen |
Geen |
Het Kennisinstituut in zijn rol als methodologisch ondersteuner, de NVMDL als initiërende vereniging en de richtlijnwerkgroep zijn zich bewust van de belangen die spelen binnen de richtlijnwerkgroep, maar het werd toch noodzakelijk geacht om de betreffende inhoudelijk experts op dit gebied bij de richtlijn te betrekken. Tijdens de commentaarfase werd de NVMDL verzocht om bij het aanleveren van commentaar kritisch te zijn op de gemelde belangen en geformuleerde aanbevelingen en onderbouwing en om experts, vrij van belangen, expliciet te verzoeken om de richtlijn te beoordelen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden vanuit patiëntenverenigingen in de klankbordgroep met de conceptrichtlijn mee te laten lezen. De commentaren zijn besproken in de werkgroep en verwerkt. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Stichting Darmkanker, Stomavereniging en Stichting Lynch Polyposis.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen. De werkgroep heeft ook interne kwaliteitsindicatoren ontwikkeld.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging van Maag-Darm-Leverartsen, 2019) op noodzaak tot revisie. Op basis van de geprioriteerde knelpunten zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, en bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
