Frequentie pijn- en comfortmeting bij chronische pijn
Uitgangsvraag
Wat is de optimale frequentie van pijnmeting en comfortmeting bij kinderen met chronische pijn?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de optimale frequentie van pijnmeting bij kinderen met chronische pijn?
- Wat is de waarde van pijnmeting vergeleken met comfortmeting op de pijnbeleving bij kinderen met chronische pijn?
- Wat is de optimale frequentie van comfortmeting bij kinderen met chronische pijn?
Aanbeveling
Meet bij kinderen met chronische pijn (zonder acute pijn) welke zijn opgenomen in het ziekenhuis of de Spoedeisende Hulp hoogstens 1 keer per dag comfort en/of de pijnintensiteit.
Bepaal het effect van aanpassingen in het farmacologische pijnbeleid voor kinderen met chronische pijn (zonder acute pijn) op basis van het te verwachten resultaat:
- Antineuropatische medicatie: geen aanpassing in frequentie van meten comfort en/of pijnintensiteit
- NSAID’s, tramadol, opioiden: meet 3 maal daags comfort en/of de pijnintensiteit voor 3 dagen en daarna weer voor hoogstens 1 keer per dag
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematische literatuursearch verricht, maar er werden geen studies gevonden die de optimale frequentie van pijnmeting of comfortmeting hebben onderzocht, en ook geen studies die de waarde van pijnmeting met comfortmeting op de pijnbeleving hebben vergeleken.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Bij acute pijn wordt vanuit het VMS Veiligheidsprogramma geadviseerd om driemaal daagse de pijnintensiteit te meten. Voor kinderen opgenomen met chronische pijn (zonder acute pijn) is dit niet zinvol. Wel is het van belang dat de verpleging alert blijft op eventuele veranderingen in pijn bij de patiënt en dat aan de hand hiervan in overleg met de patiënt en de ouders gehandeld wordt. Alleen bij wijzigingen in pijnmedicatie kan kortdurend een frequentie van driemaal daags zinvol zijn om het effect van de therapie op de pijnintensiteit van de chronische pijn te bepalen. Voor neuropatische pijnmedicatie geldt dat een kortdurende hogere frequentie van meten van de pijnintensiteit niet zinvol is.
Kosten (middelenbeslag)
Door bij kinderen met chronische pijn (zonder acute pijn) minder vaak de pijnintensiteit te meten heeft de verpleging meer tijd voor psychosociale factoren bij het opgenomen kind en minder regeldruk.
Aanvaardbaarheid, haalbaarheid en implementatie
Minder frequent meten van de pijnintensiteit bij kinderen met chronische pijn (zonder acute pijn) leidt tot meer tijd van de verpleging voor het opgenomen kind (minder regeldruk).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er is geen literatuur gevonden die ondersteund dat zowel het meten van de pijnintensiteit (middels unidimensionele vragenlijst) als het meten van comfort de pijnbeleving van het kind met chronische pijn negatief of positief beïnvloed. Er is tevens geen literatuur gevonden over een nadelig dan wel positief effect van de frequentie van het dagelijks uitvragen van de pijnintensiteit en comfort een negatieve invloed heeft op de pijnbeleving van het kind met chronische pijn. De werkgroep is van mening dat het meten van comfort een lichte voorkeur heeft boven de pijnintensiteit meting op basis van het multidimensionele pijnmodel.
Bij kinderen met chronische pijn (zonder acute pijn) die zijn opgenomen in het ziekenhuis of de Spoedeisende Hulp wordt hoogstens 1 keer per dag de pijnintensiteit (middels unidimensionele vragenlijst) en/of comfort gemeten.
Indien de pijnmedicatie tijdens de opname wordt opgehoogd en/of additionele pijnmedicatie wordt opgehoogd moet het effect hiervan wel worden opgevolgd middels een pijnintensiteit meting. De frequentie van deze pijnmeting is echter afhankelijk van het middel:
- Bij starten dan wel ophogen van antineuropatische medicatie wordt de frequentie van meten van pijnintensiteit niet verhoogd omdat het effect op de pijnintensiteit pas na 2-3 weken verwacht wordt.
- Voor de niet-neuropatische pijnmedicatie (zoals bijvoorbeeld paracetamol, NSAID (inclusief metamizol), tramadol/tapentadol, opioiden kan kortdurend (3 dagen) een 3 maal daagse pijnintensiteit metingen worden verricht om het effect van het starten dan wel ophogen van het medicijn te evalueren
Volg voor kinderen met chronische pijn die zijn opgenomen in het ziekenhuis of de Spoedeisende Hulp met tevens acute pijn (nociceptief, neuropatisch, visceraal, vasculair, oncologisch) module 10 voor de frequentie van pijnmetingen.
Onderbouwing
Achtergrond
Voor acute pijn wordt geadviseerd vanuit het VMS veiligheidsprogramma om frequent (3 maal daags) de pijnintensiteit te meten bij patiënten die opgenomen zijn in het ziekenhuis of de Spoedeisende Hulp.
De ervaren pijnintensiteit (pijnbeleving) wordt beïnvloed door psychische, biologische en sociale factoren. Hierdoor bestaat het risico dat zowel het meten van de pijnintensiteit (middels unidimensionele vragenlijst) als het meten van comfort de pijnbeleving van het kind met chronische pijn negatief beïnvloed.
Onbekend is of de frequentie van het dagelijks uitvragen van de pijnintensiteit en comfort een negatieve invloed heeft op de pijnbeleving van het kind met chronische pijn.
Conclusies / Summary of Findings
Due to the lack of evidence, no conclusions could be formulated.
Samenvatting literatuur
Not applicable.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
- What is the effect of the frequency of measurement pain (using valid instruments) on pain experience in children with chronic pain?
- What is the effect of measuring pain versus measuring comfort on pain experience in children with chronic pain?
- What is the effect of the frequency of measuring comfort (using valid instruments) on pain experience in children with chronic pain?
P: Children with chronic pain
I1: Frequently (3 dd) measuring pain
I2: Measuring pain
I3: Frequently (3 dd) measuring comfort
C1: Infrequently (other frequency) measuring pain
C2: Measuring comfort
C3: Infrequently (other frequency) measuring comfort
O: Pain experience
Relevant outcome measures
The guideline development group considered pain experience as a critical outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group did not define a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until October 24th 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 67 hits. Studies were selected based on the following criteria:
- Being a systematic review or meta-analysis or observational study (cohort study or case control study)
- Investigating the effect of different frequencies of pain or comfort measurement (with a valid measurement instrument) or comparing the effect of measuring pain or comfort in children with chronic pain.
Seven studies were initially selected based on title and abstract screening. After reading the full text, seven studies were excluded (see the table with reasons for exclusion under the tab Methods), and no studies were included.
Results
No studies were included in the analysis of the literature. Therefore, no summary of literature was performed.
Evidence tabellen
Not applicable.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Lee RR, Rashid A, Ghio D, Thomson W, Cordingley L. Chronic Pain Assessments in Children and Adolescents: A Systematic Literature Review of the Selection, Administration, Interpretation, and Reporting of Unidimensional Pain Intensity Scales. Pain Res Manag. 2017;2017:7603758. doi: 10.1155/2017/7603758. Epub 2017 Aug 21. PMID: 28912638; PMCID: PMC5585620. |
Wrong O: frequency of pain/comfort measurement not reported in SR |
|
Bice AA, Wyatt TH. Holistic Comfort Interventions for Pediatric Nursing Procedures: A Systematic Review. J Holist Nurs. 2017 Sep;35(3):280-295. doi: 10.1177/0898010116660397. Epub 2016 Jul 25. PMID: 27459362. |
Wrong study design: review of holistic comfort interventions |
|
Eccleston C, Jordan AL, Crombez G. The impact of chronic pain on adolescents: a review of previously used measures. J Pediatr Psychol. 2006 Aug;31(7):684-97. doi: 10.1093/jpepsy/jsj061. Epub 2005 Sep 8. PMID: 16150880. |
Wrong study design: measurement properties, no frequency reported |
|
Fisher E, Heathcote LC, Eccleston C, Simons LE, Palermo TM. Assessment of Pain Anxiety, Pain Catastrophizing, and Fear of Pain in Children and Adolescents With Chronic Pain: A Systematic Review and Meta-Analysis. J Pediatr Psychol. 2018 Apr 1;43(3):314-325. doi: 10.1093/jpepsy/jsx103. PMID: 29049813; PMCID: PMC6927870. |
Wrong study design: measurement properties, no frequency reported |
|
Connolly MR, Chaudari JY, Yang X, Ward N, Kitt RA, Herrmann RS, Krane EJ, LeBel AA, Smith SM, Walco GA, Weisman SJ, Turk DC, Dworkin RH, Gewandter JS. Design and Reporting Characteristics of Clinical Trials of Select Chronic and Recurrent Pediatric Pain Conditions: An Analgesic, Anesthetic, and Addiction Clinical Trial Translations, Innovations, Opportunities, and Networks Systematic Review. J Pain. 2019 Apr;20(4):394-404. doi: 10.1016/j.jpain.2018.08.007. Epub 2018 Sep 13. PMID: 30219729; PMCID: PMC6784317. |
Wrong study design: SR of reported outcomes in intervention studies for chronic pain |
|
Ridgers ND, McNarry MA, Mackintosh KA. Feasibility and Effectiveness of Using Wearable Activity Trackers in Youth: A Systematic Review. JMIR Mhealth Uhealth. 2016 Nov 23;4(4):e129. doi: 10.2196/mhealth.6540. PMID: 27881359; PMCID: PMC5143467. |
Wrong I: activity trackers; wrong study design: feasibility and effectiveness
|
|
Birnie KA, Hundert AS, Lalloo C, Nguyen C, Stinson JN. Recommendations for selection of self-report pain intensity measures in children and adolescents: a systematic review and quality assessment of measurement properties. Pain. 2019 Jan;160(1):5-18. doi: 10.1097/j.pain.0000000000001377. PMID: 30180088. |
Wrong study design: measurement properties, no frequency reported
|
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-04-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met pijn.
Kernwerkgroep
- Drs. M.A. (Maarten) Mensink, kinderanesthesioloog en pijnarts, werkzaam in het Prinses Máxima Centrum voor Kinderoncologie te Utrecht, NVA, voorzitter
- Drs. J.F. (Joanne) Goorhuis, algemeen kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Dr. F (Felix) Kreier, algemeen kinderarts, werkzaam in het OLVG te Amsterdam, NVK
- Drs. M.S. (Sukru) Genco, algemeen kinderarts, werkzaam in het OLVG te Amsterdam, NVK
- Dr. S.H. (Steven) Renes, anesthesioloog-pijnspecialist, werkzaam in het Radboud UMC te Nijmegen, NVA
- Dr. P. (Petra) Honig-Mazer, psychotherapeut, werkzaam in het Erasmus MC Sophia te Rotterdam, NIP/LVMP
- Drs. M. (Marjorie) de Neef, kinder-IC verpleegkundige, werkzaam in het Amsterdam UMC, V&VN
- R. (Rowy) Uitzinger, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis, tot 1 juni 2022
- E.C. (Esen) Doganer, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis, vanaf 1 juni 2022
Werkgroep
- Drs. L.A.M. (Lonneke) Aarts, algemeen kinderarts, werkzaam in het RadboudUMC Amalia kinderziekenhuis te Nijmegen, NVK
- Prof. dr. W.J.E. (Wim) Tissing, kinderoncoloog, werkzaam in het UMCG te Groningen en Prinses Máxima Centrum te Utrecht, NVK
- Prof. dr. S.N. (Saskia) de Wildt, kinderintensivist, werkzaam in het RadboudUMC te Nijmegen, NVK (tot 9-9-2022)
- Prof. dr. N.M. (Nico) Wulffraat, kinderreumatoloog, werkzaam in het UMC Utrecht te Utrecht, NVK (tot 1-11-2022)
- Drs. P. (Petra) Hissink-Muller, kinderreumatoloog, werkzaam in het Erasmus MC Sophia te Rotterdam (vanaf 1-11-2022)
- Drs. A.M. (Arine) Vlieger, algemeen kinderarts, werkzaam in het St. Antonius Ziekenhuis te Utrecht, NVK
- Dr. S.H.P. (Sinno) Simons, kinderarts-neonatoloog, werkzaam in het Erasmus MC Sophia te Rotterdam, NVK
- Drs. K. (Karina) Elangovan, kinderanesthesioloog, werkzaam in het Erasmus MC Sophia te Rotterdam, NVA
- Dr. C.M.G. (Claudia) Keyzer – Dekker, kinderchirurg, werkzaam in het Erasmus MC Sophia te Rotterdam, NVvH
- A.P. (Annette) van der Kaa, kinderfysiotherapeut, werkzaam in het Erasumc MC Sophia te Rotterdam, NVFK en KNGF
- Drs. A. H. (Agnes) Dommerholt, klinisch psycholoog, werkzaam in het OLVG te Amsterdam, NIP/LVMP (vanaf 1-1-2023)
Klankbordgroep
- Drs. J. (Judig) Blaauw, kinderrevalidatiearts, VRA
- Dr. H. (Hanneke) Bruijnzeel, AIOS, werkzaam in het UMC Utrecht te Utrecht, NVKNO
- Dr. A.M.J.W. (Anne-Marie) Scheepers, ziekenhuisapotheker, werkzaam in het MUMC te Maastricht, NVZA
- Dr. S.A. (Sylvia) Obermann-Borst, ervaringsdeskundige ouder & huisarts-epidemioloog, Care4Neo (voorheen Vereniging van Ouders van Couveusekinderen - VOC)
- Dr. I.H. (Ilse) Zaal-Schuller, arts voor verstandelijk gehandicapten/kaderarts palliatieve zorg i.o., werkzaam bij Prinsenstichting Purmerend/ AmsterdamUMC locatie AMC, NVAVG
- M. (Miep) van der Doelen, CliniClowns Nederland (tot 1-9-2023)
- Dr. E. (Eva) Schaffrath, anesthesioloog, werkzaam in het Maastricht UMC te Maastricht, PROSA Kenniscentrum
- M. (Mirjam) Jansen op de Haar, HME-MO Vereniging Nederland
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst – Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. C. (Cécile) Overman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. D.A.M. (Danique) Middelhuis, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Liza) van Mun, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van (kern)werkgroepleden en klankbordgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Betrokkenen |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Werkgroep |
||||
|
Aarts |
Algemeen kinderarts in het Amalia kinderziekenhuissinds november 2017 |
Interne functies onbetaald: 1. voorzitter Pijn werkgroep Amalia kinderziekenhuis. 2. Verbonden aan werkgroep procedurele sedatie bij kinderen. 3. Implementatie VR in Amalia. |
Onderzoek naar effect comfort talk technieken; maar eenmalige subsidie gekregen voor uitvoer. Geen extern belang qua uitkomst. |
Geen actie |
|
Dommerholt |
Klinisch psycholoog KJ, vakgroep kindergeneeskunde OLVG |
Praktijk Dommerholt, praktijk voor kinder- en jeugdpsychotherapie, supervisie en doceren. (momenteel inactief). Lid vakgroep en medische staf, uitvoeren van psychologische diagnostiek en behandeling van kinderen en hun systeem, opleider. |
Geen |
Geen actie |
|
Elangovan |
Universitair medisch specialist Anesthesioloog-pijnspecialist; ErasmusMC |
Geen |
Geen |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam |
- Eigenaar Genco Med. Beheer B.V. |
Directe belangen bij eigen B.V. maar geen relatie met de bezigheden van de werkgroep. Bijvangst van het project kan zijn: nieuwe kennis en ervaring om binnen onze organisatie te delen. |
Geen actie |
|
Goorhuis |
Algemeen kinderarts - acute kindergeneeskunde |
Geen |
Geen |
Geen actie |
|
Hissink-Muller |
Kinderreumatoloog, Erasmus MC Sophia |
|
|
|
|
Kaa, van der |
Kinderfysiotherapeut |
-Docent Master Kinderfysiotherapie bij Breederode Hogeschool - Universitair docent -Kinderfysiotherapeut 1e lijn (Fysio van der Linden) |
Geen |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg Sophia Kinderziekenhuis ErasmusMC te Rotterdam |
APLS instructeur SSHK Riel, dagvergoeding |
Geen |
Geen actie |
|
Kreier |
Kinderarts OLVG Amsterdam |
Medeauteur en -oprichter “De hamster in je brein” |
Geen |
Geen actie |
|
Mensink* |
kinderanesthesioloog - pijnarts - Prinses Máxima Centrum voor kinderoncologie |
Bestuurslid sectie Pijn&palliatieve geneeskunde NVA - onbetaalde functie |
Geen |
Geen actie |
|
Neef, de |
Verpleegkundig onderzoeker, Kinder IC, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Petra Honig-Mazer |
Erasmus MC - Sophia Kinderziekenhuis Afdeling Kinder- en Jeugdpsychiatrie/psychologie Unit Psychosociale Zorg Psychotherapeut BIG |
Kleine eigen praktijk: Praktijk voor Psychotherapie Honig-Mazer, betaald |
Geen |
Geen actie |
|
Renes |
Anesthesioloog-pijnspecialist Radboudumc |
Kwaliteitsvisitaties Nederlandse Vereniging Anesthesiologie, vacatiegeld |
Geen |
Geen actie |
|
Simons |
Kinderarts - neonatoloog - klinisch farmacoloog (Universitair Medische Specialist) |
Lid geneesmiddelencommissie Erasmus MC (onbetaald) |
Geen |
Geen actie |
|
Tissing |
Kinderoncoloog, Hoogleraar supportive care in de kinderoncologie. 0.6 fte Prinses Maxima Centrum, 0,4 fte UMCG |
PI van onderzoek naar app over invloed van laagdrempelig contact op pijn bij patiënten met kanker. |
Geen |
Geen actie |
|
Uitzinger |
Junior Project manager en beleidsmedewerker Stichting kind en ziekenhuis |
Geen |
Geen |
Geen actie |
|
Vlieger |
1. Kinderarts St Antonius ziekenhuis Nieuwegein |
1. Les geven via Cure en Care en via het Prinses MAxima Centrum op het gebiedvan hypnose bij kinderen. Dit is betaald. |
Aangezien ik les geef op het gebied van non-farmacologische methoden om pijn en angst te voorkomen cq te behandelen kan ik daar theoretisch voordeel van ondervinden als nog meer afdelingen hun personeel geschoold wilt hebben in non-farmacologische technieken. in de richtlijn komen uiteraard geen namen van bedrijven te staan, dus ik verwacht geen evident voordeel. Mijn mede eigenaars van het skills4comfort bedrijf. Overigens loopt dit al heel goed. Iedereen is gelukkig al overtuigd van het belang van het aanleren van positief taalgebruik, afleiden, echt contact maken en een vertrouwensband opbouwen. |
Uitsluiten van besluitvorming voor modules over non-farmacologische pijnbestrijding. Mag wel meelezen. |
|
Wildt, de |
Kinderarts-intensivist, hoogleraar klinische farmacologie, Radboudumc |
Directeur stichting Nederlands Kenniscentrum Farmacotherapie Kinderen (detachering |
Patent: Gebruik van PENK voor nierfunctiebepaling bij kinderen (aangevraagd). Bill and Melinda Gates Foundation: model-informed dosing for pediatric dosing |
Geen actie |
|
Wulffraat |
Hoogleraar kinderimmunologie/reumatologie. UMCU |
Voorzitter (coordinator) ERN-RITA (european reference network (onbetaald). |
Onze vakgroep heeft zeer veel extern gefinancierd onderzoek. Er is geen direct belang van de financier bij deze richtlijn. Onderzoekslijn chronische pijn bij jeugdreuma is puur academisch. Mensink (aangesteld in PMC) is hier de promovendus. Ik ben de promotor. |
Geen actie |
|
Klankbordgroep |
||||
|
Bruijnzeel |
Arts-assistent Keel-, Neus- en Oorheelkunde, UMC Utrecht |
Kerngroep Pediatrie (KNO vereniging) - onbetaald |
Geen |
Geen actie |
|
Scheepers |
ziekenhuisapotheker, Maastricht UMC+ |
Geen |
Geen |
Geen actie |
|
Obermann-Borst |
Coördinator Wetenschap bij Care4Neo 10 u per week |
Coördinator Wetenschap bij Care4Neo 75% betaald/25% vrijwillig verzorgen van bijdrage vanuit patientenperspectief aan wetenschap, richtlijnen en kwaliteit van zorg namens de patientenvereniging voor ouders van en voor kinderen die te vroeg, te klein en/of ziek geboren zijn. |
Geen |
Geen actie |
|
Zaal Schuller |
Arts voor verstandelijk gehandicapten |
Arts voor verstandelijk gehandicapten, betaald. |
Geen |
Geen actie |
|
Schaffrath |
Kinderanesthesioloog MUMC |
Faculty member PROSA (tegen dagvergoeding) |
Geen |
Geen actie |
|
Blaauw |
Kinderrevalidatiearts |
Geen |
Geen |
Geen actie |
|
Bruijn, de (interim) |
Kinderrevalidatiearts bij Revalidatie Friesland |
Lid kwaliteitscommissie VRA (deels betaald, vacatiegeld) |
Geen |
Geen actie |
|
Doelen |
CliniClown bij stichting CliniClowns 28 uur per week |
Bestuurslid theaterproducties Natuurtheater de Kersouwe in Heeswijk Dinther (onbetaald) |
Hoofddoel van mijn bijdrage aan de werkgroep is de kennis en ervaring van CliniClowns in te zetten bij het geven van feedback op de gemaakte stukken. |
Geen actie |
|
Haar, van der |
Freelance consultant Moonshot |
Bestuurslid HME-MO Vereniging Nederland |
Geen |
Geen actie |
* Voorzitter
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Stichting Kind en Ziekenhuis in de kernwerkgroep en Care4Neo, CliniClowns Nederland en HME-MO Vereniging Nederland in de klankbordgroep. Op verschillende momenten is input gevraagd tijdens een invitational conference en bij het opstellen van het raamwerk. Het verslag van de invitational conference [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Frequentie pijnmeting bij chronische pijn |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Voorafgaand aan de voorbereidende fase is een invitational conference georganiseerd over herkenning en behandeling van pijn binnen de kindzorg. Een verslag hiervan is opgenomen onder aanverwante producten. Daarnaast werd tijdens de voorbereidende fase van de richtlijn een schriftelijke knelpunteninventarisatie gehouden. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
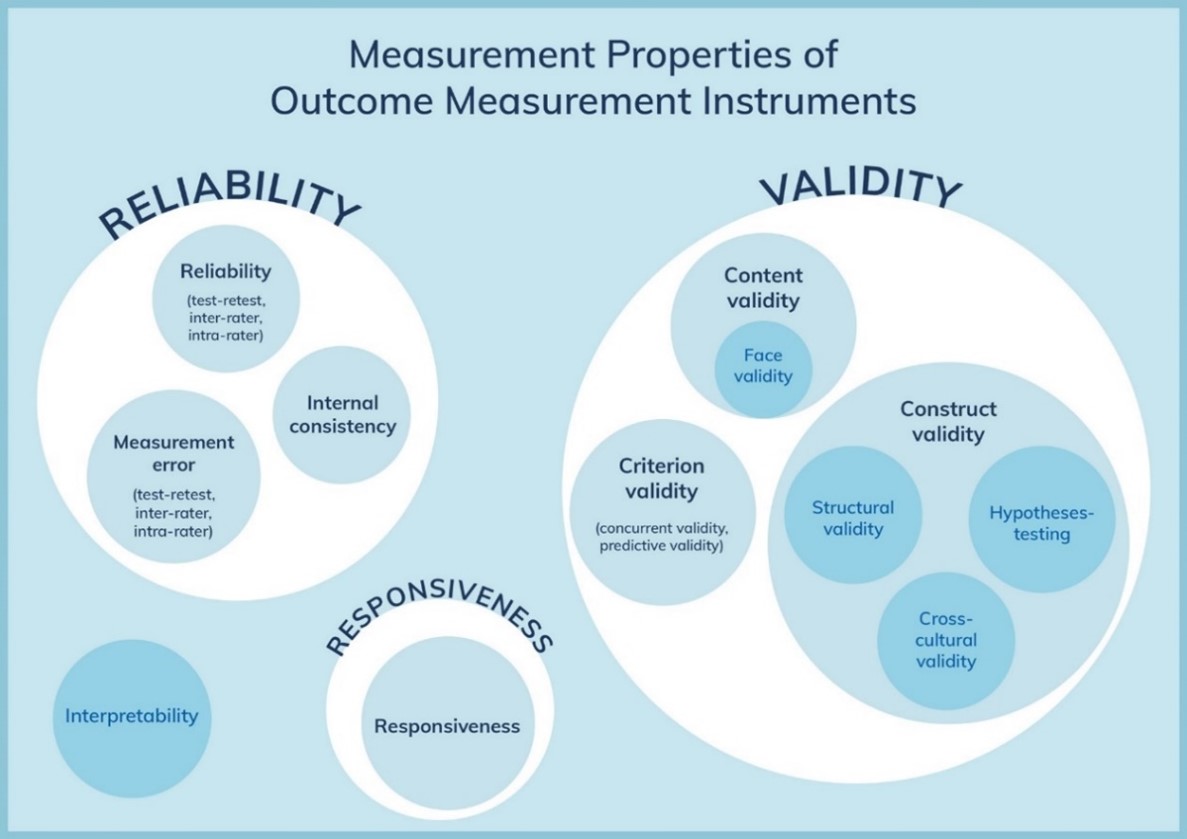
COSMIN
The COSMIN Risk of Bias tool was used to assess the quality of single studies for each measurement property. Thereby, the worst-score-counts method was used to determine the risk of bias, this means that the lowest rating given in a box determines the final rating, i.e. the quality of the study. The result of each study on a measurement property were rated against the updated criteria for good measurement properties (Table 1). Each result was rated as either sufficient (+), insufficient (–), or indeterminate (?).
Table 1. Criteria for good measurement properties (Mokkink, 2018)
|
Measurement property |
Rating[1] |
Criteria |
|
Structural validity |
+ |
CTT: CFA: CFI or TLI or comparable measure >0.95 OR RMSEA <0.06 OR SRMR <0.08[2] IRT/Rasch: No violation of unidimensionality[3]: CFI or TLI or comparable measure >0.95 OR RMSEA <0.06 OR SRMR <0.08 AND no violation of local independence: residual correlations among the items after controlling for the dominant factor < 0.20 OR Q3's < 0.37 AND no violation of monotonicity: adequate looking graphs OR item scalability >0.30 AND adequate model fit: IRT: χ2 >0.01 Rasch: infit and outfit mean squares ≥ 0.5 and ≤ 1.5 OR Z-standardized values > ‐2 and <2 |
|
? |
CTT: Not all information for ‘+’ reported IRT/Rasch: Model fit not reported |
|
|
- |
Criteria for ‘+’ not met |
|
|
Internal consistency |
+ |
At least low evidence[4] for sufficient structural validity[5] AND Cronbach's alpha(s) ≥ 0.70 for each unidimensional scale or Subscale.[6] |
|
? |
Criteria for “At least low evidence for sufficient structural validity” not met |
|
|
- |
At least low evidence4 for sufficient structural validity5 AND Cronbach’s alpha(s) < 0.70 for each unidimensional scale or Subscale.6 |
|
|
Reliability |
+ |
ICC or weighted Kappa ≥ 0.70 |
|
? |
ICC or weighted Kappa not reported |
|
|
- |
ICC or weighted Kappa < 0.70 |
|
|
Measurement error |
+ |
SDC or LoA < MIC |
|
? |
MIC not defined |
|
|
- |
SDC or LoA > MIC |
|
|
Hypotheses testing for construct validity |
+ |
The result is in accordance with the hypothesis[7] |
|
? |
No hypothesis defined (by the review team) |
|
|
- |
The result is not in accordance with the hypothesis |
|
|
Cross‐cultural validity\measurement invariance |
+ |
No important differences found between group factors (such as age, gender, language) in multiple group factor analysis OR no important DIF for group factors (McFadden's R2 < 0.02) |
|
? |
No multiple group factor analysis OR DIF analysis performed |
|
|
- |
Important differences between group factors OR DIF was found |
|
|
Criterion validity |
+ |
Correlation with gold standard ≥ 0.70 OR AUC ≥ 0.70 |
|
? |
Not all information for ‘+’ reported |
|
|
- |
Correlation with gold standard < 0.70 OR AUC < 0.70 |
|
|
Responsiveness |
+ |
The result is in accordance with the hypothesis OR AUC ≥ 0.70 |
|
? |
No hypothesis defined (by the review team) |
|
|
- |
The result is not in accordance with the hypothesis OR AUC < 0.70 |
|
|
AUC: area under the curve, CFA: confirmatory factor analysis, CFI: comparative fit index, CTT: classical test theory, DIF: differential item functioning, ICC: intraclass correlation coefficient, IRT: item response theory, LoA: limits of agreement, MIC: minimal important change, RMSEA: Root Mean Square Error of Approximation, SEM: Standard Error of Measurement, SDC: smallest detectable change, SRMR: Standardized Root Mean Residuals, TLI = Tucker‐Lewis Index |
||
[1] “+” = sufficient, ” –“ = insufficient, “?” = indeterminate
[2] To rate the quality of the summary score, the factor structures should be equal across studies
[3] unidimensionality refers to a factor analysis per subscale, while structural validity refers to a factor analysis of a (multidimensional) patient‐reported outcome measure
[4] As defined by grading the evidence according to the GRADE approach
[5] This evidence may come from different studies
[6] The criteria ‘Cronbach alpha < 0.95’ was deleted, as this is relevant in the development phase of a PROM and not when evaluating an existing PROM.
[7] The results of all studies should be taken together and it should then be decided if 75% of the results are in accordance with the hypotheses
The level of evidence of the literature was evaluated as described in the COSMIN user manual for systematic reviews of patient-reported outcome measures (Mokkink, 2018). The following four factors were taken into account: (1) risk of bias (i.e. the methodological quality of the studies), (2) inconsistency (i.e. unexplained inconsistency of results across studies), (3) imprecision (i.e. total sample size of the available studies), and (4) indirectness (i.e. evidence from different populations than the population of interest in the review). The quality of evidence could be downgraded with one level (e.g. from high to moderate evidence) if there is serious risk of bias, with two levels (e.g. from high to low) if there is very serious risk of bias, or with three levels (i.e. from high to very low) if there is extremely risk of bias. The quality of the evidence could be downgraded with one or two levels for inconsistency, imprecision (-1 if total N=50-100; -2 if total N<50) and indirectness.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J [corrected to Schünemann, Holger J]. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.