Farmacologische pijnbestrijding bij neuropathische pijn
Uitgangsvraag
Wat is de meest waardevolle farmacologische pijnbestrijding bij kinderen met neuropathische pijn?
Aanbeveling
Gebruik het biopsychosociale model voor de behandeling van chronische neuropathische pijn uit van, en besteed daarbij ook aandacht aan het verwachtingsmanagement. Zie ook Zorgstandaard Chronische pijn.
Volg voor medicamenteuze behandeling van chronische neuropathische pijn de pijnladder zoals aangegeven in deze module.
Overweeg verwijzing naar kinderpijncentrum indien de ingestelde monotherapie (antidepressivum of anti-epilepticum) onvoldoende effect heeft bij chronische neuropathische pijn.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In deze literatuuranalyse werd één studie geïncludeerd die het effect van gabapentine op neuropathische pijn bij kinderen onderzochten.
Op basis van de literatuuranalyse is het onzeker of gabapentine een effect heeft op neuropathische pijn, in vergelijking met placebo. De enige studie die gedaan is naar de uitkomst pijn, laat geen effect zien op de uitkomstmaat pijn. De bewijskracht hiervan is zeer laag, doordat de studie niet duidelijk beschrijft hoe het randomisatieproces heeft plaatsgevonden, wat risico geeft op vertekening van de resultaten. Daarnaast includeerde de studie weinig patiënten en waren de betrouwbaarheidsintervallen breed, wat de kwaliteit van het bewijs ook verlaagt. Er werden geen studies gevonden die de cruciale uitkomstmaten functioneren en stress/distress en de belangrijke uitkomstmaten angst en kwaliteit van leven onderzochten.
Concluderend is het onzeker of gabapentine een effect zou kunnen hebben op neuropathische pijn bij kinderen. De bewijskracht hiervan is zeer laag, met name door risico op vertekening en lage generaliseerbaarheid door de kleine studiepopulatie.
De werkgroep is van mening dat voor neuropatische pijn bij kinderen en adolescenten gebruik kan worden gemaakt van de aanbevelingen uit de module “Pijn- en revalidatiebehandeling bij polyneuropathie” van de richtlijn “Polyneuropathie” voor volwassenen.
De aanbevelingen van deze module zijn expliciet niet van toepassing voor de volgende ziektebeelden: trigeminus neuralgie, diabetische neuropathie, HIV neuropathie en voor nociplastische pijnsyndromen zoals complex regionaal pijnsyndroom (CRPS) type 1 en fibromyalgie.
Omdat voor kinderen er een dosis aanpassing nodig is van de medicatie is de werkgroep
van mening dat deze medicatie alleen voorgeschreven kan worden door artsen die zich bekwaam en bevoegd voelen.
Behandeling van neuropathische pijn, gebaseerd op de richtlijn voor volwassenen
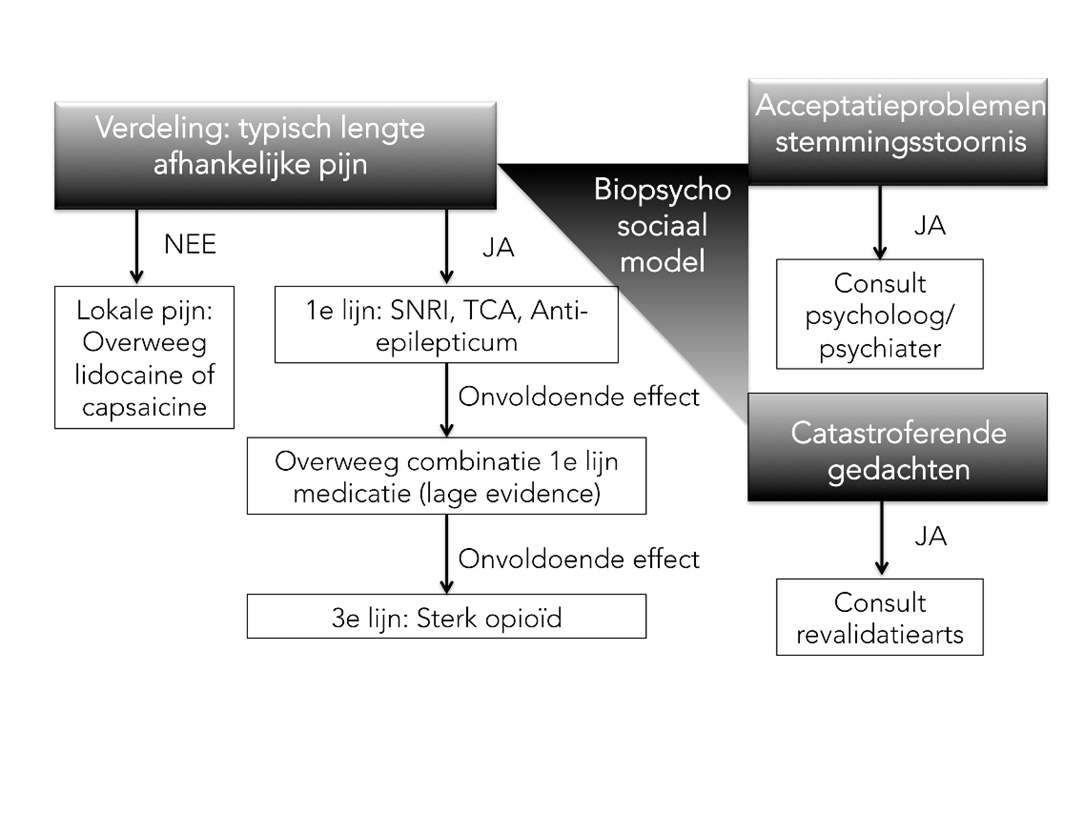
Voor het behandelen van chronische neuropathische pijn wordt uitgegaan van het biopsychosociale model (zie figuur 1) en wordt gewerkt volgens de zorgstandaard chronische pijn (integrale, multidisciplinaire aanpak volgens stepped care principe) (Zorgstandaard chronische pijn 2017). Momenteel is de zorgstandaard chronische pijn bij kinderen ook in ontwikkeling. Na het stellen van de diagnose en voor het starten van de behandeling is het essentieel om te werken aan het verwachtingsmanagement samen met de patiënt (tools hiervoor worden verderop in het document besproken). Voor meer informatie: https://www.ntvg.nl/system/files/publications/2004125350001a.pdf.
Figuur 1. Behandeling volgens het biopsychosociale model
(Bron: Zorgstandaard chronische pijn, 2017).
Afkortingen: SNRI: serotonine-noradrenalin reuptake inhibitors; TCA: tricyclische antidepressiva
Naast lichamelijke factoren kunnen ook psychologische, socio-economische en culturele factoren de pijnbeleving en het voortbestaan van de pijn beïnvloeden. Om de behandeling voor de individuele patiënt te optimaliseren is een multidisciplinaire benadering conform het bio-psychosociale model noodzakelijk (Abdulla, 2013).
Medicamenteuze behandeling
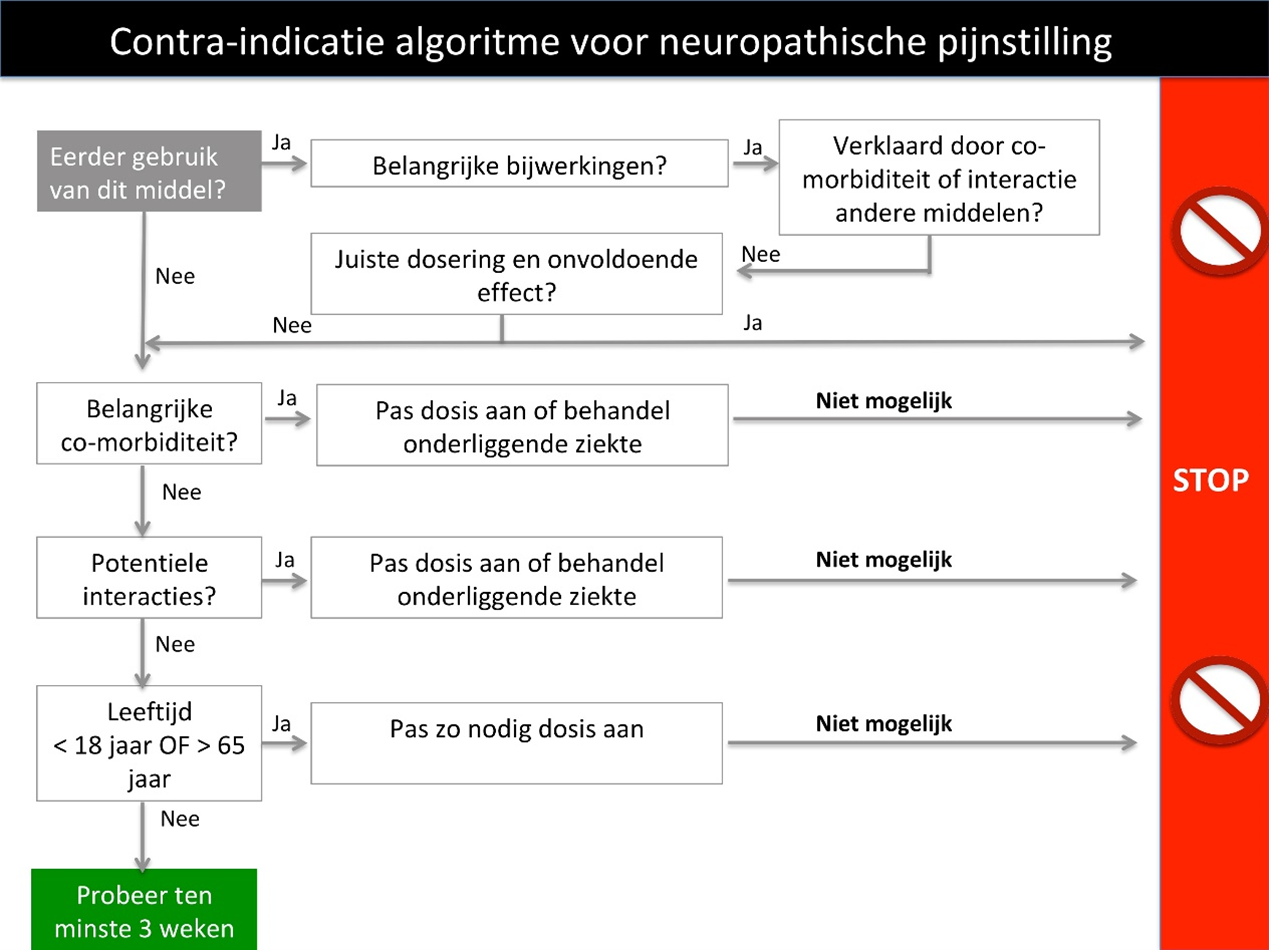
Het effect van medicamenteuze behandeling is beperkt: minder dan 50% van de patiënten zal maximaal 50% pijnvermindering ervaren (Attal, 2010; Finnerup, 2015). Voor de medicamenteuze behandeling van neuropathische pijn zijn er drie typen middelen beschikbaar: antidepressiva (serotonine-noradrenalin reuptake inhibitors (SNRIs) en tricyclische antidepressiva (TCAs)), anti-epileptica (gabapentine en pregabaline) en opioïden. Het effect van de meeste middelen kan pas goed na enkele weken worden beoordeeld. De behandeling kan men pas als niet-effectief beschouwen indien het middel meerdere malen is opgehoogd en voldoende lang is geprobeerd in adequate dosering (minimaal 3 weken). Bedenk dat in de opbouwfase de bijwerkingen op de voorgrond staan en het effect nog beperkt is.
Eerstelijnmiddelen: antidepressiva of anti-epileptica
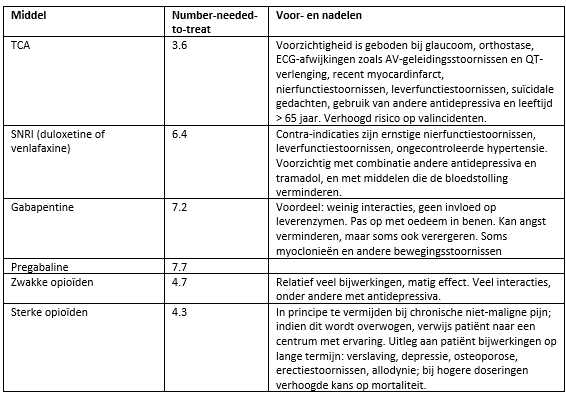
De eerstelijnkeuzes zijn antidepressiva (TCA of SNRI) of anti-epileptica (gabapentine of pregabaline). Welk middel er als eerste middel gestart wordt is met name afhankelijk van de mogelijke interacties en bijwerkingen (zie figuur 2). Voorts kan de number-needed-to-treat meegenomen worden in de overweging (Finnerup, 2015; zie tabel 1). Start de behandeling met een lage dosering, en bouw de dosis geleidelijk op, op geleide van het effect en de bijwerkingen.
Indien dit onvoldoende is, kan worden gekozen voor een combinatie van middelen (figuur 1).
De eerstelijns medicamenteuze behandeling kan door de kinderartsen, kinderneurologen, kinderneurochirurgen, kinderrevalidatieartsen en kinderpijnspecialisten worden opgestart. Als de huisarts de medicamenteuze behandeling op zich neemt, wordt wel geadviseerd dat de adviserende medisch specialist een behandelplan meegeeft voor de huisarts.
Tweedelijn: combinatie van middelen
Indien de eerstelijnsbehandeling onvoldoende is, dient patiënt te worden verwezen naar een kinderpijncentrum.
Derdelijn: opioïden
Indien de antidepressiva en anti-epileptica niet toereikend zijn, kan overwogen worden om te starten met langwerkende opioïden. Gezien de problemen op langere termijn (gewenning, morbiditeit en mortaliteit) wordt geadviseerd om dit alleen in gespecialiseerde kinderpijncentra voor te schrijven en continu bewust te zijn van de mogelijke (ernstige) nadelen (Labianca, 2012; Christie, 2008; Chou, 2015). Kortwerkende opioïden dienen te worden vermeden en patiënten moeten door de voorschrijver opgevolgd worden zolang ze opioïden gebruiken.
Een dosisequivalent vanaf 90 mg morfine is geassocieerd met verhoogde kans op mortaliteit (Garg, 2017) en dient daarom voor de indicatie chronisch neuropathische pijn niet overschreden te worden (dit staat gelijk aan een equivalent van bijvoorbeeld fentanylpleister 50 microgram per uur en oxycodon 2dd 40mg). Wanneer een patiënt geen effect heeft van een lage dosering opioïden, dan is de verwachting dat deze ook geen effect heeft van hogere doseringen.
Lokale behandeling
Indien lokale pijn overweeg TENS/capsaïcine/lidocainezalf.
De evidence hiervoor is laag, echter de kans op complicaties/bijwerkingen is ook laag.
Tabel 1. NNT (50% pijnreductie) neuropathische pijnstilling (Finnerup, 2015)
Behandelprincipes
- Start met lage doseringen.
- Streef een gemiddelde pijnscore (NRS) <4 na en vraag of de pijn te accepteren is. Volledig pijnvrij is meestal niet haalbaar (voorlichting).
- Vervolg de patiënt met behulp van de NRS-score, bijvoorbeeld 1 keer per 2-3 weken, waarbij medicatie stapsgewijs getitreerd of gewijzigd wordt.
- Vraag structureel naar bijwerkingen.
De behandeling kan men als niet-effectief beschouwen indien het middel meerdere malen is opgehoogd, en voldoende lang is geprobeerd in adequate dosering (minimaal 3 weken).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De eerstelijnkeuzes zijn antidepressiva (TCA of SNRI) of anti-epileptica (gabapentine of pregabaline). Welk middel er als eerste middel gestart wordt is met name afhankelijk van de mogelijke interacties en bijwerkingen. Voorts kan de number-needed-to-treat meegenomen worden in de overweging. Start de behandeling met een lage dosering, en bouw de dosis geleidelijk op, op geleide van het effect en de bijwerkingen.
Kosten (middelenbeslag)
Gelet op de lage prijs van de antineuropatische pijnmedicatie zijn de kosten niet relevant.
Aanvaardbaarheid, haalbaarheid en implementatie
Antineuropatische pijnmedicatie heeft geen invloed op de gezondheidsgelijkheid. In Nederland heeft iedereen in principe dezelfde toegang tot medische hulp.
Er zijn geen voorwaarden aan de haalbaarheid. Voor implementatie zouden geen specifieke investeringen of kennis nodig zijn.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De werkgroep is van mening dat voor neuropatische pijn bij kinderen en adolescenten gebruik kan worden gemaakt van de aanbevelingen uit de module “Pijn- en revalidatiebehandeling bij polyneuropathie” van de richtlijn “Polyneuropathie” voor volwassenen.
Onderbouwing
Achtergrond
Pain is common in children and adolescents. Neuropathic pain is defined by the International Association for the Study of Pain (IASP) as ‘pain caused by a lesion or disease of the somatosensory nervous system’. The most effective treatment of neuropathic pain in children and adolescents is unclear. For neuropathic pain, treatment in adults consists of antidepressants, antiepileptics, selective norepinephrine reuptake inhibitors (SNRI), opioids (including methadone and tramadol/tapentadol), clonidine, and lidocaine transdermally.
Conclusies / Summary of Findings
Pain
|
Very low GRADE |
The evidence is very uncertain about the effect gabapentin compared with placebo on pain in children with neuropathic pain between 1 and 21 years of age.
Source: Anghelescu, 2020 |
Functioning
|
No GRADE |
No evidence was found regarding the effect of pharmacological treatment on functioning when compared with placebo or other pharmacological treatment in children with neuropathic pain. |
Stress/distress
|
No GRADE |
No evidence was found regarding the effect of pharmacological treatment on stress/distress when compared with placebo or other pharmacological treatment in children with neuropathic pain. |
Anxiety
|
No GRADE |
No evidence was found regarding the effect of pharmacological treatment on anxiety when compared with placebo or other pharmacological treatment in children with neuropathic pain. |
Quality of life
|
No GRADE |
No evidence was found regarding the effect of pharmacological treatment on quality of life when compared with placebo or other pharmacological treatment in children with neuropathic pain. |
Samenvatting literatuur
Description of studies
Anghelescu (2020) performed a randomized double-blinded placebo-controlled phase II trial to determine the effect of gabapentin in children with acute lymphoblastic leukemia with neuropathic pain related to vincristine use. Children aged ≥1 year of age were randomized to either receive gabapentin (20 mg/kg/day divided into three doses) or look-alike placebo treatment. A total of 25 children received gabapentin and 25 received placebo. In the gabapentin group, 47% was male and in the placebo group 53%. Most patients were >7 years of age in both groups. Relevant outcome measures were pain score ‘right now’ and pain scores previous 24 hours, on a scale from 0-10.
Results
Pain
Anghelescu (2020) reported that no statistically significant difference was found in average pain score between gabapentin compared to placebo after 21 days ‘right now’ (MD=0.65; 95%CI -0.89 to -0.41) and in the previous 24 hours (MD=0.85; 95%CI -1.15 to -0.55).
Functioning
None of the included studies reported on the outcome functioning.
Stress/distress
None of the included studies reported on the outcome stress/distress.
Anxiety
None of the included studies reported on the outcome anxiety.
Quality of life
None of the included studies reported on the outcome quality of life.
Level of evidence of the literature
Pain
The level of evidence regarding the outcome measure pain was downgraded by three levels because of study limitations (risk of bias) and number of included patients (imprecision) (2 levels) to Very low GRADE.
Functioning
The level of evidence regarding the outcome measure functioning was not assessed due to the lack of studies.
Stress/distress
The level of evidence regarding the outcome measure stress/distress was not assessed due to the lack of studies.
Anxiety
The level of evidence regarding the outcome measure anxiety was not assessed due to the lack of studies.
Quality of life
The level of evidence regarding the outcome measure quality of life was not assessed due to the lack of studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of pharmacological pain control compared to placebo and other pain medications in children with neuropathic pain?
| P: | Children (<18 years) with neuropathic pain |
| I: | Pharmacological pain treatment |
| C: | Placebo or other pharmacological pain treatment |
| O: | Pain, functioning, stress/distress, anxiety, quality of life |
Relevant outcome measures
The guideline development group considered pain, functioning, and stress/distress as critical outcome measures for decision making; and anxiety and quality of life as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
For dichotomic outcome measures, the working group used the GRADE default limits as limits for clinical decision making, which are defined as a risk ratio (RR) of >1.25 and <0.8 as clinically relevant. For continuous outcome measures, the working group defined a difference of 0.5 standard deviation (SD) as clinically relevant. When standardized mean difference (SMD) was used, 0.2 represented a small effect size, 0.5 a medium effect size and 0.8 a large effect size, based on Cohen, 1988.
Since the objective was to determine whether pharmacological treatment is more effective than placebo or other pharmacological treatment, the results were compared against the threshold of beneficial effect (figure 1).
Figure 1. Visual representation of the values of clinical decision making for any beneficial effect
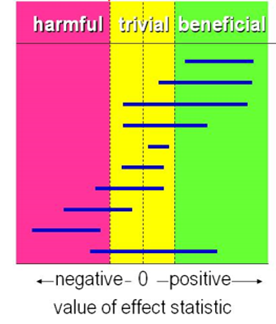
(retrieved from Batterham AM, Hopkons WG (2005). Making meaningful inferences about magnitudes. Sportscience 9, 6-13)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until October 2nd, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 603 hits. Studies were selected based on the following criteria: (systematic reviews of) randomized controlled trials investigating the effect of any pharmacological pain treatment in children with neuropathic pain, compared to placebo or other pharmacological pain treatment. Ten studies were initially selected based on title and abstract screening. After reading the full text, nine studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One study was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- 1 - Anghelescu DL, Tesney JM, Jeha S, Wright BB, Trujillo L, Sandlund JT, Pauley J, Cheng C, Pei D, Pui CH. Prospective randomized trial of interventions for vincristine-related neuropathic pain. Pediatr Blood Cancer. 2020 Sep;67(9):e28539. doi: 10.1002/pbc.28539. Epub 2020 Jul 2. PMID: 32618122; PMCID: PMC8149969.
- 2 - Batterham AM, Hopkins WG. Making meaningful inferences about magnitudes. Int J Sports Physiol Perform. 2006 Mar;1(1):50-7. PMID: 19114737.
- 3 - Brouwer, B. A., de Greef, B. T., Hoeijmakers, J. G., Geerts, M., van Kleef, M., Merkies, I. S., & Faber, C. G. (2015). Neuropathic Pain due to Small Fiber Neuropathy in Aging: Current Management and Future Prospects. Drugs & aging, 32(8), 611-621. https://doi.org/10.1007/s40266-015-0283-8.
- 4 - Cohen J. Statistical Power Analysis for the Behavioral Sciences. 2nd ed. New York: Routledge; 1988. 567 p.
Evidence tabellen
Evidence table for intervention studies
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Anghelescu, 2020 |
Type of study: Randomized, double-blind, placebo-controlled, phase II trial
Setting and country: Single centre study, US
Funding and conflicts of interest: The authors have no financial relationships relevant to this article to disclose. The authors have no conflicts of interest relevant to this article to disclose. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 25 Control: 26
Important prognostic factors: Sex: I: 47% M C: 53% M
Groups comparable at baseline? Yes
|
Participants randomized to the active treatment arm will receive gabapentin 20mg/kg/day PO divided into 3 doses and rounded to the nearest 100 mg for capsules and 10 mg for liquid preparation.
|
Participants randomized to the placebo treatment arm will receive look-alike capsules or liquid in a respective capsule size or liquid measure equivalent to the active treatment arm, but which contain no active treatment.
|
Length of follow-up: 21 days
Excluded after randomization: Intervention: N (%): 0
Control: N (%): 2 (7.8%) Reasons: not described
Loss-to-follow-up: Intervention: N (%): 3 (12%)
Control: N (%): 1 (3.8%)
Reason (not specified intervention/control): two parental/patient request, two critical illness unrelated to the study
|
Pain Collected on face-to-face interaction and telephone follow-up, by a scale from 0-10 Pain score ‘right now’ (mean (95%CI): I: 1.41 (1.22 – 1.60) C: 0.76 (0.63 – 0.90) P = 0.04 (from longitudinal model), NS
Pain score previous 24 hours (mean (95%CI): I: 2.58 (2.37 – 2.81) C: 1.73 (1.54 – 1.93) P = 0.06 (from longitudinal model), NS |
Registered: NCT01506453
Outcomes on opioid use not reported here. |
Risk of bias table
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
|
Was the allocation adequately concealed?
|
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? |
Was loss to follow-up (missing outcome data) infrequent?
|
Are reports of the study free of selective outcome reporting?
|
Was the study apparently free of other problems that could put it at a risk of bias?
|
Overall risk of bias If applicable/necessary, per outcome measure
|
|
Anghelescu, 2020 |
Definitely yes;
Reason: Randomization was performed by a research pharmacist using a randomization program developed by our institution’s Department of Biostatistics, with stratification by three age ranges for which distinct pain assessment tools are applied (1–3, 4–7, >7 years) and by two categories of the baseline pain score (<5, ≥5, on pain scales of 1 to 10). For each subject, a pre-treatment, baseline pain score was obtained and used in the stratified randomization. |
No information;
Reason: No information provided about randomization concealment. |
Definitely yes
Reason: Triple (Participant, Care Provider, Investigator) blinding. |
Probably yes
Reason: Loss to follow-up was infrequent and evenly distributed in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported. |
Definitely yes;
Reason: No other problems noted |
Some concerns |
Table of excluded studies
|
Author, year |
Title |
Reason for exclusion |
|
Friedrichsdorf, 2013 |
Management of neuropathic pain in children with cancer |
Wrong study design: non systematic review |
|
Stock, 2021 |
Use of Gabapentin in Management of Postoperative Pain after Crosslinking |
No separate analysis performed for children |
|
Cooper, 2017 |
Antidepressants for chronic non-cancer pain in children and adolescents |
Review includes studies in abdominal pain and one study in neuropathic pain (Brown 2016), but this study is already included in our search |
|
Windsor, 2019 |
The Use of Opioids for Treatment of Pediatric Neuropathic Pain: A Literature Review |
Wrong study design: non systematic review |
|
Lee, 2021 |
Temporomandibular disorder treatment algorithm for otolaryngologists |
Wrong P: no neuropathic pain |
|
Wong, 2017 |
Medical cannabinoids in children and adolescents: A systematic review |
One study included in neuropathic pain, but this is published in 2003, before our search date |
|
Cooper, 2017 |
Antiepileptic drugs for chronic non-cancer pain in children and adolescents |
Review includes one study in neuropathic pain (Brown 2016), but this study is already included in our search |
|
Brown, 2016 |
A randomized controlled trial of amitriptyline versus gabapentin for complex regional pain syndrome type I and neuropathic pain in children |
Results for CRPS I and neuropathic pain not reported separately |
|
Puri, 2021 |
Gabapentin for acute pain in sickle cell disease: A randomized double-blinded placebo-controlled phase II clinical trial |
Wrong P: children with acute pain crises with sickle cell disease (no neuropathic pain) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-03-2025
Beoordeeld op geldigheid : 21-02-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met pijn.
Kernwerkgroep
- Drs. M.A. (Maarten) Mensink, kinderanesthesioloog en pijnarts, werkzaam in het Prinses Máxima Centrum voor Kinderoncologie te Utrecht, NVA, voorzitter
- Drs. J.F. (Joanne) Goorhuis, algemeen kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Dr. T. (Tessa) Sieswerda, kinderarts, werkzaam in het Amsterdam UMC te Amsterdam, NVK
- Drs. M.S. (Sukru) Genco, algemeen kinderarts, werkzaam in het OLVG te Amsterdam, NVK
- Dr. S.H. (Steven) Renes, anesthesioloog-pijnspecialist, werkzaam in het Radboud UMC te Nijmegen, NVA
- Dr. P. (Petra) Honig-Mazer, psychotherapeut, werkzaam in het Erasmus MC Sophia te Rotterdam, PAZ/LVMP
- Drs. M. (Marjorie) de Neef, kinder-IC verpleegkundige, werkzaam in het Amsterdam UMC, V&VN
- E.C. (Esen) Doganer, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis
Werkgroep
- Drs. L.A.M. (Lonneke) Aarts, algemeen kinderarts, werkzaam in het RadboudUMC Amalia kinderziekenhuis te Nijmegen, NVK
- Prof. dr. W.J.E. (Wim) Tissing, kinderoncoloog, werkzaam in het UMCG te Groningen en Prinses Máxima Centrum te Utrecht, NVK
- Drs. P. (Petra) Hissink-Muller, kinderreumatoloog, werkzaam in het Erasmus MC Sophia te Rotterdam
- Dr. A.M. (Arine) Vlieger, algemeen kinderarts, werkzaam in het St. Antonius Ziekenhuis te Utrecht, NVK
- Dr. G.E. (Gerbrich) van den Bosch, kinderarts-neonatoloog, werkzaam in het Erasmus MC Sophia te Rotterdam, NVK
- Drs. K. (Karina) Elangovan, kinderanesthesioloog, werkzaam in het Erasmus MC Sophia te Rotterdam, NVA
- Dr. C.M.G. (Claudia) Keyzer – Dekker, kinderchirurg, werkzaam in het Erasmus MC Sophia te Rotterdam, NVvH
- A.P. (Annette) van der Kaa, kinderfysiotherapeut, werkzaam in het Erasumc MC Sophia te Rotterdam, NVFK en KNGF
- Drs. A. H. (Agnes) Dommerholt, klinisch psycholoog, werkzaam in het OLVG te Amsterdam, NIP/LVMP (vanaf 1-1-2023)
Klankbordgroep
- Drs. J. (Judig) Blaauw, kinderrevalidatiearts, VRA
- Dr. H. (Hanneke) Bruijnzeel, AIOS, werkzaam in het UMC Utrecht te Utrecht, NVKNO
- Dr. A.M.J.W. (Anne-Marie) Scheepers, ziekenhuisapotheker, werkzaam in het MUMC te Maastricht, NVZA
- Dr. S.A. (Sylvia) Obermann-Borst, ervaringsdeskundige ouder & huisarts-epidemioloog, Care4Neo (voorheen Vereniging van Ouders van Couveusekinderen - VOC)
- Dr. I.H. (Ilse) Zaal-Schuller, arts voor verstandelijk gehandicapten/kaderarts palliatieve zorg i.o., werkzaam bij Prinsenstichting Purmerend/ AmsterdamUMC locatie AMC, NVAVG
- Dr. E. (Eva) Schaffrath, anesthesioloog, werkzaam in het Maastricht UMC te Maastricht, PROSA Kenniscentrum
- M. (Mirjam) Jansen op de Haar, HME-MO Vereniging Nederland
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst – Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. C. (Cécile) Overman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. D.A.M. (Danique) Middelhuis, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Liza) van Mun, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van (kern)werkgroepleden en klankbordgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Betrokkenen |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Werkgroep |
||||
|
Aarts |
Algemeen kinderarts in het Amalia kinderziekenhuissinds november 2017 |
Interne functies onbetaald: 1. voorzitter Pijn werkgroep Amalia kinderziekenhuis. 2. Verbonden aan werkgroep procedurele sedatie bij kinderen. 3. Implementatie VR in Amalia. |
Onderzoek naar effect comfort talk technieken; maar eenmalige subsidie gekregen voor uitvoer. Geen extern belang qua uitkomst. |
Geen actie |
|
Bosch van den |
Kinderarts-neonatoloog |
NALS (Newborn Advanced Life Support) instructeur SSHK te Riel (reanimatietraining, alleen onkostenvergoeding). Wetenschapelijk onderzoeker Erasmus MC-Sophia (onbetaald, betaald voor klinische werkzaamheden als neonatoloog). O.a. begeleider 3 PhD studenten m.b.t. neonatale pin en stress |
Vriendenloterij en De Stichting Vrienden van het Sophia - HIPPO studie - Landelijke studie naar de hoeveelheid en impact van neonatale en ouderlijke stress op de NICU, projectleider. De Stichting Vrienden van het Sophia – Pijn bij NEC project (lange termijn follow up van patienten met NEC o.a. testen van pijngevoeligheid, projectleider. Horizon 2020 - ALBINO study (RCT naar Allopurinol bij neonaten met asfyxie, Europese multicenter studie waarbij Rotterdam meedoet als 1 van deze centra) – Nee geen projectleider, alleen lokale pi van Rotterdam (maar niet inhoudelijk betrokken bij de opzet en dergelijke van de studie) |
Geen actie
|
|
Dommerholt |
Klinisch psycholoog KJ, vakgroep kindergeneeskunde OLVG |
Praktijk Dommerholt, praktijk voor kinder- en jeugdpsychotherapie, supervisie en doceren. (momenteel inactief). Lid vakgroep en medische staf, uitvoeren van psychologische diagnostiek en behandeling van kinderen en hun systeem, opleider. |
Geen |
Geen actie |
|
Elangovan |
Universitair medisch specialist Anesthesioloog-pijnspecialist; ErasmusMC |
Geen |
Geen |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam |
- Eigenaar Genco Med. Beheer B.V. |
Directe belangen bij eigen B.V. maar geen relatie met de bezigheden van de werkgroep. Bijvangst van het project kan zijn: nieuwe kennis en ervaring om binnen onze organisatie te delen. |
Geen actie |
|
Goorhuis |
Algemeen kinderarts - acute kindergeneeskunde |
Geen |
Geen |
Geen actie |
|
Hissink-Muller |
Kinderreumatoloog, Erasmus MC Sophia |
Geen |
Ja, CHAMP studie en UCAN CAN DU. 1. NWO, Goed Geneesmiddelen Gebruik. UCAN CAN DU, CIHR, ZONMW, ReumaNederland. 2. CHAMP studie, mono of polytherapie bij non systemic JIA patienten. Personalised medicine bij JIA. |
Geen actie |
|
Kaa, van der |
Kinderfysiotherapeut |
-Docent Master Kinderfysiotherapie bij Breederode Hogeschool - Universitair docent -Kinderfysiotherapeut 1e lijn (Fysio van der Linden) |
Geen |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg Sophia Kinderziekenhuis ErasmusMC te Rotterdam |
APLS instructeur SSHK Riel, dagvergoeding |
Geen |
Geen actie |
|
Mensink* |
kinderanesthesioloog - pijnarts - Prinses Máxima Centrum voor kinderoncologie |
Bestuurslid sectie Pijn&palliatieve geneeskunde NVA - onbetaalde functie |
Geen |
Geen actie |
|
Neef, de |
Verpleegkundig onderzoeker, Kinder IC, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Honig-Mazer |
Erasmus MC - Sophia Kinderziekenhuis Afdeling Kinder- en Jeugdpsychiatrie/psychologie Unit Psychosociale Zorg Psychotherapeut BIG |
Kleine eigen praktijk: Praktijk voor Psychotherapie Honig-Mazer, betaald |
Geen |
Geen actie |
|
Renes |
Anesthesioloog-pijnspecialist Radboudumc |
Kwaliteitsvisitaties Nederlandse Vereniging Anesthesiologie, vacatiegeld |
Geen |
Geen actie |
|
Sieswerda |
Kinderarts sociale pediatrie Amsterdam UMC locatie AMC |
Werkgroeplid NVK commissie richtlijnen |
2023 - heden. Initiatiefnemeer gekoelde vs niet-gekoelde sondes, met funding vanuit Janivo stichting. 2021 – heden. Initiatiefnemer studie ‘Focus on comfort - the effect of language on pain perception in pediatric patients.’ met funding vanuit ESPR. Publicatie verwacht Q4 2023 2021 – heden. Initiatiefnemer studie ‘The ARCADE study, Anxiety Reduction in Children Analyzing Data from EEG.’ met funding vanuit WAR. Publicatie verwacht Q2 2024 |
Geen actie |
|
Simons |
Kinderarts - neonatoloog - klinisch farmacoloog (Universitair Medische Specialist) |
Lid geneesmiddelencommissie Erasmus MC (onbetaald) |
Geen |
Geen actie |
|
Tissing |
Kinderoncoloog, Hoogleraar supportive care in de kinderoncologie. 0.6 fte Prinses Maxima Centrum, 0,4 fte UMCG |
PI van onderzoek naar app over invloed van laagdrempelig contact op pijn bij patiënten met kanker. |
Geen |
Geen actie |
|
Uitzinger |
Junior Project manager en beleidsmedewerker Stichting kind en ziekenhuis |
Geen |
Geen |
Geen actie |
|
Vlieger |
Kinderarts St Antonius ziekenhuis Nieuwegein |
1. Betaald les geven via Cure en Care op het gebied van hypnose bij kinderen. 2. Mede-eigenaar van Skills4Comfort, een onderwijsbedrijf, dat tegen betaling trainingen verzorgt in ziekenhuizen op het gebied van non-farmacologische technieken om het comfort van patienten te verbeteren, mn tijdens pijnlijke procedures. 3. Voorzitter Stichting Hypnose bij Kinderen. Onbetaald. 4. Tot 2021: bestuurslid en mede-oprichter van de stichting Procedureel comfort bij Kinderen (Prosa). |
Enig financieel belang door mede-eigenaarschap van Skills4comfort dat onderwijs verzorgt op hte gebied van non-farmacologische pijn bestrijding. |
Uitsluiten van besluitvorming voor modules over non-farmacologische pijnbestrijding. Mag wel meelezen. |
*Voorzitter
|
Klankbordgroep |
||||
|
Blaauw |
Kinderrevalidatiearts |
Geen |
Geen |
Geen actie |
|
Bruijnzeel |
Arts-assistent Keel-, Neus- en Oorheelkunde, UMC Utrecht |
Kerngroep Pediatrie (KNO vereniging) - onbetaald |
Geen |
Geen actie |
|
Haar, van der |
Freelance consultant Moonshot |
Bestuurslid HME-MO Vereniging Nederland |
Geen |
Geen actie |
|
Scheepers |
ziekenhuisapotheker, Maastricht UMC+ |
Geen |
Geen |
Geen actie |
|
Obermann-Borst |
Coördinator Wetenschap bij Care4Neo 10 u per week |
Coördinator Wetenschap bij Care4Neo 75% betaald/25% vrijwillig verzorgen van bijdrage vanuit patientenperspectief aan wetenschap, richtlijnen en kwaliteit van zorg namens de patientenvereniging voor ouders van en voor kinderen die te vroeg, te klein en/of ziek geboren zijn. |
Geen |
Geen actie |
|
Zaal Schuller |
Arts voor verstandelijk gehandicapten |
Arts voor verstandelijk gehandicapten, betaald. |
Geen |
Geen actie |
|
Schaffrath |
Kinderanesthesioloog MUMC |
Faculty member PROSA (tegen dagvergoeding) |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Stichting Kind en Ziekenhuis in de kernwerkgroep en Care4Neo en HME-MO Vereniging Nederland in de klankbordgroep. Op verschillende momenten is input gevraagd tijdens een invitational conference en bij het opstellen van het raamwerk. Het verslag van de invitational conference [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Farmacologische pijnbestrijding bij neuropathische pijn |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Voorafgaand aan de voorbereidende fase is een invitational conference georganiseerd over herkenning en behandeling van pijn binnen de kindzorg. Een verslag hiervan is opgenomen onder aanverwante producten. Daarnaast werd tijdens de voorbereidende fase van de richtlijn een schriftelijke knelpunteninventarisatie gehouden. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Embase.com
|
No. |
Query |
Results |
|
#1 |
'neuropathic pain'/exp OR 'neuralgia'/exp OR ((('neuro pathic' OR neurogenic OR neuropathic OR nerve*) NEAR/3 (discomfort OR pain*)):ti,ab,kw) OR neuralgi*:ti,ab,kw |
153535 |
|
#2 |
'paracetamol'/exp OR paracetamol:ti,ab,kw OR acetaminophen*:ti,ab,kw |
119272 |
|
#3 |
'nonsteroid antiinflammatory agent'/exp OR nsaid*:ti,ab,kw OR ((('non steroid*' OR nonsteroid*) NEAR/2 ('anti inflam*' OR 'anti rheumat*' OR antirheumat*) NEAR/2 (agent* OR drug*)):ti,ab,kw) OR aceclofenac:ti,ab,kw OR dexketoprofen:ti,ab,kw OR diclofenac:ti,ab,kw OR fenylbutazon:ti,ab,kw OR flurbiprofen:ti,ab,kw OR ibuprofen:ti,ab,kw OR indometacine:ti,ab,kw OR ketoprofen:ti,ab,kw OR meloxicam:ti,ab,kw OR metamizol:ti,ab,kw OR nabumeton:ti,ab,kw OR naproxen:ti,ab,kw OR piroxicam:ti,ab,kw OR celecoxib:ti,ab,kw OR etoricoxib:ti,ab,kw OR parecoxib:ti,ab,kw |
1500646 |
|
#4 |
'anticonvulsive agent'/exp OR gabapentin:ti,ab,kw OR pregabalin*:ti,ab,kw OR carbamezapin*:ti,ab,kw OR oxcarbazepin*:ti,ab,kw OR anticonvuls*:ti,ab,kw |
518693 |
|
#5 |
'antidepressant agent'/exp OR 'antidepress*':ti,ab,kw OR amitriptylin*:ti,ab,kw OR nortriptylin*:ti,ab,kw |
612034 |
|
#6 |
'serotonin noradrenalin reuptake inhibitor'/exp OR duloxetin*:ti,ab,kw OR venlafaxin*:ti,ab,kw OR 'serotonin noradrenalin reuptake inhibitor*':ti,ab,kw OR snri*:ti,ab,kw |
220549 |
|
#7 |
'opiate agonist'/exp OR morphin*:ti,ab,kw OR buprenorphin*:ti,ab,kw OR codein*:ti,ab,kw OR methadon*:ti,ab,kw OR nalbuphin*:ti,ab,kw OR oxycodon*:ti,ab,kw OR pethidin*:ti,ab,kw OR hydromorphon*:ti,ab,kw OR fentanyl*:ti,ab,kw OR tramadol:ti,ab,kw OR tapentadol:ti,ab,kw |
521654 |
|
#8 |
'clonidine'/exp OR clonidin*:ti,ab,kw |
46791 |
|
#9 |
'lidocaine'/exp OR lidocain*:ti,ab,kw |
95053 |
|
#10 |
'cannabis'/exp OR cannabis:ti,ab,kw OR marihuana:ti,ab,kw OR marijuana:ti,ab,kw |
68650 |
|
#11 |
#2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9 OR #10 |
2866112 |
|
#12 |
#1 AND #11 |
25604 |
|
#13 |
#12 AND [2005-2024]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
13809 |
|
#14 |
'adolescent'/exp OR 'baby'/exp OR 'boy'/exp OR 'child'/exp OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR 'childhood disease'/exp OR infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab |
5823930 |
|
#15 |
#13 AND #14 |
1002 |
|
#16 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#17 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3302394 |
|
#18 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#19 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14456092 |
|
#20 |
#15 AND #16 SR |
188 |
|
#21 |
#15 AND #17 NOT #20 Clinical trials |
422 |
|
#22 |
#15 AND (#18 OR #19) NOT #20 NOT #21 OBS |
535 |
|
#23 |
#20 OR #21 OR #22 |
1145 |
|
#24 |
'pharmacological interventions for chronic pain in children: an overview of systematic reviews' AND 2019 |
1 |
|
#25 |
'antidepressants for chronic non-cancer pain in children and adolescents' AND 2017 |
1 |
|
#26 |
'antiepileptic drugs for chronic non-cancer pain in children and adolescents' AND 2017 |
1 |
|
#27 |
'opioids for chronic non-cancer pain in children and adolescents' AND 2017 |
1 |
|
#28 |
'non-steroidal anti-inflammatory drugs (nsaids) for chronic non-cancer pain in children and adolescents' AND 2017 |
1 |
|
#29 |
'the use of opioids for treatment of pediatric neuropathic pain: a literature review' AND 2019 |
1 |
|
#30 |
#24 OR #25 OR #26 OR #27 OR #28 OR #29 |
6 |
|
#31 |
#23 AND #30 5 sleutelartikelen gevonden van de 6 |
5 |
Ovid/Medline
|
# |
Searches |
Results |
|
1 |
exp Neuralgia/ or (("neuro pathic" or neurogenic or neuropathic or nerve*) adj3 (discomfort or pain*)).ti,ab,kf. or neuralgi*.ti,ab,kf. |
56496 |
|
2 |
exp Acetaminophen/ or (acetaminophen or paracetamol).ti,ab,kf. |
33981 |
|
3 |
exp Anti-Inflammatory Agents, Non-Steroidal/ or nsaid*.ti,ab,kf. or ((non steroid* or nonsteroid*) adj2 (anti inflam* or anti rheumat* or antirheumat*) adj2 (agent* or drug*)).ti,ab,kf. or aceclofenac.ti,ab,kf. or dexketoprofen.ti,ab,kf. or diclofenac.ti,ab,kf. or fenylbutazon.ti,ab,kf. or flurbiprofen.ti,ab,kf. or ibuprofen.ti,ab,kf. or indometacine.ti,ab,kf. or ketoprofen.ti,ab,kf. or meloxicam.ti,ab,kf. or metamizol.ti,ab,kf. or nabumeton.ti,ab,kf. or naproxen.ti,ab,kf. or piroxicam.ti,ab,kf. or celecoxib.ti,ab,kf. or etoricoxib.ti,ab,kf. or parecoxib.ti,ab,kf. |
249829 |
|
4 |
exp Anticonvulsants/ or gabapentin*.ti,ab,kf. or pregabalin*.ti,ab,kf. or carbamezapin*.ti,ab,kf. or oxcarbazepin*.ti,ab,kf. |
159342 |
|
5 |
exp Antidepressive Agents/ or antidepress*.ti,ab,kf. or amitriptylin*.ti,ab,kf. or nortriptylin*.ti,ab,kf. |
193759 |
|
6 |
exp Selective Serotonin Reuptake Inhibitors/ or duloxetin*.ti,ab,kf. or venlafaxin*.ti,ab,kf. or "selective serotonin reuptake inhibitor*".ti,ab,kf. |
55785 |
|
7 |
exp Analgesics, Opioid/ or morphin*.ti,ab,kf. or buprenorphin*.ti,ab,kf. or codein*.ti,ab,kf. or methadon*.ti,ab,kf. or nalbuphin*.ti,ab,kf. or oxycodon*.ti,ab,kf. or pethidin*.ti,ab,kf. or hydromorphon*.ti,ab,kf. or fentanyl*.ti,ab,kf. or tramadol.ti,ab,kf. or tapentadol.ti,ab,kf. |
172077 |
|
8 |
exp Clonidine/ or clonidin*.ti,ab,kf. |
18901 |
|
9 |
exp Lidocaine/ or lidocaine.ti,ab,kf. |
35344 |
|
10 |
exp cannabis/ or (cannabis or marihuana or marijuana).ti,ab,kf. |
43398 |
|
11 |
2 or 3 or 4 or 5 or 6 or 7 or 8 or 9 or 10 |
856848 |
|
12 |
1 and 11 |
10775 |
|
13 |
limit 12 to yr="2015 -Current" |
4425 |
|
14 |
13 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
3283 |
|
15 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2942994 |
|
16 |
14 and 15 |
148 |
|
17 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
696683 |
|
18 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2638629 |
|
19 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4543698 |
|
20 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5521932 |
|
21 |
16 and 17 SR |
19 |
|
22 |
(16 and 18) not 21Clinical trials |
25 |
|
23 |
(16 and (19 or 20)) not 21 not 22 OBS |
33 |
|
24 |
21 or 22 or 23 |
77 |