Screening en diagnostiek PDNP
Uitgangsvraag
Wat is de optimale methode voor het screenen op, en vaststellen van neuropathische pijn bij volwassen personen met diabetes mellitus?
- Wat is de plaats van gestructureerde vragenlijsten bij het screenen op, en vaststellen van neuropathische pijn bij volwassen personen met diabetes mellitus?
- Wat is de plaats van anamnese en lichamelijk onderzoek (inclusief bedside testen) bij het stellen van de diagnose polyneuropathie bij volwassen personen met diabetes mellitus die positief screenen voor neuropathische pijn?
Aanbeveling
Bij personen met diabetes in het kader van de jaarlijkse controle, of tussentijds:
- Vraag de persoon of er sprake is van pijn aan de voeten en/of handen.
- Als er sprake is van pijn, verricht de DN4; een score van 4 of hoger betekent waarschijnlijk neuropathische pijn.
- Controleer op de aanwezigheid van alarmsymptomen die niet passen bij een geleidelijk progressieve sensibele of sensomotorische distale, symmetrische polyneuropathie of dunne vezel neuropathie: acuut begin, asymmetrie, een voornamelijk proximale aandoening, overwegend motorische klachten, of snelle progressie of veel pijn.
- Bespreek bij aanwezigheid van neuropathische pijn het mogelijke belang van goede diabetes regulatie en de mogelijkheid van symptomatische therapie.
Start bij stap 2 als een persoon met diabetes mellitus bij de jaarlijkse controle of tussentijds zelf aangeeft pijn te hebben aan de voeten en/of handen.
Nederlandse versie van DN4: www.neuropathie.nu/download/Vragenlijsten/DN4.pdf
Verwijs een persoon met diabetes mellitus met alarmsymptomen door naar een neuroloog voor nader onderzoek.
Overweeg bij pijnklachten en een DN4 score van minder dan 4 een andere oorzaak voor de pijn, bijvoorbeeld vasculair, arthrogeen, medicamenteus.
Overwegingen
De werkgroep heeft de toegevoegde waarde van het gebruik van gestructureerde vragenlijsten als hulpmiddel geëvalueerd bij het screenen op pijnlijke diabetische neuropathie bij volwassen personen met diabetes.
Geconstateerd kan worden dat de meeste gestructureerde vragenlijsten (waarbij soms ook gericht lichamelijk onderzoek onderdeel van het screeningsinstrument is) slecht onderzocht en gevalideerd zijn, zeker in de Nederlandse situatie. De enige goed onderzochte vragenlijst die ook in de Nederlandse vertaling geëvalueerd is met voldoende sensitiviteit (74%) en specificiteit (79%) voor de aan- of afwezigheid van neuropathische pijn is de DN4. De Nederlandse versie is niet specifiek onderzocht bij mensen met diabetes. De Italiaanse versie toont bij diabetespatiënten een sensitiviteit van 80 en een specificiteit van 92%. Nadeel is dat de reproduceerbaarheid in de diabetes populatie niet is onderzocht. De DN4 is in de originele taal (Frans) echter wel goed onderzocht bij patiënten met neuropathische pijn op reproduceerbaarheid, en betrouwbaar gebleken (Bouhassira, 2005). De DN4 bestaat uit een aantal gestandaardiseerde vragen, aangevuld met enkele delen van het lichamelijk onderzoek.
Vanuit het perspectief van de patiënt en van de professional lijkt de DN4 ook een aantrekkelijke keuze: het betreft een beperkt aantal redelijk eenduidige vragen die snel beantwoord kunnen worden. Er is een eenvoudig score-systeem waardoor snel een eindoordeel volgt. De test kan bij de jaarlijkse screening worden uitgevoerd, en worden vergeleken met de uitkomst van eerdere testen. De DN4 kan worden uitgevoerd door diabetesverpleegkundigen, praktijkondersteuners en medisch pedicures. Hiermee lijkt de DN4 ondanks de eerder aangegeven beperkingen de test van keuze bij de jaarlijkse algemene screening als bij patiënten die tussentijds onder de aandacht komen. Het uiteindelijke advies om de DN4 te gebruiken komt daarmee overeen met de NHG-Standaard Diabetes mellitus type 2 (derde herziening; NHG, 2013) en de NHG-Standaard Pijn (NHG, 2015). In de richtlijn polyneuropathie van 2005 van de NVN (NVN, 2005) wordt het gebruik van de DN4 niet genoemd, maar de meeste literatuur hierover is van recentere datum. De werkgroep is van mening dat bij pijn en een negatieve DN4 aan een andere oorzaak moet worden gedacht voor de pijn, bijvoorbeeld vasculair, arthrogeen of medicamenteus.
DN4-vragenlijst (Douleur Neuropathique)
De DN4-vragenlijst (Douleur Neuropathique) bestaat uit vier vragen en tien items die met Ja of Nee beantwoord worden. Bij vier of meer positieve antwoorden is (een bijdrage van) neuropathische pijn waarschijnlijk.
Tabel 1 DN4-screeningsvragenlijst
|
DN4 |
|
|
Heeft de pijn één of meerdere van de volgende kenmerken: |
|
|
Branderig |
꙱ Ja ꙱ Nee |
|
Pijnlijk koude gevoel |
꙱ Ja ꙱ Nee |
|
Elektrische schokken |
꙱ Ja ꙱ Nee |
|
Gaat de pijn gepaard met één of meerdere van de volgende symptomen in hetzelfde gebied? |
|
|
Tintelingen |
꙱ Ja ꙱ Nee |
|
Prikkelingen |
꙱ Ja ꙱ Nee |
|
Doofheid |
꙱ Ja ꙱ Nee |
|
Jeuk |
꙱ Ja ꙱ Nee |
|
Is er in het pijngebied t.o.v. een normaal aanvoelend gebied een verminderd gevoel bij: |
|
|
Aanraking |
꙱ Ja ꙱ Nee |
|
Prikken (cocktailprikker) |
꙱ Ja ꙱ Nee |
|
Wordt de pijn verergerd door: |
|
|
Wrijven |
꙱ Ja ꙱ Nee |
Indien een vraag met ‘ja’ wordt beantwoord, wordt 1 punt toegekend. Bij score ≥ 4 punten is neuropathische pijn waarschijnlijk.
Er zijn geen diagnostische accuratessestudies beschikbaar van screeningsinstrumenten voor diabetische polyneuropathie (aanvullende anamnese, lichamelijk onderzoek, eenvoudige bedside testen) waarin een betrouwbare referentietest werd gebruikt bij mensen met diabetes mellitus die positief screenen voor neuropathische pijn. Wel zijn er verschillende gestandaardiseerde anamnese-vragen, al dan niet in combinatie met lichamelijk onderzoek, en bedside testen die de diagnose polyneuropathie of dunne vezel neuropathie kunnen ondersteunen. Helaas is van deze onderzoeken de bewijskracht zeer laag, wanneer wordt getracht bovenstaande specifieke vraag te beantwoorden, tot maximaal laag, wanneer alleen het vaststellen van een polyneuropathie als vraag wordt genomen. Een aantal testen lijken dan een redelijk goede sensitiviteit te hebben, maar de specificiteit is vaak veel minder goed. Voor een screeningsinstrument kunnen dit op zich goede testkarakteristieken zijn, maar gezien de relatief hoge sensitiviteit en specificiteit die al wordt behaald met de DN4 voor het vaststellen van neuropathische pijn, is het zeer de vraag of extra testen wat zullen toevoegen, maar dit is niet formeel onderzocht.
Wanneer alleen het vaststellen van een polyneuropathie of een dunne vezel neuropathie het doel is bij mensen met diabetes mellitus, dan lijken een aantal testen in aanmerking te kunnen komen. Voor het vaststellen van een polyneuropathie kan voor de dikke vezel component de vibratieperceptie worden bepaald. Verschillende methodes zijn hiervoor beschikbaar. Het gebruik van een stemvork lijkt de meest eenvoudige methode. Een groot onderzoek bij mensen met diabetes mellitus toont dat een gegradeerde stemvork van 128 Hz een redelijke sensitiviteit en specificiteit heeft (Kästenbauer, 2004). In Nederland wordt echter bij andere polyneuropathieën steeds meer gebruik gemaakt van de 64 Hz gegradeerde Rydel-Seiffer stemvork (Martina, 1998). Hiervan zijn goede leeftijdsafhankelijke normaalwaardes beschikbaar, maar deze stemvork is alleen onderzocht in een gemengde polyneuropathie populatie, waarbij een deel met diabetes mellitus type 2. Hoewel niet formeel onderzocht, lijkt dit ook een relatief goedkope methode. Indien bij een patiënt met een PDNP een stoornis van dikke zenuwvezels aangetoond kan worden is separaat onderzoek naar dunne zenuwvezels niet meer nodig.
Indien een stoornis van dikke zenuwvezels niet aangetoond kan worden, lijkt de Neuropad (een teststrip die verkleurt als reactie op zweet, niet verkleuren duidt op sudomotore disfunctie en daarmee op neuropathie) als eenvoudige test een voldoende sensitiviteit te hebben voor het beoordelen van de dunne vezel component, echter de specificiteit lijkt lager. Daarnaast is er sprake van grote en onverklaarbare heterogeniteit in testkarakteristieken tussen individuele diagnostische accuratessestudies. Verder onderzoek is nodig voordat de neuropad kan worden aanbevolen. Er is geen kosteneffectiviteitsanalyse beschikbaar.
Hoewel het dus op grond van het beschikbare onderzoek lastig is de diagnose polyneuropathie geformaliseerd definitief te stellen, is het van belang dat het beeld past bij de meest voorkomende distale vooral sensibele polyneuropathie, met aan benen meer klachten dan aan armen. Bij een acuut begin, asymmetrie, een voornamelijk proximale aandoening, overwegend motorische klachten, of snelle progressie of veel pijn (alarmsymptomen) past het beeld hier dus niet bij, en is verwijzing naar een neuroloog voor aanvullend onderzoek noodzakelijk. Ook kan dit zinvol zijn als er behoefte is aan aanvullende therapieadviezen.
Onderbouwing
Achtergrond
In Nederland zijn er in 2015 naar schatting 930.000 mensen met gediagnosticeerde diabetes mellitus (VTV, 2014). De medische zorg voor mensen met diabetes mellitus wordt voor het grootste deel verzorgd door de eerste lijn (huisarts, praktijkondersteuner (POH), specialist ouderengeneeskunde) en tweede lijn (internist, diabetesverpleegkundige(DVK)). In de eerste lijn wordt de meerderheid van de type 2 diabetespatiënten gezien, in de tweede lijn de mensen met diabetes mellitus type 1, zeldzame vormen van diabetes, en patiënten met gecompliceerde type 2 diabetes. Tijdens de jaarlijkse controle door de huisarts, internist, POH en/of DVK worden cardiovasculaire risicofactoren in kaart gebracht en wordt nagegaan of er complicaties zijn opgetreden. Diabetische polyneuropathie is een van de meest voorkomende complicaties van diabetes en komt in populatiestudies bij 30 tot 90% van alle volwassen mensen met diabetes voor. De kans op een pijnlijke diabetische polyneuropathie neemt toe met het aantal jaren dat de patiënt diabetes mellitus heeft, met een slechte glykemische controle (hoog HbA1c) en met de aanwezigheid van andere systemische afwijkingen (nefro- en retinopathie). 16 tot 34% van de mensen met diabetes mellitus heeft een pijnlijke diabetische neuropathie (Javed, 2015).
Het is wenselijk tijdig met meer zekerheid de diagnose PDNP vast te kunnen stellen, zowel om lichamelijke klachten van de patiënt te kunnen verklaren, als om een behandeling te kunnen starten. Optimalisatie van de diabetesregulatie lijkt een eerste logische stap. Bij DM1 is aangetoond dat verbetering van glucoseregulatie en daling van het HbA1c door intensieve insulinebehandeling neuropathie voorkomt; bij DM2 is hiervoor onvoldoende bewijs (Fullerton, 2014; Hemmingsen, 2013 en 2015; UKPDS, 1998; DCCT, 1995). Optimale glucoseregulatie verlaagt de kans op neuropathie en bij patiënten met PDNP kan optimale glucoseregulatie de klachten mogelijk verminderen. In deze langdurige follow-up studies is echter niet apart gekeken naar de vermindering van neuropathische pijn. Een kleinere studie met zowel DM1 als DM2 patiënten geeft hiervoor wel ondersteuning (Archer, 1983). De patiënten hadden allemaal een snelle en ernstige gewichtsreductie met daarbij een gestoorde diabetesregulatie, waarbij na herstel hiervan de neuropathische klachten verbeterden. Naast optimalisatie van de diabetesregulatie kan medicamenteuze of niet-medicamenteuze symptomatische therapie worden overwogen.
Om de optimale methode vast te stellen om neuropathische pijn bij volwassen personen met diabetes mellitus vast te stellen, is besloten twee deelvragen te formuleren.
De eerste deelvraag is om te onderzoeken of er betrouwbare, gevalideerde en voor de dagelijkse praktijk bruikbare gestructureerde vragenlijsten bestaan voor het vaststellen van neuropathische pijn bij volwassen personen met diabetes mellitus die door de zorgverleners kunnen worden gehanteerd bij de jaarcontrole of tussentijds, wanneer patiënten zich melden met klachten die bij neuropathische pijn kunnen passen.
De tweede (vervolg) deelvraag is of bij volwassen personen met diabetes mellitus die bij een vragenlijst positief screenen voor neuropathische pijn bij (aanvullende) anamnese, lichamelijk onderzoek en eenvoudige bedside testen de diagnose distale symmetrische pijnlijke polyneuropathie kan worden gesteld. De voorkeur gaat dan uit naar gestandaardiseerde vragen in de anamnese en gestandaardiseerde testen bij het lichamelijk onderzoek, eenvoudige bedside testen, of combinaties hiervan. Een groot aantal vragenlijsten, testen bij het lichamelijk onderzoek en eenvoudige bedside testen is beschikbaar, maar het is noodzakelijk hierin op grond van sensitiviteit en specificiteit de beste keuze te maken. Van belang is dat het gaat om het vaststellen van de meest voorkomende vormen van diabetische polyneuropathie, gekarakteriseerd door een langzaam progressieve, symmetrische, distale, sensibele of sensomotorische zenuwuitval.
Doel van de uitgangsvraag is om te onderzoeken of er betrouwbare, gevalideerde en voor de dagelijkse praktijk bruikbare vragenlijsten, gestandaardiseerde anamnesevragen, kenmerken bij het lichamelijk onderzoek en bedside testen zijn, voor het vaststellen van de diagnose pijnlijke diabetische polyneuropathie. Alle testen moeten geschikt zijn om te worden afgenomen in zowel de eerste als de tweede lijn, zowel af te nemen bij de jaarlijkse algemene screening als bij patiënten die tussentijds onder de aandacht komen.
Conclusies / Summary of Findings
1. Wat is de plaats van vragenlijsten bij het screenen op, en vaststellen van neuropathische pijn bij volwassen personen met diabetes mellitus?
|
Zeer laag GRADE |
De originele versies van de DN4 (Franse taal), S-LANSS (Engels), PainDETECT (Duits) en NPQ (Engels) lijken een voldoende sensitiviteit (≥70%) te hebben bij het vaststellen van neuropathische pijn.
De originele versies van de DN4 (Frans), LANSS (Engels), S-LANSS (Engels), PainDETECT (Duits), NPQ (Engels), en NPQ-SF (Engels) lijken een voldoende specificiteit (≥70%) te hebben bij het vaststellen van neuropathische pijn.
De originele versies van DN4 (Franse taal), S-LANSS (Engels), PainDETECT (Duits), en NPQ (Engels) lijken zowel een voldoende sensitiviteit als specificiteit (≥70%) te hebben bij het vaststellen van neuropathische pijn.
Van de originele versies van de screeningsinstrumenten, lijken de DN4 (Frans) en ID Pain (Engels) een voldoende betrouwbaarheid (reproduceerbaarheid) te hebben.
Bij patiënten met chronische pijn (tenminste drie maanden): algemene en specifieke pijncondities (neuropathische pijn, nociceptieve pijn, gemengde pijn).
Van de patiënten met de klinische diagnose neuropathische pijn wordt 10-20 procent niet gedetecteerd (fout-negatief).
Het bepalen van de optimale screeningsvragenlijst wordt bemoeilijkt door een relatief gebrek aan direct vergelijkend onderzoek, onderzoek waarin de verschillende screeningsinstrumenten worden vergeleken in dezelfde studiepopulatie.
Bronnen (Mathieson, 2015) |
|
Zeer laag GRADE |
DN4 en PainDETECT zijn beschikbaar in de Nederlandse taal.
De Nederlandse versie van de DN4 is gevalideerd bij patiënten met chronische pijn en lijkt een voldoende sensitiviteit (74%) en specificiteit (79%) te hebben, maar een onvoldoende betrouwbaarheid (reproduceerbaarheid).
De Testaccuratesse en betrouwbaarheid van de Nederlandse versie van PainDETECT zijn onbekend.
Er zijn geen screeningsinstrumenten in de Nederlandse taal die zijn gevalideerd bij mensen met diabetes.
Bronnen (Mathieson, 2015) |
|
Zeer laag GRADE |
De DN4 is het enige screeningsinstrument dat is gevalideerd bij mensen met diabetes (studiepopulatie bestaande uit patiënten met en zonder pijn): de Italiaanse versie van de DN4 lijkt een voldoende sensitiviteit (80%) en specificiteit (92%) te hebben. De betrouwbaarheid (reproduceerbaarheid) is niet onderzocht.
Er zijn geen studies die de testaccuratesse of betrouwbaarheid van verschillende screeningsvragenlijsten vergelijken bij mensen met diabetes.
Bronnen (Mathieson, 2015) |
|
- |
Er zijn geen licentiekosten verbonden aan het gebruik van de screeningsvragenlijsten.
De vragenlijsten bevatten vergelijkbare, en een vergelijkbaar aantal, items (Tabel 1). Het bepalen en interpreteren van de totaalscores door de behandelaar is vergelijkbaar tussen de screeningsinstrumenten en relatief eenvoudig, alleen bij de NPQ en NPQ-SF is een (simpele) berekening nodig.
DN4 en LANSS combineren een patiëntenvragenlijst met klinische onderzoeksvragen (DN4-interview betreft alleen de patiëntenvragenlijst).
De S-LANSS combineert een patiëntenvragenlijst met zelfonderzoek.
ID Pain, PainDETECT, modified PainDETECT, NPQ en NPQ-SF en DN4-interview bevatten geen klinische onderzoeksvragen.
Bronnen (Mathieson, 2015; originele publicaties) |
2. Wat is de plaats van anamnese en lichamelijk onderzoek (inclusief bedside testen) bij het stellen van de diagnose polyneuropathie bij volwassen personen met diabetes mellitus die positief screenen voor neuropathische pijn?
|
--- |
Er zijn geen diagnostische accuratessestudies van screeningsinstrumenten voor diabetische polyneuropathie (anamnese, lichamelijk onderzoek, bedside testen) waarin een betrouwbare referentietest werd gebruikt in onderzoek bij mensen met diabetes mellitus die positief screenen voor neuropathische pijn. |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat de Neuropad voldoende sensitiviteit (79 tot 91%) biedt als test voor diabetische polyneuropathie, de specificiteit lijkt laag (51 tot 76%).
Er zijn enige aanwijzingen dat de Neuropad met name gevoelig is voor dunnevezel neuropathie.
Er is sprake van grote en onverklaarbare heterogeniteit in testkarakteristieken tussen individuele diagnostische accuratessestudies.
Bronnen (Tsapas, 2014 (SR); Ponirakis, 2014) |
|
Zeer laag GRADE |
Er zijn enige aanwijzingen dat de Sudoscan en NIS-LL een vergelijkbare sensitiviteit en specificiteit bieden als test voor diabetische polyneuropathie.
Bronnen (Casellini, 2013) |
|
Zeer laag GRADE |
Er zijn enige aanwijzingen dat een Biothesiometer (handheld) en stemvork (128 Hz) voldoende sensitiviteit en specificiteit bieden als test voor dikkevezel polyneuropathie bij diabetes mellitus.
Sensitiviteit en specificiteit lijken aanzienlijk lager als test voor dunnevezel polyneuropathie bij diabetes mellitus.
Bronnen (Pourhamidi, 2014) |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat bij patiënten met type 1 diabetes, de Vibratron II een hoge sensitiviteit maar lage specificiteit heeft, het monofilament (SWMF) een hoge specificiteit maar lage sensitiviteit heeft, en MNSI een hoge sensitiviteit en redelijke specificiteit heeft.
Betreft patiënten van middelbare leeftijd met een vroege diagnose van type 1 diabetes (voor het zeventiende levensjaar).
Bronnen (Pambianco, 2011) |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat met name monofilament (SWMF) en stemvork (128 Hz), al dan niet in combinatie met onderzoek naar uiterlijk van de voet en enkelreflexen (MNSI), de diagnose diabetische polyneuropathie kunnen ondersteunen.
Gebaseerd op een analyse van de positieve en negatieve likelihood ratio’s.
Bronnen (Kanji, 2010 (SR)) |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat de aanwezigheid van diabetische polyneuropathie kan worden voorspeld op basis van leeftijd, HbA1c, HDL-C en diabetische retinopathie.
Gebaseerd op een enkel onderzoek waarin de voorspellingsregel (prediction rule) is ontwikkeld en getest in dezelfde patiëntenpopulatie.
Bronnen (Jurado, 2009) |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat de UENS een enigszins hogere sensitiviteit heeft dan MDNS en NIS-LL.
Gebaseerd op een enkel onderzoek met een gemengde eerste- en tweedelijns patiëntenpopulatie. Specificiteit van de testen wordt niet gerapporteerd.
Bronnen (Singleton, 2008) |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat vibratieperceptie (kwantitative stemvork en neurothesiometer) en monofilament een hoge specificiteit maar lage sensitiviteit hebben voor detectie van diabetische polyneuropathie in een eerstelijns populatie van type 2 diabetes patiënten.
In een onderzoek waarin beide indextesten deel uit maakten van de referentietest.
Bronnen (Jurado, 2007) |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat een gegradeerde stemvork (128 Hz) een hoge sensitiviteit maar lage specificiteit heeft in de detectie van symptomatische en asymptomatische diabetische polyneuropathie bij jaarlijkse diabetes controle in de tweede lijn.
In een onderzoek waarin de referentietest was gebaseerd op Achilles reflex en SWMF, en waarin de prevalentie zeer laag was.
Bronnen (Kästenbauer, 2004) |
Samenvatting literatuur
1. Wat is de plaats van vragenlijsten bij het screenen op, en vaststellen van neuropathische pijn bij volwassen personen met diabetes mellitus?
Mathieson (2015) is een systematische review van zeer goede kwaliteit (zie Table of quality assessment). Mathieson (2015) analyseert de door de IASP (International Association for the Study of Pain) aanbevolen vragenlijsten (Haanpää, 2011) voor screening van neuropathische pijn (DN4, ID Pain, LANSS, PainDETECT, NPQ), inclusief modificaties en/of adaptaties (S-LANSS, modified painDETECT, NPQ-SF; zie tabel 1 voor een verklaring van de afkortingen). Mathieson (2015) beperkt zich tot publicaties in het Engels, maar kent geen restricties met betrekking tot de studiepopulatie waarin de vragenlijsten worden getest.
Mathieson (2015) includeert 37 studies en beoordeelt de psychometrische eigenschappen van genoemde screeningsvragenlijsten aan de hand van de COSMIN criteria (Terwee, 2007; Mokkink, 2010): inhoudsvaliditeit (content validity), criterionvaliditeit (testaccuratesse in relatie tot de gouden standaard), constructvaliditeit, betrouwbaarheid (reproduceerbaarheid: test-retest, intrabeoordelaar en interbeoordelaar), interne consistentie (internal consistency), en responsiviteit. De methodologische kwaliteit van onderzoek met betrekking tot criterionvaliditeit (testaccuratesse, sensitiviteit en specificiteit) wordt bepaald met het QUADAS-2 instrument, en de COSMIN checklijst wordt gebruikt bij de beoordeling van de methodologische kwaliteit in relatie tot de overige psychometrische eigenschappen (Terwee, 2012). Tenslotte wordt de bewijskracht bepaald met behulp van de GRADE methodiek, met enkele aanpassingen die een beoordeling van psychometrische eigenschappen van meetinstrumenten mogelijk maakt (zie evidence-tabel).
Meta-analyses zijn niet verantwoord door een te grote klinische heterogeniteit, met name veroorzaakt door verschillen tussen studiepopulaties (pijnconditie), verschillen in de wijze waarop de diagnose neuropathische pijn werd gesteld (referentietest), verschillen in de wijze waarop de vragenlijsten werden afgenomen (indextest), en verschillen in uitvoering (taal) van de meetinstrumenten (zie evidence-tabel). Pijncondities variëren van postherpetische neuralgie, trigeminus neuralgie, en radiculopathie, tot specifieke pijncondities zoals chronische rugpijn, lepra, kanker en fibromyalgie. Elf studies (30%) gebruiken inadequate methodes voor het vaststellen van neuropathische pijn (indextest) bijvoorbeeld uitsluitend op basis van een beoordeling van het medisch dossier, of op basis van zelfrapportage.
Onderstaande literatuuranalyse richt zich op de door de werkgroep benoemde meest relevante uitkomstmaten: testaccuratesse en betrouwbaarheid (kritieke uitkomstmaten), bruikbaarheid en geschiktheid, en kosten (belangrijke uitkomstmaten). De overige psychometrische eigenschappen komen, voor zover relevant voor de besluitvorming, terug in de Overwegingen. Tabel 1 geeft een overzicht van de test-items en de belangrijkste karakteristieken van de meetinstrumenten (gebaseerd op respectievelijk Bennett (2007) en Mathieson (2015); zie voor meer details de evidence-tabel).
In de literatuuranalyse wordt geen onderscheid gemaakt tussen de twee zoekvragen omdat er nauwelijks onderzoek gedaan is naar testaccuratesse en betrouwbaarheid van screeningsinstrumenten voor neuropathische pijn bij mensen met diabetes, en er geen onderzoek is dat zich specifiek richt op gebruik bij de jaarlijkse diabetescontrole, of bij mensen met diabetes die zich melden met pijn of pijn-gerelateerde klachten in eerste en tweede lijn.
Diagnostische testaccuratesse en betrouwbaarheid – kritieke uitkomstmaten
In slechts 7 van de 37 geïncludeerde studies wordt de testaccuratesse van twee of meer screeningsinstrumenten rechtstreeks met elkaar vergeleken bij dezelfde patiëntenpopulatie, de overige studies analyseren een enkel screeningsinstrument. Studies die de testaccuratesse van screeningsvragenlijsten vergelijken bij mensen met diabetes ontbreken geheel.
Waarschijnlijk mede veroorzaakt door de grote klinische heterogeniteit, bestaat er een aanzienlijke variatie in diagnostische testaccuratesse zowel binnen dezelfde taalversies van een screeningsinstrument, als tussen verschillende taalversies van een screeningsinstrument. De bandbreedtes van sensitiviteit en specificiteit bij de verschillende screeningsinstrumenten laten een grote overlap zien (zie de evidence-tabel voor meer details). De sensitiviteit van de screeningsinstrumenten varieert tussen 47 tot 100% (DN4), 50 tot 83% (ID Pain), 22 tot 90% (LANSS), 52 tot 74% (S-LANSS), 64 tot 85% (PainDETECT), 50 tot 75% (NPQ) en 51 tot 65% (NPQ-SF). De specificiteit varieert tussen 45 tot 100% (DN4), 65 tot 86% (ID Pain), 42 tot 100% (LANSS), 76 tot 80% (S-LANSS), 53 tot 84% (PainDETECT), 65 tot 100 (NPQ) en 61 tot 79% (NPQ-SF). Sensitiviteit en specificiteit van de modified PainDETECT zijn niet gerapporteerd.
Uitgaande van de screeningsinstrumenten in hun originele taal (zie tabel 1), en een voldoende beoordeling van sensitiviteit en specificiteit bij een waarde van tenminste 70%, hebben DN4, S-LANSS, PainDETECT en NPQ voldoende sensitiviteit, en DN4, LANSS, S-LANSS, PainDETECT, NPQ, en NPQ-SF voldoende specificiteit. De originele versies van DN4 (Franse taal), S-LANSS (Engels), PainDETECT (Duits) en NPQ (Engels) hebben zowel voldoende sensitiviteit als specificiteit. Bij een beoordeling van de betrouwbaarheid (reproduceerbaarheid) van de screeningsinstrumenten in hun originele taal, scoren alleen DN4 (Frans) en ID Pain (Engels) een voldoende.
Twee screeningsinstrumenten zijn beschikbaar in de Nederlandse taal, DN4 (Van Seventer, 2012) en PainDETECT (Timmerman, 2013). Er zijn geen gegevens gepubliceerd met betrekking tot testaccuratesse en betrouwbaarheid van de Nederlandse versie van PainDETECT. Van alle screeningsinstrumenten is alleen de DN4 gevalideerd in de Nederlandse taal (Van Seventer, 2012). Van Seventer (2012) onderzocht testaccuratesse en betrouwbaarheid van de DN4 bij patiënten met chronische pijn (langer dan drie maanden): overwegend posttraumatische pijn (36%), (pseudo)radiculaire pijn (14%), of mechanische rugpijn (12%). De klinische diagnose Van deze patiënten kreeg 43% de klinische diagnose neuropathische pijn, 29% nociceptieve pijn, en bij 28% was sprake van een gemengde pijn. De Nederlandse versie van de DN4 heeft voldoende sensitiviteit en specificiteit, respectievelijk 74% en 79%. De betrouwbaarheid scoort onvoldoende (Mathieson, 2015).
De DN4 is het enige screeningsinstrument dat is gevalideerd bij volwassen personen met diabetes, zij het in de Italiaanse taal (Spallone, 2012). Spallone (2012) includeert zowel patiënten met pijn en verdenking PDNP als patiënten zonder pijn (routinematige controle), en rapporteert een sensitiviteit van 80% en specificiteit van 92%. De positief en negatief voorspellende waarde bedraagt respectievelijk 82% en 91%, en de positieve en negatieve Likelihood ratio 9,6 (LR+) en 0,22 (LR-). De betrouwbaarheid werd niet onderzocht. Als afname van de DN4 wordt beperkt tot de patiëntenvragenlijst (DN4-interview) bedragen sensitiviteit en specificiteit 84%.
Tabel 1 Vergelijking van test-items bij screeningsinstrumenten voor neuropathische pijn
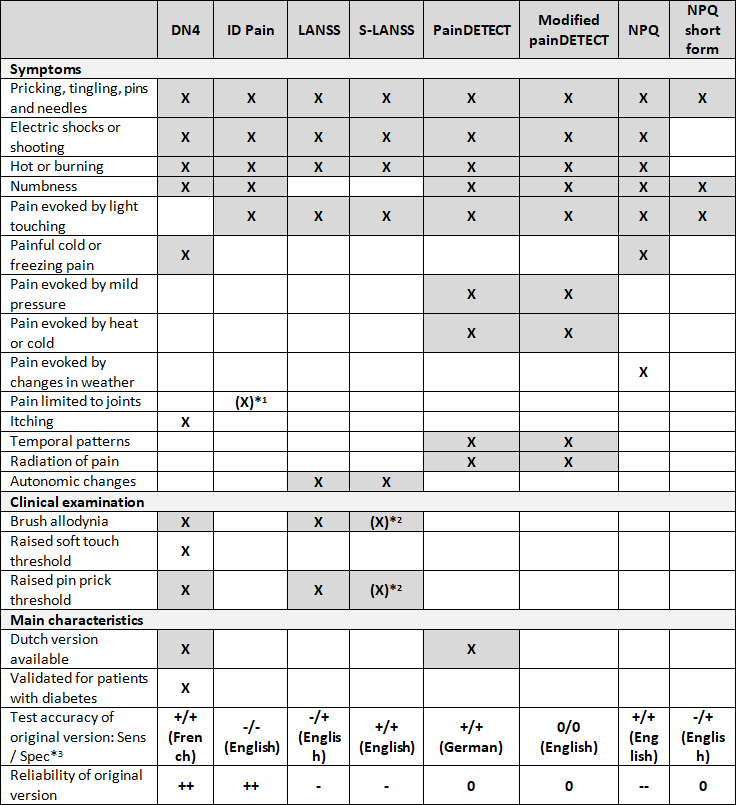 *1 item relating to whether pain is located in the joints, used to identify nociceptive pain
*1 item relating to whether pain is located in the joints, used to identify nociceptive pain
*2 patients are asked to examine themselves
*3 ++ = satisfactory measurement property, low level of evidence; + = satisfactory measurement property, very low level of evidence; -- = unsatisfactory measurement property, low level of evidence; - = unsatisfactory measurement property, very low level of evidence; 0 = no evidence (not reported). Assessment of measurement properties and the level of evidence are based on the COSMIN criteria and GRADE criteria, respectively (taken from Mathieson 2015). Note that the level of evidence (GRADE) is low or very low.
Afkortingen: DN4: Douleur Neuropathique; ID Pain: acronym voor ID Pain Neuropathic Pain Screening Questionnaire; LANSS: Leeds Assessment of Neuropathic Symptoms and Signs; PainDETECT: acronym voor PainDETECT Questionnaire; NPQ: Neuropathic Pain Questionnaire; S-LANSS: Self-reported LANSS; modified painDETECT: gemodificeerde Paindetect; NPQ-SF: NPQ Short-Form
De grijze vakken in de tabel geven aan dat een test-item in tenminste twee screeningsinstrumenten voorkomt (gebaseerd op Bennett, 2007). De voor de uitgangsvraag belangrijkste karakteristieken van de meetinstrumenten zijn aangegeven (gebaseerd op Mathieson, 2015); zie voor meer details de evidence-tabel.
Bruikbaarheid en geschiktheid, en kosten - belangrijke uitkomstmaten
Mathieson (2015) heeft de bruikbaarheid en geschiktheid, en kosten van de screeningsinstrumenten niet onderzocht. Enig inzicht in hanteerbaarheid, tijdsbeslag, begrijpelijkheid voor patiënt en belasting voor de patiënt kan wel worden verkregen uit de geïncludeerde primaire studies. Twee screeningsinstrumenten (DN4, LANSS) combineren een patiëntenvragenlijst met klinisch onderzoek, in de S-LANSS (Self-reported LANSS) zijn de klinische onderzoeksvragen vervangen door vergelijkbare vragen geschikt voor zelfonderzoek. De overige vragenlijsten bevatten geen klinische onderzoeksvragen. Bij geen van de screeningsinstrumenten is er sprake van licentiekosten. De vragenlijsten bevatten veel overeenkomstige items (zie Tabel 1), en de vragen zijn relatief eenvoudig en snel te beantwoorden. Met uitzondering van de NPQ-SF dat uit slecht drie vragen bestaat, is het aantal vragen bij de overige screeningsinstrumenten vergelijkbaar. Ook het bepalen en interpreteren van de totaalscores door de behandelaar is in grote lijnen vergelijkbaar tussen de screeningsinstrumenten en relatief eenvoudig. Alleen bij de NPQ en NPQ-SF moeten item-scores worden vermenigvuldigd met coëfficiënten en een constante worden afgetrokken van de totaalscore, dit maakt deze screeningsinstrumenten wat bewerkelijker. Twee screeningsinstrumenten zijn beschikbaar in de Nederlandse taal, DN4 (Van Seventer, 2012) en PainDETECT (Timmerman, 2013). De DN4 is gevalideerd in de Nederlandse taal, maar niet specifiek bij mensen met diabetes.
Bewijskracht van de literatuur
De bewijskracht is gebaseerd op de analyse van Mathieson (2015) die de methodologische kwaliteit van onderzoek (risk of bias) bepaald met het QUADAS-2 instrument en de COSMIN checklijst, en de bewijskracht met behulp van de GRADE methodiek, met enkele aanpassingen die een beoordeling van psychometrische eigenschappen van meetinstrumenten mogelijk maakt (zie evidence-tabel). De bewijskracht bepaald door Mathieson (2015) moet voor de huidige uitgangsvraag, die specifiek betrekking heeft op Nederlandse personen met diabetes, nog met tenminste een niveau worden verlaagd vanwege indirectheid. De bewijskracht met betrekking tot testaccuratesse (sensitiviteit, specificiteit) en betrouwbaarheid (reproduceerbaarheid) is daarom zeer laag. Bij de uitkomstmaten bruikbaarheid en geschiktheid, en kosten kan door een gebrek aan data geen bewijskracht worden bepaald.
2. Wat is de plaats van anamnese en lichamelijk onderzoek (inclusief bedside testen) bij het stellen van de diagnose polyneuropathie bij volwassen personen met diabetes mellitus die positief screenen voor neuropathische pijn?
Er bestaan grote verschillen tussen de geïncludeerde onderzoeken met betrekking tot indextest(en) en referentietest(en), de onderzochte patiëntenpopulatie, en de methodologische kwaliteit (zie risk of bias tabellen). Vanwege te grote klinische heterogeniteit is een meta-analyse niet verantwoord. In de SR van Tsapas (2014) wordt wel een meta-analyse uitgevoerd voor de sensitiviteit en specificiteit van Neuropad, maar is de validiteit van deze meta-analyse twijfelachtig vanwege zeer grote en onverklaarde statistische heterogeniteit. Vanwege het grote aantal indextesten dat is onderzocht, en de grote klinische heterogeniteit die een meta-analyse in de weg staat, kunnen de studies alleen individueel worden beoordeeld. In plaats van een beschrijving van elke studie in de tekst, is gekozen voor een tabel met een overzicht van de belangrijkste karakteristieken en uitkomsten (tabel 2).
Diagnostische testaccuratesse en betrouwbaarheid – kritieke uitkomstmaten
Tabel 2 geeft een overzicht van de voor de uitgangsvraag belangrijkste karakteristieken van de meetinstrumenten, met betrekking tot de diagnostische accuratesse zijn alleen de sensitiviteit en specificiteit vermeld. Voor een uitgebreidere beschrijving met meer details, zoals likelihood ratio’s, wordt verwezen naar de evidence-tabel.
Bruikbaarheid en geschiktheid, en kosten - belangrijke uitkomstmaten
Incidenteel wordt in de geïncludeerde studies aandacht besteed aan de bruikbaarheid en geschiktheid, kosten worden nauwelijks belicht (zie tabel 2).
Tabel 2 Belangrijkste karakteristieken en resultaten van de geïncludeerde diagnostische accuratessestudies naar de waarde van anamnese en lichamelijk onderzoek (inclusief bedside testen) bij het stellen van de diagnose polyneuropathie bij volwassen personen met diabetes mellitus (zie de evidence-tabel voor een meer gedetailleerd overzicht)
|
Reference |
Design |
Patients |
Index tests |
Reference test |
Sensitivity |
Specificity |
Conclusions, comments |
|
Tsapas 2014
|
SR 18 studies, N=3470 |
Adult outpatients, excl high-risk populations, 15% T1, 85% T2, dur diab 11-18 yrs, HbA1c 6.3-8.3% |
Neuropad (cut-off = complete color change)
|
Reference varies per study: NDS, MDNS, DNI, signs and score, combination of signs, symptoms and NCS Prevalence 12-75% (range) |
0.43-1.00 Pooled: 0.86 [0.79−0.91] I2 = 90% |
0.22-1.00 Pooled: 0.65 [0.51−0.76] I2 = 95% |
Simple triage test with reasonable Sens to rule out foot at risk; Spec is low: patients testing pos should be referred; high heterogeneity; low inter- and intra-observer variability; can be used by patients |
|
Ponirakis 2014
|
DTA N=127 |
Patients from UK Diabetes Centre, 54% T1, 46% T2
|
Neuropad (cut-off % colour change)
|
Multiple refence tests: Large fibre assessments NDS (>2) Small fibre assessments Warm percept thresh Corneal nerve fibre dens Corn nerve fibre length Prevalence 30% (based on Toronto criteria) |
Depending on reference test 0.70
0.68 0.74 0.83 |
0.50
0.49 0.60 0.80 |
Practical diagnostic test for small fibre neuropathy; uses % colour change; uses multiple reference tests (multiple testing) |
|
Casellini 2013
|
DTA 83 patients 210 healthy controls |
USA Diabetes center, 24% T1, 76% T2
|
Sudoscan (ESC) NIS-LL
|
Toronto criteria (TNS>2) Prevalence 60/83 (72%) 46/83 (55% painful)
|
Hands ESC: 0.78 Feet ESC: 0.78 NIS-LL: 0.77 |
Hands ESC: 0.86 Feet ESC: 0.92 NIS-LL: 0.86 |
Sudoscan is Sensitive tool; conducted in 3 min, no special training; not clear how patients with diabetes were selected; in DTA analysis, patients possibly combined with unmatched HCs. |
|
Pourhamidi 2014
|
DTA N=119
|
Population based prevention program, prim care, Sweden; consec participants with NGT or IGT, or T2 diab |
Vibration VPT (biothesiom) Vibration (tuning fork) Pressure (SWMF) Skin biopsies (microscopy)
|
Two reference tests: Large fiber weighted def = abnormal NCS + NDS ≥2 Small fiber weighted def = normal NCS + abnormal thermal thresholds + NDS ≥2 Prevalence 20% ‘large fiber’ 24% ‘small fiber’ |
‘Large fiber’ 0.82 0.77 not reported 0.73 ‘Small fiber’ 0.67 0.44 not reported 0.74 |
‘Large fiber’ 0.70 0.67 0.97 0.70 ‘Small fiber’ 0.46 0.67 0.97 0.61 |
Biothesiometer is Sensitive and Specific method for large nerve fibre dysfunction. Combining skin biopsies with routine clinical tools (e.g.tuning fork) is of greater use considering less advanced (small fiber) than more advanced (large fiber) neuropathy; mixed group of individuals with and w/o diabetes (Spec data may be less relevant); multiple testing |
|
Pambianco 2011 |
DTA N=195
|
Sec care USA, T1 diabetes; <17 years of age at diagnosis; attending the 18 year examination, dur diab ~35 yrs, HbA1c ~7.5% |
Vibratron II [age-adjusted] NC-stat SNAP NC-stat Sensory NC-stat Motor Neurometer 2000 Hz Neurometer 250 Hz Neurometer 5 Hz MNSI Monofilament |
clinical history, symptoms, neurological examination (reflex, pain, tuning fork, sensation) Prevalence not reported
|
0.91 0.79 0.53 0.46 0.71 0.79 0.51 0.87 0.20 |
0.26 0.48 0.77 0.76 0.42 0.32 0.61 0.49 0.98 |
Vibratron II and MNSI highest Sens (>87%), monofilament highest Spec (98%) but lowest Sens (20%); MNSI also had highest NPV (83%) and presents single best combination of Sens and Spec in longstanding type 1 diabetes (: middle-aged patients with early-onset type 1 diabetes) |
|
Mythili 2010 |
DTA N=100
|
Sec care India, consecutive T2 diab patients, dur diab 6.9 yrs, HbA1c 8%, Hist foot ulcers 13% |
DNS DNE Monofilament (SWMF) Vibration VPT (biothesiometer) |
NCS Prevalence 71% |
not reported 0.83 0.96 0.86 |
not reported 0.79 0.55 0.76 |
DNE similar to VPT in evaluation of neuropathy in diabetic clinic; monofilament highly Sensitive but less Specific; selective outcome reporting; setting may be less relevant to situation in NL; very high prevalence |
|
Kanji 2010
|
SR 9 DTA N=37-426 per study
Note: no meta-analysis; most index tests only reported in a single study
|
Diabetes patients (mostly); (almost) only T2 patients |
Large number of index tests: Symptoms Italian screening question Neurological Symptom Score Any single symptom Physical ‘Signs’ -Individual components Vibration 128Hz tuning fork SW monofilament (3 studies) 1 2 3 Inability to walk on heels Deep tendon reflexes Combinations of findings Neurologic examination NDS 5-Test Score MNSI Clinical examination |
NCS (‘large fiber’) Prevalence 23-78% (range)
|
Symptoms 0.85 [0.72-0.94] 0.73 [0.54-0.87] 0.75 [0.55-0.89] Physical ‘Signs’
not reported
0.93 [0.77-0.99] 0.57 [0.44-0.69] Not reported 0.25 [0.16-0.37] 0.71 [0.51-0.86]
0.94 [0.83-0.99] 0.85 [0.76-0.91] 0.22 [0.12-0.33] 0.65 [0.53-0.76] 0.75 [0.55-0.89] |
Symptoms 0.79 [0.72-0.85] 0.30 [0.21-0.42] 0.25 [0.09-0.49] Physical ‘Signs’
not reported
1.00 [0.63-1.00] 0.95 [0.86-0.99] Not reported 0.98 [0.86-1.00] 0.80 [0.56-0.93]
0.92 [0.87-0.96] 0.82 [0.64-0.92] 0.94 [0.68-0.99] 0.83 [0.74-0.89] 0.70 [0.46-0.88] |
Based on a comparison of LR+ (see evidence table) authors conclude that physical examination is most useful: abnormal results on SWMF and vibratory perception (alone or in combination with appearance of feet, ulceration, and ankle reflexes = MNSI) are most helpful signs; meta-analyses not performed; for most diagnostic tools only one study was included (3 studies for SWMF but using different protocols i.e. with high clinical heterogeneity)
|
|
Jurado 2009 |
DTA N=307 |
Prim care, random sample, T2 diabetes, Spain; dur diab 8.6 yrs; HbA1c 7.0% |
‘DPN selection method’ set of 4 clinical parameters identified by logistic regression analysis: age, HbA1c, HDL-C, Retinopathy |
Clinical Neurol Examination (CNE) bilateral signs and symptoms Prevalence 23% |
0.74 |
0.75 |
Useful tool in primary care settings; note that index test = prediction rule, which was developed and tested in the same study population (high risk of bias) |
|
Singleton 2008 |
DTA N=215 |
Mixed prim and sec care; USA; diabetes or prediabetes |
UENS MDNS NIS-LL |
NCS, QST, QSART, skin biopsies (symptoms of neuropathy confirmed by 2 confirmatory electrodiagn, electrophysiol, or histol tests) Prevalence 40% |
0.92 0.67 0.81 |
Not reported (but ‘similar between index tests’) |
UENS Sens (92%) higher than MDNS or NIS-LL without sacrificing Spec. UENS more closely correlated with change in small-fiber neuropathy over 1 year follow-up than MDNS or NIS-LL; note that cut-off values were not reported; Spec not reported; differences between tests not stat sign |
|
Jurado 2007 |
DTA N=305 |
Prim care, random sample, T2 diabetes, Spain |
VPT-neurothesiometer NTS VPT-quant tuning fork QTF SW-MF Olmos technique SW-MF MDNS criteria |
CNE based on symptoms, phys exam, sensory tests (VPT; SWMF) Prevalence 23% |
0.44 0.52 0.28 0.42 |
0.95 0.95 0.96 0.98 |
VPTs and SWMF have high Spec but low Sens in primary care settings; patient characteristics not described; cut-off values UENS and NIS-LL not reported |
|
Kästenbauer 2004 |
DTA N=2022 |
Sec care; Austria; annual diabetes check; 35% T1, 65% T2; HbA1c 8.1% |
VPT (RS tuning fork) |
2 reference tests: DPN = ‘abnormal bedside tests’ (abnormal Achilles tendon reflexes + abnormal SWMF) Symptomatic DPN = DPN + >=3 neuropathic symptoms Prevalence 6.3% (DPN); 5.1% (symptom DPN) |
0.96
0.97 |
0.45
0.42 |
Tuning fork is a useful screening test for diabetic neuropathy (graduated tuning fork is superior to standard tuning forks); note very low prevalence of DPN |
|
Viswanathan 2002 |
DTA N=910 |
Sec care; India; routine screening for neuropathy; dur diab 9.7 yrs [T1/T2 not reported] |
Temp perception (Tip-therm)
|
2 reference tests VPT (biothesiometry) SWMF Prevalence 32.7% (VPT), 26.5% (SWMF) |
0.97 0.98 |
1.00 0.92 |
Tip-therm appears to be highly Sensitive, and Specific device for detection DPN; note that ‘gold standard’ is questionable; relatively old study, setting may be less relevant to situation in NL |
|
Perkins 2001
|
DTA N=478 |
Sec care; Canada; 'mixed' cohort 4 sources including unselected diabetes patients, patients referred for suspected DPN, and ‘reference subjects’; <20% T1; diab duration 9-15 yrs; HbA1c 8.0-8.7% |
SWMF Vibrat on-off (tuning fork) Vibrat timed (tuning fork) Superficial pain (Neurotip) [Note: different cut-off values used for abnormal versus normal test result] |
NCS Prevalence 78%
|
‘abnormal test’ 0.41 0.27 0.37 0.28 ‘normal test’ 0.68 0.92 0.61 0.82 |
‘abnormal test’ 0.96 0.99 0.98 0.97 ‘normal test’ 0.77 0.53 0.80 0.59 |
Tests show comparable Sens and Spec; vibration ‘timed’ takes longer and interpretation is more complicated; note that study population is not representative of any primary of secundary care patient population; prevalence of DPN is very high (78%); different cut-offs were used for ‘abnormal’ and ‘normal’ test |
Afkortingen: NDS: Neurop Disab Score; DNI: Diab Neurop Index; MDNS: Michigan Diab Neurop Score; NCS: Neuro Conduction Studies; MNSI: michigan neuropathy screening instrument; Toronto criteria: abnormal NCS, and symptoms/signs NDS>2; NIS-LL: Neuropathy Impairment Score—Lower Legs; DNS: Diabetic Neuropathy Symptom score; DNE: Diabetic Neuropathy Examination score; UENS: Utah Early Neuropathy Scale; NGT: normal glucose tolerance; IGT: impaired glucose tolerance; SWMF: Semmes-Weinstein monofilament; VPT: Vibration Perception Threshold
Bewijskracht van de literatuur
De bewijskracht met betrekking tot testaccuratesse (sensitiviteit, specificiteit) moet met een niveau worden verlaagd vanwege beperkingen in onderzoeksopzet (zie risk of bias tabellen), met een tot twee niveaus vanwege indirectheid (met name vanwege van de praktijk afwijkende patiëntenpopulatie), en met een niveau vanwege imprecisie (slechts een enkele studie beschikbaar, of een breed betrouwbaarheidsinterval dat overlapt met de grens voor klinische besluitvorming). De redenen voor downgraden verschillen enigszins per indextest, maar in alle gevallen is de uiteindelijke bewijskracht zeer laag. Bij de uitkomstmaten bruikbaarheid en geschiktheid, en kosten kan door een gebrek aan data geen bewijskracht worden bepaald.
Zoeken en selecteren
1. Wat is de plaats van vragenlijsten bij het screenen op, en vaststellen van neuropathische pijn bij volwassen personen met diabetes mellitus?
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Zoekvraag 1: Wat zijn de voor- en nadelen (testaccuratesse, betrouwbaarheid, bruikbaarheid en geschiktheid, kosten) van diverse vragenlijsten voor screening op neuropathische pijn van volwassen personen met diabetes mellitus bij de jaarlijkse diabetescontrole in eerste en tweede lijn?
Zoekvraag 2: Wat zijn de voor- en nadelen (testaccuratesse, betrouwbaarheid, bruikbaarheid en geschiktheid, kosten) van diverse vragenlijsten voor screening op neuropathische pijn van volwassen personen met diabetes mellitus die zich melden met pijn en pijn-gerelateerde klachten die kunnen wijzen op PDNP in eerste en tweede lijn?
In een gecombineerde zoekactie is gezocht naar diagnostische karakteristieken van vragenlijsten voor screening van neuropathische pijn bij volwassen personen met diabetes mellitus type 1 of 2, met het klinisch oordeel van de behandelaar als referentietest, en met testkarakteristieken, betrouwbaarheid, bruikbaarheid en geschiktheid, en kosten als uitkomstmaten.
Relevante uitkomstmaten
De werkgroep achtte diagnostische testaccuratesse (sensitiviteit, specificiteit, positieve en negatieve Likelihoods ratio’s) en betrouwbaarheid (reproduceerbaarheid) voor de besluitvorming kritieke uitkomstmaten; en bruikbaarheid en geschiktheid, en kosten voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. De uitkomstmaat: bruikbaarheid en geschiktheid, staat voor bruikbaarheid in de dagelijkse praktijk: hanteerbaarheid, tijdsbeslag, begrijpelijkheid voor patiënt en belasting voor de patiënt.
Zoeken en selecteren (Methode)
Een oriënterende zoekactie leverde een recente systematische review van zeer goede kwaliteit op (Mathieson, 2015) die de literatuur dekt tot mei 2013. In de database Medline (OVID) is aanvullend gezocht met relevante zoektermen naar diagnostisch onderzoek aan screeningsinstrumenten voor neuropathische pijn bij mensen met diabetes. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 136 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: diagnostische studie, screeningsinstrument (vragenlijst) voor neuropathische pijn, volwassen personen met diabetes, en diagnostische testaccuratesse als uitkomstmaat. Op basis van titel en abstract werden in eerste instantie 22 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens alle studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording).
De literatuuranalyse is gebaseerd op een onderzoek, de SR van Mathieson (2015). Voor een volledig overzicht van studiekarakteristieken en resultaten van de systematische review van Mathieson (2015) en beoordeling van de individuele studieopzet (risk of bias) van de geïncludeerde studies wordt verwezen naar de bewuste publicatie. De belangrijkste studiekarakteristieken, resultaten, en beoordeling van de geïncludeerde studies in Mathieson (2015) zijn opgenomen in de evidence-tabellen.
2. Wat is de plaats van anamnese en lichamelijk onderzoek (inclusief bedside testen) bij het stellen van de diagnose polyneuropathie bij volwassen personen met diabetes mellitus die positief screenen voor neuropathische pijn?
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de voor- en nadelen (testaccuratesse, betrouwbaarheid, bruikbaarheid en geschiktheid, kosten) van (onderdelen van de) anamnese en lichamelijk onderzoek (of combinaties) bij het stellen van de diagnose polyneuropathie bij volwassen personen met diabetes mellitus die positief screenen voor neuropathische pijn?
Er is gezocht naar diagnostische karakteristieken van anamnese (vragenlijsten), bevindingen bij lichamelijk/neurologisch onderzoek, bedside tests, en combinaties hiervan, bij het stellen van de diagnose polyneuropathie bij volwassen personen met diabetes mellitus (type 1 of 2) en neuropathische pijn, met EMG en klinisch oordeel van de behandelaar als referentietest, en met testkarakteristieken, betrouwbaarheid, bruikbaarheid en geschiktheid, en kosten als uitkomstmaten.
Relevante uitkomstmaten
De werkgroep achtte diagnostische testaccuratesse (sensitiviteit, specificiteit, positieve en negatieve Likelihoods ratio’s) en betrouwbaarheid (reproduceerbaarheid) voor de besluitvorming kritieke uitkomstmaten. Met betrekking tot de testaccuratesse is met name een hoge sensitiviteit van belang (een laag percentage fout-negatieven), specificiteit (een laag percentage fout-positieven) is weliswaar ook een kritieke uitkomstmaat maar hoeft slechts acceptabel te zijn (zie de Overwegingen). Bruikbaarheid en geschiktheid, en kosten zijn voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. De uitkomstmaat ‘bruikbaarheid en geschiktheid’ staat voor bruikbaarheid in de dagelijkse praktijk: hanteerbaarheid, tijdsbeslag, begrijpelijkheid voor patiënt en belasting voor de patiënt.
Zoeken en selecteren (Methode)
In de database Medline (OVID) is met relevante zoektermen gezocht naar diagnostisch onderzoek aan screeningsinstrumenten voor polyneuropathie bij mensen met diabetes. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 278 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: diagnostische studie, screening (anamnese, lichamelijk onderzoek, bedside testen) voor diabetische polyneuropathie, volwassen personen met diabetes, en diagnostische testaccuratesse als uitkomstmaat. Elektrofysiologie/EMG en andere specialistische diagnostische testen vallen niet onder de mogelijke indextesten. Gouden standaard is bij voorkeur EMG en als dit normaal is, het klinische oordeel van de behandelaar, maar de aard van de referentietest (gouden standaard) werd niet als een a priori in- of exclusiecriterium gebruikt. Studies gepubliceerd voor 2001 werden door de werkgroep als minder relevant beoordeeld en alsnog geëxcludeerd. Op basis van titel en abstract werden in eerste instantie 41 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 28 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 13 studies definitief geselecteerd.
Dertien onderzoeken, twee systematische reviews (SR’s) en elf primaire diagnostische studies, zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de studieopzet (risk of bias) is opgenomen in de risk of bias tabellen. De beoordeling van de risk of bias van de studies die deel uitmaken van de twee SR’s is niet opnieuw beoordeeld maar overgenomen uit de bewuste publicaties en opgenomen in de evidence-tabel.
Referenties
- Archer AG, Watkins PJ, Thomas PK, et al. The natural history of acute painful neuropathy in diabetes mellitus. J Neurol Neurosurg Psychiatry. 1983;46(6):491-9. PubMed PMID: 6875582; PubMed Central PMCID: PMC1027437.
- Bennett MI, Attal N, Backonja MM, et al. Using screening tools to identify neuropathic pain. Pain. 2007;127(3):199-203. Epub 2006 Dec 19. Review. PubMed PMID: 17182186.
- Bouhassira D, Attal N, Alchaar H, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain. 2005;114(1-2):29-36. PubMed PMID: 15733628.
- Casellini CM, Parson HK, Richardson MS, et al. Sudoscan, a noninvasive tool for detecting diabetic small fiber neuropathy and autonomic dysfunction. Diabetes Technol Ther. 2013;15(11):948-53. doi: 10.1089/dia.2013.0129. Epub 2013 Jul 27. PubMed PMID: 23889506; PubMed Central PMCID: PMC3817891.
- DCCT. The effect of intensive diabetes therapy on the development and progression of neuropathy. The Diabetes Control and Complications Trial Research Group. Ann Intern Med. 1995;122(8):561-8. PubMed PMID: 7887548.
- Fullerton B, Jeitler K, Seitz M, et al. Intensive glucose control versus conventional glucose control for type 1 diabetes mellitus. Cochrane Database Syst Rev. 2014;2:CD009122. doi: 10.1002/14651858.CD009122.pub2. Review. PubMed PMID: 24526393.
- Haanpää M, Attal N, Backonja M, et al. NeuPSIG guidelines on neuropathic pain assessment. Pain. 2011;152(1):14-27. doi: 10.1016/j.pain.2010.07.031. Epub 2010 Sep 19. Review. PubMed PMID: 20851519.
- Hemmingsen B, Lund SS, Gluud C, et al. Targeting intensive glycaemic control versus targeting conventional glycaemic control for type 2 diabetes mellitus. Cochrane Database Syst Rev. 2013;11:CD008143. doi: 10.1002/14651858.CD008143.pub3. Review. Update in: Cochrane Database Syst Rev. 2015;7:CD008143. PubMed PMID: 24214280.
- Hemmingsen B, Lund SS, Gluud C, et al. WITHDRAWN: Targeting intensive glycaemic control versus targeting conventional glycaemic control for type 2 diabetes mellitus. Cochrane Database Syst Rev. 2015;7:CD008143. doi: 10.1002/14651858.CD008143.pub4. Review. PubMed PMID: 26222248.
- Javed S, Petropoulos IN, Alam U, et al. Treatment of painful diabetic neuropathy. Ther Adv Chronic Dis. 2015;6(1):15-28. doi: 10.1177/2040622314552071. Review. PMID: 25553239 /pubmed/25553239.
- Jurado J, Ybarra J, Pou JM. Isolated use of vibration perception thresholds and semmes-weinstein monofilament in diagnosing diabetic polyneuropathy: "the North Catalonia diabetes study". Nurs Clin North Am. 2007;42(1):59-66. PubMed PMID: 17270590.
- Jurado J, Ybarra J, Romeo JH, et al. Clinical screening and diagnosis of diabetic polyneuropathy: the North Catalonia Diabetes Study. Eur J Clin Invest. 2009;39(3):183-9. doi: 10.1111/j.1365-2362.2008.02074.x. PubMed PMID: 19260947.
- Kanji JN, Anglin RE, Hunt DL, et al. Does this patient with diabetes have large-fiber peripheral neuropathy? JAMA. 2010;303(15):1526-32. doi: 10.1001/jama.2010.428. Review. PubMed PMID: 20407062.
- Kästenbauer T, Sauseng S, Brath H, et al. The value of the Rydel-Seiffer tuning fork as a predictor of diabetic polyneuropathy compared with a neurothesiometer. Diabet Med. 2004;21(6):563-7. PubMed PMID: 15154940.
- Martina IS, van Koningsveld R, Schmitz PI, et al. Measuring vibration threshold with a graduated tuning fork in normal aging and in patients with polyneuropathy. European Inflammatory Neuropathy Cause and Treatment (INCAT) group. J Neurol Neurosurg Psychiatry. 1998;65(5):743-7. PubMed PMID: 9810949; PubMed Central PMCID: PMC2170371.
- Mathieson S, Maher CG, Terwee CB, et al. Neuropathic pain screening questionnaires have limited measurement properties. A systematic review. J Clin Epidemiol. 2015;68(8):957-66. doi: 10.1016/j.jclinepi.2015.03.010. Review. PubMed PMID: 25895961.
- Mokkink LB, Terwee CB, Patrick DL, et al. The COSMIN study reached international consensus on taxonomy, terminology, and definitions of measurement properties for health-related patient-reported outcomes. J Clin Epidemiol. 2010;63(7):737-45. doi: 10.1016/j.jclinepi.2010.02.006. PubMed PMID: 20494804.
- Mythili A, Kumar KD, Subrahmanyam KA, et al. A Comparative study of examination scores and quantitative sensory testing in diagnosis of diabetic polyneuropathy. Int J Diabetes Dev Ctries. 2010;30(1):43-8. doi: 10.4103/0973-3930.60007. PubMed PMID: 20431806.
- NDF. Zorgstandaard Diabetes. 2015. Link: http://www.zorgstandaarddiabetes.nl/ [geraadpleegd op 20 januari 2017].
- Rutten GEHM, De Grauw WJC, Nijpels G, et al. NHG-Standaard Diabetes mellitus type 2 (derde herziening). Huisarts Wet 2013;56(10):512-525. https://www.nhg.org/standaarden/volledig/nhg-standaard-diabetes-mellitus-type-2.
- De Jong L, Janssen PGH, Keizer D, et al. NHG-Standaard Pijn. NHG-Werkgroep Pijn. 2015. https://www.nhg.org/standaarden/volledig/nhg-standaard-pijn.
- NVN. Richtlijn Polyneuropathie Nederlandse Vereniging voor Neurologie. 2005. https://www.neurologie.nl/uploads/136/87/richtlijnen_-_polyneuropathie.pdf.
- Pambianco G, Costacou T, Strotmeyer E, et al. The assessment of clinical distal symmetric polyneuropathy in type 1 diabetes: a comparison of methodologies from the Pittsburgh Epidemiology of Diabetes Complications Cohort. Diabetes Res Clin Pract. 2011;92(2):280-7. doi: 10.1016/j.diabres.2011.02.005. PubMed PMID: 21411172.
- Perkins BA, Olaleye D, Zinman B, et al. Simple screening tests for peripheral neuropathy in the diabetes clinic. Diabetes Care. 2001;24(2):250-6. PubMed PMID: 11213874.
- Ponirakis G, Petropoulos IN, Fadavi H, et al. The diagnostic accuracy of Neuropad for assessing large and small fibre diabetic neuropathy. Diabet Med. 2014;31(12):1673-80. doi: 10.1111/dme.12536. Epub 2014 Jul 14. PubMed PMID: 24975286; PubMed Central PMCID: PMC4236278.
- Pourhamidi K, Dahlin LB, Englund E, et al. Evaluation of clinical tools and their diagnostic use in distal symmetric polyneuropathy. Prim Care Diabetes. 2014;8(1):77-84. doi: 10.1016/j.pcd.2013.04.004. Epub 2013 May 9. PubMed PMID: 23664849.
- Singleton JR, Bixby B, Russell JW, et al. The Utah Early Neuropathy Scale: a sensitive clinical scale for early sensory predominant neuropathy. J Peripher Nerv Syst. 2008;13(3):218-27. doi: 10.1111/j.1529-8027.2008.00180.x. PubMed PMID: 18844788.
- Spallone V, Morganti R, D'Amato C, et al. Validation of DN4 as a screening tool for neuropathic pain in painful diabetic polyneuropathy. Diabet Med. 2012;29(5):578-85. doi: 10.1111/j.1464-5491.2011.03500.x. PubMed PMID: 22023377.
- Terwee CB, Bot SD, de Boer MR, et al. Quality criteria were proposed for measurement properties of health status questionnaires. J Clin Epidemiol. 2007;60(1):34-42. Epub 2006 Aug 24. PubMed PMID: 17161752.
- Terwee CB, Mokkink LB, Knol DL, et al. Rating the methodological quality in systematic reviews of studies on measurement properties: a scoring system for the COSMIN checklist. Qual Life Res. 2012;21(4):651-7. doi: 10.1007/s11136-011-9960-1. Epub 2011 Jul 6. PubMed PMID: 21732199
- Timmerman H, Wolff AP, Schreyer T, et al. Cross-cultural adaptation to the Dutch language of the PainDETECT-Questionnaire. Pain Pract. 2013;13(3):206-14. doi: 10.1111/j.1533-2500.2012.00577.x. PubMed PMID: 22776283.
- Tsapas A, Liakos A, Paschos P, et al. A simple plaster for screening for diabetic neuropathy: a diagnostic test accuracy systematic review and meta-analysis. Metabolism. 2014;63(4):584-92. doi: 10.1016/j.metabol.2013.11.019. Epub 2013 Dec 7. Review. PubMed PMID: 24405753.
- UKPDS. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet. 1998;352(9131):837-53.
- Van Seventer R, Vos C, Giezeman M, et al. Validation of the Dutch version of the DN4 diagnostic questionnaire for neuropathic pain. Pain Pract. 2013;13(5):390-8. doi: 10.1111/papr.12006. Epub 2012 Oct 31. PubMed PMID: 23113981.
- Viswanathan V, Snehalatha C, Seena R, et al. Early recognition of diabetic neuropathy: evaluation of a simple outpatient procedure using thermal perception. Postgrad Med J. 2002;78(923):541-2. PubMed PMID: 12357015.
- VTV. Volksgezondheid Toekomst Verkenning 2014. 2014. RIVM, in opdracht van het ministerie van VWS. http://www.eengezondernederland.nl/Een_gezonder_Nederland.
Evidence tabellen
1. Wat is de plaats van gestructureerde vragenlijsten bij het screenen op, en vaststellen van neuropathische pijn bij volwassen personen met diabetes mellitus?
Table of quality assessment for systematic reviews of diagnostic studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: What is the value of measuring instruments (questionnaires) for screening and diagnosis of neuropathic pain, in patients with diabetes without known pain complaints (during annual diabetes checks), and in patients with pain complaints suspected of having painful diabetic polyneuropathy (PDNP)?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Mathieson 2015 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
No*1 |
No*1 |
*1 but risk of bias is low
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO) should be reported
- Quality of individual studies should be assessed using a quality scoring tool or checklist (preferably QUADAS-2; COSMIN checklist for measuring instruments)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, diagnostic tests (strategy) to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests?
- An assessment of publication bias should include a combination of graphical aids and/or statistical tests. Note: If no test values or plots included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Evidence table for measuring instruments (questionnaires)
Research question: What is the value of measuring instruments (questionnaires) for screening and diagnosis of neuropathic pain, in patients with diabetes without known pain complaints (during annual diabetes checks), and in patients with pain complaints suspected of having painful diabetic polyneuropathy (PDNP)?
|
Study reference |
Per type of instrument |
Method of diagnosis (‘golden standard’) |
Patient characteristics
|
Language of measuring instrument |
Test accuracy Sensitivity Specificity (validity and level of evidence) |
Reliability (validity and level of evidence) |
Usability
|
Other comments |
|
Mathieson 2015
[Studies included in Mathieson 2015] |
a Questionnaire cut-off values used to determine sensitivity and specificity: DN4 value was 4 (except Harifi 2011 in which a value of 3 was Used, and van Seventer using a value of 5). ID Pain was 2 (except Chan 2011 which a value of 3 was used). LANSS and S-LANSS were 12. PainDETECT value was19 (except Gauffin 2013 which a value of 17 was used). NPQ and short form were 0. b Scale development. c Evaluation study. d Phone administration. e Mail administration. f Test-retest study |
|
|
|
Sens / Spec (%) NA, not reported
Validity (Cosmin criteria) and Level of evidence (modified GRADE approach): Overall, per measuring instrument and language version ++++ = satisfactory measurement property, high level of evidence; +++ = satisfactory measurement property, moderate level of evidence; ++ = satisfactory measurement property, low level of evidence + = satisfactory measurement property, very low level of evidence 0 = no evidence (not reported); ---- = unsatisfactory measurement property, high level of evidence; --- = unsatisfactory measurement property, moderate level of Evidence -- = unsatisfactory measurement property, low level of evidence; - = unsatisfactory measurement property, very low level of evidence |
Validity (Cosmin criteria) and Level of evidence (modified GRADE approach): idem |
For primary and secondary care; for screening and diagnosis; items to consider: length (number of questions), time required, costs (licence required?)
Note: usability was not analysed in Mathieson 2015; based on original publications on the measuring instrument and on NeuPSIG guidelines (Haanpää 2011), EFSN guidelines (Cruccu 2010), and Bennett (2007)
Haanpää (2011): PubMed PMID: 20851519
Cruccu (2010): PubMed PMID: 20298428
Bennett (2007): PubMed PMID 17182186 |
Authors use a modified GRADE approach to determine the level of evidence per measurement property (overall, i.e. based on all studies included reporting the measurement property): scores started at high level of evidence and were downgraded for inconsistency, risk of bias and imprecision.
Inconsistency: no downgrade if >75% results the same in a single measurement property; downgrade-1 if ≤75% results consistent
Risk of Bias: no downgrade if Excellent or good COSMIN score OR low QUADAS-2 score; downgrade-1 if Majority fair COSMIN scores OR unclear QUADAS-2 score; downgrade-2 if Majority poor or mixture of COSMIN scores OR high QUADAS-2 score
Imprecision: no downgrade if >400 participants; downgrade-1 if <400 participants; downgrade-2 if Very wide confidence interval (CI) or wide CI plus <400 participants |
|
DN4 DN4, Douleur Neuropathique 4 |
||||||||
|
Bouhassira 2005 |
Clinical history and sensory testing by Pain specialist, neurologist |
160 chronic pain patients in France |
French [original] |
82.9 / 89.9 + / + (overall) |
++ (overall) |
The DN4 was developed in 160 patients with either neuropathic or nociceptive pain.
DN4 consists of 7 items related to symptoms and 3 related to clinical examination (Bouhassira 2005).
The DN4 is easy to score and a total score of 4 out of 10 or more suggests neuropathic pain. [but note that e.g. van Seventer uses a cut-off value of 5]
The 7 sensory descriptors can be used as a self-report questionnaire with similar results (Bouhassira 2005).
|
|
|
|
Attal 2011 |
Clinical history, sensory testing, additional tests by Neurologist, rheumatologist |
132 low back pain patients in France |
French [original] |
80 / 92
|
|
|
||
|
Harourn 2012 |
Clinical history and sensory testing by Investigator |
80 leprosy patients in Ethiopia |
Amharic |
100 / 45 + / - |
0 |
Compares DN4 with LANSS: Sens/Spec 100/45 vs 85/42 |
||
|
Harifi 2011
|
Clinical history, sensory testing, additional tests by Clinician |
170 chronic pain patients in Morocco |
Arabic |
89.4 / 72.4 + / + |
++ |
|
||
|
van Seventer 2012 |
Inadequate methods; Anaesthetists and neurologist |
269 chronic pain patients in The Netherlands |
Dutch |
75 / 79 (cut-off=5) + / + |
- |
Note: Dutch version; patients mostly with posttraumatic (36%), (pseudo) radicular (14%), and mechanical back pain (12%); diagnosis for nociceptive, neuropathic or mixed pain by 2 physicians (independently; blinded) using ‘whichever diagnostic tools they felt were appropriate’: identical diagnosis of pain in 196 / 248 patients, 85 with neuropathic pain, 57 with nociceptive pain, and 54 with mixed pain; sens and spec of DN4-interview was 74 / 79% (cut-off=3) |
||
|
Walsh 2012 |
Inadequate methods; Physiotherapist |
45 low back-leg pain patients in Ireland |
English |
NA / NA 0 / 0 |
0 |
Compares DN4 with S-LANSS: Sens/Spec NA/NA vs NA/NA |
||
|
Lasry-Levy 2011 |
Clinical history and sensory testing;Clinician |
101 leprosy patients in India |
Hindi and Marathi |
78.6 / 100 ++ / ++ |
0 |
|
||
|
Spallone 2012 |
Clinical history and sensory testing by Investigator |
158 patients with diabetes in Italy |
Italian |
80 / 92 (cut-off=4) + / + (overall) |
0 (overall) |
Note: only validation study in patients with diabetes (with and w/o pain complaints) 158 patients with diabetes: 50 PDNP, 47 DNP, 61 w/o DNP; PPV = 82%; NPV = 91%; LR+ = 9.6; LR- = 0.22. PS. At the cut-off of 3, DN4-interview (i.e. w/o clinical questions) showed sens and spec of 84%, PPV of 71%, NPV of 92%, and LR+ of 5.3 |
||
|
Pauda 2013
|
Clinical history, sensory testing, additional tests; Clinician |
392 peripheral nerve disease patients in Italy |
Italian |
82 / 81
|
|
Compares DN4 with ID Pain: Sens/Spec 82/81 vs 78/74 |
||
|
Santos 2010
|
Clinical history, sensory testing, additional tests; Pain specialist, neurologist, orthopedist |
101 chronic pain patients in Brazil |
Portuguese |
100 / 93.2 + / + |
+ - |
|
||
|
Perez 2007
|
Clinical history, sensory testing, additional tests; Pain specialist |
158 chronic pain patients in Spain |
Spanish |
79.8 / 78 + / + |
+ |
|
||
|
Hallstrom and Norrbrink 2011 |
Clinical history and sensory testing; Neurologist and pain physician |
40 spinal cord injury patients in Sweden |
Swedish |
92.9 / 75.0 ++ / ++ |
++ |
Compares DN4, LANSS, PainDETECT, NPQ: Sens/Spec 93/75 vs 36/100 vs 68/83 vs 50/100 |
||
|
Unal Cevik 2010 |
Clinical history, sensory testing, additional tests; Neurologist, pain specialist, and physiatrists |
180 pain patients in Turkey |
Turkish |
95 / 96.6 + / + |
++ |
|
||
|
ID Pain |
||||||||
|
Portenoy 2006 b,c |
Clinical history and sensory testing; Pain specialist |
308 chronic pain patients in America |
English [original] |
NA / NA - / - (overall) |
++ (overall) |
The tool was developed in 586 patients with chronic pain of nociceptive, mixed or neuropathic etiology, and validated in 308 patients with similar pain classification.
ID-Pain consists of 5 sensory descriptor items and 1 item relating to whether pain is located in the joints (used to identify nociceptive pain); it does not require a clinical examination (Portenoy 2006).
|
|
|
|
Reyes-Gibby 2010 d |
Inadequate methods; Self-reported |
240 breast cancer survivors patients in America |
English [original] |
50 / 86
|
|
|
||
|
Chan 2011
|
Clinical history, sensory testing, additional tests; Pain specialist |
92 pain patients in Hong Kong |
Chinese |
81 / 65 + / - (overall) |
- (overall) |
|
||
|
Li 2012 |
Inadequate methods; Pain specialist |
140 chronic pain patients in China |
Chinese |
78 / 74
|
|
Compares ID Pain, LANSS, NPQ: Sens/Spec 78/74 vs 80/53 vs 53/91 |
||
|
Pauda 2013
|
Clinical history, sensory testing, additional tests; Not described |
392 peripheral nerve disease patients in Italy |
Italian |
78 / 74 + / + |
0 |
Compares DN4 with ID Pain: see DN4 |
||
|
Kitisomprayoonkul 2011 |
Inadequate methods; Physiatrists off site |
100 pain patients in Thailand |
Thai |
83 / 80 + / + |
0 |
|
||
|
LANSS LANSS, Leeds Assessment of Neuropathic Symptoms and Signs |
||||||||
|
Bennett 2001 b,c
|
Clinical history, sensory testing, additional tests; Pain clinician |
60 chronic pain patients in UK |
English [original] |
83 / 87 - / + (overall) |
- (overall) |
The original LANSS was developed in a sample of 60 patients with chronic nociceptive or neuropathic pain and validated in a further sample of 40 patients.
The LANSS contains 5 symptom and 2 clinical examination items.
LANSS is easy to score within clinical settings (Bennett, 2001).
|
|
|
|
Potter 2003 |
Clinical history and sensory testing; Pain specialist |
25 head and neck cancer patients in UK |
English [original] |
79 / 100
|
|
|
||
|
Tampin 2013
|
Clinical history, sensory testing, additional tests; Physiotherapist |
152 neck and upper limb pain patients in Australia |
English [original] |
22 / 88
|
|
Compares LANSS with PainDETECT: Sens/Spec 22/88 vs 64/62 |
||
|
Harourn 2012 |
Clinical history and sensory testing; Investigator |
80 leprosy patients in Ethiopia |
Amharic |
85 / 42 + / - |
0 |
Compares DN4 with LANSS: see DN4 |
||
|
Li 2012 |
Inadequate methods; Pain specialist |
140 chronic pain patients in China |
Chinese |
80 / 52.9 + / + |
0 |
Compares ID Pain, LANSS, NPQ: see ID Pain |
||
|
Mercandante 2009
|
Clinical history, sensory testing, additional tests; Physician |
167 chronic cancer patients in Italy |
Italian |
29.5 / 91.4 -- / ++ |
0 |
Compares LANSS, NPQ, NPQ-SF: Sens/Spec 30/91 vs 51/65 vs 51/61 |
||
|
Barbosa 2013
|
Clinical history, sensory testing, additional tests; Pain clinician |
167 chronic pain patients in Portugal |
Portuguese |
89 / 74 + / + (overall) |
++ (overall) |
|
||
|
Schestatsky 2011
|
Clinical history, sensory testing, additional tests; Neurologist |
90 chronic pain patients in Brazil |
Portuguese |
NA / NA
|
|
|
||
|
Hallstrom and Norrbrink 2011 |
Clinical history and sensory testing; Neurologist, pain physician |
40 spinal cord injury patients in Sweden |
Swedish |
35.7 / 100 -- / ++ |
++ |
Compares DN4, LANSS, PainDETECT, NPQ: see DN4 |
||
|
Yucel 2004 |
Clinical history, sensory testing, additional tests; Pain specialist |
101 pain patients in Turkey |
Turkish |
89.9 / 94.2 + / + |
0 |
|
||
|
S-LANSS Self-reported LANSS |
||||||||
|
Bennett 2005
|
Clinical history, sensory testing, additional tests; Pain specialist |
200 chronic pain patients in UK |
English [original] |
74 / 76 + / + (overall) |
- (overall) |
See LANSS: validated as a self-report tool = the S-LANSS (Bennett 2005); the 2 clinical examination items of LANSS were reworded asking the patients to examine themselves |
|
|
|
Walsh 2012 |
Inadequate methods; Physiotherapist |
45 low back-leg pain patients in Ireland |
English [original] |
NA / NA
|
|
Compares DN4 with S-LANSS: see DN4 |
||
|
Weingarten 2007 d,e |
Clinical history and sensory testing; Pain specialist |
205 chronic pain patients in America |
English [original] |
52 / 78
|
|
|
||
|
Elzahaf 2013 c,e,f |
Inadequate methods; Self-reported |
13 and 25 chronic pain patients in Libya |
Arabic |
NA / NA 0 / 0 |
+ |
|
||
|
Koc and Erdemoglu 2010
|
Clinical history, sensory testing, additional tests; Pain specialist |
244 chronic pain patients in Turkey |
Turkish |
72.3 / 80.4 +++ / +++ |
-- |
|
||
|
PainDETECT |
|
|
|
|
|
|
|
|
|
Freynhagen 2006
|
Clinical history, sensory testing, additional tests; Pain specialist |
392 pain patients in Germany |
German [original] |
85 / 80 + / + |
0 |
This questionnaire was validated in a multicentre study of 392 patients with either neuropathic or nociceptive pain (Freynhagen 2006).
There are 7 weighted sensory descriptor items (never to very strongly) and 2 items relating to the spatial (radiating) and temporal characteristics of the individual pain pattern.
incorporates an easy to use patient-based (self-report) questionnaire with 9 items that do not require a clinical examination.
|
|
|
|
Timmerman 2013 |
Inadequate methods; Physician |
60 pain patients in The Netherlands & Belgium |
Dutch |
NA / NA 0 / 0 |
0 |
Note: Dutch version |
||
|
Tampin 2013
|
Clinical history, sensory testing, additional tests; Physiotherapist |
152 neck and upper limb pain patients in Australia |
English |
64 / 62 - / - |
0
|
Compares LANSS with PainDETECT: see LANSS |
||
|
Gauffin 2013 |
Clinical history and sensory testing; Rheumatologist |
158 fibromyalgia patients in Finland |
Finnish |
79 / 53 + / - |
0 |
|
||
|
Matsubayashi 2013 |
Clinical history and sensory testing; Pain specialist |
113 pain patients in Japan |
Japanese |
NA / NA 0 / 0 |
+ |
|
||
|
DeAndres 2012 |
Inadequate methods Clinicians at pain clinic |
221 chronic pain patients in Spain |
Spanish |
75 / 84 + / + |
-- |
|
||
|
Hallstrom and Norrbrink 2011 |
Clinical history and sensory testing; Neurologist, pain physician |
40 spinal cord injury patients in Sweden |
Swedish |
67.9 / 83.0 -- / ++ |
-- |
Compares DN4, LANSS, PainDETECT, NPQ: see DN4 |
||
|
Modified PainDETECT |
||||||||
|
Hochman 2011 d |
Inadequate methods; Not described |
171 hip/knee arthritis patients in Canada |
English [original] |
NA / NA 0 / 0 |
0 |
painDETECT, was modified for use in knee OA: enlargement of font, numbering of questions, addition of an introductory ‘framing’ paragraph, and framing of questions to ask about symptoms ‘in or around’ the worst knee, over a specific time frame; some questions were reworded |
|
|
|
NPQ NPQ, Neuropathic Pain Questionnaire |
||||||||
|
Krause and Backonja 2003 |
Inadequate methods; Hospital physician |
532 chronic pain patients in America |
English [original] |
74.7 / 77.6 + / + |
-- |
NPQ was developed in 382 patients with a broad range of chronic pain diagnoses.
The NPQ consists of 12 items that include 10 related to sensations or sensory responses, and 2 related to affect (Krause and Backonja 2003).
The NPQ scale is time-consuming in terms of conversion of the raw results given as percentages (item scores have to be multiplied by coefficients, and a constant is substracted to obtain a total discriminant function score; a score at or above 0 predicts neuropathic pain) |
|
|
|
Li 2012 |
Inadequate methods; Pain specialist |
140 chronic pain patients in China |
Chinese |
52.9 / 91.4 - / + |
0 |
Compares ID Pain, LANSS, NPQ: see ID Pain |
||
|
Mercandante 2009
|
Clinical history, sensory testing, additional tests; Physician |
167 chronic cancer patients in Italy |
Italian |
50.8 / 64.8 -- / -- |
0 |
Compares LANSS, NPQ, NPQ-SF: see LANSS |
||
|
Hallstrom and Norrbrink 2011 |
Clinical history and sensory testing; Neurologist, pain physician |
40 spinal cord injury patients in Sweden |
Swedish |
50 / 100 -- / ++ |
++ |
Compares DN4, LANSS, PainDETECT, NPQ: see DN4 |
||
|
NPQ-short form |
||||||||
|
Backonja and Krause 2003 |
Inadequate methods; Hospital physician |
278 chronic pain patients in America |
English [original] |
64.5 / 78.6 - / + |
0 |
See NPQ: short form of the NPQ with only 3 items (numbness, tingling and pain increase in response to touch; Backonja and Krause 2003).
The NPQ-short form also requires conversion, but for only 3 items, and is therefore less time-consuming than the NPQ |
|
|
|
Mercandante 2009
|
Clinical history, sensory testing, additional tests; Physician |
167 chronic cancer patients in Italy |
Italian |
50.8 / 60.6 -- / -- |
0 |
Compares LANSS, NPQ, NPQ-SF: see LANSS |
||
2. Wat is de plaats van anamnese en lichamelijk onderzoek (inclusief bedside testen) bij het stellen van de diagnose polyneuropathie bij volwassen personen met diabetes mellitus die positief screenen voor neuropathische pijn?
Table of quality assessment for systematic reviews of diagnostic studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: what is the value of patient history and physical examination (including bedside tests) in diagnosing (painful) diabetic polyneuropathy?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Tsapas 2014 |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear*1 |
Yes |
Unclear*1 |
|
Kanji 2010 |
Yes |
Yes |
Yes |
Yes*2 |
Yes*2 |
Unclear*2 |
Yes |
Unclear*2 |
*1 Meta-analysis shows very high heterogeneity, not explained by subgroup analysis, meta-regression or sensitivity analyses (but this is discussed in the text); funding and potential conflicts of interest reported for the SR, but not for the included individual studies
*2 only limited description of study/patient characteristics; simple tool used to judge study quality (not validated); for most diagnostic tools examined only 1 study was included, and in other instances high clinical heterogeneity did not allow for pooling; funding and potential conflicts of interest reported for the SR, but not for the included individual studies
- Research question (PICO) and inclusion criteria should be appropriate (in relation to the research question to be answered in the clinical guideline) and predefined
- Search period and strategy should be described; at least Medline searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO) should be reported
- Quality of individual studies should be assessed using a quality scoring tool or checklist (preferably QUADAS-2; COSMIN checklist for measuring instruments)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, diagnostic tests (strategy) to allow pooling? For pooled data: assessment of statistical heterogeneity and, more importantly (see Note), assessment of the reasons for heterogeneity (if present)? Note: sensitivity and specificity depend on the situation in which the test is being used and the thresholds that have been set, and sensitivity and specificity are correlated; therefore, the use of heterogeneity statistics (p-values; I2) is problematic, and rather than testing whether heterogeneity is present, the reasons for heterogeneity should be examined.
- An assessment of publication bias should include a combination of graphical aids and/or statistical tests. Note: If no test values or plots included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of quality assessment – diagnostic test accuracy studies
(The criteria used in this checklist are adapted from: Whiting P, Rutjes AW, Dinnes J et al. (2003). Development and validation of methods for assessing the quality of diagnostic accuracy studies. Health Technology Assessment 8: 1–234, following guidance from the Cochrane Collaboration only 11 items are included)
Research question: what is the value of patient history and physical examination (including bedside tests) in diagnosing (painful) diabetic polyneuropathy?
|
Study reference
(first author, year of publication) |
Was the spectrum of patients representative of the patients who will receive the test in practice?
yes/no/unclear |
Is the reference standard likely to correctly classify the target condition?
yes/no/unclear |
Is the time period between reference standard and index test short enough to be reasonably sure that the target condition did not change between the two tests?
yes/no/unclear |
Did the whole sample or a random selection of the sample, receive verification using a reference standard?
yes/no/unclear |
Did patients receive the same reference standard irrespective of the index test result?
yes/no/unclear |
Was the reference standard independent of the index test (i.e. the index test did not form part of the reference standard)?
yes/no/unclear |
Were the index test results interpreted without knowledge of the results of the reference standard and vice versa?
yes/no/unclear |
Were the same clinical data available when test results were interpreted as would be available when the test is used in practice?
yes/no/unclear |
Were uninterpretable/ intermediate (unclear) test results reported?
yes/no/unclear |
Were withdrawals from the study explained?
yes/no/unclear |
Level of evidence
|
|
Ponirakis 2014 |
No*1 |
Unclear*1 |
Yes |
Yes |
Yes |
Unclear*1 |
Yes |
Unclear |
No |
Unclear |
B [EBRO] |
|
Casellini 2013 |
No*2 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
No |
Unclear |
B [EBRO] |
|
Pourhamidi 2014 |
No*3 |
Unclear*3 |
Yes |
Yes |
Yes |
No*3 |
Yes |
Unclear |
No |
No |
B [EBRO] |
|
Pambianco 2011 |
Yes*4 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear |
No |
No |
B [EBRO] |
|
Mythili 2010 |
Unclear*5 |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear*5 |
Unclear |
No |
Yes*5 |
B [EBRO] |
|
Jurado 2009 |
Yes*6 |
Unclear*6 |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear |
No |
Yes*6 |
B [EBRO] |
|
Singleton 2008 |
Unclear*7 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear |
No |
Yes*7 |
B [EBRO] |
|
Jurado 2007 |
Yes*8 |
Yes |
Yes |
Yes |
Yes |
Unclear*8 |
Yes |
Unclear |
No |
Yes*8 |
B [EBRO] |
|
Kästenbauer 2004 |
Yes*9 |
Yes |
Yes |
Yes |
Yes |
Unclear*9 |
Yes |
Unclear |
No |
No |
B [EBRO] |
|
Viswanathan 2002 |
No*10 |
No*10 |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear |
No |
Yes*10 |
B [EBRO] |
|
Perkins 2001 |
No*11 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear |
No |
Yes*11 |
B [EBRO] |
*1 non-consecutive patients (selection procedure not described); multiple reference standards were used with large differences in outcome; index test has a continuous outcome and cut-off values are not reported; missing data not described; risk of bias due to multiple testing
*2 non-consecutive patients (selection procedure not described), possibly combined with unmatched healthy controls (: a database provided by the manufacturer of the index test); missing data not described; cut-off values used in DTA analyses were not predefined
*3 consecutive individuals including persons without diabetes with and without IGT (impaired glucose tolerance); defines ‘large fiber weighted’ and ‘small fiber weighted’ distal sensory poly neuropathy using 2 different reference tests; reference standards are (also) based on NDS which includes one of the index tests (128 Hz tuning fork; in total 4 different index tests are compared)
*4 consecutive (middle-aged) patients with childhood-onset type 1 diabetes
*5 consecutive patients with T2 diabetes visiting a diabetes clinic in India; blinding of outcome assessors not mentioned; results suggest that there were no missing data
*6 random sample of primary care T2 patients in Spain; uses clinical neurological examination as gold standard; results suggest that there were no missing data; Note: a clinical prediction rule (‘DPN Selection Method’) is developed and tested in the same study population
*7 mixed study population of primary and secundary care patients with diabetes or prediabetes (with IGT), with or without peripheral neuropathy; results suggest that there were no missing data; Note: cut-off values are not properly reported
*8 random sample of primary care T2 patients in Spain; uses clinical neurological examination as gold standard; index tests are also part of the gold standard (which contains many different elements); results suggest that there were no missing data
*9 consecutive patients in diabetes centre for annual diabetes check (but note that the prevalence of DPN is very low amounting to only 6%); reference test is not completely clear and may (also) include the index test
*10 consecutive patients referred to diabetes centre for routine screening for neuropathy, relatively old study (2002) in India; uses 2 reference standards based on single test (VPT-biothesiometry; SW-MF); results suggest that there were no missing data
*11 mixed study population (4 sources) of ‘reference subjects’ (without diabetes) and patients with diabetes with and without neuropathy; results suggest that there were no missing data; Note: selective reporting of test accuracy data using different cut-off values for ‘normal’ and ‘abnormal’ test results (see evidence table)
Evidence table for systematic reviews of diagnostic test accuracy studies
Research question: what is the value of patient history and physical examination (including bedside tests) in diagnosing (painful) diabetic polyneuropathy?
|
Study reference |
Study characteristics |
Patient characteristics |
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Tsapas 2014
PS. study characteristics and results are extracted from the SR (unless stated otherwise) |
SR [and meta-analysis]
Literature search up to April 2013
A: Aubert 2013 B: Bousboulas 2007 C: Didangelos 2006 D: Forth 2010 E: Freitas 2009 F: Gedik 2005 G: Manes 2012 H: Papanas 2005 I: Papanas 2007 J: Papanas 2011 K: Pritchard 2012 L: Quattrini 2008 M: Spallone 2009 N: Tentolouris 2010 O: Tesic 2009 P: Zick 2003 Q: Ziegler 2011a R: Ziegler 2011b
Study design: both cohort, and case-control type of DTA were included (not further specified)
Setting and Country: A: France Diabetes and Cardiology Department B: Greece Diabetes outpatient clinic C: idem D: UK Unclear E: Portugal Endocrinology and Orthopaedics service in peripheral hospital F: Turkey Unclear G: Greece Diabetes outpatient clinics H: Greece Diabetes and medical outpatient clinic I: idem J: Greece Diabetes outpatient clinics K: Australia Patients recruited through hospital & community L: UK Diabetes center M: Italy Diabetes outpatient clinic N: Greece Diabetes outpatient clinic O: Serbia Diabetes outpatient clinic P: Germany Unclear Q: Germany Diabetes center R: Germany Population survey
Source of funding and conflicts of interest: SR was not supported by external funds; one author reports honoraria fees from manufacturer of Neuropad ‘outside the submitted work’ |
Inclusion criteria SR: adult outpatients; T1 or T2 diab; DTA studies using acceptable reference (Neuropathy Disability Score NDS, Michigan Diabetic Neuropathy Score MDNS, Diabetic Neuropathy Index DNI, San Luis Valley Diabetes Study tool, Neuropathy Impairment Score in the Lower Limbs, or composite examination scores combining multiple individual examination findings); cohort or case–control type accuracy studies
Exclusion criteria SR: high-risk populations (e.g., patients with diabetic ulcers); prognostic accuracy studies
18 studies included (3470 participants)
Important patient characteristics: 15% T1 diab 85% T2 dia
Dur diab (mean) 11-18 yrs (range)
Only 1/18 studies including only newly diagnosed patients with diabetes (Ziegler et al., 2011, Diab Med 28, 1412)
HbA1c (mean) ranged from 6.3% to 8.3% (only reported in subset of studies)
|
Describe index test and cut-off point(s):
A-R: Neuropad
Neuropad (TRIGOCare Intern, Wiehl-Drabenderhöhe, Germany) is an adhesive indicator test detecting sweating through color change from blue to pink; simple test that can be used even by patients themselves to diagnose sudomotor dysfunction and peripheral neuropathy; following removal of socks and shoes and a 10-min acclimatization period in room temperature (20 °C–25 °C), the plaster is applied to the sole at the level of the first through second metatarsal heads, and assessed 10 min later for color change.
Cut-off points: Normal = complete color change Abnormal ('neuropathy') = incomplete or no change
Number of participants A: 200 B: 129 C: 174 D: 66 E: 40 F: 40 G: 784 H: 104 I: 120 J: 212 K: 236 L: 57 M: 39 N: 379 O: 499 P: 40 Q: 150 R: 201 |
Describe reference test and cut-off point(s):
A: NDS ( ≥6) B: NDS ( ≥3, ≥6) C: DNI ( >2) MDNS ( >0) D: NDS ( ≥3, ≥6) E: NDS ( ≥6) F: DNI (unclear) G: NDS ( ≥3, ≥6) H: DNI ( >2) I: MDNS ( >0) J: NDS ( ≥3, ≥6) K: NDS ( ≥3, ≥6) L: NDS ( ≥5) M: DNI ( >2) N: NDS ( ≥3, ≥6) O: NDS ( ≥3, ≥6) P: signs and score Q: Combination of signs, symptoms and conduction studies R: DNI ( >2)
Prevalence (%) [based on refence test at cut-off point used for main analysis] A: 16 B: 22 C: 64 / 71 D: 33 E: 55 F: 75 G: 14 H: 68 I: 31 J: 60 K: 12 L: 60 M: 54 N: 41 O: 19 P: 50 Q: 34 R: 37
NDS: Neuropathy Disability Score DNI: Diabetic Neuropathy Index MDNS: Michigan Diabetic Neuropathy Score |
Endpoint of follow-up:
[not reported in the SR]
For how many participants were no complete outcome data available? N (%)
[not reported in the SR]
Reasons for incomplete outcome data described?
[not reported in the SR]
|
Outcome measures and effect size (include 95%CI and p-value if available):
Sensitivity A: 0.94 [0.79 − 0.99] B: 0.83 [0.64 − 0.94] C (ref=DNI): 0.78 [0.69 − 0.85] C (ref=MDNS): 0.73 [0.64 − 0.81] D: 0.91 [0.71 − 0.99] E: 1.00 [0.85 − 1.00] F: 0.80 [0.61 − 0.92] G: 0.95 [0.89 − 0.98] H: 0.94 [0.86 − 0.98] I: 0.97 [0.86 − 1.00] J: 0.89 [0.82 − 0.94] K: 0.66 [0.46 − 0.82] L: 0.85 [0.68 − 0.95] M: 0.76 [0.53 − 0.92] N: 0.95 [0.90 − 0.98] O: 0.43 [0.32 − 0.53] P: 0.90 [0.68 − 0.99] Q: 0.69 [0.54 − 0.81] R: 0.76 [0.64 − 0.85] Pooled characteristic [hierarchical summary receiver operating curve (HSROC) models]: Sens= 0.86 [0.79 − 0.91] I2 = 90.13 [86.73 − 93.53] p = 0.00
Specificity A: 0.23 [0.17 − 0.31] B: 0.61 [0.51 − 0.71] C (ref=DNI): 0.92 [0.82 − 0.97] C (ref=MDNS): 0.90 [0.79 − 0.97] D: 0.66 [0.50 − 0.80] E: 0.44 [0.22 − 0.69] F: 0.40 [0.12 − 0.74] G: 0.72 [0.68 − 0.75] H: 0.70 [0.51 − 0.84] I: 1.00 [0.96 − 1.00] J: 0.69 [0.58 − 0.79] K: 0.67 [0.60 − 0.73] L: 0.46 [0.26 − 0.67] M: 0.22 [0.06 − 0.48] N: 0.54 [0.47 − 0.60] O: 0.80 [0.76 − 0.84] P: 0.65 [0.41 − 0.85] Q: 0.47 [0.37 − 0.58] R: 0.36 [0.28 − 0.45] Pooled characteristic [hierarchical summary receiver operating curve (HSROC) models]: Spec= 0.65[0.51 − 0.76] I2 = 94.96 [93.54 − 96.38] p = 0.00
Overall: diagnostic odds ratio (DOR)= 11.3 [5.3-24.0]; LR+=2.44 [1.68-3.55], LR-= 0.22 [0.14-0.34]
Bayesian analysis: using Fagan’s nomograms and LR+=2, LR-=0.22; (1) ‘prim care setting’ = low risk population (pre-test prob (prevalence) DN=20%): pos test increases prob DN to 38%; neg test decreases prob to 5% (2) ‘sec care setting’ = average-risk population (pre-test prob (prevalence) DN=40%): post-test increases prob of DN to 62%, neg test decreases prob to 13% |
Authors conclude that Neuropad is a simple test with reasonable sens and could be used for triage of DN to rule out foot at risk, although its relative effectiveness compared to standard clinical examination is not established. Spec is low: patients testing pos should be referred to specialized care to establish a definite diagnosis. There is insufficient evidence for effectiveness on patient-important outcomes and cost-effectiveness of implementation in the diagnostic pathway compared with the standard clinical examination.
Place of the index test in the clinical pathway: triage test for screening for clinically relevant DSPN (Diabetic Sensory Poly Neuropathy) that poses feet at risk of ulceration
Study quality (ROB): QUADAS-2; overall analysis: few studies at low ROB regarding patient selection (6/18), use of index test (5/18), or use of reference standard (5/18); most studies at low ROB regarding flow and timing (13/18), and had low applicability concerns for use of index test (17/18) or use of reference standard (15/18); main concern on applicability related to study participants (in particular 8/18 studies with very high prevalence of diabetic neuropathy). Note: most studies do not provide sufficient details regarding blinding of assessors of index and reference test
Heterogeneity: high heterogeneity, both overall and in subgroups (see below), i.e. heterogeneity not explained
Publication bias: linear regression analysis of diagnostic log odds ratio against effective sample size >>no substantial publication bias detected (p=0.71 for slope coefficient)
Subgroup analysis: per reference standard >>Ref=NDS (10 studies), at highest threshold (≥6): Sens 89% [78-95], Spec 59% [48-70]; Ref=DNI (5 studies): Sens 82% [73-88], Spec 56% [28-80]
Choice of cut-off point: ‘there are limited data suggesting that different cut-offs (longer application time) may have greater sensitivity for diagnosis of DSPN and hence could be used with greater confidence for exclusion of DSPN’
Note: Neuropad is a simple test, not very operator-dependent, has low inter- and intra-observer variability (Papanas et al., 2005, Exp Clin Endocrinol Diab 113, 577), and can be used by patients themselves (Tentolouris et al., 2008, Diab Care 31, 236) |
|
Ponirakis 2014
|
DTA; cohort type
Setting and Country: UK Diabetes center
Source of funding and conflicts of interest: Non-commercial funding; declare ‘no competing interests’ |
Inclusion criteria: patients from UK Diabetes Centre Jan 2011 - March 2012 [Note: not further specified; non-consecutive patients ..]
Exclusion: history of neuropathy due to non-diabetic cause; corneal trauma or surg
N= 127 patients
Important patient characteristics: T1 68/127 (54%) T2 59/127 (46%) Age 57 ±10 yrs
Neuropathy defined by the Toronto criteria (abnormal nerve conduction NCS, and symptoms / signs NDS>2)
N tot 127 N w/o DNP 89 N with DNP 38
With vs w/o DNP medians Age 56 vs 61 Diab dur 19 vs 36 %T1 49 vs 63 HbA1c 7.7 vs 7.8 SBP 129 vs 150 DBP 71 vs 75 NDS 2 vs 6 DNS 0 vs 2 .. statistically sign diff in all large fibre, and small fibre assessments
|
Describe index test and cut-off point(s):
Neuropad: 10 min; percentage colour change blindly estimated by 3 independent clinicians
Cut-off points: Not stated; ‘the cut-off value with the highest accuracy was defined for each reference method’ [using the Toronto criteria as gold standard?]
|
Describe reference test and cut-off point(s):
Multiple refence tests used: reflecting large fibre function, small fibre function, or neuropathy symptoms
Large fibre assessments 1: Neuropathy Disability Score NDS (>2) 2: Vibration perception threshold (>14 volts) 3: Sural nerve action potential (<3 lV) 4:Sural nerve conduction velocity (<43 m/s) 5: Peroneal motor nerve action potential (<2 mV) 6: Peroneal motor nerve conduction velocity (<42 m/s)
Small fibre assessments 7: Warm perception threshold (>43°C) 8: Corneal nerve fibre density (<24 n/mm2) 9: Corneal nerve fibre length (<14 mm/mm2)
Neuropathy symptoms 10: DNS score (cut-off?)
Prevalence (%) 38/127 (30%) based on the Toronto criteria (see 2 columns to the left)
For other reference tests [deduced from Table 2: 1: 55% 2: 43 3: 16 4: 37 5: 21 6: 45 7: 30 8: 39 9: 19 10: 21
[i.e. prevalence of neuropathy according to these ‘reference tests’ varies between 16% and 55%] |
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? N (%) Not reported
Reasons for incomplete outcome data described? Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Using the reference tests 1-10
Sensitivity (%) Large fibre assessment 1: 70 [ref=NDS) 2: 83 3: 70 4: 64 5: 82 6: 81 Small fibre assessment 7: 68 8: 74 9: 83 Neuropathy symptoms 10: 78
Specificity (%) Large fibre assessment 1: 50 [ref=NDS) 2: 53 3: 64 4: 54 5: 50 6: 54 Small fibre assessment 7: 49 8: 60 9: 80 Neuropathy symptoms 10: 60
[95% CI not provided] |
Authors conclude that Neuropad has improved diagnostic performance against corneal nerve fibre length [= reference test 9), underlining the importance of Neuropad as a practical diagnostic test for small fibre neuropathy in patients with diabetes
Authors hypothesize that small fibre neuropathy is an early manifestation of diabetic peripheral neuropathy, and that using large fibre tests such as the NDS, vibration perception threshold and nerve conduction studies, to define ‘neuropathy’ will miss patients with early neuropathy, providing an explanation for the low specificity of the Neuropad in previous studies
Note: this study uses % colour change instead of complete blue-to-pink transition for Neuropad assessment of DNP; authors state ‘reproducibility was good. The coefficient of repeatability for intra- and inter-observer variability was 0.3 and 0.4, respectively’ [details not reported]
Note: an improved specificity is only found for 1 out of 3 small fibre reference tests; study uses multiple reference tests (high risk of bias due to multiple testing); cut-off point used for Neuropad assessment is not stated; selection procedure for participants is unclear (given the high number of T1 patients, these are not consecutive patients ..)
Note: using NDS as reference, Sens is 70% and Spec 50%, in reasonable agreement with Tsapas (2014; Sens 89%, Spec 59% [48-70] )
Place of the index test in the clinical pathway: triage test for screening of diabetic peripheral neuropathy |
|
Casellini 2013
|
DTA; case-control type?
Setting and Country: USA Diabetes center
Source of funding and conflicts of interest: supported by a grant from the manufacturer of Sudoscan; declare ‘no competing financial interests’ |
Inclusion criteria: not mentioned explicitly
83 patients with T1 or T2 DM 60/83 with DPN (72%)
Compared with database of 210 healthy controls (HCs) from Impeto Medical (manufacturer of Sudoscan)
(1) N=83 diabetes patients; (2) N= 210 healthy controls
Important patient characteristics:
(1) 83 diab patients: T1 20/83 (24%) T2 63/83 (76%) Age 54.7±1.6 yrs 38% male
Neuropathy defined by the Toronto criteria TNS>2): DNP 60/83 (72%) PDNP 46/60 = 77% of patients with DNP
(2) 210 HCs: Age 45.4±0.6 yrs 21% male All w/o diabetes or (P)DNP [i.e. these healthy controls were not matched to the diabetes cohort] |
Describe index test and cut-off point(s):
Sudoscan, compared to NIS-LL (Neuropathy Impairment Score—Lower Legs)
Sudoscan: evaluates sweat gland function based on sweat chloride concentrations; two sets of large-area electrodes for hands and feet, connected to computer; measures electrochem skin conductance (ESC).
Patients place their hands and feet on the electrodes and have to stand still for 2–3 min. The device produces ESC results (average scores). Neither special subject preparation nor specially trained medical personnel are required. Reproducibility has been successfully validated in previous studies
Cut-off points: Cut-offs: >60 uS = no dysfunction (60–40 uS = moderate dysfunction, and <40 = severe dysfunction)
[Note: in DTA analysis the maximum value of the Youden’s index was used to select the optimum cut-off point: 77 uS for ESC of the feet]
|
Describe reference test and cut-off point(s):
Neuropathy defined by the Toronto criteria (TNS>2)
Prevalence (%) DNP 60/83 diabetes patients (72%) Painful DNP (PDNP) 46/83 diabetes patients (55%)
[PS. not clear whether DTA analyses were performed on diabetes cohort alone, or combined with HCs: in that case prevalence of DNP would be 20.5%]
[i.e. depending on how analysis was performed, prevalence of neuropathy was extremely high, or quite low] |
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? N (%) Not reported
Reasons for incomplete outcome data described? Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Sudoscan ESC of hands and feet, and NIS-LL: Hands ESC (64 uS cut-off) Feet ESC (77 uS cut-off) NIS-LL (total score; 1.5 cut-off)
Sensitivity (%) Hands ESC: 78.3 Feet ESC: 78.3 NIS-LL: 76.7
Specificity (%) Hands ESC: 85.7 Feet ESC: 92.4 NIS-LL: 85.7
LR+ Hands ESC: 5.48 Feet ESC: 10.28 NIS-LL: 5.37
LR- Hands ESC: 0.25 Feet ESC: 0.23 NIS-LL: 0.27
Test-retest reliability: Feet ESC Tested on 112 HCs Corr coefficient 0.814 (p<0.0001) |
Authors conclude that Sudoscan is a sensitive tool to detect neuropathy in patients with DM; testing is painless, can be conducted in 3 min, and requires no special patient or equipment preparation; administration and result interpretation demand no special training; It is objective, reproducible, and quantitative, requiring no patient cooperation
‘combined with a simple bedside test as the NIS-LL, Sudoscan may increase the effectiveness in detecting neuropathy’ [but note that this combination of tests was not analysed]
Note: not clear how patients with diabetes were selected, and in DTA analysis, the patient cohort may have been combined with unmatched (e.g. 10 yrs younger of age) healthy controls (: a database provided by the manufacturer of Sudoscan); in addition, the cut-off values in DTA analyses were not predefined but chosen based on the Youden’s index
Note: Sudoscan and Neuropad are based on similar principles evaluating sweat gland function and sudomotor dysfunction, which is one of the earliest detectable neurophysiol abnormalities in distal small fiber neuropathies
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of diabetic peripheral neuropathy (although in the Discussion, a combination with the NIS-LL is proposed ..) |
|
Pourhamidi 2014
|
DTA; cohort type
Setting and Country: Pop based prevention program (screening), prim care, Sweden
Source of funding and conflicts of interest: supported by a non-commercial, declare ‘no conflict of interest’ |
Inclusion criteria: consecutive participants; normal glucose tolerance (NGT) or IGT, or T2 diab;, aged 60±1 years
Nov 2004 - April 2007
from pop based Intervention Program; NGT and IGT glucose status confirmed by 2 standardised OGTT
Tot=119 patients NGT, n = 39 IGT, n = 29 T2 diab, n = 51 matched for age and sex
Important patient characteristics: NGT/IGT/T2 Male 49/52/59% Dur diab -/-/7.2y HbA1c 5.4/5.5/7.3% |
Describe index test and cut-off point(s):
A: Vibration thresholds hand-held biothesio-meter at 100 Hz
B: Vibration perception 128 Hz tuning fork applied bilaterally
C: Pressure perception Semmes-Weinstein 5.07/10-g monofilament (Gertab AB, Stockholm,Sweden)
The same physician, who also performed the NDS examinations, performed all of the physical examinations
D: Skin biopsies punch skin biopsy under local anaesthesia using a 3 mm disposable circular needle; microscopical quantification of intraepidermal nerve fibre density by 2 observers blinded to identity of participants
Cut-off points: A: >=24.5V B: ‘no sens at >=1 site’ C: ‘no sens at >=1 site’ D: <=2.96 fibres/mm (DSPN) and <=3.39 fibres/mm (sDSPN)
|
Describe reference test and cut-off point(s):
DSPN = definition Toronto Diabetic Neuropathy (: abnormal nerve conduction study [NCS] and symptom(s) or sign(s) of neuropathy confirms clinical DSPN) but not including subjective symptoms in the definition = having abnormal NCS according to neurophysiologist and objective clinical neuropathic signs (NDS ≥2) [large nerve fiber weighted definition]
sDSPN = normal NCS, but abnormal thermal thresholds (abnormal heat and/or cold thresholds) in presences of clinical signs of neuropathy (NDS ≥2) [small nerve fiber weighed definition]
DSPN=22 patients sDSPN=27 Rest=61 Total N=110 (excl 9 with missing data)
Prevalence (%) NGT: 16% DSPN; 13 sDSPN IGT: 12% DSPN; 32 sDSPN T2: 28% DSPN; 30 sDSPN
Nerve conduction studies Standardized NCS by experienced neurophysiologist, blinded to group allocation; determined abnormal nerve conduction or not
Neuropathy disability score modified version of Dyck’s original NDS; includes examination of sensory perception, muscle strength and reflexes in the lower extremities (light touch (cotton wool), vibration (128 Hz tuning fork), pin prick (needle) and cold (cold metal item)
Thermal threshold tests using Thermotest® equipment (Somedic AB); only individuals with bilaterally abnormal thresholds considered to have abnormal outcome; standard laboratory cut-off values (adjusted for age and sex): 40.6◦C for heat and 26.7◦C for cold perceptions |
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? 9/119=8%
Reasons for incomplete outcome data described? ‘missing NDS or NCS/thermal thresholds’ [reasons not mentioned]
1 NGT, 4 IGT, 4 T2 patients |
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=110 DSPN=22 patients sDSPN=27 patients DSPN+sDSPN=49 patients Rest=61 patients=Control
A: Biothesiometer at 100 Hz B: 128 Hz tuning fork C: Semmes-Weinstein MF D: Skin biopsies
Detecting DSPN Sensitivity (%) A: 18/22 (82%) B: 17/22 (77%) C: not reported (>>DSPN+sDSPN) D: 16/22 (73%) Specificity (%) A: 43/61 (70%) B: 41/61 (67%) C: 59/61 (97%) D: 43/61 (70%)
Detecting sDSPN Sensitivity (%) A: 18/27 (67%) B: 12/27 (44%) C: not reported (>>DSPN+sDSPN) D: 20/27 (74%) Specificity (%) A: 28/61 (46%) B: 41/61 (67%) C: 59/61 (97%) D: 37/61 (61%)
Detecting DSPN+sDSPN Sensitivity (%) A: - B: - C: 3/49 (6%) D:- Specificity (%) A:- B:- C: 59/61 (97%) D:- [for the SW-MF only data for combined detection of DSPN+sDSPN are reported]
Combining methods for DSPN A+D: +2 DSPN cases >>sens 20/22 (91%) B+D: +3 >>sens 20/22 (91%) A+B: +3 >>sens 21/22 (95%) [monofilament in combination with the other methods: no improved sens] [no data on spec]
Combining methods for sDSPN A+D: +4 >>sens 24/27 (89%) B+D: +2 >>sens 22/27 (81%) A+B: +4 >>sens 22/27 (81%) A+B+D: +5 >>sens 25/27 (93%) [monofilament in combination with the other methods: no improved sens] [no data on spec] |
Authors conclude that biothesiometer is a sensitive and specific method for large nerve fibre dysfunction in lower extremity. Combining skin biopsies with routine clinical tools, such as the 128 Hz tuning fork is of greater use when considering less advanced neuropathy (sDSPN) than more advanced large nerve fibre neuropathy (DSPN).
'the diagnostic usefulness of detecting early peripheral neuropathy, especially when NCS are normal, can be increased by combining measures of intraepidermal nerve fibres and vibrotactile sense'
Note: skin biopsy method = minimal invasive method (: minor wound; no complaints were reported by patients); biopsies taken above the foot, thus with less risk of foot ulcers or delayed wound healing >>‘However, whether skin biopsies will become a widespread measure or a useful alternative clinical tool in clinical practice is uncertain’
Note: mixed group of individuals with and w/o diabetes (in particular spec data may be less relevant); multiple testing (2 conditions, 4 index tests, even more combinations of index tests; 3 subgroups of patients ..)
Note: DSPN and sDSPN were also detected in the control group (NGT)
Note: 10-g monofilament was not a suitable method in detection of neuropathy in the lower extremity (cf other studies suggesting that MF is valuable in identification of very high-risk individuals)
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of DSPN and sDSPN (‘large fiber’ and ‘small fiber’ distal sensory poly neuropathy) |
|
Pambianco 2011 |
DTA; cohort type
Setting and Country: Sec care; prosp study childhood onset T1 diab [epidemiologically representative of local type 1 diabetes population]; USA
Pittsburgh Epidemiology of Diabetes Complications (EDC) Study
Source of funding and conflicts of interest: Some diagn tools were provided by manufacturers (NC-stat and Neurometer) |
Inclusion: Type 1 diabetes; <17 years of age at diagnosis; attending the 18 year examin (2004–2006)
195/304 (64%) with available clinical exam data, Vibratron II testing, and NC-stat
[Neurometer analysed in subgroup of 141 participants]
N=195
Important patient characteristics: See paper, specified for cases and noncases Age ~43 yrs Dur diab ~35 yrs Sex ~50% male HbA1c ~7.5% |
Describe index test and cut-off point(s):
A: Vibratory sensory thresholds (Vibratron II) on index finger and great toe; abnormal age-specific vibratory thresholds are >2.39, >2.56, and >2.89 vibration units for ages <35, 36–50, and >50 years
B: NC-stat (NEUROMetrix, Inc.) point-of-care device for standard noninvasive nerve conduction studies by nontechnical personnel; focused on peroneal nerve (motor) and sensory nerve at region of foot and ankle; testing took ~15 min; analysed two ways: >=6 mV or <6 mV (SNAP), and any vs. no response (NCstat sensory)
C: Neurometer R-CPT (Neurotron, Inc.) introduced later and therefore analysed in subgroup; point of care device which stimulates peripheral sensory nerve fibers in great toe at 2000 Hz (Ab fibers), 250 Hz (Ad fibers), and 5 Hz (C fibers); normal range (R-CPT Level, 6–13), hyperesthesia (R-CPT Level, 1–5), and hypoesthesia (R-CPT Level, 14–25).
D: MNSI examination structured clinical assessment of the feet to identify deformities, dry skin, calluses, infection, fissure, or ulcers (foot appearance), and evaluation of ankle reflexes and vibration sensation in the great toe; foot appearance exam by trained study technician and ankle reflexes and vibration sensation by the study physician; score of >=2 considered a positive result
E: Monofilament 10 g SW monofilament; dorsum of the great toe; done ten times for each foot: 8–10 correct responses=normal; 0–7 correct responses =abnormal |
Describe reference test and cut-off point(s):
DSPN = determined by study trained physician using the Diabetes Control and Complications Trial clinical examination protocol: standard clinical history, symptoms (e.g., numbness, dysesthesias, and/or paresthesias, hypersensitivity to touch, burning and/or aching, and stabbing pain in the hands or feet), standard neurological examination (reflex activity, pain [pinprick], vibration [tuning fork, 128 Hz], sensation, and position)
DSP defined as presence of two or more of the following: symptoms, sensory and/or motor signs, and/or absent (or present only with reinforcement) tendon reflexes
DSPN=?? patients Total N=195
Prevalence (%) Not reported
|
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? 36% (only those with complete data included=64% of cohort)
Reasons for incomplete outcome data described? No, but no diff in age, sex, duration of diabetes, between those with complete and those with incomplete data |
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=195 DSPN=?? patients No DSPN=?? patients
A: Vibratron II [age-adjusted] B1: NC-stat SNAP B2: NC-stat Sensory B3: NC-stat Motor C1: Neurometer 2000 Hz C2: Neurometer 250 Hz C3: Neurometer 5 Hz D: MNSI E: Monofilament
Detecting DSPN Sensitivity / Specificity (in %) A: 91 / 26 B1: 79 / 48 B2: 53 / 77 B3: 46 / 76 C1: 71 / 42 C2: 79 / 32 C3: 51 / 61 D: 87 / 49 E: 20 / 98 PPV / NPV (%) A: 49 /78 B1: 54 / 74 B2: 65 / 68 B3: 61 / 64 C1: 50 /65 C2: 48 / 66 C3: 52 / 61 D: 58 / 83 E: 89 / 61 |
Authors conclude that Vibratron II and MNSI showed highest sens for DSP (>87%), whereas monofilament had highest spec (98% DSP) and PPV (89% DSP), but lowest sens (20% DSP); MNSI also had highest NPV (83%) and currently presents the single best combination of sens and spec of DSP in longstanding type 1 diabetes.
Note: study concerns middle-aged patients with early-onset type 1 diabetes
Note: number of patients with DSPN is not reported
Note: MNSI clinical exam is a validated instrument that can be implemented at low cost; non-physician personnel can be trained and certified
Note: monofilament is too insensitive for use as a single screen, but has high specificity and thus may be helpful where identification of only those with a high probability of disease (e.g., an intervention with major side effects) is critical; monofilament is very simple, easy to perform, takes very little time, and is inexpensive
Note: no gender differences noted between the different neuropathy tests, except for NC-stat motor nerve testing (CMAP), where males were significantly more likely to test positive
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of DSPN |
|
Mythili 2010 |
DTA; cohort type
Setting and Country: Sec care (‘hospital-based’); India
Source of funding and conflicts of interest: Non-commercial; declare ‘no conflicts of interest’ |
Inclusion: consecutive T2 diab patients
Exclusion: other causes of neuropathy such as alcoholism, liver or renal disease, toxic exposure, other endocrine, metabolic or nutritional disorders, inflammatory diseases, or monoclonal gammopathy
N=100
Important patient characteristics: Age (range) 52.9 (32-80) yrs Dur diab (range) 6.9 (0-30) yrs Sex 52% male HbA1c 8% Hist foot ulcers 13% |
Describe index test and cut-off point(s):
A: Diabetic neuropathy symptom score (DNS) symptom more times a week during last 2 weeks = yes (1 point) or ‘no’ (no point): unsteadiness in walking? burning, aching pain or tenderness of your legs or feet? pricking sensations at your legs and feet? places of numbness on your legs or feet? >>1-4 points = PNP present (PNP = Polyneuropathy)
B: Diabetic neuropathy examination score (DNE) neurological examination >>signs scored on DNE score (: modification of Neuropathy Disability Score of Dyck); 8 items, 2 on muscle strength, 1 on tendon reflex, and 5 on sensations; score >3 points = abnormal
C: Monofil (SW-MF) 10 g SW monofilament; plantar surface of the hallux and centrally at the heel; done 6 times for each foot: 1 or more incorrect=abnormal
D: Vibration perception threshold (VPT) hand-held biothesio-meter; average of 6 areas on plantar aspect of both feet; >15 V= neuropathy
|
Describe reference test and cut-off point(s):
Nerve conduction studies NCS) conventional sensory and motor nerve conduction studies; median, ulnar, common peroneal, tibial and sural nerves
DSPN= 71 patients Total N=100
Prevalence (%) 71/100 (71%)
[90% among patients with diabetes duration of >10 yrs; 63% among patients with diabetes duration <10 yrs]
|
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? 36% (only those with complete data included=64% of cohort)
Reasons for incomplete outcome data described? No, but no diff in age, sex, duration of diabetes, between those with complete and those with incomplete data |
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=100 DSPN=71 patients No DSPN=29 patients
A: DNS B: DNE C: monofilament (SW-MF) D: VPT
Detecting DPN Sensitivity / Specificity (in %) A: not reported B: 83 / 79 C: 95.8 / 55 [sens was reported wrongly as 98.5] D: 86 / 76 PPV / NPV (%) A: not reported B: 91 / 34 C: 84 / 31 D: 90 / 16
Subtypes of neuropathy based on NCS Distal sensory neuropathy (11%); Distal sensorimotor neuropathy (54%); Distal motor neuropathy (3%); Mononeuropathy (2%); Asymmetrical (1%); Entrapment neuropathies [CTS] (44%) |
Authors conclude that a simple neurological examination score (DNE) is as good as VPT in evaluation of polyneuropathy in a diabetic clinic >. ‘It may be a better screening tool for diagnosis of diabetic polyneuropathy in view of the cost effectiveness and ease of applicability’; monofilament examination, though highly sensitive, was less specific in diagnosing DPN
Note: the sens of monofilament is not calculated correctly, the correct sens is 95.8% (reported as 98.5%)
Note: relatively low spec monofilament (55%) >>‘different areas chosen in various studies, some patients had thicker soles, there are no guidelines for application of monofilaments, filaments that are available need to be standardized’
Note: relatively high prevalence of DPN (71%); ‘may be due to selection of patients from the specialty diabetes mellitus clinic who were more symptomatic and tended to have more complications’
Note: selective outcome reporting >>results for the DNS were not reported: ‘DNS was highly sensitive … However, since many of the patients included in the study were severely affected they were more likely to have symptoms. Accordingly, the symptom scores were not analysed further’
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of DPN in hospital-based T2 population |
|
Kanji 2010
[individual study characteristics deduced from Kanji 2010]
|
SR [no meta-analysis]
Literature search up to Nov 2009 DTA studies A: Beghi 1988 B: Gentile 1995 C: Shin 2000 D: Perkins 2001 E: Lee 2003 F: Hsu 2005 G: Moghtader 2006 H: Costa 2006 I: Papanas 2007 Studies on precision J: Smija 1999 K: Maser 1989 L: O’Neill 2006
Study design: both cohort, and case-control type of DTA were included
Setting and Country: Not reported in SR
Source of funding and conflicts of interest: SR was not supported by external funds; one author reports honoraria fees from several pharmaceutical companies |
Inclusion criteria SR: English language articles on accuracy or precision of bedside screening for peripheral neuropathy in diabetes patients
Exclusion criteria SR: studies not using nerve conduction testing as gold standard
9 studies on DTA, 3 studies on precision
Important patient characteristics: Diab T1/T2 A:? total 48 B: 6/198 C:? total 126 D: 65/361 +52 reference partic E: 0/37 F: 0/112 G: 0/176 H: 0/80 +45 controls I: 0/120
>>7/9 DTA studies with (almost) only T2 patients (2/9 studies with unknown diab type) |
Describe index test and cut-off point(s):
A: Components of physical examination; Overall clinical examination; Deep tendon reflexes; Sensation Symptoms B: Symptom questionnaire Neurologic examination C: SWMF D: SWMF; Superficial pain; Vibration (on-off) Vibration (timed) E: SWMF F: Neurological Symptom Score G: Michigan Neuropathy Screening Instrument H: Ability to walk on heels 5-Test Score I: Neuropathy Disability Score
Questionnaire on Symptoms of Neuropathy (Italian Society of Diabetology) 10 items: tingling, numbness, or heaviness in your hands or legs? burning, stabbing pain, pains, or cramps in your legs or arms? as if you were walking on foam or cotton wool or unable to feel unevenness (roughness) of ground while walking? unable to feel pain of burning or a cut?weakness in your legs while climbing or descending stairs? faint or dizzy on rising from bed? difficulty in starting to urinate or loss of control of bladder function? diarrhea, particularly in the night? sweat abundantly from your face only? difficulty in maintaining an erection? (Men only); each item 0=no, 1=sometimes, and 2=often; positive result if sum of scores >4 (must include a score of 2 for at least 1 of questions 3, 4, 9, or 10).
Neuropathy Disability Score (NDS) Vibration perception with 128-Hz tuning fork; Temperature perception using tuning fork with beaker of ice/warm water; Pinprick; Achilles reflex
Michigan Neuropathy Screening Instrument (MNSI) Appearance of feet; Ulceration; Ankle reflexes; Vibration perception |
Describe reference test and cut-off point(s):
Nerve conduction study (NCS) = gold standard
Prevalence (%) [based on gold standard] A: 28/48 (58%) B: 47/204 (23%) C:67/126 (53%) D: 336/426 (79%) E: 29/37 (78%) F: 30/112 (27%) G: 68/176 (39%) H: 60/80 (75%) I: 92/120 (77%)
Number of participants A: 48 B: 204 C:126 D: 426 diab (+52 ref) E: 37 F: 112 G: 176 H: 80 diab (+45 controls) I: 120
|
Endpoint of follow-up: cross-sectional studies
For how many participants were no complete outcome data available? [not reported in the SR]
Reasons for incomplete outcome data described? [not reported in the SR]
|
Outcome measures and effect size (include 95%CI and p-value if available):
(1) Symptoms of LFPN in patients with diabetes Sens/Spec/LR+/LR- (95%CI) B: Italian screening questionnaire 85 (72-94) 79 (72-85) 4.0 (2.9-5.6) 0.19 (0.10-0.38) F: Neurological Symptom Score 73 (54-87) 30 (21-42) 1.0 (0.81-1.4) 0.90 (0.46-1.7) A: Any single symptom 75 (55-89) 25 (9-49) 1.0 (0.72-1.4) 1.0 (0.37-2.7) [any single symptom: Muscle cramps, burning feet, restless legs, muscle pain, trouble with object handling, impairment of standing and gait, or distal paresthesias]
(2) Physical examination manoeuvres for LPFN in patients with diabetes (‘Signs of LFPN’)
(2A) Individual components of clinical neurologic examination D: 128Hz tuning fork LR+ __On-off >=5 of 8 LR+ 35 (5.0-252) 2-4 of 8 LR+ 3.9 (2.0-7.5) <=1 of 8 LR+ 0.51 (0.45-0.57) __Timed, per toe >20 sec LR+ 16 (5.3-51) 11-20 sec LR+ 1.1 (0.89-1.5) <=10 sec LR+ 0.33 (0.26-0.43)
Sens/Spec/LR+/LR- (95%CI)
E/C/D: SW monofilament E: 93 (77-99) 100 (63-100) 16 (1.1-244) 0.09 (0.03-0.29) C: 57 (44-69) 95 (86-99) 11 (3.61-341) 0.46 (0.35-0.60) D: >=5 of 8 LR+ 11 (4.6-26) 2-4 of 8 LR+ 1.3 (0.94-1.7) <+1 of 8 LR+ 0.54 (0.46-0.64)
H: Inability to walk on heels 25 (16-37) 98 (86-100) 11 (0.67-171) 0.76 (0.65-0.90) A: Deep tendon reflexes 71 (51-86) 80 (56-93) 3.6 (1.4-8.8) 0.36 (0.19-0.66)
(2B) Combinations of findings B: Neurologic examination 94 (83-99) 92 (87-96) 12 (7.1-211) 0.07 (0.02-0.21) I: Neuropathy Disability Score 85 (76-91) 82 (64-92) 4.7 (2.1-11) 0.19 (0.11-0.31) H: 5-Test Score >=3 22 (12-33) 94 (68-99) 3.9 (0.25-60) 0.83 (0.68-1.0) G: MNSI (cutpoint>=2) 65 (53-76) 83 (74-89) 3.8 (2.5-6.1) 0.42 (0.30-0.58) A: Clinical examination 75 (55-89) 70 (46-88) 2.5 (1.2-5.0) 0.83 (0.64-1.1) |
Authors conclude that physical examination is most useful in evaluating for LFPN in patients with diabetes; abnormal results on monofilament testing and vibratory perception (alone or in combination with the appearance of the feet, ulceration, and ankle reflexes = MNSI) are the most helpful signs [note that these conclusions are based on a comparison of LR+ between the diagnostic tools]
Place of the index test in the clinical pathway: triage test for screening for [large-fiber] peripheral neuropathy
Note that nerve conduction testing (NCT) is considered the most objective, sensitive, and reliable measure of large-fiber peripheral nerve Function, and that ‘Use of NCT as reference standard selects out patients with small fiber peripheral neuropathy, which generally has normal test results’
Precision / reproducibility: eliciting symptoms of LFPN on history taking had, at best, fair to moderate overall precision (kappa=0.26-0.57), with “paresthesias” having the best interobserver agreement (0.57); all physical examination manoeuvres in had similar precision (kappa =0.26-0.59), with vibration testing, ankle jerk, and monofilament testing having best reproducibility
Note: overall, internists were more apt to diagnose a patient as having clinical neuropathy than were neurologists (37% vs 25%)
Study quality (ROB): using JAMA Rational Clinical Examination criteria (Butalia 2008; JAMA) •Level I: independent, blind comparison of test results with gold standard among >=30 consecutive patients with suspected target condition •Level II: idem among <30 consecutive patients •Level III: idem among non-consecutive patients •Level IV: non-independent comparison among “grab” sample of patients •Level V: non-independent comparison with standard of uncertain validity >>Level-I (G,I), level-III (A,D,E), level-IV (B,C,F,H,); i.e. only 2/9 high quality studies (G,I); consecutive patients (B,G,H,I), non-consecutive (A), both (D), unknown (C,E,F)
Heterogeneity: meta-analyses not performed; for most diagnostic tools only one study was included (3 studies for SW-MF but using different protocols i.e. with high clinical heterogeneity)
Publication bias: cannot be evaluated (low number of studies per type of diagn test) |
|
Jurado 2009 |
DTA; cohort type (random sample)
Setting and Country: Prim care; Spain
Source of funding and conflicts of interest: Non-commercial; statement on potential conflicts of interest is lacking |
Inclusion: random sample of T2 diab patients in prim care setting; age 30-69 yrs
Nov 2003 – Nov 2004
Exclusion: Neuropathies of other aetiology; alcohol >60g/d in women and ≥80g/d in men; previous foot ulcers; refused consent
Random sample of 400; 307 met incl criteria
N=307
Important patient characteristics: Age (range) 59.6 (30–70) yrs Dur diab (range) 8.6 (1–44) yrs Sex 62% male HbA1c 7.0± 1.4% HDL-C 1.39± 0.33 LDL-C 3.26± 0.90 BMI 30.0 ± 4.7 Diab retinopathy 17.3%
|
Describe index test and cut-off point(s):
DPN selection method set of 4 clinical parameters / predicting variables identified by logistic regression analysis related to presence of DPN; using step-forward method (removal based on likelihood ratio; α = 0·05) >>Age, HbA1c, HDL-C, Retinopathy
Sens and spec analysed by ROC analysis
|
Describe reference test and cut-off point(s):
Clinical Neurological Examination (CNE) bilateral signs and symptoms: >=2 signs [VPT, SW-MF, Achilles reflex] or 1 sign plus 2 symptoms [sensitivity alterations, pain perception and decrease in muscle strength (≥3 points in NSS reduced scale) [High NSS scores considered indicative of DPN only in conjunction with alteration of >=1 major sign]
Neuropathy symptoms modified NSS scale (patients questioned about muscular cramps, numbness, abnormal hot or cold sensations, tingling sensations, burning pain, and irritation from bed clothes in lower legs and feet, and whether manoeuvres could reduce the symptoms)
Neuropathy signs (1) VPT evaluated by Quantitative tuning fork (Rydel-Seiffer) at dorsum of great toe; value <4db considered major neuropathy; (2) Neurothesiometer (HORWELL); both feet on pulp of great toe; >18V and <25V considered DPN in presence of other important sign; ≥25V diagnostic of DPN in conjunction with symptoms or other altered sign; (3) Muscle strength and reflexes (MDNS); (4) SW-MF 5·07/10-gr; applied to dorsum of great toe (MDNS criteria), and applied according to Olmos criteria; (5) Superficial pain sensation applying neurological examination pin (Neurotips) on dorsum of both great toes; (6) Temperature perception by placing a cold tuning fork on dorsal foot according to Young
Prevalence (%) Based on CNE 71/307 = 23.1% [21.7% in men, 25.4% in women] |
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? None?
|
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=307 DPN=71 patients No DPN=236 patients
Detecting DPN DPN selection method (4 variables) Sensitivity / Specificity (in %) 74.2 / 74.9 PPV / NPV (%) 47.6 / 90.4 AUC = 0.813
[below additional calculations based on estimated 2x2 table] Sens 0.75 [0.63;0.84] Spec 0.75 [0.69;0.80] PPV 0.47 [0.38;0.57] NPV 0.91 [0.06;0.14] LR+ 2.99 [2.30;3.87] LR- 0.33 [0.23;0.51]
|
Authors conclude that DPN Selection Method is a useful tool in primary care settings in the evaluation and diagnosis of DPN; ‘but does not substitute individual CNE of each patient, which is paramount in the assessment of DPN according to all consensuses’
‘could be a significant contribution to the early screening, providing a sensitive method to identify patients at high risk for DPN presence at primary care level’
Note: index test = prediction rule, which was developed and tested in the same study population (high risk of bias)
Note: ‘obese T2DM patients in their late 50s’; random sample T2 DM patients, method not stated
Note: CNE tested against more established gold standard NCS >>subset of 50 patients; median and ulnar nerves for upper extremities and peroneal and tibial nerves for lower extremities; sensory and motor nerve conduction velocities) >>significant corr, r = 0·88 (P <0·0005)
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of DPN in primary care T2 population |
|
Singleton 2008 |
DTA; cohort type (‘mixed’)
Setting and Country: Mixed prim and sec care; USA
Source of funding and conflicts of interest: Non-commercial; statement on potential conflicts of interest is lacking |
Inclusion: N=215 subjects with diabetes or prediabetes (ADA criteria) from 2 NIH studies: (1) Impaired Glucose Tolerance Neuropathy (IGTN) study: 69 IGTN subjects presenting to endocrin or neurol clinics at univ hospitals, mostly for evaluation of otherwise idiopathic polyneuropathy and subsequently discovered to have IGT; all IGTN subjects had clinically evident peripheral neuropathy at time of study enrolment
(2) Cutaneous Measures of Neuropathy in Diabetes (CMND) study: 146 random subjects with diabetes, with or without early neuropathy, from a large community-based primary care network
Exclusion: advanced neuropathy (symptoms >5 years); common alternative causes of neuropathy; family hist neuropathy (indep of diab); disease known to be associated with neuropathy
N=215 total Neurop=86 No Neurop=129
Important patient characteristics: Neur/No Neur Age (mean) 55.5/57.8 Sex % female 50.0/54.2 BMI 32.4/34.8 UENS 1.39/9.24 MDNS 0.83/6.62 NIS-LL 0.91/7.23 Pain (VAS; mm) 6.3/24.2
|
Describe index test and cut-off point(s):
A: Utah Early Neuropathy Scale (UENS) number-2 safety pin and a 128 Hz tuning fork; first normal sharp sensation is assessed, next 2 points scored for each region in which patient fails to feel any sharpness, 1 additional point for each additional region in which the pin feels less sharp than expected; Vibration tested by holding maximally vibrated tuning fork to dorsum of great toe, extinction of vibration in <10s considered ‘diminished’ while ‘absent’ = cannot detect; motor examination is limited to great toe dorsiflexion; other aspects as typically performed in neurol exam; 24 of 42 points in UENS are devoted to a brief anatomical mapping of sensory loss to pin in foot / lower leg [cut-off not reported]
B: Michigan Diabetes Neuropathy Scale (MDNS) 40-point examination scale: strength in finger spread, great toe extension, and foot dorsiflexion; deep tendon reflexes at biceps, triceps, patella, and Achilles; sensation tested with vibration, 10 g MF pressure, and pin sensation at great toe; cut-off MNDS >=6 for neuropathy
C: Neuropathy Impairment Score - Lower Limb (NIS-LL) strength for ankle and toe flexion; reflexes at knee and ankle; sensation at distal joint of great toe tested with touch pressure, pin sensation, vibration, and joint position; total max 56 (32 motor, 8 reflex, 16 sensory); ‘no specific diagnostic threshold for neuropathy has been set’ [cut-off not reported]
All patients had same symptom questionnaires, focused physical exam scales, nerve conduction studies (NCS), skin biopsy for intraepidermal nerve fiber density (IENFD) determination, quantitative sudomotor axon reflex testing (QSART), and quantitative sensory testing (QST) |
Describe reference test and cut-off point(s):
Ref for Polyneuropathy (PN) = symptoms of neuropathy confirmed by abnormalities of at least 2 confirmatory electrodiagnostic, electrophysiological, or histological tests (NCS, QST, QSART, skin biopsies); reports of persistent numbness or paresthesias developing symmetrically in the feet, and progression from distal to proximal involvement were required historical elements
Examination signs were specifically excluded from the neuropathy threshold definition because of concern for a self-referential bias in comparing examination scales
NCS: left sural sensory and peroneal motor responses; abnormal if one or more of: low-amplitude sural sensory nerve action potential, low-amplitude peroneal compound motor action potential, or slowed peroneal conduction velocity from distal to the fibular head to ankle.
QST for vibration and cold detection thresholds: at foot using CASE IV machine
QSART: sweat production in response to iontophoresed acetylcholine; QSweat machine
3-mm punch skin biopsies: from ankle and proximal thigh; stained and examined microscopically to calculate IENFD
Total N=215 Neurop=86
Prevalence (%) 86/215 (40%)
|
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? None?
|
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=215 total PN=86 No PN=129
A: UENS B: MDNS C: NIS-LL
Detecting PN Sensitivity / Specificity (in %) A: 92 / not reported B: 67 / not reported C: 81 / not reported [Spec of A/B/C reported to be similar] [cut-off values for UENS and NIS-LL not reported]
PPV / NPV (%) not reported
AUC (ROC) A: 0.88 [0.81;0.94] B: 0.77 [0.72;0.86] C: 0.82 [0.74;0.87]
‘ROC curves demonstrate greater sensitivity and specificity for the UENS throughout its score. These differences do not reach statistical significance’
interrater reliability of UENS performed on sequential days by 2 separate blinded physician examiners for 20 subjects with peripheral neuropathy >>interrater reliability of 94% |
Authors conclude that UENS had a superior profile to receiver operating characteristic analysis across a range of scores, with a sensitivity (92%) higher than MDNS (67%) or NIS-LL (81%), without sacrificing specificity. UENS more closely correlated with change in ancillary and small-fiber neuropathy measures over 1 year follow-up than did MDNS or NIS-LL
'UENS is a sensitive and reproducible clinical measure of sensory and small-fiber nerve injury and may be useful in trials of early neuropathy'
Note: cut-off values not reported (only ROC shown and AUC data provided); sensitivities are mentioned (percentage w/o CI) but specificities only reported to be similar between A/B/C; differences between tests are not statistically significant
Note: Compared with other scales, the UENS emphasizes severity and spatial distribution of pin (sharp) sensation loss in the foot and leg and focuses less on motor weakness; ‘UENS is a physical examination scale specific to early sensory predominant polyneuropathy’ [small fiber]
Note: UENS takes about 3 min
Note: UENS is designed to be sensitive to the changes in anatomic distribution common to sensory loss early in neuropathy progression >>‘the UENS would not be appropriate to the evaluation of neuropathies with prominent weakness (acute inflammatory demyelinating polyradiculoneuropathy) or in those with more severe disease (advanced diabetic neuropathy)’
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of ‘early sensory predominant [small fiber] neuropathy in mixed primary/secondary care population of subjects with diabetes or prediabetes |
|
Jurado 2007 |
DTA; cohort type
Setting and Country: prim care; Spain
Source of funding and conflicts of interest: Non-commercial; statement on potential conflicts of interest is lacking |
Inclusion: T2DM (WHO criteria)
Random sample from T2DM prim care population
Exclusion: neuropathies of other etiology, high alcohol ingestion (>60 g/d [women] and >80 g/d [men]), previous foot ulcers, and refusal to give consent
random sample, N=400; N=305 meeting criteria
Important patient characteristics: No details provided Age ‘between 30-69 yrs’
reference sample of 290 subjects w/o diabetes or neuropathy as a control group [only to determine cut-offs for index tests?] |
Describe index test and cut-off point(s):
A: Vibration Perception Thresholds (VPT) 2 methods: (A1) Neurothesiometer (HORWELL); >18 V (99th percentile in control group) considered abnormal (=DPN); (A2) Quantitative tuning fork (Rydel-Seiffer AB-125 c64/c128) according to Liniger (1990); <5 mgHz (5th percentile in control group) considered abnormal
B: Tactile sensitivity (SW-MF) SW-MF 5.07/10 g (Sensifil), using (B1) Olmos technique; or (B2) MDNS criteria
‘study was performed by 12 general practitioners and 16 nurses. Clinical parameters, symptoms, and signs were evaluated by two observers’ [..] |
Describe reference test and cut-off point(s):
Ref for Diabetic Polyneuropathy (DPN) = Clinical neurologic examination based on 3 categories of San Antonio Consensus for DPN diagnosis: (1) Neuropathic symptoms assessed by modified Neuropathy Symptom Score; (2) Physical examination (muscle strength, reflexes) according to Michigan Diabetic Neuropathy Score (MDNS), Superficial pain sensation (Neurotips), Temperature perception using cold tuning fork; (3) Semiquantitative and quantitative sensory tests: VPTs using Neurothesiometer (HORWELL), Quantitative tuning fork (Rydel-Seiffer AB-125 c64/c128), and Tactile sensitivity SW-MF (Olmos technique and MDNS criteria)
Total N=305 DPN=71
Prevalence (%) 71/305 (23.2%)
|
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? None? [21 patients in the random sample of 400 T2DM patients were ‘lost to followup’]
|
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=305 total PN=71 No PN=234
A1: VPT-neurothesiometer NTS A2: VPT-quant tuning fork QTF B1: SW-MF Olmos technique B2: SW-MF MDNS criteria
Detecting DPN Sensitivity / Specificity (in %) A1: 43.7/94.7 A2: 52.1/94.5 B1: 28.2/95.8 B2: 42.3/97.9 [cut-off values for UENS and NIS-LL not reported]
PPV / NPV (%) A1: 72.1/84.4 A2: 74.0/86.7 B1: 66.7/81.6 B2: 85.7/84.2
LR+ / LR- A1: 8.3/0.59 A2: 9.4/0.50 B1: 6.6/0.75 B2:19.9/0.59
AUC (ROC) Not reported
Reproducibility (CCI) Inter/intra-observer A1: 0.944/0.975 A2: 0.893/ 0.950 B1: constant/constant B2: 0.911/0.972 [methods are not described] |
Authors conclude that VPTs (neurothesiometer and quantitative tuning fork) and SW-MF (Olmos and MDNS criteria) presented high specificity and low sensitivity for DPN diagnosis in primary care settings. However, high sensitivity, rather than high specificity, should be the objective.
‘As assessments of large fiber function, the tuning fork, neurothesiometer, and MF are unable to measure small fiber dysfunction, muscle weakness, or symptoms that our gold standard assesses; a considerable number of patients who had DPN were not diagnosed with the isolated use of these techniques’
Note: patient characteristics are not described (but reported to be representative of the local T2DM prim care population); methods only briefly described (e.g. not clear how reproducibility was exactly determined, no details on blinding, not clear who applied the gold standard)
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of DPN in primary care population of subjects with T2DM |
|
Kästenbauer 2004
|
DTA; cohort type
Setting and Country: sec care; Austria
Source of funding and conflicts of interest: Grant of Austrian National Bank; statement on potential conflicts of interest is lacking |
Inclusion: consecutive diabetic patients visiting diabetes centre April 1999-March 2000 for annual diabetes check
N= 2022
Exclusion: None?
Important patient characteristics: Norm/abnorm VPT (RS tuning fork)
Number patients 1917/105 Gender %F 45.0/32.4 Age 56.7/64.7 BMI 27.0/27.4 DM Type 1 35.2/22.9 Diab dur 14.7/20.0 HbA1c % 8.1/8.4
To define normal values for tuning fork, 175 non-diabetic subjects investigated |
Describe index test and cut-off point(s):
(A) VPT by tuning fork at pulp of both big toes in supine position, using 128-Hz Rydel-Seiffer tuning fork; if patient could no longer feel the vibration, vibration was determined on the 9-point grading scale (0/8–8/8) of tuning fork; 5th percentile of VPT in non-diabetic control subjects used as cut-off (4.0/8 for <61 yrs, and 2.5/8 for >61 yrs)
|
Describe reference test and cut-off point(s):
2 reference tests
(1) Peripheral nerve dysfunction (DPN) = ‘abnormal bedside tests’ = abnormal Achilles tendon reflexes + abnormal monofilament
(2) Symptomatic neuropathy = peripheral nerve dysfunction (see above) + >=3 neuropathic symptoms
Total N=2022 DPN= 128 Symptom. DPN= 104
Prevalence (%) 128/2022 (6.3%)
Symptoms of diabetic neuropathy questionnaire Feldman (1994): >= 3 symptoms = patients has neuropathic symptoms
Sensorimotor nerve function; 4 bedside tests: (1) SW-MF 5.07 (10 g) monofilament (Gillis) applied to nine non-callused sites of both feet; If subject could not feel pressure at >2 sites per foot, test considered abnormal (2) Achilles tendon reflexes investigated with standard reflex hammer; abnormal when no reflex seen in one or both extremities (3) VPT by tuning fork (see index test; not part of reference ..) (4) VPT neurothesiometer (not part of reference) electronic neurothesio-meter (Horwell); vibration gradually increased until patient reported perception |
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? None?
|
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=2022 total DPN=128 [104 symptomatic] No DPN=1894
A: VPT RS Tuning fork
2 reference tests (1) DPN (2) symptomatic DPN
(1) Detecting DPN Sensitivity / Specificity (in %) 96/45% PPV / NPV (%) 97%/not reported
(2) Detecting symptomatic DPN Sensitivity / Specificity (in %) 97/42% PPV / NPV (%) 97%/not reported
Reproducibility coefficient of variance (CV) interobserver neurothesiometer 13.2% tuning fork 4.2% [between an experienced and inexperienced investigator?]
intra-observer inexperienced investigator neurothesiometer 18.2% tuning fork 3.2% experienced investigator neurothesiometer 11.2% tuning fork 2.6% [methods are poorly described]
Associations between tests Categorized Normal/Abnorm VPT based on RS tuning fork (= 1917/105 patients) Absent Ach tend reflex 24.8/68.6% Abnormal SW-MF 7.2/66.7% Neuropathic symptoms (>=3) 31.9/86.7% Abnormal bedside tests % 4.2/44.8 Symptomatic neuropathy % 3.0/41.9 VPT neurothesiometer Volt 12.5/32.0 V |
Authors conclude that a tuning fork reliably detected peripheral neuropathy in comparison with the neurothesiometer: a tuning fork is a useful screening test for diabetic neuropathy [but note that test accuracy of neurothesiometer was not reported]
‘use of a graduated tuning fork is superior to standard tuning forks and comparable to a neurothesiometer’
Note: very low prevalence of DPN (based on abnormal bedside tests); paper reports high PPV but this is not supported by calculations (see below)
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of DPN in diabetic population during annual diabetes check in diabetes clinic (secundary care)
Note: extra calculations based on estimated 2X2 table for detecting DPN
Test/Condition +/- 1042 +/+ 123 -/- 852 -/+ 5
Sens 0.96[0.91;0.99] Spec 0.45[0.43;0.47] PPV 0.11[0.088;0.125] NPV 0.99[0.986;0.998] LR+ 1.75[1.66;1.84] LR- 0.09[0.04;0.21]
>>calculated sens and spec are in agreement with reported sens and spec, but PPV is only 11% (reported to be 97%) |
|
Viswanathan 2002
|
DTA; cohort type
Setting and Country: sec care (referral centre for diabetes); India
Source of funding and conflicts of interest: Not reported |
Inclusion: consecutive patients at foot department for routine screening for neuropathy
Exclusion: None?
N=910
Important patient characteristics: M/F 628/282 mean age 53.7 mean dur diab 9.7 yrs |
Describe index test and cut-off point(s):
(A) Temp perception Tip-therm 2 flat surfaces placed on tip of patient’s great toe at irregular intervals and patient asked whether it feels cold or not so cold; air conditioned room with a temperature range of 20–23°C; 'only if correct answers are given it is presumed that patient’s temperature perception is functioning satisfactorily'
>=1 incorrect answer considered abnormal? [not stated explicitly in the text] |
Describe reference test and cut-off point(s):
2 reference tests (1) Vibration perception threshold (VPT) - Biothesiometry 3 readings from each foot on first metatarsal; VPT>25 V considered significant neuropathy (2) SW-MF (10 g) a new monofilament (Gills W Long) used only for this study; applied to >= 5 sites on foot; not detected by patient on >= 3 out of 5 times considered abnormal
Total N=910 DPN-Ref-1: = 298 DPN-Ref-2: = 241
Prevalence (%) 298/910 (32.7%) 241/910 (26.5%) |
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? None?
|
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=2022 total DPN=128 [104 symptomatic] No DPN=1894
A: Tip-therm (temp perception)
2 reference tests (1) biothesiometer (VPT) (2) SW-MF (pressure perc)
(1) Detecting DPN (Ref-1) Sensitivity / Specificity (in %) Sens 290/298 (97.3%) Spec 612/612 (100%)
[additional calculations based on 2x2 table] Test/Condition +/- 0 +/+ 290 -/- 612 -/+ 8
Sens 0.97[0.95;0.99] Spec 1.0[0.99;1.0] PPV 1.0[0.98;1.0] NPV 0.99[0.97;0.99] LR+ infinity LR- 0.03[0.01;0.05]
(2) Detecting DPN (Ref-2) Sensitivity / Specificity (in %) Sens 237/241 (98.3%) Spec 616/669 (92.1%) |
Authors conclude that Tip-therm appears to be an inexpensive, highly sensitive, and specific device for detection of diabetic neuropathy when compared with biothesiometry and a monofilament
Note: ‘gold standard’ is questionable
Note: relatively old study (2002) performed in India (setting may be less relevant to situation in NL: indirectness)
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of DPN in patients with diabetes referred to referral centre for diabetes (secundary care)
|
|
Perkins 2001
|
DTA; cohort type (‘mixed’)
Setting and Country: sec care; Canada
Source of funding and conflicts of interest: statement on source of funding, and potential conflicts of interest is lacking |
Inclusion: 'mixed' cohort 4 sources: unselected patients at diabetes clinic with unknown neuropathy status, patients referred to Diabetic Neuropathy Research Clinic for suspected neuropathy, people with diabetes and unknown neuropathy status recruited through advertisements, and ‘reference subjects’
June 1998-Aug 1999
Exclusion: neuropathy of other etiologies
Clinical stratification to ensure broad spectrum neuropathy severity; based on 6 symptom scores, 8 reflex scores and 5 physical exam scores (pinprick, temperature, light touch, vibration, position sense (max score 19): <=5 = no neurop 6–8 = mild 9–11 = moderate >=12 = severe
>>5 strata (S1-5) S1 (ref subjects) S2 (no neurop) S3 (mild) S4 (moderate) S5 (severe)
N total = 478 Strata as % total S1 11% S2 17% S3 20% S4 23% S5 30%
Important patient characteristics: S1/S2/S3/S4/S5 Sex (% male) 46/68/65/75/65 Age (yrs) 37/51/56/57/57 T1 diabetes 0/19/13/13/20 Diab dur (yrs) 0/9/11/13/15 HbA1c (%) 5.5/8.3/8.1/8.0/8.7 Neurop dur (yrs) 0/0/2.9/4.2/5.1 Footulc hist (%) 0/0/9/27/64 |
Describe index test and cut-off point(s):
(A) Monofilament (SWMF) 5.07/10-g applied to non-callused site dorsum first toe proximal to nail bed; repeated 4-times on both feet; result defined as number of times not perceived; max score = 8
(B) Vibr test (on-off) 128-Hz tuning fork applied to bony prominence bilaterally at dorsum of first toe proximal to nail bed; patient asked to report perception of start and cessation of vibration; conducted twice on each toe; result defined as number of times not felt; max score = 8
(C) Vibr test (timed method) 128-Hz tuning fork as above; patient asked to report time at which vibration diminished beyond perception; compared to examiner’s perception on own thumb
(D) Superficial pain (Neurotip) Neurotip applied 4-times (as for SWME); result defined as total number not perceived; max score = 8
Cut-off values: Tests A,B,D: >= 5 out of 8 attempts insensate defined as abnormal test
Tests A,B,D: <=15 out of 8 attempts insensate defined as normal test
Test C: abnormal defined as persistence of vibration is >20 s per toe; and normal is <= 10 s per toe
[Note: different cut-off values used for abnormal versus normal test result!] |
Describe reference test and cut-off point(s):
Nerve Conduct Study (NCS) latencies, distances, amplitudes; motor and sensory nerves (score 0 normal, and 1 abnormal; taking mean reference values ± 2 SD as normal range); max NCS score (all parameters abnormal) 28 points (16 motor and 12 sensory); abnormal defined as >= 3 abnormal parameters
Total N=478 DPN= 372
Prevalence (%) Overall 372/478 (78%) S1-5: 8/62/83/93/98 %
|
Endpoint of follow-up: Cross-sectional
For how many participants were no complete outcome data available? None?
|
Outcome measures and effect size (include 95%CI and p-value if available):
Total N=478 DPN= 372
(A) SWME (monofilament) (B) Vibration (on-off) (C) Vibration (timed) (D) Pain (Neurotip)
DTA characteristics See index tests for details on cut-off values; note that different cut-off values were used for ‘abnormal’ and ‘normal’ results
Interobserver variability assessed by triplicate independent blinded testing in a subset of >= 10 subjects assessed by 3 different examiners
Detecting DPN
AUC (A) 0.72 (B) 0.73 (C) 0.70 (D) 0.70
Specificity and LR+ ‘abnormal test’ (see index tests) (A) 96% / 10.2 (B) 99% / 26.6 (C) 98% / 18.5 (D) 97% / 9.2 [Sensitivity estimated [see Note]: (A) 41% (B) 27% (C) 37% (D) 28%
Specificity and LR+ ‘normal test’ (see index tests) (A) 77% / 0.34 (B) 53% / 0.51 (C) 80% / 0.33 (D) 59% / 0.50 [Sensitivity estimated [see Note]: (A) 68% (B) 92% (C) 61% (D) 82%
Interobserver variability P values for Kruskal-Wallis test (A) 0.7391 (B) 0.6814 (C) 0.9925 (D) 0.9928 |
Authors conclude that annual screening for diabetic neuropathy should be conducted using superficial pain sensation testing, SWME, or vibration testing by the on-off method
Note: paper claims study population to be an inception cohort, but patients are recruited from 4 different sources and not a common time / stage in the disease; study population is a mixture of ‘reference subjects’ without diabetes, with patients with diabetes having no, mild, moderate or severe neuropathy; not representative of any primary of secundary care patient population; prevalence of DPN (based on NCS) is very high (78%)
Note: different cut-offs were used for the reported values of specificity versus sensitivity, and for LR+ versus LR-; the lacking data can be calculated using: LR+ = sens / (1 – spec) Sens=LR+ X (1-spec) and LR- = (1 - sens) / spec Spec=(1-sens)/LR- (see evidence table)
Note: clinical strata do not match DPN diagnosis based on NCS (gold standard), e.g. stratum-2 (‘no neuropathy’) has 62% DPN based on NCS
Place of the index test in the clinical pathway: analysed as a stand-alone (triage) test for screening of DPN in diabetic population during annual diabetes check in diabetes clinic (secundary care); but note non-representative study population with very high prevalence of DPN
|
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel (deelvraag-1)
|
Auteur en jaartal |
Redenen van exclusie |
|
Smith 2012 |
Verkeerde PICO; betreft QoL instrumenten |
|
Nokleby 2005 |
Narrative review |
|
Kasznicki 2014 |
Narrative review |
|
Bouhassira 2013 |
Verkeerde PICO; geen testaccuratesse; beschrijvende studie |
|
Spallone 2012a |
Maakt deel uit van Mathieson 2015 |
|
Spallone 2012b |
Narrative review |
|
Gayle 2012 |
Verkeerde PICO; betreft test voor perifere neuropathie |
|
Adelmanesh 2012 |
Verkeerde PICO; geen testaccuratesse |
|
Nakatani 2011 |
Verkeerde PICO; geen meetinstrument |
|
Koroschetz 2011 |
Verkeerde PICO; geen testaccuratesse |
|
Jambart 2011 |
Verkeerde PICO; geen testaccuratesse |
|
Petrikonis 2010 |
Verkeerde PICO; geen testaccuratesse |
|
Van Acker 2009 |
Verkeerde PICO; geen testaccuratesse |
|
Baron 2009 |
Verkeerde PICO; geen testaccuratesse |
|
Wu 2007 |
Verkeerde PICO; geen testaccuratesse |
|
Zelman 2005a |
Verkeerde PICO; geen testaccuratesse |
|
Zelman 2005b |
Verkeerde PICO; geen testaccuratesse |
|
Bastyr 2005 |
Verkeerde PICO; assessment tool; geen testaccuratesse |
|
Mold 2004 |
Verkeerde PICO; geen testaccuratesse |
|
Kastenbauer 2004 |
Verkeerde PICO; geen testaccuratesse |
|
Valk 1994 |
Verkeerde PICO; geen testaccuratesse |
|
Harris 1993 |
Verkeerde PICO; geen testaccuratesse |
Tabel Exclusie na het lezen van het volledige artikel (deelvraag-2)
|
Auteur en jaartal |
Redenen van exclusie |
|
Sacco 2015 |
Verkeerde PICO; geen testaccuratesse |
|
Najafi 2014 |
Verkeerde PICO; geen adequate referentiestandaard |
|
Eryilmaz 2014 |
Verkeerde PICO; geen testaccuratesse |
|
Calvet 2013 |
Verkeerde PICO; geen testaccuratesse |
|
Ziegler 2012 |
Maakt deel uit van de geselecteerde SR van Tsapas (2014) |
|
Yoshioka 2012 |
Verkeerde PICO; geen testaccuratesse |
|
Spallone 2012 |
Verkeerde PICO; betreft DN4 screening tool voor neuropathische pijn |
|
Ziegler 2011 |
Maakt deel uit van de geselecteerde SR van Tsapas (2014) |
|
Papanas 2011a |
SR van mindere kwaliteit (geen zoekstrategie, geen ROB beoordeling) |
|
Papanas 2011b |
Maakt deel uit van de geselecteerde SR van Tsapas (2014) |
|
Petrikonis 2010 |
Verkeerde PICO; geen testaccuratesse |
|
Van Acker 2009 |
Verkeerde PICO; geen testaccuratesse |
|
Spallone 2009 |
Maakt deel uit van de geselecteerde SR van Tsapas (2014) |
|
Asad 2009 |
Verkeerde PICO; geen testaccuratesse |
|
Haussleiter 2008 |
Verkeerde PICO |
|
Liatis 2007 |
Valt onder de SR van Tsapas (2014) |
|
Kles 2006 |
Narrative review (geen origineel onderzoek of systematische review) |
|
Ziegler 2005 |
Verkeerde PICO; geen testaccuratesse |
|
Meijer 2005 |
Verkeerde PICO |
|
Perkins 2003 |
Narrative review (geen origineel onderzoek of systematische review) |
|
Meijer 2003 |
Verkeerde PICO |
|
Meijer 2002 |
Verkeerde PICO; betreft validatie DNE |
|
Meijer 2000 |
Studie van voor 2001 |
|
Franse 2000 |
Studie van voor 2001 |
|
Valk 1997 |
Studie van voor 2001 |
|
Gentile 1995 |
Studie van voor 2001 |
|
Feldman 1994 |
Studie van voor 2001 |
|
Valk 1992 |
Studie van voor 2001 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-04-2018
Beoordeeld op geldigheid : 16-12-2021
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Geldigheid/ frequentie herbeoordeling per module:
- Module-1 (Screening): 2022/ eens in de vijf jaar
- Module-2 (Medicamenteuze): 2019/ jaarlijks
- Module-3 (Niet-medicamenteuze): 2020/ eens in de twee jaar
- Module-4 (Evaluatie): 2020/ eens in de twee jaar
- Module-5 (Organisatie): 2022/ eens in de vijf jaar
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De richtlijn heeft als doelstelling zorgprofessionals handvatten te bieden voor de screening, diagnostiek, en behandeling van pijnlijke diabetische polyneuropathie (PDNP). Daarnaast beschrijft de richtlijn hoe de zorg voor een patiënt met PDNP het beste georganiseerd kan worden in Nederland.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor volwassen personen met diabetes en (risico op) PDNP. Deze beroepsgroepen bestaan onder andere uit internisten, diabetes verpleegkundigen, huisartsen, praktijkondersteuners, neurologen, klinisch neurofysiologen, anesthesiologen, revalidatieartsen, (diabetes) podotherapeuten, medisch pedicures en klinisch psychologen.
Samenstelling werkgroep
De richtlijn Pijnlijke diabetische neuropathie is onderdeel van de Netwerkrichtlijn diabetes mellitus ontwikkeld onder overkoepelend voorzitterschap van Dr. P.H.L.M. (Nel) Geelhoed, internist-endocrinoloog, Haaglanden Medisch Centrum, Den Haag (Nederlandse Internisten Vereniging).
Voor het ontwikkelen van de richtlijn Pijnlijke diabetische neuropathie is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de relevante specialismen die betrokken zijn bij de zorg voor personen met diabetes en (een risico op) PDNP.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. J.L.M. (Joost) Jongen, neuroloog, afd. Neurologie, Erasmus MC, Rotterdam (voorzitter); Nederlandse Vereniging voor Neurologie
- Dr. C. (Camiel) Verhamme, neuroloog en klinisch neurofysioloog, afd. Neurologie, AMC Amsterdam; Nederlandse Vereniging voor Neurologie
- Dr P.S. (Sytze) van Dam, internist-endocrinoloog en -vasculair geneeskundige, afd. Interne Geneeskunde, OLVG Amsterdam; Nederlandse Internisten Vereniging
- Prof. Dr. N.C. (Nicolaas) Schaper, internist-endocrinoloog, Maastricht UMC+; Nederlandse Internisten Vereniging
- Dr G. (Gerbrig) Versteegen, klinisch medisch psycholoog, UMC Groningen; Nederlands Instituut van Psychologen
- Dr. A.J.M. (Bart) van Wijck, anesthesioloog-pijnspecialist, UMC Utrecht; Nederlandse Vereniging voor Anesthesiologie
Klankbordgroep
- Dr A. (Anneloes) Kerssen, huisarts en kaderarts diabetes, Huisartsenpraktijk Kerssen & van der Wal, Den Haag; Nederlands Huisartsen Genootschap
- Dr. C.J. (Cees) Vos, huisarts en kaderarts diabetes, Huisartsenpraktijk C.J. Vos, Spijkenisse; Nederlands Huisartsen Genootschap
- Dr. J.V.H. (Jan) Palmen, huisarts en kaderarts diabetes, Aarveld Medisch Centrum, Heerlen; op persoonlijke titel
Met ondersteuning van
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Monique) Wessels, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- L. (Linda) Niesink (MSc), medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S.K. (Sanne) Josso, senior projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Met dank aan
- E. (Eglantine) Barends, beleidsmedewerker, Diabetesvereniging Nederland
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Ondernomen actie |
|
Jongen |
Neuroloog, ErasmusMC, Rotterdam |
Lid richtlijn pijn bij kanker (onbetaald) |
sporadische sprekersvergoeding, zie hieronder voor de afgelopen twee jaar: Nederlandse Vereniging voor Oncologie (nascholing) Two Hands Events; het pijnspreekuur (nascholing); Amgen (2x in 2016; vergoeding t.n.v. Erasmus MC, onderzoek, niet t.b.v. mijzelf) |
sporadische sprekersvergoeding, zie hieronder voor de afgelopen twee jaar: Amgen (nascholing) |
nvt |
Wetenschappelijk onderzoek, medegefinancierd (geweest) door: |
nvt |
nvt |
Geen |
|
Kerssen |
huisarts |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Palmen |
huisarts |
als kaderhuisarts DM: Adviseur zorggroep, Huisartsen OZL; Hoofddocent DM, SOBH, Utrecht;Docent Langerhans Stichting;DoCent DM, Univ. Maastricht, 3dejaars AIOS |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Schaper |
Hoofd Endocrinologie, afd. Interne Geneeskunde Maastricht UMC |
Hoofdredacteur Diabetes educatie website DIEP (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Van Dam |
internist |
geen |
geen |
geen |
geen |
in het verleden wetenschappelijke trial diabetische neuropathie met alfa-lipic acid. Thans deelname aan mlticentrer trial Grünenthal met cebranopadol |
geen |
geen |
Geen |
|
Van Wijck |
anesthesioloog-pijnspecialist in UMC Utrecht |
geen |
Ik heb wel persoonlijke belangen gehad, maar geen persoonlijke relaties die hier van belang zijn. 2014 adviesraad Versaties van Grunenthal |
Ik heb wel persoonlijke belangen gehad, maar geen persoonlijke relaties die hier van belang zijn. 2014 adviesraad Versaties van Grunenthal |
vice voorzitter stafconvent UMC Utrecht |
Ik ben betrokken (geweest) bij onderzoek gefinancierd door Astellas en SanofiPasteurMSD. Beide onderzoeken gingen over posttherpetisch neuralgie. |
geen |
geen |
Geen |
|
Verhamme |
neuroloog/klinisch neurofysioloog 0,8 fte |
geen |
geen |
geen |
Onbetaald: spierziekten Nederland, werkgroep erfelijk polyneuropathieën, medisch adviseur. Interuniversitair steunpunt neuromusculair onderzoek (ISNO), symposium en website commissie |
geen |
geen |
geen |
Geen |
|
Versteegen |
klinisch psycholoog |
docent/mentor PPO post doc. Opleiding voor GZ psycholoog en klinisch psycholoog |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Vos |
huisarts |
geen |
geen |
geen |
lid commissie Whiplash Nederland |
geen |
geen |
geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een in een eerder stadium door de patiëntenvereniging uitgevoerde enquête onder haar leden (zie richtlijn Diabetes Mellitus; NIV, 2014). Daarnaast zijn de conceptuitgangsvragen tijdens de knelpuntanalyse voorgelegd aan een viertal representatieve patiënten (zie Verslag patiënteninterviews). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging (Diabetesvereniging Nederland).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference (gezamenlijk voor zeven richtlijnen die deel uitmaken van de netwerkrichtlijn diabetes, diabetische neuropathie, diabetische voet, diabetische retinopathie, kinderen, ouderen met comorbiditeit, diabetes en zwangerschap, diabetes en psychiatrie) door: de Nederlandse Internisten Vereniging, Diabetesvereniging Nederland, Eerste Associatie Van Diabetesverpleegkundigen, Inspectie voor de Gezondheidszorg, Koninklijke Nederlandse Organisatie van Verloskundigen, Menzis, Nefarma, Nederlandse Federatie van Universitair Medische Centra, Nederlands Huisartsen Genootschap, Nederlands Oogheelkundig Gezelschap, Nederlandse Vereniging voor Anesthesiologie, Nederlandse Vereniging van Diëtisten, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Vereniging voor Neurologie, Nederlandse Vereniging voor Obstetrie & Gynaecologie, Nederlandse Vereniging van Diabetes Podotherapeuten, Optometristen Vereniging Nederland, Provoet (Brancheorganisatie voor de Pedicure), Verpleegkundigen & Verzorgenden Nederland, Verenso, WCS Kenniscentrum Wondzorg, Zorgverzekeraars Nederland en Zorginstituut Nederland. Een verslag van de invitational conference is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor deze richtlijn is geen overkoepelende oriënterende zoekactie uitgevoerd. Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor: Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig/ Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie).
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode (zie ook Mathieson 2015).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Er zijn geen nieuwe kwaliteitsindicatoren ontwikkeld omdat er voor diabetes al voldoende indicatoren bestaan, onder andere behorend bij de NDF Zorgstandaard Diabetes (NDF 2015).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisatie voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Diabetesvereniging Nederland, Vereniging Innovatieve Geneesmiddelen (voorheen Nefarma), Nederlandse Federatie van Universitair Medische Centra, beroepsorganisatie voor diabetesverpleegkundigen en praktijkondersteuners, Nederlandse Vereniging voor Klinische Geriatrie, Verpleegkundigen en Verzorgenden Nederland, Verenso, Zorgverzekeraars Nederland, Zorginstituut Nederland, Inspectie voor de Gezondheidszorg, Nederlandse Vereniging van Diabetes Podotherapeuten, Nederlandse Vereniging van Podotherapeuten, ProVoet, Nederlandse Vereniging voor Heelkunde, Nederlandse Vereniging van Revalidatieartsen, Nederlandse Orthopaedische Vereniging, Nederlandse Diabetes Federatie, Stichting InEen, Nederlandse Vereniging voor de Gezondheidszorgpsychologie, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, Nederlandse Vereniging van Ziekenhuisapothekers, Bijwerkingencentrum Lareb, en Koninklijk Nederlands Genoodschap voor Fysiotherapie. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Mathieson S, Maher CG, Terwee CB, et al. Neuropathic pain screening questionnaires have limited measurement properties. A systematic review. J Clin Epidemiol. 2015. pii: S0895-4356(15)00155-9. doi: 10.1016/j.jclinepi.2015.03.010. [Epub ahead of print] Review. PubMed PMID: 25895961.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. 2012. Link: https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
NDF. Zorgstandaard Diabetes. 2015. Link: http://www.zorgstandaarddiabetes.nl/ [geraadpleegd op 20 januari 2017].
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. Link xxx.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen - Deelvraag-1 |
Totaal |
|
Medline (OVID)
1990 – maart 2015 |
1 exp *Diabetes Mellitus/ or diabetes mellitus.ab,ti. or exp *Diabetes Mellitus, Type 1/ or exp *Diabetes Mellitus, Type 2/ or diabet*.ti. or dm1.ti. or dm2.ti. or iddm.ti. (334259) 2 (exp mononeuropathies/ or exp polyneuropathies/ or neuropath*.ab,ti. or polyneuropath*.ab,ti.) and pain*.mp. (24687) 3 exp Questionnaires/ or questionnaire*.ab,ti. or screening.ab,ti. or assessment.ti. or tool*.ab,ti. (1342124) 4 1 and 2 and 3 (288) 5 limit 4 to yr="1990 -Current" (278) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (230741) 7 5 and 6 (6) 8 exp "Sensitivity and Specificity"/ or (Sensitiv* or Specific*).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or diagnos*.ab,ti. or validation Studies.pt. (5785247) 9 5 and 8 (135) 10 7 or 9 (137)
= 137 (136 uniek) |
136 |
|
Database |
Zoektermen - Deelvraag-2 |
Totaal |
|
Medline (OVID)
1980-juli 2015
|
1 exp *Diabetes Mellitus/ or diabetes mellitus.ab,ti. or exp *Diabetes Mellitus, Type 1/ or exp *Diabetes Mellitus, Type 2/ or diabet*.ti. or dm1.ti. or dm2.ti. or iddm.ti. (343965) 2 exp polyneuropathies/ or polyneuropath*.ab,ti. or Erythromelalgia/ or ((fibre* or fiber*) adj3 neuropath*).ti,ab. (31151) 3 1 and 2 (2006) 4 exp Diagnosis, Differential/ or differential diagnosis.ab,ti. or exp Early Diagnosis/ or early diagnosis.ab,ti. or exp Diagnostic Techniques, Neurological/ or exp Neurologic Examination/ or exp Physical Examination/ or (examination* and (neurologic* or physic*)).ab,ti. or exp Algorithms/ or exp "Predictive Value of Tests"/ or (bedside and test*).ab,ti. or neuropad*.ti,ab. (2176457) 5 3 and 4 (618) 13 exp "Sensitivity and Specificity"/ or (Sensitiv* or Specific*).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or diagnos*.ab,ti. or validation Studies.pt. (5941900) 14 5 and 13 (368) 15 limit 14 to (yr="1980 - 2015" and english) (281) – 278 uniek |
278 |
