Medicamenteuze behandeling PDNP
Uitgangsvraag
Wat is de optimale medicamenteuze pijnbestrijding bij volwassen personen met pijnlijke diabetische polyneuropathie?
Aanbeveling
Bepaal de medicamenteuze behandeling van pijnlijke diabetische polyneuropathie, in overleg met de patiënt, op basis van het profiel van de patiënt, de verwachte werkzaamheid, bijwerkingen en contra-indicaties. Overweeg:
- een SNRI (duloxetine en venlafaxine) als eerste keus;
- een TCA (bij voorkeur amitriptyline, nortriptyline) of anti-epilepticum (gabapentine en pregabaline) als tweede keus;
- carbamazepine of topische 0,075% capsaïcine als derde keus.
Start de behandeling van PDNP met een lage dosering van het medicament, dat geleidelijk en op grond van effect en bijwerkingen opgehoogd dient te worden, contra-indicaties in acht nemende.
Verwijs de patiënt bij onvoldoende resultaat van de behandeling naar een anesthesioloog-pijnspecialist of neuroloog met expertise en ervaring in neuropathische pijnbehandeling.
Overwegingen
Pijnlijke diabetische neuropathie is de meest frequente neurologische complicatie van diabetes, waarbij de werkgroep van mening is dat allereerst gestreefd dient te worden naar optimale glykemische controle, alhoewel de evidentie voor het effect van glykemische controle op de ernst van de neuropathie en neuropathische pijn beperkt is. Daarnaast is symptomatische behandeling vaak nodig, met de middelen die in deze module worden beschreven. Paracetamol en NSAID’s/Coxib’s hebben geen plaats bij de behandeling van PDNP.
In de aanbevelingen beperkt de werkgroep zich tot middelen die in Nederland geregistreerd zijn voor PDNP. Op basis van de GRADE systematiek varieert de wetenschappelijke evidentie voor de medicamenteuze behandeling van pijnlijke diabetische polyneuropathie van zeer laag tot matig. Hierdoor is het nauwelijks mogelijk sterke aanbevelingen te doen. Ten aanzien van farmacotherapie bij PDNP geldt in het algemeen dat met een lage dosering dient te worden gestart en dat de dosering geleidelijk opgehoogd dient te worden op geleide van effect en bijwerkingen. Omdat bijwerkingen vaak al vroeg bij aanvang van de therapie kunnen optreden, maar op middellange termijn weer kunnen afnemen, is nauw en regelmatig contact met de patiënt noodzakelijk. Daarnaast is van belang dat patiënten met diabetische neuropathie andere complicaties van de diabetes, zoals bijvoorbeeld hart- en vaatziekten, kunnen hebben die de keuze voor een medicament kunnen beïnvloeden, zoals hieronder beschreven.
De literatuuranalyse in deze richtlijnmodule is gebaseerd op de SR van Griebeler (2014) die een netwerk meta-analyse uitvoert voor pijnreductie als continue uitkomstmaat, en gestandaardiseerde gemiddelde verschillen berekend. Griebeler (2014) geeft daarmee geen inzicht in verschillen tussen de interventies in het percentage patiënten dat adequaat reageert op behandeling, en berekent geen number-needed-to-treat (NNT). Uit reviews en richtlijnen over neuropathische pijn in het algemeen (Finnerup, 2015; NICE, 2013) weten we echter dat de NNT van individuele middelen ten opzichte van placebo over het algemeen ligt tussen 3 en 5. Dat betekent dat er 3 tot 5 patiënten moeten worden behandeld met de interventie in plaats van placebo om bij 1 extra patiënt een klinisch relevante pijnreductie (gedefinieerd als 30% pijnreductie ten opzichte van baseline) te bereiken. Zelfs bij deze lage waardes voor de NNT (een NNT van 11 wordt in het algemeen al als acceptabel beschouwd; Finnerup 2015) zal er derhalve bij een meerderheid van de patiënten geen klinisch relevant voordeel zijn van de medicamenteuze behandeling ten opzichte van een placebobehandeling. De NNT moet worden afgewogen tegen de number-needed to harm (NNH), die ook betrekkelijk laag is en ligt tussen de 10 en 20 (Finnerup, 2015; NICE, 2013; een lage NNH betekent een hoog risico op harm). Hierbij dient men zich te realiseren dat de NNH gebaseerd is op het aantal drop-outs uit de klinische studies, waardoor het waarschijnlijk is dat minor harm, zoals geringe duizeligheid, sufheid, en droge mond niet wordt meegewogen en daarmee de NNH eerder wordt overschat dan onderschat. Daarom is de werkgroep van mening dat bij patiënten met slechts geringe PDNP overwogen moet worden, in nauw overleg met de patiënt, om helemaal geen farmacotherapie voor te schrijven.
Op basis van de beschikbare literatuur kan overwogen worden SNRI’s, TCA’s, anti-epileptica (gabapentine en pregabaline; voor carbamazepine zie hieronder) en topische capsaïcine 0,075% voor te schrijven als pijnbehandeling van PDNP. Voor deze middelen is bewijs van werkzaamheid op korte-middellange termijn, tot 3 maanden (evidentie laag-matig). Voor de werkzaamheid op de lange termijn, >3 maanden, is er minder sterk wetenschappelijk bewijs (evidentie laag). Desalniettemin worden deze middelen in de klinische praktijk frequent langdurig voorgeschreven, omdat PDNP een chronische aandoening is.
Voorts kan overwogen worden SNRI’s preferentieel voor te schrijven ten faveure van anti-epileptica en pregabaline, en TCA’s preferentieel voor te schrijven ten faveure van topische capsaïcine 0,075% bij behandeling van PDNP, alhoewel de wetenschappelijke evidentie daarvoor laag is. Somnolentie en duizeligheid zijn de meest gerapporteerde bijwerkingen van SNRI’s, TCA’s en anti-epileptica. Voor een overzicht van de bijwerkingen zoals deze worden vermeld in de officiële productinformatie (SmPC) van de diverse geneesmiddelen, verwijzen wij u naar de website van het College ter Beoordeling van Geneesmiddelen (www.cbg-meb.nl) en voor meldingen van mogelijke bijwerkingen naar de website van Bijwerkingencentrum Lareb (www.lareb.nl). Omdat bijwerkingen in de onderzochte literatuur geen primair eindpunt van studies waren, omdat ernstige bijwerkingen zeldzaam zijn, en omdat er weinig lange termijn follow-up gegevens zijn, is het onmogelijk om deze middelen qua bijwerkingen met elkaar te vergelijken. In de klinische praktijk lijken deze middelen echter over het algemeen veilig, mits (relatieve) contra-indicaties (zoals cardiale ritmestoornissen bij TCA’s en nierfunctiestoornissen bij alle middelen) in acht worden genomen. In de ervaring van de werkgroep is sufheid een relatief vaak voorkomende en hinderlijke bijwerking van TCA’s. Voorts moet men zich bij ouderen bewust zijn van anticholinerge bijwerkingen van TCA’s zoals urineretentie, orthostatische hypotensie en verwardheid. Tenslotte, alhoewel niet benoemd in de review van Griebeler, is gewichtstoename bij TCA’s, gabapentinoïden (pregabaline, gabapentine) en carbamazepine waarschijnlijk een relatief frequente bijwerking. Bij duloxetine en venlafaxine wordt daarentegen een gewichtsafname beschreven (Domecq, 2015; FK, 2016), wat meegewogen kan worden bij het voorschrijven van deze middelen bij mensen met diabetes. Ten aanzien van de kosten per maand zijn er verschillen tussen de genoemde middelen, maar bij een gemiddelde dosering zijn deze middelen niet duurder dan €50/maand.
Op basis van effectiviteit, bijwerkingen, contra-indicaties, kosten en ervaring geeft de werkgroep ter overweging SNRI’s als eerste keus in de pijnbehandeling van PDPN voor te schrijven. Als tweede keus kunnen TCA’s en de anti-epileptica gabapentine en pregabaline worden overwogen. Deze medicamenten kunnen ook overwogen worden als tweede stap in het behandelschema als de initiële behandeling met een SNRI onvoldoende effect (of te veel bijwerkingen) heeft. Capsaïcine crème 0,075% en carbamazepine zijn de derde keus. Bij iedere patiënt moet echter een individuele afweging gemaakt worden in nauw overleg met betrokkene, en afhankelijk van het profiel van de patiënt kan als initiële therapie voor een ‘tweede keus’ geneesmiddel gekozen worden. Bijvoorbeeld voor een patiënt met vooral nachtelijke pijn kan de sufheid van een TCA juist een voordeel zijn, waarbij het middel dan eenmaal daags bij de avondmaaltijd wordt ingenomen. Vanwege bijwerkingen en het risico op tolerantie adviseert de werkgroep zeer terughoudend te zijn met opioïden. Belangrijk is dat de patiënt bij onvoldoende resultaat van de behandeling wordt doorverwezen naar een anesthesioloog-pijnspecialist of neuroloog met expertise en ervaring in neuropathische pijnbehandeling
Er is matig bewijs dat lacosamide niet effectiever is dan placebo bij de behandeling van PDNP op de lange termijn en er is laag bewijs dat datzelfde geldt voor topische amitriptyline. Deze middelen worden derhalve niet geadviseerd bij de behandeling van PDNP. Uit onze literatuur analyse kwam het gebruik van cannabis niet naar voren bij de behandeling van PDNP. De review van Finnerup (2015), bij neuropathische pijn in het algemeen, dat wil zeggen niet alleen door PDNP, leverde geen klinische evidentie voor een analgetisch effect van cannabis op neuropathische pijn. Mede gezien bijwerkingen en risico’s van cannabis bij daarvoor gevoelige patiënten wordt cannabis niet aanbevolen voor de behandeling van PDNP.
De literatuuranalyse in deze richtlijnmodule is gebaseerd op de SR van Griebeler (2014) die zich uitsluitend richt op monotherapie en daarom RCT's naar de waarde van combinatietherapie uitsluit. De werkgroep is van mening dat bij toekomstige revisie van de richtlijnmodule ook de waarde van combinatietherapie voor PDNP moet worden onderzocht aangezien dit in de klinische praktijk vaak wordt gebruikt bij patiënten die refractair zijn op monotherapie. Het advies van de werkgroep is om combinatietherapie bij PDNP alleen voor te laten schrijven door specialisten met ruime expertise hiermee. Op grond van farmacodynamische overwegingen ligt het voor de hand om TCA/SNRI te combineren met gabapentine/pregabaline en niet middelen binnen dezelfde groep (met een vergelijkbaar werkingsmechanisme) te combineren.
Ten aanzien van de capsaïcine 8% pleister geldt dat er voor dit preparaat geen RCT’s specifiek met betrekking tot PDNP werden gevonden in onze literatuur zoekactie. Een zeer recente publicatie, verschenen na onze zoekactie (Simpson, 2016) geeft weliswaar een statistisch significant grotere pijnreductie te zien bij gebruik van de capsaïcine 8% pleister dan bij placebobehandeling, maar het voordeel ten opzichte van placebo is relatief gering en vormt daarmee geen overtuigend bewijs voor de werking van de capsaïcine 8% pleister bij PDNP. Daarom beschouwen we dit als een kennislacune en stellen we voor om de effectiviteit van de capsaicine 8% pleister bij PDNP bij toekomstige revisie van de richtlijnmodule in de analyse mee te nemen.
Tenslotte worden in de klinische praktijk vaak medicamenteuze opties en niet-medicamenteuze opties (zoals TENS) naast elkaar gebruikt. Voor de plaatsbepaling van niet-medicamenteuze behandelingen ten opzichte van medicamenteuze behandelingen wordt verwezen naar de module ‘Niet-medicamenteuze behandeling PDNP’.
Onderbouwing
Achtergrond
De bestaande richtlijn Polyneuropathie van de NVN uit 2005 is verouderd en is niet specifiek gericht op de behandeling van pijnlijke diabetische polyneuropathie, maar op polyneuropathie in het algemeen. Het doel van de huidige uitgangsvraag is een up-to-date en specifiek op pijnlijke diabetische polyneuropathie gericht behandeladvies.
De uitgangsvraag richt zich medicamenteuze behandeling van pijnlijke diabetische polyneuropathie met (adjuvante) analgetica (inclusief opioïden en cannabis) bij volwassen personen met diabetes type 1 of 2.
Conclusies / Summary of Findings
Noten: de nummers verwijzen naar een toelichting op de gradering van bewijskracht (zie de paragraaf Bewijskracht van de literatuur).
Vergelijking van geneesmiddelgroepen (onderling en met placebo)
|
Laag1
GRADE |
Er zijn aanwijzingen op basis van korte termijn gegevens (<3 maanden) dat SNRI’s diabetische neuropathische pijn meer reduceren dan anti-epileptica en opioïden.
Bronnen (Griebeler, 2014) |
|
Laag2
GRADE |
Er zijn aanwijzingen op basis van korte termijn gegevens (<3 maanden) dat TCA’s diabetische neuropathische pijn meer reduceren dan topisch capsaïcine (0,075%).
Bronnen (Griebeler, 2014) |
|
Laag-Matig3
GRADE |
SNRI’s, topisch capsaïcine (0,075%), TCA’s en anti-epileptica reduceren diabetische neuropathische pijn meer dan placebo (conclusie op basis van korte termijn gegevens [<3 maanden]).
Bronnen (Griebeler, 2014; Moore, 2015; Yasuda, 2016; Gao, 2015; Huffman, 2015; Vinik, 2014b; Razazian, 2014) |
|
Matig4
GRADE |
Mexiletine lijkt niet effectief in het reduceren van diabetische neuropathische pijn ten opzichte van placebo (conclusie op basis van korte termijn gegevens [<3 maanden]).
Bronnen (Griebeler, 2014) |
|
Zeer laag-Laag5
GRADE |
De effectiviteit van ARI’s, lacosamide en dextromethorfan in het reduceren van diabetische neuropathische pijn ten opzichte van placebo is onduidelijk (conclusie op basis van korte termijn gegevens [<3 maanden]).
De effectiviteit van pijnreductie door opioïden ten opzichte van placebo is onduidelijk (conclusie op basis van zowel korte termijn gegevens [<3 maanden] als langere termijn gegevens [>3 maanden]).
Bronnen (Griebeler, 2014; Schwartz, 2015) |
|
Laag-Matig6
GRADE |
ARI’s en anti-epileptica reduceren diabetische neuropathische pijn meer dan placebo (conclusie op basis van langere termijn gegevens [>3 maanden]).
Bronnen (Griebeler, 2014) |
|
Matig7
GRADE |
Lacosamide lijkt niet effectief in het reduceren van diabetische neuropathische pijn ten opzichte van placebo (conclusie op basis van langere termijn gegevens [>3 maanden]).
Bronnen (Griebeler, 2014) |
|
Geen
GRADE |
Door een gebrek aan onderzoek bij langere follow-up is geen uitspraak mogelijk over de langere termijn effectiviteit van topisch capsaïcine 0,075%, TCA’s, opioïden, dextromethorfan, mexiletine, en SNRI’s.
Bronnen (Griebeler, 2014; Yasuda, 2016) |
Vergelijking van individuele geneesmiddelen (onderling en met placebo)
|
Laag8
GRADE |
Er zijn aanwijzingen op basis van korte termijn gegevens (<3 maanden) dat de SNRI’s venlafaxine en duloxetine diabetische neuropathische pijn meer reduceren dan het anti-epilepticum pregabaline.
Bronnen (Griebeler, 2014) |
|
Laag9
GRADE |
Er zijn aanwijzingen dat botuline toxine-A (BoNT/A) diabetische neuropathische pijn mogelijk meer reduceert dan placebo (conclusie gebaseerd op korte termijn resultaten [<3 maanden]).
Bronnen (Yuan, 2009; Ghasemi, 2014) |
|
Laag10
GRADE |
Topisch amitriptyline lijkt niet effectief in het reduceren van diabetische neuropathische pijn in vergelijking met placebo.
Bronnen (Thompson, 2015) |
|
Laag11
GRADE |
Clonidine gel (1%) en capsaïcine crème (0,075%) lijken een vergelijkbare effectiviteit te bezitten in het reduceren van diabetische neuropathische pijn.
De werkzaamheid van deze middelen bij patiënten met diabetische neuropathische pijn ten opzichte van placebo is onbekend.
Bronnen (Kiani, 2015) |
|
Zeer laag12
GRADE |
Er zijn aanwijzingen dat stikstofoxide pleisters (Nitrosense Derma Protect) mogelijk diabetische neuropathische pijn meer reduceren dan placebo.
Bronnen (Agrawal, 2014) |
|
Geen
GRADE |
Solomnentie en duizeligheid zijn veelvoorkomende bijwerkingen van TCA’s, SNRI’s en anti-epileptica.
Daarnaast is droge mond een veelvoorkomende bijwerking van TCA’s.
Daarnaast zijn Nausea, constipatie en dyspepsia veel voorkomende bijwerkingen van SNRI’s.
Daarnaast is Perifeer oedeem een veelvoorkomende bijwerking van pregabaline
Branderige pijn, jeuk, blaarvorming, en erythema zijn veel voorkomende bijwerkingen bij gebruik van topisch 0,075% capsaïcine.
Droge huid en jeuk zijn veel voorkomende bijwerkingen bij gebruik van topisch clonidine.
Op basis van data ontleend aan RCT’s, die door hun relatief geringe studieomvang en korte studieduur niet geschikt zijn voor de analyse van lange termijn en/of zeldzame (ernstige) bijwerkingen.
Bronnen (Griebeler, 2014; Yasuda, 2016; Gao, 2015; Allen, 2015; Huffman, 2015; Vinik, 2014b; Razazian, 2014; Kiani, 2015) |
Samenvatting literatuur
Griebeler (2014) is de meest recente SR van de belangrijkste medicamenteuze behandelopties voor pijnlijke diabetische polyneuropathie. Vanwege het grote aantal relevante behandelopties is er voor gekozen om de netwerk meta-analyse van Griebeler (2014) te gebruiken als basis, en de aanvullende literatuur vervolgens per geneesmiddelgroep te analyseren.
Griebeler (2014) richt zich op gangbare medicamenteuze behandelopties voor pijnlijke diabetische neuropathie in de Verenigde Staten en Europa: tricyclische antidepressiva (TCA’s: amitriptyline, desipramine, imipramine, nortriptyline), serotonine-noradrenaline heropname remmers (SNRI’s: duloxetine, venlafaxine), anti-epileptica (carbamazepine, gabapentine, lamotrigine, oxcarbazepine, pregabaline, natrium valproaat, topiramaat), topische analgetica (capsaïcine crème 0,075%, doxepine crème, lidocaine 5% pleister, pentoxifylline crème), opioïden (morfine, oxycodon, tapentadol, tramadol), aldose reductase inhibitors (epalrestat, ranirestat, fidarestat, ponalrestat, sorbinil), en overige middelen (lacosamide, mexiletine, en dextromethorfan). Alleen RCT’s die tenminste de minimale effectieve dosis (gebaseerd op aanbevelingen van de American Diabetes Association; Boulton, 2005) van de middelen gebruikten werden geïncludeerd, studies naar combinaties van middelen werden uitgesloten. Combinatietherapie vormt daarmee geen onderdeel van de literatuuranalyse (zie ook Overwegingen). Griebeler (2014) includeert 65 RCT’s met in totaal 12.632 volwassenen met pijnlijke diabetische neuropathie, die 27 van de genoemde medicamenteuze behandelopties (monotherapie) evalueren. Slechts negen RCT’s vergelijken middelen direct (head-to-head), de overige vergelijken met placebo. De individuele studieopzet werd beoordeeld met de Cochrane RoB tool, waarbij verborgen groepstoekenning (allocation concealment) en blindering van patiënten voor de behandeling als doorslaggevend werd gezien voor de overall risk of bias: 30 van de 65 RCT’s (46%) had een laag risico op bias.
Vanwege het grote aantal relevante behandelopties en het gebrek aan directe (head-to-head) vergelijking tussen de behandelopties, werd een netwerk meta-analyse uitgevoerd. Een netwerk meta-analyse maakt ook gebruik van informatie afkomstig uit indirecte vergelijkingen tussen interventies, en geeft een completer beeld van de relatieve effectiviteit van de behandelopties. Hierbij moet wel rekening worden gehouden met een verminderde betrouwbaarheid van effectschattingen die geheel of gedeeltelijk zijn gebaseerd op indirecte data. Een meerderheid van de geïncludeerde studies rapporteert pijnreductie als een continue uitkomstmaat, slechts enkele RCT’s rapporteren de fractie patiënten met een 30% of 50% reductie in pijn ten opzichte van baseline. Griebeler (2014) baseert de meta-analyses daarom op pijnreductie als continue uitkomstmaat, en normaliseert de verschillende pijnschalen gebruikt in de studies door het berekenen van gestandaardiseerde gemiddelde verschillen (SMD, standardized mean difference). Naast pijnreductie brengt Griebeler (2014) bijwerkingen (adverse effects) en contra-indicaties in kaart. Patiënttevredenheid, pijn-gerelateerde klachten en kosten worden niet gerapporteerd.
Pijnintensiteit (kritieke uitkomstmaat)
Griebeler (2014) voert zowel een netwerk meta-analyse (Bayesiaanse Markov-chain Monte Carlo methode) uit op het niveau van geneesmiddelgroepen (n=9 groepen), als op het niveau van de individuele middelen (n=27 middelen), en maakt onderscheid tussen korte termijn (≤3 maanden follow-up) en lange termijn effecten (>3 maanden follow-up). Analyse per geneesmiddelgroep biedt het voordeel van een nauwkeuriger effectschatting (hogere statistische power) maar veronderstelt een vergelijkbare effectiviteit van de individuele geneesmiddelen binnen een groep. Griebeler (2014) baseert de meta-analyses op pijnreductie als continue uitkomstmaat en voert geen responder analyse uit. Daarom kan niet worden uitgesloten dat de effectiviteit van pijnstilling wordt onderschat of overschat in bepaalde subgroepen (responders versus non-responders).
De gemiddelde follow-up duur was veertien weken, en de meerderheid van de RCT’s rapporteert alleen korte termijn resultaten (≤3 maanden follow-up). Tabel 1 geeft een overzicht van de korte termijn effectiviteit per geneesmiddelgroep op basis van directe vergelijkingen en op basis van directe en indirecte vergelijkingen (netwerk meta-analyse). Effectschattingen worden weergegeven samen met een 95% geloofwaardigheidsinterval (credibility interval, CrI), de Bayesiaanse tegenhanger van het 95% betrouwbaarheidsinterval: er is 95% kans dat het ware effect in het geloofwaardigheidsinterval ligt. Uit de negen head-to-head trials komt naar voren dat bij directe vergelijking van behandelopties, SNRI’s een statistisch significant en mogelijk klinisch relevant grotere pijnreductie geven dan anti-epileptica (SMD= -0.34; 95% geloofwaardigheidsinterval, 95%CrI= [-0,63; -0,05]), TCA’s een statistisch significant en klinisch relevant grotere pijnreductie geven dan topisch capsaïcine 0,075% (SMD= -1,02; 95%CrI= [-1,29; -0,75]), en TCA’s en anti-epileptica een vergelijkbare pijnreductie geven (SMD= 0,00 [-0,17; 0,17]). Bij bepaling van klinische relevantie is hierbij uitgegaan van het geloofwaardigheidsinterval en een minimaal klinisch relevant verschil van 0,5 (zie eerder in de tekst onder Relevante uitkomstmaten). De netwerk meta-analyse waarbij zowel direct als indirecte vergelijkingen worden meegenomen, geeft een vergelijkbaar beeld behalve in situaties waarin slechts een enkele head-to-head trial beschikbaar is: in de netwerk meta-analyse lijkt er geen verschil in effectiviteit te bestaan tussen TCA’s en topisch capsaïcine 0,075% (SMD= 0,13 [-0,74; 1,03]; statistisch niet significant; tabel 1).
Tabel 1 Vergelijking van korte termijn (≤3 maanden) pijnreductie ten opzichte van placebo of actief alternatief op basis van geneesmiddelgroep (Griebeler, 2014)
|
|
|
Pijnreductie SMD [95%CrI] |
|||
|
interventie |
vergelijking |
Direct |
Direct |
Direct + indirect |
|
|
|
|
n |
Alle RCT’s |
RCT’s met laag RoB |
Alle RCT’s |
|
Opioïden |
Placebo |
5 |
-0,36 [-0,55; -0,18] |
-0,30 [-0,44; -0,16] |
-0,44 [-1,15; 0,25] |
|
ARI’s |
Placebo |
1 |
-0,34 [-1,19; 0,52] |
---- |
-0,33 [-2,08; 1,42] |
|
Anti-epileptica |
Placebo |
18 |
-0,79 [-1,01; -0,57] |
-0,66 [-0,91; -0,41] |
-0,67 [-0,97; -0,37] |
|
|
SNRI’s |
2 |
0,34 [0,05; 0,63] |
0,46 [-0,09; 1,00] |
0,69 [0,21; 1,17] |
|
|
TCA’s |
12 |
0,00 [-0,17; 0,17] |
-0,04 [-0,21; 0,14] |
0,11 [-0,34; 0,56] |
|
Lacosamide |
Placebo |
1 |
-0,29 [-0,65; 0,07] |
---- |
-0,29 [-1,87; 1,28] |
|
SNRI’s |
Placebo |
6 |
-2,10 [-3,41; -0,79] |
-0,98 [-1,67; -0,28] |
-1,36 [-1,77; -0,95] |
|
|
Anti-epileptica |
2 |
-0,34 [-0,63; -0,05] |
-0,46 [-1,00; 0,09] |
-0,69 [-1,17; -0,21] |
|
|
TCA’s |
1 |
-0,25 [-0,78; 0,28] |
-0,25 [-0,78; 0,28] |
-0,58 [-1,16; 0,01] |
|
Topisch capsaïcine |
Placebo |
3 |
-1,44 [-2,84; -0,03] |
---- |
-0,91 [-1,18; -0,08] |
|
|
TCA’s |
1 |
1,02 [0,75; 1,29] |
1,02 [0,75; 1,29] |
-0,13 [-1,03; 0,74] |
|
TCA’s |
Placebo |
5 |
-0,55 [-0,99; -0,11] |
---- |
-0,78 [-1,24; -0,33] |
|
|
Anti-epileptica |
12 |
0,00 [-0,17; 0,17] |
0,04 [-0,14; 0,21] |
-0,11 [-0,56; 0,34] |
|
|
SNRI’s |
1 |
0,25 [-0,28; 0,78] |
0,25 [-0,28; 0,78] |
0,58 [-0,01; 1,16] |
|
|
Top capsaïcine |
1 |
-1,02 [-1,29; -0,75] |
-1,02 [-1,29; -0,75] |
0,13 [-0,74; 1,03] |
|
Dextromethorfan |
Placebo |
2 |
-0,25 [-0,77; 0,28] |
---- |
-0,28 [-1,49; 0,92] |
|
Mexiletine |
Placebo |
5 |
-0,46 [-0,83; -0,09] |
-0,54 [-1,26; 0,18] |
-0,29 [-0,91; 0,33] |
Meta-analyse (random effects model) van resultaten uit directe (head-to-head) vergelijking (n= totaal aantal studies), en directe plus indirecte vergelijking (netwerk meta-analyse). Voor de directe vergelijking is ook een berekening op basis van alleen RCT’s met een laag risico op bias (RoB) vermeld. Statistisch significante verschillen zijn vetgedrukt; een negatieve waarde is in het voordeel van de interventie. Resultaten zijn alleen vermeld voor vergelijkingen waarvoor ook directe data beschikbaar waren (zie voor een volledig overzicht: Griebeler, 2014). SMD= gestandaardiseerd gemiddeld verschil (standardized mean difference); 95%CrI= 95% geloofwaardigheidsinterval (credibility interval; Bayesiaans betrouwbaarheidsinterval); ARI = aldose reductase inhibitor; SNRI = serotonin–norepinephrine reuptake inhibitor; TCA= tricyclisch antidepressivum. Noot: de netwerkmeta-analyse bevat slechts een RCT met betrekking tot de selectieve serotonine heropnameremmer (SSRI) paroxetine tegen negen RCT’s met betrekking tot de SNRI’s venlafaxine (drie RCT’s) en duloxetine (zes RCT’s) en daarom typeert Griebeler deze drie middelen samen in analyses op groepsniveau als SNRI.
Figuur 1 geeft een overzicht van de korte termijn effectiviteit in vergelijking met placebo, op basis van zowel directe als indirecte vergelijkingen (netwerk meta-analyse): SNRI’s (SMD= -1,36 [-1,77; -0,95]), topisch capsaïcine 0,075% (SMD= -0,91 [-1,18; -0,08]), TCA’s (SMD= -0,78 [-1,24; -0,33]), en anti-epileptica (SMD= -0,67 [-0,97; -0,37]) geven een statistisch significant en waarschijnlijk klinisch relevant grotere pijnreductie dan placebo. In veel gevallen is echter een aanzienlijk risico op bias (zie tabel bij figuur 1; zie ook tabel 2.1, RCT’s met laag RoB). Studies met een follow-up van meer dan drie maanden zijn schaars: aldose reductase inhibitors (SMD= -0,86 [-1,58; -0,14]) en anti-epileptica (SMD= -0,23 [-0,65; -0,18]) geven een statisch significant en mogelijk klinisch relevant grotere pijnreductie dan placebo. Door een gebrek aan onderzoek bij lange follow-up is geen uitspraak mogelijk over de lange termijn effectiviteit van topisch capsaïcine 0,075%, TCA’s, opioïden, dextromethorfan, mexiletine, en SNRI’s.
Figuur 1 Vergelijking van korte termijn en langere termijn (>3 maanden) pijnreductie ten opzichte van placebo op basis van geneesmiddelgroep (Griebeler, 2014)
|
|
Studies met directe vergelijking (n) |
Studies met lage RoB (%) |
Netwerk meta-analyse
SMD [95%CrI] |
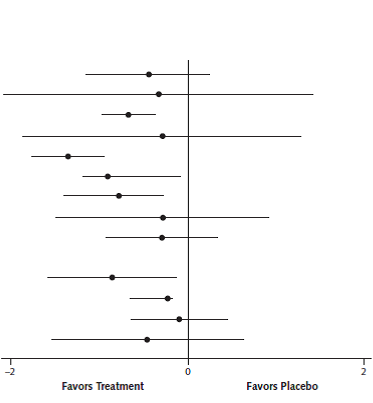 |
|
Korte termijn |
|
|
|
|
|
Opioïden |
5 |
71 |
-0,44 [-1,15; 0,25] |
|
|
ARI’s |
1 |
0 |
-0,33 [-2,08; 1,42] |
|
|
Anti-epileptica |
16 |
53 |
-0,67 [-0,97; -0,37] |
|
|
Lacosamide |
1 |
100 |
-0,29 [-1,87; 1,28] |
|
|
SNRI’s |
7 |
71 |
-1,36 [-1,77; -0,95] |
|
|
Topisch capsaïcine |
3 |
0 |
-0,91 [-1,18; -0,08] |
|
|
TCA’s |
5 |
0 |
-0,78 [-1,24; -0,33] |
|
|
Dextromethorfan |
2 |
0 |
-0,28 [-1,49; 0,92] |
|
|
Mexiletine |
5 |
20 |
-0,29 [-0,91; 0,33] |
|
|
Langere termijn |
|
|
|
|
|
ARI’s |
5 |
17 |
–0,86 [–1,58; –0,14] |
|
|
Anti-epileptica |
7 |
78 |
–0,23 [–0,65; –0,18) |
|
|
Lacosamide |
3 |
67 |
–0,10 [–0,64; 0,45] |
|
|
SNRI’s |
1 |
100 |
–0,46 [–1,54; 0,63] |
Netwerk meta-analyse (random effects model) van resultaten uit directe plus indirecte vergelijking met placebo. Statistisch significante verschillen zijn vetgedrukt; een negatieve waarde is in het voordeel van de interventie. Resultaten zijn alleen vermeld voor vergelijkingen waarvoor ook directe data beschikbaar waren. SMD= gestandaardiseerd gemiddeld verschil (standardized mean difference); 95%CrI= 95% geloofwaardigheidsinterval (credibility interval; Bayesiaans betrouwbaarheidsinterval); ARI= aldose reductase inhibitor; SNRI= serotonin–norepinephrine reuptake inhibitor; TCA= tricyclisch antidepressivum. Noot: de netwerkmeta-analyse bevat slechts een RCT met betrekking tot de selectieve serotonine heropnameremmer (SSRI) paroxetine tegen negen RCT’s met betrekking tot de SNRI’s venlafaxine (drie RCT’s) en duloxetine (zes RCT’s), en daarom typeert Griebeler deze drie middelen samen in analyses op groepsniveau als ‘SNRI’.
Netwerk meta-analyse van de korte termijn effectiviteit (≤3 maanden follow-up) van individuele middelen, op basis van zowel directe als indirecte vergelijkingen geeft een statistisch significant en (mogelijk) klinisch relevant grotere pijnreductie in vergelijking met placebo voor de anti-epileptica carbamazepine (SMD= -1.57 [-2,83; -0,31]; 1 directe vergelijking) en pregabaline (SMD= -0,55 [-0,94; -0,15]; 7 directe vergelijkingen), de SNRI’s venlafaxine (SMD= -1,53 [-2,41; -0,65]; 2 directe vergelijkingen) en duloxetine (SMD= -1,33 [-1,82; -0,86]; 4 directe vergelijkingen), en de TCA amitriptyline (SMD= -0,72 [-1,35; -0,08]; 2 directe vergelijkingen). Verschillen in effectiviteit tussen de individuele middelen bleken over het algemeen niet statistisch significant, met uitzondering van pregabaline ten opzichte van venlafaxine (SMD= 0,99 [0,02; 1,96]; geen directe vergelijkingen) en pregabaline ten opzichte van duloxetine (SMD= 0,79 [0,20; 1,38]; 1 directe vergelijking), beide in het nadeel van pregabaline. Data bij langere follow-up (>3 maanden) zijn schaars maar suggereren een statistisch significant en (mogelijk) klinisch relevant grotere pijnreductie dan placebo voor de aldose reductase inhibitor fidarestat (SMD= -4,00 [-4,59; -3,41]), de SNRI duloxetine (SMD= -0,46 [-0,81; -0,10]), en het anti-epilepticum oxcarbazepine (SMD= -0,45 [-0,68; -0,21]).
Bijwerkingen en complicaties (ernstig= kritieke uitkomstmaat; mild= belangrijke uitkomstmaat)
Naast een vergelijking van de effectiviteit (pijnreductie) analyseert Griebeler (2014) bijwerkingen (Adverse Effects) op basis van de geïncludeerde RCT’s en informatie beschikbaar in geneesmiddel informatiesystemen (Microdex 2.0 en Lexicomp). Frequent gerapporteerde bijwerkingen in de RCT’s die deel uitmaken van Griebeler (2014) zijn slaperigheid (somnolentie) en duizeligheid bij gebruik van TCA’s, SNRI’s, en anti-epileptica; droge mond (xerostomie) bij gebruik van TCA’s; en perifeer oedeem en branderig gevoel bij gebruik van respectievelijk pregabaline en capsaïcine (tabel 2; voor een uitvoerig overzicht van bijwerkingen en contra-indicaties, zie Griebeler (2014), bijlage 7).
Tabel 2 Veel voorkomende bijwerkingen in de geïncludeerde RCT’s (Griebeler, 2014)
|
Geneesmiddel |
Veel voorkomende bijwerkingen |
|
|
TCA’s |
xerostomie (2%–89%), somnolentie (4%–69%), vermoeidheid (11%–34%), hoofdpijn (11%–21%), duizeligheid (5%–16%), slapeloosheid (35%) |
|
|
SNRI’s |
Nausea (10%–32%), somnolentie, (8%–28%), duizeligheid (6%–25%), constipatie (7%–19%), dyspepsie (9%–18%) |
|
|
Anti-epileptica |
|
|
|
|
pregabalin |
Somnolentie (5%–40%), duizeligheid, (5%–38%), perifeer oedeem, (4%–17%), hoofdpijn (2%–13%) |
|
|
gabapentin |
Somnolentie (22%–48%), duizeligheid (22%–28%) |
|
|
carbamazepine |
Duizeligheid (10%–53%), somnolentie, (14%), braken (10%) |
|
Topische analgetica |
|
|
|
|
Capsaïcine (0,075%) |
Brandende pijn bij aanbrengplaats (54%–63%) |
Griebeler (2014) dekt de literatuur tot april 2014. In onderstaande tekst wordt de aanvullende literatuur per geneesmiddelgroep besproken. Aan dit overzicht zijn enkele relevante behandelopties die geen onderdeel zijn van de SR van Griebeler (2014) toegevoegd (zie de paragraaf Overige behandelopties).
Tricyclische antidepressiva TCA’s (oraal)
Moore (2015) verrichtte een Cochrane SR naar gebruik van amitriptyline (oraal) bij chronische neuropathische pijn. De SR dekt de literatuur tot maart 2015 en includeert zeventien RCT’s waarvan vijf (314 deelnemers in amitriptyline arm) betrekking hebben op diabetische neuropathische pijn. Deze RCT’s hebben een studieduur van 4 tot 9 weken en vergelijken amitriptyline met pregabaline, topisch capsaïcine, duloxetine, lamotrigine, desipramine of fluoxetine. Twee RCT’s rapporteren een dichotome uitkomstmaat voor pijnreductie. Geen van de vijf RCT’s vindt een verschil in effectiviteit tussen amitriptyline en actieve controle. Een kleine RCT (Max, 1992) met cross-over design en hoog RoB suggereert dat amitriptyline effectiever is dan placebo (relatief risico op volledige of grote pijnreductie, RR= 2,18; 95%BI= [1,15; 4,14]; n=46), een tweede grotere RCT (Anon, 2000 [see Moore, 2015]) met parallel design en onduidelijk RoB vindt geen statistisch significant verschil (RR= 1,42 [0,94; 2,15]; n=169). De bevindingen in Moore (2015) vormen geen reden om de conclusies op basis van Griebeler (2014) aan te passen.
Serotonine-noradrenaline heropname remmers SNRI’s (oraal)
Yasuda (2016) verrichtte een open-label extensie van een eerdere Japanse placebogecontroleerde RCT voor duloxetine (Yasuda, 2011) die deel uit maakt van Griebeler (2014). Na afloop van de RCT werden patiënten (n=258) gerandomiseerd naar duloxetine 40mg/d of 60 mg/d en vervolgd gedurende 52 weken. De studie suggereert lange termijn effectiviteit van duloxetine, en geeft met name belangrijke aanvullende informatie over bijwerkingen (adverse events): somnolentie (13,6%), constipatie (13,2%) en nausea (10,5%). Het merendeel van de deelnemers (96%) ondervindt een adverse event, overwegend milde (43%) of matige ernstige (55%) adverse events; 54 deelnemers (20,9 %) stopt met de behandeling vanwege adverse events.
Gao (2015) verrichtte een Chinese placebogecontroleerde RCT (n=405) voor duloxetine (60 mg/d) met een studieduur van 12 weken. Gao (2015) rapporteert een statistisch significant en mogelijk klinisch relevant grotere pijnreductie in de duloxetine groep (NRS pijn, gemiddeld groepsverschil, MD= -0.43 [-0,82; -0,04]). De fractie patiënten met tenminste 30% reductie in pijn ten opzichte van baseline bedraagt respectievelijk 61.5% en 49,0% in de duloxetine en placebogroep, resulterend in een number needed to treat (NNT) van 8,0 (95%BI= [5; 35]). Op basis van tenminste 50% reductie in pijn ten opzichte van baseline bedraagt de NNT 7,6 (95%BI= [5; 26]). Een groter aantal patiënten stopt behandeling vanwege bijwerkingen in de interventiegroep dan in de placebogroep (8,4% versus 4,0%). Misselijkheid, slaperigheid en asthenie (incidentie 10%, 8%, en 5% in interventiegroep) komen statistisch significant vaker voor bij duloxetine behandeling, de numbers needed to harm (NNH) bedragen respectievelijk 15, 13 en 20. Deze resultaten ondersteunen de conclusie van Griebeler (2014) dat op basis van korte termijn gegevens, SNRI’s zoals duloxetine diabetische neuropathische pijn meer reduceren dan placebo.
Allen (2014) verrichtte een Noord-Amerikaanse placebogecontroleerde RCT (n=412) voor desvenlafaxine met een studieduur van 13 weken, gevolgd door een open-label extensiestudie gedurende negen maanden. Patiënten werden gerandomiseerd naar 50mg, 100 mg, 200 mg, of 400 mg desvenlafaxine dd, of placebo. Allen (2014) rapporteert een statistisch significant en mogelijk klinisch relevant grotere pijnreductie bij behandeling met 200 mg en 400 mg desvenlafaxine dd, ten opzichte van placebo: NRS pijn, gemiddeld groepsverschil respectievelijk MD= -1,10 [-1,70; -0,50] en MD= -0,91 [-1,59; -0,23]). Bij lagere dosering wordt geen statistische significantie bereikt. De fractie patiënten met tenminste 50% reductie in pijn ten opzichte van baseline varieert tussen 32% en 37% in de desvenlafaxine groepen en bedraagt 26% in de placebogroep, deze verschillen zijn statistisch niet significant. Een groter aantal patiënten stopt behandeling vanwege bijwerkingen in de interventiegroep (tussen 8% en 30% afhankelijk van de desvenlafaxine dosis) dan in de placebogroep (5,6%). De extensiestudie werd voortijdig beëindigd (n=147) om zakelijke redenen (niet nader gespecificeerd). Het veiligheidsprofiel van venlafaxine was vergelijkbaar tussen korte en lange termijn behandeling, met duizeligheid (12.2%) en misselijkheid (8.4%) als meest voorkomende met de behandeling geassocieerde bijwerkingen (treatment emergent adverse events).
De resultaten van bovenstaande studies (Yasuda, 2016; Gao, 2015; Allen, 2014) geven meer inzicht in veiligheid- en tolerantieprofiel van SNRI’s, en ondersteunen de conclusies van Griebeler (2014) dat op basis van korte termijn gegevens, SNRI’s zoals duloxetine en desvenlafaxine diabetische neuropathische pijn meer reduceren dan placebo. De bevindingen vormen geen reden om de conclusies op basis van Griebeler (2014) aan te passen.
Anti-epileptica (oraal)
Huffman (2015) verrichtte een multinationale placebogecontroleerde cross-over RCT (n=203) voor pregabaline (150 tot 300 mg dd) met twee behandelperiodes van 6 weken onderbroken door een wash-out periode van twee weken. Berekend over beide behandelperiodes vindt Huffman (2015) een gering en statistisch niet significant verschil in gemiddelde pijnscore, ten opzichte van placebo (NRS, gemiddeld groepsverschil MD= -0,13 [-0,44; 0,18]). Waarschijnlijk is er sprake van een carry-over effect: berekend over alleen de eerste behandelperiode, wordt een statistisch significant en mogelijk klinisch relevant betere pijnscore gevonden voor de pregabaline groep (MD= -0,89 [-1,42; -0,36]). De fractie patiënten met tenminste 30% reductie in pijn ten opzichte van baseline is 39% in de pregabaline groep en 25% in de placebogroep (eerste periode), bij tenminste 50% reductie in pijn bedragen deze percentages respectievelijk 24% en 14%; deze verschillen zijn statistisch niet significant. Een groter aantal patiënten stopt behandeling vanwege adverse events in de pregabalinegroep (6,6%) dan in de placebogroep (2,7%). De meest voorkomende adverse events zijn slaperigheid (6,1%), duizeligheid (5,6%), vermoeidheid (5,6%), en perifeer oedeem (4,5%).
Vinik (2014b) verrichtte een placebogecontroleerde RCT (n=452) voor mirogabalin (5 mg, 10 mg, 15 mg, 20 mg, en 30 mg dd; n=57 per arm) met een studieduur van 5 weken, die tevens een arm bevat voor pregabaline (300 mg dd). Vinik (2014b) rapporteert voor de hogere doseringen (15 mg, 20 mg en 30 mg dd) een statistisch significant en mogelijk klinisch relevant grotere pijnreductie dan placebo (NRS pijn, respectievelijk MD= –0,94, –0,88, en –1,01; p<0,05). Bij een dosering van 15 mg of 30 mg mirogabalin dd wordt ook een statistisch significant en mogelijk klinisch relevant grotere pijnreductie gevonden in vergelijking met pregabaline 300 mg dd (NRS pijn, respectievelijk MD= –0,89 en –0,96; p<0,05). De fractie patiënten met tenminste 30% reductie in pijn ten opzichte van baseline varieert tussen 56% en 67% bij de hogere doseringen mirogabaline en bedraagt 42% in de placebogroep (NNT tussen 4 en 7; p<0,05). Bij tenminste 50% reductie in pijn variëren deze percentages tussen 39% en 44% voor mirogabalin in vergelijking met 24% voor de placebogroep (NNT tussen 5 en 7; p<0,05). De meest voorkomende behandeling-gerelateerde adverse events zijn duizeligheid (7,6%) en somnolentie (5,1%) bij gebruik van mirogabalin (alle doseringen gecombineerd), en somnolentie (8,0%), evenwichtsstoornis (4,0%), fatigue (4,0%) en perifeer oedeem (4,0%) bij gebruik van pregabaline (300 mg dd).
Razazian (2014) verrichtte een Iraanse RCT (n=257) die de anti-epileptica carbamazepine (400 mg dd) en pregabaline (150 mg dd), en de SNRI venlafaxine (150 mg dd) vergelijkt bij een studieduur van 5 weken. De carbamazepine dosering is lager dan de minimaal effectieve dosering (600 mg dd; zie Griebeler, 2014). De fractie patiënten met tenminste 30% reductie in pijn (VAS) ten opzichte van baseline is bijzonder hoog en bedraagt 87% in de carbamazepine groep, 93% in de pregabaline groep en 65% in de venlafaxine groep. Bij tenminste 50% reductie in pijn gaat het om respectievelijk om 41%, 77%, en 42% van de patiënten. Een groter aantal patiënten stopt behandeling vanwege adverse events in de venlafaxine groep (32%) en pregabaline groep (19%) dan in de carbamazepine groep (2%). Er bestaan aanzienlijke verschillen in het optreden van adverse events bij gebruik van de drie middelen: duizeligheid (12%, 73%, 42% van de patiënten in respectievelijk de carbamazepine, pregabaline en venlafaxine groep), somnolentie (4%, 53%, 23%), asthenie (1%, 6%, 13%), hoofdpijn (0%, 0%, 21%), en nausea (1%, 0%, 35%).
De resultaten van bovenstaande studies (Huffman, 2015; Vinik, 2014b; Razazian, 2014) geven meer inzicht in veiligheid- en tolerantieprofiel van anti-epileptica, inclusief verschillen tussen de anti-epileptica onderling. De studies ondersteunen de conclusies van Griebeler (2014) dat op basis van korte termijn gegevens, anti-epileptica zoals pregabaline, carbamazepine en het nieuwe middel mirogabaline, diabetische neuropathische pijn meer reduceren dan placebo. De bevindingen vormen geen reden om de conclusies op basis van Griebeler (2014) aan te passen.
Opioïden (oraal)
Schwartz (2015) verrichtte een gepoolde analyse van twee zogenaamde enriched enrollment randomized withdrawal (EERW) clinical trials van tapentadol ER (extended release; optimale dosering tussen 100 mg en 250 mg dd) met een studieduur van 12 weken (n=703); een van deze RCT’s maakt deel uit van de meta-analyse van Griebeler (2014). De RCT’s bestaan uit een verrijkingsfase waarin patiënten die gunstig reageren op tapentadol worden geïdentificeerd (responders), gevolgd door randomisatie van de responders naar continuering van behandeling (12 weken) met tapentadol (maintenance) of placebo (withdrawal): de toename in pijn en pijn-gerelateerde klachten in de placebo groep wordt geanalyseerd in vergelijking met de effecten van continuering van de behandeling met tapentadol. Schwartz (2015) rapporteert een statistisch significant en waarschijnlijk klinisch relevant grotere pijntoename in de placebogroep (NRS pijn, gemiddeld groepsverschil, MD= -1,14 [-1,44; -0,84). Een groter aantal patiënten ondervindt adverse events in de tapentadolgroep, 75% ten opzichte van 56% in de placebogroep: met name gastro-intestinale adverse events zoals nausea en braken (35% versus 18%), neurologische bijwerkingen zoals duizeligheid en somnolentie (20% versus 13%), en psychische bijwerkingen zoals angsten en insomnie (15% versus 9%). De resultaten van Schwartz (2015) vormen geen reden om de conclusies op basis van Griebeler (2014) aan te passen.
Aldose reductase inhibitors ARIs (oraal)
Er werd geen relevante aanvullende literatuur voor deze geneesmiddelgroep gevonden.
Overige behandelopties
Lakhan (2015) verrichtte een SR naar de waarde van botuline toxine-A (BoNT/A) bij behandeling van diabetische neuropathische pijn. Lakhan (2015) dekt de literatuur tot augustus 2014 en includeert twee RCT’s (Yuan, 2009; Ghasemi, 2014). De aanvullende zoekactie (zie: Zoeken en selecteren) leverde geen relevante recentere literatuur op. Omdat de SR van Lakhan (2015) van lage kwaliteit is door een inadequate beoordeling van de risk of bias van de geïncludeerde studies en onjuiste toepassing van statistiek, zijn de individuele studies (Yuan, 2009; Ghasemi, 2014) geanalyseerd en beoordeeld. Yuan (2009) is een kleine Taiwanese cross-over RCT (n=20) van lage kwaliteit met twee behandelperiodes van drie maanden waarin BoNT/A (50 units per voet) wordt vergeleken met placebo (fysiologisch zout). Een meerderheid van de patiënten (55%) gebruikt daarnaast anti-epileptica en/of antidepressiva. Yuan (2009) rapporteert een statistisch significant en waarschijnlijk klinisch relevant grotere pijnreductie in de BoNT-A groep (VAS pijn [0 tot 10], gemiddeld groepsverschil, MD= -2,00; p=0,024). Er wordt geen statistisch significant verschil in slaapkwaliteit (gemeten met de Chinese versie van de Pittsburgh Sleep Quality Index) of kwaliteit van leven (SF-36) waargenomen. Bij een patiënt wordt een milde huidinfectie vastgesteld bij een van de injectieplaatsen (groep niet gespecificeerd), er worden geen andere adverse events geconstateerd. Ghasemi (2014) is een Iranese RCT (n=40) van lage kwaliteit met een studieduur van slechts 3 weken, waarin BoNT/A (100 units per voet) wordt vergeleken met placebo (fysiologisch zout). Ghasemi (2014) rapporteert een mogelijk klinisch relevant grotere pijnreductie in de BoNT-A groep (NPS domein pijnintensiteit, NRS [0-10], gemiddeld groepsverschil, MD= -1,70 [-3,58; 0,18]); dit verschil in pijnreductie tussen interventie en controlegroep is echter statistisch niet significant. Er worden geen adverse events geconstateerd. Bovenstaande resultaten (Yuan, 2009; Ghasemi, 2014) suggereren dat BoNT/A diabetische neuropathische pijn mogelijk meer reduceert dan placebo. Hierbij dient rekening te worden gehouden met lage kwaliteit (hoge RoB) en geringe omvang van de studies.
Thompson (2015) verrichtte een SR naar de waarde van topisch amitriptyline bij behandeling van neuropathische pijn, waaronder diabetische neuropathische pijn. Thompson (2015) dekt de literatuur tot oktober 2014. De aanvullende zoekactie (zie: Zoeken en selecteren) leverde geen relevante recentere literatuur op. De SR includeert 5 placebogecontroleerde RCT’s, 2 ongecontroleerde klinische studies, en 5 observationele studies (case reports). Bij 3 van de 5 RCT’s werden ook patiënten met diabetische neuropathische pijn geïncludeerd (20 tot 40% van de studiepopulaties). De studieduur varieerde tussen 2 dagen en 6 weken. Bij geen van de 5 RCTs werd een statistisch significant grotere pijnreductie gevonden in de groep behandeld met topisch amitriptyline in vergelijking met placebo. Deze resultaten suggereren dat topisch amitriptyline niet effectief is bij de bestrijding van (diabetische) neuropathische pijn.
Kiani (2015) verrichtte een Iranese RCT die topisch gebruik van clonidine gel (0,1%) vergelijkt met capsaïcine crème (vermeld als 0,75%) bij patiënten met diabetische neuropathische pijn (n= 139) en een studieduur van 12 weken. Het is gebruikelijk om in capsaïcine crème 0,075% werkzame stof te gebruiken. Echter, de grondstof ervoor is oleo resina capsici, dat 10% capsaïcine bevat. De leden van de werkgroep vermoeden dat de auteurs dezelfde concentratie onderzochten als elders gebruikelijk, namelijk 0,75% oleoresina capsici, dat maakt dat de crème 0,075% werkzame stof bevat. Er wordt geen statistisch significant verschil gevonden tussen clonidine (een α2-adrenerge agonist) en capsaïcine in pijnreductie (afname in mediane VAS [0-10] pijnscore ten opzichte van baseline, respectievelijk 3,9 en 3,4; p=0,93). De fractie patiënten met tenminste 50% reductie in pijn (VAS) ten opzichte van baseline is hoger in de clonidine groep (57,1%) dan in de capsaïcine groep (40,6%); dit verschil bereikt net geen statistische significantie (p=0,051). Een statistisch significant groter aantal patiënten stopt de behandeling in de capsaïcine groep (43%) dan in de clonidine groep (23%; p=0,001). De meest voorkomende bijwerkingen van clonidine gel zijn een droge huid (4,2%) en jeuk (1,2%), en bij capsaïcine crème, jeuk (45,5%), blaarvorming (13,6%), en erythema (9,1%). Deze resultaten suggereren een vergelijkbare effectiviteit van clonidine gel en capsaïcine crème in het verminderen van diabetische neuropathische pijn, waarbij clonidine minder bijwerkingen lijkt te veroorzaken. De richtlijnwerkgroep is overigens van mening dat het percentage blaarvorming dat Kiani (2015) rapporteert bij gebruik van capsaïcine crème uitzonderlijk hoog is. Omdat een vergelijking met placebo ontbreekt kan geen directe conclusie worden getrokken met betrekking tot de werkzaamheid van deze middelen. De resultaten van Kiani (2015) vormen geen reden om de conclusies op basis van Griebeler (2014) aan te passen.
Agrawal (2014) verrichtte een Indiase placebogecontroleerde RCT naar de waarde van een stikstofoxide pleister (Nitrosense Derma Protect) bij patiënten met diabetische neuropathische pijn (n= 50) en een studieduur van 3 weken. Pijnreductie wordt gemeten met vier meetinstrumenten: VAS [0-10], PPI (present pain intensity; 6 puntsschaal 0 tot 5), een 11-punts Likert schaal (PLS, 11-puntsschaal 0-10), en de short form McGill pain questionnaire (SF-MPQ; 15 domeinen op 4-puntschaal 0-3). Agrawal (2014) rapporteert een mogelijk klinisch relevant grotere pijnreductie in de interventiegroep, die echter alleen op de PLS statistische significantie bereikt (gemiddeld groepsverschil op VAS, PPI, PLS, en SF-MPQ, respectievelijk MD= -0.33 [-1.16; 0.50], -0.20 [-0.62; 0.22], -0.54 [-1.07; -0.01], en -1.54 [-4.71; 1.63]). Bij een patiënt behandeld met de stikstofoxide pleister werd een huidreactie waargenomen die spontaan verdween. Bovenstaande resultaten suggereren dat een stikstofoxide pleister diabetische neuropathische pijn mogelijk meer reduceert dan placebo. Hierbij dient rekening te worden gehouden met de onverklaarbare verschillen die optraden bij gebruik van grotendeels vergelijkbare meetinstrumenten (VAS, PPI, PLS).
Bewijskracht van de literatuur
De bewijskracht (GRADE methodiek) is bepaald per uitkomstmaat en vergelijking, de nummering verwijst naar de opeenvolgende literatuurconclusies:
- Vergelijking met anti-epileptica: de bewijskracht is met 2 niveaus verlaagd vanwege imprecisie (SMD ligt onder de grens voor klinische relevantie, ondergrens CrI ligt dichtbij nul-effect en CrI van enige studie met lage RoB overlapt met nul-effect). Vergelijking met opioïden: met 1 niveau verlaagd vanwege indirectheid (indirecte vergelijking) en 1 niveau vanwege imprecisie (overlap met grens klinische relevantie). De bewijskracht is LAAG.
- Bewijskracht met 1 niveau verlaagd vanwege imprecisie (een enkele studie met lage RoB) en 1 niveau vanwege inconsistentie (resultaat niet bevestigd in netwerk meta-analyse). De bewijskracht is LAAG.
- SNRI’s: bewijskracht met 1 niveau verlaagd vanwege inconsistentie (SMD varieert tussen overall, lage RoB studies en netwerkmeta-analyse). Capsaïcine crème 0,075%: bewijskracht met 1 niveau verlaagd vanwege hoge RoB en 1 niveau vanwege imprecisie (overlap met grens klinische relevantie). TCA’s: bewijskracht met 1 niveau verlaagd vanwege hoge RoB en 1 niveau vanwege imprecisie (overlap met grens klinische relevantie). Anti-epileptica: bewijskracht met 1 niveau verlaagd vanwege imprecisie (overlap met MID in studie met lage RoB, en in netwerk meta-analyse). Bewijskracht is MATIG voor SNRI’s en anti-epileptica, en LAAG voor capsaïcine en TCA’s.
- Bewijskracht met 1 niveau verlaagd vanwege imprecisie (overlap met grens klinische relevantie). De bewijskracht is MATIG.
- ARI’s: bewijskracht verlaagd met 1 niveau voor RoB, en 2 niveau’s voor ernstige imprecisie (slechts 1 studie, CrI overlapt met beide grenzen MID). Lacosamide: bewijskracht verlaagd met 2 niveaus voor ernstige imprecisie (slechts 1 studie, CrI overlapt met beide grenzen MID). Dextromethorfan: bewijskracht verlaagd met 1 niveau voor RoB, en 2 niveaus voor ernstige imprecisie (slechts 1 studie, CrI overlapt met beide grenzen MID). Opioïden: bewijskracht verlaagd met 2 niveaus vanwege ernstige imprecisie (overlap met nul-effect). De bewijskracht is ZEER LAAG voor ARIs en dextromethorfan, en LAAG voor lacosamide en opioïden.
- ARI’s: bewijskracht met 1 niveau verlaagd vanwege RoB, en 1 niveau vanwege imprecisie (overlap met MID). Anti-epileptica: bewijskracht verlaagd met 1 niveau vanwege imprecisie (overlap met MDI). De bewijskracht is LAAG voor ARI’s, en MATIG anti-epileptica.
- Bewijskracht met 1 niveau verlaagd vanwege imprecisie (overlap met MID). De bewijskracht is MATIG.
- Vergelijking met venlafaxine: bewijskracht met 1 niveau verlaagd vanwege indirectheid (geen directe vergelijkingen) en 1 niveau vanwege imprecisie (overlap met MID). Vergelijking met duloxetine: bewijskracht met 1 niveau verlaagd vanwege indirectheid (maar 1 directe vergelijking), en 1 niveau vanwege imprecisie (overlap met MID). De bewijskracht is LAAG.
- Bewijskracht met 1 niveau verlaagd vanwege RoB, en 1 niveau vanwege imprecisie. De bewijskracht is LAAG.
- De bewijskracht is met 1 niveau verlaagd vanwege indirectheid (patiëntenpopulatie bestaat slechts deels uit patiënten met diabetische neuropathische pijn), en 1 niveau vanwege imprecisie (geringe studieomvang). De bewijskracht is LAAG.
- De bewijskracht is met 2 niveaus verlaagd vanwege imprecisie (overlap met nul-effect). De bewijskracht is LAAG.
- De bewijskracht is met 1 niveau verlaagd vanwege RoB, 1 niveau vanwege inconsistentie (tegenstrijdige resultaten bij vergelijkbare uitkomstmaten), en 2 niveaus vanwege imprecisie (overlap met nul-effect). De bewijskracht is ZEER LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat zijn de voor- en nadelige effecten (pijnreductie; vermindering van pijn-gerelateerde klachten; patiënttevredenheid, bijwerkingen en complicaties; kosten) van medicamenteuze behandelopties bij behandeling van pijnlijke diabetische polyneuropathie bij volwassen personen met diabetes?
Relevante uitkomstmaten
De werkgroep achtte patiëntgerapporteerde pijnintensiteit, ernstige bijwerkingen en complicaties, en patiënttevredenheid kritieke uitkomstmaten voor de besluitvorming. Een dichotome uitkomstmaat voor afname in pijnintensiteit verdient hierbij de voorkeur: de fractie patiënten met 30 tot 50% pijnreductie ten opzichte van baseline op een NRS schaal, of ten minste goede pijnreductie (Dworkin, 2008). Pijn-gerelateerde klachten (direct aan pijn gerelateerde aspecten van kwaliteit van leven, zoals slaapproblemen), milde bijwerkingen en complicaties, en kosten zijn benoemd als belangrijke uitkomstmaten voor de besluitvorming.
Als minimaal klinisch (patiënt) relevant effect definieerde de werkgroep voor pijnreductie (dichotome uitkomstmaat) een number needed to treat (NNT) van 11 (Finnerup, 2015). Voor pijnreductie (continue uitkomstmaat) ten opzichte van baseline, gemeten als een gestandaardiseerd gemiddeld verschil (SMD, standardized mean difference), werd de default grens aangehouden die wordt geadviseerd door de internationale GRADE working group: een groepsverschil van tenminste 0,5 standaard deviatie (0,5SD; SMD=0,5) werd als klinisch (patiënt) relevant beschouwd. Voor pijnreductie gemeten als een gemiddeld verschil (MD, mean difference) werd een waarde overeenkomend met 10% van de meetschaal beschouwd als een minimaal klinisch relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), en Embase is met relevante zoektermen gezocht vanaf het jaar 2003 naar systematische reviews over medicamenteuze behandelopties bij behandeling van pijnlijke diabetische polyneuropathie bij volwassen personen met diabetes. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 241 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review van vergelijkend onderzoek, vergelijking van medicamenteuze behandelopties onderling of met placebo, volwassen patiënten met pijnlijke diabetische polyneuropathie, met pijnintensiteit, pijn-gerelateerde klachten, patiënttevredenheid, ernstige bijwerkingen en complicaties of kosten als uitkomstmaat. Op basis van titel en abstract werden in eerste instantie 59 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 56 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 3 studies definitief geselecteerd. Een van de geselecteerde SR’s is een recente netwerk meta-analyse van de belangrijkste medicamenteuze behandelopties (Griebeler, 2014), de SR is van zeer goede kwaliteit en dekt de literatuur tot april 2014. Een aanvullende zoekactie richtte zich op gerandomiseerd onderzoek verschenen na april 2014 (zie zoekverantwoording op tabblad Verantwoording; zoekdatum april 2016). De zoekactie leverde 90 treffers op, 49 studies werden voorgeselecteerd waarvan 39 studies werden geëxcludeerd na raadpleging van de volledige tekst, en 10 studies definitief geselecteerd. Een recent Cochrane review (Moore, 2015) werd aan de selectie toegevoegd.
Veertien onderzoeken zijn opgenomen in de literatuuranalyse. Voor een gedetailleerde beschrijving van de studiekarakteristieken en resultaten van de netwerk meta-analyse van Griebeler (2014) en een beoordeling van de studieopzet (risk of bias) van de geïncludeerde studies, wordt verwezen naar de originele publicatie inclusief bijlagen. De beoordeling van de individuele studieopzet (risk of bias) van de aanvullende studies zijn opgenomen in de risk of bias tabellen.
Referenties
- Agrawal RP, Jain S, Goyal S, et al. A Clinical Trial of Nitrosense patch for the treatment of patients with painful diabetic neuropathy. J Assoc Physicians India. 2014;62(5):385-90. PubMed PMID: 25507999.
- Allen R, Sharma U, Barlas S. Clinical experience with desvenlafaxine in treatment of pain associated with diabetic peripheral neuropathy. J Pain Res. 2014;7:339-51. doi: 10.2147/JPR.S55682. eCollection 2014. PubMed PMID: 25018648; PubMed Central PMCID: PMC4075949.
- Burness CB, McCormack PL. Capsaicin 8 % Patch: A Review in Peripheral Neuropathic Pain. Drugs. 2016;76(1):123-34. doi: 10.1007/s40265-015-0520-9. Review. PubMed PMID: 26666418.
- Boulton AJ, Vinik AI, Arezzo JC, et al. Diabetic neuropathies: a statement by the American Diabetes Association. Diabetes Care. 2005;28(4):956-62. Review. PubMed PMID: 15793206.
- Domecq JP, Prutsky G, Leppin A, et al. Clinical review: Drugs commonly associated with weight change: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2015;100(2):363-70. doi: 10.1210/jc.2014-3421. Review. PubMed PMID: 25590213.
- Dworkin RH, Turk DC, Wyrwich KW, et al. Interpreting the clinical importance of treatment outcomes in chronic pain clinical trials: IMMPACT recommendations. J Pain. 2008;9(2):105-21. Epub 2007 Dec 11. PubMed PMID: 18055266.
- FK. Farmacotherapeutisch Kompas. 2016. Link: www.farmacotherapeutischkompas.nl [geraadpleegd dec 2016].
- Finnerup NB, Attal N, Haroutounian S, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015;14(2):162-73. doi: 10.1016/S1474- 422(14)70251-0. Epub 2015 Jan 7. Review. PubMed PMID: 25575710; PubMed Central PMCID: PMC4493167.
- Gao Y, Guo X, Han P, et al. Treatment of patients with diabetic peripheral neuropathic pain in China: a double-blind randomised trial of duloxetine vs. placebo. Int J Clin Pract. 2015;69(9):957-66. doi: 10.1111/ijcp.12641. Epub 2015 May 4. PubMed PMID: 25939897; PubMed Central PMCID: PMC4682474.
- Ghasemi M, Ansari M, Basiri K, et al. The effects of intradermal botulinum toxin type a injections on pain symptoms of patients with diabetic neuropathy. J Res Med Sci. 2014;19(2):106-11. PubMed PMID: 24778662; PubMed Central PMCID: PMC3999594.
- Griebeler ML, Morey-Vargas OL, Brito JP, et al. Pharmacologic interventions for painful diabetic neuropathy: An umbrella systematic review and comparative effectiveness network meta-analysis. Ann Intern Med. 2014;161(9):639-49. doi: 10.7326/M14-0511. Review. Erratum in: Ann Intern Med. 2015 Apr 21;162(8):600. Ann Intern Med. 2015 May 19;162(10):739. PubMed PMID: 25364885.
- Huffman C, Stacey BR, Tuchman M, et al. Efficacy and Safety of Pregabalin in the Treatment of Patients With Painful Diabetic Peripheral Neuropathy and Pain on Walking. Clin J Pain. 2015;31(11):946-58. doi: 10.1097/AJP.0000000000000198. PubMed PMID: 25565583.
- Kiani J, Sajedi F, Nasrollahi SA, et al. A randomized clinical trial of efficacy and safety of the topical clonidine and capsaicin in the treatment of painful diabetic neuropathy. J Res Med Sci. 2015;20(4):359-63. PubMed PMID: 26109991; PubMed Central PMCID: PMC4468451.
- Lakhan SE, Velasco DN, Tepper D. Botulinum Toxin-A for Painful Diabetic Neuropathy: A Meta-Analysis. Pain Med. 2015;16(9):1773-80. doi: 10.1111/pme.12728. Epub 2015 Mar 20. PubMed PMID: 25800040.
- Max MB, Lynch SA, Muir J, et al. Effects of desipramine, amitriptyline, and fluoxetine on pain in diabetic neuropathy. N Engl J Med. 1992;326(19):1250-6. PubMed PMID: 1560801.
- Moore RA, Derry S, Aldington D, et al. Amitriptyline for neuropathic pain in adults. Cochrane Database Syst Rev. 2015;7:CD008242. doi: 10.1002/14651858.CD008242.pub3. Review. PubMed PMID: 26146793.
- NDF. Zorgstandaard Diabetes. 2015. Link: http://www.zorgstandaarddiabetes.nl/ [geraadpleegd op 20 januari 2017].
- NICE. NICE guidelines [CG173]. Neuropathic pain in adults: pharmacological management in non-specialist settings. 2013. Link: https://www.nice.org.uk/guidance/cg173 (geraadpleegd april 2016).
- Razazian N, Baziyar M, Moradian N, et al. Evaluation of the efficacy and safety of pregabalin, venlafaxine, and carbamazepine in patients with painful diabetic peripheral neuropathy. A randomized, double-blind trial. Neurosciences (Riyadh). 2014;19(3):192-8. PubMed PMID: 24983280; PubMed Central PMCID: PMC4727652.
- Schwartz S, Etropolski MS, Shapiro DY, et al. A pooled analysis evaluating the efficacy and tolerability of tapentadol extended release for chronic, painful diabetic peripheral neuropathy. Clin Drug Investig. 2015;35(2):95-108. doi: 10.1007/s40261-014-0249-3. PubMed PMID: 25503082; PubMed Central PMCID: PMC4300409.
- Simpson DM, Robinson-Papp J, Van J, et al. Capsaicin 8% Patch in Painful Diabetic Peripheral Neuropathy: A Randomized, Double-Blind, Placebo-Controlled Study. J Pain. 2016. pii: S1526-5900(16)30244-9. doi: 10.1016/j.jpain.2016.09.008. [Epub ahead of print] PubMed PMID: 27746370.
- Thompson DF, Brooks KG. Systematic review of topical amitriptyline for the treatment of neuropathic pain. J Clin Pharm Ther. 2015. doi: 10.1111/jcpt.12297. [Epub ahead of print] PubMed PMID: 26059975.
- Vinik A, Rosenstock J, Sharma U, et al. Efficacy and safety of mirogabalin (DS-5565) for the treatment of diabetic peripheral neuropathic pain: a randomized, double-blind, placebo- and active comparator-controlled, adaptive proof-of-concept phase 2 study. Diabetes Care. 2014;37(12):3253-61. doi: 10.2337/dc14-1044. Epub 2014 Sep 17. PubMed PMID: 25231896. [2014b]
- Yasuda H, Hotta N, Kasuga M, et al. Efficacy and safety of 40 mg or 60 mg duloxetine in Japanese adults with diabetic neuropathic pain: Results from a randomized, 52-week, open-label study. J Diabetes Investig. 2016;7(1):100-8. doi: 10.1111/jdi.12361. Epub 2015 May 18. PubMed PMID: 26816607; PubMed Central PMCID: PMC4718094.
- Yuan RY, Sheu JJ, Yu JM, et al. Botulinum toxin for diabetic neuropathic pain: a randomized double-blind crossover trial. Neurology. 2009;72(17):1473-8. doi: 10.1212/01.wnl.0000345968.05959.cf. PubMed PMID: 19246421.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: What is the optimal pharmaceutical treatment of neuropathic pain in patients with diabetic polyneuropathy?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Griebeler 2014 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes*1 |
Unclear*1 |
|
Moore 2015 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes*2 |
Yes *2 |
Unclear*2 |
|
Lakhan 2015 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes/No*3 |
No*3 |
Unclear*3 |
Unclear *3 |
|
Thompson 2015 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Unclear*4 |
Yes*4 |
Unclear*4 |
Unclear*4 |
*1 authors state that evaluation for publication bias was not possible because of the few studies included in each drug class (n<10) and large heterogeneity; potential conflicts of interest and funding reported for the systematic review but not for the individual studies included in the systematic review
*2 SR on use of amitriptyline for neuropathic pain with subanalyses on diabetic neuropathic pain; authors state that assessment of publication bias was not carried out because of low quality of the data identified; potential conflicts of interest and funding reported for the systematic review but not for the individual studies included in the systematic review
*3 used Cochrane RoB tool, but authors’ judgment of RoB is inadequate (BoNT/A cannot be properly blinded: patients easily guess which treatment they received); pooled analyses are inadequate (crossover design not taken into account, assessment of heterogeneity inadequate, only data at very short followup analysed); assessment of publication bias inadequate (funnel plot with only 2 studies); potential conflicts of interest and funding reported for the systematic review but not for the individual studies included in the systematic review
*4 only limited assessment of study quality (RoB) by stating ‘study limitations’; no meta-analysis; possibility of publication bias mentioned without formal analysis; potential conflicts of interest and funding reported for the systematic review but not for the individual studies included in the systematic review
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: What is the optimal pharmaceutical treatment of neuropathic pain in patients with diabetic polyneuropathy?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Yasuda 2016 |
re-randomized using a stochastic minimization method |
Unlikely*1 |
Unlikely*1 |
Unlikely*1 |
Unlikely*1 |
Unlikely |
Unlikely*1 |
Unlikely |
|
Gao 2015 |
No details provided |
Unclear*2 |
Unlikely |
Unlikely |
Unlikely*2 |
Unlikely |
Unlikely |
Unlikely |
|
Allen 2014 |
computerized randomization to assign subject numbers and study drug package numbers |
Unlikely*3 |
Unlikely*3 |
Unlikely*3 |
Unlikely*3 |
Unlikely |
Unclear*3 |
Unlikely |
|
Hufman 2015 |
computer-generated pseudorandom code using method of random permuted blocks |
Unlikely |
Unlikely |
Unclear*4 |
Unlikely |
Unlikely |
Unlikely |
Unlikey |
|
Vinik 2014b |
No details provided |
Unclear*5 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Razazian 2014 |
computer generated randomization schedule |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely*6 |
Unlikely |
|
Schwartz 2015 |
No details provided |
Unclear*7 |
Unclear*7 |
Unclear*7 |
Unclear*7 |
Unlikely |
Unclear*7 |
Unlikely |
|
Yuan 2009 |
No details provided |
Unclear*8 |
Unclear*8 |
Unclear*8 |
Unclear*8 |
Unclear*8 |
Unlikely |
Unlikely |
|
Ghasemi 2014 |
‘simple randomized sampling method’ |
Likely |
Unclear*9 |
Unclear*9 |
Unclear*9 |
Unclear*9 |
Unlikely |
Unlikely |
|
Kiani 2015 |
‘Randomization by permuted-block design’ |
Unlikely |
Unclear*10 |
Unclear*10 |
Unclear*10 |
Unclear*10 |
Unclear*10 |
Unlikely |
|
Agrawal 2014 |
‘independent statistician generated randomisation list using dedicated computer software’ |
Unlikely |
Unlikely |
Unlikely*11 |
Unlikely*11 |
Likely*11 |
Unlikely |
Unlikely |
*1 Long-term open-label extension study of earlier placebo-controlled RCT of duloxetin (re-randomized to 2 dosages of duloxetine); bias as a result of lack of blinding is unlikely because 2 dosages of the active substance are being compared; patient reported outcome measure; for the comparison between the 2 dosages, bias as a result of loss to follow-up is unlikely; Note: concerning the efficacy of the active substance, the extenison study only provides indirect evidence of effectiveness in comparison with placebo (a placebo group was lacking in the extension study)
*2 patients ‘were randomised’ (no details on method of randomization provided); patient reported outcome measure
*3 Study consists of short-term double-blind RCT followed by open-label extension (i.e. not blinded; extension study was stopped early); patient reported outcome measure; relatively high number of discontinuations in (high dose) intervention groups (17% in placebo versus upto 39% at highest dose of active substance), LCOF approach used for missing data
*4 Crossover RCT with two 6-week treatment periods, separated by a 2-week ‘single-blind’ washout period (: only patients blinded?); patient reported outcome measure; Note:despite of the washout period, data suggest a considerable carryover effect to the second treatment period
*5 patients ‘were randomised’ (no details on method of randomization provided); patient reported outcome measure; slightly higher number of discontinuations in intervention groups (13% in placebo versus upto 32% at higher dosages of active substance), LCOF approach used for missing data
*6 patient reported outcome measure; management of withdrawals is unclear (‘patients that withdrew due to adverse events were substituted with an equal number’); Note: one of the active substances tested (carbamazepine) was used at a dosage below what is generally considered the minimal effective dose; one of the treatment groups (pregabaline) had considerably higher mean pain score at baseline; the percentage responders is much higher than generally observed in similar studies
*7 randomization method not specified in this pooled analysis of 2 erichment trials in which responders to tapentadol were randomized to continuation of treatment (12 weeks) or placebo; risk of unblinding of patients (and care providers) as a result of withdrawal symptoms; patient reported outcome measure; high number of discontinuations (30% versus 29% in placebo group)
*8 randomization method not specified; proper blinding of BoNT/A is not possible because of obvious effects; patient reported outcome measure; responder analysis only reports results using high MID (: leaving no responders in the placebo group); Note: trial registry states n=30 participants while only 20 patients are mentioned in the publication; high risk of carryover effect (crossover RCT without washout period [however carryover effect would be expected to decrease the effect size of BoNT/A])
*9 randomization specified as ‘simple randomized sampling method’ (and very little detail is provided on baseline characteristics of intervention and control group); proper blinding of BoNT/A is not possible because of obvious effects; patient reported outcome measure; incomplete reporting of VAS pain results (only proportion of patients without pain [= VAS score of 0?] at end of treatment is being reported); trial not registered
*10 proper blinding of capsaicin cream (versus clonidine gel) may not be possible because of obvious effects (as well as obvious differences between a cream and a gel); patient reported outcome measure; very high number of discontinuations (44% in capsaicine, and 23% in clonidine group), study used ‘multiple imputations by the regression method’ (no details provided)
*11 Nitrosense and placebo patch had identical appearance; patient reported outcome measure; 4 different pain assessments were used, responders were defined using the (only) pain assessment tool that showed a statistically significant treatment effect
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Stap-1 Eerste zoekactie naar (mogelijke) SR’s |
|
|
Zhang 2015 |
SR pregabaline; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Whalen 2015 |
meeting abstract |
|
Snedecor 2014 |
SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Pauer 2014 |
verkeerde PICO |
|
Lunn 2014 |
SR duloxetine; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Li 2014 |
SR acetylcarnitine; verkeerde PICO |
|
Dixit 2014 |
narrative review |
|
Zhou 2013 |
SR oxcarbazepine; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Vinik 2013 |
verkeerde PICO; secundaire analyse |
|
Rudroju 2013 |
SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Pergolizzi 2013 |
SR duloxetine 60 mg 1x/dag; exclusie vanwege dosis-eis; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Lin 2013 |
poster/abstract |
|
Iyer 2013 |
SR duloxetine, pregabaline; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Chinthammit 2013 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Mijnhout 2012 |
verkeerde PICO |
|
Hearn 2012 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Griebeler 2012 |
protocol |
|
Othman 2011 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Mahmoud 2011 |
geen SR |
|
Gill 2011 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Edelsberg 2011 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Chen 2011 |
verkeerde PICO |
|
Bril 2011a |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Bril 2011b |
komt overeen met Bril 2011a |
|
Bril 2011c |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Zilliox 2010 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Wolff 2010 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Roth 2010 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
McCleane 2010 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Lunn 2010 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Finnerup 2010 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014; update verschenen (Finnerup 2015) |
|
Dhillon 2010 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Quilici 2009 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Lunn 2009 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Harris 2009 |
verkeerde PICO |
|
Gabriel 2009 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Chou 2009 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Sultan 2008 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Peppin 2008 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Lee 2008 |
verkeerde PICO |
|
Hurley 2008 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Freeman 2008 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Ang 2008 |
verkeerde PICO |
|
Wong 2007 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Tang 2007 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Gutierrez-Alvarez 2007 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Guirguis-Blake 2007 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Chalk 2007 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Attal 2006 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Vinik 2005 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Hahn 2005 |
verkeerde PICO |
|
Corbett 2005 |
geen SR |
|
Adriaensen 2005 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Dib 2004 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Halat 2003 |
verkeerde PICO |
|
Backonja 2003 |
minder recente SR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Stap-2 Vervolgzoekactie: naar (mogelijke) RCT’s ter aanvulling van geselecteerde SR’s (Thompson 2015; Lakhan 2015; Griebeler 2014) |
|
|
Zhang 2015 |
exclusie in stap-1 |
|
Yasuda 2016 |
verkeerde PICO |
|
Yasuda 2015 |
commentaar |
|
Wallace 2015 |
verkeerde PICO (3 uur follow-up) |
|
Schaeffer 2015 |
verkeerde PICO; niet vergelijkend |
|
Rokicka 2015 |
verkeerde PICO |
|
Parsons 2015 |
post-hoc analyse |
|
Ogawa 2015 |
verkeerde PICO |
|
Marchettini 2015 |
verkeerde PICO |
|
Macaré van Maurik 2015 |
verkeerde PICO |
|
Lakhan 2015 |
geïncludeerd in stap-1 |
|
Juhn 2015 |
verkeerde PICO |
|
Jaiswal 2015 |
verkeerde PICO |
|
Hong 2015 |
verkeerde PICO |
|
Ziegler 2014 |
post-hoc analyse |
|
Wiffen 2014 |
minder recente SR carbamazepine; niet beperkt tot PDNP; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Wang 2014 |
verkeerde PICO; betreft fulranumab |
|
Vinik 2014a |
onderdeel van Schwartz 2015 |
|
Vinik 2014c |
post-hoc analyse |
|
Vasudevan 2014 |
verkeerde PICO |
|
Tanenberg 2014 |
post-hoc analyse; verkeerde PICO |
|
Snedecor 2014 |
exclusie in stap-1 |
|
Smith 2014 |
verkeerde PICO; betreft carisbamate |
|
Slangen 2014 |
verkeerde PICO |
|
Saeed 2014 |
verkeerde PICO; niet vergelijkend |
|
Raskin 2014 |
verkeerde PICO |
|
Rajanandh 2014 |
verkeerde PICO |
|
Patel 2014 |
geen RCT maar cohortstudie |
|
Niesters 2014 |
verkeerde PICO |
|
Lunn 2014 |
exclusie in stap-1 |
|
Irving 2014 |
verkeerde PICO; betreft subpopulatie (non-responders voor gabapentin) |
|
Hearn 2014a |
geen RCT; SR Desipramine; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Hearn 2014b |
geen RCT; SR Imipramine; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Happich 2014 |
geen RCT |
|
Gaskell 2014 |
geen RCT; SR oxycodone-CR; geen meerwaarde ten opzichte van Griebeler 2014 |
|
Deng 2014 |
verkeerde PICO |
|
De Vos 2014 |
verkeerde PICO |
|
Tesfaye 2013 |
valt onder Griebeler 2014 |
|
Rudroju 2013 |
exclusie in stap-1 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-04-2018
Beoordeeld op geldigheid : 28-11-2017
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Geldigheid/ frequentie herbeoordeling per module:
- Module-1 (Screening): 2022/ eens in de vijf jaar
- Module-2 (Medicamenteuze): 2019/ jaarlijks
- Module-3 (Niet-medicamenteuze): 2020/ eens in de twee jaar
- Module-4 (Evaluatie): 2020/ eens in de twee jaar
- Module-5 (Organisatie): 2022/ eens in de vijf jaar
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De richtlijn heeft als doelstelling zorgprofessionals handvatten te bieden voor de screening, diagnostiek, en behandeling van pijnlijke diabetische polyneuropathie (PDNP). Daarnaast beschrijft de richtlijn hoe de zorg voor een patiënt met PDNP het beste georganiseerd kan worden in Nederland.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor volwassen personen met diabetes en (risico op) PDNP. Deze beroepsgroepen bestaan onder andere uit internisten, diabetes verpleegkundigen, huisartsen, praktijkondersteuners, neurologen, klinisch neurofysiologen, anesthesiologen, revalidatieartsen, (diabetes) podotherapeuten, medisch pedicures en klinisch psychologen.
Samenstelling werkgroep
De richtlijn Pijnlijke diabetische neuropathie is onderdeel van de Netwerkrichtlijn diabetes mellitus ontwikkeld onder overkoepelend voorzitterschap van Dr. P.H.L.M. (Nel) Geelhoed, internist-endocrinoloog, Haaglanden Medisch Centrum, Den Haag (Nederlandse Internisten Vereniging).
Voor het ontwikkelen van de richtlijn Pijnlijke diabetische neuropathie is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de relevante specialismen die betrokken zijn bij de zorg voor personen met diabetes en (een risico op) PDNP.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. J.L.M. (Joost) Jongen, neuroloog, afd. Neurologie, Erasmus MC, Rotterdam (voorzitter); Nederlandse Vereniging voor Neurologie
- Dr. C. (Camiel) Verhamme, neuroloog en klinisch neurofysioloog, afd. Neurologie, AMC Amsterdam; Nederlandse Vereniging voor Neurologie
- Dr P.S. (Sytze) van Dam, internist-endocrinoloog en -vasculair geneeskundige, afd. Interne Geneeskunde, OLVG Amsterdam; Nederlandse Internisten Vereniging
- Prof. Dr. N.C. (Nicolaas) Schaper, internist-endocrinoloog, Maastricht UMC+; Nederlandse Internisten Vereniging
- Dr G. (Gerbrig) Versteegen, klinisch medisch psycholoog, UMC Groningen; Nederlands Instituut van Psychologen
- Dr. A.J.M. (Bart) van Wijck, anesthesioloog-pijnspecialist, UMC Utrecht; Nederlandse Vereniging voor Anesthesiologie
Klankbordgroep
- Dr A. (Anneloes) Kerssen, huisarts en kaderarts diabetes, Huisartsenpraktijk Kerssen & van der Wal, Den Haag; Nederlands Huisartsen Genootschap
- Dr. C.J. (Cees) Vos, huisarts en kaderarts diabetes, Huisartsenpraktijk C.J. Vos, Spijkenisse; Nederlands Huisartsen Genootschap
- Dr. J.V.H. (Jan) Palmen, huisarts en kaderarts diabetes, Aarveld Medisch Centrum, Heerlen; op persoonlijke titel
Met ondersteuning van
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Monique) Wessels, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- L. (Linda) Niesink (MSc), medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S.K. (Sanne) Josso, senior projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Met dank aan
- E. (Eglantine) Barends, beleidsmedewerker, Diabetesvereniging Nederland
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Ondernomen actie |
|
Jongen |
Neuroloog, ErasmusMC, Rotterdam |
Lid richtlijn pijn bij kanker (onbetaald) |
sporadische sprekersvergoeding, zie hieronder voor de afgelopen twee jaar: Nederlandse Vereniging voor Oncologie (nascholing) Two Hands Events; het pijnspreekuur (nascholing); Amgen (2x in 2016; vergoeding t.n.v. Erasmus MC, onderzoek, niet t.b.v. mijzelf) |
sporadische sprekersvergoeding, zie hieronder voor de afgelopen twee jaar: Amgen (nascholing) |
nvt |
Wetenschappelijk onderzoek, medegefinancierd (geweest) door: |
nvt |
nvt |
Geen |
|
Kerssen |
huisarts |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Palmen |
huisarts |
als kaderhuisarts DM: Adviseur zorggroep, Huisartsen OZL; Hoofddocent DM, SOBH, Utrecht;Docent Langerhans Stichting;DoCent DM, Univ. Maastricht, 3dejaars AIOS |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Schaper |
Hoofd Endocrinologie, afd. Interne Geneeskunde Maastricht UMC |
Hoofdredacteur Diabetes educatie website DIEP (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Van Dam |
internist |
geen |
geen |
geen |
geen |
in het verleden wetenschappelijke trial diabetische neuropathie met alfa-lipic acid. Thans deelname aan mlticentrer trial Grünenthal met cebranopadol |
geen |
geen |
Geen |
|
Van Wijck |
anesthesioloog-pijnspecialist in UMC Utrecht |
geen |
Ik heb wel persoonlijke belangen gehad, maar geen persoonlijke relaties die hier van belang zijn. 2014 adviesraad Versaties van Grunenthal |
Ik heb wel persoonlijke belangen gehad, maar geen persoonlijke relaties die hier van belang zijn. 2014 adviesraad Versaties van Grunenthal |
vice voorzitter stafconvent UMC Utrecht |
Ik ben betrokken (geweest) bij onderzoek gefinancierd door Astellas en SanofiPasteurMSD. Beide onderzoeken gingen over posttherpetisch neuralgie. |
geen |
geen |
Geen |
|
Verhamme |
neuroloog/klinisch neurofysioloog 0,8 fte |
geen |
geen |
geen |
Onbetaald: spierziekten Nederland, werkgroep erfelijk polyneuropathieën, medisch adviseur. Interuniversitair steunpunt neuromusculair onderzoek (ISNO), symposium en website commissie |
geen |
geen |
geen |
Geen |
|
Versteegen |
klinisch psycholoog |
docent/mentor PPO post doc. Opleiding voor GZ psycholoog en klinisch psycholoog |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Vos |
huisarts |
geen |
geen |
geen |
lid commissie Whiplash Nederland |
geen |
geen |
geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een in een eerder stadium door de patiëntenvereniging uitgevoerde enquête onder haar leden (zie richtlijn Diabetes Mellitus; NIV, 2014). Daarnaast zijn de conceptuitgangsvragen tijdens de knelpuntanalyse voorgelegd aan een viertal representatieve patiënten (zie Verslag patiënteninterviews). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging (Diabetesvereniging Nederland).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference (gezamenlijk voor zeven richtlijnen die deel uitmaken van de netwerkrichtlijn diabetes, diabetische neuropathie, diabetische voet, diabetische retinopathie, kinderen, ouderen met comorbiditeit, diabetes en zwangerschap, diabetes en psychiatrie) door: de Nederlandse Internisten Vereniging, Diabetesvereniging Nederland, Eerste Associatie Van Diabetesverpleegkundigen, Inspectie voor de Gezondheidszorg, Koninklijke Nederlandse Organisatie van Verloskundigen, Menzis, Nefarma, Nederlandse Federatie van Universitair Medische Centra, Nederlands Huisartsen Genootschap, Nederlands Oogheelkundig Gezelschap, Nederlandse Vereniging voor Anesthesiologie, Nederlandse Vereniging van Diëtisten, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Vereniging voor Neurologie, Nederlandse Vereniging voor Obstetrie & Gynaecologie, Nederlandse Vereniging van Diabetes Podotherapeuten, Optometristen Vereniging Nederland, Provoet (Brancheorganisatie voor de Pedicure), Verpleegkundigen & Verzorgenden Nederland, Verenso, WCS Kenniscentrum Wondzorg, Zorgverzekeraars Nederland en Zorginstituut Nederland. Een verslag van de invitational conference is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor deze richtlijn is geen overkoepelende oriënterende zoekactie uitgevoerd. Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor: Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig/ Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie).
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode (zie ook Mathieson 2015).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Er zijn geen nieuwe kwaliteitsindicatoren ontwikkeld omdat er voor diabetes al voldoende indicatoren bestaan, onder andere behorend bij de NDF Zorgstandaard Diabetes (NDF 2015).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisatie voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Diabetesvereniging Nederland, Vereniging Innovatieve Geneesmiddelen (voorheen Nefarma), Nederlandse Federatie van Universitair Medische Centra, beroepsorganisatie voor diabetesverpleegkundigen en praktijkondersteuners, Nederlandse Vereniging voor Klinische Geriatrie, Verpleegkundigen en Verzorgenden Nederland, Verenso, Zorgverzekeraars Nederland, Zorginstituut Nederland, Inspectie voor de Gezondheidszorg, Nederlandse Vereniging van Diabetes Podotherapeuten, Nederlandse Vereniging van Podotherapeuten, ProVoet, Nederlandse Vereniging voor Heelkunde, Nederlandse Vereniging van Revalidatieartsen, Nederlandse Orthopaedische Vereniging, Nederlandse Diabetes Federatie, Stichting InEen, Nederlandse Vereniging voor de Gezondheidszorgpsychologie, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, Nederlandse Vereniging van Ziekenhuisapothekers, Bijwerkingencentrum Lareb, en Koninklijk Nederlands Genoodschap voor Fysiotherapie. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Mathieson S, Maher CG, Terwee CB, et al. Neuropathic pain screening questionnaires have limited measurement properties. A systematic review. J Clin Epidemiol. 2015. pii: S0895-4356(15)00155-9. doi: 10.1016/j.jclinepi.2015.03.010. [Epub ahead of print] Review. PubMed PMID: 25895961.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. 2012. Link: https://richtlijnendatabase.nl/over_deze_site.html
NDF. Zorgstandaard Diabetes. 2015. Link: http://www.zorgstandaarddiabetes.nl/ [geraadpleegd op 20 januari 2017].
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. Link xxx.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Stap-1: initiële search naar systematische reviews |
|
|
|
Medline (OVID) 2003 – juli 2015
zoekdatum: 15 juli 2015 |
1 exp *Diabetes Mellitus/ or diabetes mellitus.ab,ti. or exp *Diabetes Mellitus, Type 1/ or exp *Diabetes Mellitus, Type 2/ or diabet*.ti. or dm1.ti. or dm2.ti. or iddm.ti. (344111) 2 exp Mononeuropathies/ or neuropath*.ab,ti. or exp polyneuropathies/ or polyneuropath*.ab,ti. or Erythromelalgia/ or ((fibre* or fiber*) adj3 neuropath*).ti,ab. (133698) 3 1 and 2 (14851) 4 exp Pain/ or pain*.ab,ti. (628074) 5 3 and 4 (2437) 6 exp analgesics/ or exp anticonvulsants/ or Serotonin Uptake Inhibitors/ or exp Analgesics, Opioid/ or exp Drug Therapy/ or exp Cannabis/ or exp Capsaicin/ or exp Lidocaine/ or exp Botulinum Toxins/ or mexelitin*.ab,ti. or nmda.ab,ti. or snri*.ab,ti. (1614584) 7 5 and 6 (668) 8 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (242136) 9 7 and 8 (43) 10 limit 9 to (yr="2003 -Current" and (dutch or english)) (36)
= 36 (35 uniek) |
241 |
|
Embase |
'diabetes mellitus'/exp/mj OR 'diabetes mellitus' OR 'insulin dependent diabetes mellitus'/exp/mj OR 'insulin dependent diabetes mellitus' OR 'non insulin dependent diabetes mellitus'/exp/mj OR 'non insulin dependent diabetes mellitus' OR diabet*:ti OR dm1:ti OR dm2:ti OR iddm:ti AND ('polyneuropathy'/exp OR polyneuropath*:ab,ti OR 'neuropathy'/exp OR neuropath*:ab,ti OR 'erythromelalgia'/exp OR ((fibre* OR fiber*) NEAR/3 neuropath*):ab,ti) AND ('pain'/exp OR pain*:ab,ti) AND ('analgesic agent'/exp OR 'drug therapy'/exp OR 'serotonin noradrenalin reuptake inhibitor'/exp OR snri*:ab,ti OR 'anticonvulsive agent'/exp OR 'opiate'/exp OR opioid*:ab,ti OR 'cannabis'/exp OR cannabis:ab,ti OR capsaïcine*:ab,ti OR lidocaine*:ab,ti OR botulin*:ab,ti OR nmda:ab,ti OR mexelitin*:ab,ti) AND ([dutch]/lim OR [english]/lim) AND [2003-2015]/py AND [embase]/lim AND ('meta analysis'/exp OR 'meta analysis' OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/exp OR 'systematic review')
= 230 (225 uniek) |
|
|
Stap-2: aanvullende search naar RCTs |
|
|
|
Medline (OVID) april 2014 – december 2015
zoekdatum: 15 dec 2015 |
1 exp *Diabetes Mellitus/ or diabetes mellitus.ab,ti. or exp *Diabetes Mellitus, Type 1/ or exp *Diabetes Mellitus, Type 2/ or diabet*.ti. or dm1.ti. or dm2.ti. or iddm.ti. 2 exp Mononeuropathies/ or neuropath*.ab,ti. or exp polyneuropathies/ or polyneuropath*.ab,ti. or Erythromelalgia/ or ((fibre* or fiber*) adj3 neuropath*).ti,ab. 3 1 and 2 4 exp Pain/ or pain*.ab,ti. 5 3 and 4 6 exp analgesics/ or exp anticonvulsants/ or Serotonin Uptake Inhibitors/ or exp Analgesics, Opioid/ or exp Drug Therapy/ or exp Cannabis/ or exp Capsaicin/ or exp Lidocaine/ or exp Botulinum Toxins/ or mexelitin*.ab,ti. or nmda.ab,ti. or snri*.ab,ti. 7 5 and 6 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) 9 7 and 8 10 (201404$ or 201405$ or 201406$ or 201407$ or 201408$ or 201409$ or 201410$ or 201411$ or 201412$).ed. 11 2015$.ed. 12 10 or 11 13 9 and 12 14 limit 13 to (dutch or english)
= 31 (28 uniek) |
90 |
|
Embase |
'diabetes mellitus'/exp/mj OR 'diabetes mellitus' OR 'insulin dependent diabetes mellitus'/exp/mj OR 'insulin dependent diabetes mellitus' OR 'non insulin dependent diabetes mellitus'/exp/mj OR 'non insulin dependent diabetes mellitus' OR diabet*:ti OR dm1:ti OR dm2:ti OR iddm:ti AND ('polyneuropathy'/exp OR polyneuropath*:ab,ti OR 'neuropathy'/exp/mj OR neuropath*:ab,ti OR 'erythromelalgia'/exp OR ((fibre* OR fiber*) NEAR/3 neuropath*):ab,ti) AND ('pain'/exp OR pain*:ab,ti) AND ('analgesic agent'/exp OR 'drug therapy'/exp OR 'serotonin noradrenalin reuptake inhibitor'/exp OR snri*:ab,ti OR 'anticonvulsive agent'/exp OR 'opiate'/exp OR opioid*:ab,ti OR 'cannabis'/exp OR cannabis:ab,ti OR capsaïcine*:ab,ti OR lidocaine*:ab,ti OR botulin*:ab,ti OR nmda:ab,ti OR mexelitin*:ab,ti) AND ([dutch]/lim OR [english]/lim) AND ([1-4-2014]/sd NOT [15-12-2015]/sd) AND [embase]/lim AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it)
= 76 (71 uniek) |
|
