PIEB versus CEI en/ of PCEA
Uitgangsvraag
Wat is de toegevoegde waarde van PIEB ten opzichte van continue epidurale infusie of PCEA (met of zonder achtergrondinfusie) bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
Aanbeveling
Geef, indien mogelijk, PIEB met PCEA bolus-only de voorkeur boven PCEA of CEI in de pijnbehandeling tijdens de bevalling boven andere toedieningsvormen. Ieder ziekenhuis kiest een modus voor het onderhoud van epidurale analgesie tijdens de bevalling en beschrijft dit in het lokale protocol.
Overwegingen
De onderstaande overwegingen gelden in principe voor de gehele patiëntenpopulatie zoals geformuleerd in de uitgangsvraag.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit het literatuuronderzoek blijkt PIEB (met patiënt gecontroleerde bolus toediening) ten aanzien van een aantal belangrijke uitkomstmaten net iets beter dan CEI of PCEA alleen: hogere maternale tevredenheid, een lager verbruik van lokaal anesthetica en een kortere uitdrijvingsduur. In de PIEB-groep lijkt ook minder vaak rescue medicatie nodig te zijn, grotere tevredenheid kan hier mee samenhangen. Naast de door ons gebruikte studies wordt deze vermindering in behoefte aan rescue medicatie ook gevonden in de retrospectieve studie van McKenzie (2016). Voor de overige uitkomstmaten blijken er weinig klinische relevante verschillen te zijn.
Tussen de onderzochte toedieningsvormen (PIEB versus CEI of PCEA) wordt geen verschil gezien in maternale of foetale bijwerkingen. Geen enkele studie was gepowerd op het vinden van verschillen wat betreft deze bijwerkingen. Het gebrek aan matige-hoge bewijskracht wordt onder andere verklaard door beperkingen in blindering en te lage patiënt-aantallen in de studies. De bewijskracht voor de uitkomstmaten varieert van laag tot zeer laag.
Op fysiologische gronden zou een gunstiger resultaat ten gunste van de intermitterende bolus verwacht mogen worden: de bolustoediening kan zich door hogere druk beter verspreiden in de epidurale ruimte. Analgesie en motorblok ontstaan doordat het lokaal anestheticum vanuit de extraneurale ruimte de zenuw in diffundeert. Na toediening van een bolus zal aanvankelijk de concentratie het hoogst zijn buiten de zenuw, maar na verloop van tijd ontstaat een steady state waarbij de concentratie binnen en buiten de zenuw gelijk is. Bij gebruik van lage concentratie lokaal anesthetica zullen dan de dunne sensibele vezels geblokkeerd worden, dikkere motorische vezels niet. De zenuwblokkade eindigt wanneer de concentratie binnen de zenuw hoger wordt dan buiten de zenuw. Bij continue infusie blijft de concentratie buiten de zenuw continue hoger en zullen na zekere tijd ook de motorische vezels geblokkeerd worden.
Er zijn meer studies nodig met voldoende power om de superioriteit van PIEB overtuigend te bewijzen.
Waarden en voorkeuren van patiënten
Voor de patiënt lijkt PIEB de voorkeur te genieten: er lijkt minder behoefte aan rescue medicatie en een grotere maternale tevredenheid.
Van belang hierbij is te vermelden dat pompen met zowel PIEB-instelling als PCEA-instelling de voorkeur hebben, zodat zwangeren zelf een extra bolus kunnen toedienen wanneer de PIEB-bolus niet snel genoeg komt. Deze pompen passen dan automatisch de tijdsduur aan tot de volgende gefixeerde toediening. Tevens draagt de combinatie met PCEA, net als bij de PCEA al dan niet met achtergrondinfusie bij aan de eigen regie en het gevoel van controle bij de zwangere.
Een kortere uitdrijvingsduur, te verklaren door betere motoriek ten gevolge van een verminderd verbruik van lokaal anesthetica, is een voordeel.
Tot slot, er zijn geen evidente nadelen in de literatuur te vinden ten aanzien van het toepassen van PIEB op de waarden en voorkeuren van patiënten. Zwangere vrouwen willen al tijdens de zwangerschap informatie over de verschillende vormen van pijnbehandeling, de voor- en de nadelen en wat dit betekent in hun situatie en willen hierover samen beslissen. Uit de meldactie blijkt dat dit nog onvoldoende in de praktijk gebeurt en vastgelegd wordt. Zie voor wijze van counselen en de vergelijking van de verschillende opties de module ‘Counseling: Samen beslissen‘.
Kosten (middelenbeslag)
Een aantal in Nederlandse ziekenhuizen gebruikte infusiepompen kan makkelijk voorzien worden van de benodigde software om PIEB met PCEA toe te kunnen dienen. In andere gevallen zouden meer kosten gemaakt moeten worden om PIEB te kunnen gebruiken (aanschaf pompen en scholing).
PIEB lijkt gepaard te gaan met minder verbruik aan lokaal anesthetica en rescue medicatie, dus daar vindt enige besparing plaats.
Niet in alle ziekenhuizen zijn pompen beschikbaar die zowel een PIEB als PCEA bolus-only programma hebben.
Aanvaardbaarheid voor de overige relevante stakeholders
PIEB (met PCEA) is een toedieningsvorm voor epidurale analgesie tijdens de bevalling vergelijkbaar met PCEA met of zonder achtergrondinfusie of CEI. Bij het gebruik van PIEB lijken minder rescue bolussen nodig te zijn waardoor minder werkdruk voor de zorgverleners rondom de barende.
Haalbaarheid en implementatie
Zie ook bovenstaande punten. Daarnaast, voor een betere spreiding van het lokaal anestheticum in de epidurale ruimte en dus een adequater effect van PIEB dient de bolusinfusieduur niet te lang te zijn (Carvalho, 2016). De meest optimale tijdsduur is nog niet bekend. In een studie waarbij epiduraalcatheters met een eindstandige opening werden gebruikt, werd een pompinfusiesnelheid van 100 ml/uur vergeleken met 300 ml/uur (Lange, 2018). Hierbij werden geen verschillen in kwaliteit van blok, additionele top-ups en uurconsumptie van lokaal anestheticum gemeten. In een eerdere studie werd een positief effect van PIEB ten opzichte van CEI beschreven bij een pompsnelheid van 400 ml/uur (Wong, 2006). Andere studies gebruikten pompsnelheden van 75 tot 120 ml/uur bij multiorifice catheters (Chua, 2004; Fettes, 2006). Bij multiorifice catheters komt de infusievloeistof alleen uit de dichtstbijzijnde opening wanneer de snelheid onder 120 ml/uur ligt (Wong, 2011). Bij geen enkele pompstand werd de occlusiedruk overschreden. Ook in een in vitro studie waar verschillende pompstanden bij verschillende catheters werden vergeleken was de occlusiedruk geen probleem. De multiorifice catheters (zonder eindopening) genereerden een hogere piekdruk en dus een snellere afgifte in de epidurale ruimte (Klumpner, 2016).
Rationale/ balans tussen voor- en nadelen van de interventie
PIEB met PCEA bolus only lijkt gepaard te gaan met de grootste maternale tevredenheid, een lager verbruik van lokaal anesthetica en mindere behoefte aan rescue bolussen. Indien de in het ziekenhuis gebruikte pompen dit mogelijk maken lijkt deze wijze van toedienen van onderhoudsdosering enig voordeel te hebben boven PCEA bolus-only of PCEA met achtergrondinfusie.
Onderbouwing
Achtergrond
Programmed Intermittent Epidural Bolus (PIEB) is een geautomatiseerde bolustoediening waarbij met een vaste regelmaat een bolus epiduraal vloeistof gegeven wordt. Het kan gebruikt worden als alternatief voor Continue Epidurale Infusie (CEI) of Patient Controlled Epidural Analgesia (PCEA). Bij bolustoediening zal de epidurale vloeistof zich beter verspreiden dan bij continue infusie. Hierdoor ontstaat er ook een meer uniforme diffusie van het lokaal anestheticum (Hogan, 2002). De vraag is of deze voorgeprogrammeerde bolussen een toegevoegde waarde hebben ten opzichte van CEI of PCEA.
Conclusies / Summary of Findings
|
GRADE |
Er lijkt geen verschil in pijnscore tussen zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (Ferrer, 2017; George, 2013) |
|
Laag GRADE |
Zwangeren behandeld met PIEB lijken minder vaak aanvullende pijnmedicatie (rescue medicatie) nodig te hebben van zorgverleners dan zwangeren behandeld met CEI of PCEA.
Bronnen: (Ferrer, 2017; George, 2013) |
|
Laag GRADE |
Er lijkt geen verschil in het aantal zwangeren dat zichzelf tenminste eenmaal een extra bolus toedient tussen behandeling middels PIEB met PCEA of behandeling middels PCEA met achtergrondinfusie.
Bronnen: (Capogna, 2011; Leo,2010; Sia, 2017) |
|
Laag GRADE |
Zwangeren behandeld met PIEB lijken meer tevreden ten aanzien van pijnstilling dan zwangeren behandeld met CEI of PCEA.
Bronnen: (George, 2013) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op een vaginale kunstverlossing of sectio caesarea tussen zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (Ferrer, 2017; George, 2013; Nunes, 2016) |
|
Zeer laag GRADE |
Er lijkt geen verschil in het risico op hypotensie tussen zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (Ferrer, 2017; George, 2013) |
|
Laag GRADE |
Er lijkt geen verschil in de mate van motorisch blok tussen zwangeren behandeld met PIEB versus CEI of PCEA met achtergrondinfusie.
Bronnen: (George, 2013; Nunes, 2016) |
|
Zeer laag GRADE |
Er lijkt geen verschil in het risico op misselijkheid of braken tussen zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (Ferrer, 2017; George, 2013) |
|
Zeer laag GRADE |
Er lijkt geen verschil in het risico op koorts tussen zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (George, 2013) |
|
Laag GRADE |
Er lijkt geen verschil in de totale bevallingsduur tussen zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (Ferrer, 2017; George, 2013) |
|
Laag GRADE |
Er lijkt geen verschil in de duur van de ontsluiting tussen zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (George, 2013) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op jeuk tussen zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (Ferrer, 2017; George, 2013) |
|
Laag GRADE |
Er lijkt geen verschil in pH a. umbilicalis van neonaten van zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (Bremerich, 2005; Okutomi, 2009) |
|
Laag GRADE |
Er lijkt geen verschil in foetale hartslag afwijkingen bij neonaten van zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (George, 2013) |
|
Laag GRADE |
Er lijkt geen verschil in Apgarscore van neonaten van zwangeren behandeld met PIEB versus CEI of PCEA.
Bronnen: (Ferrer, 2017; George, 2013; Nunes, 2016) |
Samenvatting literatuur
Beschrijving studies
De meta-analyse van George (2013) is als uitgangspunt genomen. George (2013) beoordeelde de methodologie van 9 RCT’s die PIEB (al dan niet met PCEA) vergeleken met CEI of PCEA met achtergrondinfusie, hiervan werden twee studies geëxcludeerd (Chua, 2004; Salim, 2005) omdat deze niet voldeden aan de PICO (resp. CEI werd pas gestart na toediening van een rescuebolus of er werd geen PIEB toegepast). Uiteindelijk voldeden 7 RCT’s binnen de meta-analyse en 2 RCT’s gepubliceerd na de meta-analyse (Ferrer, 2017; Nunes, 2016) aan de selectiecriteria van deze uitgangsvraag en werden opgenomen in de literatuuranalyse.
Vijf RCT’s beschreven PIEB versus PCEA plus achtergrondinfusie en vier RCT’s beschreven PIEB versus CEI. In totaal werden 950 patiënten geïncludeerd. De geïncludeerde studies verschillen qua (doseringen) pijnmedicatie en lock-out tijden (zie evidencetabel). In bijna alle studies hadden patiënten de mogelijkheid een extra bolus zelf toe te dienen of een extra bolus te laten toedienen door zorgverleners in zowel de PIEB als de CEI of PCEA met achtergrondinfusie groep.
Resultaten
Pijnintensiteit
Acht van de geïncludeerde studies onderzochten pijn middels de VAS-schaal of NRS 1 tot 10 schaal waarbij 1= geen pijn en 10= meest hevige pijn. De uitkomstmaat pijnintensiteit werd op verschillende manieren (mediaan, gemiddelde, maximale pijn) en tijdstippen gerapporteerd. Daarom konden slechts 3 RCT’s met 228 zwangeren op 2 verschillende tijdstippen worden gepoold. Na 2 uur werd er geen significant en klinisch relevant verschil gevonden tussen de PIEB groep en CEI groep (zie figuur 1).
Figuur 1 Pijn na 2 uur

Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT Ferrer (2017
Na 4 uur werd er een klinisch relevant verschil gevonden, de pijn in de PIEB groep was 1,02 punt lager op de VAS-schaal dan bij de CEI groep (zie figuur 2).
Figuur 2 Pijn na 4 uur
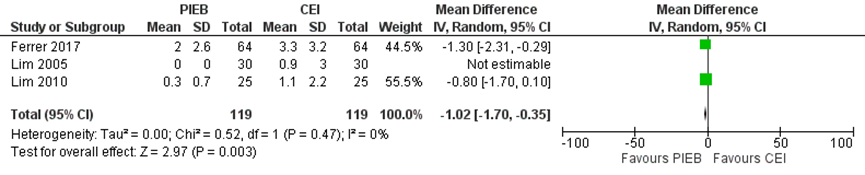
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT Ferrer (2017)
In de overige vijf studies uit de meta-analyse van George (2013) werd bij 375 zwangeren geen significant verschil waargenomen tussen de PIEB versus CEI of PCEA wanneer er gekeken werd naar de area under the curve (AUC): mediane pijn 6,7 (PIEB) versus 10,3 (CEI); p=0,25 (Wong, 2006) en 591 versus 1121; p=0,43 (Fettes, 2006) op de VAS-schaal, gemiddelde pijn bij eerste pijndoorbraak (VAS 7,8 versus 7,5; p=0,19) (Leo, 2010), een VAS-pijnscore >1 (Relatief Risico= 0,50, 95% BI 0,14 tot 1,74) (Sia, 2007) en kwalitatief beschreven dat er geen verschil was tussen de 2 groepen (Capogna, 2011).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijnintensiteit is met twee niveaus verlaagd gezien risico op bias door afwezigheid van blindering en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Cross-over naar andere pijnmedicatie/ aanvullende pijnmedicatie (bolustoediening door zorgverleners of patiënt (PCEA))
Zeven studies uit de meta-analyse van George (2013) en 1 aanvullende RCT van Ferrer (2017) (n=653 zwangeren) rapporteerden het aantal zwangeren die extra bolustoediening door zorgverleners nodig hadden. Zwangeren behandeld met PIEB hadden 41% minder kans op het nodig hebben van aanvullende bolusdoseringen in vergelijking met zwangeren behandeld met CEI of PCEA (RR 0,59, 95% BI: 0,41 tot 0,86 voor het aantal zwangeren dat tenminste eenmaal een extra bolustoediening door zorgverlener nodig had). Er was sprake van matige heterogeniteit (I2 31%).
Figuur 3 Aanvullende pijnbehandeling door zorgverleners

Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT Ferrer (2017)
Vier studies in de meta-analyse van George (2013) gaven patiënten de mogelijkheid om zichzelf een bolus toe te dienen (PCEA) naast de PIEB in vergelijking tot PCEA met achtergrondinfusie. Drie studies rapporteerden het aantal zwangeren dat tenminste eenmaal zichzelf een extra bolus (PCEA) toediende. Zwangeren behandeld met PIEB lijken minder kans te hebben op het gebruik van extra bolustoediening in vergelijking met zwangeren behandeld met PCEA met achtergrondfusie (RR 0,55, 95% BI: 0,30 tot 1,04 voor het aantal zwangeren dat zichzelf tenminste eenmaal een extra bolus (PCEA) toedient), maar het gevonden verschil was niet significant. Er was sprake van ernstige heterogeniteit (I2 90%).
Figuur 4 Aanvullende pijnbehandeling door bolustoediening door patiënt zelf (PCEA)
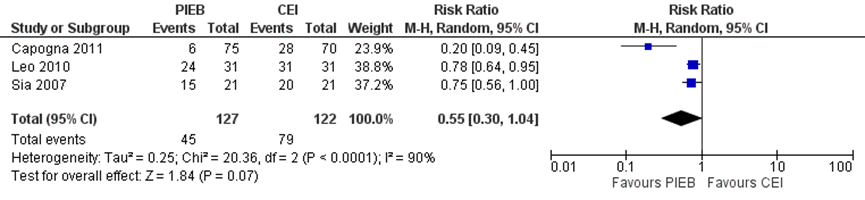
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bolustoediening door zorgverleners of patiënten is met twee niveaus verlaagd gezien het risico op bias door afwezigheid van blindering in studies en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Tevredenheid ten aanzien van pijnstilling
Twee studies binnen de meta-analyse (George, 2013) rapporteerden de gemiddelde tevredenheid bij 122 zwangeren middels de VAS-schaal. Zwangeren in de PIEB groep waren meer tevreden ten aanzien van pijnstilling ten opzichte van zwangeren met CEI of PCEA (gemiddeld verschil 7,98 punten (95% BI 5,39 tot 10,57). Drie andere studies (n=228 zwangeren) binnen de meta-analyse van George (2013) rapporteerden de mediaan. In alle 3 de studies was de mediane tevredenheid ten aanzien van pijnstilling hoger in de PIEB-groep (95 versus 90; 92 versus 85; 100 versus 95). In alle groepen wordt een hoge tevredenheid gerapporteerd, hierbij moet rekening gehouden worden met een mogelijk plafondeffect.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat tevredenheid ten aanzien van pijnstilling is met twee niveaus verlaagd gezien het risico op bias door afwezigheid van blindering en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Wijze van bevallen/ modus partus - vaginale kunstverlossing
Alle studies (n=9) namen vaginale kunstverlossing mee als uitkomstmaat (totaal n=783 zwangeren). Het risico op een vaginale kunstverlossing bleek niet significant te verschillen tussen zwangeren met PIEB en zwangeren met CEI of PCEA (RR 0,73, 95% BI: 0,44 tot 1,22). Er was sprake van matige heterogeniteit (I2 48%).
Figuur 5 vaginale kunstverlossing
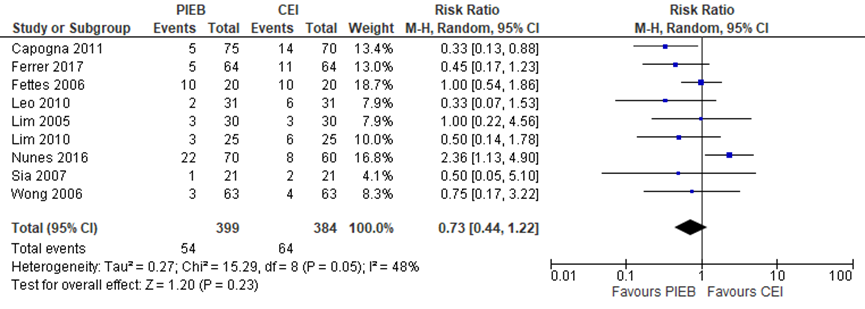
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT’s Ferrer (2017) en Nunes (2016)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vaginale kunstverlossing is met twee niveaus verlaagd gezien het brede betrouwbaarheidsinterval en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Wijze van bevallen/ modus partus - sectio caesarea
Alle studies (n=10) namen de sectio caesarea mee als uitkomstmaat (totaal n=910 zwangeren). Het risico op een sectio caesarea bleek niet significant te verschillen tussen zwangeren met PIEB in vergelijking tot zwangeren met CEI of PCEA (RR 0,84, 95% BI: 0,63 tot 1,12). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 6 Sectio caesarea
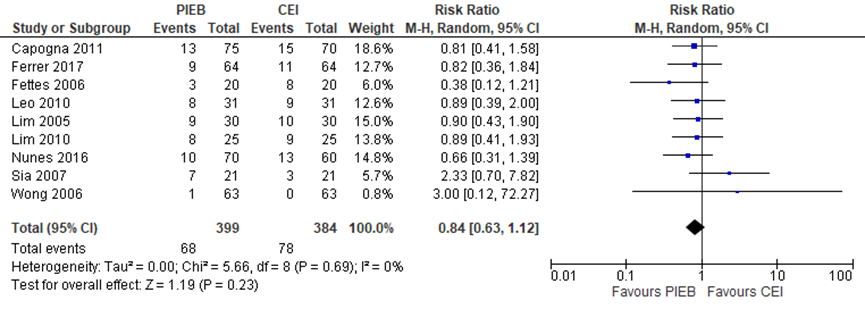
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT’s Ferrer (2017) en Nunes (2016)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat sectio caesarea is met twee niveaus verlaagd gezien het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Maternale complicaties
Hypotensie
Vier studies uit de meta-analyse van George (2013) en 1 aanvullende RCT van Ferrer (2017) rapporteerden de uitkomstmaat maternale hypotensie (n=340). Het risico op een maternale hypotensie bleek niet significant te verschillen tussen zwangeren met PIEB in vergelijking tot zwangeren met CEI of PCEA (RR 1,43, 95% BI 0,43 tot 4,80). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 7 Maternale hypotensie
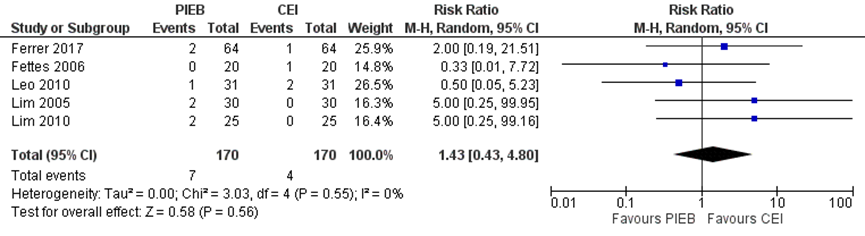
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT Ferrer (2017)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat hypotensie is met drie niveaus verlaagd gezien het risico op bias vanwege het afwezigheid van blindering in studies, het brede betrouwbaarheidsinterval en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Motorisch blok
George (2013) rapporteerde de gepoolde uitkomst van zwangeren zonder motorisch blok versus enige mate van motorisch blok in één studie. Deze data werden aangevuld met de resultaten van de RCT van Nunes, 2016 met totaal 256 zwangeren. Zwangeren met PIEB hadden minder kans op een motorisch blok (RR 0,10, 95% BI 0,03 tot 0,32) in vergelijking tot zwangeren met CEI of PCEA met achtergrondinfusie. Ferrer (2017) vond geen significante verschillen tussen de groepen op verschillende tijdstippen. Drie studies binnen de meta-analyse van George (2013) rapporteerden geen verschillen in motorisch blok tussen de groepen, waarbij motorisch blok op verschillende manieren werd gerapporteerd.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat motorisch blok is met twee niveaus verlaagd gezien het risico op bias vanwege de afwezigheid van blindering in studies en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Misselijkheid
Vier studies uit de meta-analyse van George (2013) namen misselijkheid mee als uitkomstmaat. Deze data werden aangevuld met de resultaten van de RCT van Ferrer (2017) (totaal n=342 zwangeren). Het risico op misselijkheid bleek niet significant te verschillen tussen zwangeren behandeld met PIEB in vergelijking tot CEI of PCEA (RR 1,28, 95% BI: 0,55 tot 2,82). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 8 Misselijkheid
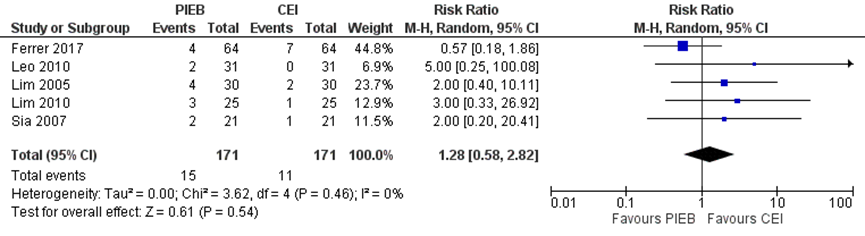
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT Ferrer (2017)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat misselijkheid is met drie niveaus verlaagd gezien het risico op bias vanwege de afwezigheid van blindering in studies, het geringe aantal patiënten en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Braken
Vier studies uit de meta-analyse van George (2013) namen braken mee als uitkomstmaat. Deze data werden aangevuld met de resultaten van de RCT van Ferrer (2017) (totaal n=342 zwangeren). Het risico op braken bleek niet significant te verschillen tussen zwangeren behandeld met PIEB in vergelijking tot CEI of PCEA (RR 2,43, 95% BI: 0,76 tot 7,74). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 9 Braken
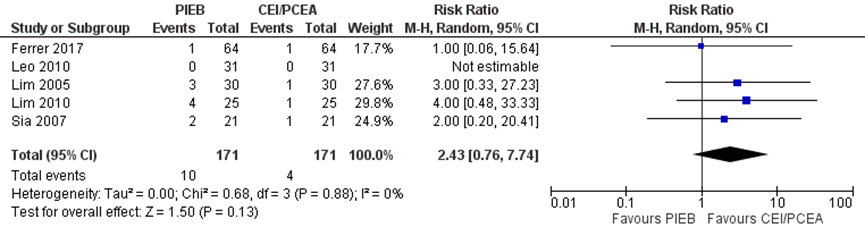
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT Ferrer (2017)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat braken is met drie niveaus verlaagd gezien het risico op bias vanwege het afwezigheid van blindering in studies, het geringe aantal patiënten en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Temperatuur
Een studie in de meta-analyse van George (2013) nam koorts mee als uitkomstmaat (totaal n=62 zwangeren). Koorts kwam bij 1/31 zwangeren voor in de PIEB-groep en bij 5/31 zwangeren in de groep met PCEA en achtergrondinfusie, met een RR van 0,20 (95% BI 0,02 tot 1.61; P= 0,13) werd er geen significant verschil tussen de groepen waargenomen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat koorts is met drie niveaus verlaagd gezien het risico op bias vanwege de afwezigheid van blindering in studies, het brede betrouwbaarheidsinterval en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Bevallingsduur
Zeven studies geïncludeerd in de meta-analyse van George (2013) namen de totale bevallingsduur mee als uitkomstmaat. Deze data werden aangevuld met de resultaten van de RCT van Ferrer (2017) (totaal n=653 zwangeren). Er werd geen significant verschil waargenomen in de totale bevallingsduur (ontsluiting en uitdrijving) tussen zwangeren met PIEB in vergelijking tot zwangeren met CEI of PCEA (gemiddeld verschil -16,59 minuten, 95% BI: -48,98 tot 15,81). Er was sprake van matige heterogeniteit (I2 45%).
Figuur 10 Totale bevallingsduur (minuten) - ontsluiting- en uitdrijvingsfase
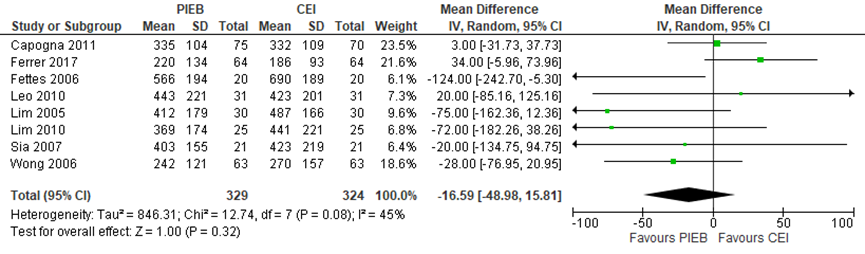
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT Ferrer (2017)
De duur van de ontsluiting werd niet gerapporteerd. Er werd geen verschil in uitdrijvingsduur waargenomen in de CEI of PCEA groep in 4 studies van de systematische review van George (2013) (totaal n=204 zwangeren) (gemiddeld verschil -11,48 minuten, 95% BI: -25,38 tot 2,42). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 11 Bevallingsduur tijdens het 2e stadium (minuten) - uitdrijvingsfase
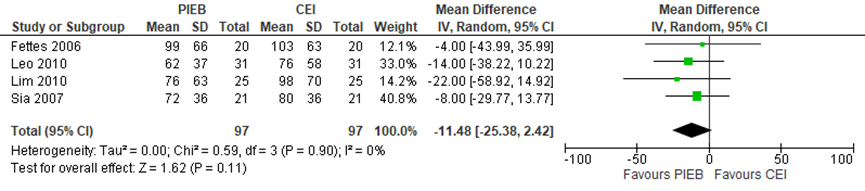
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bevallingsduur (zowel totale bevallingsduur als de uitdrijvingsfase) is met twee niveaus verlaagd gezien de brede betrouwbaarheidsintervallen en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Jeuk
Vier studies geïncludeerd in de meta-analyse van George (2013) namen jeuk mee als uitkomstmaat. Deze data werden aangevuld met de resultaten van de RCT van Ferrer (2017) (totaal n=342 zwangeren). Er werd geen verschil waargenomen tussen zwangeren met PIEB en CEI of PCEA (RR 0,99, 95% BI: 0,82 tot 1,20). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 12 Jeuk
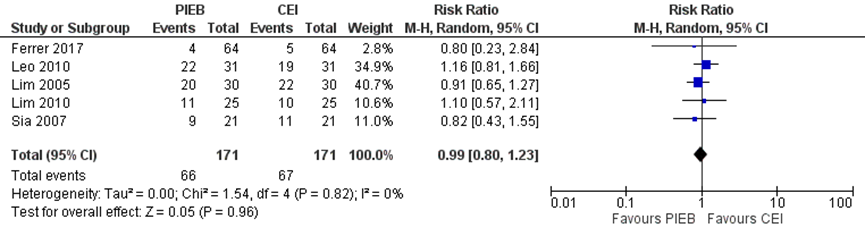
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: George (2013) aangevuld met RCT Ferrer (2017)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat jeuk is met twee niveaus verlaagd gezien het risico op bias vanwege de afwezigheid van blindering in studies en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Complicaties - neonatale complicaties
pH a. umbilicalis
Twee studies geïncludeerd in de meta-analyse van George (2013) rapporteerden de pH a. umbilicalis van neonaten (n=90 zwangeren). Beide studies vonden geen significante verschillen tussen de groepen (gemiddelde in 1 studie 7,25 versus 7,30, p=0,18, de andere studies rapporteerden geen getallen).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pH a. umbilicalis is met twee niveaus verlaagd gezien het zeer geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Foetale hartslag afwijkingen
Twee studies in de meta-analyse van George (2013) rapporteerden foetale bradycardie bij neonaten van 112 zwangeren. Er was geen significant verschil tussen de twee groepen (RR: 1,07 95% BI: 0,24 tot 4,79).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat foetale hartslag afwijkingen is met twee niveaus verlaagd gezien het zeer geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Apgarscore
Twee studies in de meta-analyse van George (2013) onderzochten Apgarscore bij 5 minuten bij neonaten van 169 zwangeren. Er was geen significant verschil tussen de twee groepen (RR: 2,00 95% BI: 0,41 tot 9,77) in één van de studies. De andere studie vond ook geen significante verschillen (geen cijfers gerapporteerd). Ferrer (2017) rapporteerde de mediane Apgarscore en range bij 5 minuten, geen van de neonaten had een Apgarscore < 7 bij 5 minuten. Nunes (2016) rapporteerde de gemiddelde Apgarscores, ook hier waren er geen significante verschillen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Apgarscore < 7 bij 5 minuten is met twee niveaus verlaagd gezien het zeer geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Geen van de studies naar het effect van PIEB versus CEI of PCEA rapporteerden de uitkomstmaten: angst ten aanzien van maternale complicaties: convulsie/ eclamptisch insult, fluxus post-partum, ademhalingsdepressie, urineretentie, postspinale punctie hoofdpijn, epiduraal abces/ hematoom, neonatale complicaties: opname NICU, temperatuur, mortaliteit, negatieve uitkomsten voor de baby op lange termijn en kosten.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
wat zijn de (on)gunstige effecten van PIEB vergeleken met continue epidurale infusie infusie bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
P: zwangere vrouwen met het verzoek tot behandelen van de baringspijn;
I: PIEB*;
C: CEI of PCEA*;
*waarbij interventie beschreven wordt ongeacht of de extra bolus toediening is gegeven door barende zelf (PCEA), dan wel een manuele bolus door verpleegkundige of anesthesioloog);
O: zie onderstaand:
- Pijnintensiteit (VAS/ NRS-schaal of ander gevalideerd instrument).
- Cross-over naar andere pijnmedicatie/aanvullende pijnmedicatie (bolustoediening door zorgverleners).
- Tevredenheid ten aanzien van pijnstilling (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument).
- Borstvoeding.
- Wijze van bevallen (vaginale kunstverlossing, sectio caesarea).
- Maternale complicaties: convulsie/ eclamptisch insult, fluxus post-partum, ademhalingsdepressie, bevallingsduur, hypotensie, temperatuur, urineretentie, misselijkheid/braken, jeuk, mate van motorisch blok, postspinale punctie hoofdpijn, epiduraal abces/ hematoom.
- Neonatale complicaties: opname NICU, Apgarscore < 7 bij 5 min, foetale hartslag afwijkingen, temperatuur, pH a. umbilicalis.
- Maternale/ neonatale sterfte.
- Negatieve uitkomsten voor de baby op lange termijn.
- Kosten.
Relevante uitkomstmaten
De werkgroep achtte pijnintensiteit, tevredenheid, modus partus en maternale/ neonatale sterfte voor de besluitvorming kritieke uitkomstmaten. De werkgroep achtte extra toediening lokaal anestheticum en opioïd en mate van motorisch blok voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt: pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument) en tevredenheid (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument), waarbij scores door de patiënt zelf gedurende of direct na de bevalling gerapporteerd (vragenlijsten achteraf werden geëxcludeerd). De werkgroep definieerde niet a priori de genoemde overige uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Naast significantie wordt de klinische besluitvorming vooral bepaald door de klinische relevantie van de waargenomen verschillen tussen behandelopties. Voor dichotome uitkomstmaten definieerde de werkgroep een minimaal klinisch (patiënt) relevant verschil volgens de grenzen van de GRADE-working group, namelijk een verschil in relatief risico van 25%. Voor de continue uitkomstmaten definieerde de werkgroep een verschil van 10% op pijnintensiteit of tevredenheid als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 17 januari 2018 met relevante zoektermen gezocht naar Engelstalige systematische reviews, gerandomiseerde gecontroleerde studies (RCT’s), gecontroleerde klinische studie (CCT’s) en vergelijkend observationeel onderzoek studies gepubliceerd vanaf 1946 die PIEB met PCEA en/ of CEI vergelijken bij zwangere vrouwen met baringspijn. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 95 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Studiedesign RCT.
- Gepubliceerd tussen 1946 en 17 januari 2018.
- Gelijke concentratie lokaal anestheticum en opioïd in de interventie en controle-groep;
- Beschrijven van minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 38 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 29 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 1 systematisch review en 8 RCT’s definitief geselecteerd. Zes van deze RCT’s werden ook beschreven in de systematische review van George (2013). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- George RB, Allen TK, Habib AS. Intermittent epidural bolus compared with continuous epidural infusions for labor analgesia: a systematic review and meta-analysis. Anesth Analg. 2013 Jan;116(1):133-44. Epub 2012 Dec 7. Review. Erratum in: Anesth Analg. 2013 Jun;116(6):1385. PubMed PMID: 23223119.
- Ferrer LE, Romero DJ, Vásquez OI, Matute EC, Van de Velde M. Effect of programmed intermittent epidural boluses and continuous epidural infusion on labor analgesia and obstetric outcomes: a randomized controlled trial. Arch Gynecol Obstet. 2017 Nov;296(5):915-922. doi: 10.1007/s00404-017-4510-x. Epub 2017 Sep 7.
- Nunes J, Nunes S, Veiga M, Cortez M, Seifert I. A prospective, randomized, blinded-endpoint, controlled study - continuous epidural infusion versus programmed intermittent epidural bolus in labor analgesia. Braz J Anesthesiol. 2016 Sep-Oct;66(5):439-44.
- Hogan Q. Distribution of solution in the epidural space: examination by cryotome section. Reg Anesth Pain Med 2002; 27: 150-156
- Mc Kenzie, Cobb, Riley, Carvalho. Programmed intermittent epidural boluses for maintenance of labor analgesia: an impact study. Int J. of Obstet. Anesth. (2016) 26, 32-38.
- Carvalho B, George RB, Cobb B, McKenzie C, Riley ET. Implementation of Programmed Intermittent Epidural Bolus for the Maintenance of Labor Analgesia. Anesth Analg. 2016 Oct;123(4):965-71.
- Lange EMS, Wong CA, Fitzgerald PC, Davila WF, Rao S, McCarthy RJ, Toledo P. Effect of Epidural Infusion Bolus Delivery Rate on the Duration of Labor Analgesia: A Randomized Clinical Trial. Anesthesiology. 2018 Apr;128(4):745-753.
- Wong CA, Ratliff JT, Sullivan JT, Scavone BM, Toledo P, McCarthy RJ. A randomized comparison of programmed intermittent epidural bolus with continuous epidural infusion for labor analgesia. Anesth Analg. 2006 Mar;102(3):904-9.
- Chua SM, Sia AT. Automated intermittent epidural boluses improve analgesia induced by intrathecal fentanyl during labour. Can J Anaesth. 2004 Jun-Jul;51(6):581-5.
- Fettes PD, Moore CS, Whiteside JB, McLeod GA, Wildsmith JA. Intermittent versus continuous administration of epidural ropivacaine with fentanyl for analgesia during labour. Br J Anaesth. 2006 Sep;97(3):359-64. Epub 2006 Jul 18.
- Wong CA, McCarthy RJ, Hewlett B. The effect of manipulation of the programmed intermittent bolus time interval and injection volume on total drug use for labor epidural analgesia: a randomized controlled trial. Anesth Analg. 2011 Apr;112(4):904-11.
- Klumpner TT, Lange EM, Ahmed HS, Fitzgerald PC, Wong CA, Toledo P. An in vitro evaluation of the pressure generated during programmed intermittent epidural bolus injection at varying infusion delivery speeds. J Clin Anesth. 2016 Nov;34:632-7. doi: 10.1016/j.jclinane.2016.06.017.
- Kocarev M, Khalid F, Khatoon F, Fernando R. Neuraxial labor analgesia: a focused narrative review of the 2017 literature. Curr Opin Anaesthesiol. 2018 Jun;31(3):251-257.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de toegevoegde waarde van PIEB al dan niet met PCEA ten opzichte van continue epidurale infusie en ten opzichte van PCEA bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
George, 2013
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to July 2012
Studies fulfilling the PICO of the research question: A: Capogna, 2011 B: Leo, 2010 C: Sia, 2007 D: Wong, 2006 E: Fettes, 2006 F: Lim, 2010 G: Lim, 2005
Study included in the SR but excluded because CEI was used after a rescue bolus and therefore not further described: I: Chua, 2004 H: Salim, 2005
Study design: RCT
Setting and Country: IWK Health Centre, Dalhousie University, Halifax, Nova Scotia, Canada
Source of funding: Not reported
|
Inclusion criteria SR: randomized controlled trials (RCTs) to compare the effects of IEB to standard CEI dosing with or without PCEA in healthy women receiving labor epidural analgesia.
Exclusion criteria SR: -
Important patient characteristics at baseline:
N (I/C) A: 75/70 patients B: 31/31 patients C: 21/21 patients D: 63/63 patients E: 20/ 20 patients F: 25/ 25 patients G: 30/ 30 patients
Groups comparable at baseline? Yes |
Describe intervention:
A: Epidural solution Levobupivacaine, 0.0625%– 0.125%; sufentanil, 0.5 μg/mL PIEB 10 mL (0.0625%) bolus every hour PCEA 5 mL bolus, 10 minute lockout, 0.125%
B: Epidural solution Ropivacaine 0.1%; fentanyl 2 μcg/mL PIEB 5 mL bolus every hour (or 30 minutes after successful PCEA dose) PCEA 5 mL bolus, 10 minute lockout
C: Epidural solution Ropivacaine 0.1%; fentanyl 2 μcg/mL PIEB 5 mL bolus every hour (or 1 hour after successful PCEA dose) PCEA 5 mL bolus, 10 minute lockout
D: Epidural solution Bupivacaine, 0.625%; fentanyl 2, μg/mL PIEB 6 mL bolus every 30 minutes PCEA 5 mL bolus, 10 minute lockout
E: Epidural solution Ropivacaine, 0.2%; fentanyl, 2 μg/mL PIEB 10 mL bolus every hour
F: Epidural solution Ropivacaine, 0.1%; fentanyl, 2 μg/mL PIEB 2.5 mL bolus every 15 minutes (initiated 7.5 minutes after SA dose)
G: Epidural solution Ropivacaine, 0.1%; fentanyl, 2 μg/mL PIEB 5 mL bolus every 30 minutes
|
Describe control:
A: Epidural solution Levobupivacaine, 0.0625%– 0.125%; sufentanil, 0.5 μg/mL CEI 10 mL/h (0.0625%) PCEA 5 mL bolus, 10 minute lockout, 0.125%
B: Epidural solution Ropivacaine 0.1%; fentanyl 2 μcg/mL CEI 5 mL/h PCEA 5 mL bolus, 10 minute lockout
C: Epidural solution Ropivacaine 0.1%; fentanyl 2 μcg/mL CEI 5 mL/h PCEA 5 mL bolus, 10 minute lockout
D: Epidural solution Bupivacaine, 0.625%; fentanyl 2, μg/mL CEI 12 mL/h PCEA 5 mL bolus, 10 minute lockout
E: Epidural solution Ropivacaine, 0.2%; fentanyl, 2 μg/mL CEI 10 mL/h
F: Epidural solution Ropivacaine, 0.1%; fentanyl, 2 μg/mL CEI 10 mL/h
G: Epidural solution Ropivacaine, 0.1%; fentanyl, 2 μg/mL CEI 10 mL/h
|
End-point of follow-up: Delivery
For how many participants were no complete outcome data available?* (intervention/control) A: 0/5 B: 0/0 C: 0/0 D: 11/9 E: 0/0 F: 0/1 G: 0/0
*extracted from individual studies
|
Separate analyses were performed for the 4 included studies
Outcome measure-1 Pain* Defined as VAS pain A: similar in both groups and all scores at all times were <20 mm (data not reported) B: mean 7.8 (SD 1.3)/ 7.5 (1.8) at first breakthrough pain p=0.19 C: N VAS (0-10) >1 cm during maintenance of analgesia 3/6 D: AUC from start of epidural infusion (15 min after intrathecal injection) to delivery median 6.7 (range 0-42.3) / 10.3 (0-57.6) p=0.25 E: AUC median 591 (IQR 107-1547)/ 1121 (0-2963), p=0.43 F: mean (SD) 30 min 0.0 (0.2)/ 0.1 (0.4), p=0.60; 2h 0.5 (1.4)/ 0.0 (0.2), p=0.10; 4h 0.3 (0.7)/ 1.1 (2.2), p=0.21; 8h 1.2 (2.3)/ 0.6 (1.1), p=0.19 G: mean (SD) 30 min 0 (0)/ 1.3 (5.0); 2h 0.4 (2.0)/ 2.1 (9.5); 4h 0 (0)/ 0.9 (3.0); 6h 1.0 (3.1)/ 10.1 (11.5), no significant differences
Outcome measure-2 Satisfaction with pain relief* Defined as satisfaction with pain relief (0-100 scale) A: NR B: mean 93.77 (SD 7.0)/ 85.8 (7.2) C: median 95 (range 65-100)/ 90 (60-100) D: median 92 (95% CI 89-95) / 85 (95% CI 77-90) p<0.01 F: NR G: median 100 (range 65-100)/ 95 (80-100), p=0.64 F: NR G: mean 97 (SD 8)/ 89 (SD 7), p<0.05
Outcome measure-3 Type of delivery
Defined as cesarean delivery Effect measure: RR (95% CI): A: 0.81 (0.41, 1.58) B: 0.89 (0.89, 2.00) C: 2.33 (0.70, 7.82) D: 3.00 (0.63, 1.61) E: 0.37 (0.10, 1.33) F: 0.89 ( 0.39, 2.00) G: 0.90 (0.43, 1.90)
Pooled effect (random effects model): 0.88 (95% CI 0.63 to 1.21) favoring PIEB Heterogeneity (I2): 0
Defined as instrumental delivery Effect measure: RR (95% CI): A: 0.33 (0.13, 0.88) B: 0.33 (0.07, 1.53) C: 0.50 (0.05, 5.10) D: 0.75 (0.17, 3.22) E: 1.00 (0.54, 1.86) F: 0.50 (0.14, 1.78) G: 1.00 (0.22, 4.56)
Pooled effect (random effects model): 0.71 (95% CI 0.48 to 1.06) favoring PIEB Heterogeneity (I2): 0
Outcome measure-4 maternal complications:
Defined as duration labour Effect measure: mean difference (95% CI): A: 3.00 (-31.73, 37.73) B: 20.00 (-85.16, 125.16) C: -20.00 (-134.75, 94.75) D: -28.00 (-76.95, 20.95) E: -124.00 ( -242.70, -5.30) F: -72.00 (-182.26, 38.26) G: -75.00 (-162.36, 12.36)
Pooled effect (random effects model): -17.48 (95% CI -41.68 to 6.71) favoring PIEB Heterogeneity (I2): 17%
Second stage Effect measure: mean difference (95% CI): A: NR B: -14.00 (-88.22, 10.22) C: -8.00 (-27.77, 13.77) D: NR E: -4.00 (-43.99, 35.99) F: -22.00 (-58.92, 14.92) G: NR
Pooled effect (random effects model): -11.66 (95% CI -22.84 to -0.49) favoring PIEB Heterogeneity (I2): 0
Required manual anaesthetic interventions Effect measure: mean difference (95% CI): A: not estimable (0 events) B: 0.67 (0.21, 2.13) C: 1.67 (0.46, 6.10) D: 0.59 (0.38, 0.90) E: 0.33 (0.13, 0.86) F: 1.13 (0.52, 2.44) G: 0.27 (0.08, 0.88)
Pooled effect (random effects model): 0.59 (95% CI 0.38 to 0.90) favoring PIEB Heterogeneity (I2): 39%
Patients requiring PCEA boluses (n)* A: 6/ 28, p=0.001 B: 24/ 31 C: 15/ 20, p=0.03 D: PCEA requests/h, median (range): 1.1 (0-5.4)/ 1.3 (0-6.7), p=0.60 E: Not applicable F: Not applicable G: Not applicable
Pruritus, N (I/C)* A: NR B: 22/19 C: 9/11 D: NR E: NR F: 11/10 G: 20/22
Nausea, N (I/C)* A: NR B: 2/0 C: 2/1 D: NR E: NR F: 3/1 G: 4/2
Vomiting, N (I/C)* A: NR B: 0/0 C: 2/1 D: NR E: NR F: 3/1 G: 4/
Hypotension, N (I/C)* A: NR B: 1/2 C: NR D: NR E: 0/1 F: 2/0 G: 2/0
Maternal pyrexia, N (I/C)* A: NR B: 1/5 C: NR D: NR E: NR F: NR G: NR
Motor Block* A: Bromage score <6 2.7%/ 37% B: NR C: Bromage >1 1/0 D: NR E: similar in both groups F: NR G: 0/0
Outcome measure-5 Neonatal outcomes N (I/C)
Neonatal Apgarscore <7 at 5 min* A: NR B: NR C: 4/2 D: NR E: NR F: NR G: NR
Fetal bradycardia* A: NR B: 0/1 C: NR D: NR E: NR F: 3/2 G: NR
pH a. umbilicalis* A: NR B: NR C: NR D: NR E: mean 7.25/ 7.30, p=0.18 F: NR G: NR |
*Data were extracted from the individual studies
Author’s conclusion IEB is an appealing concept; current evidence suggests IEB slightly reduces local anesthetic usage and improves maternal satisfaction. Given the wide CIs of the pooled results for many outcomes, definite conclusions cannot be drawn for those outcomes, but there is also a potential that IEB improves instrumental delivery rate and need of anesthesia interventions. More study is required to conceptualize the ideal IEB regimen and investigate its effect on labor analgesia and obstetric outcomes.
Level of evidence: not reported
|
95% CI: 95% confidence interval; AUC: area under curve; CEI: continuous epidural infusion; NR: not reported; PCEA: patient controlled epidural analgesia; PIEB: Programmed Intermittent Epidural Bolus; RCT: randomized controlled trial; RR: risk ratio; SD: standard deviation; SR: systematic review; VAS: visual analogue scale
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
Research question: Wat is de toegevoegde waarde van PIEB ten opzichte van continue epidurale infusie en ten opzichte van PCEA en/ of CEI bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Ferrer, 2017 |
Type of study: single blind parallel RCT
Setting: Hospital Universitario Fundación Santa Fe de Bogotá
Country: Colombia
Source of funding: non-commercial |
Inclusion criteria: Labouring term women aged between 18 and 45 years requiring epidural analgesia
Exclusion criteria: Patients with American Society of Anesthesiologists physical status ≥III, allergy to local anesthetics, hemodynamic instability, chronic use of analgesics, mental disease, pregnancy related disease/high obstetric risk, or with any neuraxial contraindication.
N total at baseline: Intervention: 66 Control: 66
Important prognostic factors: Age, mean (SD) I: 31.6 (5.1) C: 32.3 (3.8)
Pain VAS, mean (SD): I: 7.9 (2.05) C: 7.6 (1.9)
BMI, mean (SD): I: 27.1 (3.5) C: 27 (2.9)
Nulliparous, mean (SD): I: 42 (65.6) C: 38 (59.4)
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Each patient received an initial loading dose of 10 mL of 0.1% bupivacaine (2 mL of 0.5% bupivacaine plus 50 μg/mL of fentanyl in 7 mL of 0.9% normal saline).
PIEB Every hour a 10 mL bolus of a mixture of 0.1% bupivacaine plus 2 μg/mL of fentanyl in 0.9% normal saline with the first PIEB bolus given 1 h after the initial loading dose.
|
Describe control (treatment/procedure/test):
Each patient received an initial loading dose of 10 mL of 0.1% bupivacaine (2 mL of 0.5% bupivacaine plus 50 μg/mL of fentanyl in 7 mL of 0.9% normal saline).
CEI: Continuous infusion of 10 mL/h of of a mixture of 0.1% bupivacaine plus 2 μg/mL of fentanyl in 0.9% normal saline started immediately after the initial loading dose.
|
Length of follow-up: until delivery
Loss-to-follow-up: Intervention: 0 (0%)
Control: 0 (0%)
Discontinued intervention: Intervention: 0 (0%)
Control: 0 (0%)
Incomplete outcome data: Intervention: 2 (3%)
Control: 2 (3%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure-1 Pain Defined as VAS pain, mean (SD)
15 min I: 2.2 (2.7) C: 2.5 (2.3)
60 min I: 2.2 (2.8) C: 2.9 (2.8)
120 min I: 2.5 (3.3) C: 3.6 (3.1)
180 min I: 2.6 (3.1) C: 2.9 (2.7)
240 min I: 2 (2.6) C: 3.3 (3.2)
Outcome measure-2 Satisfaction with pain relief Defined as satisfaction with pain relief (0-100 scale) NR
Outcome measure-3 Type of delivery
Defined as cesarean delivery, n (%) I: 9 (14.1) C: 11 (17.2) P=0.626
Defined as instrumental delivery, n (%) I: 5 (9.1) C: 11 (17.2) P=0.262
Outcome measure-4 maternal complications:
Defined as duration labour (min), mean (SD) I: 219.7 (134.2) C: 186.3 (93.4) P=0.323
Required manual anaesthetic interventions (at least one), n (%) I: 12 (18.8%) C: 25 (39%) P=0.011
Pruritus, n (%) I: 4 (6.25) C: 5 (7.81)
Nausea, n (%) I: 4 (6.25) C: 7 (10.94)
Vomiting, n (%) I: 1 (1.56) C: 1 (1.56)
Hypotension, N (I/C) I: 2 (3.12) C: 1 (1.56)
Maternal pyrexia, N (I/C) NR
Motor Block, Bromage scale (0: no block/ 1:partial/ 2: almost complete/ 3: complete), n
15 min I: 59/ 4/ 0/ 1 C: 52/ 6/ 1/ 5
60 min I: 55/ 7/ 0/ 0 C: 46/ 9/ 3/ 4
120 min I: 36/ 8/ 1/ 0 C: 30/ 9/ 4/ 3
180 min I: 21/ 6/ 3/ 0 C: 16/ 11/ 2/ 1
p>0.005
Outcome measure-5 Neonatal outcomes N (I/C)
Neonatal Apgarscore <7 at 5 min, median (range) I: 9.7 (8-10) C: 9.6 (7-10) P=0.695
Fetal bradycardia NR
pH a. umbilicalis NR |
Author’s conclusion PIEB and CEI are effective analgesic techniques to control pain with similar success rates. However, in order to achieve the same results, a greater consumption of drug is required when administering CEI. No differences were seen on labor analgesia, and obstetric and newborn outcomes between both groups. |
|
Nunes, 2016 |
Type of study: RCT
Setting: Hospital Central do Funchal, Funchal, Portugal
Country: Portugal
Source of funding: not reported |
Inclusion criteria: Women with viable pregnancies who requested labor analgesia, with a cervical dilation >3 cm and <5 cm and with a baseline pain score (assessed at the peak of the contraction) from 5 to 10 in verbal numeric scale (VNS) of pain, were included.
Exclusion criteria: Women who had received parenteral opioids, who did not speak the language or were unable to perform motor block evaluation tests, were excluded from the study.
N total at baseline: Intervention: 88* Control: 78
*Patients receiving PIEB were subdivided in 2 groups: n=41 were allocated in PIEB (I1) 0.1%, n=47 were allocated in PIEB (I2) 0.15%.
Important prognostic factors2: Age, mean (SD) I1: 29.4 (6.3) I2: 28.1 (6.7) C: 29.2 (6.1)
Mulitiparous, n I1: 11 I2: 13 C: 19
Twin pregnancy I1: 0 I2: 3 C: 1
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
All parturients received an initial epidural fractioned loading dose of 10 mL with 0.16% Ropivacaine plus Sufentanil 10 µg
I1 PIEB 10 mL of 0.1% Ropivacaine plus Sufentanil 0.2 µg/mL solution every hour beginning 60 min after the administration of the initial epidural loading dose
I2 PIEB 10 mL of 0.15% Ropivacaine plus Sufentanil 0.2 µg/mL solution every hour beginning 60 min after the administration of the initial epidural loading dose |
Describe control (treatment/procedure/test):
All parturients received an initial epidural fractioned loading dose of 10 mL with 0.16% Ropivacaine plus Sufentanil 10 µg
CEI Ropivacaine 0.15% plus Sufentanil 0.2 µg/mL solution at a rate of 5 mL/h
PCEA Boluses of 5 mL with a lockout interval of 20 min, and a per hour maximum volume of 15 mL |
Length of follow-up: until delivery
Loss-to-follow-up: Intervention: 1 (1%)
Control: 3 (4%)
Discontinued intervention: Intervention: 0 (0%)
Control: 0 (0%)
Incomplete outcome data: Intervention: 4 (5%)
Control: 2 (3%) Reason: maternal satisfaction was missing
Number of patients analysed: I1: 33 I2: 37 C: 60 |
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure-1 Pain Defined as VAS pain NR
Outcome measure-2 Satisfaction with pain relief Defined as satisfaction with pain relief (0-100 scale) NR
Outcome measure-3 Type of delivery
Defined as cesarean delivery, n I1: 2 I2: 8 C: 13
Defined as instrumental delivery I1: 11 I2: 11 C: 8
Outcome measure-4 maternal complications:
Defined as duration labour NR
Required manual anaesthetic interventions NR
Pruritus, N (I/C) NR
Nausea No significant differences between groups, values not reported
Vomiting No significant differences between groups, values not reported
Hypotension, N (I/C) No significant differences between groups regarding cardiovascular changes, values not reported
Maternal pyrexia, N (I/C) NR
Motor Block I1: 0% I2: 2.7% C: 6.7%
Outcome measure-5 Neonatal outcomes N (I/C)
Neonatal Apgarscore <7 at 5 min, mean (SD) I1: 9.88 (0.3) I2: 9.92 (0.3) C: 9.80 (0.61)
Fetal bradycardia NR
pH a. umbilicalis NR |
|
95% CI: 95% confidence interval; AUC: area under curve; CEI: continuous epidural infusion; NR: not reported; PCEA: patient controlled epidural analgesia; PIEB: Programmed Intermittent Epidural Bolus; RCT: randomized controlled trial; RR: risk ratio; SD: standard deviation; SR: systematic review; VAS: visual analogue scale
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
George, 2013 |
Yes |
Yes |
Yes |
No, patient characteristics are not described |
Not applicable |
Yes |
Yes |
Yes, using the Egger test |
Unclear, the authors of the SR declared no conflicts of interest, but conflicts of interests were not described for the included studies |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat is de toegevoegde waarde van PIEB al dan niet met PCEA ten opzichte van continue epidurale infusie en ten opzichte van PCEA bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Ferrer, 2017 |
Patients were randomized according to a computer generated sequence to analgesia with either PIEB or CEI with a 1:1 allocation ratio |
Unlikely, the randomization sequence was only known by the research assistant and the nurse staff in charge of drug administration |
Unlikely, single blind trial |
Likely, single blind trial |
Likely, single blind trial |
Unlikely |
Unlikely |
Likely, incomplete outcome data |
|
Nunes, 2016 |
Even age: CEI Odd age+last number of clinical file between 0-4: PIEB 0.1% Odd age+last number of clinical file between 5-9: PIEB 0.15% |
Likely |
Likely |
Likely |
Unlikely, blinded nurse |
Likely, pain was predefined in the method section, but no results were reported |
Unlikely |
Likely, incomplete outcome data |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Gizzo, 2014 |
SR, waarvan relevante studies al geïncludeerd zijn door George, 2013 |
|
Sng, 2014 |
Protocol |
|
George, 2013 |
Erratum op SR George, 2013 |
|
Ferrer, 2017 |
Duplicaat |
|
Kanczuk, 2017 |
Studie naar PIEB tijdinterval |
|
Zakus, 2017 |
Studie naar optimaal bolusvolume |
|
Leone, 2016 |
Voldoet, niet aan PICO, gaat om zwangeren die abortus laten plegen bij <24 weken zwangerschap |
|
McKenzie, 2016 |
Observationele studie uitkomstmaat die niet in RCTs wordt beschreven |
|
Tien, 2016 |
Observationele studie uitkomstmaat die niet in RCTs wordt beschreven |
|
Ferreira, 2014 |
Conference abstract |
|
Freitas, 2014 |
Conference abstract |
|
Nunes, 2014 |
Conference abstract |
|
Sia, 2013 |
Pomp die tijdsduur aanpast adhv de hoeveelheid gevraagde extra bolussen |
|
Campogna, 2012 |
Geen SR of origineel onderzoek |
|
Stirparo, 2011 |
Conference abstract |
|
Wong, 2011 |
Beschrijving van verschillende doseringen |
|
Shidhaye, 2010 |
Voldoet niet aan PICO: geen PIEB |
|
Leo, 2009 |
Duplicaat |
|
Ocampo, 2009 |
Franstalig artikel |
|
Chakravarty, 2006 |
Conference abstract |
|
Wong, 2005 |
Conference abstract |
|
Chua, 2004 |
Voldoet niet aan PICO, na rescue bolus wordt overgegaan op CEI |
|
Sia, 2004 |
Conference abstract |
|
Boutros, 1999 |
Voldoet niet aan PICO: geen PIEB |
|
Onuoha, 2017 |
Geen SR of origineel onderzoek |
|
Sng, 2015 |
Computer geïntegreerde aanpassingen van achtergrondinfusie bij PCEA |
|
Freitas, 2014 |
Duplicaat |
|
Tan, 2012 |
Geen SR of origineel onderzoek |
|
Singh, 2011 |
Geen PIEB, maar bolus on demand |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-07-2020
Beoordeeld op geldigheid : 03-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijnmodule deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
PIEB versus PCEA of CEI |
NVA/ NVOG |
2019 |
2024 |
Eens in de 5 jaar |
Regiehouder en andere wetenschappelijke verenigingen |
Nieuwe inzichten uit onderzoek naar PIEB |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
De ontwikkeling van de richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
- Dr. W.L.M.C.M. Schellekens, extern voorzitter
- Drs. I.C.M. Beenakkers, anesthesioloog, werkzaam in het UMC Utrecht, NVA
- Drs. F.A. Klerk, anesthesioloog, werkzaam in het Diakonessenhuis Utrecht, NVA
- Drs. C.E. Kam-Endtz, anesthesioloog, werkzaam in het Haaglanden Medisch Centrum, NVA
- Dr. F.T.H. Lim, gynaecoloog, werkzaam in het IJssellandziekenhuis, NVOG
- Dr. L.M. Freeman, gynaecoloog, werkzaam in het Ikazia Ziekenhuis Rotterdam, NVOG
- Dr. J.M. Middeldorp, gynaecoloog, werkzaam in het Leids Universitair Medisch Centrum, NVOG
- Drs. A.G. Kaspers, kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Drs. L.A.M. Moll, klinisch verloskundige, werkzaam in het St. Antonius Ziekenhuis Nieuwegein, KNOV
- Dr. J. de Boer, beleidsmedewerker bij KNOV
- Drs. S. Ratsma-Wesselius, Obstetrisch verpleegkundige, werkzaam bij het Amsterdam UMC, Locatie AMC, V&VN
- Dr. J.E. Nagtegaal, Ziekenhuisapotheker, werkzaam in het Meander Medisch Centrum, NVZA
- Dr. A.M.D.E. Timmerman, Klinisch Fysicus, werkzaam in het UMC Utrecht, NVKF
- Drs. J.C. Mooij, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
Met ondersteuning van
- Dr. E.M.E. den Breejen, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. Harmsen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schellekens |
gepensioneerd, ZZP: strategisch adviseur |
Lid RvT Diakonessenhuis, Utrecht |
Geen |
Geen |
|
Klerk |
Staf Anesthesiologie Diakonessenhuis Utrecht. |
bestuurslid Obst. Anesth. onbetaald |
Geen |
Geen |
|
Ratsma Wesselius |
Senior verpleegkundige Verloscentrum AMC |
Gastdocent VU Amstel Academie verpleegkundige vervolgopleidingen Obstetrie, betaald |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog WKZ/UMCU |
Voorzitter sectie obstetrische anesthesie van de NVA. Onbetaald |
Echtgenoot werkzaam bij GSK |
Geen |
|
Nagtegaal |
Ziekenhuisapotheker Meander Medisch Centrum |
Beroepenveldcommissie Farmakunde Hogeschool Utrecht, onbetaald |
Geen |
Geen |
|
Timmerman |
Staffunctionaris Klinische Fysica & Patiëntveiligheid |
Lid NIVEL expertgroep infuustechnologie - advies maken kennistoets voor verpleegkundigen – onbetaald Lid ondernemingsraad UMC Utrecht - onbetaald |
EMRP Researcher Grant Metrology for Drug Delivery HLT07- REG1 €120,422.88 USPTO Applicaton #: #20160106909 Apparatus for simultaneous multiple medicament administration |
Geen |
|
Kam-Endtz |
Anesthesioloog Haaglanden MC |
Geen |
Geen |
Geen |
|
Middeldorp |
Gynaecoloog-perinatoloog |
Geen |
Geen |
Geen |
|
Moll |
Klinisch verloskundige/research verloskundige in het St. Antoniusziekenhuis in Nieuwegein |
Geen |
Geen |
Geen |
|
Freeman |
Gynaecoloog |
voorzitter multidiciplinaire werkgroep obstetrische anesthesie
|
Mijn promotieonderzoek naar epidurale analgesie en remifentanil is gesubsidieerd door ZonMw. Dit onderzoek is afgerond maar de resultaten zullen gebruikt worden in deze richtlijn |
Geen |
|
Mooij |
Beleidsmedewerker Patiëntenvereniging Nederland |
Vrijwilligerswerk (onbetaald) patiëntenorganisatie CCUVN |
Geen |
Geen |
|
Kaspers |
Kinderarts-neonatoloog, MST Enschede |
Geen |
Geen |
Geen |
|
De Boer |
Beleidsmedewerker richtlijnontwikkeling |
Geen nevenwerkzaamheden |
Geen |
Geen |
|
Lim |
gynaecoloog |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patientenfederatie Nederland in de werkgroep te laten deelnemen. De conceptmodule is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland. Daarnaast is door de Patiëntenfederatie Nederland een achterbanraadpleging verricht, waarvan de uitkomsten zo veel mogelijk meegenomen zijn in de overwegingen van de modules.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze modules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, (2010)), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit inventarisatie van de knelpunten door de commissie van de NVA bleek dat er een noodzaak was voor revisie van deze richtlijnmodules. Tevens zijn tijdens een fysieke knelpunteninventarisatie knelpunten aangedragen door aanpalende stakeholders inclusief patiëntenorganisaties. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroepleden en de adviseur uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Indicatoren over zwangerschap en geboorte zijn reeds onderdeel van de vervaardigde indicatoren bij de zorgstandaard integrale geboortezorg. Derhalve zijn er bij deze modules geen indicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules werden aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
(jaartal)
|
1 exp Labor, Obstetric/ or exp Delivery, obstetric/ or exp Labor pain/ or exp Analgesia, obstetric/ or (labor or labour or childbirth or birth* or delivery or parturient*).ti,ab. 783762 2 (pieb or ieb or CIPCEA or ((intermittent or programmed or automated or mandatory or computer*) adj3 bolus*)).ti,ab. 983 3 (PCEA or cei).ti,ab. 1161 4 (exp analgesia, epidural/ or epidural*.ti,ab.) and (exp Analgesia, Patient-Controlled/ or 'patient-controlled'.ti,ab.) 1945 5 ((continuous or basal) adj2 infusion*).ti,ab. 29261 6 3 or 4 or 5 31654 7 1 and 2 and 6 104 8 limit 7 to english language 97 9 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) 367387 10 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) 1891108 11 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ 3174004 12 8 and 9 7 13 8 and (10 not 9) 50 14 8 and (11 not (10 or 9)) 10 |
(na ontdubbelen) 95 |
|
Embase (Elsevier) |
#14 #11 AND #10 NOT (#9 OR #8) 9 #13 #11 AND #9 NOT #8 57 #12 #11 AND #8 8 #11 #7 AND (english)/lim 165 #10 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) 1,869,485 #9 ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it 2,059,220 #8 ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT 'conference abstract':it 297,239* #7 #1 AND #2 AND #6 172 #6 #3 OR #4 OR #5 36,466 #5 ((continuous OR basal) NEAR/2 infusion*):ab,ti 33,226 #4 ('epidural analgesia'/exp OR epidural*:ab,ti) AND ('patient controlled analgesia'/exp OR 'patient-controlled':ab,ti) 2,731 #3 'patient controlled epidural analgesia'/exp OR pcea:ab,ti OR cei:ab,ti 1,562 #2 'programmed intermittent epidural bolus'/exp OR pieb:ab,ti OR ieb:ab,ti OR cipcea:ab,ti OR (((intermittent OR programmed OR automated OR mandatory OR computer*) NEAR/3 bolus*):ab,ti) 1,333 #1 'labor'/exp OR 'obstetric delivery'/exp OR 'labor pain'/exp OR 'obstetric analgesia'/exp OR labor:ab,ti OR labour:ab,ti OR childbirth:ab,ti OR birth*:ab,ti OR delivery:ab,ti OR parturient*:ab,ti 945,703 |
|
|
Cochrane library (wiley) |
(labor:ab,ti OR labour:ab,ti OR childbirth:ab,ti OR delivery:ab,ti OR parturient*:ab,ti) AND (pieb:ab,ti OR ieb:ab,ti OR cipcea:ab,ti OR ((intermittent OR programmed OR automated OR mandatory OR computer*) NEAR/3 bolus*):ab,ti) AND ((pcea:ab,ti OR cei:ab,ti OR (epidural*:ab,ti AND 'patient-controlled':ab,ti)) OR ((continuous OR basal) NEAR/2 infusion*):ab,ti) |
