Pethidine vs Morfine of Tramadol
Uitgangsvraag
Wat is de effectiviteit van parenterale pethidine vergeleken met morfine of tramadol bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
Aanbeveling
Ontraad de zwangere vrouw om voor lang werkende opioïden voor pijnbehandeling tijdens de bevalling te kiezen.
Indien de zwangere vrouw in samenspraak met haar zorgverlener kiest voor langwerkende opioïden ten behoeve van sedatie aan het begin van de bevalling, dan is er op grond van de beschikbare literatuur geen reden om één van de langwerkende opioïden de voorkeur te geven boven de andere.
Overwegingen
De onderstaande overwegingen gelden in principe voor de gehele patiëntenpopulatie zoals geformuleerd in de uitgangsvraag.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Literatuur over langwerkende opioïden voor de behandeling van pijn tijdens de bevalling is relatief schaars en weinig recent. Op basis van de literatuurstudie werd de Cochrane systematische review van Ullman geselecteerd (Ullman, 2011). Opvallend was de beperkte mate van pijnstilling die bereikt werd met relatief hoge pijnscores gerapporteerd als door middel van een VAS (mediaan) van 8 en 9 op een schaal van 10.
In de onderlinge vergelijking tussen pethidine en tramadol toont de literatuur geen duidelijk klinisch relevant verschil in effectiviteit van de pijnbehandeling, met 39% onvoldoende pijnstilling bij tramadol en 25% bij pethidine. Ook lijkt er geen verschil in cross-over naar een andere of aanvullende pijnbehandeling, tussen behandeling met pethidine of tramadol. De kritieke uitkomstmaten tevredenheid en maternale/neonatale sterfte werden niet in de literatuur gerapporteerd. De bijwerking misselijkheid/braken verschilt niet significant tussen de groepen, met 16% bij behandeling met tramadol en 21% bij pethidine. Ook de modus partus lijkt niet te verschillen tussen de beide opties en een Apgarscore <7 bij 5 minuten kwam in de studies niet voor.
Er is slechts beperkt literatuur beschikbaar over de vergelijking pethidine versus morfine. In deze module hebben we ons daarbij voor de pethidine ook beperkt tot de toedieningsweg IM, aangezien deze voornamelijk in Nederland toegepast wordt. Zo worden de kritieke uitkomstmaten pijnintensiteit, tevredenheid en maternale/neonatale sterfte niet in de literatuur gerapporteerd. Het verzoek om aanvullende pijnbehandeling wordt wel beschreven waarbij geen verschil wordt waargenomen met pethidine indien morfine IM wordt toegediend. Ook de bijwerking misselijkheid/braken verschilt niet tussen morfine IM versus pethidine IM.
Een overig nadelig effect van langwerkende opioïden is maternale sufheid/ sedatie welke werd gerapporteerd in de Cochrane review van Ullman (2011) met 28% bij behandeling met tramadol, 55% bij pethidine en 20% bij morfine.
Samengevat lijken er geen grote verschillen in de effectiviteit en veiligheid tussen de opioïden onderling. De overall bewijskracht is laag tot zeer laag. De effectiviteit van deze langwerkende opioïden kan worden aangeduid als matige pijnbehandeling en een sedatieve werking wordt beschreven. Hierbij moet rekening gehouden worden met de lange halfwaardetijden van de betreffende middelen en de bijbehorende actieve metabolieten. Pethidine en de actieve metaboliet norpethidine hebben respectievelijk een halfwaardetijd van 4 en 20 uur maternaal en van 13 en 62 uur voor de neonaat. Pethidine passeert de placenta door passieve diffusie met een maximale foetale plasmaconcentratie 2 tot 3 uur na maternale toediening. Neonaten kunnen na maternale toediening van langwerkende opioïden dan ook minder alert zijn en problemen met borstvoeding hebben. Morfine passeert de placenta ook, maar geeft door een snellere maternale eliminatie met een halfwaardetijd van 2 tot 3 uur mindere foetale belasting.
Waarden en voorkeuren van patiënten
Zwangere vrouwen willen informatie over alle vormen van pijnbehandeling. Naast informatie over de effectiviteit, willen zij ook inzage in de mogelijke bijwerkingen van de verschillende vormen van pijnbehandeling voor henzelf en de baby. Tevens is de beschikbaarheid van middelen een belangrijke overweging voor de zwangere vrouw. Uit de meldactie van de Patiëntenfederatie Nedeland blijkt dat ongeveer de helft van de zwangeren van tevoren ingelicht is over injecties met pethidine. Uiteindelijk heeft 10% pethidine gehad tijdens de bevalling.
Veel genoemde nadelen van opioïden zijn beperkte pijnstilling, sedatie/sufheid, misselijkheid en braken voor de zwangere en mogelijk verminderde alertheid en voedingsproblemen bij de pasgeborene. Ook kan de relatief pijnlijke parenterale toedieningsroute een rol spelen.
Beweegredenen voor de zwangere om voor pijnbehandeling met pethidine/ tramadol/ morfine te kiezen kunnen zijn contra-indicatie of angst voor epidurale analgesie of geen beschikbaarheid van remifentanil.
Kosten (middelenbeslag)
Pethidine, tramadol en morfine hebben vergelijkbare prijzen per dosering.
Aanvaardbaarheid voor de overige relevante stakeholders
Bij gebruik van pethidine, morfine of tramadol kan in sommige klinieken de begeleiding van de zwangere door de eigen verloskundige voortgezet worden. Dit is bij epidurale analgesie en remifentanil niet het geval.
Haalbaarheid en implementatie
Gezien de geringe effectiviteit van langwerkende opioïden voor de behandeling van pijn tijdens de bevalling en de sedatieve werking van opioïden, beveelt de werkgroep aan terughoudend te zijn met het gebruik van deze middelen voor pijnbehandeling. In Nederland zijn effectievere methoden voor pijnbehandeling voorhanden, zie de modules ‘Epidurale analgesie versus Pethidine‘ en ‘Remifentanil vs Epidurale analgesie, Pethidine of Tramadol’.
De sedatieve werking van opioïden kan een rol hebben in de fase voor de bevalling, wanneer met name sedatie gewenst is.
Aanbeveling-1
Rationale/ balans tussen voor- en nadelen van de interventie
Uit de literatuur blijkt dat er met langwerkende opioïden IM slechts beperkte pijnstilling wordt bereikt met relatief hoge pijnscores. In Nederland zijn effectievere methoden voor pijnbehandeling tijdens de bevalling ruim voorhanden.
Aanbeveling-2
Uit de literatuurstudie blijkt dat er geen grote verschillen in effectiviteit en veiligheid lijken te bestaan tussen pethidine IM en tramadol IM of morfine IM. De effectiviteit van deze langwerkende opioïden kan worden aangeduid als matige pijnstilling, waarbij de voornaamste bijwerkingen misselijkheid, braken en maternale sufheid zijn.
Onderbouwing
Achtergrond
Langwerkende parenterale opioïden worden sinds lange tijd gebruikt als pijnbehandeling tijdens de bevalling. Hoewel epidurale analgesie inmiddels de gouden standaard is en er bij gebruik van opioïden slechts matige vermindering van de pijn optreedt, wordt nog wel eens voor deze vorm van pijnbehandeling gekozen. Wellicht omdat deze relatief goedkoop en makkelijk voorhanden is wanneer epidurale pijnstilling niet mogelijk en remifentanil niet beschikbaar is of omdat zwangeren hiervoor kiezen zodat de verloskundige de bevalling zo mogelijk verder kan begeleiden. Wereldwijd wordt pethidine het meest gebruikt, andere minder gebruikte parenterale middelen zijn morfine en tramadol. Er is een grote praktijkvariatie in het gebruik van langwerkende parenterale opioïden tijdens de bevalling. De vraag is hoe de effectiviteit, de tevredenheid en de veiligheid van parenterale morfine en tramadol zich verhoudt tot die van pethidine.
Conclusies / Summary of Findings
IM tramadol versus IM pethidine
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in de pijnintensiteit tussen zwangeren behandeld met IM tramadol en zwangeren behandeld met IM pethidine.
Bronnen: (Keskin, 2003; Viegas, 1993; Kooshideh, 2009) |
|
Laag GRADE |
Er lijkt geen verschil in het gebruik van aanvullende pijnmedicatie tussen zwangeren behandeld met IM tramadol en zwangeren behandeld met IM pethidine.
Bronnen: (Bitsch, 1980; Khooshideh, 2009; Prasertsawat, 1986) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op misselijkheid/braken tussen zwangeren behandeld met IM tramadol en zwangeren behandeld met IM pethidine.
Bronnen: (Bitsch, 1980; Husslein, 1987; Keskin, 2003; Khooshideh, 2009; Prasertsawat, 1986; Viegas, 1993) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op een vaginale kunstverlossing of sectio caesarea tussen zwangeren behandeld met IM tramadol en zwangeren behandeld met IM pethidine.
Bronnen: (Husslein, 1987; Khooshideh, 2009; Viegas, 1993) |
|
Laag GRADE |
In geen van de studies naar pethidine IM versus tramadol IM werden neonaten met een lage Apgarscore (≤ 7 bij 5 minuten) waargenomen.
Bronnen: (Khooshideh, 2009; Prasertsawat, 1986) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op opname in een special care unit/intensive care unit bij neonaten van zwangeren behandeld met IM tramadol en neonaten van zwangeren behandeld met IM pethidine.
Bronnen: (Keskin, 2003) |
|
Laag GRADE |
In geen van de studies naar pethidine IM versus tramadol IM werd reanimatie van de neonaat waargenomen.
Bronnen: (Prasertsawat, 1986) |
IM morfine versus IM pethidine
|
Laag GRADE |
Er lijkt geen verschil in het risico op gebruik van aanvullende pijnmedicatie tussen zwangeren behandeld met IM morfine en zwangeren behandeld met IM pethidine.
Bronnen: (Prasertsawat, 1986) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op misselijkheid/braken tussen zwangeren behandeld met IM morfine en zwangeren behandeld met IM pethidine.
Bronnen: (Prasertsawat, 1986) |
|
Laag GRADE |
In geen van de studies naar pethidine IM versus morfine IM werd reanimatie van de neonaat waargenomen.
Bronnen: (Prasertsawat, 1986) |
Samenvatting literatuur
Beschrijving studies
De Cochrane-review van Ullman (2011) includeerde 7 RCT’s (Bitsch, 1980; Fieni, 2000; Husslein, 1987; Keskin, 2003; Khooshideh, 2009; Prasertsawat, 1986; Viegas, 1993), waarbij IM tramadol werd vergeleken met IM pethidine. De doseringen IM tramadol en IM pethidine varieerden tussen studies (50, 75 of 100 mg). Eén RCT vergeleek IM morfine met IM pethidine (Prasertsawat, 1986). Er werden geen studies gevonden die aan de PICO voldeden waarin subcutane toediening van tramadol of morfine vergeleken werd met IM pethidine. De overige studies uit de meta-analyse van Ullman (2011) beschreven andersoortige pijnmedicatie en zijn om die reden buiten beschouwing gelaten in deze literatuuranalyse.
Resultaten
IM tramadol versus IM pethidine
Pijnintensiteit
De Cochrane review van Ullman (2011) includeerde vijf RCT’s (Bitsch, 1980; Keskin, 2003; Khooshideh, 2009; Prasertsawat, 1986; Viegas, 1993) (n=143 zwangeren) waarin de uitkomstmaat pijnintensiteit gerapporteerd werd. De studies van Bitsch (1980) en Prasertsawat (1986) definieerden de meetmethode niet of gebruikte een niet-nader gedefinieerde vragenlijst. Deze studies werden buiten beschouwing gelaten in de analyse naar pijnintensiteit. In drie studies (Keskin, 2003; Viegas, 1993; Kooshideh, 2009) (n=268 zwangeren) werd pijnintensiteit gemeten volgens een gevalideerde schaal (VAS-schaal, VRS-schaal, Faces Pain Rating-schaal). De data van Kooshideh (2009) kon niet worden gepoold vanwege het rapporteren van medianen. Deze studie wordt beschrijvend weergegeven.
Keskin (2003) en Viegas (1993) rapporteerden het aantal zwangeren dat de pijnbehandeling als ‘onvoldoende’ beoordeelde. Zwangeren in de pethidine groep bleken een betere pijnstilling te ervaren in vergelijking met zwangeren in de tramadol-groep (RR 1,56; 95% BI 1,06 tot 2,32). Khooshideh (2009) bepaalde de pijnintensiteit 10 en 60 minuten na het toedienen van de medicatie en gedurende de ontsluitings- en uitdrijvingsfase. Er werd geen significant verschil waargenomen in pijnintensiteit op de tijdspunten 10 en 60 minuten, alsmede tijdens de ontsluitingsfase . Tijdens de uitdrijvingsfase werd er een significant lagere pijnscore waargenomen bij zwangeren behandeld met pethidine in vergelijking met tramadol (mediaan, range: 8, 5 tot 10 voor pethidine versus 9, 5 tot 10 voor tramadol, P-waarde= 0,009). Echter, ook hier lijkt geen sprake van een klinisch relevant verschil.
Figuur 1 Pijnintensiteit (aantal zwangeren dat pijnbehandeling als ‘onvoldoende’ beoordeelde)
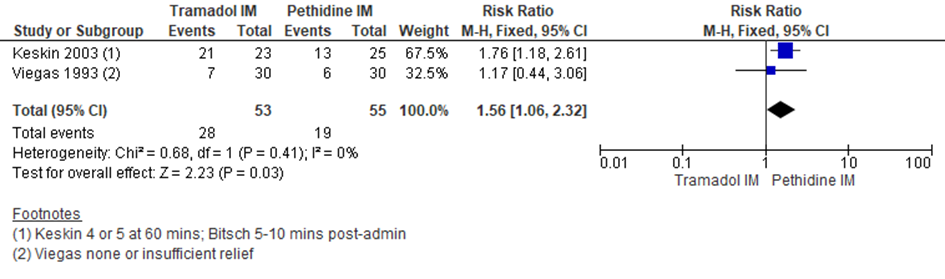
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Ullman (2011) (studies over IM tramadol versus IM pethidine geselecteerd)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijnintensiteit is met drie niveau’s verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), imprecisie (-2 graderingen vanwege geringe aantal patiënten/events en brede betrouwbaarheidsinterval). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Aanvullende pijnmedicatie
De Cochrane review van Ullman (2011) includeerde drie RCT’s (Bitsch, 1980; Khooshideh, 2009; Prasertsawat, 1986) (n=295 zwangeren) waarin het gebruik van aanvullende pijnmedicatie gerapporteerd werd. Er werd geen significant verschil waargenomen tussen zwangeren die behandeld werden met IM tramadol en IM pethidine in het verzoek om aanvullende pijnmedicatie (RR 1,07; 95% BI: 0,60 tot 1,91). Er was sprake van matige heterogeniteit (I2 46%).
Figuur 2 Aanvullende pijnmedicatie
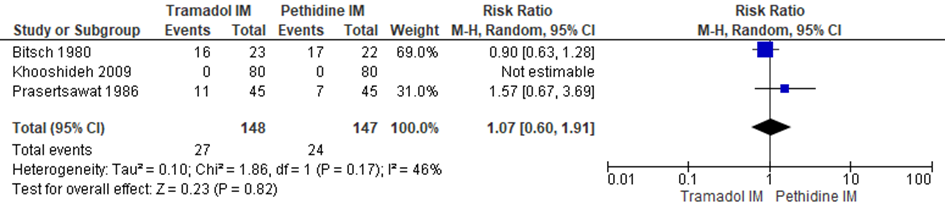
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Ullman (2011) (studies over IM tramadol versus IM pethidine geselecteerd)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aanvullende pijnmedicatie is met twee niveau’s verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), imprecisie (brede betrouwbaarheidsinterval). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Misselijkheid/ braken
De Cochrane review van Ullman (2011) includeerde zes RCT’s (Bitsch, 1980; Husslein, 1987; Keskin, 2003; Khooshideh, 2009; Prasertsawat, 1986; Viegas, 1993) (n=454 zwangeren) waarin de bijwerking misselijkheid en braken gerapporteerd werd.
Er werd geen significant verschil waargenomen tussen zwangeren die behandeld werden met IM tramadol en IM pethidine in de bijwerking misselijkheid en braken (RR 0,97; 95% BI: 0,34 tot 2,76) Er was sprake van substantiële heterogeniteit (I2 72%).
Figuur 3 Misselijkheid/braken
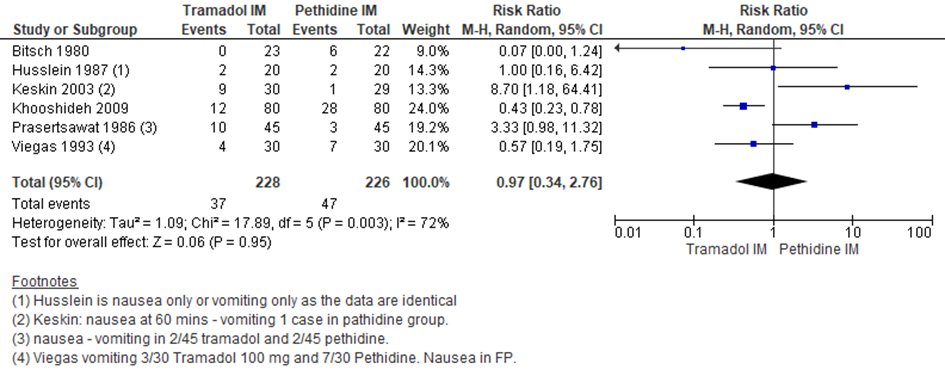
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Ullman (2011) (studies over IM tramadol versus IM pethidine geselecteerd)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat misselijkheid/braken is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en inconsistentie van de puntschatters (heterogeniteit die tevens resulteert in een breed betrouwbaarheidsinterval van het gepoolde effect). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Modus partus - Vaginale kunstverlossing
De Cochrane review van Ullman (2011) includeerde drie RCT’s (Husslein, 1987; Khooshideh, 2009; Viegas, 1993) (n=260) waarin het aantal vaginale kunstverlossingen gerapporteerd werd (in de individuele studies gedefinieerd als forceps/vacuüm).
Er werd geen significant verschil waargenomen in het risico op een vaginale kunstverlossing tussen zwangeren behandeld met IM tramadol en IM pethidine (RR 0,56; 95% BI: 0,12 tot 2,56). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 4 Modus partus (vaginale kunstverlossing)
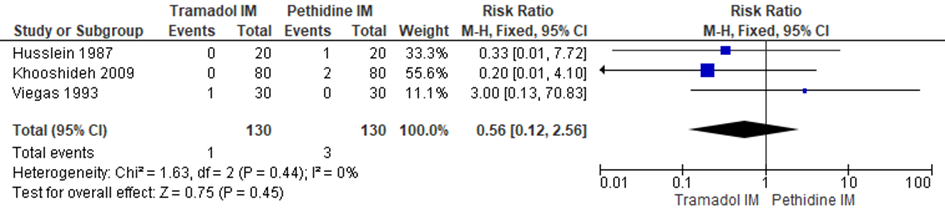
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Ullman (2011) (studies over IM tramadol versus IM pethidine geselecteerd)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vaginale kunstverlossing is met twee niveau’s verlaagd vanwege het geringe aantal patiënten/events en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Modus partus - Sectio caesarea
De Cochrane review van Ullman (2011) includeerde drie RCT’s (Husslein, 1987; Khooshideh, 2009; Viegas, 1993) (n=260) waarbij sectio caesarea als uitkomstmaat meegenomen werd. Er werd geen significant verschil waargenomen in het risico op een sectio caesarea tussen zwangeren behandeld met IM tramadol en IM pethidine (RR 0,71; 95% BI: 0,23 tot 2,18). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 5 Modus partus (sectio caesarea)
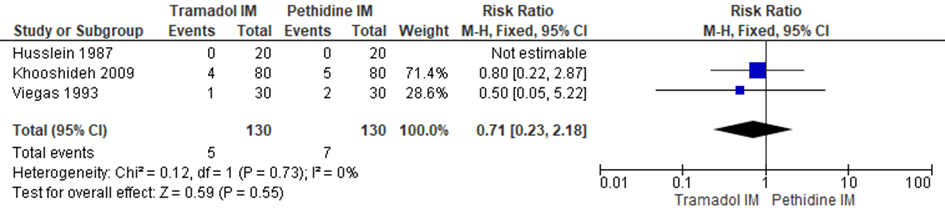
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Ullman (2011) (studies over IM tramadol versus IM pethidine geselecteerd
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat sectio caesarea is met twee niveau’s verlaagd gezien het geringe aantal patiënten/events en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Apgarscore (< 7 bij 5 minuten)
De Cochrane review van Ullman (2011) includeerde twee RCT’s (Prasertsawat, 1986; Khooshideh, 2009) (n=250 zwangeren) waarin een Apgarscore < 7 bij 5 minuten meegenomen werd als uitkomstmaat. Echter, in beide studies werd bij geen enkele baby een Apgarscore < 7 waargenomen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Apgarscore is met twee niveau’s verlaagd gezien het geringe aantal patiënten en ontbreken van events (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Opname NICU
De Cochrane review van Ullman (2011) includeerde één RCT (Keskin, 2003) (n=59 zwangeren) waarin de opname in een speciale care unit/intensive care unit gerapporteerd werd. Er bleek geen significant verschil tussen het risico in opname op de NICU tussen zwangeren behandeld met IM tramadol en IM pethidine (RR 2,26; 95%BI: 0,64 tot 7,89).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat opname NICU is met drie niveau’s verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias), het geringe aantal patiënten en brede betrouwbaarheidsinterval (-2 graderingen voor imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Hartslag afwijkingen
De Cochrane review van Ullman (2011) includeerde één RCT (Prasertsawat, 1986) (n= 90 zwangeren) waarin neonatale reanimatie werd meegenomen als uitkomstmaat. Binnen deze trial werden geen neonaten gereanimeerd.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat neonatale reanimatie is met twee niveau verlaagd vanwege het geringe aantal patiënten en ontbreken van events (-2 graderingen voor imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
De volgende uitkomstmaten werden niet in de literatuur gerapporteerd: tevredenheid ten aanzien van pijnstilling, borstvoeding, maternale complicaties (convulsie/ eclamptisch insult, fluxus postpartum, ademhalingsdepressie, bevallingsduur, hypotensie, temperatuur, urineretentie, jeuk, mate van motorisch blok, postspinale punctie hoofdpijn en epiduraal abces/hematoom) neonatale complicaties (temperatuur, pH a. umbilicalis, mortaliteit en negatieve uitkomsten voor de baby op lange termijn), maternale/ neonatale sterfte en kosten.
IM morfine versus IM pethidine
Pijnintensiteit
Één studie (Prasertsawat, 1986) (n=90 zwangeren) uit de Cochrane review van Ullman (2011) includeerde de vergelijking IM morfine versus IM pethidine. De studie van Prasertsawat (1986) gebruikte een niet-nader gedefinieerde vragenlijst voor het meten van pijnintensiteit. Deze studie werd om die reden buiten beschouwing gelaten in deze analyse.
Aanvullende pijnmedicatie
De Cochrane review van Ullman (2011) includeerde één RCT (Prasertsawat, 1986) (n=90 zwangeren) waarin het gebruik van aanvullende pijnmedicatie gerapporteerd werd. Er bleek geen significant verschil in het gebruik van aanvullende pijnmedicatie tussen zwangeren behandeld met IM morfine en IM pethidine (RR 1,14; 95% BI: 0,45 tot 2,89).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aanvullende pijnmedicatie is met twee niveaus verlaagd vanwege het geringe aantal patiënten en brede betrouwbaarheidsinterval (-2 graderingen voor imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Misselijkheid/ braken
De Cochrane review van Ullman (2011) includeerde één RCT (Prasertsawat, 1986) (n = 90 zwangeren) waarin de complicatie misselijkheid/braken gerapporteerd werd. Er bleek geen significant verschil in de complicatie misselijkheid/braken tussen zwangeren behandeld met IM morfine en IM pethidine (RR 1,00; 95% BI: 0,21 tot 4,69).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat misselijkheid/braken is met twee niveaus verlaagd vanwege het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Hartslag afwijkingen
Neonatale reanimatie
De Cochrane review van Ullman (2011) includeerde één RCT (Prasertsawat, 1986) (n = 90 zwangeren) waarin de uitkomstmaat neonatale reanimatie gerapporteerd werd. Binnen de trial werden geen neonaten gereanimeerd.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat neonatale reanimatie is met twee niveaus verlaagd vanwege het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
De volgende uitkomstmaten werden niet in de literatuur gerapporteerd: pijnintensiteit, tevredenheid ten aanzien van pijnstilling, borstvoeding, wijze van bevallen (vaginale kunstverlossing, sectio caesarea), maternale complicaties (convulsie/ eclamptisch insult, fluxus postpartum, ademhalingsdepressie, bevallingsduur, hypotensie, temperatuur, urineretentie, misselijkheid/braken, jeuk, mate van motorisch blok, postspinale punctie hoofdpijn en epiduraal abces/ hematoom), neonatale complicaties (opname NICU, Apgarscore <7 bij 5 min, foetale hartslag afwijkingen, temperatuur, pH a. umbilicalis, mortaliteit en negatieve uitkomsten voor de baby op lange termijn) , maternale/ neonatale sterfte en kosten.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van parenterale pethidine vergeleken met morfine of tramadol bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
P: zwangere vrouwen met het verzoek tot behandelen van de baringspijn?;
I: pethidine (parenterale toediening intramusculair (IM));
C: morfine/ Tramadol (parenterale toediening intramusculair (IM) of subcutaan);
O: zie onderstaand:
- Pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument).
- Cross-over naar andere/ aanvullende pijnmedicatie.
- Tevredenheid ten aanzien van pijnstilling (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument).
- Borstvoeding.
- Modus partus (vaginale kunstverlossing, sectio caesarea).
- Maternale complicaties: convulsie/ eclamptisch insult, fluxus postpartum, ademhalingsdepressie, bevallingsduur, hypotensie, temperatuur, urineretentie, misselijkheid/braken, jeuk, mate van motorisch blok, postspinale punctie hoofdpijn, epiduraal abces/ hematoom.
- Neonatale complicaties: opname NICU, Apgarscore < 7 bij 5 min, foetale hartslag afwijkingen, temperatuur, pH a. umbilicalis, mortaliteit, negatieve uitkomsten voor de baby op lange termijn.
- Maternale/ neonatale sterfte.
- Kosten.
Relevante uitkomstmaten
De werkgroep achtte pijnintensiteit, tevredenheid, modus partus (vaginale kunstverlossing, sectio caesarea) en maternale/ neonatale sterfte voor de besluitvorming kritieke uitkomstmaten; Apgarscore < 7 bij 5 min en misselijkheid/braken zijn voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt: pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument) en tevredenheid (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument), waarbij scores door de patiënt zelf gedurende of direct na de bevalling gerapporteerd werden. Voor neonatale Apgarscore wordt de definitiescore van < 7 bij 5 minuten aangehouden. Voor de overige uitkomstmaten definieerde de werkgroep niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Naast significantie wordt de klinische besluitvorming vooral bepaald door de klinische relevantie van de waargenomen verschillen tussen behandelopties. Voor dichotome uitkomstmaten definieerde de werkgroep een minimaal klinisch (patiënt) relevant verschil volgens de grenzen van de GRADE-working group, namelijk een verschil in relatief risico van 25%. Voor de continue uitkomstmaten definieerde de werkgroep een verschil van 10% op pijnintensiteit of tevredenheid als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
Het betreft een literatuurzoekactie gebaseerd op de Cochrane systematische review van Ullman (2011). In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 12 januari 2018 met relevante zoektermen gezocht naar studies die pijnbehandeling middels pethidine vergeleken met morfine of tramadol bij zwangere vrouwen met baringspijn. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 85 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Studiedesign RCT.
- Gepubliceerd tussen 1 januari 2009 en 12 januari 2018.
- Beschrijven van minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 14 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 13 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 1 studie definitief geselecteerd. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Ullman R, Smith LA, Burns E, Mori R, Dowswell T. Parenteral opioids for maternal pain relief in labour. Cochrane Database Syst Rev. 2010 Sep 8;(9):CD007396. doi: 10.1002/14651858.CD007396.pub2. Review. Update in: Cochrane Database Syst Rev. 2018 Jun 05;6:CD007396.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de effectiviteit van Pethidine vergeleken met Morfine of Tramadol bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Ullman, 2014
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to (month/year)
A: Bitsch, 1980 B: Fieni, 2000 C: Husslein, 1987 D: Keskin, 2003 E: Khooshideh, 2009 F: Prasertsawat, 1986 H: Prasertsawat, 1986
I: Campbell, 1961 J: Olofsson, 1996
Study design: RCTs
Setting and Country: A: Hospital setting, Germany Source of funding: (commercial / non-commercial / industrial co-authorship)
|
Inclusion criteria SR:
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N participants: B: IM Tramadol = 20; IM Pethidine = 20 C: IM Tramadol = 20; IM Pethidine = 20 D: IM Tramadol = 30; IM Pethidine = 29
Groups comparable at baseline? B: No baseline characteristics table C: Baseline characteristics stated as similar D: Unclear |
Describe intervention:
A: IM tramadol 50 mg (If additional analgesia required, repeat doses could be administered within < 1 hr – Tramadol could have up to 3 repeat doses, 50 mg) B: IM tramadol 100 mg (second dose of study drug allowed after 2 hrs as required) C: IM tramadol 100 mg D: IM tramadol 100 mg, single dose E: IM tramadol 100 mg 2nd dose on maternal request after 4 hours F: IM tramadol 100 mg Second injection possible after 1 hr or half original study dose, each participant could receive maximum of 2 doses G: IM tramadol 50 mg; IM tramadol 100 mg (single dose of study drug) IM morphine versus IM pethidine IV morphine versus IV pethidine I: IV pethidine (initial dose 100 mg) (Interventions at 3-4 cm dilatation for primiparous, and 4-5 cm for multiparous women. All 3 groups also received 0.4 mg of scopolamine. If further analgesia was required women were given a half of the initial dose and 0.2 mg of scopolamine. If more than 2 additional doses were required analgesia was at the discretion of the attending doctor. |
Describe control:
IM tramadol versus IM pethidine B: IM pethidine 75 mg (second dose of study drug allowed after 2 hrs as required) C: IM pethidine 100 mg D: IM pethidine 100 mg, single dose E: IM pethidine 50 mg 2nd dose on maternal request after 4 hours but pethidine withheld if cx dilated > 8 cm and tramadol given instead F: IM pethidine 100 mg Second injection possible after 1 hr or half original study dose, each participant could receive maximum of 2 doses G: IM pethidine 75 mg (single dose of study drug) H: IM pethidine 100 mg Second injection possible after 1 hr of half original study dose, each participant could receive maximum of 2 doses
I: IV Morphine (initial dose 8 mg) (Interventions at 3-4 cm dilatation for primiparous, and 4-5 cm for multiparous women.
|
End-point of follow-up: Untill day of delivery (for outcomes relevant for this study question)
For how many participants were no complete outcome data available? (intervention/control) A: Women not having a normal birth were excluded from analyses. No information on pain relief was available for 7/45 women. B: Unclear how many women analysed as only percentages reported. C: All women analysed. D: Losses to follow-up not explained and no intention-to-treat analysis E: Flow chart addresses all data. F: All participants analysed. G: All participants analysed. H: All participants analysed. I: All women appear to be accounted for in the analysis and there were few missing data. The data regarding babies was less clear, denominators were not provided J: No apparent loss to follow-up.
|
IM tramadol versus IM pethidine Defined as pain intensity: women with poor pain relief Range: 5-10
Additional analgesia required
RiskRatio M-H 1.07 (95% CI 0.60 to 1.91) favoring IM pethidine Heterogeneity (I2): 46% Outcome measure-3 Nausea and vomiting RiskRatio M-H 0.97 (95% CI 0.34 to 2.76) favoring IM tramadol Heterogeneity (I2): 72% RiskRatio M-H 0.56 (95% CI 0.12 to 2.56) favoring IM tramadol Heterogeneity (I2): 0.0% RiskRatio M-H 0.71 (95% CI 0.23 to 2.18) favoring IM tramadol Heterogeneity (I2): 0.0% Heterogeneity (I2): not estimable IM Tramadol: 0/45 Heterogeneity (I2): not estimable
IM Tramadol: 7/30 Heterogeneity (I2): not applicable
RiskRatio: 2.26 (95% CI 0.64 to 7.89) favoring IM pethidine IM morphine versus IM pethidine
RiskRatio M-H 1.14 (95% CI 0.45 to 2.89) favoring IM pethidine Heterogeneity (I2): not applicable RiskRatio M-H 1.00 (95% CI 0.21 to 4.69) favoring nothing Heterogeneity (I2): not applicable Heterogeneity (I2): not estimable
IV morphine versus IV pethidine
Outcome measure-17 Heterogeneity (I2): not applicable Heterogeneity (I2): not applicable Heterogeneity (I2): not applicable Heterogeneity (I2): not applicable
RiskRatio: not estimable Heterogeneity (I2): not estimable |
Risk of bias: Random sequence (selection bias): Low risk: B, E High risk: Unclear: A, C, D, F, G, H, I, J
Allocation concealment (selection bias): Low risk: E, I, J Unclear: A, B, C, D, F, G, H
Blinding participants (performance/ detection bias): Low risk: G, I, J High risk: Unclear: A, B, C, D, E, F, H
Blinding clinical staff (performance/ detection bias): Low risk: G, I, J High risk: Unclear: A, B, C, D, E, F, H
Blinding outcome assessor (performance/ detection bias): Low risk: A, D, E, F, G, H, I High risk: Unclear: B, C, J
Incomplete outcome data (attrition bias): Low risk: C, E, F, G, H, J High risk: A, D Unclear: B, I
Selective reporting (reporting bias): Low risk: High risk: I Unclear: A, B, C, D, E, F, G, H, J
Other bias: Low risk: F, H High risk: B
Notes:
|
Risk of bias table
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Wat is de effectiviteit van Pethidine vergeleken met Morfine of Tramadol bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Ullman, 2011 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Jones, 2012 |
Betreft een samenvatting van Cochrane reviews |
|
Pandya, 2010 |
Narratieve review |
|
Reynolds, 2010 |
Narratieve review |
|
Koyyalamudi, 2016 |
Narratieve review |
|
Shetty, 2014 |
Voldoet niet aan PICO: vergelijkt met Pentazocine |
|
Tveit, 2013 |
Enkel een abstract |
|
Jabalameli, 2012 |
Voldoet niet aan PICO: gaat over pijnstilling na sectio |
|
Wee, 2012 |
Voldoet niet aan PICO: vergelijkt met diamorphine |
|
Anderson, 2011 |
Narratieve review |
|
Halpern, 2010 |
Voldoet niet aan PICO: vergelijkt met epiduraal |
|
Fyneface-Ogan, 2009 |
Voldoet niet aan PICO: vergelijkt met epiduraal |
|
Khooshideh, 2009 |
Al geïncludeerd in de Cochrane review van Ullman, 2010. Wordt dus al meegenomen. |
|
Weissman, 2009 |
Voldoet niet aan PICO: vergelijkt met epiduraal |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-07-2020
Beoordeeld op geldigheid : 03-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijnmodule deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Opioïden |
NVA |
2019 |
2024 |
5-jaarlijks |
NVA |
- |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
De ontwikkeling van de richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
- Dr. W.L.M.C.M. Schellekens, extern voorzitter
- Drs. I.C.M. Beenakkers, anesthesioloog, werkzaam in het UMC Utrecht, NVA
- Drs. F.A. Klerk, anesthesioloog, werkzaam in het Diakonessenhuis Utrecht, NVA
- Drs. C.E. Kam-Endtz, anesthesioloog, werkzaam in het Haaglanden Medisch Centrum, NVA
- Dr. F.T.H. Lim, gynaecoloog, werkzaam in het IJssellandziekenhuis, NVOG
- Dr. L.M. Freeman, gynaecoloog, werkzaam in het Ikazia Ziekenhuis Rotterdam, NVOG
- Dr. J.M. Middeldorp, gynaecoloog, werkzaam in het Leids Universitair Medisch Centrum, NVOG
- Drs. A.G. Kaspers, kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Drs. L.A.M. Moll, klinisch verloskundige, werkzaam in het St. Antonius Ziekenhuis Nieuwegein, KNOV
- Dr. J. de Boer, beleidsmedewerker bij KNOV
- Drs. S. Ratsma-Wesselius, Obstetrisch verpleegkundige, werkzaam bij het Amsterdam UMC, Locatie AMC, V&VN
- Dr. J.E. Nagtegaal, Ziekenhuisapotheker, werkzaam in het Meander Medisch Centrum, NVZA
- Dr. A.M.D.E. Timmerman, Klinisch Fysicus, werkzaam in het UMC Utrecht, NVKF
- Drs. J.C. Mooij, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
Met ondersteuning van
- Dr. E.M.E. den Breejen, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. Harmsen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schellekens |
gepensioneerd, ZZP: strategisch adviseur |
Lid RvT Diakonessenhuis, Utrecht |
Geen |
Geen |
|
Klerk |
Staf Anesthesiologie Diakonessenhuis Utrecht. |
bestuurslid Obst. Anesth. onbetaald |
Geen |
Geen |
|
Ratsma Wesselius |
Senior verpleegkundige Verloscentrum AMC |
Gastdocent VU Amstel Academie verpleegkundige vervolgopleidingen Obstetrie, betaald |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog WKZ/UMCU |
Voorzitter sectie obstetrische anesthesie van de NVA. Onbetaald |
Echtgenoot werkzaam bij GSK |
Geen |
|
Nagtegaal |
Ziekenhuisapotheker Meander Medisch Centrum |
Beroepenveldcommissie Farmakunde Hogeschool Utrecht, onbetaald |
Geen |
Geen |
|
Timmerman |
Staffunctionaris Klinische Fysica & Patiëntveiligheid |
Lid NIVEL expertgroep infuustechnologie - advies maken kennistoets voor verpleegkundigen – onbetaald Lid ondernemingsraad UMC Utrecht - onbetaald |
EMRP Researcher Grant Metrology for Drug Delivery HLT07- REG1 €120,422.88 USPTO Applicaton #: #20160106909 Apparatus for simultaneous multiple medicament administration |
Geen |
|
Kam-Endtz |
Anesthesioloog Haaglanden MC |
Geen |
Geen |
Geen |
|
Middeldorp |
Gynaecoloog-perinatoloog |
Geen |
Geen |
Geen |
|
Moll |
Klinisch verloskundige/research verloskundige in het St. Antoniusziekenhuis in Nieuwegein |
Geen |
Geen |
Geen |
|
Freeman |
Gynaecoloog |
voorzitter multidiciplinaire werkgroep obstetrische anesthesie
|
Mijn promotieonderzoek naar epidurale analgesie en remifentanil is gesubsidieerd door ZonMw. Dit onderzoek is afgerond maar de resultaten zullen gebruikt worden in deze richtlijn |
Geen |
|
Mooij |
Beleidsmedewerker Patiëntenvereniging Nederland |
Vrijwilligerswerk (onbetaald) patiëntenorganisatie CCUVN |
Geen |
Geen |
|
Kaspers |
Kinderarts-neonatoloog, MST Enschede |
Geen |
Geen |
Geen |
|
De Boer |
Beleidsmedewerker richtlijnontwikkeling |
Geen nevenwerkzaamheden |
Geen |
Geen |
|
Lim |
gynaecoloog |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patientenfederatie Nederland in de werkgroep te laten deelnemen. De conceptmodule is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland. Daarnaast is door de Patiëntenfederatie Nederland een achterbanraadpleging verricht, waarvan de uitkomsten zo veel mogelijk meegenomen zijn in de overwegingen van de modules.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze modules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, (2010)), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit inventarisatie van de knelpunten door de commissie van de NVA bleek dat er een noodzaak was voor revisie van deze richtlijnmodules. Tevens zijn tijdens een fysieke knelpunteninventarisatie knelpunten aangedragen door aanpalende stakeholders inclusief patiëntenorganisaties. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroepleden en de adviseur uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Indicatoren over zwangerschap en geboorte zijn reeds onderdeel van de vervaardigde indicatoren bij de zorgstandaard integrale geboortezorg. Derhalve zijn er bij deze modules geen indicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules werden aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
(2009-2018)
|
1 exp Labor, Obstetric/ or exp Delivery, obstetric/ or exp Labor pain/ or exp Analgesia, obstetric/ or (labor or labour or childbirth or birth* or delivery or parturient*).ti,ab. 783275 2 (parenteral adj2 opioid*).ti,ab. 288 3 exp Meperidine/ or (meperidin* or pethidin* or isonipecain or dolsin or dolosal or dolin or perindine or dolantin or dolargan or lidol or lydol or demerol or dolcontral).ti,ab. 8351 4 exp Morphine/ or exp Tramadol/ or (morphin* or morfin* or tramado* or tramal or tradol or trama or tramundin or ultram).ti,ab. 62212 5 1 and (2 or (3 and 4)) 225 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) 367013 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) 1890171 8 limit 5 to (english language and yr="2009 -Current") 56 9 8 and 6 7 10 8 and (7 not 6) 19 |
(na ontdubbeling) 85 |
|
Embase (Elsevier) |
#12 #8 AND #10 NOT #9 53 #11 #8 AND #9 22 #10 ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it 2,058,224 #9 ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT 'conference abstract':it 297,239 #8 (#5 OR #6) AND (english)/lim AND (2009-2018)/py 224 #7 #5 OR #6 830 #6 #1 AND #2 86 #5 #1 AND #3 AND #4 756 #4 'tramadol'/exp OR 'morphine'/exp OR morphin*:ab,ti OR morfin*:ab,ti OR tramado*:ab,ti OR tramal:ab,ti OR tradol:ab,ti OR trama:ab,ti OR tramundin:ab,ti OR ultram:ab,ti 120,585 #3 'pethidine'/exp OR meperidin*:ab,ti OR pethidin*:ab,ti OR isonipecain:ab,ti OR dolsin:ab,ti OR dolosal:ab,ti OR dolin:ab,ti OR perindine:ab,ti OR dolantin:ab,ti OR dolargan:ab,ti OR lidol:ab,ti OR lydol:ab,ti OR demerol:ab,ti OR dolcontral:ab,ti 23,818 #2 (parenteral NEAR/2 opioid*):ab,ti 398 #1 'labor'/exp OR 'obstetric delivery'/exp OR 'labor pain'/exp OR 'obstetric analgesia'/exp OR labor:ab,ti OR labour:ab,ti OR childbirth:ab,ti OR birth*:ab,ti OR delivery:ab,ti OR parturient*:ab,ti 945,112 |
|
|
Cochrane library |
(labor or labour or childbirth or birth* or delivery or parturient*):ti and ((parenteral near/2 opioid*):ti,ab or ((meperidin* or pethidin* or isonipecain or dolsin or dolosal or dolin or perindine or dolantin or dolargan or lidol or lydol or demerol or dolcontral):ti,ab and (morphin* or morfin* or tramado* or tramal or tradol or trama or tramundin or ultram):ti,ab)) Publication Year from 2009 to 2018 |
