PCEA met achtergrondinfusie/ bolus only vs CEI
Uitgangsvraag
Wat is de effectiviteit van patiënt gecontroleerde epidurale analgesie (PCEA) versus continue epidurale infusie (CEI) bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
Aanbeveling
Geef de voorkeur aan PCEA boven CEI voor epidurale pijnbehandeling tijdens de bevalling.
Gebruik bij PCEA een lage concentratie van een lokaal anestheticum vanwege de voordelen ten aanzien van minder motorische blokkade.
Overwegingen
De onderstaande overwegingen gelden in principe voor de gehele patiëntenpopulatie zoals geformuleerd in de uitgangsvraag.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De literatuur beschrijft dezelfde effectieve pijnstilling van PCEA (met of zonder achtergrondinfusie) wanneer deze vergeleken wordt met continue epidurale infusie. Het verwachte voordeel bij patiënt gecontroleerde pijnstilling ten aanzien van de noodzaak tot extra bolustoediening wordt niet in alle studies in dezelfde mate beschreven. Overall lijkt het er op dat PCEA bolus-only met lage concentratie lokaal anestheticum afdoende is en er minder interventies nodig zijn vergeleken met CEI. Bij CEI zou de pompstand idealiter aangepast moeten worden naar gelang de baring vordert. Dit vereist directe betrokkenheid van een anesthesioloog en mogelijk frequente extra bolustoediening.
In enkele studies wordt een geringer verbruik van lokaal anestheticum beschreven wanneer PCEA toegepast wordt (onder andere Vallejo, 2007; Ferrante 1994; Ferrante 1991). Wanneer een lage concentratie lokaal anestheticum gebruikt wordt is er mogelijk minder motorische blokkade bij PCEA dan bij CEI en een grotere kans op mobiliteit tijdens de bevalling. De verwachte positieve obstetrische effecten van meer mobiel zijn, zoals kortere bevallingsduur, minder oxytocinegebruik, minder kunstverlossingen en betere Apgarscores, zijn niet aangetoond (Collis, 1999; Collis, 1994; Bloom, 1998; Vallejo, 2001). Wel wordt het kunnen rondlopen tijdens de ontsluitingsfase over het algemeen zeer gewaardeerd. Met name zelf naar een badkamer lopen om te plassen of af en toe korte stukjes lopen of rechtop zitten op een stoel geeft een gevoel van zelfcontrole en leidt tot een grotere tevredenheid. Voorwaarden voor ambulantie zijn voldoende kracht in de benen (been gestrekt kunnen heffen), voldoende kracht in de rug, intacte propriocepsis, geen orthostatische hypotensie. Zwangeren dienen altijd begeleid te worden tijdens rondlopen, foetale bewaking moet onderbroken kunnen worden of overgezet op telemetrie (Cohen, 2000; Parry, 1998).
Het geven van een aparte epidurale testdosis, met een hoge concentratie lokaal anestheticum (ook lidocaïne) leidt tot een langere duur voordat zwangeren ambulant zijn. Bij een lage oplaaddosis met een lage concentratie lokaal anestheticum kunnen echter zoveel extra top-ups nodig zijn dat het ook langer duurt voordat mobiliteit weer bereikt is. Bolus-only toediening heeft een positief effect op de mobiliteit. Starten met intrathecale toediening met alleen een opioïd of gecombineerd met een lage dosis lokaal anestheticum heeft een positief effect op de mobiliteit.
Waarden en voorkeuren van patiënten
Hoewel beschreven wordt dat zwangeren tevreden zijn met de mogelijkheid om zelf de pijnbehandeling te reguleren, is dit niet duidelijk aangetoond in de literatuuranalyse. Aannemelijk is wel dat een vermindering van de noodzaak voor extra pijnbehandeling door een anesthesioloog bijdraagt aan een groter gevoel van controle en grotere tevredenheid. Saito (2005) beschrijft dat het tijdsinterval tussen het opnieuw ontstaan van pijn en een top up bij CEI langer is dan bij PCEA. Dit kan tot angst en vermeerdering van pijn leiden waardoor nog meer extra lokaal anestheticum nodig is. Ook beschrijven zij dat er in de CEI-groep zwangeren waren die terughoudend waren om een verzoek te doen voor extra bolustoediening door een arts. Curry (1994) beschrijft een placebo-effect van de bolusknop, waarbij de groep met CEI ook een (placebo)bolusknop in handen kreeg. Veel zwangeren hadden de indruk dat deze wel werkte en meldden hierbij een goed effect. Deze studie is in deze uitgangsvraag niet meegenomen omdat er in de oplossing geen opioïd toegevoegd is, maar het is aannemelijk dat deze constatering ook geldt voor oplossingen waar wel opioïd toegevoegd is. Ledin (2003) beschrijft dat bij pijnbehandeling met PCEA adequater individueel getitreerd kan worden. Ook Viscomi (1991) stelt dat de achtergrondinfusie bij PCEA aangepast kan worden aan het aantal cm ontsluiting. Ferrante (1995) zegt dat door de grotere tevredenheid met PCEA minder intense pijnstilling geaccepteerd wordt. Zwangere vrouwen willen al tijdens de zwangerschap informatie over de verschillende vormen van pijnstilling, de voor- en de nadelen en wat dit betekent in hun situatie en willen hierover samen beslissen. Uit de meldactie blijkt dat dit nog onvoldoende in de praktijk gebeurt en vastgelegd wordt. Zie voor wijze van counselen en de vergelijking van de verschillende opties de module ‘Counseling: Samen beslissen‘.
Kosten (middelenbeslag)
Beschreven is dat minder lokaal anestheticum verbruikt wordt wanneer PCEA toegepast wordt. Ook kan bespaard worden op personele kosten wanneer zwangeren zelf de pijnbehandeling kunnen regelen met de mogelijkheid van de PCEA-knop.
Perfusiepompen met alleen continu-infusie mogelijkheid zullen op termijn vervangen moeten worden door pompen met PCA modus.
Aanvaardbaarheid voor de overige relevante stakeholders
Scholing op de verlosafdeling dient plaats te vinden. De mogelijkheid om bij vragen of problemen de hulp van een anesthesioloog in te roepen moet blijven bestaan.
Carvalho (2006) beschrijft dat er terughoudendheid is om PCEA in te voeren vanwege de kosten van nieuwe pompen en bedenkingen over de veiligheid, pompinstellingen en het ongemak van overstappen op een nieuwe techniek. Scholing van de staf wordt geadviseerd.
Haalbaarheid en implementatie
De implementatie van deze methode wordt bepaald door de aanschaf van PCA-perfusiepompen, eventueel vervangen van de oplossing lokaal anestheticum/opioïd, het maken en accorderen van een aangepast protocol, aanpassing van MO’s, scholing aan medewerkers op de verloskamer.
Aanbeveling-1
Rationale/ balans tussen voor- en nadelen van de interventie
De werkgroep is van mening dat PCEA voordelen heeft ten opzichte van CEI, omdat het mogelijk leidt tot minder verbruik van lokaal anestheticum, minder motorische blokkade, er minder interventies door anesthesiologen nodig zijn. Ondanks dat het verschil op tevredenheid onvoldoende met literatuur is onderbouwd, is het aannemelijk dat ook een grotere tevredenheid ervaren wordt door het hebben van meer controle in geval van zelftoedieningen bij de PCEA-techniek.
Aanbeveling-2
Rationale/ balans tussen voor- en nadelen van de interventie
Afhankelijk van de concentratie van het gebruikte lokaal anestheticum zijn de voordelen van PCEA ten opzichte van CEI meer uitgesproken of aannemelijker. Bij gebruik van lage concentraties van een lokaal anestheticum (ropivacaïne ≤ 0,1 % of bupivacaïne ≤ 0,0625%) is door de regelmatige bolustoediening de pijnstilling bij PCEA (eventueel met achtergrondinfusie) voldoende en is er weinig motorische blokkade. Bij CEI zijn vaker top-ups nodig om voldoende pijnstilling te bereiken.
Onderbouwing
Achtergrond
Patiënt gecontroleerde epidurale analgesie tijdens de bevalling werd in 1988 voor het eerst beschreven (Gambling, 1988), met als potentieel voordeel ten opzichte van continue epidurale infusie minder verbruik van lokaal anestheticum en daardoor minder motorisch blok en een minder lange duur van de uitdrijvingsfase. Daarnaast zou door de zelftoediening met behulp van een pomp een grotere tevredenheid bestaan zowel bij de vrouw, die direct extra pijnstilling krijgt wanneer dit nodig is en daarmee controle over de pijnbehandeling heeft, als bij de zorgverlener die zich niet hoeft vrij te maken van andere werkzaamheden voor extra bolustoediening. In Nederland wordt in veel ziekenhuizen nog continue infusie gebruikt. Middels deze uitgangsvraag wordt de effectiviteit van beide technieken met elkaar vergeleken.
Conclusies / Summary of Findings
PCEA bolus only versus CEI
|
Zeer laag GRADE |
Er lijkt geen verschil in de ervaren pijnintensiteit tijdens de baring tussen zwangeren behandeld met PCEA bolus only vergeleken met zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Collis, 1999; Haydon, 2011) |
|
Zeer laag GRADE |
Er lijkt geen verschil in de ervaren tevredenheid ten aanzien van de pijnstilling tijdens de baring tussen zwangeren behandeld met PCEA bolus only vergeleken met zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Collis, 1999;Vallejo, 2007; hoge concentratie: Boutros, 1999) |
|
Laag GRADE |
Er zijn voorzichtige aanwijzingen dat het gebruik van aanvullende pijnmedicatie (bolussen) lager is bij zwangeren behandeld met PCEA bolus only vergeleken met zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Collis, 1999; Haydon, 2011b; Ledin, 2003; hoge concentratie: Boutros, 1999) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op een vaginale kunstverlossing of sectio caesarea tussen zwangeren behandeld met PCEA bolus only en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Collis, 1999; Haydon, 2011b; Ledin, 2003; Smedvig, 2001; Vallejo, 2007a; hoge concentratie: Boutros, 1999; Ferrante, 1991; Ferrante, 1994) |
|
Laag GRADE |
Er lijkt geen verschil in de bevallingsduur tussen zwangeren behandeld met PCEA bolus only en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Collis, 1999; Haydon, 2011b; Vallejo, 2007a; hoge concentratie: Boutros, 1999; Ferrante, 1991; Ferrante, 1994) |
|
Zeer laag GRADE |
Het is onduidelijk of het risico op motorisch blok verschilt tussen zwangeren behandeld met PCEA bolus only vergeleken met zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Ledin, 2003; hoge concentratie: Boutros, 1999) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op een Apgarscore < 7 bij 5 minuten tussen de neonaten van zwangeren behandeld met PCEA bolus only en neonaten van zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Collis, 1999; Ledin, 2003; hoge concentratie: Boutros, 1999) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op hypotensie tussen zwangeren behandeld met PCEA bolus only en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Ledin, 2003; hoge concentratie: Boutros, 1999; Ferrante, 1991) |
|
Laag GRADE |
Er lijkt geen verschil in de pH. a. umbilicalis tussen zwangeren behandeld met PCEA bolus only en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Collis, 1999; Ledin, 2003) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op jeuk tussen zwangeren behandeld met PCEA bolus only en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Ledin, 2003; hoge concentratie: Boutros, 1999; Ferrante, 1991) |
PCEA + achtergrondinfusie versus CEI
|
Zeer laag GRADE |
Er lijkt geen verschil in de ervaren pijnintensiteit tijdens de baring tussen zwangeren behandeld met PCEA + achtergrondinfusie vergeleken met zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Haydon, 2011) |
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in de ervaren tevredenheid ten aanzien van de pijnstilling tussen zwangeren behandeld met PCEA + achtergrondinfusie vergeleken met zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Haydon, 2011; Saito, 2005; Vallejo, 2007) |
|
Laag GRADE |
Het gebruik van aanvullende pijnmedicatie (bolussen) lijkt lager bij zwangeren behandeld met PCEA + achtergrondinfusie vergeleken met CEI. Dit verschil lijkt met name waar te nemen bij gebruik van hoge concentraties (>0,1% ropivacaïne/ >0,0625 bupivacaïne).
Bronnen: (lage concentratie: Haydon, 2011a; hoge concentratie: Viscomi, 1991) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op een vaginale kunstverlossing tussen zwangeren behandeld met PCEA + achtergrondinfusie en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Chen, 2014a; Haydon, 2011a; Saito, 2005; Vallejo, 2007b; hoge concentratie: Ferrante, 1994; Viscomi, 1991; Chen, 2014b) |
|
Laag GRADE |
Er zijn voorzichtige aanwijzingen dat het risico op een sectio caesarea lager is bij zwangeren behandeld met PCEA + achtergrondinfusie vergeleken met CEI. Dit verschil werd voornamelijk waargenomen bij hoge concentraties.
Bronnen: (lage concentratie: Chen, 2014a; Haydon, 2011a; Vallejo, 2007b; hoge concentratie: Ferrante, 1994; Viscomi, 1991; Chen, 2014b) |
|
Laag GRADE |
Er lijkt geen verschil in de bevallingsduur tussen zwangeren behandeld met PCEA + achtergrondinfusie en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Haydon, 2011a) |
|
Laag GRADE |
Er zijn voorzichtige aanwijzingen dat het risico op motorisch blok lager is bij zwangeren behandeld met PCEA + achtergrondinfusie vergeleken met zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Chen, 2014a; hoge concentratie Chen, 2014b) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op hypotensie tussen zwangeren behandeld met PCEA + achtergrondinfusie en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Saito, 2005; hoge concentratie: Viscomi, 1991) |
|
Zeer laag GRADE |
Er zijn zeer voorzichtige aanwijzingen dat het risico op urine retentie lager is bij zwangeren behandeld met PCEA + achtergrondinfusie vergeleken met CEI.
Bronnen: (lage concentratie: Chen, 2014a; hoge concentratie Chen, 2014b) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op misselijkheid tussen zwangeren behandeld met PCEA + achtergrondinfusie en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Chen, 2014a; Saito, 2005; hoge concentratie Chen, 2014b) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op jeuk tussen zwangeren behandeld met PCEA + achtergrondinfusie en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Chen, 2014a; Saito, 2005; hoge concentratie Chen, 2014b) |
|
Laag GRADE |
Er lijkt geen verschil in de pH. a. umbilicalis tussen neonaten van zwangeren behandeld met PCEA + achtergrondinfusie en zwangeren behandeld met CEI.
Bronnen: (lage concentratie: Saito, 2005) |
Samenvatting literatuur
PCEA zonder achtergrondinfusie (bolus only) versus CEI
Zeven RCT’s werden geïncludeerd waarin PCEA bolus only werd vergeleken met CEI. De studies includeerden gezonde zwangeren met een ongecompliceerde zwangerschap a terme en een eenling zwangerschap in vertex presentatie. Van de geïncludeerde studies gaven vijf studies (Collis, 1999; Haydon, 2011; Ledin, 2003; Smedvig, 2001; Vallejo, 2007) een concentratie lokaal anestheticum ≤ 0,1% ropivacaïne / ≤ 0,0625 bupivacaine (oftewel lage concentratie) en twee studies een concentratie lokaal anestheticum > 0,1% ropivacaïne / > 0,0625% (oftewel hoge concentratie) (Boutros, 1999; Ferrante, 1991; Ferrante, 1994). Waar mogelijk werden de resultaten gestratificeerd beschreven volgens deze categorieën in lage/ hoge concentratie.
Resultaten
Pijnintensiteit
Pijnintensiteit werd in acht studies gemeten (lage concentratie: Collis, 1999; Haydon, 2011; Ledin, 2003; Smedvig, 2001; Vallejo, 2007; hoge concentratie: Boutros, 1999; Ferrante, 1991; Ferrante, 1994) middels een VAS-pijnscore (0 tot 10/ 0 tot 100 schaal) of een VRS-schaal (verbal rating score van de NRS). In de studies van Ledin (2003), Smedvig (2001), Vallejo (2007), Boutros (1999), Ferrante (1991) en Ferrante (1994) werden de resultaten gepresenteerd in figuren waardoor het niet mogelijk was de data te extraheren. Echter, in al deze studies was geen sprake van een significant verschil in pijnintensiteit tussen de groepen. De RCT van Collis (1999) rapporteerde het aantal keren dat zwangeren ‘milde pijn’ hadden, welke ieder uur werd gemeten middels een VRS-schaal (verbal rating score van de NRS). Een score 0 tot 3 werd gedefinieerd als ‘milde pijn’. Er werd geen significant verschil waargenomen tussen de groepen (PCEA bolus only: 207/248; CEI 184/206 events ‘milde pijn’) met een relatief risico van RR: 0,93; 95% BI 0,87 tot 1,01. De studie van Haydon (2011) rapporteerde de mediane VRS-pijnscore (verbal rating score van de NRS), welke werd gemeten op een schaal van 0= geen pijn tot 10= meest erge pijn. Ook in deze studie werd geen significant verschil in pijnintensiteit tussen de groepen waargenomen (mediaan; range: 0; 0 tot 5 PCEA bolus only groep; 0; 0 tot 4 CEI-groep). Vanwege het beperkte aantal studies met bruikbare data was het niet mogelijk deze uitkomstmaat te stratificeren naar lage/ hoge concentratie.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijnintensiteit is met drie niveau’s verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten/ beperkt aantal studies met bruikbare data (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Tevredenheid ten aanzien van pijnstilling
Tevredenheid ten aanzien van de pijnstilling werd gemeten in vijf studies (lage concentratie: Collis, 1999; Haydon, 2011; Ledin, 2003; Vallejo, 2007; hoge concentratie: Boutros, 1999) middels een tevredenheidsschaal (0 tot 100 schaal) of een VRS-schaal (verbal rating score van de NRS) (excellent/goed/matig/slecht). In de studie van Ledin (2003) werden de resultaten gepresenteerd in figuren waardoor het niet mogelijk was de data te extraheren. In de studie van Haydon (2011) werden enkel de medianen zonder spreidingsmaat gerapporteerd. De studie beschrijft dat er geen significante verschillen tussen de groepen werden waargenomen. Collis (1999) rapporteerde de mediane tevredenheidsscore op een VAS-schaal 0 tot 100 mm (0= meest tevreden, 100= meest ontevreden). Er werden geen significante verschillen tussen de groepen waargenomen (mediaan; range: 4; 2 tot 15 PCEA bolus only groep; 3; 1 tot 8 CEI-groep). Vallejo (2007) rapporteerde de tevredenheid op een 0 tot 100 schaal waarbij hoge scores een hogere tevredenheid reflecteren. Ook in deze studie werd geen significant verschil tussen de groepen waargenomen (mediaan; range: 100; 50 tot 100 PCEA bolus only groep; 100; 50 tot 100 CEI-groep). De studie van Boutros (1999) rapporteerde de tevredenheid op een schaal van 0 tot 10, waarbij eveneens geen significant verschil tussen de groepen werd waargenomen (gemiddeld verschil: -0,20; 95% BI -0,54 tot 0,14). Vanwege het beperkte aantal studies met bruikbare data was het niet mogelijk deze uitkomstmaat te stratificeren naar lage/ hoge concentratie.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat tevredenheid ten aanzien van pijnstilling is met drie niveau’s verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten/ beperkt aantal studies met bruikbare data (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Aanvullende pijnmedicatie
Vier RCT’s rapporteerden het aantal patiënten dat additionele bolussen pijnstilling nodig had (lage concentratie: Collis, 1999; Haydon, 2011b; Ledin, 2003; hoge concentratie: Boutros, 1999). De studies van Ferrante (1991), Ferrante (1994) en Smedvig (2001) rapporteerden niet het aantal events per groep, maar beschreven in de publicatie dat er geen significante verschillen werden waargenomen tussen de groepen. De studie van Vallejo (2007) rapporteerde het mediane aantal ‘staff-interventions’ waardoor resultaten niet konden worden gepoold. Er werd een significant hoger aantal gebruik van additionele bolussen waargenomen in de CEI-groep versus de PCEA bolus only groep na stratificatie in de hoge concentratie categorie (RR: 0,62; 95% BI 0,40 tot 0,98). De verschillen in gebruik van additionele bolussen in de lage concentratie studies lijken eenzelfde trend te laten zien, echter, niet significant. Het overall gepoolde effect was significant in het voordeel van de PCEA bolus only groep (RR: 0,62; 95% BI 0,40 tot 0,98). Er was sprake van matige heterogeniteit (28%).
Figuur 1 Aanvullende pijnmedicatie
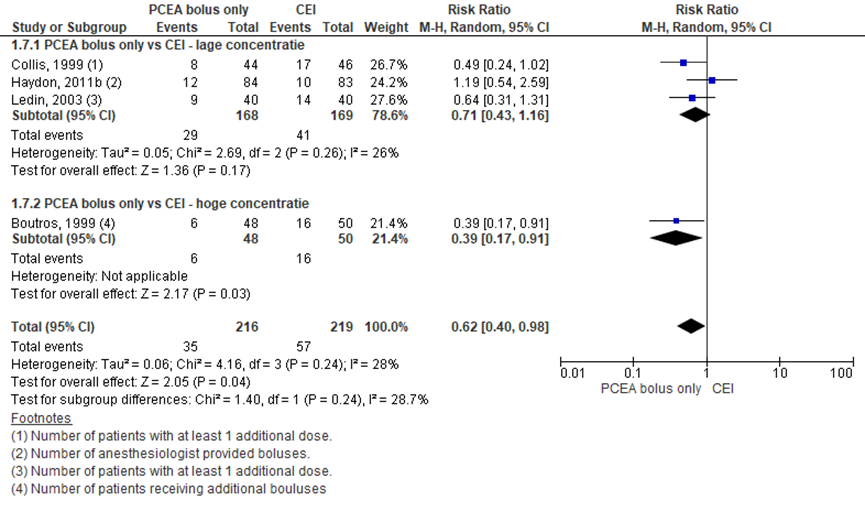
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aanvullende pijnmedicatie is met twee niveau’s verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias), het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Modus partus - vaginale kunstverlossing
Acht RCT’s rapporteerden het aantal vaginale kunstverlossingen (lage concentratie: Collis, 1999; Haydon, 2011b; Ledin, 2003; Smedvig, 2001; Vallejo, 2007a; hoge concentratie: Boutros, 1999; Ferrante, 1991; Ferrante, 1994). Vaginale kunstverlossing werd gedefinieerd als instrumentele/ forceps/ vacuüm bevalling. Er werd geen significant verschil waargenomen in het risico op een vaginale kunstverlossing tussen zwangeren behandeld met PCEA bolus only in vergelijking tot CEI (overall RR: 0,94; 95% BI 0,70 tot 1,25). Er werden tevens geen verschillen waargenomen indien gestratificeerd werd naar concentratie hoog versus laag. Er was geen sprake van heterogeniteit.
Figuur 2 Modus partus - vaginale kunstverlossing
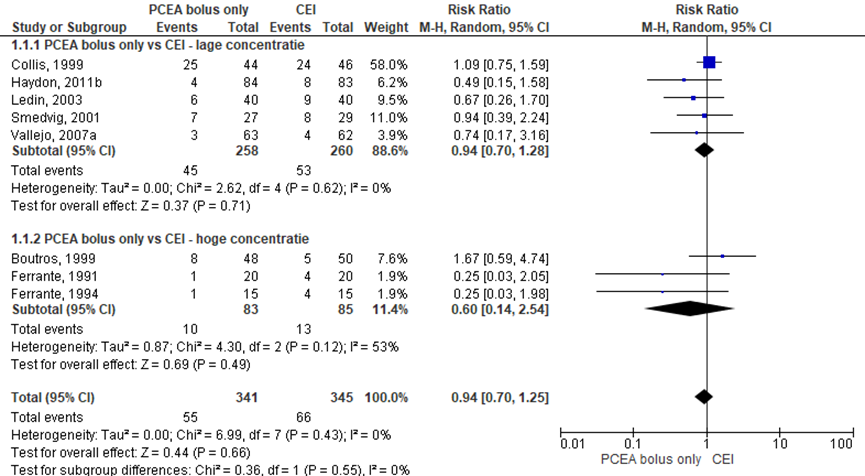
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vaginale kunstverlossing is met twee niveau’s verlaagd vanwege het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Modus partus - sectio caesarea
Acht RCT’s rapporteerden het aantal sectio caesarea (lage concentratie: Collis, 1999; Haydon, 2011b; Ledin, 2003; Smedvig, 2001; Vallejo, 2007a; hoge concentratie: Boutros, 1999; Ferrante, 1991; Ferrante, 1994). Er werd geen significant verschil waargenomen in het risico op een sectio caesarea tussen zwangeren behandeld met PCEA bolus only in vergelijking tot CEI (overall RR: 0,81; 95% BI 0,57 tot 1,15). Er werden tevens geen verschillen waargenomen indien gestratificeerd werd naar concentratie hoog versus laag. Er was geen sprake van heterogeniteit.
Figuur 3 Modus partus - sectio caesarea
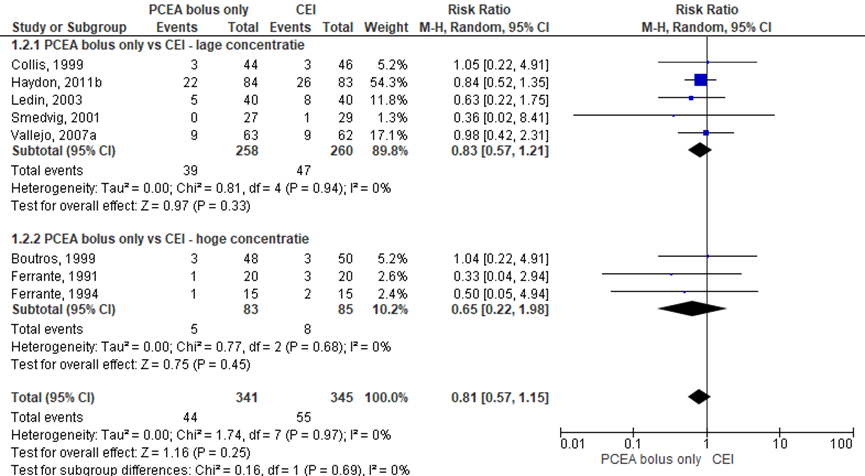
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat sectio caesarea is met twee niveau’s verlaagd vanwege het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Bevallingsduur
Ontsluitingsfase/ uitdrijvingsfase
Drie RCT’s rapporteerden de duur van de ontsluitingsfase en uitdrijvingsfase (lage concentratie: Vallejo, 2007a; hoge concentratie: Ferrante, 1991; Ferrante, 1994). Er werd geen significant verschil waargenomen in zowel de duur van de ontsluitings- als uitdrijvingsfase (gemiddeld verschil ontsluitingsfase: -11,63 minuten; 95% BI -69,28 tot 46,02 minuten; uitdrijvingsfase: -3,0138 minuten; 95% BI -15,73 tot 9,71). Er werden tevens geen verschillen waargenomen indien gestratificeerd werd naar concentratie hoog versus laag. Er was sprake van geen tot matige heterogeniteit (I2 0 tot 42%).
Figuur 4 Bevallingsduur - ontsluitingsfase (minuten)
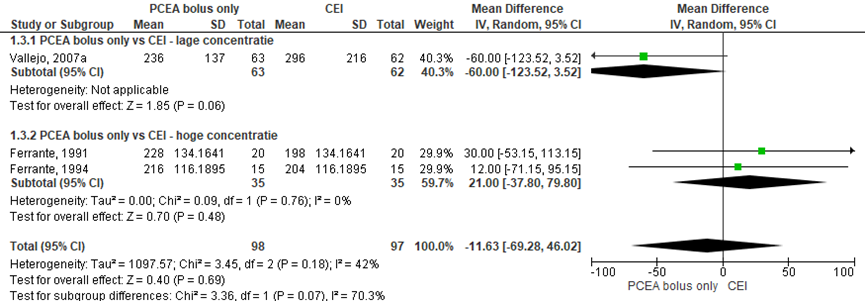
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 5 Bevallingsduur - uitdrijvingsfase (minuten)
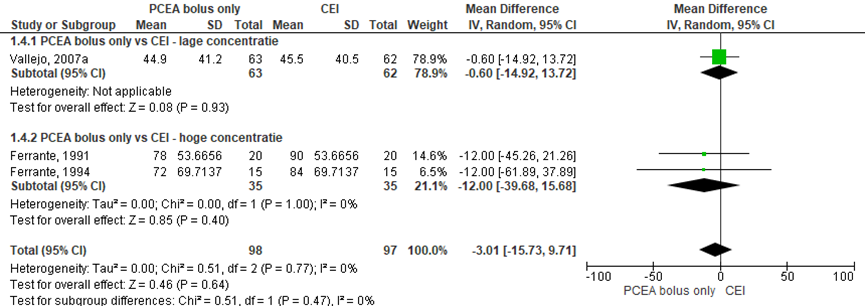
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Totale bevalling
Drie RCT’s rapporteerden de duur van de totale bevalling (lage concentratie: Collis, 1999; Haydon, 2011b; hoge concentratie: Boutros, 1999). Er werd geen significant verschil waargenomen in de totale bevallingsduur (gemiddeld verschil: 23,59 minuten; 95% BI –17,31 tot 64,50 minuten). Er werden tevens geen verschillen waargenomen indien gestratificeerd werd naar concentratie hoog versus laag. Er was sprake van matige heterogeniteit (I2 30%).
Figuur 6 Bevallingsduur - totale bevallinsgduur
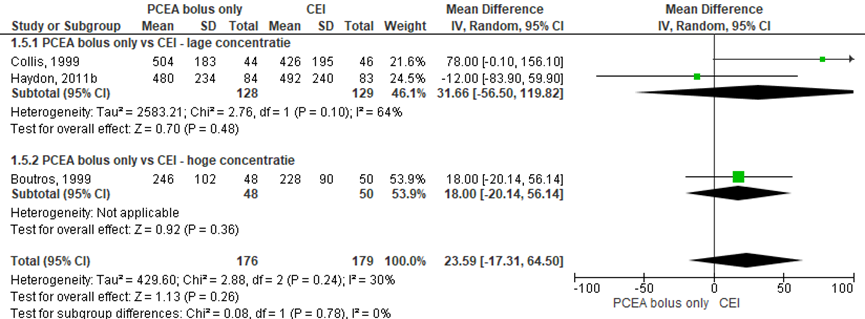
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bevallingsduur is met twee niveau’s verlaagd vanwege het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Motorisch blok
Motorisch blok werd gemeten in zeven studies (lage concentratie: Collis, 1999; Ledin, 2003; Smedvig, 2001; Vallejo, 2007; hoge concentratie: Boutros, 1999; Ferrante, 1991; Ferrante, 1994) an de hand van diverse schalen of afkapwaarden. In de studies van Collis (1999), Ferrante (1991) en Ferrante (1994) werden de resultaten gepresenteerd in figuren waardoor het niet mogelijk was de data te extraheren. De studies van Smedvig (2001) en Vallejo (2007) rapporteerden dat er geen sprake was van motorisch blok bij de zwangeren geïncludeerd in de studies. De studie van Boutros (1999) rapporteerde de incidentie van motorisch blok, gemeten volgens een gemodificeerde Bromage-schaal (0= afwezigheid motorisch blok; 3= onmogelijkheid flexie knie en enkels). Ledin (2003) rapporteerde het aantal zwangeren waarbij er sporadisch of gedurende de gehele bevalling sprake was van een verminderde bewegingsmogelijkheid. Deze studies zijn gepoold weergegeven in onderstaand figuur. Er werd geen significant verschil tussen de groepen waargenomen (RR: 0,53; 95% BI 0,24 tot 1,15). Er was geen sprake van heterogeniteit.
Figuur 7 Motorisch blok
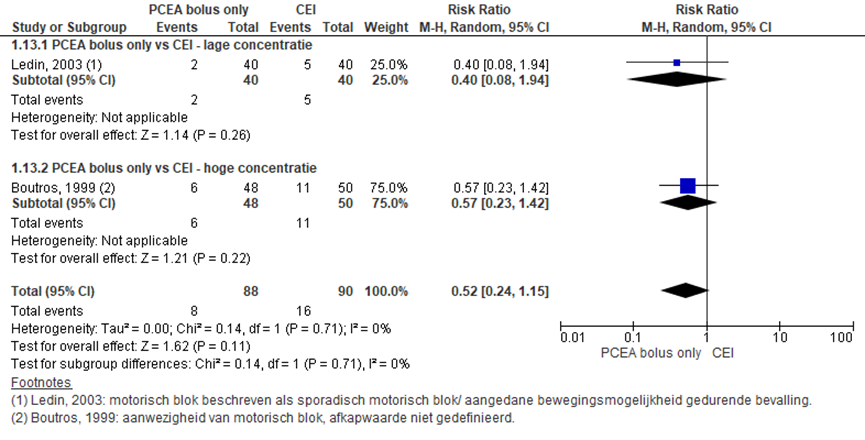
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat motorisch blok is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten/ beperkt aantal studies met bruikbare data (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Apgarscore < 7 bij 5 minuten
Drie RCT’s rapporteerden het aantal neonaten met een Apgarscore < 7 bij 5 minuten (lage concentratie: Collis, 1999; Ledin, 2003; hoge concentratie: Boutros, 1999). Deze uitkomstmaat kwam weinig voor (n=4 PCEA bolus only en n=0 CEI groep). Er werd geen significant verschil waargenomen in het risico op een Apgarscore < 7 bij 5 minuten tussen zwangeren behandeld met PCEA bolus only in vergelijking tot CEI (overall RR: 2,70; 95% BI 0,50 tot 14,68). Er werden tevens geen verschillen waargenomen indien gestratificeerd werd naar concentratie hoog versus laag. Er was geen sprake van heterogeniteit.
Figuur 8 Apgarscore < 7 bij 5 minuten
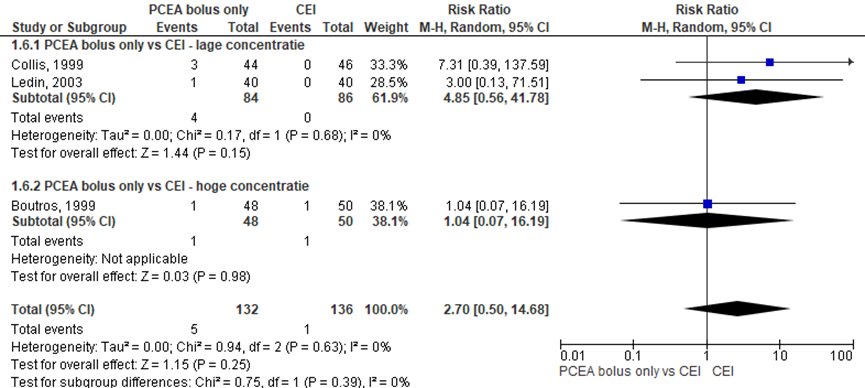
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Apgarscore < 7 bij 5 minuten is met twee niveau’s verlaagd vanwege het geringe aantal patiënten/ events en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Hypotensie
Drie RCT’s rapporteerden het aantal patiënten met hypotensie (lage concentratie: Ledin, 2003; hoge concentratie: Boutros, 1999; Ferrante, 1991). De studie van Ferrante (1994) rapporteerde niet het aantal events per groep, maar beschreef in de publicatie dat er geen significante verschillen werden waargenomen tussen de groepen. Deze uitkomstmaat kwam weinig voor (n=1 PCEA bolus only en n=3 CEI). Er werd geen significant verschil waargenomen in het risico op hypotensie tussen zwangeren behandeld met PCEA bolus only in vergelijking tot CEI (overall RR: 0,44; 95% BI 0,07 tot 2,96). Er werden tevens geen verschillen waargenomen indien gestratificeerd werd naar concentratie hoog versus laag. Er was geen sprake van heterogeniteit.
Figuur 9 Hypotensie
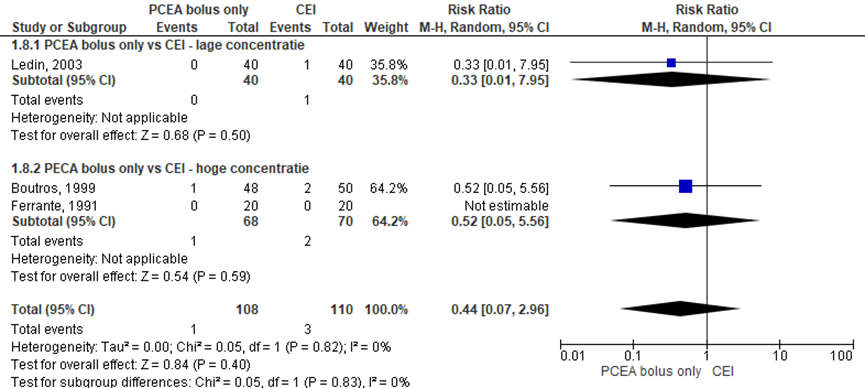
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat hypotensie is met twee niveau’s verlaagd vanwege het geringe aantal patiënten/ events en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
pH. a. umbilicalis
Twee RCT’s rapporteerden de gemiddelde pH. a. umbilicalis (lage concentratie: Collis, 1999; Ledin, 2003). Studies in de hoge concentratie categorie rapporteerden deze uitkomstmaat niet. Er werd geen significant verschil waargenomen in de pH. a. umbilicalis tussen zwangeren behandeld met PCEA bolus only in vergelijking tot CEI (gemiddeld verschil: -0,03; 95% BI -0,07 tot 0,01). Er was sprake heterogeniteit (I2= 49%).
Figuur 10 pH. a. umbilicalis
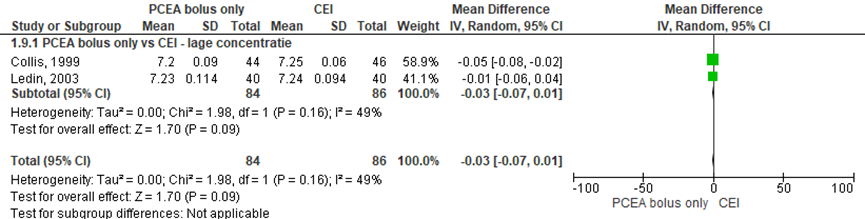
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat hypotensie is met twee niveau’s verlaagd vanwege het geringe aantal patiënten/ events (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Jeuk
Drie RCT’s rapporteerden het aantal zwangeren met klachten van jeuk (lage concentratie: Ledin, 2003; hoge concentratie: Boutros, 1999; Ferrante, 1991). Er werd geen significant verschil waargenomen in het aantal jeukklachten tussen zwangeren behandeld met PCEA bolus only in vergelijking tot CEI (overall RR: 1,13; 95% BI 0,72 tot 1,79). Er was sprake van heterogeniteit (I2 9%).
Figuur 11 Jeuk
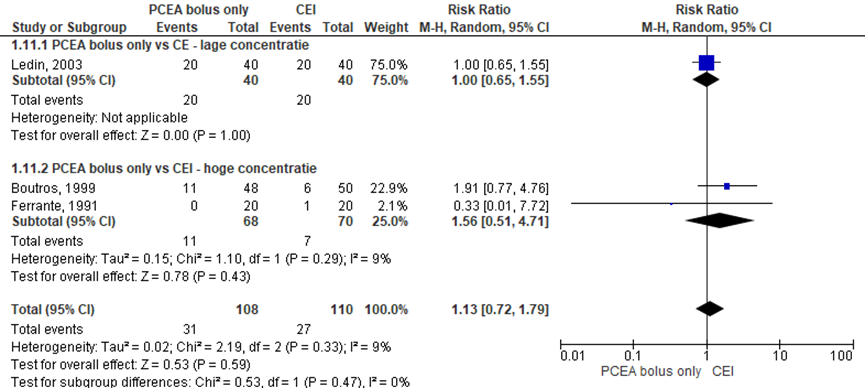
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat jeuk is met twee niveau’s verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias), het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
PCEA met achtergrondinfusie versus CEI
Beschrijving studies
Zes RCT’s werden geïncludeerd waarbij onderzoek werd gedaan naar PCEA + achtergrondinfusie versus CEI. Hiervan viel één studie (Chen, 2014) zowel in de lage concentratie categorie (1 studie-arm ontving ≤ 0,1% ropivacaïne) als in de hoge concentratie categorie (1 studie-arm ontving > 0,0625 bupivacaïne). Daarnaast vielen drie studies (Haydon, 2011; Vallejo, 2007; Saito, 2005) in de lage concentratie categorie (dat wil zeggen ≤ 0,1% ropivacaïne/ ≤ 0,0625 bupivacaïne) en twee studies (Ferrante, 1994; Viscomi, 1991) in de hoge concentratie categorie (dat wil zeggen > 0,1% ropivacaïne/ >0 ,0625 bupivacaïne). Waar mogelijk werden de resultaten gestratificeerd beschreven naar lage/ hoge concentratie. De studies includeerden gezonde zwangeren met een ongecompliceerde zwangerschap a terme en een eenling zwangerschap in vertex presentatie.
Resultaten
Pijnintensiteit
Pijnintensiteit werd in drie studies gemeten (lage concentratie: Haydon, 2011; Vallejo, 2007; hoge concentratie: Ferrante, 1994) middels een VAS-pijnscore of een VRS-schaal (verbal rating score van de NRS). In de studies van Vallejo (2007) en Ferrante (1994) werden de resultaten gepresenteerd in figuren waardoor het niet mogelijk was de data te extraheren. Echter, in al deze studies was geen sprake van een significant verschil in pijnintensiteit tussen de groepen. De studie van Haydon (2011) rapporteerde de mediane VRS-pijnscore (verbal rating score van de NRS), welke werd gemeten op een schaal van 0= geen pijn tot 10= meest erge pijn. Ook in deze studie werd geen significant verschil in pijnintensiteit tussen de groepen waargenomen (mediaan; range: 0; 0 tot 5 PCEA + achtergrondinfusie groep; 0; 0 tot 4 CEI groep). Vanwege het beperkte aantal studies met bruikbare data was het niet mogelijk deze uitkomstmaat te stratificeren naar lage/ hoge concentratie.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijnintensiteit is met drie niveau’s verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten/ beperkt aantal studies met bruikbare data (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Tevredenheid ten aanzien van pijnstilling
Tevredenheid ten aanzien van de pijnstilling werd gemeten in drie studies (lage concentratie: Haydon, 2011; Saito, 2005; Vallejo, 2007) middels een tevredenheidsschaal (VAS of VRS-schaal (verbal rating score van de NRS)). In de studie van Haydon (2011) werden enkel de medianen zonder spreidingsmaat gerapporteerd. De studie beschrijft dat er geen significante verschillen tussen de groepen werden waargenomen. De studie van Saito (2005) beschrijft dat alle zwangeren in de PCEA + achtergrondinfusie groep een VAS-score > 81mm hadden, terwijl in de CEI-groep 24% een VAS-score <70mm en 14% < 50 mm werd waargenomen. Hogere scores reflecteren in deze studie een betere tevredenheid. Vallejo (2007) rapporteerde de tevredenheid op een 0 tot 100 schaal waarbij hoge scores een hogere tevredenheid reflecteren. In deze studie werd geen significant verschil tussen de groepen waargenomen (mediaan; range: 100; 30 tot 100 PCEA + achtergrondinfusie-groep; 100; 50 tot 100 CEI-groep). Vanwege het beperkte aantal studies met bruikbare data was het niet mogelijk deze uitkomstmaat te stratificeren naar lage/ hoge concentratie.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat tevredenheid ten aanzien van pijnstilling is met drie niveau’s verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten/ beperkt aantal studies met bruikbare data (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Aanvullende pijnmedicatie
Twee RCT’s rapporteerden het aantal patiënten dat additionele bolussen pijnstilling nodig had (lage concentratie: Haydon, 2011a; hoge concentratie: Viscomi, 1991). De studies van Ferrante (1994) en Saito (2005) rapporteerden niet het aantal events per groep, maar beschreven in de publicatie dat er geen significante verschillen werden waargenomen tussen de groepen. Het overall gepoolde effect was significant (RR: 0,32; 95% BI 0,16 tot 0,65) waarbij significant meer zwangeren in de CEI-groep additionele bolussen nodig hadden vergeleken met PCEA + achtergrondinfusie. Er was sprake van een lage mate van heterogeniteit (8%). Stratificatie naar concentratie toont dat dit verschil in gebruik additionele bolussen met name waar te nemen is bij de hoge concentratie groep (RR: 0,23; 95% BI 0,09 tot 0,57). De verschillen in gebruik van additionele bolussen in de studie met lage concentratie laat eenzelfde trend zien maar deze resultaten zijn niet significant (RR 0,48; 95% BI 0,17 tot 1,34).
Figuur 12 Aanvullende pijnmedicatie
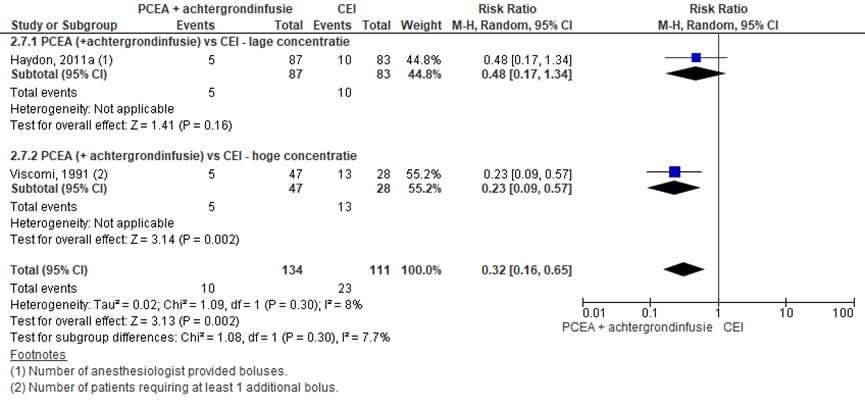
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aanvullende pijnmedicatie is met twee niveau’s verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias), het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Modus partus: vaginale kunstverlossing
Zes RCT’s rapporteerden het aantal vaginale kunstverlossingen (lage concentratie: Chen, 2014a; Haydon, 2011a; Saito, 2005; Vallejo, 2007b; hoge concentratie: Ferrante, 1994; Viscomi, 1991; Chen, 2014b). Vaginale kunstverlossing werd gedefinieerd als instrumentele/ forceps/ vacuüm bevalling. Er werd geen significant verschil waargenomen in het risico op een vaginale kunstverlossing tussen zwangeren behandeld met PCEA + achtergrondinfusie in vergelijking tot CEI (overall RR: 0,94; 95% BI 0,72 tot 1,23). Er werden tevens geen significante verschillen waargenomen indien gestratificeerd werd naar concentratie hoog versus laag. Er was geen sprake van heterogeniteit.
Figuur 13 Vaginale kunstverlossing
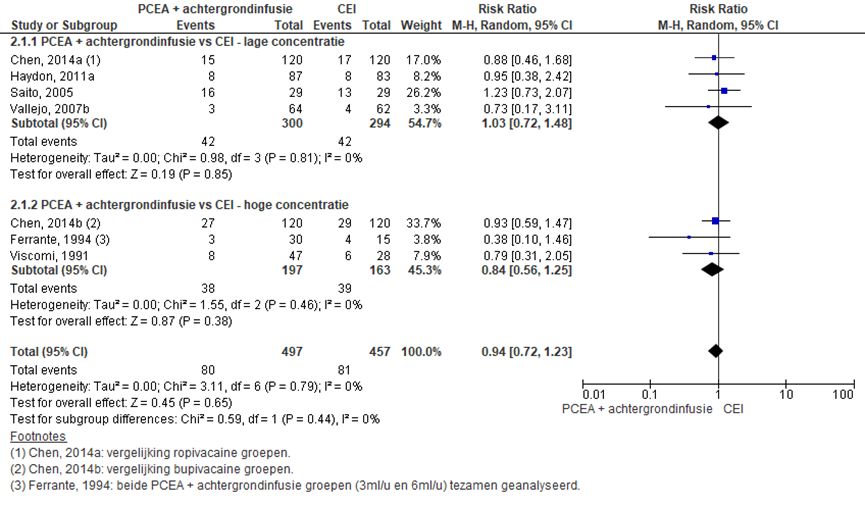
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vaginale kunstverlossing is met twee niveau’s verlaagd vanwege het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Modus partus: sectio caesarea
Zes RCT’s rapporteerden het aantal sectio caesarea (lage concentratie: Chen, 2014a; Ferrante, 1995; Haydon, 2011a; Vallejo, 2007b; hoge concentratie: Ferrante, 1994; Viscomi, 1991; Chen, 2014b). Het overall gepoolde effect was significant in het voordeel van de PCEA + achtergrondinfusie-groep, waarbij er minder sectio’s werden gedaan in de PCEA + achtergrondinfusie-groep (overall RR: 0,70; 95% BI 0,54 tot 0,91). Na stratificatie naar concentratie bleef het significante verschil enkel aanwezig in de hoge concentratie categorie (RR: 0,63; 95% BI 0,41 tot 0,95), maar een trend in dezelfde richting, ten faveure van de PCEA + achtergrondinfusie, werd waargenomen voor de lage concentratie subgroep (RR: 0,75; 95% BI 0,54 tot 1,04) Er was geen sprake van heterogeniteit.
Figuur 14 Sectio caesarea
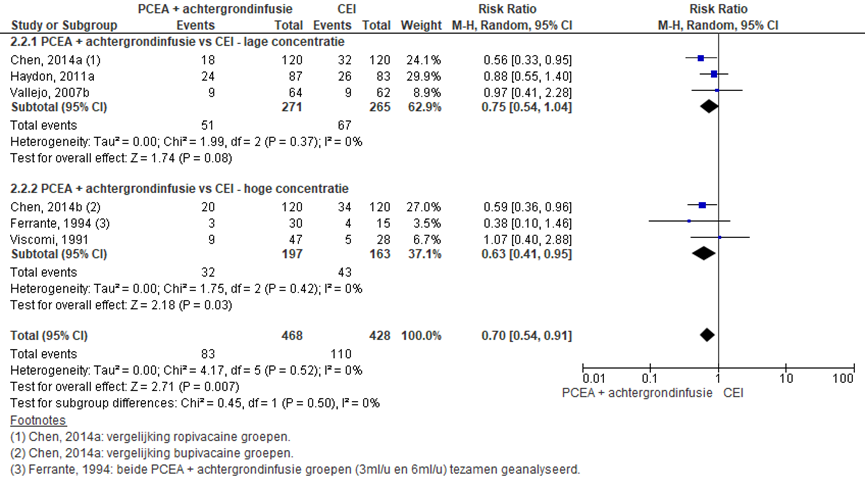
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat sectio caesarea is met twee niveau’s verlaagd het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Bevallingsduur
Ontsluitingsfase/ uitdrijvingsfase
Drie RCT’s rapporteerden de duur van de ontsluitingsfase en uitdrijvingsfase (lage concentratie: Saito, 2005; Vallejo, 2007b; hoge concentratie: Ferrante, 1994). Er werd geen significant verschil waargenomen in zowel de duur van de ontsluitings- als uitdrijvingsfase (gemiddeld verschil ontsluitingsfase: -21,78 minuten; 95% BI -69,58 tot 26,02 minuten; uitdrijvingsfase: 10,82 minuten; 95% BI -7,04 tot 28,69). Er werden tevens geen verschillen waargenomen indien gestratificeerd werd naar concentratie hoog versus laag. Er was sprake van lage tot matige heterogeniteit (I2 13 tot 32%).
Figuur 15 Bevallingsduur ontsluitingsfase (minuten)
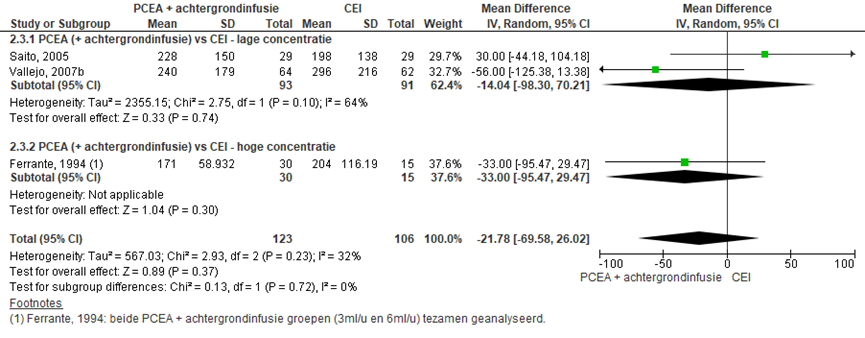
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 16 Bevallingsduur uitdrijvingsfase (minuten)
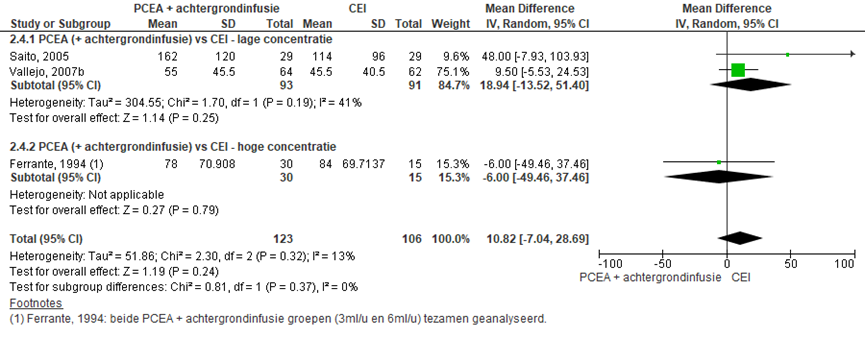
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Totale bevallingsduur
Twee RCT’s rapporteerden de duur van de totale bevalling (lage concentratie: Ferrante, 1995; Haydon, 2011a). Er werd geen significant verschil waargenomen in de totale bevallingsduur (gemiddeld verschil: 12,01 minuten; 95% BI -40,60 tot 64,61 minuten). Gezien het ontbreken van hoge concentratie studies, werden de data niet gestratificeerd. Er was geen sprake van heterogeniteit.
Figuur 17 Totale bevallingsduur
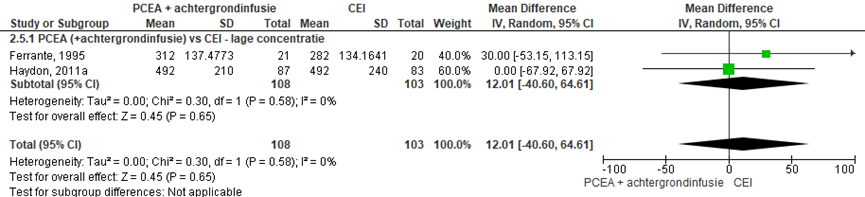
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bevallingsduur is met twee niveau’s verlaagd vanwege het geringe aantal patiënten en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Motorisch blok
Één RCT rapporteerde het aantal zwangeren met motorisch blok (Chen, 2014). De studie van Ferrante (1994) rapporteerde resultaten enkel in een figuur waardoor het niet mogelijk was data te extraheren. In de studie van Chen (2014) werden de ropvicaine groepen en bupivacaïne groepen apart vergeleken. Motorisch blok werd gemeten volgens een Bromage schaal. Het aantal zwangeren met motorisch blok was significant lager in de PCEA + achtergrondinfusie-groep in vergelijking tot de CEI groep (RR: 0,38; 95% BI 0,18 tot 0,79). Dit effect was in zowel de hoge als lage concentratie subgroepen gelijk.
Figuur 18 Motorisch blok
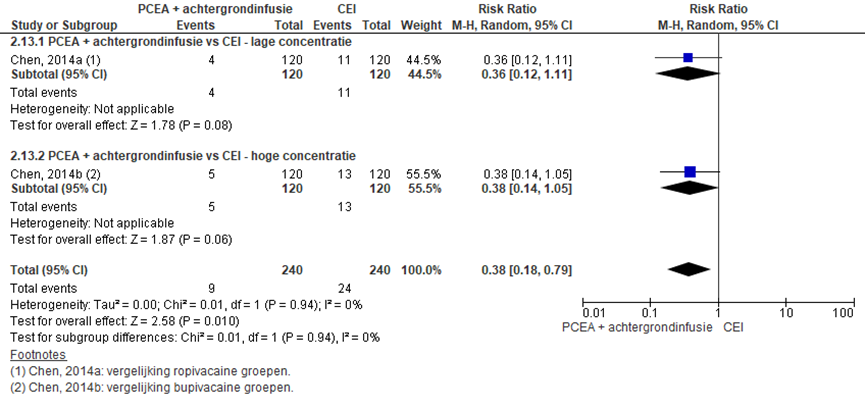
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat motorisch blok is met twee niveau’s verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Hypotensie
Twee RCT’s rapporteerden het aantal zwangeren met hypotensie (lage concentratie: Saito, 2005; hoge concentratie: Viscomi, 1991). In de studie van Saito (2005) kwamen geen events van hypotensie voor in beide groepen. In de studie van Viscomi (1991) werd geen significant verschil waargenomen in het risico op hypotensie tussen zwangeren behandeld met PCEA + achtergrondinfusie in vergelijking tot CEI (overall RR: 1,19; 95% BI 0,11 tot 12,55).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat hypotensie is met twee niveau’s verlaagd vanwege het geringe aantal patiënten/ RCT’s en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Urine retentie
Één RCT rapporteerde het aantal zwangeren met urineretentie (lage concentratie: Chen, 2014a en hoge concentratie: Chen, 2014b). In deze studie werden de ropivacaïne groepen en bupivacaïne groepen onderling vergeleken. Urine retentie kwam significant vaker voor in de CEI-groep (n=35/240) in vergelijking tot de PCEA + achtergrondinfusie-groep (n=18/240) (RR: 0,52; 95% BI 0,30 tot 0,89). Wanneer gestratificeerd wordt naar hoge of lage concentratie, lijkt het effect voornamelijk waar te nemen in de lage concentratie groepen (RR: 0,44; 95% BI 0,20 tot 0,98). Echter, in beide subgroepen wordt eenzelfde trend waargenomen ondanks lage studie aantallen.
Figuur 19 Urine retentie
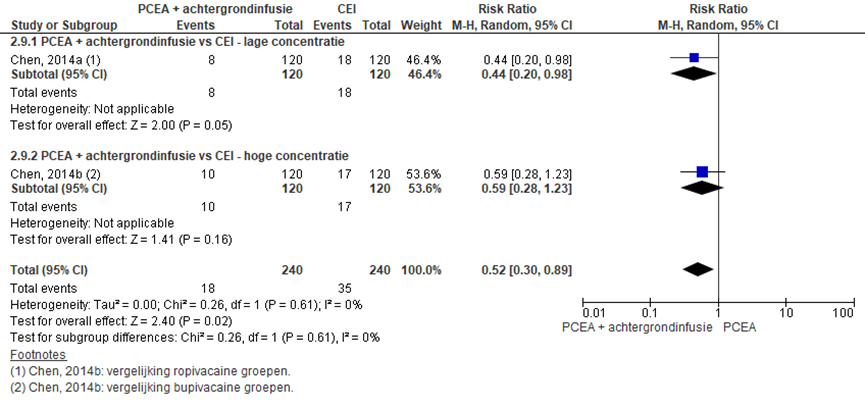
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat urineretentie is met twee niveau’s verlaagd vanwege het geringe aantal patiënten/ RCT’s en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Misselijkheid
Twee RCT’s rapporteerden misselijkheid (lage concentratie: Saito, 2005; Chen, 2014a en hoge concentratie: Chen, 2014b). Er werd geen significant verschil waargenomen in het risico op misselijkheid tussen zwangeren behandeld met PCEA + achtergrondinfusie in vergelijking tot CEI (RR: 0,95; 95% BI 0,64 tot 1,40). Er was geen sprake van heterogeniteit.
Figuur 20 Misselijkheid
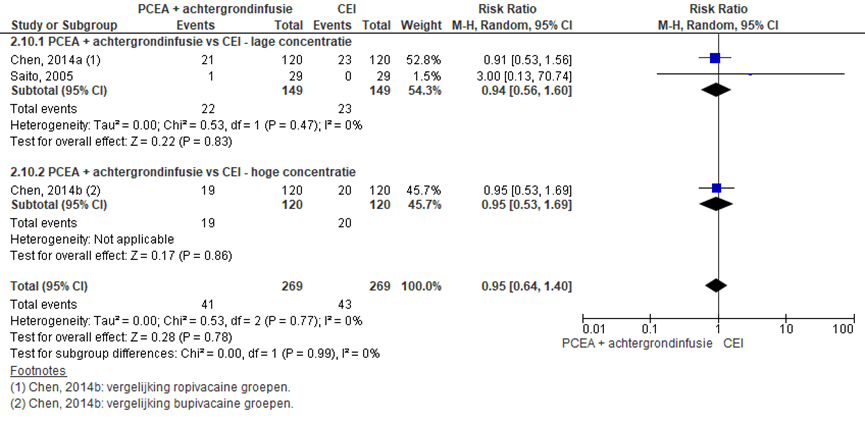
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat misselijkheid is met twee niveau’s verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’
Jeuk
Twee RCT’s rapporteerden jeuk (lage concentratie: Saito, 2005; Chen, 2014a en hoge concentratie Chen, 2014b). Er werd geen significant verschil waargenomen in het risico op jeuk tussen zwangeren behandeld met PCEA + achtergrondinfusie in vergelijking tot CEI (RR: 1,12; 95% BI 0,96 tot 1,31). Er was geen sprake van heterogeniteit.
Figuur 21 Jeuk
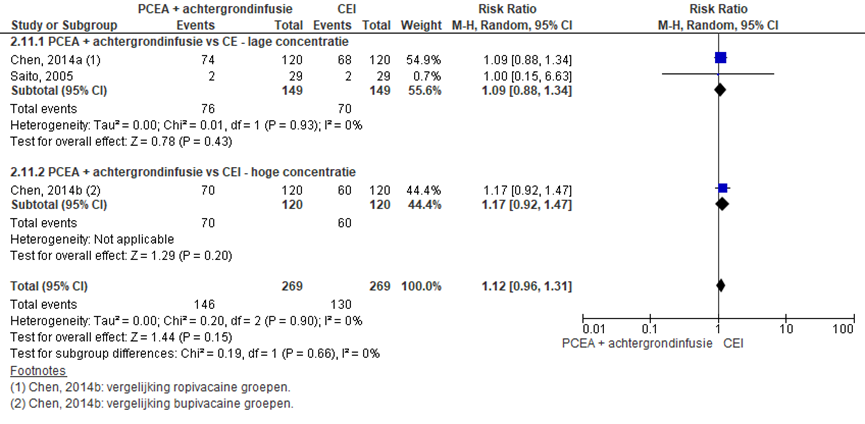
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat jeuk is met twee niveau’s verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias) en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’
pH. a. umbilicalis
Één RCT rapporteerde de pH. a. umbilicalis (lage concentratie: Saito, 2005). Er werd geen significant verschil waargenomen in de pH. a. umbilicalis tussen neonaten van zwangeren behandeld met PCEA + achtergrondinfusie in vergelijking tot CEI (gemiddeld verschil: -0.01; 95% BI -0.03 tot 0.01).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pH. a. umbilicalis is met twee niveau’s verlaagd vanwege het geringe aantal patiënten/ RCT’s en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’
Geen van de studies rapporteerde de uitkomstmaten: foetale hartslag afwijkingen, temperatuur, Apgarscore, borstvoeding, eclamptisch insult, fluxus postpartum, maternale of neonatale sterfte of negatieve uitkomsten voor de baby op lange termijn.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van PCEA vergeleken met CEI bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
P: zwangere vrouwen met het verzoek tot behandelen van de baringspijn;
I: PCEA zonder achtergrondinfusie (bolus only), of PCEA met achtergrondinfusie;
C: CEI;
O: zie onderstaand:
- Pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument.
- Cross-over naar andere/ aanvullende pijnmedicatie.
- Tevredenheid ten aanzien van pijnstilling (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument).
- Borstvoeding.
- Modus partus (vaginale kunstverlossing, sectio caesarea).
- Maternale complicaties: convulsie/ eclamptisch insult, fluxus postpartum, ademhalingsdepressie, bevallingsduur, hypotensie, temperatuur, urineretentie, misselijkheid/braken, jeuk, mate van motorisch blok, postspinale punctie hoofdpijn, epiduraal abces/ hematoom.
- Neonatale complicaties: opname NICU, Apgarscore < 7 bij 5 min, foetale hartslag afwijkingen, temperatuur, pH a. umbilicalis, mortaliteit, negatieve uitkomsten voor de baby op lange termijn.
- Kosten.
Relevante uitkomstmaten
De werkgroep achtte pijnintensiteit, tevredenheid, modus partus en maternale/ neonatale sterfte voor de besluitvorming kritieke uitkomstmaten; en motorisch blok en Apgarscore < 7 bij 5 minuten voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt: pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument) en tevredenheid (rapportcijfer/ VAS/ NRS of een ander gevalideerd instrument), waarbij scores door de patiënt zelf gedurende of direct na de bevalling gerapporteerd werden. Voor neonatale Apgarscore wordt de definitiescore van < 7 bij 5 minuten aangehouden. De overige uitkomstmaten werden niet a priori gedefinieerd, maar de werkgroep hanteerde de in de studies gebruikte definities.
Naast significantie wordt de klinische besluitvorming vooral bepaald door de klinische relevantie van de waargenomen verschillen tussen behandelopties. Voor dichotome uitkomstmaten definieerde de werkgroep een minimaal klinisch (patiënt) relevant verschil volgens de grenzen van de GRADE-working group, namelijk een verschil in relatief risico van 25%. Voor de continue kritieke uitkomstmaten definieerde de werkgroep een verschil van 10% op pijnintensiteit of tevredenheid als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 11 december 2017 met relevante zoektermen gezocht naar studies die pijnbehandeling middels PCEA vergeleken met CEI bij zwangere vrouwen met baringspijn. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 76 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Studiedesign RCT.
- Voldoet aan de PICO.
- Epidurale analgesie bevat een combinatie van lokaal anestheticum met opioïd.
- Gelijke concentratie lokaal anestheticum en opioïd in de interventie en controle groep;.
- Beschrijven van minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 35 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 24 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 11 studies definitief geselecteerd. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Collis RE, Harding SA, Morgan BM. Effect of maternal ambulation on labour with low-dose combined spinal-epidural analgesia. Anaesthesia. 1999 Jun;54(6):535-9.
- Bloom SL, McIntire DD, Kelly MA, Beimer HL, Burpo RH, Garcia MA, Leveno KJ. Lack of effect of walking on labor and delivery. N Engl J Med. 1998 Jul 9;339(2):76-9.
- Vallejo MC, Firestone LL, Mandell GL, Jaime F, Makishima S, Ramanathan S. Effect of epidural analgesia with ambulation on labor duration. Anesthesiology. 2001 Oct; 95(4):857-61.
- Cohen SE, Yeh JY, Riley ET, Vogel TM. Walking with labor epidural analgesia: the impact of bupivacaine concentration and a lidocaine-epinephrine test dose. Anesthesiology. 2000 Feb;92(2):387-92.
- Parry MG, Fernando R, Bawa GP, Poulton BB. Dorsal column function after epidural and spinal blockade: implications for the safety of walking following low-dose regional analgesia for labour. Anaesthesia. 1998 Apr;53(4):382-7.
- Breen TW, Shapiro T, Glass B, Foster-Payne D, Oriol NE. Epidural anesthesia for labor in an ambulatory patient. Anesth Analg. 1993 Nov;77(5):919-24.
- Collis RE, Plaat FS, Morgan BM. Comparison of midwife top-ups, continuous infusion and patient-controlled epidural analgesia for maintaining mobility after a low-dose combined spinal-epidural. Br.J.Anaesth. 1999 Feb;82(2):233-236.
- Haydon ML, Larson D, Reed E, Shrivastava VK, Preslicka CW, Nageotte MP. Obstetric outcomes and maternal satisfaction in nulliparous women using patient-controlled epidural analgesia. Am.J.Obstet.Gynecol. 2011 Sep;205(3):271.e1-271.e6.
- Ledin Eriksson S, Gentele C, Olofsson CH. PCEA compared to continuous epidural infusion in an ultra-low-dose regimen for labor pain relief: a randomized study. Acta Anaesthesiol.Scand. 2003 Oct;47(9):1085-1090.
- Smedvig JP, Soreide E, Gjessing L. Ropivacaine 1 mg/ml, plus fentanyl 2 microg/ml for epidural analgesia during labour. Is mode of administration important?. Acta Anaesthesiol.Scand. 2001 May;45(5):595-599.
- Vallejo MC, Ramesh V, Phelps AL, Sah N. Epidural labor analgesia: continuous infusion versus patient-controlled epidural analgesia with background infusion versus without a background infusion. J.Pain 2007 Dec;8(12):970-975.
- Boutros A, Blary S, Bronchard R, Bonnet F. Comparison of intermittent epidural bolus, continuous epidural infusion and patient controlled-epidural analgesia during labor. Int.J.Obstet.Anesth. 1999 Oct;8(4):236-241.
- Ferrante FM, Lu L, Jamison SB, Datta S. Patient-controlled epidural analgesia: demand dosing. Anesth.Analg. 1991 Nov;73(5):547-552.
- Chen S, Lin P, Yang Y, Yang Y, Lee C, Fan S, et al. The effects of different epidural analgesia formulas on labor and mode of delivery in nulliparous women. Taiwan.j.obstet.gynecol. 2014 Mar;53(1):8-11.
- Saito M, Okutomi T, Kanai Y, Mochizuki J, Tani A, Amano K, et al. Patient-controlled epidural analgesia during labor using ropivacaine and fentanyl provides better maternal satisfaction with less local anesthetic requirement. J.Anesth. 2005;19(3):208-212.
- Ferrante FM, Rosinia FA, Gordon C, Datta S. The role of continuous background infusions in patient-controlled epidural analgesia for labor and delivery. Anesth.Analg. 1994 Jul;79(1):80-84.
- Viscomi C, Eisenach JC. Patient-controlled epidural analgesia during labor. Obstet.Gynecol. 1991 Mar;77(3):348-351.
- Carvalho B, Wang P, Cohen SE. A survey of labor patient-controlled epidural anesthesia practice in California hospitals. Int J Obstet Anesth. 2006 Jul;15(3):217-22.
- Curry PD, Pacsoo C, Heap DG. Patient-controlled epidural analgesia in obstetric anaesthetic practice. Pain. 1994 Apr;57(1):125-7.
Evidence tabellen
Evidence table for intervention studies (randomized controlled)
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Boutros, 1999 |
Type of study: RCT
Setting: Hospital
Country: France
Source of funding: Not reported |
Inclusion criteria: ASA physical status I or II term parturients.
Exclusion criteria: Not specified
N total at baseline: PCEA: N = 50 CEI: N = 50
Important prognostic factors: Age mean ± SD: PCEA: 30.0 ± 5.6 CEI: 29.8 ± 4.6
Weight (kg) mean ± SD PCEA: 73.6 ± 13.0 CEI: 71.4 ± 10.0
Height (cm) mean ± SD PCEA: 162.5 ± 6.2 CEI: 162.6 ± 6.8
Gestational age (weeks) mean ± SD: PCEA: 39.6 ± 1.3 CEI: 39.3 ± 1.2 |
Patient-controlled epidural analgesia (PCEA) bolus only
Initial bolus of 10µg of sufentanil plus bupivacaine 0.25% in divided doses of 3 mL each to achieve satisfactory analgesia. Analgesia was maintained with bupivacaine 0.125%, with 0.5µg/mL of sufentanil. The solution was administered with a pump programmed to deliver 5 mL patient-triggered boluses with a 10 min lock-out interval and a 50 mL maximum in 4 h, with no continuous background infusion. |
Continuous epidural infusion (CEI)
Initial bolus of 10µg of sufentanil plus bupivacaine 0.25% in divided doses of 3 mL each to achieve satisfactory analgesia. Analgesia was maintained with bupivacaine 0.125%, with 0.5µg/mL of sufentanil. A continuous infusion of the bupivacaine-sufentanil solution was started 30 min after the first bolus, at 8 mL/h. The infusion rate was increased to 14 mL/h whenever analgesia was inadequate. If the sensory level extended above T7, the infusion rate was reduced or the CEI interrupted. |
Length of follow-up: Followed to labor.
Loss-to-follow-up: PCEA: N = 2 (4%) Reason, severe pain requiring another analgesic solution than the one used in the study. CEI: N = 0
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Chen, 2014 |
Type of study: RCT
Setting: University Hospital
Country: Taiwan
Source of funding: The authors have non conflicts of interest to declare. No details about funding. |
Inclusion criteria: All recruited women were in active labor with cervical dilation of 3-5 cm with regular uterine contractions, and none received parenteral opioids before epidural infusion.
Exclusion criteria: Multiparous women, contraindications for epidural analgesia, drug or alcohol abuse, known fetal abnormality, maternal obstetric complications (placenta previa and antepartum hemorrhage), previous uterine surgery, ineffective epidural labor analgesia (Verbal Pain Scale ≥4 after an epidural loading dose of 15 mL of the study regimen) and incomplete epidural labor analgesia (epidural analgesia duration <2 hours).
N total at baseline: PCEA group A: N = 126 PCEA group B: N = 127 CEI group C: N = 128 CEI group D: N = 125
Important prognostic factors: Age mean ± SD: PCEA group A: 30.17 ± 2.47 PCEA group B: 30.05 ± 2.66 CEI group C: 30.04 ± 2.32 CEI group D: 29.94 ± 2.23
Weight (kg) mean ± SD PCEA group A: 64.13 ± 4.16 PCEA group B: 64.34 ± 4.29 CEI group C: 64.13 ± 3.85 CEI group D: 64.28 ± 3.80
Height (cm) mean ± SD PCEA group A: 159.32 ± 2.76 PCEA group B: 159.68 ± 2.85 CEI group C: 159.73 ± 2.64 CEI group D: 160.09 ± 2.85
Gestational age (weeks) mean ± SD Not reported |
Patient-controlled epidural analgesia (PCEA) + achtergrondinfusie
PCEA group A: Received a loading dose of 10 mL 1 mg/mL ropivacaine with 2 µg/mL fentanyl, then an intermittent bolus dose of 5 mL with a background infusion rate at 5 mL/hour by PCEA.
PCEA group B: Received a loading dose of 10 mL 0.8 mg/mL bupivacaine with 2 µg/mL fentanyl, then an intermittent bolus dose of 5 mL, with a background infusion rate at 5 mL/hour by PCEA.
|
Continuous epidural infusion (CEI)
CEI group C: Received the same loading dose as Group A, followed by a continuous infusion dose of 1 mg/ml ropivacaine with 2 µg/mL fentanyl at 10mL/hour.
CEI group D: Received the same loading dose as Group B, followed by a continuous infusion dose of 0.8 mg/ml bupivacaine with 2 µg/mL fentanyl at 10mL/hour.
|
Length of follow-up: Followed to labor.
Loss-to-follow-up: PCEA group A: N = 6 ( 4.8%) Reason, ineffective analgesia (N = 2), incomplete analgesia (N = 4). PCEA group B: N = 7 (5.5%) Reason, ineffective analgesia (N = 3), incomplete analgesia (N = 4). CEI group C: N = 8 (6.3%) Reason, ineffective analgesia (N = 3), incomplete analgesia (N = 5). CEI group D: N = 5 (4%) Reason, ineffective analgesia (N = 2), incomplete analgesia (N = 3).
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Collis 1999 |
Type of study: RCT
Setting: Hospital
Country: United Kingdom
Source of funding: No details about funding. |
Inclusion criteria: Primigravid women requesting regional analgesia in early labour with a singleton, term, cephalic pregnancy.
Exclusion criteria: None specified
N total at baseline: PCEA: N = 44 CEI: N = 46
Important prognostic factors: Age mean (range): PCEA: 29.9 (18 to 38) CEI: 30.6 (20 to 40)
Weight (kg) mean ± SD Not reported
Height (cm) mean ± SD Not reported
Gestational age (weeks) mean ± SD Not reported |
Patient-controlled epidural analgesia (PCEA) bolus only
Hartmann’s solution 500–1000 ml was given as preload. One millilitre of 0.25% bupivacaine (2.5 mg) and 0.5 ml of fentanyl (25 g) were injected into the cerebrospinal fluid. The spinal needle was removed and an epidural catheter sited. The epidural catheter was flushed with normal saline. The epidural solution for all groups was 0.1% bupivacaine with fentanyl 2 g ml–1.
A 100-ml bag of premixed solution was inserted into a battery operated Abbott Provider 5500 which was carried in a bag with a shoulder strap. The PCEA pump was set up with a 10-ml bolus dose and a 30-min lockout period.
In all groups, the anaesthetist was recalled if analgesia was unsatisfactory and gave 10–15 ml of the premixed solution until analgesia was satisfactory. |
Continuous epidural infusion (CEI)
Hartmann’s solution 500–1000 ml was given as preload. One millilitre of 0.25% bupivacaine (2.5 mg) and 0.5 ml of fentanyl (25 g) were injected into the cerebrospinal fluid. The spinal needle was removed and an epidural catheter sited. The epidural catheter was flushed with normal saline. The epidural solution for all groups was 0.1% bupivacaine with fentanyl 2 g ml–1.
A 100-ml bag of premixed solution was inserted into a battery operated Abbott Provider 5500 which was carried in a bag with a shoulder strap. The pump was started 45 min after the initial dose to run at 10 ml h-1.
In all groups, the anaesthetist was recalled if analgesia was unsatisfactory and gave 10–15 ml of the premixed solution until analgesia was satisfactory. |
Length of follow-up: Followed to labor.
Loss-to-follow-up: PCEA: N = 0 CEI: N = 0
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Ferrante 1991 |
Type of study: RCT
Setting: University hospital
Country: United States of America
Source of funding: No details about funding. |
Inclusion criteria: Singleton fetus with vertex presentation at term, a pregnancy without complication, no prior history of caesarean delivery, and a conversational fluency in English.
Exclusion criteria: Not specified
N total at baseline: PCEA: N = 20 CEI: N = 20
Important prognostic factors: Age mean ± SE PCEA: 32.3 ± 1.2 CEI: 31.5 ± 1.1
Weight (kg) mean ± SE PCEA: 77.3 ± 3.0 CEI: 77.6 ± 3.0
Height (cm) mean ± SE PCEA: 165.8 ± 1.4 CEI: 160.7 ± 1.2
Gestational age (weeks) mean ± SD Not reported |
Patient-controlled epidural analgesia (PCEA) bolus only
All patients received an initial dose of 8-13 mL of 0.5% bupivacaine to achieve a level of anesthesia from S-5 to at least T-10. The epidural catheter was connected to an Abbot Life-Care PCA Plus 4100 infuser. All patients received 0.125% bupivacaine and 2 µg/mL of fentanyl.
Self-administer a demand dose of 3 mL every 10 min as needed. |
Continuous epidural infusion (CEI)
All patients received an initial dose of 8-13 mL of 0.5% bupivacaine to achieve a level of anesthesia from S-5 to at least T-10. The epidural catheter was connected to an Abbot Life-Care PCA Plus 4100 infuser. All patients received 0.125% bupivacaine and 2 µg/mL of fentanyl.
Received 12 ml/h.
|
Length of follow-up: Followed to labor.
Loss-to-follow-up: PCEA: N = 0 CEI: N = 0
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Ferrante 1994 |
Type of study: RCT
Setting: University hospital
Country: United States of America
Source of funding: No details about funding. |
Inclusion criteria: Singleton fetus with vertex presentation at term, a pregnancy without complication, no prior history of caesarean delivery, and a conversational fluency in English.
Exclusion criteria: Not specified
N total at baseline: PCEA group A: N = 20 PCEA group B: N = 20 CEI: N = 20
Important prognostic factors: Age mean ± SE: PCEA group A: 32.0 ± 1.4 PCEA group B: 28.5 ± 1.5 CEI: 32.3 ± 1.3
Weight (kg) mean ± SE PCEA group A: 75.9 ± 2.2 PCEA group B: 78.1 ± 3.0 CEI: 77.0 ± 3.8
Height (cm) mean ± SE PCEA group A: 165.0 ± 2.2 PCEA group B: 164.6 ± 2.0 CEI: 159.9 ± 1.2
Gestational age (weeks) mean ± SD Not reported |
Patient-controlled epidural analgesia (PCEA)
All patients received an initial dose of 0.5% bupivacaine sufficient to achieve a level of sensory analgesia from S5 to at least T10.
The epidural catheter was connected to an Abbot Life-Care PCA Plus 4100 infuser. All patients received 0.125% bupivacaine and 2 µg/mL of fentanyl.
Group PCEA only: demand dose= 3ml with lock-out time 10min; no max described. No background infusion
PCEA + achtergrond, group A: Were able to self-administer a demand dose of 3mL every 10 min as needed, with a background epidural infusion at a rate of 3 mL/h.
PCEA + achtergrond, group B: Were able to self-administer a demand dose of 3mL every 10 min as needed, with a background epidural infusion at a rate of 6 mL/h.
|
Continuous epidural infusion (CEI)
All patients received an initial dose of 0.5% bupivacaine sufficient to achieve a level of sensory analgesia from S5 to at least T10.
The epidural catheter was connected to an Abbot Life-Care PCA Plus 4100 infuser. All patients received 0.125% bupivacaine and 2 µg/mL of fentanyl.
Received an epidural infusion at a fixed rate of 12 mL/h without recourse to PCEA or adjustment of the infusion rate. |
Length of follow-up: Followed to labor.
Loss-to-follow-up: PCEA group A: N = 0 PCEA group A: N = 0 CEI: N = 0
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Haydon, 2011 |
Type of study: RCT
Setting: Hospital
Country: United States of America
Source of funding: No details about funding. |
Inclusion criteria: nulliparous women at >36 wk gestational age, spontaneous labor and requested epidural.
Exclusion criteria: women with contraindications to regional spinal analgesia, cervical dilation >5 cm, nonvertex presentation, without category I fetal tracing, multiple gestation or fetal malformations.
N total at baseline: PCEA bolus only: N = 90 PCEA + CEI: N = 90 CEI: N = 90
Important prognostic factors: Age mean ± SD: PCEA bolus only: 24.25 ± 4.6 PCEA + CEI: 24.99 ± 6.3 CEI: 24.93 ± 6.3
Weight (kg) mean ± SD Not reported
Height (cm) mean ± SD Not reported
Gestational age (weeks) mean ± SD PCEA bolus only: 39.4 ± 1.1 PCEA + CEI: 39.5 ± 1.1 CEI: 39.3 ± 1.6 |
Patient-controlled epidural analgesia (PCEA)
initial bolus via CSE 0,5% bupi 0,4ml + fentanyl 50ug/ml 0,4ml followed by epidural dosing schemes:
Group PCEA+CEI = 0,1% bupi + fentanyl 2ug/ml
demand bolus= 10ml/h with lock-out 20min, no max described. Background infusion at 10ml/h
PCEA bolus only = 0,1% bupi + fentanyl 2ug/ml
demand bolus= 10ml/h with lock-out 20min, no max described
Subjects in each group were allowed up to 2 boluses of 10ml bupi 0,25%, or epidural was replaced if pain remained insufficient |
Continuous epidural infusion (CEI)
initial bolus via CSE 0,5% bupi 0,4ml + fentanyl 50ug/ml 0,4ml followed continuous infusion 0,1% bupi + fentanyl 2ug/ml (placebo button). Infusion rate: 10ml/h
subjects in each group were allowed up to 2 boluses of 10ml bupi 0,25%, or epidural was replaced if pain remained insufficient |
Length of follow-up: Followed to labor.
Loss-to-follow-up: PCEA bolus only: N = 6 Reason: technical difficulties with pump PCEA + CEI: N = 3 Reason: technical difficulties with pump CEI: N = 7 Reason: technical difficulties with pump
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Ledin, 2003 |
Type of study: RCT
Setting: Hospital
Country: Sweden
Source of funding: No details about funding |
Inclusion criteria: singleton pregnancies, ASA I-II, no systemic opioids for 6h before entering study
Exclusion criteria: ASA III-IV, breech presentation and existing language barrier
N total at baseline: 97 randomized Completing protocol: PCEA: N = 40 CEI: N = 40
Important prognostic factors: Age mean ± SD: Not reported
Weight (kg) mean ± SD PCEA: 78.8 ± 12.2 CEI: 80.6 ± 9.83
Height (cm) mean ± SD PCEA: 166 ± 6.3 CEI: 166 ± 5.39
Gestational age (weeks) mean ± SD PCEA: 40.3 ± 1.24 CEI: 40.2 ± 1.17 |
Patient-controlled epidural analgesia (PCEA) bolus only
epidural test dose 3ml followed by main dose 5ml of study solution: 10ml ropivacaine 10mg/ml + 1ml sufentanil 50ug/l (giving 100ml of ropi 1mg/l + sufenta 0,5ug/ml) followed by PCEA pump
demand dose= 4ml; 20min lock-out and no 1- or 4-hr limit
Both groups could request resque bolusses of 5ml study solution given by midwife or anesthetist if VAS >5 or patient request with a max of 3 boluses up to 15ml. |
Continuous epidural infusion (CEI)
epidural test dose 3ml followed by main dose 5ml of study solution: 10ml ropivacaine 10mg/ml + 1ml sufentanil 50ug/l (giving 100ml of ropi 1mg/l + sufenta 0,5ug/ml), followed by continuous infusion of study solution. Infusion rate: 6ml/h
Both groups could request resque bolusses of 5ml study solution given by midwife or anesthetist if VAS >5 or patient request with a max of 3 boluses up to 15ml. |
Length of follow-up: Followed to labor.
Loss-to-follow-up: N = 17 Reason: technical difficulties with pump (n= 8)/ delivery within an hour (n= 8)/ existing exclusion criteria (n= 1)
Lost-to-follow-up not reported per group |
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Saito, 2005 |
Type of study: RCT
Setting: Hospital
Country: Sweden
Source of funding: No details about funding |
Inclusion criteria: ASA status I-II, who requested analgesia at term, singleton, vertex presentation of fetus.
Exclusion criteria: multiparity, preeclampsia, pregnancy induced hypertension, multiple gestation, and any contraindication to epidural analgesia such as a bleeding disorder.
N total at baseline: PCEA: N = 29 CEI: N = 29
Important prognostic factors: Age mean ± SD: PCEA: 29 ± 5 CEI: 30 ± 4
Weight (kg) mean ± SD PCEA: 62.7 ± 7.4 CEI: 63.6 ± 8.7
Height (cm) mean ± SD PCEA: 160.1 ± 5.3 CEI: 159.6 ± 5.1
Gestational age (weeks) mean ± SD PCEA: 39.7 ± 1.2 CEI: 39.3 ± 1.3 |
Patient-controlled epidural analgesia (PCEA) + background infusion
test dose 3ml 0,2 ropi and initial dose 4ml 0,2 ropi twice in 10min follwed by epidural solution of 0,1% ropi + 0,0002% fentanyl via PCEA
demand bolus= 5ml with lock-out 10min, no max described. Basal infusion rate 6ml/h
|
Continuous epidural infusion (CEI)
test dose 3ml 0,2 ropi and initial dose 4ml 0,2 ropi twice in 10min follwed by epidural solution of 0,1% ropi + 0,0002% fentanyl via continuous infusion 10ml/h |
Length of follow-up: Followed to labor.
Loss-to-follow-up: no loss to follow-up
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Smedvig, 2001 |
Type of study: RCT
Setting: Hospital
Country: Norway
Source of funding: No details about funding |
Inclusion criteria: nulliparous women at term who requested epidural analgesia. Only deliveries starting between 8 am and 2 pm were included.
Exclusion criteria: women with anticipated communication problems, pre-eclampsia, known predictors of more painful deliveries, multiple deliveries, and premature rupture of membranes
N total at baseline: 90 Not reported per group
Important prognostic factors: Age mean ± SD: PCEA: 26.3 ± 4.9 CEI: 27.1 ± 5.4
Weight (kg) mean ± SD PCEA: 75.7 ± 10.4 CEI: 83.5 ± 12.7
Height (cm) mean ± SD PCEA: 167 ± 6.5 CEI: 166 ± 6.8
Gestational age (weeks) mean ± SD PCEA: 40.4 ± 1.4 CEI: 40.2 ± 1.0 |
1.0Patient-controlled epidural analgesia (PCEA) bolus only
inital bolus 1mg/ml ropivacaine + 2ug/ml fentanyl injected in incremental doses, followed by PCEA of the standard mixture
demand dose= 5ml; lock-out time 10 min; max at 25ml/hr
all pt could receive additional analgesia 5ml of standard ropi/fenta mixture in case VAS exceeded 3 |
Continuous epidural infusion (CEI)
inital bolus 1mg/ml ropivacaine + 2ug/ml fentanyl injected in incremental doses, followed by continuous infusion of the standard mixture
8ml/h (placebo PCEA button)
all pt could receive additional analgesia 5ml of standard ropi/fenta mixture in case VAS exceeded 3 |
Length of follow-up: Followed to labor.
Loss-to-follow-up: n = 1 excluded Reason: technical problems
Lost-to-follow-up not reported per group
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Vallejo, 2007 |
Type of study: RCT
Setting: Hospital
Country: Unites States of America
Source of funding: No details about funding |
Inclusion criteria: ASA I-II parturients who requested labor analgesia at 2-6cm cervical dilation at term (37-42 weeks of gestation), singleton fetus in vertex presentation.
Exclusion criteria: patients who received parental analgesics within 1 hr before the epidural block, history of chronic pain syndrome, fetal presentation other than vertex, patients with a known history of allergy, sensitivity, or any other reaction to amide local anaesthetics, preeclampsia, parturients with any known contraindications toe epidural analgesia, and history of caesarean delivery.
N total at baseline: PCEA bolus only: N = 63 PCEA + CEI: N = 64 CEI: N = 62
Important prognostic factors: Age mean ± SD: PCEA bolus only: 28.7 ± 5.6 PCEA + CEI: 29.6 ± 6.6 CEI: 27.8 ± 5.7
Weight (kg) mean ± SD PCEA bolus only: 83.0 ± 14.2 PCEA + CEI: 84.0 ± 18.0 CEI: 85.2 ± 18.6
Height (cm) mean ± SD PCEA bolus only: 165.3 ± 7.7 PCEA + CEI: 163.3 ± 11.0 CEI: 164.1 ± 6.7
Gestational age (weeks) mean ± SD PCEA bolus only: 39.2 ± 1.4 PCEA + CEI: 39.1 ± 1.4 CEI: 39.2 ± 1.4 |
Patient-controlled epidural analgesia (PCEA)
Inital bolus 0,1% ropi 10ml + fentanyl 100ug, followed by 0,1% ropi + 2ug/ml fentanyl by PCEA according the scheme below:
group PCEA + CEI: demand dose= 5ml with lockout time 20min; max 20ml/h. Background infusion of 5ml/h
Group PCEA bolus only demand dose= 5ml with lockout time 15min; max 20ml/h. without background infusion |
Continuous epidural infusion (CEI)
Inital bolus 0,1% ropi 10ml + fentanyl 100ug, followed by 0,1% ropi + 2ug/ml fentanyl by continuous infusion 10ml/h. |
Length of follow-up: Followed to labor.
Loss-to-follow-up: n = 6 excluded Reason: due to misplacement of the epidural catheter resulting in inadequate analgesia, or malfunction of the epidural infusion device.
Lost-to-follow-up not reported per group
|
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
|
Viscomi, 1991 |
Type of study: RCT
Setting: Hospital
Country: Unites States of America
Source of funding: No details about funding |
Inclusion criteria: ASA I-II and vertex presentation.
Exclusion criteria: pregnancy complicated by multiple gestation, thick meconium, cervical dilatation more than 7cm, or late decelerations on FHR monitoring.
N total at baseline: PCEA + CEI: N = 60 CEI: N = 28
Important prognostic factors: Age mean ± SD: PCEA + CEI: 25 ± 1 CEI: 24 ± 1
Weight (kg) mean ± SD Not reported
Height (cm) mean ± SD Not reported
Gestational age (weeks) mean ± SD Not reported |
initial dose of 2ml + 5ml 2% lido (if pain persisted additional 5ml 0,25% bupi), then followed by PCEA of 0,125% bupi + 1ug/ml fentanyl
demand dose= 4ml with lock-out 10min; max 20ml/h. Basal infusion reate 4 ml/hr.
all pt could receive additional analgesia with 10ml of 0,25 bupi |
initial dose of 2ml + 5ml 2% lido (if pain persisted additional 5ml 0,25% bupi), then followed by continuous infusion of 0,125% bupi + 1ug/ml fentanyl
12ml/h with infusion rates adjusted in increments of 2 ml/h
all pt could receive additional analgesia with 10ml of 0,25 bupi |
Length of follow-up: Followed to labor.
Loss-to-follow-up: n = 13 from the PCEA + CEI group excluded Reason: repeated pump alarm due to ‘overpressure’. |
Outcome measures as defined in this research question are extracted from the individual studies. The outcomes (results) and effect sizes can be found in the forest plots (figures) of the literature analysis. |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders)).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Boutros 1999 |
‘…were allocated randomly to either…’ |
Unclear |
Likely |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
|
Chen 2014 |
‘The randomization sequence was generated by a table of random numbers’ |
Unlikely |
Likely |
Likely |
Unlikely |
Unclear |
Unlikely |
Likely |
|
Collis 1999 |
‘They were allocated randomly to one of three groups, by sealed numbered envelopes that contained the study form and procedure.’ |
Unlikely |
Likely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
|
Ferrante 1991 |
‘Patients were then randomized to receive either CEI or PCEA in a double-blind fashion’ |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Ferrante 1994 |
‘…were randomized to receive either CEI or PCEA in a double-blind fashion.’ |
Unlcear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Haydon 2011 |
‘…were assigned randomly to 1 of 3 groups, and the pump was initiated in all patients. The subject, nurse, anesthesiologist, and obstetrician were each blinded to the group assignement’… ‘in a 1:1:1 ratio with the use of a computer-generated random number table. The randomization assignments were placed in sealed envelopes.’ |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
|
Ledin, 2003 |
‘Randomization was done using urn model with 80 tickets. Each ticket was drawn without replacement. The parturients were grouped by sealed envelope assignment…’ |
Unlikely |
Likely |
Likely |
Likely |
Likely |
Unclear |
Unlikely |
|
Saito, 2005 |
‘…randomly devided into two groups by an envelope method. The PCEA group (…) with a patient-controlled pump (…). The CEI group (…) syringe pump (…) at a constant rate…’ |
Unclear |
Likely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
|
Smedvig, 2001 |
‘The patient was allocated to either PCEA or CEI mode by a computerised two group randomisation program. The pump programming and randomisation was performed by nurses not connected to the maternity ward. The parturient, the obstetrician, midwife and investigator were blinded with respect to the pump program use’ |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unclear |
Unlikely |
|
Vallejo, 2007 |
‘a research coordinator not involved in data collection assigned patients to a study group using a computer-generated randomization table, and set up epidural pumps in all groups.’ |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unclear |
Unlikely |
|
Viscomi, 1991 |
‘… the randomization schedule was weighted so that 67% of patients would be assigned to continuous epidural infusion (…) |
Unclear |
Likely |
Likely |
Likely |
Unclear |
Unclear |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Sng, 2016 |
Narratieve review |
|
Sng, 2014 |
Narratieve review |
|
George, 2013 |
Vergelijking voldoet niet aan PICO |
|
George, 2011 |
Vergelijking voldoet niet aan PICO |
|
Allcock, 2010 |
Betreft enkel een conference abstract |
|
Halpern, 2005 |
Geen systematische review |
|
Van der Vyver, 2002 |
Relevante studies komen individueel al in de literatuuranalyse terug |
|
Tien, 2016 |
Vergelijking voldoet niet aan PICO |
|
Feng, 2014 |
Vergelijking voldoet niet aan PICO |
|
Bamber, 2006 |
Geen vergelijkende studie |
|
Sia, 2006 |
Vergelijking voldoet niet aan PICO (computer integrated regimen) |
|
Missant, 2005 |
Vergelijking voldoet niet aan PICO |
|
Salim, 2005 |
Vergelijking voldoet niet aan PICO (CEI versus bolus on demand (dus door omstander)) |
|
Norris, 2003 |
Geen vergelijkende studie |
|
Paech, 2003 |
Narratieve review |
|
Yu, 1988 |
Dezelfde studie als Gambling, 1988 |
|
Fontenot, 1993 |
Geen opioid toegevoegd |
|
Lysak, 1990 |
CEI wordt ook getitreerd |
|
Gambling, 1988 |
Geen opioid toegevoegd |
|
Chen, 2006 |
Retrospectieve studie |
|
Sia, 1999 |
Geen opioid toegevoegd |
|
Purdie, 1992 |
Geen opioid toegevoegd |
|
Tan, 1994 |
Geen opioid toegevoegd |
|
Ferrante, 1995 |
Voldoet niet aan de PICO (concentratie bupi is niet gelijk tussen groepen) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-07-2020
Beoordeeld op geldigheid : 03-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijnmodule deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
PCEA versus CEI |
NVA/ NVOG |
2019 |
2024 |
Een in vijf jaar |
Regiehouder en andere wetenschappelijke verenigingen |
Niet van toepassing |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
De ontwikkeling van de richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
- Dr. W.L.M.C.M. Schellekens, extern voorzitter
- Drs. I.C.M. Beenakkers, anesthesioloog, werkzaam in het UMC Utrecht, NVA
- Drs. F.A. Klerk, anesthesioloog, werkzaam in het Diakonessenhuis Utrecht, NVA
- Drs. C.E. Kam-Endtz, anesthesioloog, werkzaam in het Haaglanden Medisch Centrum, NVA
- Dr. F.T.H. Lim, gynaecoloog, werkzaam in het IJssellandziekenhuis, NVOG
- Dr. L.M. Freeman, gynaecoloog, werkzaam in het Ikazia Ziekenhuis Rotterdam, NVOG
- Dr. J.M. Middeldorp, gynaecoloog, werkzaam in het Leids Universitair Medisch Centrum, NVOG
- Drs. A.G. Kaspers, kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Drs. L.A.M. Moll, klinisch verloskundige, werkzaam in het St. Antonius Ziekenhuis Nieuwegein, KNOV
- Dr. J. de Boer, beleidsmedewerker bij KNOV
- Drs. S. Ratsma-Wesselius, Obstetrisch verpleegkundige, werkzaam bij het Amsterdam UMC, Locatie AMC, V&VN
- Dr. J.E. Nagtegaal, Ziekenhuisapotheker, werkzaam in het Meander Medisch Centrum, NVZA
- Dr. A.M.D.E. Timmerman, Klinisch Fysicus, werkzaam in het UMC Utrecht, NVKF
- Drs. J.C. Mooij, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
Met ondersteuning van
- Dr. E.M.E. den Breejen, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. Harmsen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schellekens |
gepensioneerd, ZZP: strategisch adviseur |
Lid RvT Diakonessenhuis, Utrecht |
Geen |
Geen |
|
Klerk |
Staf Anesthesiologie Diakonessenhuis Utrecht. |
bestuurslid Obst. Anesth. onbetaald |
Geen |
Geen |
|
Ratsma Wesselius |
Senior verpleegkundige Verloscentrum AMC |
Gastdocent VU Amstel Academie verpleegkundige vervolgopleidingen Obstetrie, betaald |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog WKZ/UMCU |
Voorzitter sectie obstetrische anesthesie van de NVA. Onbetaald |
Echtgenoot werkzaam bij GSK |
Geen |
|
Nagtegaal |
Ziekenhuisapotheker Meander Medisch Centrum |
Beroepenveldcommissie Farmakunde Hogeschool Utrecht, onbetaald |
Geen |
Geen |
|
Timmerman |
Staffunctionaris Klinische Fysica & Patiëntveiligheid |
Lid NIVEL expertgroep infuustechnologie - advies maken kennistoets voor verpleegkundigen – onbetaald Lid ondernemingsraad UMC Utrecht - onbetaald |
EMRP Researcher Grant Metrology for Drug Delivery HLT07- REG1 €120,422.88 USPTO Applicaton #: #20160106909 Apparatus for simultaneous multiple medicament administration |
Geen |
|
Kam-Endtz |
Anesthesioloog Haaglanden MC |
Geen |
Geen |
Geen |
|
Middeldorp |
Gynaecoloog-perinatoloog |
Geen |
Geen |
Geen |
|
Moll |
Klinisch verloskundige/research verloskundige in het St. Antoniusziekenhuis in Nieuwegein |
Geen |
Geen |
Geen |
|
Freeman |
Gynaecoloog |
voorzitter multidiciplinaire werkgroep obstetrische anesthesie
|
Mijn promotieonderzoek naar epidurale analgesie en remifentanil is gesubsidieerd door ZonMw. Dit onderzoek is afgerond maar de resultaten zullen gebruikt worden in deze richtlijn |
Geen |
|
Mooij |
Beleidsmedewerker Patiëntenvereniging Nederland |
Vrijwilligerswerk (onbetaald) patiëntenorganisatie CCUVN |
Geen |
Geen |
|
Kaspers |
Kinderarts-neonatoloog, MST Enschede |
Geen |
Geen |
Geen |
|
De Boer |
Beleidsmedewerker richtlijnontwikkeling |
Geen nevenwerkzaamheden |
Geen |
Geen |
|
Lim |
gynaecoloog |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patientenfederatie Nederland in de werkgroep te laten deelnemen. De conceptmodule is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland. Daarnaast is door de Patiëntenfederatie Nederland een achterbanraadpleging verricht, waarvan de uitkomsten zo veel mogelijk meegenomen zijn in de overwegingen van de modules.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze modules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, (2010)), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit inventarisatie van de knelpunten door de commissie van de NVA bleek dat er een noodzaak was voor revisie van deze richtlijnmodules. Tevens zijn tijdens een fysieke knelpunteninventarisatie knelpunten aangedragen door aanpalende stakeholders inclusief patiëntenorganisaties. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroepleden en de adviseur uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Indicatoren over zwangerschap en geboorte zijn reeds onderdeel van de vervaardigde indicatoren bij de zorgstandaard integrale geboortezorg. Derhalve zijn er bij deze modules geen indicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules werden aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
(2009-4 dec 2017)
|
1 exp Labor, Obstetric/ or exp Delivery, Obstetric/ 110521 2 (labor or labour or childbirth or birth* or delivery or parturient*).ti,ab. 736608 3 1 or 2 782592 4 exp Labor pain/ or exp Analgesia, obstetric/ 4488 5 3 or 4 783262 6 exp analgesia, epidural/ 8026 7 (epidural* or CSE or PCEA).ti,ab. 43704 8 6 or 7 45179 9 exp Meperidine/ 6149 10 (meperidin* or pethidin* or isonipecain or dolsin or dolosal or dolin or 'perindine or dolantin or dolargan or lidol or lydol or demerol or dolcontral or (parenteral* adj2 opoid*) or non-epidural or nonepidural).ti,ab. 5604 11 9 or 10 8371 12 5 and 8 and 11 355 13 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) 367140 14 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) 1873901 15 12 and 13 21 16 12 and 14 163 17 (12 and 14) not 15 145 18 limit 15 to yr="2009 -Current" 13 19 limit 17 to yr="2009 -Current" 21 20 18 or 19 34 |
na ontdubbeling 88 |
|
Embase (Elsevier) |
|
|
|
Cochrane library |
(labor:ab,ti OR labour:ab,ti OR childbirth:ab,ti OR birth*:ab,ti OR delivery:ab,ti OR parturient*:ab,ti) AND (epidural*:ab,ti OR cse:ab,ti OR pcea:ab,ti) AND (meperidin*:ab,ti OR pethidin*:ab,ti OR isonipecain:ab,ti OR dolsin:ab,ti OR dolosal:ab,ti OR dolin:ab,ti OR perindine:ab,ti OR dolantin:ab,ti OR dolargan:ab,ti OR lidol:ab,ti OR lydol:ab,ti OR demerol:ab,ti OR dolcontral:ab,ti OR (parenteral* NEXT/2 opoid*):ab,ti OR 'non-epidural':ab,ti OR nonepidural:ab,ti) Publication Year from 2009 to 2017 |

