Epidurale analgesie versus Pethidine
Uitgangsvraag
Wat is de effectiviteit van epidurale analgesie vergeleken met intramusculair (IM) pethidine bij zwangere vrouwen met het verzoek tot behandeling van de baringspijn?
Aanbeveling
Geef bij zwangeren met een verzoek om medicamenteuze pijnbehandeling tijdens de baring de voorkeur aan epidurale analgesie boven intramusculair toegediende pethidine.
De werkgroep is van mening dat intramusculair toegediende pethidine slechts plaats heeft als sedativum voor de start van de baring.
Zorg dat epidurale analgesie 24/7 beschikbaar is voor alle indicaties.
Disclaimer
Pethidine is in Nederland door de leverancier uit de handel genomen sinds 20-6-2024. Pethidine is alleen nog verkrijgbaar via import.
Overwegingen
De onderstaande overwegingen gelden in principe voor de gehele patiëntenpopulatie zoals geformuleerd in de uitgangsvraag.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De literatuur toont een superieur effect van epidurale analgesie in vergelijking tot intramusculair toegediende pethidine op reductie van de pijnintensiteitscore en een lagere cross-over naar andere opties voor de behandeling van pijn tijdens de baring. Er werd een gemiddeld verschil van 3 tot 4 punten op de VAS-schaal waargenomen. Dit is een klinisch relevant effect voor de patiënt. Meta-analyse van de uitkomstmaat tevredenheid laat geen significant of klinisch relevant verschil zien tussen de behandelcondities. Echter, deze uitkomstmaat is slechts beperkt in de literatuur gerapporteerd en in deze meta-analyse werden ook de zwangeren geïncludeerd die “reasonably satisfied” scoorden in de groep die aangaf zeer goede pijnstilling te ervaren. Indien deze analyse beperkt werd tot de groep die ‘completely satisfied’ scoorden, veranderde de interpretatie van het gepoolde effect niet, maar lijkt een trend naar meer tevredenheid in de epidurale groep waar te nemen. De sterkte van de bewijskracht voor de kritieke uitkomstmaat pijnintensiteit is volgens de GRADE-classificatie redelijk en voor tevredenheid zeer laag.
Potentieel nadelige effecten van epidurale analgesie zijn een hoger risico op maternale hypotensie, maternale koorts, motorisch blok en vaginale kunstverlossing. Echter, de uitkomstmaat vaginale kunstverlossing zou beïnvloed kunnen zijn door de hogere concentratie lokaal anestheticum die in het verleden werd gebruikt. De meest recente Cochrane review van Anim-Somuah (2018) laat geen verschil zien in het risico op vaginale kunstverlossing tussen epidurale analgesie en opioïden in het algemeen (inclusief pethidine, butorphanol, fentanyl, remifentanil, phenoperidine, tramadol), indien gestratificeerd wordt op jaartal 2005. Dit verschil wordt mogelijk verklaard door het gebruik van een lagere dosis lokaal anestheticum en toepassing van meer moderne vormen van epiduraal zoals PCEA. Echter, voor de vergelijking in deze specifieke uitgangsvraag, namelijk epidurale analgesie versus pethidine, bleek het verschil in risico op een vaginale kunstverlossing ook na stratificatie volgens deze subgroepen aanwezig. Hierbij moet benadrukt worden dat in alle studies in deze literatuuranalyse een relatief hoge dosering lokaal anestheticum werd toegediend (> 0,0625% (levo)bupivacaine of > 0,1% ropivacaine). Onderzoek naar effectiviteit en bijwerkingen van pethidine versus epidurale analgesie in lagere doseringen ontbreekt. Dit is een kennislacune. Daarentegen wordt bij neonaten waarvan moeders epidurale analgesie gehad hebben minder vaak een lage pH waarde in de a. umbilicalis waargenomen. De kritieke of belangrijke uitkomstmaten maternale en neonatale complicaties (bijvoorbeeld mortaliteit, langer durende hospitalisatie) worden in RCT’s niet-tot-nauwelijks beschreven aangezien deze zelden voorkomen.
Overige nadelige effecten van epidurale analgesie zijn opname van de neonaat voor antibiotische behandeling indien er een verdenking is op intra-uteriene infectie als gevolg van maternale koorts. Daarnaast wordt er tijdens gebruik van epidurale analgesie intermitterend gekatheteriseerd of een verblijfskatheter geplaatst. Een zeldzame maar zeer ernstige complicatie is het optreden van epiduraal hematoom.
Overige nadelige effecten van pethidine zijn maternale sedatie en neonatale sedatie. Deze neonatale sedatie wordt niet waargenomen in de literatuuranalyse middels een verschil in Apgarscore. Echter, de metaboliet van pethidine, norpethidine, heeft een zeer lange halfwaardetijd waarbij potentieel voedingsproblemen als gevolg van neonatale sufheid in de eerste levensdag kunnen optreden.
Waarden en voorkeuren van patiënten
In het kader van belasting van de patiënt wordt vanuit de patiënt het ‘niet in 1 keer goed prikken’ of ‘verkeerd zitten’ van de epiduraal, de verminderde bewegingsvrijheid en de toediening van een blaaskatheter als mogelijke nadelen genoemd.
Bij pethidine wordt mogelijke sufheid waardoor de bevalling minder bewust meegemaakt wordt en ook een verminderde bewegingsvrijheid als nadeel ervaren. Een geheel andere overweging voor zwangeren om te kiezen voor pethidine kan zijn dat de baring dan mogelijk verder begeleid kan worden door de eigen verloskundige. Dit speelt mee in de afweging van de verschillende opties door zwangeren. Zwangeren willen al tijdens de zwangerschap informatie over de verschillende vormen van pijnstilling, de voor- en de nadelen en wat dit betekent in hun situatie en willen hierover samen beslissen. Uit de meldactie blijkt dat dit nog onvoldoende in de praktijk gebeurt en vastgelegd wordt (PFN, 2018). Zie voor wijze van counselen en de vergelijking van de verschillende opties de module ‘Counseling: Samen beslissen‘.
Kosten (middelenbeslag)
Epidurale analgesie is duurder dan pethidine. Pethidine kost minder dan 5 euro per injectie en wordt toegediend zonder betrokkenheid van een anesthesioloog. Er is 1 studie die gekeken heeft naar kosten van epidurale analgesie versus parenteraal toegediende opioïden (dus niet alleen pethidine) (Macario, 2000). Deze Amerikaanse studie rapporteert een bedrag van 228 dollar voor betrokkenheid van de anesthesioloog. Economische analyse van de data van de RAVEL-trial toont totale kosten van epidurale analgesie rond de 150 euro per behandelde zwangere (Freeman, 2018).
Echter, epidurale analgesie tijdens de baring lijkt een lagere cross-over naar andere/aanvullende pijnmedicatie te geven in vergelijking tot behandeling met pethidine. Desalniettemin, zijn de totale kosten voor de te leveren zorg in de keuze voor pethidine of de epiduraal van meerdere factoren afhankelijk en niet zonder economische analyse volledig te duiden.
Aanvaardbaarheid voor de overige relevante stakeholders
Het aanbieden van epidurale analgesie vereist betrokkenheid en beschikbaarheid van een anesthesioloog. Hoewel formeel de aanbeveling is om in alle ziekenhuizen 24/7 deze mogelijkheid beschikbaar te hebben, lukt dit in de praktijk niet altijd mede vanwege andere spoedingrepen op het OK complex waarbij de betrokkenheid van de anesthesioloog vereist is.
Haalbaarheid en implementatie
De werkgroep is van mening dat epidurale analgesie beschikbaar moet zijn voor alle barende zwangeren die dat willen, 7 dagen per week 24 uur per dag. Dit houdt in dat in alle centra waar zwangeren bevallen 24/7 een anesthesioloog beschikbaar moet zijn voor het plaatsen van een epiduraal als de zwangere dat wenst. Echter, het kan voorkomen dat deze door werkzaamheden elders niet op zeer korte termijn beschikbaar is.
Daarnaast is er een groep zwangeren met een verzoek om pijnbehandeling die geen epidurale analgesie meer krijgen doordat de bevalling te vlot vordert De studies van Howell, 2001 en Logtenberg, 2016 onderstrepen dat. In deze studies kreeg een aanzienlijk percentage zwangeren, welke gerandomiseerd was voor epiduraal geen pijnbehandeling meer ondanks een verzoek daarom. Ook is er een groep zwangeren die om verscheidene redenen (bijvoorbeeld stollingsstoornissen) geen epiduraal kan krijgen, het is belangrijk om deze zwangeren een alternatief te kunnen bieden. De werkgroep is van mening dat pethidine niet het alternatief van eerste keus is vanwege het met name sedatieve, en weinig analgetische effect. Remifentanil PCA heeft een betere analgetische werking en zou daarom het middel van eerste keus zijn voor zwangeren die geen epidurale analgesie kunnen krijgen (zie de module ‘Remifentanil vs Epidurale analgesie, Pethidine of Tramadol’).
Vanzelfsprekend is goede voorlichting aan de zwangere over voor- en nadelen van de beschikbare methoden van pijnbehandeling een vereiste. Dit betekent dat idealiter zwangeren al in de zwangerschap worden voorgelicht over de mogelijke vormen van pijnbehandeling tijdens de bevalling en hun voor en nadelen. Deze voorlichting dient bovenstaande en eerder bij ‘waarden en voorkeuren patiënten’ genoemde overwegingen te bevatten en objectief gegeven te worden waarbij geen methoden worden uitgesloten om de keuzevrijheid van de zwangere te bevorderen.
Aanbeveling -1
Rationale
Ondanks dat de meta-analyse van enkele studies geen significant verschil in tevredenheid laat zien, is er een superieur effect van epidurale analgesie op de pijnintensiteit met een lagere cross-over naar aanvullende pijnmedicatie. Daarbij lijken de ongewenste effecten weinig ernstig of zeldzaam te zijn. Pethidine werkt met name sedatief en heeft een zeer beperkt analgetisch effect. Deze werking maakt dat pethidine niet de voorkeur heeft als pijnbehandeling tijdens de baring, en slechts nog plaats heeft als sedativum voor start van de baring. De werkgroep is van mening dat de gewenste effecten de ongewenste effecten van epidurale analgesie ten opzichte van pethidine overstijgen, indien er een wens en indicatie is voor pijnbehandeling tijdens de baring.
Aanbeveling-2
Rationale
Pethidine werkt met name sedatief en heeft een zeer beperkt analgetisch effect. Deze werking maakt dat pethidine niet de voorkeur heeft als pijnbehandeling tijdens de baring, en slechts nog plaats heeft als sedativum voor start van de baring. De werkgroep is van mening dat de gewenste effecten de ongewenste effecten van epidurale analgesie ten opzichte van pethidine overstijgen, indien er een wens en indicatie is voor pijnbehandeling tijdens de baring.
Aanbeveling-3
Rationale
Epidurale analgesie is superieur ten opzichte van pethidine in het verlagen van de pijnintensiteit tijdens de baring. Indien zwangeren om epidurale analgesie verzoeken of er een medische indicatie voor epidurale analgesie ontstaat, moeten zij op ieder moment van de dag de mogelijkheid hebben om de beste pijnbehandeling of de pijnstilling van hun keuze te krijgen.
Onderbouwing
Achtergrond
Volgens de huidige inzichten is epidurale analgesie de gouden standaard voor het behandelen van baringspijn. Desondanks worden er, vanwege onder andere logistieke redenen, of voorkeur van de barende of zorgverleners, regelmatig andere vormen van medicamenteuze pijnbehandeling tijdens de baring gebruikt. De vraag is hoe de effectiviteit, de tevredenheid en de veiligheid van het opioïd pethidine (IM) zich verhoudt tot die van de epidurale analgesie.
Conclusies / Summary of Findings
|
Redelijk GRADE |
Epidurale analgesie tijdens de baring biedt waarschijnlijk een grotere mate van pijnstilling in vergelijking tot behandeling met IM pethidine.
Bronnen: (Anim-Somuah, 2011) |
|
Redelijk GRADE |
Epidurale analgesie tijdens de baring geeft waarschijnlijk een lagere cross-over naar andere/aanvullende pijnmedicatie in vergelijking tot behandeling met IM pethidine.
Bronnen: (Anim-Somuah, 2011) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in tevredenheid en aanzien van de pijnstilling tijdens de baring tussen zwangeren behandeld met epidurale analgesie en zwangeren behandeld met IM pethidine.
Bronnen: (Anim-Somuah, 2011) |
|
Redelijk GRADE |
Zwangeren behandeld met epidurale analgesie tijdens de baring hebben waarschijnlijk een hoger risico op vaginale kunstverlossing in vergelijking tot behandeling met IM pethidine.
Bronnen: (Anim-Somuah, 2011; Sweed, 2011) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op een sectio caesarea tussen zwangeren behandeld met epidurale analgesie en zwangeren behandeld met IM pethidine.
Bronnen: (Anim-Somuah, 2011; Sweed, 2011) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op hoofdpijn tussen zwangeren initieel behandeld met epidurale analgesie en zwangeren behandeld met IM pethidine tijdens de baring.
Bronnen: (Anim-Somuah, 2011) |
|
Laag GRADE |
Zwangeren behandeld met epidurale analgesie tijdens de baring lijken een groter risico te hebben op maternale hypotensie in vergelijking tot behandeling met IM pethidine.
Bronnen: (Anim-Somuah, 2011; Sweed, 2011) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op motorische blokkade tussen zwangeren initieel behandeld met epidurale analgesie en zwangeren behandeld met IM pethide tijdens de baring.
Bronnen: (Anim-Somuah, 2011) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op misselijkheid en braken tussen zwangeren behandeld met epidurale analgesie en zwangeren behandeld met IM pethidine tijdens de baring.
Bronnen: (Anim-Somuah, 2011; Sweed, 2011) |
|
Redelijk GRADE |
Zwangeren behandeld met epidurale analgesie tijdens de baring hebben waarschijnlijk een groter risico op maternale koorts in vergelijking tot behandeling met IM pethidine.
Bronnen: (Anim-Somuah, 2011; Sweed, 2011) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op urineretentie tussen zwangeren behandeld met epidurale analgesie en zwangeren behandeld met IM pethidine tijdens de baring.
Bronnen: (Anim-Somuah, 2011) |
|
Redelijk GRADE |
Epidurale analgesie tijdens de baring resulteert waarschijnlijk in een langere bevallingsduur van gemiddeld 27 minuten tijdens de ontsluiting en gemiddeld 16 minuten tijdens de uitdrijving in vergelijking tot behandeling met IM pethidine.
Bronnen: (Anim-Somuah, 2011; Sweed, 2011) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op jeuk tussen zwangeren behandeld met epidurale analgesie en zwangeren behandeld met IM pethidine tijdens de baring.
Bronnen: (Sweed, 2011) |
|
Redelijk GRADE |
Neonaten van zwangeren behandeld met epidurale analgesie tijdens de baring hebben waarschijnlijk een lager risico op een pH a. umbilicalis < 7.2 in vergelijking tot behandeling met IM pethidine.
Bronnen: (Anim-Somuah, 2011) |
|
Laag GRADE |
Er lijkt geen verschil in het risico voor NICU opname tussen neonaten van zwangeren behandeld met epidurale analgesie en neonaten van zwangeren behandeld met IM pethidine tijdens de baring.
Bronnen: (Anim-Somuah, 2011) |
|
Laag GRADE |
Er lijkt geen verschil in de Apgarscore < 7 bij 5 minuten tussen neonaten van zwangeren behandeld met epidurale analgesie en neonaten van zwangeren behandeld met IM pethidine tijdens de baring.
Bronnen: (Anim-Somuah, 2011) |
Samenvatting literatuur
Beschrijving studies
De Cochrane-review van Anim-Somuah (2011) includeerde 16 RCT’s (Clark, 1998; Evron, 2007; Head, 2002; Hogg, 2000; Howell, 2001; Loughnan, 2000; Lucas, 2001; Muir, 1996; Nafisi, 2006; Philipsen, 1989; Ramin, 1995; Sharma, 1997; Sharma, 2002; Thalme, 1974; Thorp, 1993; Witoonpanich, 1984) waarin epidurale analgesie werd vergeleken met pethidine. De overige studies uit deze meta-analyse beschreven andersoortige pijnmedicatie en zijn om die reden geëxcludeerd. In totaal werden 5522 zwangeren met baringspijn geïncludeerd. De uitkomstmaten van deze review werden geüpdatet en waar mogelijk gepoold met de resultaten van twee recentere RCT’s waarin tevens de effectiviteit en veiligheid van epidurale analgesie met pethidine tijdens de baring vergeleken werd (Sweed, 2011; Jalil, 2009). De RCT van Sweed (2011) includeerde 60 nulliparae a terme met een ontsluiting van 5 cm. De zwangeren werden gerandomiseerd over de volgende 5 groepen 1) CSE met lidocaïne, 2) CSE met bupivacaïne, 3) epiduraal met lidocaïne, 4) epiduraal met bupivacaïne of 5) pethidine. De data van de CSE-groep werden voor deze uitgangsvraag geëxcludeerd. Jalil (2009) includeerde 192 zwangeren en randomiseerde naar epidurale analgesie of pethidine. Bij epidurale analgesie werden in de individuele studies verschillende lokale anesthetica en opioïden gebruikt in diverse doseringen. Ook bij pethidine werd in de verschillende studies gebruik gemaakt van diverse doseringen.
Resultaten
Pijnintensiteit
De Cochrane review van Anim-Somuah (2011) includeerde 3 studies (n=1369 zwangeren) waarin de pijnintensiteit gedurende de baring middels een VAS 0 tot 10 schaal (Hogg, 2000; Ramin, 1995; Nafisi, 2006) gerapporteerd werd. De data van 7 andere studies konden niet gepoold worden vanwege verschillende tijdsintervallen (Thorp, 1993; Jalil, 2009), het rapporteren van de mediaan (Philipsen, 1989), onduidelijkheid van de data (Muir, 1996) of presentatie enkel in figuren (Sharma, 1997; Sharma, 2002; Sweed, 2011; Yayci, 2011). Twee studies (Hogg, 2000; Ramin, 1995) rapporteerden de pijnintensiteit gedurende de gehele bevalling (n=974 zwangeren). Epidurale analgesie had een groter effect op de ervaren pijnverlichting dan pethidine met een gepoold gemiddeld verschil van -3,88 (95% BI: -6,22 tot -1,53). Er was sprake van een grote mate van heterogeniteit (I2 93%). Nafisi (2006) (n=395 zwangeren) rapporteerde pijnintensiteit gedurende ontsluiting en uitdrijving. Ook hier bleek epidurale analgesie een grotere pijnverlichting te bieden dan pethidine tijdens zowel de ontsluiting (gemiddeld verschil van -3,0 (95% BI: -3,7 tot -2,3) als de uitdrijving (gemiddeld verschil van -4,0 (95% BI: -6,82 tot -1,18). Jalil, 2009 rapporteerde de gemiddelde VAS-score op een 100 mm schaal op 15 minuten na start analgesie en bij volledige ontsluiting. Ook in deze studie was de VAS-score significant lager op beide tijdspunten in de epidurale groep (gemiddelde ± SD VAS bij 15 min: 1,3 ± 3,7; gemiddelde VAS bij volledige ontsluiting: 25,1 ± 15,3) in vergelijking tot de pethidine groep (gemiddelde ± SD VAS bij 15 min: 68,6 ± 14,2; gemiddelde VAS bij volledige ontsluiting: 94,4 ± 13,5).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijnintensiteit is met één niveau verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias in de individuele studies). Er werd niet afgewaardeerd voor imprecisie (de effectschatter en het betrouwbaarheidsinterval liggen boven de grens voor klinische relevantie). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
Cross-over naar andere/aanvullende pijnmedicatie
De Cochrane review van Anim-Somuah (2011) beschreef 10 studies (n=3570 zwangeren) waarin aanvullende pijnmedicatie gerapporteerd werd. Deze uitkomstmaat werd niet gerapporteerd in de studies van Sweed (2011) en Yayci (2011). Zwangeren met epidurale pijnstilling hadden significant minder behoefte aan andere/aanvullende pijnmedicatie (RR 0,11, 95% BI: 0,04 tot 0,30) vergeleken met zwangeren die behandeld werden met pethidine. Er was sprake van substantiële heterogeniteit (I2 74%).
Figuur 1 Cross-over naar andere/aanvullende pijnmedicatie
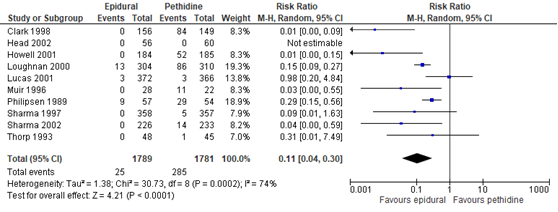
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat cross-over naar andere/aanvullend pijnmedicatie is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
Tevredenheid ten aanzien van pijnstilling
De Cochrane review van Anim-Somuah uit 2011, includeerde 3 studies (Howell, 2001; Ramin, 1995; Sharma, 2002) waarbij tevredenheid ten aanzien van de pijnstilling werd gerapporteerd (n=1666 zwnageren). De data van Jalil (2009) konden niet worden gepoold aangezien enkel de gemiddelde score van een categoriale-schaal (gemiddelde uit 4= excellent; 3= goed; 2= voldoende; 1= slecht) werd weergegeven. De studie van Sweed (2011) rapporteerde deze uitkomstmaat niet. Tevredenheid werd in alle studies gemeten middels een dichotome schaal en het percentage zwangeren dat de pijnstilling als ‘zeer goed’ of ‘excellent’ aanduidde werd gerapporteerd. In de studie van Howell (2001) werden deze groepen beschreven als ‘reasonably satisfied’ en ‘completely satisfied’. Er bleek geen significant verschil tussen de epiduraal en pethidine in tevredenheid ten aanzien van de pijnstilling (RR 1,56, 95% BI: 0,87 tot 2,80). Er was sprake van substantiële heterogeniteit, (I2 99%). Indien uit de studie van Howell (2001) enkel de data van de groep ‘completely satisfied’ werd gepooled (98/170 en 81/168) veranderde de interpretatie van het gepoolde effect niet (RR 1,64, 95% BI: 1,00 tot 2,69). Echter, een trend naar meer tevredenheid in de epidurale groep lijkt waar te nemen.
Figuur 2 Tevredenheid ten aanzien van pijnstilling
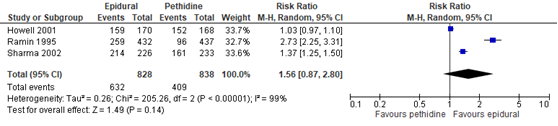
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat tevredenheid ten aanzien van pijnstilling is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), de heterogeniteit in de puntschatters (inconsistentie) en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Wijze van bevallen/ modus partus - vaginale kunstverlossing
De Cochrane review van Anim-Somuah (2011) includeerde 13 studies waarbij vaginale kunstverlossing als uitkomstmaat werd meegenomen (welke in de individuele studies gedefinieerd als forceps/ vacuüm of niet nader gedefinieerd). Deze data werden aangevuld met de resultaten van de RCT van Jalil (2009) en Sweed (2011) (totaal n=5107 zwangeren). Het risico op een vaginale kunstverlossing was groter bij de zwangeren gerandomiseerd naar de epidurale analgesie (RR 1,56, 95% BI: 1,35 tot 1,82) in vergelijking met zwangeren die pethidine kregen. Er was sprake van een matige heterogeniteit (I2 46%).
Figuur 3 Instrumentele vaginale bevalling
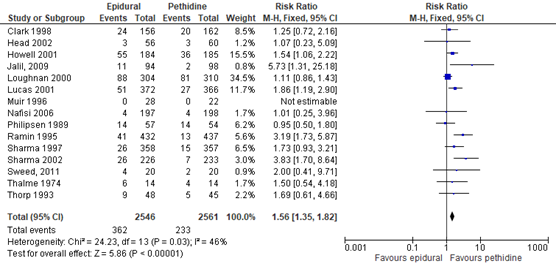
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd) aangevuld met RCT van Jalil (2009) en Sweed (2011)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat instrumentele vaginale bevalling is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
Wijze van bevallen/ modus partus - sectio caesarea
De Cochrane review van Anim-Somuah (2011) includeerde 14 studies waarbij sectio caesarea als uitkomstmaat werd meegenomen. Deze data werden aangevuld met de resultaten van de RCT van Jalil (2009) en Sweed (2011) (totaal n=5212 zwangeren). Het risico op een sectio caesarea bleek niet significant te verschillen tussen zwangeren gerandomiseerd naar de epidurale analgesie (RR 1,14, 95% BI: 0,97 tot 1,34) ten opzichte van de zwangeren die pethidine kregen. Er was sprake van een matige heterogeniteit (I2 25%).
Figuur 4 Sectio caesarea
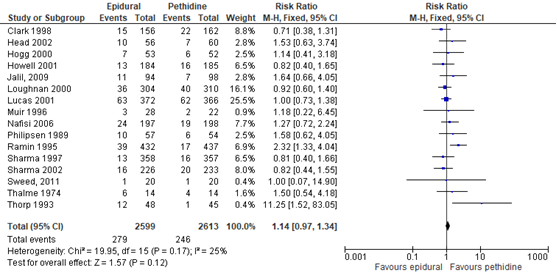
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd) aangevuld met RCT van Jalil (2009) en Sweed (2011)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat sectio caesarea is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en overschrijding van de grens voor klinische relevantie aan de rechterkant (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Maternale complicaties
Hoofdpijn
De Cochrane review van Anim-Somuah (2011) includeerde 1 studie (n=116 zwangeren) waarin hoofdpijn als uitkomstmaat werd meegenomen. Deze uitkomstmaat werd niet gerapporteerd in de studies van Sweed (2011) en Jalil (2009). Er was geen significant verschil tussen de groepen in het risico op hoofdpijn (RR 0,96, 95% BI: 0,67 tot 1,40).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat hoofdpijn is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), het geringe aantal patiënten en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Hypotensie
In totaal rapporteerden 6 studies uit de Cochrane-review van Anim-Somuah (2011) de uitkomstmaat maternale hypotensie. De definitie van hypotensie werd niet door de individuele studies gerapporteerd. Van 4 studies waren de data geschikt voor analyse (n=1354 zwangeren). Deze data werden aangevuld met de resultaten van de RCT van Sweed (2011). Hypotensie werd niet gerapporteerd in de studie van Jalil (2009). Zwangeren met epidurale analgesie hadden een significant hoger risico op hypotensie (RR 16,81, 95% BI: 3,27 tot 80,40). Er was sprake van substantiële heterogeniteit (I2 46%).
Figuur 5 Hypotensie
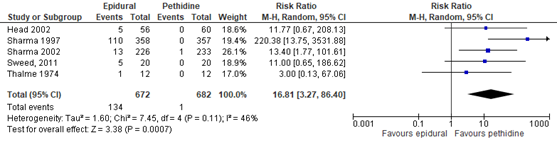
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd) aangevuld met RCT van Sweed (2011)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat hypotensie is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en mogelijke bias door matige heterogeniteit in de uitkomstmaat (I2 46%). De individuele studies rapporteerden geen definitie van maternale hypotensie, waardoor deze substantieel kan verschillen. Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Motorisch blok
Mate van motorisch blok werd gerapporteerd in 1 studie (n=110 zwangeren) van de Cochrane-review van Anim-Somuah (2011). De studies van Sweed (2011) en Jalil (2009) beschreven dat de mate van motorisch blok wel gemeten werd, maar rapporteerden hierover geen resultaten van beide groepen. Zwangeren die behandeld werden middels epidurale analgesie hadden een significant hoger risico op motorisch blok (RR 31,8, (95% BI: 1,96 tot 517,9) in vergelijking met de zwangeren behandeld middels pethidine.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat motorisch blok is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), het zeer geringe aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Misselijkheid en braken
De bijwerking misselijkheid en braken werd gerapporteerd in 4 studies (n=1590 zwangeren) van de Cochrane-review van Anim-Somuah (2011). Deze data werden aangevuld met de resultaten van de RCT van Sweed (2011). Deze uitkomstmaat werd niet gerapporteerd in de studie van Jalil (2009). Er werd geen significant verschil gerapporteerd in het risico op misselijkheid en braken tussen de groepen (RR 0,99, 95% BI: 0,60 tot 1,62). Er was sprake van substantiële heterogeniteit (I2 68%).
Figuur 6 Misselijkheid en braken
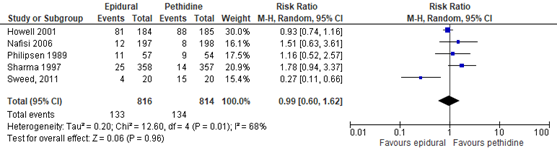
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd) aangevuld met RCT van Sweed (2011)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat misselijkheid en braken is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Temperatuur
De uitkomstmaat temperatuur werd beschreven als koorts, gedefinieerd als een temperatuur ≥ 38 ⁰C. Deze uitkomstmaat werd gerapporteerd in 4 studies (n=2307 zwangeren) van de Cochrane-review van Anim-Somuah (2011). Deze data werden gepoold met de resultaten van de RCT van Sweed (2011) (n=40). Deze uitkomstmaat werd niet gerapporteerd in de studie van Jalil (2009). Zwangeren met epidurale analgesie hadden een significant hoger risico op maternale koorts (RR 3,64, 95% BI: 2,83 tot 4,69) ten opzichte van de zwangeren behandeld met pethidine. Er was geen sprake van heterogeniteit (I2 0%).
Figuur 7 Temperatuur (koorts)
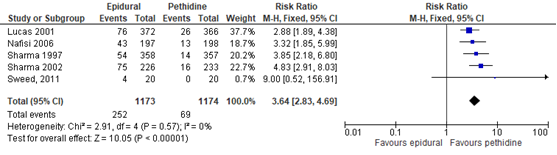
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd) aangevuld met RCT van Sweed (2011)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat temperatuur is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias in de individuele studies). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
Urineretentie
Urineretentie werd gerapporteerd in 1 studie (n=111 zwangeren) van de Cochrane-review van Anim-Somuah (2011). Deze uitkomstmaat werd niet gerapporteerd in de studies van Sweed (2011) en Jalil (2009). Er was geen significant verschil tussen de groepen in risico op urineretentie (RR 5,68, 95% BI: 0,71 tot 45,68).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat urineretentie is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), het geringe aantal patiënten en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Bevallingsduur
De duur van de ontsluitingsfase werd gerapporteerd in 6 studies (n=2362 zwangeren) van de Cochrane review van Anim-Somuah (2011). Deze data werden aangevuld met de resultaten van de RCT van Sweed (2011) (n=40). Deze uitkomstmaat werd niet gerapporteerd in de studie van Jalil (2009). Zwangeren behandeld met epidurale analgesie hadden een significant langere duur van de ontsluiting (gemiddeld verschil 30,87 min, 95% BI: 9,84 tot 51,90) dan zwangeren behandeld met pethidine. Er was sprake van substantiële heterogeniteit (I2 60%).
Figuur 8 Bevallingsduur tijdens de ontsluiting (minuten)
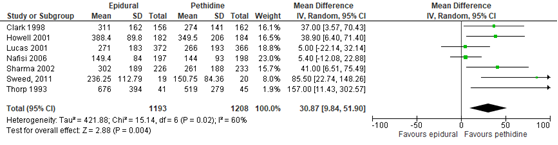
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd) aangevuld met RCT van Sweed (2011)
De duur van de uitdrijving werd gerapporteerd in 7 studies (n=2450 zwangeren) van de Cochrane review van Anim-Somuah (2011). Deze data werden aangevuld met de resultaten van de RCT’s van Jalil (2009) (n=192) en Sweed, 2011 (n=40). Zwangeren behandeld met epidurale analgesie hadden een significant langere duur van de uitdrijving (gemiddeld verschil van 13,67 min, 95% BI: 9,12 tot 18,22) dan zwangeren behandeld met pethidine. Er was sprake van substantiële heterogeniteit (I2 55%).
Figuur 9 Bevallingsduur tijdens de uitdrijving (minuten)
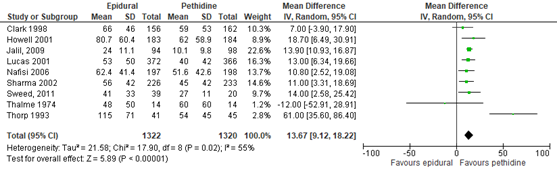
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Anim-Somuah (2011) (interventies met pethidine/meperidine geselecteerd) aangevuld met RCT’s van Jalil (2009) en Sweed (2011)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bevallingsduur is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias in de individuele studies). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
Jeuk
Sweed (2011) (n=40) rapporteerde dat de klacht jeuk niet voorkwam in de epiduraal of pethidine groep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat jeuk is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het zeer geringe aantal patiënten. Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Neonatale complicaties
pH a. umbilicalis
De Cochrane review van Anim-Somuah (2011) rapporteerde een pH a. umbilicalis <7,2 als ‘Acidosis’, welke in 7 studies (n=2782 zwangeren) gerapporteerd werd als uitkomstmaat. In één studie (Evron, 2007) uit de Cochrane review van Anim-Somuah (2011) werd enkel de gemiddelde (SD) pH waarde gerapporteerd, waardoor deze studie niet geïncludeerd kon worden in de gepoolde analyse. Deze uitkomstmaat werd niet gerapporteerd in de studies van Sweed (2011) en Jalil (2009). Neonaten van zwangeren behandeld met epidurale analgesie hadden een significant lager risico op een pH a. umbilicalis <7,2 (RR 0,76, 95% BI: 0,63 tot 0,92) vergeleken met zwangeren behandeld met pethidine. Er was geen sprake van heterogeniteit (I2 0%).
Figuur 10 pH a. umbilicalis <7.2
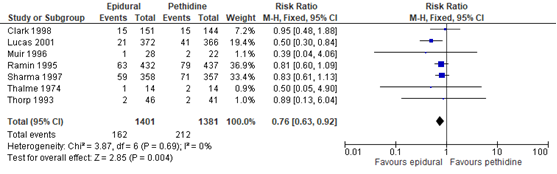
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pH a. umbilicalis is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias in de individuele studies). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
Opname NICU
De Cochrane review van Anim-Somuah (2011) includeerde 6 studies (n=3011 zwangeren) waarbij neonatale opname in een special care unit/intensive care unit werd gerapporteerd. Deze uitkomstmaat werd niet gerapporteerd in de studies van Sweed (2011) en Jalil (2009). Er bleek geen significant verschil tussen de groepen in opname in neonatale intensive care units (RR 1,17, 95% BI: 0,92 tot 1,48). Er was sprake geen sprake van heterogeniteit (I2 0%).
Figuur 11 Opname NICU
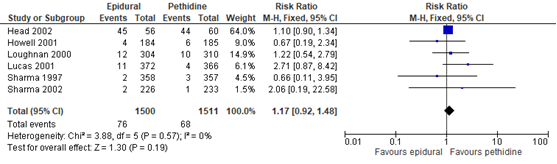
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat opname NICU is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Apgarscore
De Cochrane review van Anim-Somuah (2011) includeerde 11 studies waarbij een Apgarscore <7 bij 5 min gerapporteerd werd. Ook de RCT’s van Jalil (2009) en Sweed (2011) rapporteerden de Apgarscores. Echter, de data waren alleen geschikt voor analyse in 11 studies (n=4314 zwangeren). Er bleek geen significant verschil tussen de groepen in Apgarscore (RR 0,74, 95% BI: 0,46 tot 1,16). Er was geen sprake van heterogeniteit (I2 0%).
Figuur 12 Apgarscore
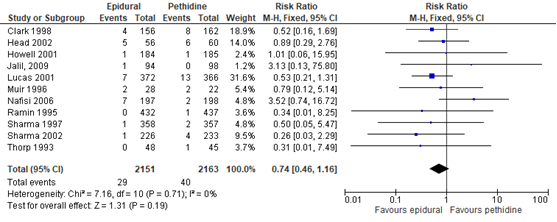
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Apgarscore is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Geen van de studies naar het effect van epiduraal versus pethidine (IM) rapporteerde de uitkomstmaten: foetale hartslag afwijkingen, borstvoeding, convulsie/ eclamptisch insult, fluxus postpartum, mortaliteit, negatieve uitkomsten voor de baby op lange termijn of kosten.
Toelichting op de studiedesigns
De geïncludeerde studies varieerden in patiënt karakteristieken, bevallingsprotocollen en aangeboden vorm van epidurale behandeling (PCEA of CEI), zo gaven de oudere studies juist bolus/top ups in plaats van PCEA of CEI. Deze factoren kunnen het verloop van de bevalling, de mate van pijnstilling en overige uitkomstmaten mogelijk beïnvloeden. Het samenvoegen van studies waarbij zowel hoge als lage concentraties van lokaal anestheticum voor epidurale analgesie worden aangeboden en studies waarbij de epiduraal gecontinueerd wordt tijdens de uitdrijving versus studies waarbij deze eerder gestaakt wordt, kunnen enkele uitkomstmaten (zoals bevallingsduur of vaginale kunstverlossing) mogelijk beïnvloeden. Subgroep analyses op basis van pariteit, spontane versus ingeleide bevalling en dergelijke werd in de Cochrane review van Anim-Somuah (2011) overwogen, echter, gegevens van deze subgroepen werden nauwelijks in de individuele studies gerapporteerd waardoor subgroep analyse niet mogelijk was. De resultaten van de literatuuranalyse dienen daarom voorzichtig geïnterpreteerd te worden, rekening houdend met bovenstaande punten.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van epidurale analgesie vergeleken met pethidine (IM) bij zwangere vrouwen met het verzoek tot behandeling van de baringspijn?
P: zwangere vrouwen met met het verzoek tot behandeling van de baringspijn;
I: epiduraal;
C: pethidine (IM);
O: zie onderstaand:
- Pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument).
- Cross-over naar andere/ aanvullende pijnmedicatie.
- Tevredenheid ten aanzien van pijnstilling (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument).
- Borstvoeding.
- Wijze van bevallen (vaginale kunstverlossing, sectio caesarea).
- Maternale complicaties: convulsie/ eclamptisch insult, fluxus postpartum, ademhalingsdepressie, bevallingsduur, hypotensie, temperatuur, urineretentie, misselijkheid/braken, jeuk, mate van motorisch blok, (postspinale punctie) hoofdpijn, epiduraal abces/ hematoom.
- Neonatale complicaties: opname NICU, Apgarscore < 7 bij 5 min, foetale hartslag afwijkingen, temperatuur, pH a. umbilicalis, mortaliteit, negatieve uitkomsten voor de baby op lange termijn.
- Kosten.
Relevante uitkomstmaten
De werkgroep achtte pijnintensiteit, tevredenheid en maternale en neonatale sterfte voor de besluitvorming kritieke uitkomstmaten; en modus partus voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt: pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument) en tevredenheid (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument), waarbij scores door de patiënt zelf gedurende of direct na de bevalling gerapporteerd werden. Voor neonatale Apgarscore wordt de definitiescore van < 7 bij 5 minuten aangehouden. Voor de overige uitkomstmaten definieerde de werkgroep niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Naast significantie wordt de klinische besluitvorming vooral bepaald door de klinische relevantie van de waargenomen verschillen tussen behandelopties. Voor dichotome uitkomstmaten definieerde de werkgroep een minimaal klinisch (patiënt) relevant verschil volgens de grenzen van de GRADE working group, namelijk een verschil in relatief risico van 25%. Voor de continue kritieke uitkomstmaten definieerde de werkgroep een verschil van 10% op pijnintensiteit of tevredenheid als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
Het betreft een literatuurzoekactie gebaseerd op de Cochrane systematische review van Anim-Somuah (2011). In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 04 december 2017 met relevante zoektermen gezocht naar studies die pijnbehandeling middels de epiduraal vergeleken met pethidine (IM) bij zwangeren met baringspijn. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 88 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Studiedesign RCT.
- Gepubliceerd tussen 1 januari 2009 en 04 december 2017.
- Voldoet aan de PICO.
- Beschrijven van minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 13 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 10 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 3 studies definitief geselecteerd. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
NB: op 21 mei 2018 werd een update van de Cochrane-review van Anim-Somuah (2011) gepubliceerd (Anim-Somuah, 2018). Twee nieuwe RCT’s werden in deze meta-analyse geïncludeerd. Deze studies zijn ook als aanvullende RCT’s beschreven in onderstaande literatuuranalyse. De studie van Sabry (2011) beschrijft het studieprotocol van de aanvullende RCT van Sweed (2011) welke in onderstaande literatuuranalyse al geïncludeerd werd. Ook de studie van Jalil (2009) is in onderstaande literatuuranalyse geïncludeerd . Een update van de literatuuranalyse naar aanleiding van de Cochrane-review uit 2018 werd dan ook niet nodig geacht.
Referenties
- Macario A, Scibetta WC, Navarro J, Riley E. Analgesia for labor pain: a cost model. Anesthesiology. 2000 Mar;92(3):841-50. PubMed PMID: 10719963.
- Logtenberg S, Oude Rengerink K, Verhoeven CJ, Freeman LM, van den Akker E, Godfried MB, van Beek E, Borchert O, Schuitemaker N, van Woerkens E, Hostijn I, Middeldorp JM, van der Post JA, Mol BW. Labour pain with remifentanil patient-controlled analgesia versus epidural analgesia: a randomised equivalence trial. BJOG. 2016 Mar;124(4):652-660. Epub 2016 Jun 27. PubMed PMID: 27348853.
- Jalil NA, Omar M. Does ropivacaine 0.2% with fentanyl change the labour epidural profile? International Medical Journal 2009;16(2):149–55.
- Sweed N, Sabry N, Azab T, Nour S. Regional versus IV analgesics in labor. Minerva Med. 2011 Oct;102(5):353-61. PubMed PMID: 22193345.
- Howell CJ, Kidd C, Roberts W, Upton P, Lucking L, Jones PW, et al. A rocess ed control trial of epidural compared with non-epidural analgesia in labour. BJOG: an international journal of obstetrics and gynaecology 2001;108 (1):27–33.
- Anim-Somuah M, Smyth RM, Cyna AM, Cuthbert A. Epidural versus non-epidural or no analgesia for pain management in labour. Cochrane Database Syst Rev. 2018 May 21;5:CD000331. PubMed PMID:29781504.
- Freeman L, Middeldorp J, van den Akker E, Oudijk M, Bax C, van Huizen M, et al. (2018) An economic analysis of patient controlled remifentanil and epidural analgesia as pain relief in labour (RAVEL trial); a randomised controlled trial. PLoS ONE 13(10): e0205220.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de effectiviteit van epidurale analgesie vergeleken met pethidine bij zwangere vrouwen met het verzoek tot behandeling van de baringspijn?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control I
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Anim-Somuah, 2011
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of 17 RCTs
Literature search up to 20 Sept 2011
A: Clark, 1998 B: Evron, 2007 C: Gambling, 1998 D: Head, 2002 E: Hogg, 2000 F: Howell, 2001 G: Loughnan, 2000 H: Lucas, 2001 I: Muir, 1996 J: Nafisi, 2006 K: Philipsen, 1989 L: Ramin, 1995 M: Sharma, 1997 N: Sharma, 2002 O: Thalme, 1974 P: Thorp, 1993 Q: Witoonpanich, 1984
Study design: RCTs
Setting and Country: A: University of Louisville Hospital, USA. B: Department of Obstetrics and Gynecology, Israel C: University of Texas, USA D: Hospital, USA E: Hospital, USA F: Hospital, UK G: Hospital, England H: hospital, USA I: hospital, Canada J: single centre hospital, Iran K: hospital, Denmark L: university of Texas South-western Medical Center, USA M: single center hospital, USA N: hospital, USA O: hospital, Sweden P: hospital, USA Q: Chula-longkorn University, Thailand
Source of funding: Not specified.
|
Inclusion criteria SR: RCTs comparing all modalities of epidural with any form of pain relief not involving regional blockade, or no pain relief in labour.
Exclusion criteria SR: quasi-RCTs were excluded
17 studies included (data from studies other than Pethidine interventions were not extracted)
Important patient characteristics at baseline:
N, population: A: 318 B: 60 C: 1223 D: 116 E: 105 F: 369 G: 616 H: 738 I: 50 J: 395 K: 112 L: 1300 M: 715 N: 459 O: 28 P: 93 Q: 62
Groups comparable at baseline? Not specified in review. |
Describe intervention: Epidural analgesia
A: epidural, test dose of 3ml 1% lidocaine with epinephrine, followed by 9ml 0.25% bupi with 50μg fenta in 3 divided doses at 10-min intervals, if vital signs remained stable during the subsequent 15min, continuous infusion of 0.125% bupi with 1μg/ml fenta at 12ml/h and titrated to maintain anaesthesia to the T10 dermatome level. B: PCEA with 0.2% ropivacaine. C: CSE: spinal block with 10ug sufentanil. Needle-trough-needle approach. Following dissipation of spinal, epidural analgesia achieved with 0.25% bupi in 3-5ml increments to achieve T10-T8 sensory level. This was followed by epi infusion 0.125% bupi and 2ug/ml fentanyl at 8ml/h. Infusionrate halved in 2nd stage labour. D: Test dose of 0.25% bupi ml, then bolus doses 3-5 ml 0.25% bupi to obtain T-10 sensory level, maintained by continuous infusion of 0.125% bupi with 2ug fentanyl at rate of 10 ml/hr. E: Epidural analgesia (no further information). F: 10ml of 0.25% bupi. Followed by to-ups of 0.2% 5-10ml as required. G: 0.25% bupi 10ml followed by infusion of 0.125% bupi at 10ml/hr until 2nd stage. Lignocaine 2% administered for instrumental caesarean delivery. H: epidural with boluses of 0.25% bupi with 2 mg/ml fentanyl. I: epidural of 0.125% bupi with adrenaline, 10-15ml plus pethidine 25mg, followed by PCA (bupi 0.125%, adrenaline plus pethidine 0.5 mg/ml, 4 ml boluses, lockout 15-min). J: 10ml bolus 1%l lido via epi catheter as a loading dose. Mini-doses of 1% lido administered at a rate of 1ml every 6min. Boluses of 2ml 1% lido injected to over-come inadequate analgesia and achieve bilateral block between the T-10 and T-8 sensory level. If additional analgesia needed during labour, 2ml of 1% lido solution provided epidurally. K: epidural bupi 0.375% (1ml per 10kg) by intermittent top-up. T10-L1 block. L: epidural analgesia with 3ml increments bupi 0.25% to achieve a bilateral t-10 sensory level. Followed by continuous epiural infusion of 0.125% bupi with 2ug/mL fentanyl at 8-10mL/hr. Infusion was titrated to achieve a max of T8 sensory level. M: epidural continuous infusion with 0.125% bupi with 2ug.mL fentanyl. N: epidural 0.25% bupi in 3ml increments till T10 sensory level. Then infusion of 0.0625% bupi with 2ug/ml fentanyl at 6ml/h with 5ml boluses every 15-min prn using PCA pump. O: epidural bupi 0.25% with adrenaline 6-8ml by intermittent top-up. P: epidural: bupi 0.25% bolus dose followed by 0.25% bupi infusion. Block to T10-T12. 2nd stage epidural use continued. Q: continuous lumbar epidural analgesia. Standard precautions for epidural were taken throughout, bupi was intermittently given to provide painless labour.
|
Describe control: Pethidine
A: meperidine IV: 50-75mg every 90min as needed. B: PCA with meperidine. C: 50mg meperidine + 25mg promethazine hydrochloride IV. Further, 50mg IV meperidine on request hourly to a mx of 200mg in 4hrs. D: PCA IV meperidine dose of 10mg and lockout interval of 10-min. Max dose of 240mg in 6hrs also had IV promethazine 25mg 4 hourly. E: IV PCA meperidine (no further information). F: Pethidine 50-100mg IM. G: pethidine 100mg IM. H: IV bolus of 50mg meperidine with 25mg promethazine followed by PCA infusion up to 15mg every 10-min. I: IV pethidine by PCA pump (up to 1 mg/kg loading dose, followed by 10mg boluses, lockout 10-min). J: meperidine single dose 25-50mg (0.5mg/kg) IV at 4cm uterine cervical dilatation. K: pethidine 75mg IM (x 1-2), nitrous oxide/oxygen inhalation, or pudendal block (20ml mepivacaine) in 2nd stage. L: IV meperidine 50mg with 25mg of promethazine hydrochloride IV. Additional doses of 50mg were given on request to a max of 200mg in 4 hrs. M: PCA with meperidine, additional doses given on request. N: 50mg IV meperidine with 25mg promethazine followed by PCA pump delivering 15mg meperidine every 15-min until delivery. Additional 25mg given on request, max of 100mg in 2hr. O: pethidine 100mg x 1 (route not stated), chlorpromazine 12.5mg x 1, then Entonox, pudenal block for delivery using 20ml 1% prilocaine. P: 75mg pethidine and 25mg promethazine IV every 90min as required. Q: pethidine or pentazocine given IM.
|
End-point of follow-up: Up until delivery for all RCTs
For how many participants were no complete outcome data available? (intervention/control) A: because of crossover, data were analyzed with respect to patients who were compliant with the assigned analgesic method. 78 of 162 (48.1%) received IV meperidine and 147 of 156 (94.2%) of the epidural group. B: 4 exclusions (3 cesarean sections and 1 parturient in control group demanded epidural). C: Crossover participants were analyzed in their original groups. D: 10 women did not receive their allocated treatment (rapid labour, discretion of anesthesiologist, nausea complaints). E: 10 did not received the assigned intervention. F: Women in the epidural and control group remain in the group to which they were initially allocated, regardless of the method of pain relief given in labour. G: All participants analyzed in their original groups with no loss. H: 77 women did not receive allocated treatment, but analyses was reported according to intent-to-treat. I: insufficient information. J: All patienrocessedsed appear accounted for in the results. K: no patient loss. L: substantial loss of patients from both groups due to not following the allocated protocol (35% loss in epi group, 34% loss in the IV group). M: of the 357 women allocated to epidural, 259 completed the study as allocated. Of 358 women allocated to control group, 243 completed study as allocated. N: 14 who received IV meperidine crossed over to epidural because of in- adequate pain relief, and 24 women refused their allocated analgesia and received other analgesia. All included in ITT analysis. O: not stated if any women did not receive their allocated treatment. P: No loss of patients and cross over patients analysed in their original groups. Q: abstract only, data limited.
|
Outcome measure-1 Pain relief – during labour Pooled effect (random effects model): -3.88 (95% CI -6.22 to -1.53) favoring epidural Heterogeneity (I2 93%).
Pain relief – 1st stage of labour (mean difference) -3.00 (95% CI -3.70 to -2.30) favoring epidural
Pain relief – 2nd stage of labour (mean difference) -4.00 (95% CI -4.50 to -3.50) favoring epidural
Outcome measure-2 Need for additional means of pain relief Pooled Risk Ratio (M-H random model): 0.08 (95% CI 0.02 to 0.24) favoring epidural Heterogeneity (I2 80%).
Outcome measure-3 Satisfaction (rating very good-excellent) Pooled Risk Ratio (M-H random model): 1.56 (95% CI 0.87 to 2.80) favoring epidural Heterogeneity (I2 99%).
Outcome measure-4 Instrumental delivery Pooled Risk Ratio (M-H fixed model): 1.52 (95% CI 1.32 to 1.75) favoring pethidine Heterogeneity (I2 42%).
Outcome measure-5 Caesarean section Pooled Risk Ratio (M-H fixed model): 1.12 (95% CI 0.96 to 1.31) favoring pethidine Heterogeneity (I2 27%).
Outcome measure-6 Postspinal headache Risk Ratio 0.96, 95% CI: 0.67 to 1.40.
Outcome measure-7 Hypotension (as defined by trial authors) Pooled Risk Ratio (M-H random model): 28.50 (95% CI 4.62 to 175.8) favoring pethidine Heterogeneity (I2 57%).
Outcome measure-8 Motorblock Risk Ratio 31.8 95% CI: 1.69 to 517.9.
Outcome measure-9 Nausea and vomiting Pooled Risk Ratio (M-H random model): 1.17 (95% CI 0.82 to 1.67) favoring pethidine Heterogeneity (I2 38%).
Outcome measure-10 Fever >38 degrees C Pooled Risk Ratio (M-H fixed model): 3.60 (95% CI 2.80 to 4.64) favoring pethidine Heterogeneity (I2 0%).
Outcome measure-11 Urine retention Risk Ratio 5.68, 95% CI: 0.71, 45.68
Outcome measure-12 Duration 1st stage of labour Mean difference (random model): 25.00 (95% CI 5.53 to 44.47) Heterogeneity (I2 54%).
Outcome measure-13 Duration 2nd stage of labour Mean difference (random model): 14.57 (95% CI 8.83 to 20.32) Heterogeneity (I2 64%).
Outcome measure-14 Pruritis
Outcome measure-15 pH. a. umbilicalis <7.2 RR (fixed model): 0.81 (95% CI 0.69 to 0.94) Heterogeneity (I2 0%).
Outcome measure-16 Admission to NICU RR (fixed model): 0.81 (95% CI 0.69 to 0.94) Heterogeneity (I2 0%).
Outcome measure-17 Apgar score RR (fixed model): 0.69 (95% CI 0.44 to 1.10) Heterogeneity (I2 0%). |
Risk of bias: Random sequence (selection bias): Low risk: A, B, C, D, F, G, H, L, M, N, P High risk: J Unclear: E, I, K, O, Q
Allocation concealment (selection bias): Low risk: A, B, D, F, G, H, L, M High risk: - Unclear: C, E, I, J, K, N, O, P, Q
Blinding participants (performance/ detection bias): Low risk: B High risk: A, Q Unclear: C, D, E, F, G, H, I, J, K, L, M, N, O, P
Blinding clinical staff (performance/ detection bias): Low risk: B High risk: Q Unclear: A, C, D, E, F, G, H, I, J, K, L, M, N, O, P
Blinding outcome assessor (performance/ detection bias): Low risk: High risk: B Unclear: A, C, D, E, F, G, H, I, J, K, L, M, N, O, P, Q
Incomplete outcome data (attrition bias): Low risk: B, C, F, G, H, J, K, L, M, N, O, P High risk: A, D, E Unclear: I, Q
Selective reporting (reporting bias): Low risk: B, D, G, J, L, M, P High risk: A, C, F, H, I, K, N, O Unclear: E, Q
Other bias: Low risk: A, B, C, D, F, G, H, J, L, M, N High risk: K, O, P Unclear: E, I, Q
Notes: P: trial terminated early following preliminary analysis, showing increase in caesarean delivery in epidural group
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
Research question: Wat is de effectiviteit van epidurale analgesie vergeleken met pethidine bij zwangere vrouwen met het verzoek tot behandeling van de baringspijn?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / contrI(C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Sweed, 2011 |
Type of study: RCT, prospective parallel single-blind study
Setting: Hospital
Country: Egypt
Source of funding: self-funded study |
Inclusion criteria: full-term nulliparous women in active labour with cervical dilatation of 5cm and cephalic presenting fetus
Exclusion criteria: women with DM, neurological disease, pre-eclampsia, subjects who had received parenteral analgesia or with contraindication to E or spinal analgesia, or sensitivity to local anesthetics or opioids.
N total at baseline: 60 women in active labour
Important prognostic factors2: age ± SD: I1: 22.8 ± 3.9 I2: 20.9 ± 2.6 I3: 22.3 ± 4.6 I4: 22.8 ± 3.3 C: 23.05 ± 2.8 P-value 0.577
Baseline VAS score: I1: 6.1 I2: 8.0 I3: 5.6 I4: 6.3 C: 6.95 P-value 0.056
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test): CSE/ epidural
Intervention 1: CSE (fentanyl IT and bolus lido 0,5%, top-ups lido) Intervention 2: CSE (fentanyl IT and bolus bupi 0,0625%, top-ups bupi) Intervention 3: Epi (fentantyl epidural, bolus lido 0,5%, top-ups lido) Intervention 4: Epi (fentantyl epidural, bolus bupi 0,125%, top-ups bupi)
|
Describe control (treatment/procedure/test): Pethidine
50mg IV pethidine as loading dose, followed by 0,5mg/kg, with a max of 130mg.
|
Length of follow-up: Up until delivery
Loss-to-follow-up: Intervention: N=0 (0%) Reasons (describe) NA
Control: N=0 (0%) Reasons (describe) NA
Incomplete outcome data: Intervention: N=1 (5%) Reasons (describe): not reported
Control: N=0 (0%) Reasons (describe): NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
VAS pain score at time of delivery (mean): CSE/EPI group: 1.1 – 4.0 Duration of 1st stage of labour (1st stage not defined) – Mean difference (SD) (data of all four intervention groups combined: I: 198 (110) C: 151 (84)
Duration of 2nd stage of labour (2nd stage not defined) – Mean difference (SD) (data of all four intervention groups combined: I: 54 (38) C: 27 (11)
Mode delivery: Ventouse or forceps, N of total I: 13/39 C: 2/20
Mode delivery: Ceasarian section, N of total I: 1/39 C: 1/20
Nausea/ vomiting: N/total: I: 6/39 C: 15/20
Hypotension: N/total: I: 9/39 C: 0/20
Pruritis: N/total: I: 11/39 C: 0/20
Fever: N/total: I: 11/39 C: 0/20
Apgar score, average at 5 min: Number of pt <7 at 5min not reported. I1: 9.00 (0.66) I2: 9.30 (0.82) I4: 9.10 (0.87) I5: 9.30 (0.67) C: 8.45 (0.69) |
Data from CSE and Epi groups were combined to present the results of the intervention versus pethidine.
Notes: Modified Bromage score, motor block mentioned as outcome in method section, but not reported in results (selective reporting bias)
|
|
Jalil, 2009 |
Type of study: RCT
Setting and country: hospital setting in Malaysia
Funding and conflicts of interest: University Sains Malaysia short-term grant no. 304/ppsp/613131. Conflicts not reported. |
Inclusion criteria: women with –SA 1 - 11, grav–da 2 - 5 with tested pelvis, spontaneous onset of labour, age18- 40yrs old, singleton fetus with cephalic presentation, presenting–OS 3 - 5 cm, height > 150 cm, weight < 100 kg
Exclusion criteria: bad obstetric history, post-date, history of allergy to local anaesthetic, patient refusal, failed epidural and contra-indications for epidural analgesia
N total at baseline: N= 192 Intervention (epidural): 94 Control (pethidine): 98
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Epidural analgesia: a 3-mL test dose of 0.2% ropivacaine was given followed by a bolus dose making the total dose of 12 mL. This was followed by continuous epidural infusion of 0.2% ropivacaine with 2 ug/mL fentanyl–at 7 - 10 mL/hr.
|
Describe control (treatment/procedure/test)–
75 - 100 mg IM pethidine with 25 mg promethazine hydrochloride at first request of pain relief. Additional 75 mg of pethidine were given by request to a max of 300 mg in 4 hrs. |
Length of follow-up: until delivery
Loss-to-follow-up: None
Incomplete outcome data: None, data reported for each participant
|
Outcome measures and effect size (include 95%CI and p-value if available):
|
Both groups were able to self-administer nitrous oxide. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of Bias tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Anim-Somuah, 2011 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat is de effectiviteit van epidurale analgesie vergeleken met pethidine zwangere vrouwen met het verzoek tot behandeling van de baringspijn?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Sweed, 2011 |
Unclear, not reported |
Unclear |
Likely, participants cannot have been blinded to the intervention of epidural |
Unclear |
Unclear |
Likely |
Unlikely |
unlikely |
|
Jalil, 2009 |
“A trained staff nurse would choose an envelope to allocate the participant randomly (closed envelope technique” |
Unclear, how sequence was generated was not clear, whether envelopes were sealed etc. |
Likely, participants cannot have been blinded to the intervention of epidural |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influence rocessproces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Direkvand-Moghadam, 2013 |
Voldoet niet aan de PICO |
|
Heesen, 2012 |
Voldoet niet aan de PICO |
|
Hitzeman, 2012 |
Betreft een Cochrane abstract en casus beschrijving van Anim-Somuah 2011 |
|
Jones, 2012 |
Betreft overzicht van Cochrane reviews waaronder de review van Anim-Somuah 2011 |
|
Pandya, 2010 |
Narrative review |
|
Reynolds, 2010 |
Narrative review |
|
Koyyalamudi, 2016 |
Systematische review, echter relevante literatuur al geïncludeerd in Cochrane Review Anim-Somuah 2011. |
|
Halpern, 2010 |
Voldoet niet aan de PICO |
|
Weissman, 2009 |
Geen RCT, maar observationele studie |
|
Yayci, 2012 |
Voldoet niet aan de PICO (pethidine IV) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-07-2020
Beoordeeld op geldigheid : 03-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijnmodule deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Epiduraal versus Pethidine |
NVA/ NVOG |
2019 |
2024 |
Eens in vijf jaar |
Regiehouder en andere wetenschappelijke verenigingen |
Niet van toepassing |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
De ontwikkeling van de richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
- Dr. W.L.M.C.M. Schellekens, extern voorzitter
- Drs. I.C.M. Beenakkers, anesthesioloog, werkzaam in het UMC Utrecht, NVA
- Drs. F.A. Klerk, anesthesioloog, werkzaam in het Diakonessenhuis Utrecht, NVA
- Drs. C.E. Kam-Endtz, anesthesioloog, werkzaam in het Haaglanden Medisch Centrum, NVA
- Dr. F.T.H. Lim, gynaecoloog, werkzaam in het IJssellandziekenhuis, NVOG
- Dr. L.M. Freeman, gynaecoloog, werkzaam in het Ikazia Ziekenhuis Rotterdam, NVOG
- Dr. J.M. Middeldorp, gynaecoloog, werkzaam in het Leids Universitair Medisch Centrum, NVOG
- Drs. A.G. Kaspers, kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Drs. L.A.M. Moll, klinisch verloskundige, werkzaam in het St. Antonius Ziekenhuis Nieuwegein, KNOV
- Dr. J. de Boer, beleidsmedewerker bij KNOV
- Drs. S. Ratsma-Wesselius, Obstetrisch verpleegkundige, werkzaam bij het Amsterdam UMC, Locatie AMC, V&VN
- Dr. J.E. Nagtegaal, Ziekenhuisapotheker, werkzaam in het Meander Medisch Centrum, NVZA
- Dr. A.M.D.E. Timmerman, Klinisch Fysicus, werkzaam in het UMC Utrecht, NVKF
- Drs. J.C. Mooij, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
Met ondersteuning van
- Dr. E.M.E. den Breejen, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. Harmsen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schellekens |
gepensioneerd, ZZP: strategisch adviseur |
Lid RvT Diakonessenhuis, Utrecht |
Geen |
Geen |
|
Klerk |
Staf Anesthesiologie Diakonessenhuis Utrecht. |
bestuurslid Obst. Anesth. onbetaald |
Geen |
Geen |
|
Ratsma Wesselius |
Senior verpleegkundige Verloscentrum AMC |
Gastdocent VU Amstel Academie verpleegkundige vervolgopleidingen Obstetrie, betaald |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog WKZ/UMCU |
Voorzitter sectie obstetrische anesthesie van de NVA. Onbetaald |
Echtgenoot werkzaam bij GSK |
Geen |
|
Nagtegaal |
Ziekenhuisapotheker Meander Medisch Centrum |
Beroepenveldcommissie Farmakunde Hogeschool Utrecht, onbetaald |
Geen |
Geen |
|
Timmerman |
Staffunctionaris Klinische Fysica & Patiëntveiligheid |
Lid NIVEL expertgroep infuustechnologie - advies maken kennistoets voor verpleegkundigen – onbetaald Lid ondernemingsraad UMC Utrecht - onbetaald |
EMRP Researcher Grant Metrology for Drug Delivery HLT07- REG1 €120,422.88 USPTO Applicaton #: #20160106909 Apparatus for simultaneous multiple medicament administration |
Geen |
|
Kam-Endtz |
Anesthesioloog Haaglanden MC |
Geen |
Geen |
Geen |
|
Middeldorp |
Gynaecoloog-perinatoloog |
Geen |
Geen |
Geen |
|
Moll |
Klinisch verloskundige/research verloskundige in het St. Antoniusziekenhuis in Nieuwegein |
Geen |
Geen |
Geen |
|
Freeman |
Gynaecoloog |
voorzitter multidiciplinaire werkgroep obstetrische anesthesie
|
Mijn promotieonderzoek naar epidurale analgesie en remifentanil is gesubsidieerd door ZonMw. Dit onderzoek is afgerond maar de resultaten zullen gebruikt worden in deze richtlijn |
Geen |
|
Mooij |
Beleidsmedewerker Patiëntenvereniging Nederland |
Vrijwilligerswerk (onbetaald) patiëntenorganisatie CCUVN |
Geen |
Geen |
|
Kaspers |
Kinderarts-neonatoloog, MST Enschede |
Geen |
Geen |
Geen |
|
De Boer |
Beleidsmedewerker richtlijnontwikkeling |
Geen nevenwerkzaamheden |
Geen |
Geen |
|
Lim |
gynaecoloog |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patientenfederatie Nederland in de werkgroep te laten deelnemen. De conceptmodule is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland. Daarnaast is door de Patiëntenfederatie Nederland een achterbanraadpleging verricht, waarvan de uitkomsten zo veel mogelijk meegenomen zijn in de overwegingen van de modules.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze modules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, (2010)), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit inventarisatie van de knelpunten door de commissie van de NVA bleek dat er een noodzaak was voor revisie van deze richtlijnmodules. Tevens zijn tijdens een fysieke knelpunteninventarisatie knelpunten aangedragen door aanpalende stakeholders inclusief patiëntenorganisaties. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroepleden en de adviseur uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Indicatoren over zwangerschap en geboorte zijn reeds onderdeel van de vervaardigde indicatoren bij de zorgstandaard integrale geboortezorg. Derhalve zijn er bij deze modules geen indicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules werden aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
(2009-4 dec 2017)
|
1 exp Labor, Obstetric/ or exp Delivery, Obstetric/ 110521 2 (labor or labour or childbirth or birth* or delivery or parturient*).ti,ab. 736608 3 1 or 2 782592 4 exp Labor pain/ or exp Analgesia, obstetric/ 4488 5 3 or 4 783262 6 exp analgesia, epidural/ 8026 7 (epidural* or CSE or PCEA).ti,ab. 43704 8 6 or 7 45179 9 exp Meperidine/ 6149 10 (meperidin* or pethidin* or isonipecain or dolsin or dolosal or dolin or 'perindine or dolantin or dolargan or lidol or lydol or demerol or dolcontral or (parenteral* adj2 opoid*) or non-epidural or nonepidural).ti,ab. 5604 11 9 or 10 8371 12 5 and 8 and 11 355 13 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) 367140 14 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) 1873901 15 12 and 13 21 16 12 and 14 163 17 (12 and 14) not 15 145 18 limit 15 to yr="2009 -Current" 13 19 limit 17 to yr="2009 -Current" 21 20 18 or 19 34 |
na ontdubbeling 88 |
|
Embase (Elsevier) |
|
|
|
Cochrane library |
(labor:ab,ti OR labour:ab,ti OR childbirth:ab,ti OR birth*:ab,ti OR delivery:ab,ti OR parturient*:ab,ti) AND (epidural*:ab,ti OR cse:ab,ti OR pcea:ab,ti) AND (meperidin*:ab,ti OR pethidin*:ab,ti OR isonipecain:ab,ti OR dolsin:ab,ti OR dolosal:ab,ti OR dolin:ab,ti OR perindine:ab,ti OR dolantin:ab,ti OR dolargan:ab,ti OR lidol:ab,ti OR lydol:ab,ti OR demerol:ab,ti OR dolcontral:ab,ti OR (parenteral* NEXT/2 opoid*):ab,ti OR 'non-epidural':ab,ti OR nonepidural:ab,ti) Publication Year from 2009 to 2017 |

