Epidurale analgesie: Opioïden
Uitgangsvraag
Welk opioïd (sufentanil of fentanyl) heeft de voorkeur en welke concentratie van deze opioïden is optimaal voor epidurale analgesie tijdens de bevalling?
Aanbeveling
Geef geen voorkeur aan fentanyl of sufentanil als opioïd in de epidurale oplossing.
Streef naar een zo laag mogelijke concentratie fentanyl of sufentanil in de epidurale oplossing die wel effectief is qua pijnstilling.
Overwegingen
De onderstaande overwegingen gelden in principe voor de gehele patiëntenpopulatie zoals geformuleerd in de uitgangsvraag.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Ten aanzien van de dosering sufentanil en fentanyl in lage (respectievelijk < 0,5µg/mL en < 2 µg/mL) versus hoge (respectievelijk ≥ 0,5 µg/mL en (≥ 2,0µg/mL) concentraties afzonderlijk werden geen vergelijkende studies gevonden. Ook werden geen vergelijkende studies gevonden waarin sufentanil en fentanyl in lage concentraties met elkaar vergeleken werden.
Het is onzeker of er een verschil is tussen sufentanil en fentanyl in hoge doseringen ten aanzien van pijnintensiteit, tevredenheid en modus partus. De overall bewijskracht is zeer laag, met name door imprecisie.
In de subgroepen met zowel lage als de hoge dosering werden geen significante verschillen waargenomen tussen epidurale analgesie met sufentanil versus epidurale analgesie met fentanyl, behoudens wellicht dat vrouwen die een hoge dosering fentanyl krijgen vaker over lijken te stappen op aanvullende/ andere pijnmedicatie dan vrouwen die een hoge dosering sufentanil ontvangen. Overall kan men stellen dat er weinig tot geen verschil zit in bijwerkingen en werking tussen fentanyl en sufentanil. In de Nederlandse setting wordt sowieso voornamelijk, zo niet alleen maar, sufentanil gebruikt op de verloskamers.
Hoewel er geen vergelijkende studies gevonden zijn naar hoge concentraties vergeleken met lage concentraties sufentanil weten we dat het reduceren van de concentratie (0,156 mcg/ml sufentanil) een positief effect heeft op de bijwerkingen (pruritus en nausea) zonder aan pijnstilling in te boeten (Bernard, 2001). Andere studies laten zien dat er ook bij lagere concentraties lokaal anesthetica (< 0,125% bupivacaïne) lagere concentraties sufentanil mogelijk zijn, bijvoorbeeld ropivacaïne 0,1% + sufentanil 0,5 mg/ml (Boselli, 2004) en bupivacaïne 0,0625% + sufentanil 0,35 mg/ml (Carvalho,2005).
Waarden en voorkeuren van patiënten
Er lijkt geen verschil in het risico op misselijkheid tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen in aanvulling op analgesie (bupivacaïne) voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens. De literatuur laat zien dat het onzeker is of er een verschil in bijwerkingen is tussen sufentanil en fentanyl in hoge concentraties en dat dit voor wat betreft lage concentraties ontbreekt, kunnen er voor wat betreft beide middelen geen voor en nadelen voor de patiënt benoemd worden.
Kosten (middelenbeslag)
Beide middelen zijn zeer goedkoop. Er zijn geen kosteneffectiviteitsstudies bekend.
Aanvaardbaarheid voor de overige relevante stakeholders
Er zitten geen patenten meer op beide middelen, dus er zijn geen verschillen.
Haalbaarheid en implementatie
De verschillende oplossingen zijn niet altijd voorradig dan wel snel te maken door de eigen apotheek. Veel oplossingen worden centraal of op beperkte plekken gefabriceerd, dit kan mogelijk tot problemen in de levering en beschikbaarheid leiden.
Aanbeveling-1
Rationale/ balans tussen voor- en nadelen van de interventie
Op basis van bijwerkingen (motorische blokkade, jeukklachten, misselijkheid, hypotensie, urineretentie, tijdsduur pijnstilling, pijnintensiteit en tevredenheid pijnstilling) zijn er geen verschillen tussen sufentanil en fentanyl behoudens dat er bij fentanyl eerder om extra pijnstilling gevraagd wordt. Echter, dit geldt voor studies waarin hoge concentraties vergeleken worden en de bewijskracht is zeer laag.
Aanbeveling-2
Rationale/ balans tussen voor- en nadelen van de interventie
Op grond van de literatuur is er geen vergelijking tussen lage concentraties (< 0,5 mg/ml) en hoge concentraties(> 0,5 mg/ml) sufentanil mogelijk. Wel is bekend dat lagere doseringen (ook van fentanyl) tot minder bijwerkingen leiden. Er is echter niet bekend hoe laag de dosering kan zijn en toch effectief blijft qua pijnstilling.
Onderbouwing
Achtergrond
Volgens de huidige inzichten varieert de concentratie sufentanil in de epidurale mix tussen de 0,156-2,0 μg/ml en fentanyl tussen de 2,0-5,0 μg/ml (Bernard, 2001).
Deze concentraties kunnen bijwerkingen geven in de vorm van jeuk en misselijkheid. De trend in de literatuur gaat steeds meer richting lagere doseringen. Echter, de laagst werkzame dosering, bij de laagst toegepaste concentratie lokaal anestheticum is nog niet bekend.
Conclusies / Summary of Findings
PICO 1 - Sufentanil laag versus sufentanil hoog (≥ 0,5µg/mL)
Er zijn geen conclusies geformuleerd bij gebrek aan evidentie.
PICO 2 - Fentanyl laag (<2,0µg/mL)versus fentanyl hoog (≥ 2,0µg/mL)
Er zijn geen conclusies geformuleerd bij gebrek aan evidentie.
PICO 3 - Sufentanil laag (<0,5µg/mL) versus fentanyl laag (<2,0µg/mL)
Er zijn geen conclusies geformuleerd bij gebrek aan evidentie.
PICO 4 – Sufentanil hoog (≥ 0,5µg/mL)versus fentanyl hoog (≥ 2,0µg/mL)
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in pijnintensiteit tijdens de ontsluitingsfase tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoeging bij een lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Cohen, 1996; Rolseng, 2002) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in pijnintensiteit tijdens de uitdrijvingsfase tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoeging bij een lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Cohen, 1996; Rolseng, 2002) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in tevredenheid tijdens de ontsluitingsfase tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoeging bij een lokaal anestheticumvoor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Rolfseng, 2002) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in tevredenheid tijdens de uitdrijvingsfase van de bevalling tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Rolfseng, 2002) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op het krijgen van een motorische blokkade tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Herman, 1998; Loftus, 1995; Rolfseng, 2002) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op jeuk tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Cohen, 1996; Herman, 1998; Loftus, 1995) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op misselijkheid tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Cohen, 1996; Herman, 1998; Loftus, 1995) |
|
Zeer laag GRADE |
Het is onzeker of er geen verschil is in het risico op het krijgen van hypotensie tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Cohen, 1996; Herman, 1998) |
|
Zeer laag GRADE |
Het is onzeker of er geen verschil is in de tijdsduur van de analgesie tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Cohen, 1996; Herman, 1998; Loftus, 1995) |
|
Zeer laag GRADE |
Het is onzeker of er geen verschil is in het aantal keer overstappen naar andere/aanvullende pijnmedicatie bij vrouwen die een hoge dosering fentanyl hebben gekregen in vergelijking met vrouwen die een hoge dosering sufentanil hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Cohen, 1996; Herman, 1998) |
|
Zeer laag GRADE |
Het is onzeker of er geen verschil is in het risico op het krijgen van urineretentie tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Cohen, 1996) |
|
Zeer laag GRADE |
Het is onzeker of er geen verschil is in het risico op een neonatale Apgarscore < 7 tussen vrouwen die een hoge dosering sufentanil hebben gekregen en vrouwen die een hoge dosering fentanyl hebben gekregen als toevoegingen bij lokaal anestheticum voor het bestrijden van baringspijn bij zwangere vrouwen met een pijnbestrijdingswens.
Bronnen: (Loftus, 1995; Rolfseng, 2002) |
Samenvatting literatuur
Beschrijving studies
PICO 1 - sufentanil laag (<0,5µg/mL) versus sufentanil hoog (≥ 0,5µg/mL)
Er zijn geen studies die voldoen aan de PICO-criteria.
PICO 2 - fentanyl laag (<2,0µg/mL) versus fentanyl hoog (≥ 2,0µg/mL)
Er zijn geen studies die voldoen aan de PICO-criteria.
PICO 3 - sufentanil laag (<0,5µg/mL)versus fentanyl laag (<2,0µg/mL)
Er zijn geen studies die voldoen aan de PICO-criteria.
PICO 4 - sufentanil hoog (≥ 0,5µg/mL)versus fentanyl hoog (≥ 2,0µg/mL)
De literatuurzoekactie levert vier publicaties op die voldoen aan bovenstaande PICO-criteria (Cohen, 1996; Herman, 1998; Loftus, 1995; Rolfseng, 2002). Een overzicht van de belangrijkste studiekarakteristieken is gepresenteerd in Tabel 1. Alle studies selecteerden hoge doseringen sufentanil (≥ 0,5µg/mL) en fentanyl (≥ 2,0µg/mL). De doseringen sufentanil varieerden tussen de studies van 0,5 tot 7,5 µg/mL en de doseringen fentanyl van 2,0 µg/mL tot 37,5 µg/mL. In totaal werden er 394 vrouwen geïncludeerd, welke gerandomiseerd werden verdeeld over twee groepen; de ene groep vrouwen kreeg sufentanil (n=293) toegediend en de andere groep vrouwen fentanyl (n=201) voor pijnbestrijding van baringspijn. Herman (1998) onderzocht het verschil in effect tussen sufentanil en fentanyl middels meerdere vergelijkingen waarin de dosis sufentanil varieert van 0,5 tot 2,5 µg/mL (n=47) en de dosis fentanyl tussen de 2,5 tot 10 µg/mL (n=51), aan alle doseringsschema’s werd bupivacaïne (0,125%) toegevoegd. Alle doseringsschema’s vallen onder de hoge categorie en zijn bij de literatuursynthese tezamen genomen. Loftus (1995) randomiseerde 23 gezonde vrouwen over de sufentanil groep (1,25 µg/mL; n=9) en de fentanyl groep (6,25 µg/mL; n=14) middels een epidurale techniek. Alle vrouwen kregen een start bolus van 0,25% bupivacaïne, gevolgd door een infusie van bupivacaïne (0,125%) met een infusiesnelheid van 10mL/h. Rolfseng (2002) includeerde 90 vrouwen met een pijnbestrijdingswens welke werden gerandomiseerd over de sufentanil groep (1,0 µg/mL; n=45) en de fentanyl groep (3,5 µg/mL; n=45).
Tabel 1 Overzicht studiekarakteristieken betreffende dosering analgesie en opioïden
|
Studie |
n |
Design |
Techniek |
Analgesie |
Sufentanil |
Fentanyl |
|
Cohen, 1996 |
100 |
RCT |
EPI |
Bupivacaïne (0,015%) |
1,0 µg/mL |
2,0 µg/mL |
|
Herman, 1998 |
98 |
DB-RCT |
EPI |
Bupivacaïne (0,125%) |
0,5-2,5 µg/mL |
2,5-10 µg/mL |
|
Loftus, 1995 |
23 |
DB-RCT |
EPI |
Bupivacaïne (0,125%) |
1,25 µg/mL |
6,25 µg/mL |
|
Rolfseng, 2002 |
90 |
DB-RCT |
EPI |
Bupivacaïne (0,100%) |
1,0 µg/mL |
3,5 µg/mL |
DB-RCT= dubbelblind gerandomiseerd onderzoek; ED= Epiduraal
Resultaten
PICO 1 - sufentanil laag (<0,5µg/mL) versus sufentanil hoog (≥ 0,5µg/mL)
Er zijn geen studies die voldoen aan de PICO-criteria.
PICO 2 - fentanyl laag (<2,0µg/mL)versus fentanyl hoog (≥ 2,0µg/mL)
Er zijn geen studies die voldoen aan de PICO-criteria.
PICO 3 - sufentanil laag (<0,5µg/mL) versus fentanyl laag (<2,0µg/mL)
Er zijn geen studies die voldoen aan de PICO-criteria.
PICO 4 - sufentanil hoog (≥ 0,5µg/mL)versus fentanyl hoog (≥ 2,0µg/mL)
Pijnintensiteit ontsluitingsfase
De pijnintensiteit tijdens de ontsluitingsfase werd in twee van de vijf RCT’s onderzocht (Cohen, 1996; Rolfseng, 2002). Beide studies maakten gebruik van een VAS-schaal welke varieert van 0= geen pijn tot 10= meest erge pijn mogelijk. Het gestandaardiseerde, gemiddelde verschil in VAS-score tijdens de ontsluitingsfase, na toediening van analgesie, tussen de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep was -0,28 punten (95% BI= (1,05 tot 0,48); p= 0,47; n= 190 vrouwen), geen statistisch significant verschil tussen de twee groepen (Figuur 1).
Figuur 1 gestandaardiseerde gemiddelde verschil in VAS-score tijdens de ontsluitingsfase

Het gestandaardiseerde gemiddelde verschil in VAS-score tijdens de ontsluitingsfase na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat pijnintensiteit tijdens de ontsluitingsfase is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is ‘zeer laag’.
Pijnintensiteit in de uitdrijvingsfase
De pijnintensiteit tijdens de uitdrijvingsfase werd in twee van de vijf RCT’s onderzocht (Cohen, 1996; Rolfseng, 2002). Beide studies maakten gebruik van een VAS-schaal welke varieert van 0= geen pijn tot 10= meest erge pijn mogelijk. Het gestandaardiseerde, gemiddelde verschil in VAS-score tijdens de uitdrijvingsfase, na toediening van analgesie, tussen de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep was -0,29 punten (95% BI= (-1,49 tot 0,91); p= 0,64; n= 190 vrouwen), geen statistisch significant verschil tussen beide groepen (Figuur 2).
Figuur 2 gestandaardiseerde gemiddelde verschil in VAS-score tijdens de uitdrijvingsfase

Het gestandaardiseerde gemiddelde verschil in VAS-score tijdens de uitdrijvingsfase na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat pijnintensiteit de uitdrijvingsfase is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is ‘zeer laag’.
Tevredenheid ten aanzien van pijnstilling tijdens de ontsluitingsfase
De tevredenheid tijdens de ontsluitingsfase werd in één van de vijf RCT’s onderzocht (Rolfseng, 2002). Rolfseng (2002) rapporteerde het aantal vrouwen dat tevreden in de ontsluitingsfase. In totaal waren in beide groepen 44 vrouwen (=98%) tevreden met de pijnstilling tijdens de ontsluitingsfase van de bevalling. Het relatieve risico (RR) voor pijnstillingstevredenheid was RR= 1,00 (95%BI= (0,94 tot 1,06); p= 1,00; n= 90 vrouwen), geen statistisch significant verschil tussen beide groepen (Figuur 3).
Figuur 3 pijnstillingstevredenheid tijdens de ontsluitingsfase
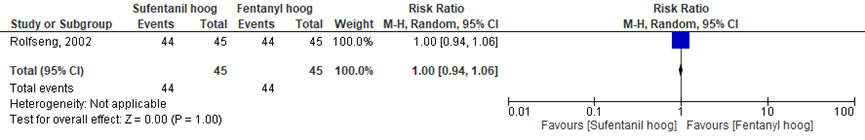
Het relatieve risico voor pijnstillingstevredenheid tijdens de ontsluitingsfase na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat tevredenheid pijnstilling tijdens de ontsluitingsfase is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is ‘zeer laag’.
Tevredenheid pijnstilling in de uitdrijvingsfase
De pijnstillingstevredenheid tijdens de uitdrijvingsfase werd in één van de vijf RCT’s onderzocht (Rolfseng, 2002). Rolfseng (2002) rapporteerde het aantal vrouwen dat tevreden is ten aanzien van de pijnstilling tijdens de uitdrijvingsfase. In totaal waren 33 vrouwen (=73%) tevreden met de pijnstilling tijdens de uitdrijvingsfase in de ‘sufentanil hoog’ groep en 36 vrouwen (= 80%) in de ‘fentanyl hoog‘ groep . Het relatieve risico (RR) voor pijnstillingstevredenheid was RR= 0,92 (95%BI= (0,73 tot 1,15); p= 0,46; n= 90 vrouwen), geen statistisch significant verschil tussen beide groepen (Figuur 4).
Figuur 4 pijnstillingstevredenheid tijdens de uitdrijvingsfase
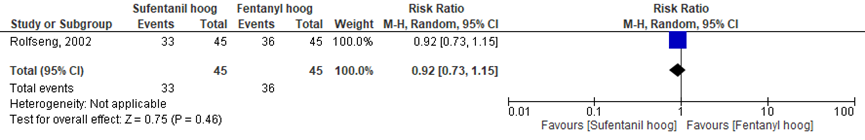
Het relatieve risico voor pijnstillingstevredenheid tijdens de uitdrijvingsfase na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat tevredenheid pijnstilling in de uitdrijvingsfase is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is ‘zeer laag’.
Motorische blokkade
Het aantal vrouwen met een motorische blokkade werd in drie van de vijf RCT’s onderzocht (Herman, 1998; Loftus, 1995; Rolfseng, 2002). Het percentage vrouwen met een motorische blokkade was 6% in de ‘sufentanil hoog’ groep (n= 6) en 7% in de ‘fentanyl hoog’ groep (n= 7). Het gemiddelde relatieve risico voor het aantal vrouwen met een motorische blokkade was RR= 1,01 (95%BI= (0,38 tot 2,65); p= 0,81; n= 203 vrouwen), geen statistisch significant tussen de twee groepen (Figuur 5).
Figuur 5 motorisch blok
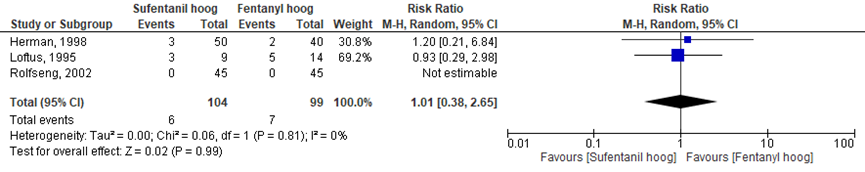
Meta-analyse en forest plot van het relatieve risico voor het aantal vrouwen met een motorisch blok na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat motorisch blok is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met één niveau vanwege imprecisie (te geringe studieomvang). De bewijskracht is ‘laag’.
Jeukklachten
Het verschil in aantal vrouwen dat jeukklachten rapporteerde tussen de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep werd onderzocht in vier van de vijf RCT’s (Cohen, 1996; Herman, 1998; Loftus, 1995). Jeukklachten kwamen voor in 43% van de vrouwen in de ‘sufentanil hoog groep’ en in 50% van de vrouwen in de ‘fentanyl hoog’ groep. Het gemiddelde relatieve risico voor jeuk was RR= 0,92 (95%BI= (0,58 tot 1,52); p= 0,74; n= 213 vrouwen, geen statistisch significant verschil tussen beide groepen (Figuur 6).
Figuur 6 jeukklachten
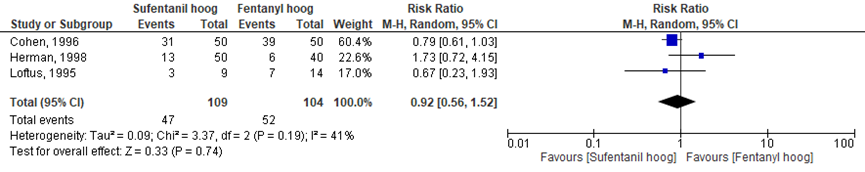
Meta-analyse en forest plot van het relatieve risico voor het aantal vrouwen met jeukklachten na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat jeukklachten is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met één niveau vanwege imprecisie (te geringe studieomvang). De bewijskracht is ‘laag’.
Misselijkheid
Het verschil in aantal vrouwen die dat misselijk was tussen de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep werd onderzocht in drie van de vijf RCT’s (Cohen, 1996; Herman, 1998; Loftus, 1995). Het percentage vrouwen met misselijkheidsklachten was 5% in de ‘sufentanil hoog’ groep (n= 5) en 7% in de ‘fentanyl hoog’ groep (n= 8). Het gemiddelde relatieve risico voor het aantal vrouwen met misselijkheidsklachten was RR= 0,80 (95%BI= (0,26 tot 2,45; p= 0,53; n= 113 vrouwen), geen statistisch significant tussen de twee groepen (Figuur 7).
Figuur 7 misselijkheid
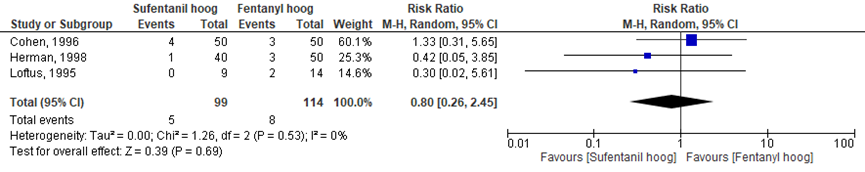
Meta-analyse en forest plot van het relatieve risico voor het aantal vrouwen met misselijkheid na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat misselijkheid is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (measurement bias) en met één niveau vanwege imprecisie (te geringe studieomvang). De bewijskracht is ‘laag’.
Hypotensie
Het verschil in aantal vrouwen met hypotensie tussen de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep werd onderzocht in twee van de vijf RCT’s (Cohen, 1996; Herman, 1998). Hypotensie kwam niet voor in de RCT van Cohen (1996), daarom kon het relatieve risico in deze studie niet worden bepaald. Het percentage vrouwen met hypotensie was 5% in de ‘sufentanil hoog’ groep (n= 5) en 4% in de ‘fentanyl hoog’ groep (n= 4). Het gemiddelde relatieve risico voor het aantal vrouwen met hypotensie was RR= 1,00 (95%BI= 0,29 tot 3,48; p= 1,00; n= 190 vrouwen), geen statistisch significant tussen de twee groepen (Figuur 8).
Figuur 8 hypotensie
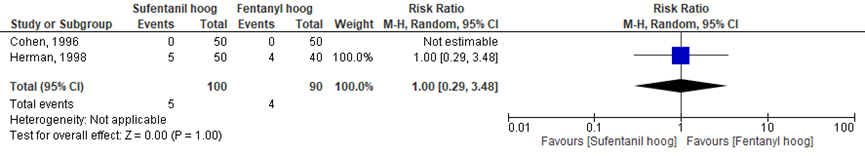
Meta-analyse en forest plot van het relatieve risico voor het aantal vrouwen met hypotensie na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat hypotensie is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (measurement bias) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is ‘zeer laag’.
Tijdsduur analgesie
Het verschil in tijdsduur van de analgesie tussen de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep werd onderzocht in drie RCT’s (Cohen, 1996; Herman, 1998; Loftus, 1995). Het gemiddelde verschil in tijdsduur van analgesie tussen de vrouwen in de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep was 34,08 min (95%BI= (-63,28 tot 131,44); p= 0,49); geen statistisch significant verschil tussen beide groepen (figuur 9). Vanwege de grote statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd. Random effect-model laat een overall statistische heterogeniteit zien van I2= 97% (p<0,001).
Figuur 9 tijdsduur van de analgesie

Meta-analyse en forest plot van het gestandaardiseerde gemiddelde verschil in tijdsduur van de analgesie na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat tevredenheid in de uitdrijvingsfase is met twee niveaus verlaagd vanwege ernstige imprecisie (te geringe studieomvang) en met één niveau vanwege inconsistentie (niet overlappen van de betrouwbaarheidsintervallen). De bewijskracht is ‘zeer laag’.
Cross-over naar andere/ aanvullende pijnmedicatie
Het verschil in aantal vrouwen dat op aanvraag aanvullende pijnmedicatie kreeg toegediend tussen ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep werd onderzocht in twee van de vijf RCT’s (Cohen, 1996; Herman, 1998). Het percentage vrouwen met aanvullende pijnmedicatie was 11% in de ‘sufentanil hoog’ groep (n= 11) en 32% in de ‘fentanyl hoog’ groep (n= 29). Het gemiddelde relatieve risico voor het aantal vrouwen dat aanvullende pijnmedicatie nodig had was RR= 0,35 (95%BI= 0,06 tot 2,00; p= 0,24; n= 190 vrouwen), geen statistisch significant verschil tussen beide groepen.
Figuur 10 aanvullende pijnmedicatie
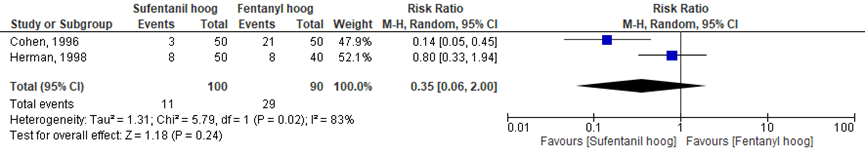
Meta-analyse en forest plot van het relatieve risico voor het aantal vrouwen met aanvullende pijnmedicatie na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat cross-over naar andere/ aanvullende pijnmedicatie is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is ‘zeer laag’.
Urineretentie
Het verschil in aantal vrouwen met urineretentie tussen de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep werd onderzocht in één van de zeven RCT’s (Cohen, 1996). Het percentage vrouwen met urineretentie was 24% in de ‘sufentanil hoog’ groep (n= 12) en 16% in de ‘fentanyl hoog’ groep (n= 8). Het gemiddelde relatieve risico voor urineretentie was RR= 1,50 (95%BI= (0,67 tot 3,35; p= 0,32; n= 100 vrouwen), geen statistisch significant verschil tussen beide groep (Figuur 11).
Figuur 11 urineretentie
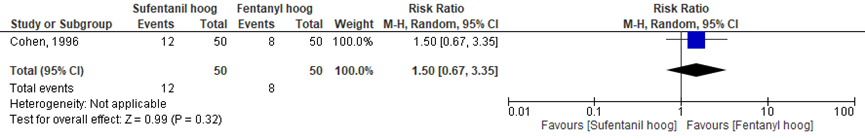
Meta-analyse en forest plot van het relatieve risico voor het aantal vrouwen met urineretentie na toediening van sufentanil met een hoge dosering versus fentanyl met een hoge dosering
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat urineretentie is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is ‘zeer laag’.
Apgarscore
Het verschil in aantal neonaten met een Apgarscore < 7 op vijf minuten na de bevalling tussen de ‘sufentanil hoog’ groep en de ‘fentanyl hoog’ groep werd onderzocht in twee van de vijf RCT’s (Loftus, 1995; Rolfseng, 2002). Het percentage neonaten met een Apgarscore < 7 op vijf minuten na de bevalling was 1% in de ‘sufentanil hoog’ groep (n= 1) en 7% in de ‘fentanyl hoog’ groep (n= 5). Het gemiddelde relatieve risico voor een neonatale Apgarscore < 7 op 5 minuten na de bevalling was RR= 0,24 (95%BI= (0,04 tot 1,42); p= 0,11; n= 113 neonaten), geen statistisch significant verschil tussen beide groepen (Figuur 12).
Figuur 12 Apgarscore < 7 op vijf minuten
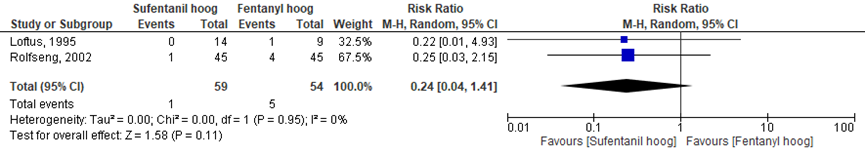
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat Apgarscore is met één niveau verlaagd vanwege beperkingen in de onderzoekopzet (risk of bias) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). De bewijskracht is ‘zeer laag’.
Geen van de studies rapporteerden de uitkomstmaten: borstvoeding, modus partus, maternale complicaties: convulsie/ eclamptisch insult, fluxus postpartum, ademhalingsdepressie, bevallingsduur, temperatuur, postspinale punctie hoofdpijn, epiduraal abces/ hematoom.
Neonatale complicaties: opname NICU, foetale hartslag afwijkingen, temperatuur, pH a. umbilicalis, mortaliteit, negatieve uitkomsten voor de baby op lange termijn, maternale/ neonatale sterfte en kosten.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Zoekvraag: Wat zijn de (on)gunstige effecten van sufentanil versus fentanyl en welke concentratie van opioïden is optimaal voor epidurale analgesie?
Om de zoekvraag te beantwoorden zijn vier PICO-vergelijkingen opgesteld:
1. Sufentanil lage dosering versus sufentanil hoge dosering:
P: zwangere vrouwen met baringspijn en een pijnbestrijdingswens;
I: sufentanil lage dosering < 0,5µg/mL;
C: sufentanil hoge dosering ≥ 0,5µg/mL;
O: zie uitkomstmatenlijst.
2. Fentanyl lage dosering versus fentanyl hoge dosering:
P: zwangere vrouwen met baringspijn en een pijnbestrijdingswens;
I: fentanyl lage dosering < 2,0µg/mL;
C: fentanyl hoge dosering ≥ 2,0µg/mL;
O: zie uitkomstmatenlijst.
3. Sufentanil lage dosering versus fentanyl lage dosering:
P: zwangere vrouwen met baringspijn en een pijnbestrijdingswens;
I: sufentanil lage dosering < 0,5µg/mL;
C: fentanyl lage dosering < 2,0µg/mL;
O: zie uitkomstmatenlijst.
4. Sufentanil hoge dosering versus fentanyl hoge dosering:
P: zwangere vrouwen met baringspijn en een pijnbestrijdingswens;
I: sufentanil hoge dosering ≥ 0,5µg/mL;
C: fentanyl hoge dosering ≥ 2,0µg/mL;
O: zie uitkomstmatenlijst.
Uitkomstmatenlijst
- Pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument).
- Cross-over naar andere/ aanvullende pijnmedicatie.
- Tevredenheid ten aanzien van pijnstilling (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument).
- Borstvoeding.
- Modus partus (vaginale kunstverlossing, sectio caesarea).
- Maternale complicaties: convulsie/ eclamptisch insult, fluxus postpartum, ademhalingsdepressie, bevallingsduur, hypotensie, temperatuur, urineretentie, misselijkheid/braken, jeuk, mate van motorisch blok, postspinale punctie hoofdpijn, epiduraal abces/ hematoom.
- Neonatale complicaties: opname NICU, Apgarscore < 7 bij 5 min, foetale hartslag afwijkingen, temperatuur, pH a. umbilicalis, mortaliteit, negatieve uitkomsten voor de baby op lange termijn.
- maternale/ neonatale sterfte.
- Kosten.
Relevante uitkomstmaten
De werkgroep achtte pijnintensiteit, tevredenheid, modus partus en maternale/ neonatale sterfte voor de besluitvorming kritieke uitkomstmaten; en motorisch blok en Apgarscore < 7 bij 5 minuten voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt: pijnintensiteit (VAS-schaal 0 tot 10/ NRS schaal 100) en tevredenheid (rapportcijfer) gemeten volgens gevalideerde instrumenten, waarbij scores door de patiënt zelf gedurende of direct na de bevalling gerapporteerd werden. Voor neonatale Apgarscore wordt de definitiescore van < 7 bij 5 minuten aangehouden. Voor de overige uitkomstmaten definieerde de werkgroep niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Naast significantie wordt de klinische besluitvorming vooral bepaald door de klinische relevantie van de waargenomen verschillen tussen behandelopties. Voor dichotome uitkomstmaten definieerde de werkgroep een minimaal klinisch (patiënt) relevant verschil volgens de grenzen van de GRADE-working group, namelijk een verschil in relatief risico van 25%. Voor de continue kritieke uitkomstmaten definieerde de werkgroep een verschil van 10% op pijnintensiteit of tevredenheid als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 26 maart 2018 met relevante zoektermen gezocht naar studies die sufentanil versus fentanyl vergelijken, alsmede hetzelfde middel in verschillende doseringen (bijvoorbeeld sufentanil lage dosis versus sufentanil hoge dosis) bij zwangere vrouwen met baringspijn en een pijnbehandelingsverzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 599 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: Studiedesign RCT’s of ander vergelijkend onderzoek, epiduraal bevat een combinatie van lokaal anestheticum met opioïd, studies gepubliceerd voor 26 maart 2018 en beschrijving van minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden door de methodologisch adviseur in eerste instantie 184 studies voorgeselecteerd, waarna twee beoordelaars 55 studies selecteerden voor full-tekst selectie. Na raadpleging van de volledige tekst, werden vervolgens 47 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vijf studies definitief geselecteerd. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Bernard, J. M., Le Roux, D., Barthe, A., Jourdain, O., Vizquel, L., & Michel, C. (2001). The dose-range effects of sufentanil added to 0.125% bupivacaine on the quality of patient-controlled epidural analgesia during labor. Anesthesia & Analgesia, 92(1), 184-188.
- Boselli, E., Debon, R., Cimino, Y., Rimmelé, T., Allaouchiche, B., & Chassard, D. (2004). Background infusion is not beneficial during labor patient-controlled analgesia with 0.1% ropivacaine plus 0.5 μg/ml sufentanil. Anesthesiology: The Journal of the American Society of Anesthesiologists, 100(4), 968-972.
- Carvalho, B., Cohen, S. E., Giarrusso, K., Durbin, M., Riley, E. T., & Lipman, S. (2005). “Ultra-light” patient-controlled epidural analgesia during labor: effects of varying regimens on analgesia and physician workload. International journal of obstetric anesthesia, 14(3), 223-229.
- Cohen, S., Amar, D., Pantuck, C. B., Pantuck, E. J., Goodman, E. J., & Leung, D. H. (1996). Epidural analgesia for labour and delivery: fentanyl or sufentanil?. Canadian Journal of Anaesthesia, 43(4), 341-346.
- Herman, N. L., Sheu, K. L., Van Decar, T. K., Rubin, J. D., Gadalla, F., Koff, H. D., & Reynolds, J. E. (1998). Determination of the analgesic dose–response relationship for epidural fentanyl and sufentanil with bupivacaine 0.125% in laboring patients. Journal of clinical anesthesia, 10(8), 670-677.
- Loftus, J. R., Hill, H., & Cohen, S. E. (1995). Placental transfer and neonatal effects of epidural sufentanil and fentanyl administered with bupivacaine during labor. The Journal of the American Society of Anesthesiologists, 83(2), 300-308.
- Rolfseng, O. K., Skogvoll, E., & Borchgrevink, P. C. (2002). Epidural bupivacaine with sufentanil or fentanyl during labour: a randomized, double-blind study. European journal of anaesthesiology, 19(11), 812-818.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: Wat is de effectiviteit van epidurale analgesie vergeleken met pethidine bij zwangere vrouwen met baringspijn en een pijnbestrijdingswens?
Sufentanil HOOG versus Fentanyl HOOG
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Cohen, 1996
|
Type of study: DB-RCT
Setting: Hospital
Country: France
Conflict of interest: NR
|
Inclusion criteria: -parturients classified as ASA physical status I or II -requested epidural analgesia were
Exclusion criteria: -complicated course of pregnancy, -abnormal fetal heart rate before randomization
N total at baseline: Intervention: n=67 Control: n= 86
Important prognostic factors Age, mean (range) I: 29,8 (22-40) C: 29,7 (19-39)
Height (cm, mean, sd) I: 163 (6) C: 165 (6)
Weight (kg, mean, sd) I: 70 (8) C: 73 (9)
Primiparous (%) I: 69.7 C: 61.7
Cervical dilatation (cm, mean, sd) I: 3.6 (0.9) C: 3.5 (0.8)
Groups comparable at baseline? Yes |
Group 1: Bupivacaïne (0,015%) + Sufenta 1.5 ug ml±1 |
Group 2: Bupivacaïne (0,015%) + Fenta 2.0 ug ml±1 |
Length of follow-up: NR
Loss-to-follow-up: NR
Incomplete outcome data: NR
|
|
PICO 4: Sufentanil HOOG versus. Fentanyl HOOG
|
|
Herman, 1998
|
Type of study: RCT
Setting: Hospital
Country: India
Conflict of interest: |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: n=50 Control: n=50
Important prognostic factors:
Age ± SD: I: 30.20±5.16 C: 29.40±6.18
Height (in cm) I: 155.2±7.12 C: 153.4±8.42
Weight (in kg) I: 52.80±5.62 C: 51.40±5.82
ASA Grade (I:II) I: 38:12 C: 36:14
Nulliparous: Multiparous I: 33:17 C:35:15
Gestational age (in wks) I: 40.20±2.60 C: 39.80±2.40
Groups comparable at baseline? |
Group-I: patients received 10 ml of a mixture consisting of 0.0625%, bupivacaine and 20mg/ml sufentanil.
|
Group-II: patients received 10 ml of a mixture consisting of 0.125% bupivacaine and 20mg/ml sufentanil. |
Length of follow-up:
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
|
PICO 4: Sufentanil HOOG versus. Fentanyl HOOG
|
|
Jorrot, 1989
|
Type of study: RCT
Setting: Hospital
Country: France
Conflict of interest: No external funding or competing interests declared. |
Inclusion criteria: ASA I or II primiparous; age ≥ 18 yrs; singleton pregnancy; gestational age ≥ 36 wks; spontaneous labour cervical dilatation ≤7 cm.
Exclusion criteria: breech, contra-indication to epidural due to haemodynamic, infectious, allergic, neurological or haematological reasons, weight > 110 kg, height < 150 cm, multiple pregnancy, multiparity, induced labour, pre-eclampsia, or any fetal abnormality.
N total at baseline: Intervention (LOW): 65 Control (HIGH): 60
Important prognostic factors: Age ± SD: I: 27.7 ± 4.4 C: 27.4 ± 3.8
Gestational age (median in wks, range) I: 40 (37-41) C: 40 (37-43)
Comparable at baseline? Yes |
Group-I: levobupi laag 0.568mg/ml-1 + 0.45mcg/ml sufenta PCEA device
levobupivacaine 0.0625% plus sufentanil (final concentration 0.0568%) |
Group-II: levobupi hoog 1.136mg/ml-1 + 0.45mcg/ml sufenta PCEA device
levobupivacaine 0.125% plus sufentanil (final concentration: 0.1136%) |
Length of follow-up: until the parturient delivered or if caesarean section was performed
Loss-to-follow-up: 11 excluded Reasons: induced labour (before randomisation), incl at 9 cm cervical dilation, violation of the rescue protocol, data unavailable from the PCEA device, loss of the case report form, subdural catheterisation and high level of anaesthesia forbidding any reinjection (before randomisation).
Incomplete outcome data: Unclear, not reported
|
|
PICO 4: Sufentanil HOOG versus. Fentanyl HOOG
In conclusion, our results confirm the expected conclusions, i.e. that levobupivacaine 0.0625% plus sufentanil (final concentration 0.0568%) provides safe, but sometimes insufficient analgesia, whilst levobupivacaine 0.125% plus sufentanil (final concentration: 0.1136%) provides better analgesia, but with a higher total administered dose of local anaesthetic. |
|
Loftus, 1995
|
Type of study: RCT
Setting: Hospital
Country: Spain
Conflict of interest: not reported |
Inclusion criteria: Primiparous, cervical dilatation ≤ 4 cm and contractions of moderate intensity, full-term ≥ 37 wks, single fetus, cephalic position, ASAI-II.
Exclusion criteria: those who received parental analgesics within 1h before carrying out epidural. Height < 150cm, weight > 100kg, expected duration labour <1h, history of alcoholism or drug addiction, any history of allergy, idionsyncrasy or hypersensitivity to amide local anaesthetics.
N total at baseline: Intervention (LOW): 40 Control (HIGH): 40
Important prognostic factors: Age ± SD: (LOW): 31.2 ± 3.3 Control (HIGH): 32.2 ± 3.5
Gestational age (in wks) I: 39.5 ± 1.1 C: 39.1 ± 1.5
Comparable at baseline? Yes |
Group-I: Initial dose: ropi 0.2% 18mg with 50ug fenta.
Ropi 0.1% + 2ug/mL fenta 10 ml/h CI. |
Group-II: Initial dose: ropi 0.2% 18mg with 50ug fenta.
Ropi 0.2% + 2ug/mL fenta 8ml/h CI. |
Length of follow-up: up till full dilatation or decision to perform a section caesarean.
Loss-to-follow-up: Intervention: N= 2 Reasons (describe): initial analgesia inadequate
Control: N=1 Reasons (describe): initial analgesia inadequate
Incomplete outcome data: See loss to FU, figure 1 gives number of participants per timepoint. However, not further explained in the results section.
|
|
PICO 4: Sufentanil HOOG versus. Fentanyl HOOG
|
|
Rolfseng, 2002, |
Type of study: RCT
Setting: Hospital
Country: Belgium/ Germany
Conflict of interest: funding by department of anaesthesiology and intensive care, universitatsklinikum, Germany. No conflicts declared. |
Inclusion criteria: term parturients, ASA I-II, single fetus, vertex presentation.
Exclusion criteria: prior administration of sedatives, analgesics, confounding medical disease, premature labour and contraindications for regional analgesia.
N total at baseline: Intervention (G1): 102 Control (G2): 103 Control (G3): 100
Important prognostic factors: Age ± SD: NR
Nulliparous: Multiparous (%/%) I (G1): 27/ 73 C (G2): 39/ 61 C (G3): 36/ 64
Gestational age (in wks) I (G1): 39.2 ± 1.3 C (G2): 39.0 ± 1.3 C (G3): 38.9 ± 1.5
Comparable at baseline? Yes |
Group-I: bupi 10mL 0.125% with sufentanil 0.75 ug/mL. PCEA device. |
Group-II: ropi 0.125% with sufentanil 0.75ug/mL. PCEA device.
Group-II: ropi 0.175% with sufentanil 0.75ug/mL. PCEA device.
|
Length of follow-up: up until delivery.
Loss-to-follow-up: N= 39 had to be excluded due to insufficient analgesia.
Incomplete outcome data: N= 83 incomplete data (fig 3) |
|
PICO 4: Sufentanil HOOG versus. Fentanyl HOOG
Alleen groep 1 versus 2/3 relevant voor deze PICO. Groep 4 is zonder opioid.
Voetnoot aan figuren. Vergelijking A: Bupi 0.125% versus Ropi 0.125% Vergelijking B: Bupi 0.125% versus Ropi 0.175% |
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Debon, 2001 |
Randomized by sealed envelopes. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Cohen, 1996 |
Blockrandomisation by opagued envelopes |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Herman, 1998 |
Method of randomnization not described |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Jorrot, 1989 |
Block randomisation |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Loftus, 1995 |
Randomly allocated. Methods not described. |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Rolfseng, 2002 |
Randomly allocated by a computer generated list. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Wang, 2014 |
Voldoet niet aan PICO-criteria: vergelijkt epiduraal met opioïde en LA versus alleen LA |
|
Capogna, 2004 |
Narratieve review |
|
Marucci, 2004 |
Narratieve review |
|
Mayberry, 2002 |
Voldoet niet aan PICO-criteria: vergelijkt bijwerkingen epiduraal/CSA/PCEA |
|
Vedagiri, 2017 |
Voldoet niet aan PICO-criteria: vergelijkt alleen initiële bolus en geen onderhoud |
|
Gamela, 2015 |
Conference abstract |
|
Freitas, 2014 |
Conference abstract |
|
Ngan, 2014 |
Voldoet niet aan PICO-criteria: evaluatie van synergetische interactie tussen fentanyl en bupivacaïne |
|
Bang, 2012 |
Voldoet niet aan PICO-criteria: vergelijkt alleen initiële bolus en geen onderhoud |
|
Sindik, 2012 |
Voldoet niet aan PICO-criteria: vergelijkt FEN/SUF met geen opioïde |
|
Tang, 2011 |
Artikel in het Chinees |
|
Bang, 2010 |
Artikel in het Chinees |
|
Kalra, 2010 |
Voldoet niet aan PICO-criteria: Fentanyl (hoog) versus Sufentanil (laag) |
|
Lilker, 2009 |
Voldoet niet aan PICO-criteria: Fentanyl (hoog) versus Sufentanil (laag) |
|
Tsai, 2009 |
Voldoet niet aan PICO-criteria: Fentanyl (hoog) versus Fentanyl (hoog) |
|
Wilson, 2009 |
Voldoet niet aan PICO-criteria: vergelijk FEN+LA versus LA (alleen) |
|
Wong, 2009 |
Geen primair vergelijkend onderzoek |
|
Siddik, 2008 |
Voldoet niet aan PICO-criteria: vergelijkt alleen initiële bolus en geen onderhoud |
|
Bamber, 2006 |
Narratieve review |
|
Rigouzzo, 2006 |
Conference abstract |
|
Beilin, 2005 |
Voldoet niet aan PICO-criteria |
|
Bernard, 2004 |
Voldoet niet aan PICO-criteria |
|
Capogna, 2004 |
Voldoet niet aan PICO-criteria: MLAC studie |
|
Wong, 2004 |
Voldoet niet aan PICO-criteria: Fentanyl (hoog) versus Fentanyl (hoog) |
|
Connelly, 2003 |
Voldoet niet aan PICO-criteria: vergelijkt alleen initiële bolus en geen onderhoud |
|
Nelson, 2002 |
Voldoet niet aan PICO-criteria: MLAC studie |
|
Bernard, 2001 |
Voldoet niet aan PICO-criteria: Sufentanil (laag) versus Sufentenil (laag) |
|
Capogna, 2001 |
Voldoet niet aan studiecriteria: up-down sequential allocation |
|
COMET, 2001 |
Voldoet niet aan PICO-criteria: vergelijkt epiduraal met opioïde en LA en CSE versus LA only |
|
Connelly, 2000 |
Voldoet niet aan PICO-criteria: Sufentanil (hoog) versus Sufentenil (hoog) |
|
Eriksson, 2000 |
Voldoet niet aan PICO-criteria: Sufentanil (hoog) versus Sufentenil (hoog) |
|
Angst, 1998 |
Letter to the editor |
|
Camann, 1998 |
Voldoet niet aan PICO-criteria |
|
Polley, 1998 |
Voldoet niet aan PICO-criteria: MLAC studie |
|
Scrutton, 1998 |
Voldoet niet aan PICO-criteria: vergelijkt alleen initiële bolus en geen onderhoud |
|
Garcia-Munoz, 1997 |
Artikel in het spaans |
|
Lyons, 1997 |
Voldoet niet aan PICO-criteria: MLAC studie |
|
Russell, 1996 |
Voldoet niet aan PICO-criteria: Fentanyl (hoog) versus Sufentanil (laag) |
|
Kudialis, 1995 |
Voldoet niet aan PICO-criteria: Fentanyl (hoog) versus Sufentanil (laag) |
|
Vertommen, 1994 |
Voldoet niet aan PICO-criteria: Sufentanil (hoog) versus Sufentenil (hoog) |
|
Breen, 1993 |
Voldoet niet aan PICO-criteria: vergelijkt FEN + LA met LA alleen |
|
Russell, 1993 |
Voldoet niet aan PICO-criteria: Fentanyl (hoog) versus Sufentanil (laag) |
|
Vertommen, 1991 |
Voldoet niet aan PICO-criteria: vergelijkt bolus injecties LA + SUF met LA alleen |
|
Yau, 1990 |
Geen full-tekst aanwezig |
|
Celeno, 1988 |
Voldoet niet aan PICO-criteria: Fentanyl (hoog) versus Fentanyl (hoog) |
|
Milon, 1986 |
Artikel in het Frans |
|
Lo, 1999 |
Voldoet niet aan PICO: onderzoekt effect van initiële bolus |
|
Cheng, 2001 |
Voldoet niet aan PICO: onderzoekt effect van initiële bolus |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-07-2020
Beoordeeld op geldigheid : 03-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijnmodule deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Opioïden |
NVA |
2019 |
2024 |
5-jaarlijks |
De regiehouder |
Nieuwe evidence |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
De ontwikkeling van de richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
- Dr. W.L.M.C.M. Schellekens, extern voorzitter
- Drs. I.C.M. Beenakkers, anesthesioloog, werkzaam in het UMC Utrecht, NVA
- Drs. F.A. Klerk, anesthesioloog, werkzaam in het Diakonessenhuis Utrecht, NVA
- Drs. C.E. Kam-Endtz, anesthesioloog, werkzaam in het Haaglanden Medisch Centrum, NVA
- Dr. F.T.H. Lim, gynaecoloog, werkzaam in het IJssellandziekenhuis, NVOG
- Dr. L.M. Freeman, gynaecoloog, werkzaam in het Ikazia Ziekenhuis Rotterdam, NVOG
- Dr. J.M. Middeldorp, gynaecoloog, werkzaam in het Leids Universitair Medisch Centrum, NVOG
- Drs. A.G. Kaspers, kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Drs. L.A.M. Moll, klinisch verloskundige, werkzaam in het St. Antonius Ziekenhuis Nieuwegein, KNOV
- Dr. J. de Boer, beleidsmedewerker bij KNOV
- Drs. S. Ratsma-Wesselius, Obstetrisch verpleegkundige, werkzaam bij het Amsterdam UMC, Locatie AMC, V&VN
- Dr. J.E. Nagtegaal, Ziekenhuisapotheker, werkzaam in het Meander Medisch Centrum, NVZA
- Dr. A.M.D.E. Timmerman, Klinisch Fysicus, werkzaam in het UMC Utrecht, NVKF
- Drs. J.C. Mooij, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
Met ondersteuning van
- Dr. E.M.E. den Breejen, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. Harmsen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schellekens |
gepensioneerd, ZZP: strategisch adviseur |
Lid RvT Diakonessenhuis, Utrecht |
Geen |
Geen |
|
Klerk |
Staf Anesthesiologie Diakonessenhuis Utrecht. |
bestuurslid Obst. Anesth. onbetaald |
Geen |
Geen |
|
Ratsma Wesselius |
Senior verpleegkundige Verloscentrum AMC |
Gastdocent VU Amstel Academie verpleegkundige vervolgopleidingen Obstetrie, betaald |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog WKZ/UMCU |
Voorzitter sectie obstetrische anesthesie van de NVA. Onbetaald |
Echtgenoot werkzaam bij GSK |
Geen |
|
Nagtegaal |
Ziekenhuisapotheker Meander Medisch Centrum |
Beroepenveldcommissie Farmakunde Hogeschool Utrecht, onbetaald |
Geen |
Geen |
|
Timmerman |
Staffunctionaris Klinische Fysica & Patiëntveiligheid |
Lid NIVEL expertgroep infuustechnologie - advies maken kennistoets voor verpleegkundigen – onbetaald Lid ondernemingsraad UMC Utrecht - onbetaald |
EMRP Researcher Grant Metrology for Drug Delivery HLT07- REG1 €120,422.88 USPTO Applicaton #: #20160106909 Apparatus for simultaneous multiple medicament administration |
Geen |
|
Kam-Endtz |
Anesthesioloog Haaglanden MC |
Geen |
Geen |
Geen |
|
Middeldorp |
Gynaecoloog-perinatoloog |
Geen |
Geen |
Geen |
|
Moll |
Klinisch verloskundige/research verloskundige in het St. Antoniusziekenhuis in Nieuwegein |
Geen |
Geen |
Geen |
|
Freeman |
Gynaecoloog |
voorzitter multidiciplinaire werkgroep obstetrische anesthesie
|
Mijn promotieonderzoek naar epidurale analgesie en remifentanil is gesubsidieerd door ZonMw. Dit onderzoek is afgerond maar de resultaten zullen gebruikt worden in deze richtlijn |
Geen |
|
Mooij |
Beleidsmedewerker Patiëntenvereniging Nederland |
Vrijwilligerswerk (onbetaald) patiëntenorganisatie CCUVN |
Geen |
Geen |
|
Kaspers |
Kinderarts-neonatoloog, MST Enschede |
Geen |
Geen |
Geen |
|
De Boer |
Beleidsmedewerker richtlijnontwikkeling |
Geen nevenwerkzaamheden |
Geen |
Geen |
|
Lim |
gynaecoloog |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patientenfederatie Nederland in de werkgroep te laten deelnemen. De conceptmodule is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland. Daarnaast is door de Patiëntenfederatie Nederland een achterbanraadpleging verricht, waarvan de uitkomsten zo veel mogelijk meegenomen zijn in de overwegingen van de modules.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze modules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, (2010)), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit inventarisatie van de knelpunten door de commissie van de NVA bleek dat er een noodzaak was voor revisie van deze richtlijnmodules. Tevens zijn tijdens een fysieke knelpunteninventarisatie knelpunten aangedragen door aanpalende stakeholders inclusief patiëntenorganisaties. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroepleden en de adviseur uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Indicatoren over zwangerschap en geboorte zijn reeds onderdeel van de vervaardigde indicatoren bij de zorgstandaard integrale geboortezorg. Derhalve zijn er bij deze modules geen indicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules werden aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
|
1 exp Labor, Obstetric/ or exp Delivery, obstetric/ or exp Labor pain/ or exp Analgesia, obstetric/ or (labor or labour or childbirth or parturient*).ti,ab. 174224 2 exp Analgesia, Epidural/ or epidural*.ti,ab. 39308 3 (concentration* or dose or doses or dosed or dosage).ti,ab. 2695324 4 exp Sufentanil/ or sufenta*.ti,ab. or Sulfentan*.ti,ab. 2672 5 Fentanyl/ or (fentan* or phentan*).ti,ab. 20396 6 4 or 5 or opioid*.ti. 51061 7 1 and 2 and 3 and 6 598 8 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) 335041 9 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) 1705532 10 limit 7 to (dutch or english) 515 11 10 and (8 or 9) |
(na ontdubbeling) 599
(na voorselectie adviseur) 184 |
|
Embase (Elsevier) |
#11 #10 AND (#8 OR #9) #10 #7 AND ((dutch)/lim OR (english)/lim) 654 #9 ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it 2,080,389 #8 ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT 'conference abstract':it 305,834 #7 #1 AND #2 AND #3 AND #6 739 #6 #4 OR #5 OR opioid*:ti 99,402 #5 'fentanyl'/exp OR fentan*:ab,ti OR phentan*:ab,ti 59,630 #4 'sufentanil'/exp OR sufenta*:ab,ti OR sulfentan*:ab,ti 8,482 #3 'dose'/exp OR concentration*:ab,ti OR dose:ab,ti OR doses:ab,ti OR dosed:ab,ti OR dosage:ab,ti 3,767,452 #2 'epidural analgesia'/exp OR ((epidural NEAR/3 analges*):ab,ti) 11,351 #1 'labor'/exp OR 'obstetric delivery'/exp OR 'labor pain'/exp OR 'obstetric analgesia'/exp OR labor:ab,ti OR labour:ab,ti OR childbirth:ab,ti OR parturient*:ab,ti 259,725 |
|
|
Cochrane library - CENTRAL |
(labor:ab,ti OR labour:ab,ti OR childbirth:ab,ti OR parturient*:ab,ti) AND (epidural NEAR/3 analges*:ab,ti) AND (concentration*:ab,ti OR dose:ab,ti OR doses:ab,ti OR dosed:ab,ti OR dosage:ab,ti) AND (sufenta*:ab,ti OR sulfentan*:ab,ti OR fentan*:ab,ti OR phentan*:ab,ti) 381 |
