CSE versus epidurale analgesie
Uitgangsvraag
Wat is de effectiviteit van CSE vergeleken met epidurale analgesie bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
Aanbeveling
Maak op lokaal niveau de keuze tussen CSE of epidurale analgesie voor routinematige toepassing.
Overweeg CSE bij vergevorderde baring en/of een standsafwijking.
Overwegingen
De onderstaande overwegingen gelden in principe voor de gehele patiëntenpopulatie zoals geformuleerd in de uitgangsvraag.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het wezenlijke verschil tussen epidurale analgesie en CSE is de oplaadbolus, deze wordt respectievelijk in de epidurale ruimte en intrathecaal toegediend. De intrathecale bolus zal een sneller en intenser effect hebben. De onderstaande resultaten kunnen daar dan ook allemaal aan toegeschreven worden.
Pijnintensiteit is in 1 RCT opgenomen als uitkomstmaat (Gambling, 2013). Er werd gekeken naar de intensiteit 1 uur na de eerste injectie. Beide groepen hadden een VPRS van < 1. De CSE-groep had een significant beter resultaat, maar dit verschil was niet klinisch relevant. Bij uitkomstmaten die gerelateerd zijn: tijdsduur tot effectieve pijnbehandeling, effectieve pijnbehandeling op 10 min en cross-over naar andere pijnmedicatie is er een licht voordeel voor CSE-groep. Echter, een duidelijk klinisch relevant verschil blijft ook bij deze uitkomstmaten uit. Voordelen van CSE zijn de snellere effectieve pijnstilling (100% effectieve pijnstilling na 10 min versus 51% bij de epidurale analgesie-groep, met een gemiddeld verschil in het aantal minuten tot effectieve pijnstilling van -5,79 min; 95% BI -7,41; -4,1 in het voordeel van de CSE-groep). Daarnaast kan CSE voordelen bieden wanneer er sprake is van een standsafwijking en 8 tot 9 cm ontsluiting. De diepere analgesie die dan ontstaat geeft een betere mogelijkheid tot ontsluiten.
Patiënt tevredenheid is in beide groepen hoog zonder significant verschil tussen de groepen. Postdurale punctie hoofdpijn kwam in beide groepen weinig voor (incidentie: 1,2% bij CSE en 0,3% bij epidurale analgesie) waarbij geen significant verschil tussen de groepen. Ook konden er geen significante verschillen aangetoond worden in het aantal instrumentele bevallingen of sectio’s caesarea en ook de Apgarscores en opnames op NICU was gelijk binnen de groepen.
Overige nadelige effecten/bijwerkingen van CSE en epidurale analgesie zijn motorisch blok, urineretentie en misselijkheid/braken. Er zijn geen significante verschillen gevonden bij deze uitkomstmaten. Men moet wel rekening houden met een significant verhoogde kans op jeuk (44% versus 25%) bij CSE en een licht verhoogde kans op hypotensie (9% versus 5%). Bij toediening van een lage dosering opioïden zijn geen afwijkingen van foetaal hartritme te verwachten in de vergelijking tussen CSE en epidurale analgesie (Patel, 2014).
De sterkte van de bewijskracht voor de cruciale uitkomstmaten varieert van laag tot redelijk. Concluderend zijn er weinig klinisch relevante verschillen tussen de twee technieken, behoudens een snellere en diepere analgesie bij CSE na de eerste injectie. Dit geeft echter voor de overall beleving van de zwangere vrouw geen positievere uitkomst. Een mogelijk voordeel van CSE, welke niet als uitkomstmaat is opgenomen maar wel terug te vinden is in de literatuur, is een hogere kans op een juist geplaatste epiduraal katheter. Er is minder kans op geen of inadequaat blok (resp. CSE versus EA: geen blok: 10 versus 14%, Inadequaat blok 4.2 versus 8.4%; of een unilateraal blok (CSE versus EA: RR 0.48) (Niesen, 2013; Heesen, 2014).
Waarden en voorkeuren van patiënten
Beide technieken hebben nagenoeg gelijke uitkomsten. Voor de beleving van de zwangere vrouw zijn er weinig verschillen tussen beide technieken. CSE geeft een snellere en diepere pijnstilling dan de epidurale analgesie, maar 5 minuten eerder pijnstilling op een gemiddelde duur van pijnbehandeling van meerdere uren is een klein verschil. Hierin moet ook in overweging genomen worden dat er een grotere kans op bijwerkingen bestaat, zoals jeuk en hypotensie en CTG veranderingen.
Epidurale pijnbehandeling is in ieder ziekenhuis beschikbaar voor zwangere vrouwen met en een verzoek tot pijnbehandeling tijdens de bevalling. Echter, niet alle ziekenhuizen maken gebruik van de CSE-techniek of deze wordt niet op regelmatige basis toegepast. Tijdens de voorlichting moet de zwangere vrouw geïnformeerd worden over de beschikbare pijnbehandelingsopties. Zwangere vrouwen willen al tijdens de zwangerschap informatie over de verschillende vormen van pijnbehandeling, de voor- en de nadelen en wat dit betekent in hun situatie en willen hierover samen beslissen. Uit de meldactie blijkt dat dit nog onvoldoende in de praktijk gebeurt en vastgelegd wordt. Zie voor wijze van counselen en de vergelijking van de verschillende opties de module ‘Counseling: Samen beslissen‘.
Kosten (middelenbeslag)
Er is geen onderzoek naar kostenverschillen tussen CSE of epidurale analgesie. Echter, op basis van de literatuur kan men concluderen dat er qua zorgkosten met betrekking tot complicaties en langere baringsduur geen verschillen zullen optreden.
Aanvaardbaarheid voor de overige relevante stakeholders
Epidurale analgesie is in ieder ziekenhuis beschikbaar voor zwangere vrouwen met baringspijn en een pijnbehandelingsverzoek. CSE is niet in elk ziekenhuis beschikbaar of wordt niet op regelmatige basis toegepast. Op lokaal niveau kan worden bepaald welke techniek routinematig toe te passen.
Haalbaarheid en implementatie
Er zijn geen harde indicaties om CSE boven epidurale analgesie te verkiezen of vice versa. Uit veiligheidsoverwegingen (verschillen in medicatie dosering en concentratie) is het aan te raden één techniek voor de routinematige toepassing te hanteren op de afdeling verloskunde. Welke dat is moet lokaal afgesproken worden.
CSE kan wel zinvol zijn bij vergevorderde baring, ook als men de epidurale analgesie als standaardtechniek gebruikt. Op indicatie kan spinaal bijgegeven worden. Mogelijk is scholing van verpleegkundig personeel en verloskundigen noodzakelijk.
Aanbeveling-1
Rationale / balans tussen voor- en nadelen van de interventie
Beide technieken zijn efficiënte manieren van pijnbehandeling tijdens de bevalling. De werkgroep acht de onderlinge verschillen tussen CSE en epidurale analgesie zo gering dat beide technieken in gelijke mate aanbevolen worden voor pijnbehandeling tijdens de bevalling.
Aanbeveling-2
Rationale / balans tussen voor- en nadelen van de interventie
In geval van een vergevorderde baring en/of een standsafwijking kan het zinvol zijn om snelle pijnstilling te bereiken door een lage dosis opioïd met of zonder lokaal anestheticum toe te dienen.
Onderbouwing
Achtergrond
Combined Spinal Epidural (CSE) analgesie geeft een snellere aanvang van pijnstilling en daardoor mogelijk betere tevredenheid van de parturiënt. In Nederland wordt deze techniek momenteel niet veel toegepast. Deze uitgangsvraag is bedoeld om een update van de literatuur te geven over de gewenste en ongewenste effecten, zodat een advies gegeven kan worden over of en wanneer deze techniek het beste toepasbaar is.
Conclusies / Summary of Findings
|
Laag GRADE |
Zwangeren behandeld met CSE lijken een lagere pijnintensiteit op 1 uur na eerste injectie te rapporteren dan zwangeren behandeld met epidurale analgesie. Het is onzeker of dit verschil ook een klinisch relevant verschil reflecteert.
Bronnen: (Gambling, 2013) |
|
Laag GRADE |
Zwangeren behandeld met CSE lijken een lagere pijnintensiteit direct na de bevalling te rapporteren dan zwangeren behandeld met epidurale analgesie. Het is onzeker of dit verschil ook een klinisch relevant verschil reflecteert.
Bronnen: (Ismael, 2012) |
|
Redelijk GRADE |
CSE leidt waarschijnlijk tot een snellere effectieve pijnbehandeling na eerste injectie in vergelijking met epidurale analgesie.
Bronnen: (Cohen, 2006; Gambling, 2013; Kartawiadi, 1996; Ngamprasertwong, 2007; Nickells, 2000; Sezer, 2007; Van de Velde, 1999) |
|
Zeer laag GRADE |
Zwangeren behandeld met CSE lijken mogelijk vaker effectieve pijnbehandeling op 10 minuten na eerste injectie te ervaren dan zwangeren behandeld met epidurale analgesie.
Bronnen: (Zeidan, 2004) |
|
Laag GRADE |
Zwangeren behandeld met CSE lijken een lager risico op andere/aanvullende pijnmedicatie te hebben dan zwangeren behandeld met epidurale analgesie.
Bronnen: (Cohen, 2006; Gambling, 2013; Gomzez, 2001; Goodman, 2006; Hepner, 2000; Nickells, 2000; Patel, 2014; Price, 1998; Zeidan, 2004) |
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in patiënttevredenheid na behandeling middels CSE in vergelijking met epidurale analgesie.
Bronnen: (Cohen, 2006; Gambling; Gomzez, 2001; Goodman, 2006; Hepner, 2000; Nickells, 2000; Price, 1998; Zeidan, 2004) |
|
Zeer laag GRADE |
Het is onzeker of het risico op post durale punctie hoofdpijn verschilt tussen behandeling met CSE en epidurale analgesie.
Bronnen: (Hepner, 2000; Kartawiadi, 1996; Ngamprasertwong, 2007; Parry, 1998; Price, 1998; Zeidan, 2004) |
|
Laag GRADE |
Er lijkt geen verschil in de mate van motorische blokkade tussen behandeling met CSE vergeleken met epidurale analgesie.
Bronnen: (Cohen, 2006; Parry, 1998; Patel, 2014; Price, 1998; Zeidan, 2004) |
|
Laag GRADE |
Zwangeren behandeld met CSE lijken vaker jeukklachten te ervaren in vergelijking met epidurale analgesie.
Bronnen: (Cohen, 2006; Gomez, 2011; Goodman, 2006; Hepner, 2000; Kartawiadi, 1996; Ngamprasertwong, 2007; Patel, 2014; Price, 1998; Sezer, 2007; Skupski, 2009; Tsen, 1999; Van de Velde, 1999; Vernis, 2004; Zeidan, 2004) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op urineretentie tussen CSE en epidurale analgesie.
Bronnen: (Hepner, 2000; Kartawiadi, 1996; Ngamprasertwong, 2007; Parry, 1998; Price, 1998; Zeidan, 2004) |
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in het risico op misselijkheid/braken tussen CSE en epidurale analgesie.
Bronnen: (Gomez, 2011; Hepner, 2000; Mitra, 2015; Ngamprasertwong, 2007; Patel, 2014; Sezer, 2007; Skupski, 2009; Tsen, 1999; Van de Velde, 1999; Zeidan, 2004) |
|
Laag GRADE |
Zwangeren behandeld met CSE lijken een hoger risico te hebben op hypotensie in vergelijking met epidurale analgesie.
Bronnen: (Cohen, 2006; Gambling, 2013; Gomez, 2011; Goodman, 2006; Hepner, 2000; Kartawiadi, 1996; Mitra, 2015; Ngamprasertwong, 2007; Nickells, 2000; Patel, 2014; Parry, 1998; Price, 1998; Skupski, 2009; Tsen, 1999; Van de Velde, 1999; Vernis, 2004; Zeidan, 2004) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op een vaginale kunstververlossing tussen CSE en epidurale analgesie.
Bronnen: (Gambling, 2013; Gomez, 2011; Hepner, 2000; Kartawiadi, 1996; Ngamprasertwong, 2007; Patel, 2014; Price, 1998; Sezer, 2007; Tsen, 1999; Van de Velde, 1999; Vernis, 2004; Zeidan, 2004) |
|
Laag GRADE |
Er lijkt geen verschil in het risico op een sectio caesarea tussen CSE en epidurale analgesie.
Bronnen: (Gambling, 2013; Gomez, 2011; Hepner, 2000; Kartawiadi, 1996; Ngamprasertwong, 2007; Patel, 2014; Price, 1998; Sezer, 2007; Tsen, 1999; Van de Velde, 1999; Vernis, 2004; Zeidan, 2004) |
|
Laag GRADE |
Er lijkt geen verschil in het aantal neonaten met een Apgarscore < 7 op vijf minuten tussen CSE en epidurale analgesie.
Bronnen: (Abrao, 2009; Bhagwat, 2008; Gambloing, 2013; Gomez, 2011; Goodman, 2006; Hepner, 2000; Kartawiadi, 1996; Ngamprasertwong, 2007; Price, 1998; Sezer, 2007; Skupski, 2009; Tsen, 1999; Van de Velde, 1999; Vernis, 2004; Zeidan, 2004) |
Samenvatting literatuur
Beschrijving studies
Voor het beantwoorden van de uitgangsvraag werd de Cochrane review van Simmons (2012) als uitgangspunt gebruikt en aangevuld met recente RCT’s (Gambling, 2013; Mitra, 2015; Patel, 2014). De review van Simmons (2012) includeerde enkel RCT’s. Quasi-RCT’s en cross-over studies werden geëxcludeerd. Alle studies vergeleken Combined Spinal-Epidural (CSE) met epidurale analgesie in een populatie zwangere vrouwen met het verzoek tot behandelen van de baringspijn.
Zowel de CSE-technieken als de toegepaste epidurale analgesie verschilden tussen de studies. Er werden verschillenden opioïden (fentanyl of sufentanil) en lokaal anesthetica (bupivacaine of ropivacaïne ) gebruikt. De dosering bupivacaïnevarieerde tussen de studies (0,004% tot 0,25%). De meta-analyse van Simmons (2012) includeerde ook studies die doseringen bupivacaine ≥ 0,125% gaven. Deze studies werden niet meegenomen in deze literatuuranalyse aangezien deze niet tot nauwelijks meer worden toegepast in de klinische praktijk (Abouleish, 1991; Breen, 1999; Caldwell, 1994; COMET, 2001a; Cortes, 2007; Dunn, 1998; Roux, 1999; Thomas, 2005).
In totaal zijn er 23 RCT’s opgenomen in de literatuuranalyse die voldoen aan de PICO-criteria (Abrao, 2009; Bhagwat, 2008; Gambling, 2013; Cohen, 2006; Gomez, 2001; Goodman, 2006; Hepner, 2000; Ismail, 2012; Kartawiadi, 1996; Mitra, 2015; Medina, 1994; Ngamprasertwong, 2007; Nickells, 2000; Parry, 1998; Patel, 2003; Patel, 2014; Price, 1998; Sezer, 2007; Skupski, 2009; Tsen, 1999; Van de Velde, 1999; Vernis, 2004; Zeidan, 2004). Alle RCT's zijn overwegend van redelijke kwaliteit (zie RoB beoordeling in Simmons, 2012). In alle gevallen betreft het open-label RCT’s. Het ontbreken van blindering van de interventie heeft mogelijk een effect gehad op de resultaten door introductie van performance bias. Daarmee is er enige kans op vertekening van resultaten (risk of bias) voor pijnbeleving en tevredenheid pijnbehandeling. De RCT’s hanteren verschillende inclusie- en exclusiecriteria wat mogelijk kan leiden tot klinische heterogeniteit. Alle RCT’s includeerden een populatie zwangere vrouwen met een pijnbehandelingsverzoek die CSE of epidurale analgesie ontvingen. Voor de individuele studiekarakteristieken en resultaten van de geïncludeerde studies en beoordeling van de studieopzet (risk of bias) wordt verwezen naar de publicatie van Simmons (2012) inclusief de appendix). Een beknopt overzicht van de belangrijkste karakteristieken van de geïncludeerde studies, aangevuld met ontbrekende gegevens over enkele relevante uitkomstmaten zijn opgenomen in de evidence-tabel.
In 16 studies werd de mate van ontsluiting gerapporteerd als een specifiek inclusie criterium waarbij de ontsluiting varieerde van ≤ 4 cm (Goodman, 2006; Tsen, 1999; Zeidan, 2004), 5 cm (Bhagwat, 2008; Gomez, 2001; Hepner, 2000; Patel, 2014; Kartawiadi, 1996; Medina, 1994; Price, 1998; Sezer, 2007), 6 cm (Abrao, 2009; Vernis, 2004) of 7 cm (Van de Velde, 1999). De overige zes studies beschreven niet specifiek de mate van ontsluiting als inclusiecriterium. In drie studies werd enkel het effect van de initiële intrathecale of epidurale bolus gerapporteerd en werd data analyse gestopt op het moment dat een ‘top-up’ dosering gevraagd werd (Nickells, 2000; Parry, 1998; Patel, 2003). Achttien studies beschreven een pre-load van crystalloid alvorens het inbrengen van de epidurale analgesie of CSE; volume werd niet gerapporteerd of varieerde tussen de 500 mL (Gambling, 2013; Gomez, 2001; Price, 1998; Vernis, 2004) en 1000 mL (Mitra, 2015; Patel, 2014; Parry, 1998; Skupski, 2009; Tsen, 1999; Zeidan, 2004). Drie studies relateerden de bolus aan het gewicht van de vrouw of de tijd, namelijk 10 ml/kg (Abrao, 2009; Bhagwat, 2008) of 15 ml/kg na 15 minuten (Van de Velden, 1999).
In 18 RCT’s werd een ‘single-space, needle-through-needle techniek’ gebruikt in de CSE groep en vijf studies definieerden de gebruikte techniek niet nader (Abrao, 2009; Cohen, 2006; Gambling, 2013; Goodman, 2006; Ismail, 2012; Mitra, 2015; Patel, 2003a; Patel, 2014; Skupski, 2009). In de CSE groep konden twee typen interventies worden onderscheiden: lokaal anestheticum plus opioïden (Abrao, 2009; Bhagwat, 2008; Cohen, 2006; Gambling, 2013; Gomez, 2001; Goodman, 2006; Hepner, 2000; Ismail, 2012 Kartawiadi, 1996; Medina, 1994; Ngamprasertwong, 2007; Nickells, 2000; Parry, 1998; Patel, 2003; Price, 1998; Skupski, 2009; Van de Velde, 1999; Vernis, 2004; Zeidan, 2004) of enkel opioïden (Sezer, 2007). Het inbrengen van de epiduraal of CSE werd in 16 studies in zittende of laterale positie uitgevoerd. In vier studies werd de positie van toediening niet gerapporteerd. Er was een grote heterogeniteit tussen de RCT’s met betrekking tot CSE-technieken voor zowel lokaal anestheticum als opioïden. Een overzicht van het gebruikte medicament en dosering is weergegeven inde evidencetabellen.
Resultaten
Pijnintensiteit één uur na start analgesie
Pijnintensiteit op één uur na toediening pijnmedicatie is in één van de 22 RCT’s onderzocht. De studie van Gambling (2013) maakt gebruik van de Verbal Rating Pain Scale (VPRS). Dit is een schaal die varieert van 0= geen pijn tot 10= meest erge pijn mogelijk. De gemiddelde VPRS-score op één uur na het toedienen van de eerste injectie was 0,3 (SD= 1,1) in de CSE-groep en 0,7 (SD= 1,7) in de epidurale analgesie groep, statistisch significant in het voordeel van de CSE-groep (gemiddeld verschil -0,4; 95% BI= (-0,76 tot -0,16); p<0,001; n= 800 zwangeren). Dit verschil lijkt niet klinische relevant.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat pijnintensiteit is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met 1 niveau vanwege imprecisie. Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Pijnintensiteit na de bevalling
Pijnintensiteit na de bevalling is in één van de 22 RCT’s onderzocht. De studie van Ismail (2012) maakt gebruik van de Visual Analog Scale. Dit is een schaal van 100 mm die varieert van 0= geen pijn tot 100= meest erge pijn mogelijk. De gemiddelde VAS-score direct na de bevalling was 22,56 (SD= 7,57) in de CSE-groep en 35,60 (SD=10,2) in de epidurale groep, statistisch significant in het voordeel van de CSE-groep (gemiddelde verschil -13,10; 95% BI= (12,28; 13,80); p<0,01, n=760 zwangeren).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat pijnintensiteit na de bevalling is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met 1 niveau vanwege imprecisie. Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Tijdsduur tot effectieve pijnbehandeling
Het verschil in tijdsduur tot effectieve pijnbehandeling vanaf het moment dat de eerste injectie werd gegeven tussen de CSE-groep en epidurale analgesie groep is onderzocht in acht van de 22 RCT’s (Figuur 1). Na meta-analyse bedraagt het gemiddelde tijdsverschil tot effectieve pijnbehandeling na eerste injectie tussen de groepen (gemiddeld verschil -5,79 min; 95% BI= (-7,41; -4,1); p<0,001; n= 1371 zwangeren), statistisch significant in het voordeel van de CSE-groep. Vanwege de grote statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd (zie hoofdtekst). Random effect-model laat een overall statistische heterogeniteit zien van I2= 83%; p<0,001.
Figuur 1 tijdsduur tot effectieve pijnbehandeling
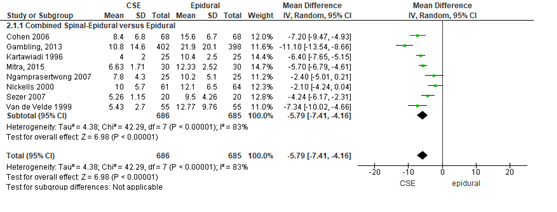
Meta-analyse en forest plot van het effect Combined Spinal-Epidural in vergelijking met epidurale analgesie op de tijdsduur tot effectieve pijnbehandeling na eerste injectie in minuten
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat tijdsduur tot effectieve pijnbehandeling is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
Effectieve pijnbehandeling op 10 minuten
Het verschil in aantal zwangeren dat effectieve pijnbehandeling rapporteerde op 10 minuten na het moment van analgesie tussen de CSE-groep en de epidurale analgesie-groep is onderzocht in de studie van Zeidan (2004). Zeidan (2004) includeerde 101 zwangeren met het verzoek tot behandelen van de baringspijn welke gerandomiseerd werden verdeeld in de CSE-groep (n=50) en de epidurale groep (n=51). Alle zwangeren in de CSE-groep rapporteerden op 10 minuten effectieve pijnbehandeling, terwijl in de epidurale analgesie 26 zwangeren effectieve pijnbehandeling rapporteerden op 10 minuten na eerste toediening analgesie (51%). Het gemiddelde RR voor effectieve analgesie op 10 minuten na eerste toediening analgesie was RR: 1,94 (95% BI 1,49 tot 2,54) p<0,001; n= 101 zwangeren, statistisch significant in het voordeel van de CSE-groep (Figuur 2).
Figuur 2 effectieve pijnbehandeling op 10 minuten
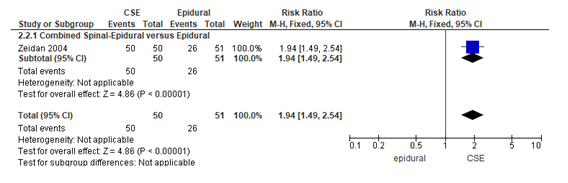
Relatieve risico van effectieve pijnbehandeling op 10 minuten na toedienen eerste analgesie voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat effectieve pijnbehandeling op 10 minuten is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met 2 niveaus vanwege ernstige imprecisie (te geringe studieomvang). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Cross-over naar andere/aanvullende pijnmedicatie
Het verschil in aantal zwangeren dat aanvullende pijnmedicatie nodig had tussen de CSE-groep en epidurale analgesie groep werd onderzocht in tien van de 22 RCT’s (Figuur 3). In de RCT’s van Hepner (2000) en Zeidan (2004) werd geen aanvullende pijnmedicatie gegeven; de RR’s in deze studies konden niet worden bepaald en zijn niet meegenomen in de overall meta-analyse. Het gemiddelde relatieve risico voor toediening aanvullende pijnmedicatie is RR: 0,84 (95% BI 0,72 tot 0,98) p= 0,03; n= 2317 zwangeren, statistisch significant in het voordeel van de CSE-groep. Vanwege de grote statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd (zie hoofdtekst). Random effect-model laat een overall statistische heterogeniteit zien van I2= 61%; p= 0,01.
Figuur 3 aanvullende pijnmedicatie
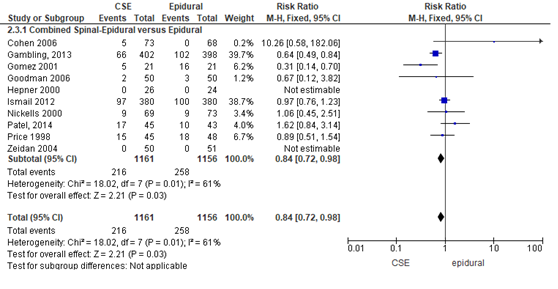
Meta-analyse en forest plot van het relatieve risico voor het toedienen van aanvullende pijnmedicatie voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat cross over naar aanvullende pijnmedicatie is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met 1 niveau vanwege het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Patiënttevredenheid pijnbehandeling
De patiënttevredenheid werd in acht van de 22 RCT’s onderzocht. Zowel in de CSE-groep als in de epidurale analgesie groep was het percentage zwangeren dat tevreden was met de behandeling hoog; 93% in de CSE-groep (n= 661) en 88% in de epidurale analgesie groep (n= 659). Het gemiddelde relatieve risico voor patiënttevredenheid was RR: 1,02 (95% BI 0,98 tot 1,06); p= 0,26; n= 1320 zwangeren, geen statistisch significant verschil tussen de twee groepen (Figuur 4).
Figuur 4 patiënttevredenheid
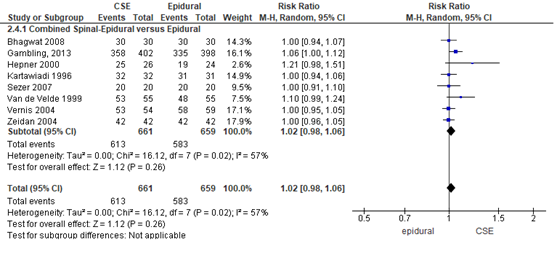
Meta-analyse en forest plot van het relatieve risico voor patiënttevredenheid pijnbehandeling voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat patiënttevredenheid is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
Post durale punctie hoofdpijn (belangrijke uitkomstmaat)
Post durale punctie hoofdpijn werd in zeven van 19 RCT’s onderzocht. In beide groepen kwam post durale punctie hoofdpijn sporadisch voor. In vijf RCT’s werd er geen post durale punctie hoofdpijn gerapporteerd en kon het relatieve risico niet worden bepaald (Hepner, 2000; Ngamprasertwong, 2007; Parry, 1998; Price, 1998; Van de Velde, 1999; Zeidan, 2004). In de meta-analyse worden de relatieve risico’s van twee studies meegenomen (Kartawiadi, 1996; Vernis, 2004). Post durale punctie hoofdpijn werd door vier zwangeren gerapporteerd in de CSE-groep en door één vrouw in de epidurale analgesie groep. Het gemiddelde relatieve risico was RR: 3,06 (95% BI 0,50 tot 18,69); p= 0,23; n= 640 zwangeren, geen statistisch significant tussen de twee groepen (Figuur 5).
Figuur 5 post durale punctie hoofdpijn
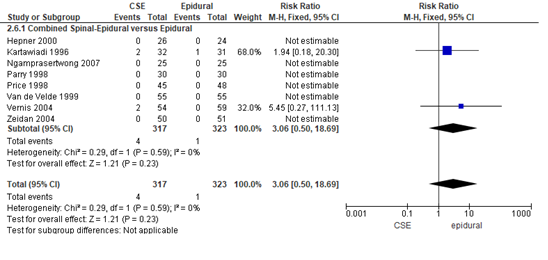
Meta-analyse en forest plot van het relatieve risico voor het aantal zwangeren dat post durale punctie hoofdpijn rapporteert voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat post durale punctie hoofdpijn is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met twee niveau’s verlaagd vanwege het brede betrouwbaarheidsinterval en de geringe studiepopulatie (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Motorisch blok
Het aantal zwangeren zonder motorisch blokkade (mobiliseert) werd in vier van de 19 RCT’s onderzocht. De definitie van de Cochrane review van Simmons (2012) wordt aangehouden en specificeert motorische blokkade als het aantal zwangeren dat kon lopen tijdens de bevalling. Het percentage zwangeren dat mobiliseert was 49% in de CSE-groep (n= 253) en 51% in de epidurale analgesie groep (n= 250). Het gemiddelde relatieve risico voor het aantal zwangeren dat mobiliseert was RR: 0,94 (95% BI 0,76 tot 1,16); p= 0,58; n= 503 zwangeren, geen statistisch significant tussen de twee groepen (Figuur 6).
Figuur 6 Motorisch blok
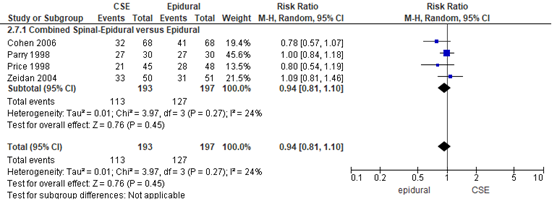
Meta-analyse en forest plot van het relatieve risico voor het aantal zwangeren dat een mate van motorisch blok heeft voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat motorisch blok is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en 1 niveau vanwege de geringe studieomvang (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Jeuk
Het verschil in aantal zwangeren dat jeukklachten rapporteert tussen de CSE-groep en epidurale analgesie-groep werd onderzocht in 16 van de 22 RCT’s (Figuur 7). In twee studies werden geen jeukklachten gerapporteerd en kon het relatieve risico niet worden bepaald (Zeidan, 2004; Tsen, 1999). Jeukklachten kwamen voor in 27% van de zwangeren in de CSE-groep en in 16% van de zwangeren in de epidurale analgesie-groep. Het gemiddelde relatieve risico voor jeuk was RR: 1,94 (95% BI 1,32 tot 2,85); p<0,001; n= 1984 zwangeren, statistisch significant in het voordeel voor de epidurale analgesie groep (Figuur 7). Vanwege de grote statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd (zie hoofdtekst). Random effect-model laat een overall statistische heterogeniteit zien van I2= 83%; p<0,001.
Figuur 7 jeuk
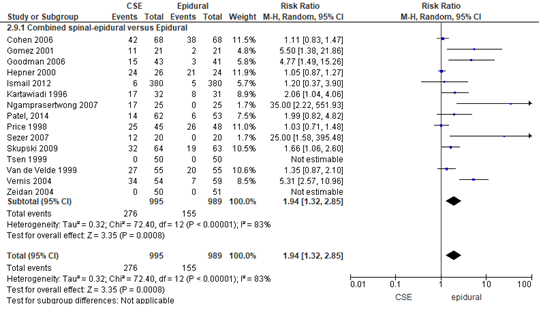
Meta-analyse en forest plot van het relatieve risico voor het aantal zwangeren met jeukklachten voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat jeuk is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met 1 niveau vanwege de geringe studieomvang (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Urineretentie
Het verschil in aantal zwangeren met urineretentie tussen de CSE-groep en epidurale analgesie groep werd onderzocht in twee van de 22 RCT’s (Figuur 8). Het percentage zwangeren urineretentie was 18% in de CSE-groep (n= 20) en 28% in de epidurale analgesie-groep (n= 32). Het gemiddelde relatieve risico voor het aantal zwangeren met urineretentie was RR: 0,64 (95% BI 0,39 tot 1,04); p= 0,07; n= 229 zwangeren, geen statistisch significant verschil tussen de twee groepen (Figuur 8).
Figuur 8 urineretentie
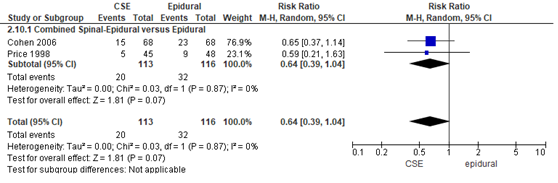
Meta-analyse en forest plot van het relatieve risico voor het aantal zwangeren met urineretentie voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat urineretentie is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met 2 niveaus verlaagd vanwege het brede betrouwbaarheidsinterval en de geringe studieomvang (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Misselijkheid/braken
Het verschil in aantal zwangeren met misselijkheidsklachten/braken tussen de CSE-groep en epidurale analgesie groep werd onderzocht in tien van de 22 RCT’s (Figuur 9). Misselijkheidsklachten/braken kwam niet voor in twee RCT’s en daarom kon het relatieve risico in deze studies niet worden bepaald (Tsen, 1999; Zeidan, 2004). Het percentage zwangeren met misselijkheidsklachten/braken was 8% in de CSE-groep (n= 60) en 9% in de epidurale analgesie groep (n= 68). Het gemiddelde relatieve risico voor het aantal zwangeren met misselijkheidsklachten/braken was RR: 0,88 (95% BI 0,64 tot 1,23); p= 0,46; n= 1555 zwangeren, geen statistisch significant tussen de twee groepen (Figuur 9).
Figuur 9 misselijkheidsklachten/braken
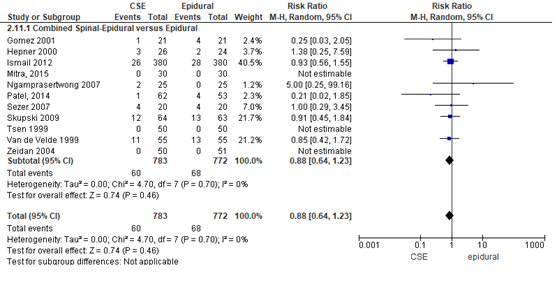
Meta-analyse en forest plot van het relatieve risico voor het aantal zwangeren met misselijkheidsklachten/braken voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat misselijkheid/braken is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie), en met twee niveaus vanwege geringe studieomvang en brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Hypotensie
Het verschil in aantal zwangeren met hypotensie tussen de CSE-groep en epidurale analgesie groep werd onderzocht in 17 van de 22 RCT’s (Figuur 10). Hypotensie kwam niet voor in zes RCT’s en daarom kon het relatieve risico in deze studies niet worden bepaald (Gomez, 2001; Kartawiadi, 1996; Parry, 1998; Price, 1998; Tsen, 1999; Zeidan, 2004). Het percentage zwangeren met hypotensie was 9% in de CSE-groep (n= 100) en 5% in de epidurale analgesie groep (n= 57). Het gemiddelde relatieve risico voor het aantal zwangeren met hypotensie was RR: 1,57 (95% BI 1,01 tot 2,42); p= 0,04; n= 2229 zwangeren, statistisch significant verschillend in het voordeel van de epidurale analgesie (Figuur 10).
Figuur 10 hypotensie
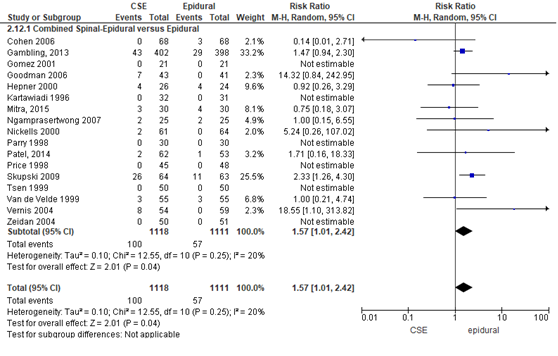
Meta-analyse en forest plot van het relatieve risico voor het aantal zwangeren met hypotensie voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat hypotensie is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met 1 niveau vanwege het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Ademhalingsdepressie
Ademhalingsdepressies werden in drie van de 22 RCT’s onderzocht. Er werden geen ademhalingsdepressies geconstateerd in deze studies. Het is niet mogelijk om relatieve risico’s te berekenen en verschillen tussen beide groepen te bepalen (Hepner, 2000; Vernis, 2004; Zeidan, 2004).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ademhalingsdepressie is niet beoordeeld middels GRADE gezien het ontbreken van events.
Modus partus - vaginale kunstverlossing
Het verschil in aantal zwangeren met een vaginale kunstverlossing tussen de CSE-groep en epidurale analgesie-groep werd onderzocht in 13 van de 22 RCT’s (Figuur 11). In de studie van Sezer (2007) werden geen vaginale kunstverlossingen gerapporteerd. Het percentage zwangeren dat beviel middels vaginale kunstverlossing was 13% in de CSE-groep (n= 154) en 14% in de epidurale analgesie-groep (n= 165). Het gemiddelde relatieve risico op een vaginale kunstverlossing was RR: 0,93 (95% BI 0,76 tot 1,14); p= 0,48; n= 2437 zwangeren, geen statistisch significant verschil tussen de twee groepen (Figuur 11).
Figuur 11 Vaginale kunstverlossing
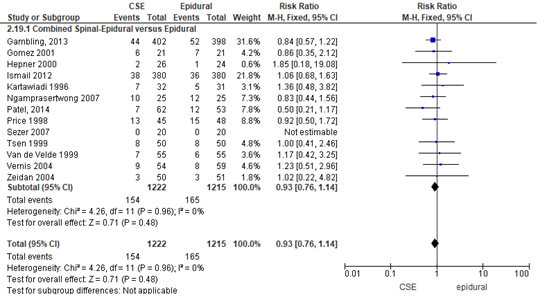
Meta-analyse en forest plot van het relatieve risico voor het aantal zwangeren met een vaginale kunstverlossing voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat modus partus- vaginale kunstverlossing is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie), en met 1 niveau vanwege het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Modus partus - sectio caesarea
Het verschil in het aantal sectio caesarea tussen de CSE-groep en epidurale analgesie-groep werd onderzocht in 17 van de 22 RCT’s (Figuur 13). Het percentage bevallingen per sectio caesarea was 18% in de CSE-groep (n= 246) en 18% in de epidurale analgesie groep (n= 245). Het gemiddelde relatieve risico op een sectio caesarea was RR: 0,99 (95% BI 0,84 tot 1,16); p= 0,89; n= 2785 zwangeren, geen statistisch significant verschil tussen de twee groepen (Figuur 12).
Figuur 12 sectio ceasarea
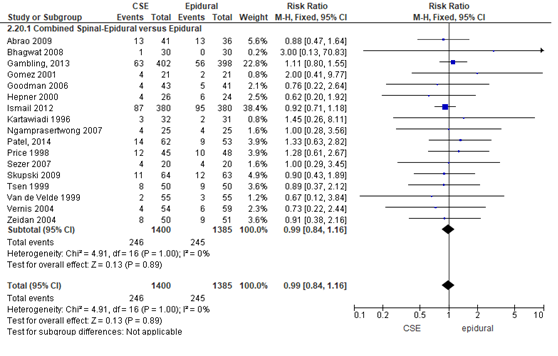
Meta-analyse en forest plot van het relatieve risico voor het aantal zwangeren met een sectio caesarea voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat sectio caesarea is met 1 niveau verlaagd vanwege het mogelijke risico op bias (geen blindering van interventie) en met 1 niveau vanwege het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Apgarscore < 7 op 5 minuten (belangrijke uitkomstmaat)
Het verschil in aantal neonaten met een Apgarscore < 7 op 5 minuten na de bevalling tussen de CSE-groep en epidurale analgesie-groep werd onderzocht in acht van de 22 RCT’s (Figuur 14). In twee studies hadden alle neonaten een Apgarscore van ≥ 7 op 5 minuten na de bevalling (Abrao, 2009; Van de Velde, 1990). In deze studies kon het relatieve risico niet worden bepaald (Abrao, 2009; Van de Velde, 1990). Het percentage neonaten met een Apgarscore < 7 op 5 minuten na de bevalling was 1,1% in de CSE-groep (n= 11) en 1,3% in de epidurale analgesie groep (n= 13). Het gemiddelde relatieve risico voor het aantal neonaten met een Apgarscore < 7 op 5 minuten na de bevalling was RR: 0,86 (95% BI 0,41 tot 1,81); p= 0,69; n= 1951 neonaten, geen statistisch significant verschil tussen de twee groepen (Figuur 13).
Figuur 13 Apgarscore < 7 op 5 minuten
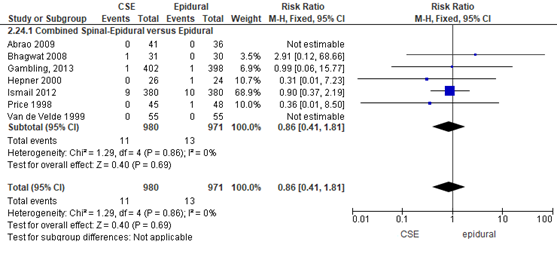
Meta-analyse en forest plot van het relatieve risico voor het aantal neonaten met een Apgarscore < 7 op 5 minuten na de bevalling voor de Combined Spinal-Epidural in vergelijking met de epidurale analgesie-groep
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat Apgarscore < 7 op vijf minuten score is met 2 niveaus verlaagd de geringe studieomvang en het brede betrouwbaarheidsinterval (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
Opname van neonaat op NICU
Het aantal opnames van de neonaat op de NICU werd in twee van de 19 RCT’s onderzocht. In deze studies werden geen neonaten overgeplaatst naar de NICU. Het is niet mogelijk om relatieve risico’s te berekenen en verschillen tussen beide groepen te bepalen (Hepner, 2000; Zeidan, 2004).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat opname NICU score is niet beoordeeld met GRADE gezien het ontbreken van events.
Kosten of kosten effectiviteit
Geen van de RCT’s rapporteert kosten of kosteneffectiviteit (Simmons, 2012).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van CSE vergeleken met epidurale analgesie bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
P: zwangere vrouwen met het verzoek tot behandelen van de baringspijn;
I: CSE (Combined Spinal Epidural);
C: epidurale analgesie;
O: zie onderstaand:
- Pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument);
- Tijdsduur tot effectieve pijnbehandeling;
- Tevredenheid ten aanzien van pijnstilling (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument).
- Borstvoeding.
- Modus partus (vaginale kunstverlossing, sectio caesarea).
- Maternale complicaties: convulsie/ eclamptisch insult, fluxus postpartum, ademhalingsdepressie, bevallingsduur, hypotensie, temperatuur, urineretentie, misselijkheid/braken, jeuk, mate van motorisch blok, postspinale punctie hoofdpijn, epiduraal abces/ hematoom.
- Neonatale complicaties: opname NICU, Apgarscore < 7 bij 5 min, foetale hartslag afwijkingen, temperatuur, pH a. umbilicalis, mortaliteit, negatieve uitkomsten voor de baby op lange termijn.
- Maternale/ neonatale sterfte.
- Kosten.
Relevante uitkomstmaten
De werkgroep achtte pijnintensiteit, tevredenheid ten aanzien van pijnstilling , modus partus en maternale/ neonatale sterfte voor de besluitvorming kritieke uitkomstmaten; en postspinale punctie hoofdpijn en ‘Apgarscore < 7 bij 5 min’ uitkomstmaten voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt: pijnintensiteit (VAS/ NRS-schaal of een ander gevalideerd instrument) en tevredenheid (rapportcijfer/ VAS/ NRS-schaal of een ander gevalideerd instrument), waarbij scores door de patiënt zelf gedurende of direct na de bevalling gerapporteerd werden. Voor neonatale Apgarscore wordt de definitiescore van < 7 bij 5 minuten aangehouden. Voor de overige uitkomstmaten definieerde de werkgroep niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Naast significantie wordt de klinische besluitvorming vooral bepaald door de klinische relevantie van de waargenomen verschillen tussen behandelopties. Voor dichotome uitkomstmaten definieerde de werkgroep een minimaal klinisch (patiënt) relevant verschil volgens de grenzen van de GRADE-working group, namelijk een verschil in relatief risico van 25%. Voor de continue uitkomstmaten definieerde de werkgroep een verschil van 10% op pijnintensiteit of tevredenheid als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
Het betreft een literatuurzoekactie gebaseerd op de Cochrane systematische review van Simmons (2012). In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 29 januari 2018 met relevante zoektermen gezocht naar studies die pijnbehandeling middels CSE vergeleken met alleen epidurale analgesie bij zwangere vrouwen met baringspijn. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 86 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Studiedesign RCT.
- Gepubliceerd tussen 1 januari 2010 en 29 januari 2018.
- Beschrijven van minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 36 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 32 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 4 studies definitief geselecteerd. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Gambling D, Berkowitz J, Farrell TR, Pue A, Shay D. A randomized controlled comparison of epidural analgesia and combined spinal-epidural analgesia in a private practice setting: pain scores during first and second stages of labor and at delivery. Anesth Analg. 2013 Mar;116(3):636-43. doi: 10.1213/ANE.0b013e31827e4e29. Epub 2013 Feb 11. PubMed PMID: 23400985.
- Mitra S, Arora J, Ahuja V, Takkar N. Combined spinal-epidural for labor analgesia with low-dose bupi- vacaine but without any opioid in the spinal component: can we improve upon the traditional? Acta Anaesthesiol Belg. 2015;66(4):9-15. PubMed PMID: 27108464.
- Ismail MT, Hassanin MZ. Neuraxial analgesia versus intravenous remifentanil for pain relief in early labor in nulliparous women. Arch Gynecol Obstet. 2012 Dec;286(6):1375-81. doi: 10.1007/s00404-012-2459-3. Epub 2012 Jul 19. PubMed PMID: 22810619.
- Patel NP, Armstrong SL, Fernando R, Columb MO, Bray JK, Sodhi V, Lyons GR. Combined spinal epidural versus epidural labour analgesia: does initial intrathecal analgesia reduce the subsequent minimum local analgesic concentration of epidural bupivacaine? Anaesthesia. 2012 Jun;67(6):584-93. doi: 10.1111/j.1365-2044.2011.07045.x. Epub 2012 Mar 15. PubMed PMID: 22420645.
- Patel NP, El-Wahab N, Fernando R, Wilson S, Robson SC, Columb MO, Lyons GR. Fetal effects of combined spinal-epidural versus epidural labour analgesia: a prospective, randomised double-blind study. Anaesthesia. 2014 May;69(5):458-67. doi: 10.1111/anae.12602. PubMed PMID: 24738803.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de effectiviteit van CSE vergeleken met epidurale analgesie bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Simmons, 2012
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of (RCTs)
Literature search up to (March, 2012)
A: Abrao, 2009 B: Bhagwat, 2008 C: Cohen, 2006 D: Gomez, 2001 E: Goodman, 2006 F: Hepner, 2000 G: Kartawiadi, 1996 H: Medina, 1994 I: Ngamprasertwong, 2007 J: Nickells, 2000 K: Parry, 1998 L: Patel, 2003 M: Price, 1998 N: Sezer, 2007 O: Skupski, 2009 P: Tsen, 1999 Q: Van de Velde, 1999 R: Vernis, 2004 S: Zeidan, 2004
Update: U: Ismail, 2012 V: Mitra, 2015 W: Patel, 2014
Study design: RCT
Notes: A: Brazil. B: One still birth in the CSE group was excluded. C: USA. Abstracts only. D: Spanish (translated). F: USA. G: Belgium. H: Italy. Poster from ASRA meeting. I: Quinke needles used (27G). Thailand. J: UK. K: UK. L: UK. Abstract only M: UK. P: Funded solely from institutional and departmental sources. Q: Belgium. R: France. S: Saudi Arabia. T: Egypt.
|
Inclusion criteria SR: All published randomised controlled trials comparing combined spinal-epidural with epidural analgesia during labour.Cluster-randomised trials were considered for inclusion. Quasi RCTs and cross-over trials were not considered for inclusion in this review.
19 studies included
Important patient characteristics at baseline:
N, mean age A: 77 singleton, cephalic, full term B: 60 nulliparous women in labour, cephalic, singleton C: 136 parturients who requested epidural analgesia for labour pain D: 42 ASA 1 or 2 women in spontaneous labour with a singleton, vertex presentation fetus E: 100, ASA 1 to 2, parous (1 or more prior vaginal delivery) women at term in early labour (< 5 cm cervical dilatation) F: 50 healthy term parturients G: 63 ASA 1-3, singleton, vertex at 36-41 weeks’ gestation H: 28 women 3 to 5 cm dilatation, primigravid I: 50 women, nulliparous and multiparous, healthy, full term, in labour J: 142 women in established labour, gestation at least 36 weeks, singleton, cephalic fetus K: ASA 1 or 2 women at term requesting analgesia in the first stage of labour or elective LSCS under regional L: 115 healthy women, 2 to 6 cm dilatation requesting regional M: 100 women in labour cervix < 6 cm dilated N: 40 nulliparous women ASA 1 at term with singleton, cephalic fetus, in spontaneous labour with cervical dilatation less than 6 cm O: 127 women, 18 to 50 years old, term, cephalic, singleton, BMI < 40, with or without induction P: 100 women, nulliparous, ASA 1 or 2, at term, in spontaneous labour with singleton, cephalic fetus. Q: 110 women ASA 1 or 2, > 36 weeks with singleton, vertex fetus R: 113 healthy women 18 to 40 years, 3 to 6 cm dilatation in active labour, > 37 weeks’ gestation, singleton, vertex S: 104 women, ASA 1 to 2, requesting epidural, singleton, nulliparous, 36 to 41 weeks’ gestation, < 4 cm dilatation
T: 1,140 healthy nulliparous women, term, singleton pregnancies
Groups comparable at baseline? YES |
Describe intervention:
A: CSE, single space, needle to needle (n=41) 10 mL bupivacaine + sufentanil 10 μg B: CSE, single space, needle-through-needle, sitting or lateral position. IT injection of 1.25 mg bupivacaine + fentanyl 25 μg. C: CSE: 68 women received ropivacaine 2 mg with sufentanil 5 μg intrathecally followed by PCEA as control. D: CSE (n = 351): single space, needle-through-needle, sitting or lateral position. IT injection of 2.5 mg bupivacaine + fentanyl 25 μg. Then epidural boluses of 15 mL bupivacaine 0.1% + fentanyl 2 μg/mL on request D: CSE (n = 21): sitting, otherwise technique not stated. IT injection of bupivacaine 2.5 mg + 25 μg fentanyl + adrenaline 1:200,000. Once VAS of 3 to 4, 8 mL bupivacaine 0.125% + adrenaline 1:200,000 and an infusion of the same solution and rate as the epidural group E: CSE (n = 43): single space, needle-through-needle, 17 gauge Touhy needle and 27 gauge Whitacre needle, intrathecally bupivacaine 2.5 mg and fentanyl 25 μg Both groups were commenced on a continuous infusion of bupivacaine 0.0625% with fentanyl 2 μg/mL at 12 mL/hr within 15 min of administration of the spinal or epidural dose G: CSE (n = 32): single space, needle-through-needle, lateral. IT injection bupivacaine 1. 0 mg + sufentanil 5 μg + epinephrine 25 μg H: CSE: 3.75 mg bupivacaine plus 3 μg sufentanil I: CSE (n = 25): crystalloid preload. Single space, needle-through-needle, using Quicke 27 G needle. 25 μg of fentanyl injected intrathecally. Epidural catheter was inserted and 3 mL of 0.25% bupivacaine given as test dose, 0.0625% bupivacaine with fentanyl 2 μg/mL was infused at 12 mL/hr J: CSE (n = 69): single space, needle-through-needle, sitting. K: CSE (n = 30): fluid preloading as for the epidural group. Single space, needle-throughneedle, sitting. Intrathecal injection of bupivacaine 2.5 mg + fentanyl 25 μg in a total volume 2.5 mL. L: CSE: all women received intrathecal bupivacaine 2.5 mg + fentanyl 5 μg. M: CSE (n = 45): single space, needle-through-needle, lateral position, IT LA: 2.5 mg bupivacaine + 25 μg fentanyl then PCEA 15 mL 0.1% bupivacaine + fentanyl 2 μg/mL, 30 min N: CSE (n = 20): intrathecal dose of fentanyl 20 μg in 1.5 mL of saline plus epidural test dose of 3 mL of 1.5% lignocaine plus adrenaline after 45 minutes O: CSE (n = 64): 1 mL of 0.25% bupivacaine plus fentanyl 20 μg intrathecally Both groups received immediate infusion of bupivacaine 0.0625% plus fentanyl 2 μg/ mL at 12 mL/hr P: CSE (n = 50): 1000 mL crystalloid preload. Single space, needle-through-needle, lateral position. IT injection bupivacaine 2.5 mg + sufentanil 10 μg. Q: CSE (n = 55): 15 mL/kg crystalloid preload given over 15 min. Single space, needlethrough- needle, lateral position. IT injection bupivacaine 2.5 mg + sufentanil 1.5 μg + epinephrine 2.5 μg. R: CSE (n = 54): needle-through-needle with 2.5 mg bupivacaine plus 5 μg sufentanil. Test dose and initial ED followed by PCEA after return of pain S: CSE (n = 50): preload as above: 1.25 mg bupivacaine plus fentanyl 25 μg T: CSE (n=380) 2 mg levobupivacaine and 15 lg fentanyl (total volume of 2 mL) |
Describe control:
A: epidural (n=36) bupivacaine 2.5 mg + sufentanil 2.5 μg B: Epidural (n=30), test dose 3 mL 1.5% lidocaine plus 15 μg of epinephrine, followed by 10 mL bupivacaine 0.062% plus 0.0002% fentanyl. C: Epidural: 68 women received 20 mL ropivacaine 0.04% (8 mg) with adrenaline and sufentanil 1 μg/mL (20 μg) followed by PCEA using same solution with 4 mL bolus and 10 minute lockout plus background infusion of 4 mL/hr D: Epidural (n = 353): test dose 3 mL 2% lidocaine (60 mg) followed after 5 min with 10 mL bupivacaine 0.25%. Subsequent boluses of 10 mL bupivacaine 0.25% on request Low-dose infusion (n = 350): bolus of 15 mL bupivacaine 0.1% with fentanyl 2 μg/mL, followed by an infusion of the same at 10 mL/hr E: Epidural (n = 21): test dose 3 mL bupivacaine 0.25% + adrenaline 1:200,000 followed by 5 mL of the same solution. Immediate infusion of bupivacaine 0.125% with fentanyl 1 μg/mL at 8 mL/hr F: Epidural (n = 41) 3 mL test dose of 0.25% bupivacaine followed 5 min later by 10 mL of bupivacaine 0.125% with fentanyl 50 μg G: Epidural (n = 31): initial bolus 10 mL bupivacaine 0.125% + sufentanil 10 μg + epinephrine 12.5 μg. H: Epidural (n = 12): initial bolus 10 mL 0.125% bupivacaine, plus 10 μg sufentanil. I: Epidural (n = 25): crystalloid preload (quantity not stated). Test dose 3 mL of 0.25% bupivacaine plus bolus of 7 mL of 0.25% bupivacaine. Then infusion of 0.0625% bupivacaine with fentanyl at 12 mL/hr started immediately J: Epidural (n = 73): initial bolus 10 mL bupivacaine 0.125% + fentanyl 50 μg. Further boluses 10 mL bupivacaine 0.1% + fentanyl 2 μg/mL given on request for additional analgesia K: Epidural (n = 30): all women were preloaded with 500 to 1000 mL crystalloid prior to epidural insertion while sitting. Initial bolus 15 mL bupivacaine 0.1% with fentanyl 2 μg/mL L: Epidural (n = 53): all women received initial bolus 20 mL bupivacaine 0.1% + fentanyl 40 μg. M: Epidural (n = 48): 15 mL bupivacaine 0.1% + fentanyl 75 μg bolus then PCEA 10 mL bupivacaine 0.1% + fentanyl 2 μg/mL with 30 min lockout N: Epidural (n = 20): test dose of 3mL of lignocaine 1.5%plus adrenaline, then 7mL bolus of 0.1% bupivacaine plus fentanyl 50 μg O: Epidural (n = 63): 15 mL of bupivacaine 0.0625% plus fentanyl 2 μg/mL P: Epidural (n = 50): 1000 mL crystalloid preload. “Dummy” spinal (no dural puncture) before placement of catheter.Bolus 12mL bupivacaine 0.25%then infusion bupivacaine 0.125% + fentanyl 2 μg/mL at 10 mL/hr Q: Epidural (n = 55): 15 mL/kg crystalloid preload over 15 min. Bolus 10 mL bupivacaine 0.125% + sufentanil 0.75 μg/mL + epinephrine 1.25 μg/mL R: Epidural (n = 60): 0.125% bupivacaine plus sufentanil 7.5 μg, with adrenaline, volume based on height, 4 mL initially as test dose. 5 mL 0.125% bupivacaine given if analgesia inadequate at 15 min. S: Epidural (n = 51): 1000 mL Ringer’s preload, left lateral; 10 to 20 mL 0.0625% (6.25 to 12.5 mg) bupivacaine plus fentanyl 15 to 30 μg T: Epidural analgesia (n=380), 8-mL dose of 0.125% levobupivacaine with 2 lg/mL fentanyl |
End-point of follow-up: na
For how many participants were no complete outcome data available? (intervention/control) A: - B: CSE (n=1) C: - D: 0 E: CSE (n=1); Epidural (n=1) F: 0 G: 0 H: CSE (n=1); Epidural (n=1) I: 0 J: 0 K: 0 L: CSE (n=1); Epidural (n=1) M: 7 N: 0 O: 0 P: 0 Q: 0 R: Epidural (n=1) S: CSE (n=3); Epidural (n=1) T: 0 U: 0
|
Outcome measure Pain intensity at one hour after start analgesia. Effect measure: mean difference (95% CI): U: -0,4; 95% BI= (-0,76 tot -0,16); p< 0,001; n= 800 zwangeren. favoring CSE.
Outcome measure Pain intensity at one hour after start analgesia. Effect measure: mean difference (95% CI): T: -13,10; 95% BI= (12,28; 13,80); p<0,01, n=760 zwangeren. favoring CSE.
Outcome measur Time until effective analgesia (minutes). Effect measure: mean difference (95% CI): C: -7,20 (-9,47; -4,93) G: -6,40 (-7,65; -5,15) I: -2,40 (-5,01; 0,21) J: -2,10 (-4,24; 0,04) N: -4,24 (-6,17; -2,31) Q: -7,34 (-10,2; -4,66)
Pooled effect: -5,79 (95% CI -7,41 to -4,16) favoring CSE Heterogeneity (I2): 83%
Outcome measure Effective pain management at 10 minutes. Effect measure: RR (95% CI): S: 1,94 (1,49; 2,54) favoring CSE
Outcome measure Cross-over medication. Effect measure: RR (95% CI): C: 10,26 (0,58; 182,06) D: 0,31 (0,14; 0,70) E: 0,67 (0,12; 3,82) F: not estimated J: 1,06 (0,45; 2,51) L: 1,62 (0,84; 3,14) M: 0,89 (0,51; 1,54) S: not estimated
Pooled effect: -0,75 (95% CI 0,61; 0,93) favoring CSE Heterogeneity (I2): 61%
Outcome measure Patient satisfaction Effect measure: RR (95% CI): B: 1,00 (0,94; 1,07) F: 1,21 (0,98; 1,51) G: 1,00 (0,94; 1,06) N: 1,00 (0,91; 1,10) Q: 1,10 (0,99; 1,24) R: 1,00 (0,95; 1,05) S: 1,00 (0,96; 1,05)
Pooled effect: 1,02 (95% CI 0,98; 1,06); ns Heterogeneity (I2): 57%
Outcome measure Post Dural headache Effect measure: RR (95% CI): F: not estimated G: 1,94 (0,18; 20,30) I: not estimated K: not estimated M: not estimated Q: not estimated R: 5,45 (0,27; 111,13) S: not estimated
Pooled effect: 3,06 (95% CI 0,50; 18,69); ns
Outcome measure Motor block Effect measure: RR (95% CI): C: 0,78 (0,57; 1,07) K: 1,00 (0,84; 1,18) M: 0,80 (0,54; 1,19) S: 1,09 (0,81; 1,46)
Pooled effect: 0,94 (95% CI 0,81; 1,10); ns
Outcome measure Itching Effect measure: RR (95% CI): C: 1,11 (0,83; 1,47) D: 5,50 (1,38; 21,86) E: 4,77 (1,49; 15,26) F: 1,05 (0,87; 1,27) G: 2,06 (1,04; 4,06) I: 35,00 (2,22; 551,93) L: 1,99 (0,82; 4,82) M: 1,03 (0,71; 1,48) N: 25,00 (1,58; 395,48) O: 1,66 (1,06; 2,60) P: not estimated Q: 1,35 (0,87; 2,10) R: 5,31 (2,57; 10,96) S: not estimated
Pooled effect: -2,01 (95% CI 1,34; 3,02) favoring CSE Heterogeneity (I2): 85%
Outcome measure Vomiting D: 0,25 (0,03; 2,05) F: 1,38 (0,25; 7,59) I: 5,00 (0,25; 99,16) L: 0,21 (0,02; 1,85) N: 1,00 (0,29; 3,45) O: 0,91 (0,45; 1,84) P: not estimated Q: 0,85 (0,42; 1,72) S: not estimated
Pooled effect: 0,85 (95% CI 0,56; 1,31) favoring CSE Heterogeneity (I2): 0%
Outcome measure Hypotension C: 0,14 (0,01; 2,71) D: not estimated E: 14,32 (0,84; 242,95) F: 0,92 (0,26; 3,29) G: not estimated I: 1,00 (0,15; 6,55) J: 5,24 (0,26; 107,02) K: not estimated L: 1,71 (0,16; 18,33) M: not estimated O: 2,33 (1,26; 4,30) P: not estimated Q: 1,00 (0,21; 4,74) R: 18,55 (1,10; 313,82) S: not estimated
Pooled effect: 1,85 (95% CI 1,01; 2,42) favoring CSE Heterogeneity (I2): 20%
Outcome measure Instrumental delivery D: 0,86 (0,35; 2,12) F: 1,85 ( 0,18; 19,08) G: 1,36 (0,48; 3,82) I: 0,83 (0,44; 1,56) L: 0,50 (0,21; 1,17) M: 0,92 (0,50; 1,72) N: not estimated P: 1,00 (0,41; 2,46) Q: 1,17 (0,42; 3,25) R: 1,23 (0,51; 2,96) S: 1,02 (0,22; 4,82)
Pooled effect: 0,90 (95% CI 0,71; 1,12); ns Heterogeneity (I2): 0%
Outcome measure Sectio caesarea A: 0,88 (0,47; 1,64) B: 3,00 (0,13; 70,83) D: 2,00 (0,41; 9,77) E: 0,76 (0,22; 2,64) F: 0,62 (0,20; 1,92) G: 1,45 (0,26; 8,11) I: 1,00 (0,28; 3,56) L: 1,33 (0,63; 2,82) M: 1,28 (0,61; 2,67) N: 1,00 (0,29; 3,45) O: 0,90 ( 0,43; 1,89) P: 0,89 (0,37; 2,12) Q: 0,67 (0,12; 3,84) R: 0,73 (0,22; 2,44) S: 0,91 (0,38; 2,16)
Pooled effect: 1,04 (95% CI 0,85; 1,27); ns Heterogeneity (I2): 0%
Outcome measure Apgarscore ≤7 (5 min) A: not estimated B: 2,91 (0,12; 68,88) F: 0,31 (0,01; 7,23) M: 0,36 (0,01; 8,50) Q: not estimated
Pooled effect: 1,04 (95% CI 0,85; 1,27); ns Heterogeneity (I2): 0% |
Facultative:
Brief description of author’s conclusion:
‘There appears to be little basis for offering CSE over epidurals in labour, with no difference in overall maternal satisfaction despite a slightly faster onset with CSE and conversely less pruritus with low-dose epidurals. There was no difference in ability to mobilise, maternal hypotension, rate of caesarean birth or neonatal outcome.’
|
|
Gambling, 2013
|
Design: Prospective randomized study |
Inclusion: All patients provided written consent after the study had been explained to them. Inclusion criteria for participation included ability to speak and understand English, ASA physical status I to III, uncomplicated term labor, and patient request for neuraxial labor pain relief. |
Epi (n=398): An epidural kit (Arrow®) containing a 17-gauge Tuohy needle and 19-gauge FlexTip Plus® single-orifice atheter, and a 26-gauge Gertie Marx® spinal needle (5 in.; IMD, Park City, UT) were used for this study. Loss of resistance was achieved with saline and/or air according to the preference of the nesthesiologist. Women assigned to the epidural analgesia group received 10 mL 0.125% bupivacaine with fentanyl 2 μg/mL in 2 equal divided doses via the epidural needle, followed by 5 mL through the catheter. |
CSE (n=402): Women assigned to the CSE group received 2.5 mL of the same solution via the spinal needle before epidural catheter placement. PCEA was used to maintain analgesia for the remainder of labor and delivery using bupivacaine 1.25 mg/mL with fentanyl 2 μg/mL basal infusion 6 mL/h, PCEA bolus dose 5 mL, lockout interval 5 minutes, maximum hourly dose 26 mL |
NA. |
Outcome measure Pain intensity Epi: 1.9 ± 2.1 CSE: 1.4 ± 1.6 P-value < 0.001
Outcome measure Tijd tot pijnstilling Epi: 21.9 ± 20.1 CSE: 10.8 ± 14.6 P-value < 0.001
Outcome measure Tevredenheid Epi: 335/398 (95.7%) CSE: 358/402 (97.8%) P-value= 0,11
Outcome measure Hypotensie Epi: 43/402 CSE: 29/398 P-value= NS
Outcome measure Sectio C Epi: 56/402 CSE: 63/398 P-value= NS
Outcome measure Instrumentele bevalling Epi: 44/402 CSE: 52/398 P-value= NS
Outcome measure Apgar-score Epi: 17/402 CSE: 17/398 P-value= NS
|
‘Compared with traditional epidural labor analgesia, CSE analgesia provided better first-stage analgesia despite fewer epidural top-up injections by an anesthesiologist.’ |
|
Ismail, 2012
|
Design: Prospective randomized interventional study |
Inclusion: One thousand four hundred sixty healthy nulliparous pregnant women (with term, singleton pregnancies), who spontaneously went into established labor (with at least 2 painful uterine contractions in 10 min and the cervix is at least 80 % effaced and up to 3 cm dilated) and requesting labor analgesia, were eligible for the study (320 women were excluded). |
Epi: The epidural space was located at the L3–L4 interspace using loss of resistance to air (an 18-gauge Tuohy needle was used). In both groups, a 3-mL epidural test dose of 2 % lidocaine was given through the epidural catheter. After test dose, an 8-mL dose of 0.125 % levobupivacaine with 2 lg/mL fentanyl was administered through the epidural catheter. |
CSE The PCIA device was set to deliver 0.1 ug/kg of Ultiva (remifentanil
hydrochloride, Glaxo Operations UK Ltd, Barnard Castle, Durham, UK), diluted with saline and given as a solution of 25 ug/mL as a bolus infused during a period of 1 min, with a lockout time of 1 min, into an IV catheter attached to a one-way line providing continuous infusion of saline at approximately 100 mL/h. |
NA. |
Outcome measure Pijnintensiteit (VAS:0-100) Epi: 64.5 ± 12.84 CSE: 66.4 ± 11.50 P-value= NS
|
|
|
Mitra, 2015
|
Design: Randomized Control Trial. Random numbers were generated by computer. |
Inclusion: Sixty parturients were randomly assigned to two groups of 30 each by an investigator not involved in performing the block or subsequent monitoring of the parturients. age > 18 year, nulliparous, single gestation with cephalic presentation at ≥ 36 wk of gestation in early spontaneous labor (cervical dilation ≤ 5 cm) expected to have a vaginal delivery with a baseline pain score > 30 (on a 0-100 VAS) and requesting epidural analgesia for labor were enrolled for the study. Age: Epi: 25.1 ± 2.8; CSE: 25.50± 2.8 |
Epi: Epidural injection was given using midline technique with disposable 18G Tuohy’s needle. 10 ml of bupivacaine 1 mg/ml (0.1%) with 2 μg/ml fentanyl was given. If the patient still complained of pain after 10 min, patient was given a bolus of another 6ml of 0.1% of bupivacaine with 2 μg/ml of fentanyl. |
CSE: Spinal injection was given using needle-through-needle technique. Epidural injection was given using midline technique with disposable 18G Tuohy’s needle. Bupivacaine 0.5% (heavy) 2.5 mg was used to produce the subarachnoid block. All patients received continuous background infusion of 8ml of 0.1% of bupivacaine with 2 μg/ml of Fentanyl. |
NA. |
Outcome measure Misselijkheid/ Braken Epi: 0/30 CSE: 0/30 P-value= 1,00
Outcome measure Hypotensie Epi: 3/30 CSE: 4/30 P-value= 1,00
|
|
|
Patel, 2014
|
Design: Prospective, randomised and double-blind study designed primarily to determine epidural bupivacaine requirements for the second dose following initial spinal or epidural initiation of analgesia for labour |
Inclusion: ASA physical status 1– 2, singleton pregnancy of > 36 weeks, gestation with vertex presentation, and in active labour between 2 and 6 cm cervical dilatation. Age: Epi: 30.3 ± 5.2; CSE: 31.0 ± 5.3. |
Epi: The epidural group received 20 ml bupivacaine 0.1% with fentanyl 2 lg.ml1 over 3 min |
CSE: The CSE group received 2.5 ml of a mixture of bupivacaine 0.1% with fentanyl 2 lg.ml1 injected over 30 s |
NA. |
Outcome measure Misselijkheid/ Braken Epi: 2/53 CSE: 1/62 P-value= NS
Outcome measure Pruritus Epi: 6/53 CSE: 14/62 P-value= NS
Outcome measure Motor Block Epi: 0/53 CSE: 10/62 P-value= 0,002
Outcome measure Sectio C Epi: 14/53 CSE: 9/62 P-value= 0,002 |
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: Wat is de effectiviteit van CSE vergeleken met epidurale analgesie bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Simmons, 2012 |
YES |
YES |
Yes |
YES |
Not applicable |
YES |
Unclear |
YES |
YES |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat is de effectiviteit van CSE vergeleken met epidurale analgesie bij zwangere vrouwen met het verzoek tot behandelen van de baringspijn?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Gambling, 2013 |
Randomisation by an investigator not involved in performing the block or subsequent monitoring of the parturients. Random numbers were generated by computer. |
Unlikely |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Ismail, 2012 |
A computer-generated, random-number list to receive either EA (Group I), or patient-controlled IV analgesia (PCIA) with remifentanil (Group II) or combined spinal–epidural (CSE) analgesia (Group III).
The random-number list was generated by means of the QuickCalcs (GraphPad Software Inc., La Jolla, CA, USA). The group assignment numbers were sealed in an envelope and kept by the study supervisor |
Unlikely
|
Likely |
Likely |
Unclear |
Unlikely |
Unclear |
Unclear |
|
Mitra, 2015 |
A statistician created randomization tables for 4 subgroups of 200 women in blocks of 20 using Microsoft Excel’s random number generator. Specifically, for each block of 20, random numbers between 0 and 1 were assigned to the integers 1 to 20, then sorted so that the integers with the smallest 10 random numbers were assigned to epidural group and the largest 10 random numbers to the CSE group |
Unclear |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Patel, 2014 |
Upon request for neuraxial analgesia, the women were randomly assigned into two groups by a computer-generated random number table using Excel (Microsoft Corporation, Redmond, WA, USA). Parturients were randomly assigned to one of the two treatment regimens (CSE or epidural labour analgesia) using sealed opaque envelopes that contained details of group allocation. |
Unlikely |
Likely |
Unlikely |
Unclear |
Unclear |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Hattler, 2016 |
Studies in review komen terug in Cochrane review Simmons (2012) |
|
Magro-Malosso, 2016 |
Voldoet niet aan PICO |
|
Gizzo, 2014 |
Studies in review komen terug in Cochrane review Simmons (2012) |
|
Heesen, 2014 |
Voldoet niet aan PICO |
|
Bauer, 2012 |
Voldoet niet aan PICO, meta-analyse van observationele studies |
|
Hitzeman, 2012 |
Case beschrijving + samenvatting Simmons (2012) niet bruikbaar voor literatuuranalyse |
|
Jones, 2012 |
Overview artikel pijnstilling bij bevalling, niet bruikbaar voor literatuuranalyse |
|
Anim-Somuah, 2011 |
Relevante studies zijn beschreven in Simmons (2012) |
|
Mazul-Sunko, 2011 |
Narrative review |
|
Wassen, 2011 |
Voldoet niet aan PICO: timing pijnstilling |
|
Chau, 2017 |
Voldoet niet aan PICO: variant op CSE techniek |
|
Yacoubian, 2017 |
Voldoet niet aan PICO, tevens kleine sample (n=11, n=13) |
|
Chatrath, 2015 |
Voldoet niet aan PICO |
|
Xing, 2015 |
Voldoet niet aan PICO: geen analgesie |
|
Boogmans, 2014 |
Voldoet niet aan PICO |
|
Gupta, 2013 |
Voldoet niet aan PICO: Dural puncture |
|
Mitra, 2013 |
Betreft een abstract supplement |
|
Capogna, 2012 |
Betreft geen full-tekst |
|
Li, 2012 |
Full-tekst in het chinees |
|
Pascual-Ramírez, 2012 |
Voldoet niet aan PICO: aanvullende predictieanalyse |
|
Patel, 2012 |
Voldoet niet aan PICO |
|
Abstract, 2011 |
Conference abstracts 30th anual ESRA conference |
|
Frigo, 2011 |
Observationeel studiedesign |
|
Labbene, 2011 |
Full-tekst in het Frans |
|
Loubert, 2011 |
Studies komen terug in Simmons (2012) |
|
Pascual-Ramírez, 2011 |
Voldoet niet aan PICO: dosering bupivacaine ≥0,125% |
|
Sweed, 2011 |
Voldoet niet aan PICO: dosering bupivacaine ≥0,125% |
|
Wilson, 2011 |
Voldoet niet aan PICO: lange termijn maternale uitkomsten |
|
Allaert, 2010 |
Voldoet niet aan PICO: prospectieve audit |
|
Halpern, 2010 |
Studies komen terug in Simmons (2012) |
|
Wilson, 2010 |
Voldoet niet aan PICO: hoge dosering bupivacaine ≥0,125% |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-07-2020
Beoordeeld op geldigheid : 03-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijnmodule deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
CSE versus epidurale analgesie |
NVA/ NVOG |
2019 |
2024 |
5-jaarlijks |
Regiehouder en relevante wetenschappelijke verenigingen |
Nieuwe evidence. |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
De ontwikkeling van de richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
- Dr. W.L.M.C.M. Schellekens, extern voorzitter
- Drs. I.C.M. Beenakkers, anesthesioloog, werkzaam in het UMC Utrecht, NVA
- Drs. F.A. Klerk, anesthesioloog, werkzaam in het Diakonessenhuis Utrecht, NVA
- Drs. C.E. Kam-Endtz, anesthesioloog, werkzaam in het Haaglanden Medisch Centrum, NVA
- Dr. F.T.H. Lim, gynaecoloog, werkzaam in het IJssellandziekenhuis, NVOG
- Dr. L.M. Freeman, gynaecoloog, werkzaam in het Ikazia Ziekenhuis Rotterdam, NVOG
- Dr. J.M. Middeldorp, gynaecoloog, werkzaam in het Leids Universitair Medisch Centrum, NVOG
- Drs. A.G. Kaspers, kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Drs. L.A.M. Moll, klinisch verloskundige, werkzaam in het St. Antonius Ziekenhuis Nieuwegein, KNOV
- Dr. J. de Boer, beleidsmedewerker bij KNOV
- Drs. S. Ratsma-Wesselius, Obstetrisch verpleegkundige, werkzaam bij het Amsterdam UMC, Locatie AMC, V&VN
- Dr. J.E. Nagtegaal, Ziekenhuisapotheker, werkzaam in het Meander Medisch Centrum, NVZA
- Dr. A.M.D.E. Timmerman, Klinisch Fysicus, werkzaam in het UMC Utrecht, NVKF
- Drs. J.C. Mooij, adviseur patiëntenbelang, Patiëntenfederatie Nederland.
Met ondersteuning van
- Dr. E.M.E. den Breejen, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. Harmsen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schellekens |
gepensioneerd, ZZP: strategisch adviseur |
Lid RvT Diakonessenhuis, Utrecht |
Geen |
Geen |
|
Klerk |
Staf Anesthesiologie Diakonessenhuis Utrecht. |
bestuurslid Obst. Anesth. onbetaald |
Geen |
Geen |
|
Ratsma Wesselius |
Senior verpleegkundige Verloscentrum AMC |
Gastdocent VU Amstel Academie verpleegkundige vervolgopleidingen Obstetrie, betaald |
Geen |
Geen |
|
Beenakkers |
Anesthesioloog WKZ/UMCU |
Voorzitter sectie obstetrische anesthesie van de NVA. Onbetaald |
Echtgenoot werkzaam bij GSK |
Geen |
|
Nagtegaal |
Ziekenhuisapotheker Meander Medisch Centrum |
Beroepenveldcommissie Farmakunde Hogeschool Utrecht, onbetaald |
Geen |
Geen |
|
Timmerman |
Staffunctionaris Klinische Fysica & Patiëntveiligheid |
Lid NIVEL expertgroep infuustechnologie - advies maken kennistoets voor verpleegkundigen – onbetaald Lid ondernemingsraad UMC Utrecht - onbetaald |
EMRP Researcher Grant Metrology for Drug Delivery HLT07- REG1 €120,422.88 USPTO Applicaton #: #20160106909 Apparatus for simultaneous multiple medicament administration |
Geen |
|
Kam-Endtz |
Anesthesioloog Haaglanden MC |
Geen |
Geen |
Geen |
|
Middeldorp |
Gynaecoloog-perinatoloog |
Geen |
Geen |
Geen |
|
Moll |
Klinisch verloskundige/research verloskundige in het St. Antoniusziekenhuis in Nieuwegein |
Geen |
Geen |
Geen |
|
Freeman |
Gynaecoloog |
voorzitter multidiciplinaire werkgroep obstetrische anesthesie
|
Mijn promotieonderzoek naar epidurale analgesie en remifentanil is gesubsidieerd door ZonMw. Dit onderzoek is afgerond maar de resultaten zullen gebruikt worden in deze richtlijn |
Geen |
|
Mooij |
Beleidsmedewerker Patiëntenvereniging Nederland |
Vrijwilligerswerk (onbetaald) patiëntenorganisatie CCUVN |
Geen |
Geen |
|
Kaspers |
Kinderarts-neonatoloog, MST Enschede |
Geen |
Geen |
Geen |
|
De Boer |
Beleidsmedewerker richtlijnontwikkeling |
Geen nevenwerkzaamheden |
Geen |
Geen |
|
Lim |
gynaecoloog |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patientenfederatie Nederland in de werkgroep te laten deelnemen. De conceptmodule is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland. Daarnaast is door de Patiëntenfederatie Nederland een achterbanraadpleging verricht, waarvan de uitkomsten zo veel mogelijk meegenomen zijn in de overwegingen van de modules.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze modules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, (2010)), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit inventarisatie van de knelpunten door de commissie van de NVA bleek dat er een noodzaak was voor revisie van deze richtlijnmodules. Tevens zijn tijdens een fysieke knelpunteninventarisatie knelpunten aangedragen door aanpalende stakeholders inclusief patiëntenorganisaties. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroepleden en de adviseur uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Indicatoren over zwangerschap en geboorte zijn reeds onderdeel van de vervaardigde indicatoren bij de zorgstandaard integrale geboortezorg. Derhalve zijn er bij deze modules geen indicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules werden aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Uitgangsvraag: UV7 Wat is de effectiviteit van CSE vergeleken met epidurale analgesie |
|
|
Database(s): Medline, Embase, Cochrane library |
Datum: 29-01-2018 |
|
Periode: 2010-2018 |
Talen: Engels, Nederlands |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
(jaartal)
|
1 exp Labor, Obstetric/ or exp Delivery, obstetric/ or exp Labor pain/ or exp Analgesia, obstetric/ or (labor or labour or childbirth or birth* or delivery or parturient*).ti,ab. 718143 2 (spinal-epidural or CSE).ti,ab. 6682 3 exp Analgesia, Epidural/ or (epidural adj3 analges*).ti,ab. 11294 4 1 and 2 and 3 413 5 limit 4 to (yr="2010 -Current" and (dutch or english)) 116 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) 328451 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) 1688222 8 5 and 6 12 9 5 and (7 not 6) 43 |
(na ontdubbelen) 86 |
|
Embase (Elsevier) |
#9 #5 AND #7 NOT #6 45 #8 #5 AND #6 15 #7 ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it 2,061,805 #6 ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT 'conference abstract':it 298,332 #5 #1 AND #2 AND #3 AND ((dutch)/lim OR (english)/lim) AND (2010-2018)/py 226 #4 #1 AND #2 AND #3 532 #3 'epidural analgesia'/exp OR ((epidural NEAR/3 analges*):ab,ti) 11,268 #2 'combined spinal epidural analgesia'/exp OR ((spinal NEXT/1 epidural):ab,ti) OR cse:ab,ti 9,894 #1 'labor'/exp OR 'obstetric delivery'/exp OR 'labor pain'/exp OR 'obstetric analgesia'/exp OR labor:ab,ti OR labour:ab,ti OR childbirth:ab,ti OR birth*:ab,ti OR delivery:ab,ti OR parturient*:ab,ti 948,050 |
|
|
Cochrane library |
(labor:ab,ti or labour:ab,ti or childbirth:ab,ti or delivery:ab,ti or parturient*:ab,ti) and ((spinal next/1 epidural):ab,ti or cse:ab,ti) and (epidural near/3 analges*):ab,ti Publication Year from 2010 to 2018 48 |
