Effectiviteit van PGDT bij hoogrisicopatiënten
Uitgangsvraag
Dient Perioperative Goal Directed Therapy (PGDT) gebruikt te worden bij hoogrisicopatiënten?
Aanbeveling
Het routinematig toepassen van PGDT bij hoogrisicopatiënten kan op grond van de beschikbare literatuur niet worden aanbevolen of afgeraden.
Overweeg op lokaal niveau (per centrum) om PGDT bij hoogrisicopatiënten en/of hoogrisico-ingrepen toe te passen.
Als PGDT wordt toegepast, maak hierover dan afspraken met ketenpartners en leg die vast in een lokaal protocol.
Evalueer het effect van PGDT op de incidentie van (mineure) complicaties en op opnameduur (ziekenhuis en/of intensive care).
Overwegingen
Op grond van de resultaten uit de hier beschreven systematische review en meta-analyse van de beschikbare literatuur, is het onduidelijk of PGDT bij hoogrisicopatiënten effectief is in vergelijking met ‘standard of care’. De bewijskracht is gegradeerd als zeer laag. Hieraan liggen drie belangrijke oorzaken ten grondslag. Allereerst is er in veel studies sprake van onduidelijkheid over de blindering van de randomisatie en/of het ontbreken van blindering van de zorgverleners en patiënten. Dit leidt tot een risico op bias. Ten tweede is er sprake van ‘klinische heterogeniteit’ tussen de studies met betrekking tot de geïncludeerde patiënten (onder andere type chirurgie, spoed versus electief en ASA-classificatie), de toepassing van PGDT (onder andere algoritme, gebruikte hemodynamische variabelen en streefwaarden) en zorg in de controlegroep. Tot slot is geconstateerd dat er verschillen bestaan in de definiëring van de uitkomstmaten in de individuele studies (indirectheid). Zo werden complicaties zeer wisselend gerapporteerd (zowel het aantal patiënten met één of meerdere complicaties als het aantal complicaties per patiënt). Daar komt nog bij dat er verschillen bestaan in de typen complicaties die worden gerapporteerd en dat het verschil vaak wordt gemaakt door kleinere (mineure) complicaties. Het zijn juist de grotere (majeure) complicaties die geassocieerd zijn met een slechte uitkomst op de lange termijn. Ook kan de betekenis van het krijgen van een bepaalde complicatie voor de patiënt heel wisselend zijn. Zo kan een pneumonie met antibiotica worden behandeld op de afdeling maar ook leiden tot respiratoire insufficiëntie en noodzaak tot beademing op een intensive care. Om deze redenen is ervoor gekozen om de resultaten voor complicaties niet te poolen. De uitkomstmaat ziekenhuis en/of intensive care opnameduur heeft binnen meta-analyses als nadeel dat er grote verschillen kunnen bestaan tussen ziekenhuizen in diverse landen en zelfs tussen ziekenhuizen binnen één bepaald land. Voor wat betreft ziekenhuis opnameduur ligt variatie in de transfer van patiënten (vanuit het ziekenhuis naar huis, revalidatiecentrum of verzorgingsinstelling) hieraan ten grondslag. Intensive care opnameduur is afhankelijk van de gehanteerde opname- en ontslagcriteria in een bepaald ziekenhuis, waarin veel variatie mogelijk is. Wel dient vermeld te worden dat studies waarin een significant verschil werd waargenomen, dit altijd een afname van ligduur betrof van PGDT ten opzichte van controlegroep. Daar komt bij dat er geen negatieve effecten van PGDT zijn gevonden en dat een meerderheid van de studies een trend liet zien naar minder complicaties in de PGDT-groep (zie figuur 4). Hieruit zou men kunnen concluderen dat het voor een individueel centrum interessant kan zijn om uit te zoeken of PGDT een optie is om tot een reductie in (mineure) complicaties en ziekenhuis en/of intensive care opnameduur te komen van hoogrisicopatiënten. Het is wel de vraag of dit gunstige effect het gevolg is van het behandelingsalgoritme of van de extra aandacht die uit kan gaan naar interventie patiënten. Daarnaast dient een eventueel gunstig effect afgewogen te worden tegen de kosten om PGDT uit te voeren, zoals kosten voor meetapparatuur, benodigde katheters en scholing van personeel.
Onderbouwing
Achtergrond
PGDT omvat in essentie het continu meten van een hemodynamische variabele om deze met behulp van een behandelingsalgoritme boven een vooraf ingestelde streefwaarde te handhaven. Door continu te meten wordt bereikt dat een daling onder de streefwaarde vroeg gedetecteerd wordt. Dit leidt vervolgens tot het doorlopen van het algoritme met één of meerdere behandelingsstappen (zie figuur 1). Het algoritme komt uiteindelijk weer terug bij de streefwaarde zodat de ingestelde behandeling niet stopt voordat deze bereikt is. Hierdoor wordt de hemodynamische variabele continu boven de streefwaarde gehouden met als doel om de hemodynamische conditie van de patiënt optimaal te houden. Hemodynamische optimalisatie kan worden bereikt door flow gerelateerde variabelen zoals slagvolumevariatie (SVV), slagvolume/ slagvolume index (SV/SVI) of cardiac output/ cardiac index (CO/CI) te sturen. De respons van deze variabelen op een vochtbolus wordt gebruikt om het volumereactievermogen te beoordelen; de respons geeft een indruk over de plaats op de Frank-Starling curve. Het overgrote deel van perioperatieve morbiditeit en mortaliteit doet zich voor bij hoogrisicopatiënten. Het is onduidelijk wat het effect van PGDT is op het reduceren van complicaties, opnameduur en/of mortaliteit in deze populatie.
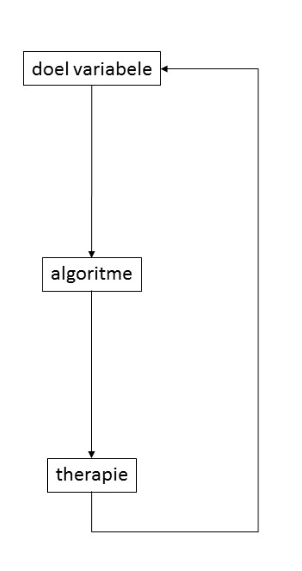
Figuur 1 Voorbeeld algoritme
Conclusies / Summary of Findings
Mortaliteit
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in mortaliteit tussen hoogrisicopatiënten behandeld met PGDT en hoogrisicopatiënten niet behandeld met PGDT.
Bronnen: (Sandham, 2003; Ackland, 2015; Bartha, 2013; Pearse, 2005; Venn, 2002; Zheng, 2013; Benes, 2010; Donati, 2007; Jhanji, 2010; Kapoor, 2017; Osawa, 2016; Schmid, 2016; van der Linden, 2010; Bisgaard AAA, 2013; Fellahi, 2015; Funk, 2015; McKendry, 2004; Moppett, 2015; Mythen, 1995; Parke, 2015; Wilson, 1999) |
Complicaties
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in het aantal complicaties tussen hoogrisicopatiënten behandeld met PGDT en hoogrisicopatiënten niet behandeld met PGDT.
Bronnen: (Ackland, 2015; Bartha, 2013; Benes, 2010; Bisgaard AAA, 2013; Donati, 2007; Fellahi, 2015; Jhanji, 2010; van der Linden, 2010; McKendry, 2004; Moppett, 2015; Mythen, 1995; Osawa, 2016; Pearse, 2005; Wilson, 1999; Zheng, 2013) |
Opnameduur
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in opnameduur tussen hoogrisicopatiënten behandeld met PGDT en hoogrisicopatiënten niet behandeld met PGDT.
Bronnen: (Sandham, 2003; Ackland, 2015; Bartha, 2013; Pearse, 2005; Venn, 2002; Zheng, 2013; Benes, 2010; Donati, 2007; Jhanji, 2010; Kapoor, 2017; Osawa, 2016; van der Linden; 2010) |
Samenvatting literatuur
Beschrijving studies
Er werden 23 RCT’s geïncludeerd in de literatuursamenvatting. In tabel 1 zijn de belangrijkste karakteristieken van de studies beschreven. Aanvullende informatie over de geïncludeerde studies is weergegeven in de individuele studies.
Tabel 1 Belangrijkste studiekarakteristieken
Resultaten
Mortaliteit
De cruciale uitkomstmaat mortaliteit werd gerapporteerd in 21 geïncludeerde RCT’s (Ackland, 2015; Bartha, 2013; Benes, 2010; Bisgaard AAA, 2013; Donati, 2007; Fellahi, 2015; Funk, 2015; Jhanji, 2010; Kapoor, 2017; van der Linden, 2010; McKendry, 2004; Moppett, 2015; Mythen, 1995; Osawa, 2016; Parke, 2015; Pearse, 2005; Sandham, 2003; Schmid, 2016; Venn, 2002; Wilson, 1999; Zheng, 2013). De periode waarin mortaliteit werd gerapporteerd varieerde (zie tabel 1). De data voor de uitkomstmaat mortaliteit is afgeleid van Kaufmann (2018), behalve voor drie studies (Sandham, 2003; Venn, 2002; Jhanji, 2010). In Kaufmann (2018) was er heterogeniteit in de rapportage van het percentage mortaliteit in Sandham (2003). Daarnaast werden de resultaten in Venn (2002) en Jhanji (2010) vergeleken tussen drie groepen en was het onduidelijk in de review van Kaufmann (2018) wat de verdeling van mortaliteit in de interventie- en controlegroep(en) was.
In totaal werden respectievelijk 2225 en 2098 hoogrisicopatiënten geïncludeerd in de interventie- en controlegroep. Er werd geen significant verschil in mortaliteit waargenomen tussen hoogrisicopatiënten behandeld met PGDT vergeleken met hoogrisicopatiënten die niet behandeld werden met PGDT (Relatieve risico (RR) 0,99; 95% Betrouwbaarheidsinterval (BI): 0,84 tot 1,17) (zie figuur 2). Tevens werd er geen significant verschil waargenomen binnen de verschillende chirurgische subgroepen (zie figuur 2) en binnen de verschillende meetmomenten tussen hoogrisicopatiënten (zie figuur 3) behandeld met PGDT en patiënten behandeld met ‘standard of care’.
Figuur 2 Uitkomstmaat mortaliteit (per type chirurgie) vergelijking PGDT versus ‘standard of care’
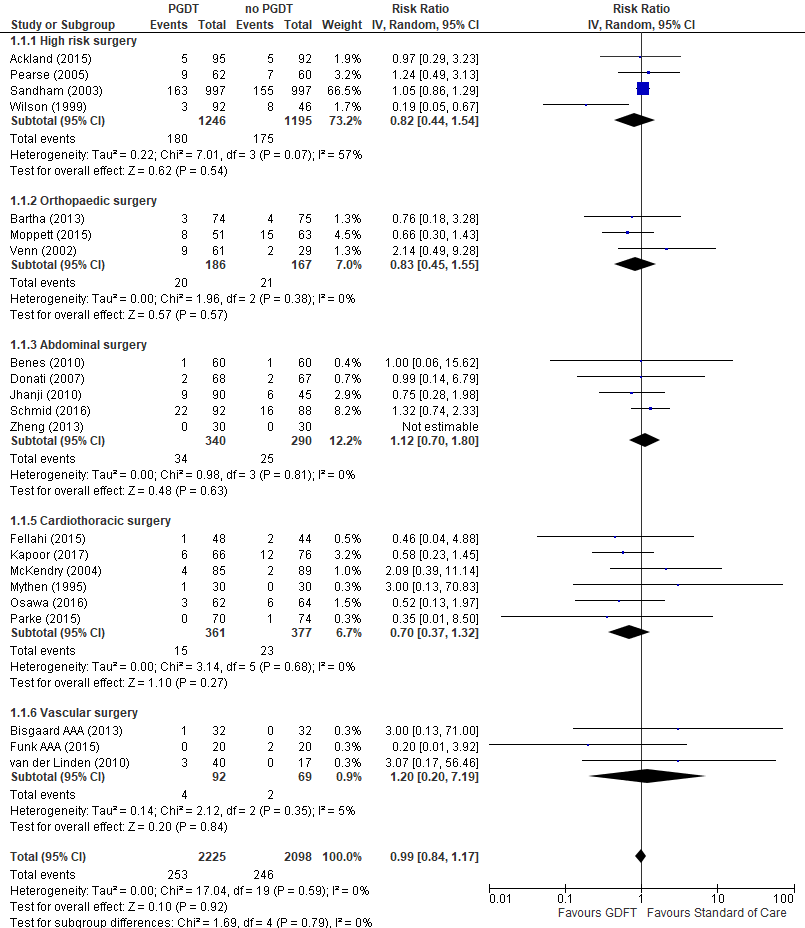
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 3 Uitkomstmaat mortaliteit (per meetmoment) vergelijking PGDT versus ‘standard of care’
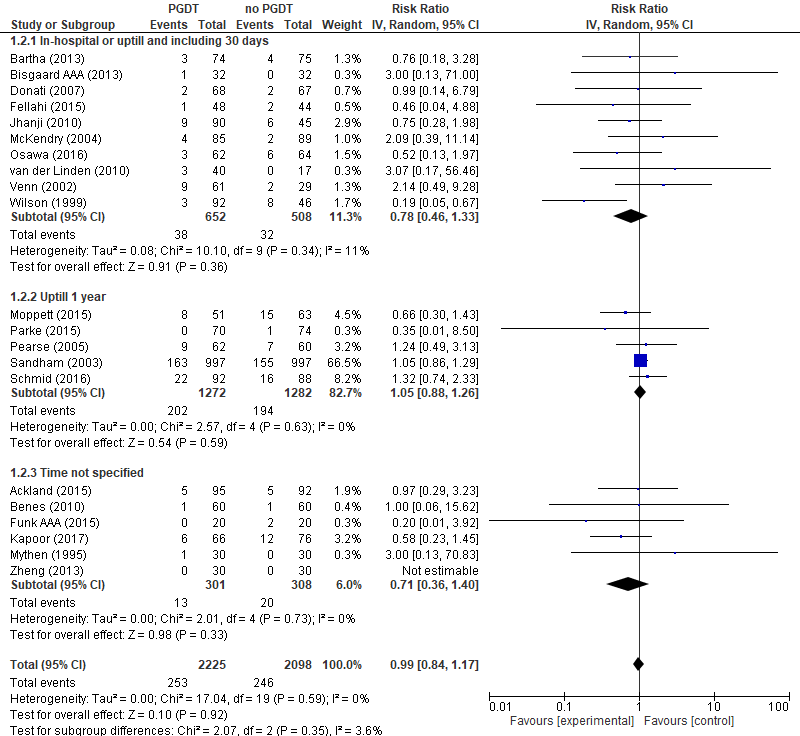
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Mortaliteit
De bewijskracht voor de uitkomstmaat mortaliteit is met 3 niveaus verlaagd. Ondanks dat blindering van het personeel en de patiënten in de meeste studies niet heeft plaatsgevonden is er niet afgetrokken voor risico op bias, omdat er geen risico is op vertekening van de resultaten (harde uitkomstmaat). Er zijn twee punten afgetrokken vanwege de heterogeniteit in interventie- en controlegroep in de individuele studies (bias ten gevolge van indirectheid). Alhoewel er verschil was in de richting van de puntschatters is er niet afgetrokken voor inconsistentie vanwege de overlap in de betrouwbaarheidsintervallen van de individuele studies. Tevens is er een punt afgetrokken vanwege het geringe aantal events (< 300) (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Complicaties
De belangrijke uitkomstmaat complicaties werd gerapporteerd in 15 geïncludeerde RCT’s (Ackland, 2015; Bartha, 2013; Benes, 2010; Bisgaard, 2013; Donati, 2007; Fellahi, 2015; Jhanji, 2010; van der Linden, 2010; McKendry, 2004; Moppett, 2015; Mythen, 1995; Osawa, 2016; Pearse, 2005; Wilson, 1999; Zheng, 2013). Studies waarin de uitkomstmaat complicaties werd beschreven als het aantal personen met één of meer complicaties werden geïncludeerd in de meta-analyse.
De data zijn afgeleid van de systematische review van Kaufmann (2018), behalve voor de studies Bartha, 2013; Bisgaard AAA, 2013; Donati, 2007; Fellahi, 2015; Jhanji, 2010; McKendry, 2010 en Wilson, 1999. In de studies werden verschillende definities voor complicaties gegeven (zie tabel 1; zie tabel 2). De in de studie gehanteerde definitie is gebruikt voor de beschrijving van de uitkomstmaat (zie tabel 2). Vanwege de klinische heterogeniteit werden de resultaten niet gepoold (zie figuur 4).
Figuur 4 Uitkomstmaat complicatie (per type chirurgie) vergelijking PGDT versus geen PGDT
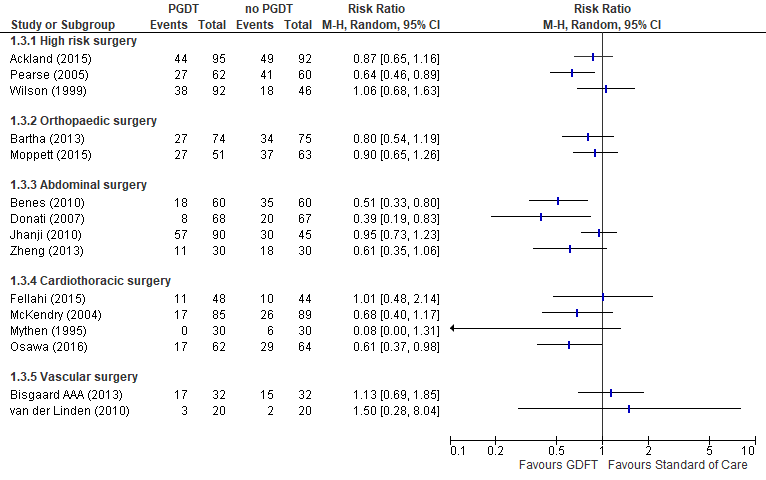
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Tabel 2 In de studie gehanteerde definitie voor complicaties
|
References |
Definition of complications |
|
High risk surgery |
|
|
Ackland, 2015 |
Number of patients with Clavien–Dindo scale or grade II of more 48 hours after surgery |
|
Pearse, 2005 |
Number of patients with complications |
|
Wilson, 1999 |
Number of patients developing one or more of a predefined range of complications |
|
Orthopedic surgery |
|
|
Bartha, 2013 |
Number of survivors with postoperative complications (cardiovascular, respiratory, cerebrovascular, acute kidney failure, gastrointestinal bleeding, confusion, sepsis, deep-vein thrombosis, wound infection, delayed healing, urinary tract infection, decubitus, wound hematoma, other complications) |
|
Moppett, 2015 |
Number of patients developing one or more postoperative complications. Postoperative complications were recorded as number of patients developing a significant defined complication, including the incidence of delirium and acute kidney injury assessed according to RIFLE serum creatinine criteria. |
|
Abdominal surgery |
|
|
Benes, 2010 |
Patients with postoperative morbidity based on number of infectious and other organ complications until day 30 after the operation, consistent with previous studies on peri-operative optimization |
|
Donati, 2007 |
Number of patients who had at least one new postoperative organ failure described using the sequential organ failure assessment score recorded daily during stay in the ICU |
|
Jhanji, 2010 |
Number of patients with complications, including acute kidney injury within seven days |
|
Zheng, 2013 |
Patients with adverse cardiac events (serious arrhythmia, congestive heart failure, myocardial ischemia, and acute myocardial infarction) |
|
Cardiothoracic surgery |
|
|
Fellahi, 2015 |
Number of patients with MACE (Major adverse cardiac events) |
|
McKendry, 2004 |
Number of patients with any of the following complications: atrial fibrillation requiring treatment, pneumothorax, cerebral vascular accident, chest infection or sternal wound infection, gastrointestinal bleed or perforated duodenal ulcer, acute renal failure, pleural effusion, infected leg wound, aortic regurgitation, death |
|
Mythen, 1995 |
Patients with a major complication being defined as one that resulted in an overall postoperative hospital stay of greater than 10 days or death |
|
Osawa, 2016 |
Composite outcome of pre-defined major postoperative complications (low cardiac output (LCO) syndrome, stroke, myocardial ischemia, infection, reoperation, and need for dialysis or hemofiltration) |
|
Vascular surgery |
|
|
Bisgaard AAA, 2013 |
Number of patients with pre-defined complications (septic shock, pneumonia, superficial wound infection, deep wound infection, abdominal wound infection, urinary tract infection, pulmonary embolus, ARDS, cardiac arrest, acute coronary syndrome, cardiac arrhythmia (intervention required), pulmonary edema, deep venous thrombosis, cerebral thrombosis, cerebral hemorrhage, lower limb paresis, acute kidney injury, intra-abdominal hypertension, severe upper gastrointestinal bleeding, gastrointestinal paralysis, CK >5000 U/I, reoperation, readmission to ICU, mechanical ventilation, acute dialysis, death) |
|
van der Linden, 2010 |
Patients experienced postoperative cardiovascular complications |
Bewijskracht van de literatuur
Complicaties
De bewijskracht voor de uitkomstmaat complicaties is met 3 niveaus verlaagd. Er is één punt afgetrokken vanwege de onduidelijkheid over de blindering van de randomisatie en/of het ontbreken van blindering van de zorgverleners en deelnemers in de individuele studies (risk of bias). Tevens zijn er twee punten afgetrokken vanwege de verschillen in interventie- en controlegroep en de definiëring van de uitkomstmaten in de individuele studies (bias ten gevolge van indirectheid). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Opnameduur
De belangrijke uitkomstmaat opnameduur werd gerapporteerd in 21 geïncludeerde RCT’s (Ackland, 2015; Bartha, 2013; Benes, 2010; Bisgaard AAA, 2013; Donati, 2007; Fellahi, 2015; Funk, 2015; Goepfert, 2013; Jhanji, 2010; Kapoor, 2017; van der Linden, 2010; McKendry, 2004; Moppett, 2015; Mythen, 1995; Osawa, 2016; Parke, 2015; Pearse, 2005; Sandham, 2003; Venn, 2002; Wilson, 1999; Zheng, 2013).
Voor de uitkomstmaat opnameduur werden de in de studies gehanteerde definities gebruikt. De data werden verkregen uit de individuele studies. De meeste studies rapporteerden opnameduur in mediaan (Interquartile range (IQR)). Het is niet mogelijk om deze data in Review Manager te poolen. De resultaten zijn dan ook hieronder per type chirurgie beschrijvend weergegeven (zie tabel 3). De overige studiekarakteristieken zijn weergegeven in tabel 1.
Tabel 3 Resultaten van de individuele studies voor de uitkomstmaat opnameduur
|
Referenties |
Conclusie |
|
Hoog risico chirurgie |
|
|
Ackland (2015) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis tussen de interventie- en controlegroep (Kaplan-Meier survival curve, log rank P=0,33). |
|
Pearse (2005) |
Er werd een statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 11 (7-15)) en controlegroep (mediaan, range: 14 (11-27)) (P=0,01). |
|
Sandham (2003) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- en controlegroep (mediaan, range: 10 (7-15) voor zowel interventie als controle) (P=niet weergegeven). |
|
Wilson (1999) |
Er werd een statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (dopexamine) en controlegroep (P=0,009). |
|
Orthopedische chirurgie |
|
|
Bartha (2013) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 9 (3-20)) en controlegroep (mediaan, range: 10 (1-38)) (P=niet weergegeven). |
|
Moppett (2015) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (gemiddelde, 95% BI: 15,3 (13,8 – 17,2)) en controlegroep (gemiddelde, 95% BI: 14,2 (12,9 – 15,8)) (P=0,32). |
|
Venn (2002) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventiegroepen (gemiddelde, 95%BI; CVP: 13,3 (10,3 – 19,2); DOP: 13,5 (10,9 – 17,5)) en controlegroep (gemiddelde, 95% BI: 17,5 (13,9 – 24,4)) (P=0,27).
|
|
Abdominale chirurgie |
|
|
Benes (2010) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 9 (8-11,5)) en controlegroep (mediaan, range: 10 (8-16)) (P=niet weergegeven). |
|
Donati (2007) |
Er werd een statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (gemiddelde ± SD: 11,3 ± 3.8) en controlegroep (gemiddelde ± SD: 13,4 ± 6.1) (P<0,05). |
|
Jhanji (2010) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventiegroepen (mediaan, range; SV: 14 (11 – 26); SV en DPX: 16 (11 – 28)) en controlegroep (mediaan, range: 15 (10-26)) (P=0,73).
|
|
Zheng (2013) |
Er werd een statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 18 (16-22,25)) en controlegroep (mediaan, range: 22 (19-27)) (P<0,001). |
|
Cardiothoracale chirurgie |
|
|
Fellahi (2015) |
Er werd niets gerapporteerd over de opnameduur in het ziekenhuis.
|
|
Groepfert (2013) |
Er werd gerapporteerd dat patiënten in de interventie- (gemiddelde ± SD: 5,3±3,5) ten opzichte van controlegroep (gemiddelde ± SD: 6,4±3,3) eerder voldeden aan de criteria voor ziekenhuisontslag (in dagen) (P=0,016). |
|
Kapoor (2017) |
Er werd een statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (gemiddelde ± SD: 5,61±1,11) en controlegroep (gemiddelde ± SD: 7,42±1,48) (P<0,001). |
|
McKendry (2004) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 7 (7-10)) en controlegroep: 9 (7-12)) (P=0,02). |
|
Mythen (1995) |
Er werd een statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 6.4 (5-9)) en controlegroep (mediaan, range: 10.1 (5-48)) (P=0.011). |
|
Parke (2015) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 6,2 (5-8)) en controlegroep (mediaan, range: 6,5 (6-8)) (P=0,64). |
|
Osawa (2016) |
Er werd een statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 9 (8-16)) en controlegroep (mediaan, range: 12 (9-22)) (P=0,049). |
|
Vasculaire chirurgie |
|
|
Bisgaard AAA (2013) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 9 (8-11)) en controlegroep (mediaan, range: 9 (8-14)) (P=0,41). |
|
Funk AAA (2015) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 8 (7-13)) en controlegroep (mediaan, range: 8 (6-12)) (P=0,73). |
|
Van der Linden (2010) |
Er werd geen statistisch significant verschil waargenomen in de opnameduur in het ziekenhuis (in dagen) tussen de interventie- (mediaan, range: 14 (13-19)) en controlegroep (mediaan, range: 18 (12-26)) (P=0,74). |
Hoogrisicochirurgie
Van de vier studies die hoog-risico-chirurgie beschreven vonden twee studies een significant kortere ziekenhuis-opnameduur in de interventiegroep ten opzichte van de controlegroep (Pearse, 2005; Wilson, 1999). Twee studies rapporteerden geen verschil in ziekenhuis-opnameduur (Ackland, 2015; Sandham, 2003). Eén studie rapporteerde over de opnameduur op de intensive care, maar vond geen significant verschil.
Orthopedische chirurgie
Alle drie de studies die orthopedische chirurgie beschreven vonden geen significant verschil in ziekenhuis opnameduur (Bartha, 2013; Moppett, 2015; Venn, 2002). Geen van de studies rapporteerden over de opnameduur op de intensive care.
Abdominale chirurgie
Van de vier studies die abdominale chirurgie beschreven vonden twee studies een significant kortere ziekenhuis-opnameduur in de interventiegroep ten opzichte van de controlegroep (Donati, 2007; Zheng, 2013). Twee studies rapporteerden de uitkomstmaat opnameduur op de intensive care. Van de twee studies vond één studie een significant kortere opnameduur op de intensive care in de interventiegroep ten opzichte van de controlegroep (Zheng, 2013).
Cardiothoracale chirurgie
Van de zeven studies die cardiothoracale chirugie beschreven, rapporteerden zes studies over ziekenhuis-opnameduur. Drie studies vonden een significant kortere ziekenhuis-opnameduur in de interventiegroep ten opzichte van de controlegroep (Kapoor, 2017; Mythen, 1995; Osawa, 2016). Van de zeven studies die de opnameduur op de intensive care beschreven vonden vier studies een significant kortere opnameduur op de intensive care ten opzichte van de controlegroep (Groepfert, 2013; Kapoor, 2017; Mythen, 1995; Osawa, 2016).
Vasculaire chirurgie
Van de drie studies die vasculaire chirurgie beschreven vond geen studie een statistisch significant verschil is ziekenhuis-opnameduur (Bisgaard AAA, 2013; Funk AAA, 2015; Van der Linden, 2010). Eén studie rapporteerde de uitkomstmaat opnameduur op de intensive care, maar vond geen statistisch significant verschil (Bisgaard AAA, 2013).
Bewijskracht van de literatuur
Opnameduur (ziekenhuis en intensive care)
De bewijskracht voor de uitkomstmaat opnameduur is met 3 niveaus verlaagd. Er is één punt afgetrokken vanwege de onduidelijkheid over de blindering van de randomisatie en/of het ontbreken van blindering van de zorgverleners en deelnemers in de individuele studies (risk of bias). Tevens zijn er twee punten afgetrokken vanwege de verschillen in interventie- en controlegroep en de definiëring van de uitkomstmaten in de individuele studies (bias ten gevolge van indirectheid). Het niveau van bewijskracht wordt gegradeerd als ‘zeer laag’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van PGDT, vergeleken met geen PGDT, bij hoogrisicopatiënten?
P: (patiënten): hoogrisicopatiënten;[1]
I: (interventie): behandeld met PGDT;
C: (controle): niet behandeld met PGDT;
O: (outcome): mortaliteit, complicaties, opnameduur.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit een voor de besluitvorming cruciale uitkomstmaat; en complicaties en opnameduur (ziekenhuis, intensive care) voor de besluitvorming belangrijke uitkomstmaten.
Indien studies uitkomstmaten op verschillende tijdstippen rapporteerden, includeerde de werkgroep alleen de data gedurende maximale follow-up.
Als studies twee of meer interventiegroepen weergaven, werden de interventiegroepen indien mogelijk samengevoegd en vergeleken met de controlegroep.
De werkgroep beschreef de uitkomstmaat mortaliteit per type chirurgie. Tevens werd de data geanalyseerd per subgroep:
- Mortaliteit gerapporteerd binnen 30 dagen of in het ziekenhuis.
- Mortaliteit gerapporteerd na 30 dagen tot 1 jaar.
- Mortaliteit waarbij het tijdstip niet werd gerapporteerd.
De werkgroep definieerde de uitkomstmaat complicaties als het aantal personen met één of meer complicaties. Studies die deze uitkomstmaat rapporteerden werden geïncludeerd in de meta-analyse.
De werkgroep definieerde de uitkomstmaat opnameduur niet a priori, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
De werkgroep heeft de zoekverantwoording van Kaufmann (2018) geüpdatet. Tevens werd de systematische review van Chong (2018) gebruikt voor de beoordeling van het risico op bias.
In de databases Medline (via OVID) en Embase (via Embase.com) is op 1 oktober 2018 met relevante zoektermen gezocht naar studies over PGDT die ingevoerd zijn in de genoemde databases tussen 1 mei 2018 en 1 oktober 2018. De zoekverantwoording (Medline en Embase) is weergegeven onder het tabblad Verantwoording. Tevens is er aanvullend gezocht in Web of Science.
De literatuurzoekactie leverde 72 nieuwe treffers op. Engelstalige randomized controlled trials (RCT’s) over hoogrisicopatiënten waarin de effectiviteit van GDFT werd vergeleken met ‘standard of care’, en die uitkomstmaten mortaliteit, complicaties en/of opnameduur rapporteerden werden geïncludeerd. Op basis van titel en abstract werden in eerste instantie 18 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 17 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 1 studie geselecteerd (Hamed, 2018).
Studies die voor 1 mei 2018 zijn ingevoerd in de database en voldoen aan de PICO werden geselecteerd uit de review van Kaufmann (2018) (n=47). Dit werd aangevuld met de geïncludeerde studie uit de aanvullende search. Dit leverde in totaal 48 geïncludeerde studies op (zie tabel 4).
Vanwege het grote aantal studies heeft de werkgroep uit deze 48 studies alleen de studies met een lager risico op bias (totale score tot en met tweeënhalf) geselecteerd. De werkgroep heeft voor het afkappunt 2,5 gekozen, omdat er dan studies over de verschillende patiëntencategorieën zijn geïncludeerd. Zowel in de studie van Kaufmann (2018) als in de studie van Chong (2018) is de kwaliteit van bijna alle geïncludeerde studies beoordeeld volgens de ‘Cochrane Risk of Bias Tool’ (Kaufmann, 2018; Chong, 2018). De kwaliteit van de studies (risk of bias) is beoordeeld voor de volgende domeinen: sequence generation (selectiebias), allocation concealment (selectiebias), het blinderen van deelnemers en personeel (performance bias), het blinderen van de beoordelaars (detection bias), incomplete rapportage van de uitkomstmaten (attrition bias), selectieve rapportage van de uitkomstmaten (reporting bias) en eventuele andere risico’s op bias. Studies kregen een punt (schaal 0 tot 7) indien het risico op bias binnen een domein aanwezig of onduidelijk was. Voor studies die in beide reviews waren geïncludeerd heeft de werkgroep het gemiddelde van de twee risk-of-bias-scores genomen (zie tabel 4). Indien de studie alleen voorkwam in Kaufmann (2018) of Chong (2018) en niet in beide, werd de score die gerapporteerd werd in de betreffende studie genomen als totaalscore. Wanneer de studie in zowel Kaufmann (2018) als Chong (2018) niet voorkwam werd er een nieuwe score berekend (Hamed, 2018). Studies met een totale score tot en met tweeënhalf werden geïncludeerd (n=24). De studie over leverchirurgie (Yassen, 2012) werd geëxcludeerd omdat PGDT normaliter niet wordt toegepast bij deze patiëntencategorie vanwege een restrictief vochtbeleid. De studie van Lenkin (2012) werd geëxludeerd omdat PGDT zowel in de interventie- als controlegroep werd gegeven. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Tweeëntwintig onderzoeken zijn opgenomen in de literatuuranalyse (Ackland, 2015; Bartha, 2013; Benes, 2010; Bisgaard AAA, 2013; Donati, 2007; Fellahi, 2015; Funk, 2015; Goepfert, 2013; Jhanji, 2010; Kapoor, 2017; van der Linden, 2010; McKendry, 2004; Moppett, 2015; Mythen, 1995; Osawa, 2016; Parke, 2015; Pearse, 2005; Sandham, 2003; Schmid, 2016; Venn, 2002; Wilson, 1999; Zheng, 2013). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen.
Tabel 4 (Totale) risk of bias score (Chong, 2018; Kaufmann, 2018)
|
Referentie |
Risk of bias |
Total Risk of Bias score |
Type of surgery |
||
|
Chong (2018) |
Kaufmann (2018) |
Kaufmann (2019)1 |
|
||
|
Sandham (2003) |
1 |
1 |
|
1 |
High risk surgery |
|
Ackland (2015) |
1 |
2 |
|
1,5 |
High risk surgery |
|
Bartha (2013) |
2 |
1 |
|
1,5 |
Orthopedic surgery |
|
Pearse (2005) |
1 |
2 |
|
1,5 |
High risk surgery |
|
Venn (2002) |
2 |
1 |
|
1,5 |
Orthopedic surgery |
|
Zheng 2013 |
2 |
1 |
|
1,5 |
Abdominal surgery |
|
Benes (2010) |
2 |
2 |
|
2 |
Abdominal surgery |
|
Donati (2007) |
2 |
2 |
|
2 |
Abdominal surgery |
|
Jhanji (2010) |
2 |
2 |
|
2 |
Abdominal surgery |
|
Kapoor (2017) |
2 |
|
2 |
Cardiothoracic surgery |
|
|
Osawa (2016) |
2 |
2 |
|
2 |
Cardiothoracic surgery |
|
Schmid (2016) |
3 |
1 |
|
2 |
Abdominal surgery |
|
van der Linden (2010) |
3 |
1 |
|
2 |
Vascular surgery |
|
Bisgaard AAA (2013) |
3 |
2 |
|
2,5 |
Vascular surgery |
|
Fellahi (2015) |
2 |
3 |
|
2,5 |
Cardiothoracic surgery |
|
Funk AAA (2015) |
2 |
3 |
|
2,5 |
Vascular surgery |
|
Goepfert (2013) |
3 |
2 |
|
2,5 |
Cardiothoracic surgery |
|
McKendry (2004) |
3 |
2 |
|
2,5 |
Cardiothoracic surgery |
|
Moppett (2015) |
1 |
4 |
|
2,5 |
Orthopedic surgery |
|
Mythen (1995) |
4 |
1 |
|
2,5 |
Cardiothoracic surgery |
|
Parke (2015) |
3 |
2 |
|
2,5 |
Cardiothoracic surgery |
|
Wilson (1999) |
3 |
2 |
|
2,5 |
High risk surgery |
|
Yassen (2012) |
3 |
2 |
|
2,5 |
Liver surgery |
|
Bender (1997) |
2 |
4 |
|
3 |
Vascular surgery |
|
Harten (2008) |
3 |
3 |
|
3 |
Abdominal surgery |
|
Kapoor (2008) |
3 |
3 |
|
3 |
Cardiothoracic surgery |
|
Kapoor (2016) |
4 |
2 |
|
3 |
Cardiothoracic surgery |
|
Kumar (2015) |
3 |
3 |
|
3 |
High risk surgery |
|
Lee (2015) |
3 |
|
3 |
Cardiothoracic surgery |
|
|
Lopes (2007) |
3 |
3 |
|
3 |
High risk surgery |
|
Mayer (2010) |
3 |
3 |
|
3 |
Abdominal surgery |
|
Berlauk (1991) |
4 |
3 |
|
3,5 |
Vascular surgery |
|
Bisgaard LLA (2013) |
4 |
3 |
|
3,5 |
Vascular surgery |
|
Jammer (2010) |
4 |
3 |
|
3,5 |
Abdominal surgery |
|
Mikor (2015) |
4 |
3 |
|
3,5 |
Abdominal surgery |
|
Pestana (2014) |
4 |
3 |
|
3,5 |
Abdominal surgery |
|
Scheeren (2013) |
4 |
3 |
|
3,5 |
High risk surgery |
|
Shoemaker (1988) |
3 |
4 |
|
3,5 |
High risk surgery |
|
Valentine (1998) |
3 |
4 |
|
3,5 |
Vascular surgery |
|
Boyd (1993) |
4 |
4 |
|
4 |
High risk surgery |
|
Pölönön (2000) |
3 |
5 |
|
4 |
Cardiothoracic surgery |
|
Smetkin (2009) |
4 |
4 |
|
4 |
Cardiothoracic surgery |
|
Zakhaleva (2013) |
5 |
3 |
|
4 |
Abdominal surgery |
|
Ziegler (1997) |
4 |
4 |
|
4 |
Vascular surgery |
|
Hamed (2018) |
4 |
4 |
Cardiothoracic surgery |
||
|
Hand (2016) |
5 |
4 |
|
4,5 |
Plastic surgery |
|
Thomson (2014) |
5 |
|
5 |
Cardiothoracic surgery |
|
|
Schultz (1985) |
5 |
6 |
|
5,5 |
Orthopedic surgery |
1 Studie werd niet meegenomen in de systematische review van Chong (2018) en Kaufman (2018). Er werd een score berekend door de werkgroep
[1] Om hoogrisicopatiënten te classificeren werd de definitie van Chong (2018) gebruikt. Studies die cardiale-chirurgiepatiënten, intensive-carepatiënten die geopereerd werden of waarin meer dan 50 procent van de geïncludeerde patiënten een ASA-classificatie 3 of hoger hadden werden geïncludeerd.
Referenties
- Ackland, G. L., Iqbal, S., Paredes, L. G., Toner, A., Lyness, C., Jenkins, N., ... & Singer, M. (2015). Individualised oxygen delivery targeted haemodynamic therapy in high-risk surgical patients: a multicentre, randomised, double-blind, controlled, mechanistic trial. The Lancet Respiratory Medicine, 3(1), 33-41.
- Bartha, E., Arfwedson, C., Imnell, A., Fernlund, M. E., Andersson, L. E., & Kalman, S. (2012). Randomized controlled trial of goal-directed haemodynamic treatment in patients with proximal femoral fracture. British journal of anaesthesia, 110(4), 545-553.
- Benes, J., Chytra, I., Altmann, P., Hluchy, M., Kasal, E., Svitak, R., ... & Stepan, M. (2010). Intraoperative fluid optimization using stroke volume variation in high risk surgical patients: results of prospective randomized study. Critical Care, 14(3), R118.
- Bisgaard, J., Gilsaa, T., Rønholm, E., & Toft, P. (2013). Optimising stroke volume and oxygen delivery in abdominal aortic surgery: a randomised controlled trial. Acta Anaesthesiologica Scandinavica, 57(2), 178-188.
- Chong, M. A., Wang, Y., Berbenetz, N. M., & McConachie, I. (2018). Does goal-directed haemodynamic and fluid therapy improve peri-operative outcomes? A systematic review and meta-analysis. European Journal of Anaesthesiology (EJA), 35(7), 469-483.
- Donati, A., Loggi, S., Preiser, J. C., Orsetti, G., Münch, C., Gabbanelli, V., ... & Pietropaoli, P. (2007). Goal-directed intraoperative therapy reduces morbidity and length of hospital stay in high-risk surgical patients. Chest, 132(6), 1817-1824.
- Fellahi, J. L., Brossier, D., Dechanet, F., Fischer, M. O., Saplacan, V., Gérard, J. L., & Hanouz, J. L. (2015). Early goal-directed therapy based on endotracheal bioimpedance cardiography: a prospective, randomized controlled study in coronary surgery. Journal of clinical monitoring and computing, 29(3), 351-358.
- Funk, D. J., HayGlass, K. T., Koulack, J., Harding, G., Boyd, A., & Brinkman, R. (2015). A randomized controlled trial on the effects of goal-directed therapy on the inflammatory response open abdominal aortic aneurysm repair. Critical Care, 19(1), 247.
- Goepfert, M. S., Richter, H. P., zu Eulenburg, C., Gruetzmacher, J., Rafflenbeul, E., Roeher, K., ... & Reuter, D. A. (2013). Individually optimized hemodynamic therapy reduces complications and length of stay in the intensive care unita prospective, randomized controlled trial. The Journal of the American Society of Anesthesiologists, 119(4), 824-836.
- Jhanji, S., Vivian-Smith, A., Lucena-Amaro, S., Watson, D., Hinds, C. J., & Pearse, R. M. (2010). Haemodynamic optimisation improves tissue microvascular flow and oxygenation after major surgery: a randomised controlled trial. Critical Care, 14(4), R151.
- Kapoor, P. M., Magoon, R., Rawat, R. S., Mehta, Y., Taneja, S., Ravi, R., & Hote, M. P. (2017). Goal-directed therapy improves the outcome of high-risk cardiac patients undergoing off-pump coronary artery bypass. Annals of cardiac anaesthesia, 20(1), 83.
- Kaufmann, T., Clement, R. P., Scheeren, T. W., Saugel, B., Keus, F., & van der Horst, I. C. (2018). Perioperative goal‐directed therapy: A systematic review without meta‐analysis. Acta Anaesthesiologica Scandinavica, 62(10), 1340-1355.
- Montenij L, de Waal E, Frank M, van Beest P, de Wit A, Kruitwagen C, et al. Influence of early goal-directed therapy using arterial waveform analysis on major complications after high-risk abdominal surgery: study protocol for a multicenter randomized controlled superiority trial. Trials. 2014;15(1):360 .
- McKendry, M., McGloin, H., Saberi, D., Caudwell, L., Brady, A. R., & Singer, M. (2004). Randomised controlled trial assessing the impact of a nurse delivered, flow monitored protocol for optimisation of circulatory status after cardiac surgery. Bmj, 329(7460), 258.
- Moppett, I. K., Rowlands, M., Mannings, A., Moran, C. G., & Wiles, M. D. (2014). LiDCO-based fluid management in patients undergoing hip fracture surgery under spinal anaesthesia: a randomized trial and systematic review. British journal of anaesthesia, 114(3), 444-459.
- Mythen, M. G., & Webb, A. R. (1995). Perioperative plasma volume expansion reduces the incidence of gut mucosal hypoperfusion during cardiac surgery. Archives of Surgery, 130(4), 423-429.
- Osawa, E. A., Rhodes, A., Landoni, G., Galas, F. R., Fukushima, J. T., Park, C. H., ... & Leme, A. C. (2016). Effect of perioperative goal-directed hemodynamic resuscitation therapy on outcomes following cardiac surgery: a randomized clinical trial and systematic review. Critical care medicine, 44(4), 724-733.
- Parke, R. L., McGuinness, S. P., Gilder, E., McCarthy, L. W., & Cowdrey, K. A. (2015). A randomised feasibility study to assess a novel strategy to rationalise fluid in patients after cardiac surgery. British journal of anaesthesia, 115(1), 45-52.
- Pearse, R., Dawson, D., Fawcett, J., Rhodes, A., Grounds, R. M., & Bennett, E. D. (2005). Early goal-directed therapy after major surgery reduces complications and duration of hospital stay. A randomised, controlled trial (ISRCTN38797445). Critical care, 9(6), R687.
- Sandham, J. D., Hull, R. D., Brant, R. F., Knox, L., Pineo, G. F., Doig, C. J., ... & Kirby, A. (2003). A randomized, controlled trial of the use of pulmonary-artery catheters in high-risk surgical patients. New England Journal of Medicine, 348(1), 5-14.
- Schmid, S., Kapfer, B., Heim, M., Bogdanski, R., Anetsberger, A., Blobner, M., & Jungwirth, B. (2016). Algorithm-guided goal-directed haemodynamic therapy does not improve renal function after major abdominal surgery compared to good standard clinical care: a prospective randomised trial. Critical care, 20(1), 50.
- Van der Linden, P. J., Dierick, A., Wilmin, S., Bellens, B., & De Hert, S. G. (2010). A randomized controlled trial comparing an intraoperative goal-directed strategy with routine clinical practice in patients undergoing peripheral arterial surgery. European Journal of Anaesthesiology (EJA), 27(9), 788-793.
- Venn, R., Steele, A., Richardson, P., Poloniecki, J., Grounds, M., & Newman, P. (2002). Randomized controlled trial to investigate influence of the fluid challenge on duration of hospital stay and perioperative morbidity in patients with hip fractures. British journal of anaesthesia, 88(1), 65-71.
- Wilson, J., Woods, I., Fawcett, J., Whall, R., Dibb, W., Morris, C., & McManus, E. (1999). Reducing the risk of major elective surgery: randomised controlled trial of preoperative optimisation of oxygen delivery. Bmj, 318(7191), 1099-1103.
- Zheng, H., Guo, H., Ye, J. R., Chen, L., & Ma, H. P. (2013). Goal-directed fluid therapy in gastrointestinal surgery in older coronary heart disease patients: randomized trial. World journal of surgery, 37(12), 2820-2829.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat zijn de (on)gunstige effecten van PGDT, vergeleken met geen PGDT, bij hoogrisicopatiënten?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Kaufmann (2018)
(study characteristics and results are extracted from the SR (unless stated otherwise)) |
SR and meta-analysis of trials
Literature search up to May 2018.
A: Sandham (2003) B: Ackland (2015) C: Pearse (2005) D: Wilson (1999) E: Bartha (2013) F: Venn (2002) G: Moppett (2015) H: Zheng (2013) I: Benes (2010) J: Donati (2007) K: Jhanji (2010) L: Schmid (2016) M: Kapoor (2017) N: Osawa (2016) R: Mythen (1995)
Study design: Trial (A-V)
Setting and Country:
Source of funding and conflicts of interest: Source of funding and conflicts of interest were not described for the individual studies. The systematic review is developed with departmental funding only. Conflicts of interests were described for the authors: BS collaborates with Pulsion Medical Systems SE (Feldkirchen, Germany) as a member of the medical advisory board and received honoraria for giving lectures and refunds of travel expenses from Pulsion Medical Systems SE. BS received research support from Edwards Lifesciences (Irvine, California, USA). BS received institutional research grants, unrestricted research grants and refunds of travel expenses from Tensys Medical Inc. (San Diego, California, USA). BS received honoraria for giving lectures and refunds of travel expenses from CNSystems Medizintechnik AG (Graz, Austria). TWLS received honoraria from Edwards Lifesciences and Masimo Inc. (Irvine, California, USA) for consulting and for giving lectures. TWLS received honoraria from Pulsion Medical Systems SE for giving lectures. Authors TK, RPC, FK and ICCvdH declare no conflicts of interest. |
Inclusion criteria SR: - All trials published in English, irrespective of blinding, publication status or sample size were considered for assessment of benefits and harms. - All trials were included irrespective of the control intervention. Exclusion criteria SR:
112 studies included
Important patient characteristics at baseline:
Number of patients, N: B: I = 95; C = 92 C: I = 62; C = 60 D: I1 = 46; I2 = 46; C = 46 E: I = 74; C = 75 F: I1 = 31; I2 = 20; C = 29 G: I = 51; C = 63 H: I = 30; C = 30 I: I = 60; C = 60 J: I = 68; C = 67 K: I1 = 45; I2 = 45; C = 45 L: I = 92; C = 88 M: I = 66; C = 76 N: I = 62; I = 64 R: I =: 30; C = 30
Mean age / Sex: Not described in the systematic review of Kaufmann (2018).
Groups comparable at baseline? Not possible to assess. |
Describe intervention[1]:
A: GDT guided by a PAC B: GDT C: Post GDT D: Invasive hemodynamic monitoring, fluid, and either adrenaline or dopexamine to increase oxygen delivery E: GDHT F: I1 = additional repeated colloid fluid challenges guided by CVP; I2 = additional repeated colloid fluid challenges guided by oesophageal Doppler ultrasonography; G: LiDCO-guided fluid therapy H: GDT I: Fluid management guided by SVV (Vigileo / FloTrac system) J: Protocolized strategy to maintain O2ER <27 |
Describe control1:
A: Standard care without the use of a PAC B: Standardized care C: Conventional management D: Routine perioperative care E: Protocol-guided RFT F: Conventional intraoperative fluid management G: Standard care H: Routine fluid therapy I: Routine Intraoperative care |
End-point of follow-up#:
A: 12 months B: Not specified C: 60 days D: Not specified E: 12 months F: Not specified G: Not specified (postoperative mortality was recorded using survival data to 12 months after admission) H: Not specified I: Not specified
For how many participants were no complete outcome data available? (intervention/control) Not described in the systematic review of Kaufmann (2018).
|
Outcome measure-1 Defined as mortality
Effect measure: RR (95% CI): A: 1.05 (0.86, 1.29)# B: 0.97 (0.29, 3.23) C: 1.24 (0.49, 3.13)
Pooled effect (random effects model effects model): 0.99 (0.84, 1.17) Heterogeneity (I2): 0%
Outcome measure-2 Defined as complications (amount of persons with one or more complications)
Effect measure: RR (95% CI): B: 0.87 (0.65, 1.16) C: 0.64 (0.46, 0.89)
Outcome measure-3# Defined as length of stay A: Length of hospital stay (in days) median, range: 10, 7-15 (for intervention and control).
Length of ICU stay not described. C: Statistical significant difference in length of hospital stay (in days) (Intervention: median, range: 11 (7-15); Control: median, range: 14 (11-27); P-value = 0.01). D: Statistical significant difference in length of hospital stay (in days) (P-value=0.009). E: No statistical significant difference in length of hospital stay (in days) (Intervention: median, range: 9 (3-20); Control: median, range: 10 (1-38); P-value = not described).
Length of ICU stay not described. F: No statistical significant difference in length of hospital stay (in days) (mean, 95%CI; intervention: CVP: 13.3 (10.3 – 19.2) and DOP: 13.5 (10.9 – 17.5); Control: 17.5 (13.9 – 24.4); (P=0.27). G: No statistical significant difference in length of hospital stay (in days) (mean, 95%CI; intervention: 15.3 (13.8 – 17.2); Control: 14.2 (12.9 – 15.8); (P=0.32).
H: Statistical significant difference in length of hospital stay (in days) (Intervention: median, range: 18 (16-22.25); Control: median, range: 22 (19-27); P<0.001). I: No statistical significant difference in length of hospital stay (in days) (Intervention: median, range: 9 (8-11.5); Control: median, range: 10 (8-16); P=not described).
No statistical significant difference in length of ICU stay (in days) (Intervention: median, range: 3 (2-5); Control: median, range: 3 (0.5-5); P=not described).
J: A statistical significant difference in length of hospital stay (in days) (Intervention: mean ± SD: 11.3 ± 3.8); Control: mean ± SD: 13.4 ± 6.1); P<0.05). Length of ICU stay not described. M: Statistical significant difference in length of hospital stay (in days) (Intervention: mean ± SD: 5.61 ± 1.11); Control: mean ± SD: 7.42 ± 1.48); (P<0,001).
Statistical significant difference in length of ICU stay (in days) (Intervention: mean ± SD: 2.53 ± 0.56); Control: mean ± SD: 4.20 ± 0.82); (P<0,001).
N: Statistical significant difference in length of hosptial stay (in days) (Intervention: median, range: 9 (8-16)); Control: median, range: 12 (9-22); (P=0.049).
Statistical significant difference in length of ICU stay (in days) (Intervention: median, range: 3 (3-4)); Control: median, range: 5 (4-7); (P<0.001).
Statistical significant difference in length of ICU stay (in hours) (Intervention: mean ± SD: 43.7 ± 19.9); Control: mean ± SD: 62.8 ± 26.3); (P=0.016).
R: Statistical significant difference in length of hospital stay (in days) (Intervention: median, range: 6.4 (5-9)); Control: median, range: 10.1 (5-48); (P=0.011).
Statistical significant difference in length of ICU stay (in days) (Intervention: median, range: 1 (1-1)); Control: median, range: 1.7 (1-11); (P=0.023).
No statistical significant difference in length of ICU stay (in days) (Intervention: median, range: 22.7 (20-46)); Control: median, range: 25.9 (21-48); (P=0.23).
Statistical significant difference in length of ICU stay (in days) (Intervention: median, range: 23 (21-68)); Control: median, range: 24 (21-78); (P=0.74).
|
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Dient Perioperative Goal Directed Therapy gebruikt te worden bij hoog risicopatiënten?
|
Study reference
(first author, publication year) |
|
Bias due to inadequate random sequence generation? |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants and personnel to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to reporting incomplete outcome data?
(unlikely/likely/unclear) |
Bias due to selective reporting?
(unlikely/likely/unclear) |
Other bias
(unlikely/likely/unclear) |
|
Sandham (2003) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
|
Ackland (2015) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
|
Bartha (2013) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
|
Pearse (2005) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
|
Venn (2002) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
|
Zheng (2013) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
|
Benes (2010) |
Kaufmann (2018) |
Unlikely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
|
Donati (2007) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
|
Jhanji (2010) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
|
Kapoor (2017) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
- |
- |
- |
- |
- |
- |
- |
|
|
Lenkin (2012) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chong (2018) |
- |
- |
- |
- |
- |
- |
- |
|
|
Osawa (2016) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
|
Schmid (2016) |
Kaufmann (2018) |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
|
Van der Linden (2010) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
|
Bisgaard AAA (2013) |
Kaufmann (2018) |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
|
Fellahi (2015) |
Kaufmann (2018) |
Unlikely |
Unclear |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
|
Funk AAA (2015) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
|
Groepfert (2013) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
|
McKendry (2004) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unclear |
Unlikely |
Unlikely |
Likely |
|
|
Moppett (2015) |
Kaufmann (2018) |
Unlikely |
Likely |
Likely |
Unlikely |
Likely |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
|
Mythen (1995) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Likely |
Unlikely |
Unclear |
Unlikely |
|
|
Parke (2015) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unclear |
|
|
Wilson (1999) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chong (2018) |
Unlikely |
Unlikely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unclear |
|
|
Yassen (2012) |
Kaufmann (2018) |
Unlikely |
Unlikely |
Likely |
Unlikely |
Likely |
Unlikely |
Unlikely |
|
Chong (2018) |
Unlikely |
Unclear |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Zhao (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018) |
|
Zhang (2018) |
Geen RCT |
|
Xu (2018) |
Geen RCT |
|
Szturz (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018) |
|
Liu (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018) |
|
Kim (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018) |
|
Kaufmann (2018) |
Geen RCT |
|
Joosten (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018) |
|
Gundersen (2018) |
Geen RCT |
|
Gerent (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018) |
|
Feng (2018) |
Geen RCT |
|
Chong (2018) |
Geen RCT |
|
Cesur (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018) |
|
Calvo-Vecino (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018 |
|
Bokhari (2018) |
Geen RCT |
|
Bahlmann (2018) |
De studie gaat niet over hoogrisicopatiënten volgens Chong (2018) |
|
Sun (2017) |
Geen RCT |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-10-2020
Beoordeeld op geldigheid : 31-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Effectiviteit van PGDT bij hoogrisicopatiënten |
NVA |
2020 |
2022 |
Eens in 2 jaar |
NVA |
Lopend onderzoek zoals de te verwachten resultaten van drie lopende studies (OPTIMISE II studie (www.optimiseii.org), FLO-ELA-studie (www.floela.org), en Montenij (2014)) |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Prof. dr. T.W.L. Scheeren, anesthesioloog, werkzaam in het Universitair Medisch Centrum te Groningen, NVA
- Dr. L.J. Montenij, anesthesioloog-intensivist, werkzaam in het Catharina Ziekenhuis te Eindhoven, NVA
- Dr. J.P. Hering, anesthesioloog, werkzaam in het Dijklander ziekenhuis te Hoorn, NVA
- Dr. I.C.C. van der Horst, cardioloog-intensivist, werkzaam in het Maastricht UMC+ te Maastricht, NVVC NVIC
- Dr. F. Daams, chirurg, werkzaam in het Amsterdam UMC te Amsterdam, NVvH
Met ondersteuning van
- T. Kaufmann, arts-onderzoeker anesthesiologie, werkzaam in het Universitair Medisch Centrum te Groningen
- Dr. M.A. Pols, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- A.L.J. Kortlever - van der Spek, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hering |
Anesthesioloog 100% Westfriesgasthuis |
Geen |
Extern gefinancierd onderzoek: (1) Trace studie zonmw (Principal investigator – de TRACE-studie bekijkt of een postoperatieve visite door de anesthesioloog de kans op complicaties kan verminderen en kosten kan besparen gesponsord door ZonMW; (2) Jens-Peter werkt ook mee aan de EPOCH-studie (AMC) naar het toepassen van GDF (EPOCH-studie). Hij voert binnen dit onderzoek alleen de ‘opdrachten’ uit die hij krijgt. Hij krijgt hiervoor geen vergoeding (en is geen principal investigator). (3) In 2015 heeft hij nog een presentatie gegeven voor Edwards (betaald) (4) Rondetafelgesprek met Edwards (initiator) waarin GDFT wordt besproken (geen vergoeding) |
Niet van toepassing. (We gaan geen aanbevelingen opstellen over het type monitor dat gebruikt moet worden tijdens GDFT) |
|
Scheeren |
Hoogleraar Anesthesiologie |
Chair Cardiovascular Dynamics Section European society of Intensive Care Medicine (ESICM) onbetaald |
Research grants form Edwards Lifesciences (Irvine, CA, USA) and Masimo Inc. (Irvine, CA, USA) (vergoeding wordt uitbetaald aan het ziekenhuis) |
Niet van toepassing. (We gaan geen aanbevelingen opstellen over het type monitor dat gebruikt moet worden tijdens GDFT) |
|
Daams |
Chirurg UMCA |
Voorzitter taskforce naadlekkage |
Gesponsord onderzoek naar de ontwikkeling van robot geassisteerde slokdarmanastomose. |
Niet van toepassing |
|
Horst |
Intensivist-cardioloog, Universitair Medisch Centrum Maastricht |
Geen |
Geen |
Niet van toepassing |
|
Montenij |
Anesthesioloog-intensivist (Catharina Ziekenhuis Eindhoven) |
Geen |
Onderzoek naar monitoring (breed) dat gesponsord wordt door Phillips |
Niet van toepassing. (We gaan geen aanbevelingen opstellen over het type monitor dat gebruikt moet worden tijdens GDFT) |
|
Overige leden |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Kaufmann |
Arts-onderzoeker (1 FTE) Afdeling Anesthesiologie – Universitair Medisch Centrum Groningen |
Geen |
Geen |
Niet van toepassing |
Inbreng patiëntenperspectief
De werkgroep heeft de conceptrichtlijn tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze modules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
De NVA beschouwt de internationale richtlijn “2014 ESC/ESA Guidelines on non-cardiac surgery: cadiovascular assessment and management” als een goede vervanger van de richtlijn “Preventie van perioperatieve cardiale complicaties bij niet-cardiale-chirurgie” uit 2009. Deze internationale richtlijn besteedt echter weinig aandacht aan perioperative goal directed therapy (PGDT). De werkgroep heeft binnen het onderwerp van PGDT de belangrijkste knelpunten benoemd voor dit onderwerp.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming) en belangrijk (maar niet kritiek).
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de modules met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabel. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze modules het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules werden aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
|
(((((goal direct*(tiab) OR objective guided*(tiab) OR haemodynamic optimi*(tiab) OR haemodynamic optimi*(tiab) OR (("Fluid Therapy"(Mesh) OR fluid therap*(tiab) OR fluid manag*(tiab) OR liquid manag*(tiab)) AND (peri-operat*(tiab) OR perioperat*(tiab) OR peroperat*(tiab) OR "Perioperative Care"(Mesh)))) AND ("Morbidity"(Mesh) OR "Mortality"(Mesh) OR "mortality" (Subheading) OR mortality(tiab) OR morbidity(tiab) OR "Posterative Complications"(Mesh) OR "Length of Stay"(Mesh) OR complication*(tiab) OR “length of stay”(tiab) OR adverse(tiab) OR "surgery" (Subheading) OR "Surgical Procedures, Operative"(Mesh) OR "Perioperative Care"(Mesh) OR perioperat*(tiab) OR peri-operat*(tiab) OR surger*(tiab)) AND ("randomised Controlled Trial" (Publication Type) OR "Controlled Clinical Trial" (Publication Type) OR "Clinical Trials as Topic"(Mesh:NoExp) OR randomi*(TIAB) OR placebo(TIAB) OR randomly(TIAB) OR trial(TI)) NOT ("Animals"(Mesh) NOT "Humans"(Mesh)))) AND ("2018/05/01"(Date - Publication) : "3000"(Date - Publication)))) OR ((((goal direct*(tiab) OR objective guided*(tiab) OR haemodynamic optimi*(tiab) OR haemodynamic optimi*(tiab) OR (("Fluid Therapy"(Mesh) OR fluid therap*(tiab) OR fluid manag*(tiab) OR liquid manag*(tiab)) AND (peri-operat*(tiab) OR perioperat*(tiab) OR peroperat*(tiab) OR "Perioperative Care"(Mesh)))) AND ("Morbidity"(Mesh) OR "Mortality"(Mesh) OR "mortality" (Subheading) OR mortality(tiab) OR morbidity(tiab) OR "Posterative Complications"(Mesh) OR "Length of Stay"(Mesh) OR complication*(tiab) OR “length of stay”(tiab) OR adverse(tiab) OR "surgery" (Subheading) OR "Surgical Procedures, Operative"(Mesh) OR "Perioperative Care"(Mesh) OR perioperat*(tiab) OR peri-operat*(tiab) OR surger*(tiab)) AND ("randomised Controlled Trial" (Publication Type) OR "Controlled Clinical Trial" (Publication Type) OR "Clinical Trials as Topic"(Mesh:NoExp) OR randomi*(TIAB) OR placebo(TIAB) OR randomly(TIAB) OR trial(TI)) NOT ("Animals"(Mesh) NOT "Humans"(Mesh)))) AND ("2018/05/01"(Date - Create) : "3000"(Date - Create)))
= 42 |
72 |
|
Embase (Elsevier) |
('goal directed':ab,ti OR 'objective guided':ab,ti OR 'haemodynamic optimisation':ab,ti OR 'haemodynamic optimization':ab,ti) AND ('morbidity'/exp OR 'morbidity' OR 'mortality'/exp OR 'mortality' OR 'peroperative complication'/exp OR 'peroperative complication' OR 'Intraerative period'/exp OR 'Intraerative period' OR 'Posterative complication'/exp OR 'Posterative complication' OR 'surgery'/exp OR 'surgery' OR perioperat*:ab,ti OR 'peri operative':ab,ti OR peroperative:ab,ti OR surger*:ab,ti) AND ('randomised controlled trial'/exp OR 'controlled clinical trial'/exp OR randomi*:ab,ti OR randomly:ab,ti OR placebo:ab,ti OR trial:ti) NOT (('animal'/exp OR 'nonhuman'/exp) NOT 'human'/exp) AND (1-5-2018)/sd NOT (1-10-2018)/sd
= 57 |
