Aanbevelingen in de uitvoering van PGDT
Uitgangsvraag
Welke aspecten zijn belangrijk voor de uitvoering van perioperative Goal-Directed Therapy (PGDT)?
Aanbeveling
Risico’s van PGDT
Houd bij de uitvoering van PGDT rekening met de potentiële risico’s:
- bijwerkingen van de toediening van vocht en vasoactieve medicijnen;
- complicaties door het gebruik van invasieve monitoringstechnieken;
- verkeerde behandelingskeuzes door misinterpretatie van hemodynamische variabelen of foutieve metingen;
- verminderde aandacht voor overige hemodynamische variabelen door de focus op de doelvariabelen.
Het algoritme
Gebruik in de uitvoering van PGDT bij voorkeur een flowchart met de volgende kenmerken:
- een of meerdere doelvariabele(n) met een streefwaarde;
- een algoritme dat doorlopen wordt wanneer de doelvariabele onder de streefwaarde zakt en dat leidt tot therapie;
- een feedbackloop die terugkomt bij de doelvariabele zodat de therapie niet stopt voordat de streefwaarde bereikt is.
Gebruik als doelvariabele een flow- of cardiale-preload-gerelateerde variabele of een combinatie hiervan.
Pas de streefwaarden voor de doelvariabele aan afhankelijk van het type patiënt, het type ingreep en de perioperatieve fase.
Patiëntenselectie
Selecteer patiënten en/of ingrepen met een verhoogd risico op postoperatieve complicaties en overlijden.
Timing
Start PGDT tijdig, zo nodig voor de inductie van anesthesie. PGDT dient gecontinueerd te worden zolang er een indicatie bestaat voor continue hemodynamische bewaking.
Betrekken van ketenpartners
Voer PGDT uit in teamverband met vertegenwoordigers van alle betrokken beroepsgroepen en disciplines. Plan regelmatig bijeenkomsten om de ontwikkeling, implementatie, uitvoering en resultaten van PGDT te evalueren.
Vermeld tijdens de overdracht naar de PACU of intensive care afdeling het peroperatieve gebruik van PGDT.
Overwegingen
In de onderstaande overwegingen worden aspecten met betrekking tot de praktische uitvoering van PGDT beschreven. De volgende onderwerpen komen aan de orde:
- risico’s van PGDT;
- het algoritme (keuze doelvariabele en streefvariabele);
- patiëntenselectie;
- timing van PGDT; en het
- betrekken van de ketenpartners
Risico’s van PGDT
Hoewel in de literatuur geen schadelijke effecten worden gerapporteerd van het volgen van de gebruikte algoritmen, ligt het voor de hand dat verkeerd gebruik niet zonder risico is (Kaufmann, 2018). Allereerst wordt in de algoritmen gebruik gemaakt van het toedienen van vocht en vasoactieve middelen, hetgeen kan leiden tot complicaties van deze therapieën zoals decompensatio cordis, myocardischemie en cardiale ritmestoornissen. Het is dan ook niet de bedoeling om blindelings het algoritme te blijven volgen wanneer dit leidt tot onacceptabel hoge doseringen inotropie of vochttoediening. Ten tweede is er sprake van sterke variatie in toegepaste monitoringstechnieken, variërend van non-invasieve meetmethoden via een vingerclip tot invasieve technieken zoals katheterisatie van centrale venen, arteriën en de arteria pulmonalis. De invasieve technieken geven in het algemeen betrouwbare en robuuste metingen maar kunnen leiden tot complicaties van katheterisatie zoals bloeding, lijninfectie en trombose. Hoewel bij non-invasieve technieken de meting zelf niet schadelijk is, kan men in zijn algemeenheid stellen dat de betrouwbaarheid van deze technieken onder wisselende hemodynamische omstandigheden minder robuust is dan die van de meer invasieve methoden. Misinterpretatie of foutieve metingen kunnen vervolgens leiden tot verkeerde keuzes in de therapie. Het is daarom cruciaal om goed kennis te nemen van de beperkingen van de gekozen monitoringsapparatuur. Tot slot dient benadrukt te worden dat PGDT een aanvulling is op de standaardbehandeling en niet een vervanging. Er wordt gebruik gemaakt van geavanceerde monitoringstechnieken en de nadruk van de algoritmen ligt veelal op meting van flow- en cardiale preload gerelateerde variabelen. Echter, de meer conventionele variabelen als bloeddruk, hartfrequentie en urineproductie zijn onverminderd van belang. De suggesties voor behandeling die volgen uit het algoritme dienen daarom niet zonder nadenken gevolgd te worden, maar moeten in het licht worden gezien van de totale conditie van de patiënt.
Het algoritme
Essentie van PGDT
PGDT omvat in essentie het continu meten van een of meerdere hemodynamische variabele(n) (doelvariabele) om deze met behulp van een behandelingsalgoritme boven een vooraf ingestelde streefwaarde te handhaven. Door continu te meten wordt bereikt dat een daling onder de streefwaarde vroeg gedetecteerd wordt. Dit leidt vervolgens tot het doorlopen van het algoritme met één of meerdere behandelingsstappen (zie figuur 1). Het algoritme komt uiteindelijk weer terug bij de streefwaarde zodat de ingestelde behandeling niet stopt voordat deze bereikt is. Hierdoor wordt de hemodynamische variabele continu boven de streefwaarde gehouden met als doel om de hemodynamische conditie van de patiënt optimaal te houden.
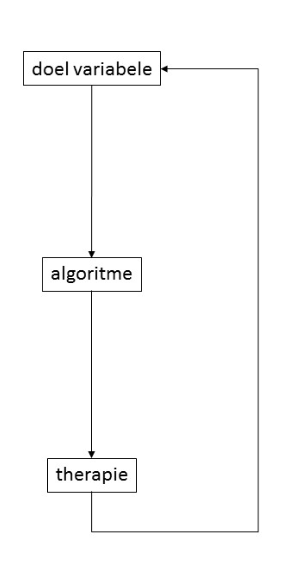
Figuur 1 Voorbeeld algoritme
Doelvariabele
De doelvariabele of variabele die het algoritme in werking zet is veelal een flowvariabele of een cardiale-preload-gerelateerde variabele (zie tabel 2 bij module over effectiviteit van PGDT). Als flowvariabele wordt veelal de cardiac output of het slagvolume genomen, al dan niet geïndexeerd naar lichaamsoppervlak (cardiac index respectievelijk slagvolume-index). De achterliggende gedachte hierbij is dat cardiac output één van de belangrijkste determinanten is van zuurstoftoevoer naar de weefsels, waardoor een PGDT-algoritme tot een continu adequate orgaan- en weefseloxygenatie leidt. In het verlengde hiervan wordt ook wel het totale zuurstofaanbod (DO2) toegepast in PGDT-algoritmen, of de veneuze saturatie (centraal of gemengd) als maat voor de balans tussen zuurstofaanbod en -verbruik. Als cardiale-preload-variabele wordt veelal een dynamische preload-parameter (bijvoorbeeld slagvolumevariatie of polsdrukvariatie) toegepast. Het doel hiervan kan zijn het continu optimaliseren van de vochtbalans en het handhaven van een adequate preload als belangrijkste determinant van cardiac output. Echter, vaak worden zowel flow- als preload-variabelen gecombineerd (zie figuur 2A). Hierbij wordt bijvoorbeeld cardiac output als doelvariabele gebruikt en wordt slagvolume variatie binnen het algoritme gebruikt om te beslissen of vochttoediening dan wel inotropie moet worden toegepast als therapie. Ook kan ervoor gekozen worden om andere hemodynamische variabelen zoals de bloeddruk toe te voegen aan het algoritme (zie figuur 2B).
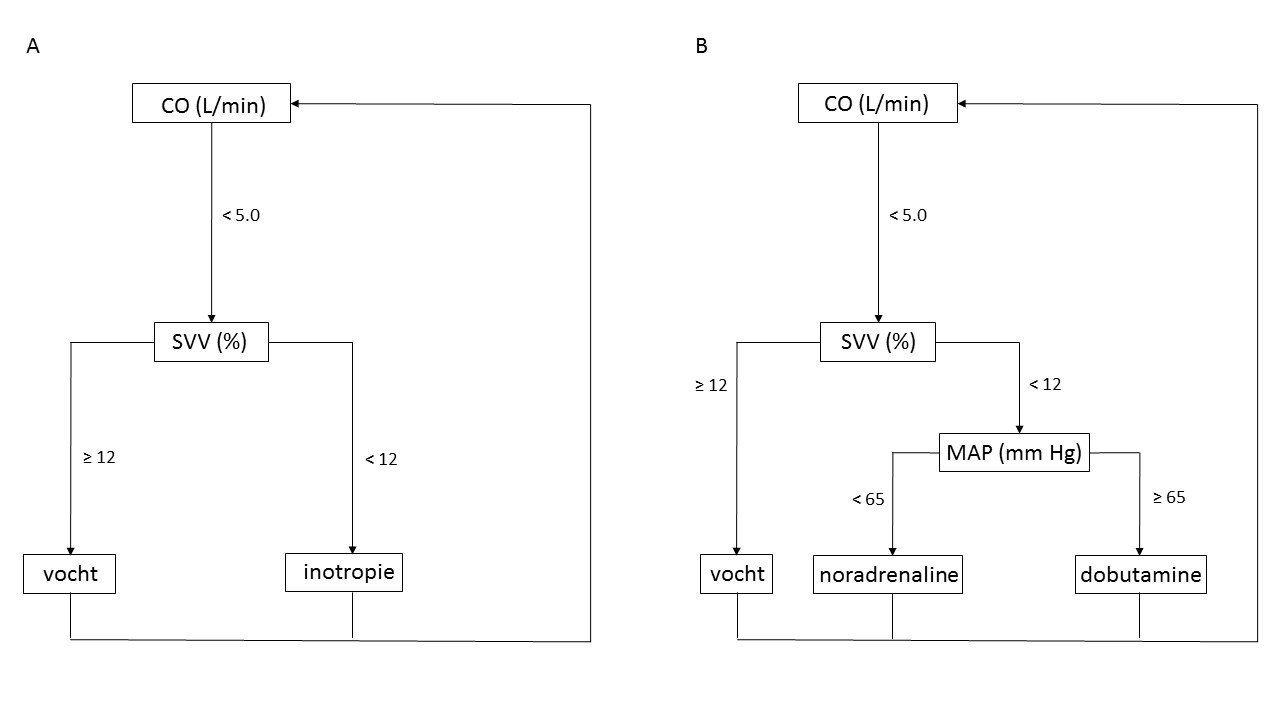
Figuur 2 (A) voorbeeld algoritme met een combinatie van een flow- en preloadvariabele; Figuur 2 (B) voorbeeld algoritme met verschillende hemodynamische variabelen
Streefwaarde
Hoewel het in studieverband gebruikelijk is om één streefwaarde voor de doelvariabele te definiëren, is het aan te raden om in de praktijk deze streefwaarde af te stemmen op de klinische context. Zo neemt bijvoorbeeld de cardiac output af met de leeftijd en kan cardiovasculaire belasting bij de patiënt reden zijn om voorzichtiger om te gaan met positief inotrope en chronotrope medicatie. Ook kunnen de hemodynamische doelstellingen aanzienlijk verschillen per type ingreep, bijvoorbeeld om te kunnen voldoen aan een restrictief vochtregime. Tot slot kan het wenselijk zijn om de streefwaarden af te stemmen op de perioperatieve fase, bijvoorbeeld bij patiënten voor open buikaneurysma repair bij wie tijdens het klemmen van de aorta doorgaans beperkt vocht wordt toegediend en een lagere cardiac output wordt geaccepteerd. Ook kan een intra-operatieve fase met lage cardiac output opgevolgd worden door een postoperatieve fase met inflammatie en hoge cardiac output, bijvoorbeeld bij cardio-chirurgische patiënten. In dit soort situaties kan dan ook overwogen worden om lagere waarden voor cardiac output of preload-gerelateerde variabelen tijdelijk te accepteren of om de streefwaarden aan te passen aan de perioperatieve fase. In tabel 2 (zie module effectiviteit van PGDT) worden voorbeelden gegeven van streefwaarden die in de literatuur gebruikt zijn. Er is geen literatuur die verschillende streefwaarden met elkaar vergelijkt.
Patiëntenselectie
Het ligt voor de hand dat PGDT de grootste potentie heeft bij patiënten met een verhoogd risico op postoperatieve complicaties en overlijden. Dit hoge risico komt voort uit de aard of omvang van de ingreep (bijvoorbeeld grote kans op fors bloedverlies, volume shifts of postoperatieve inflammatie) al dan niet in combinatie met patiënt gerelateerde factoren (bijvoorbeeld leeftijd, comorbiditeit en fysiologische reserve). In de literatuur wordt PGDT dan ook voornamelijk toegepast bij patiënten die een omvangrijke ingreep ondergaan (bijvoorbeeld cardiochirurgie of grote gastro-intestinale resecties voor maligniteit) of een hoge ASA-classificatie hebben (bijvoorbeeld perifere vaatchirurgie of ASA III/IV-patiënten voor orthopedische ingrepen).
Timing
PGDT kan worden beschouwd als preventieve maatregel om zuurstoftoevoer naar de weefsels optimaal te houden en te voorkomen dat er zuurstoftekort optreedt. Indien PGDT te laat toegepast wordt kan het zijn dat er al dusdanige schade ontstaan is als gevolg van het chirurgische trauma of bloedverlies dat er een verhoogde kans is ontstaan op complicaties. In de praktijk betekent dit dat PGDT gestart dient te worden tijdens of na de inductie van anesthesie en voordat chirurgische schade geïnduceerd wordt. Overwogen dient te worden om PGDT te starten voor de inductie van anesthesie omdat hemodynamische instabiliteit die zich voordoet voor chirurgische incisie ook gepaard is met postoperatieve orgaanstoornissen. Dit betekent dan wel dat een arterielijn al geplaatst dient te worden bij een wakkere patiënt zodat hiermee de flow variabelen of cardiale-preload-variabele gemeten kunnen worden. PGDT dient gecontinueerd te worden zolang er een indicatie bestaat voor continue hemodynamische bewaking.
Betrokkenheid van de ketenpartners
PGDT is een teamprestatie. Het is dan ook belangrijk om de anesthesiologen, snijdende specialismen, anesthesiemedewerkers, Intensive care (IC) en Post Anesthesia Care Unit (PACU)-verpleegkundigen, maar ook het management en de technische dienst van het ziekenhuis te betrekken in het ontwikkelen, implementeren en uitvoeren van PGDT. Tijdens de uitvoering moet gewaarborgd worden, dat het PGDT-algoritme bij de deelnemende patiënten door de hele zorgketen wordt uitgevoerd. Hiervoor is de overdracht van groot belang. Er zijn geen studies die de overdracht van patiënten voor of na PGDT onderzocht hebben. In het algemeen blijft close monitoring van de patiënt gewaarborgd bij overdracht naar PACU of Intensive Care afdeling en strekt het tot aanbeveling tijdens de overdracht het peroperatieve gebruik van PGDT te vermelden.
Onderbouwing
Achtergrond
Er bestaat op dit moment in Nederland geen protocol of richtlijn voor de uitvoering van PGDT. Tevens zijn er geen studies beschikbaar die hebben onderzocht welke uitvoering van PGDT het meest geschikt is voor een bepaalde klinische setting. Het doel van deze module is dan ook niet om het ideale PGDT-algoritme te presenteren, maar om de belangrijkste randvoorwaarden te beschrijven waaraan PGDT moet voldoen.
PGDT omvat niet alleen het volgen van een algoritme om de hemodynamische conditie van de patiënt te optimaliseren. Het betreft een interventie die erop is gericht om de perioperatieve zorg voor bepaalde hoogrisicopatiënten te verbeteren. Dit vereist, naast de keuze voor een bepaald behandelingsalgoritme, een inschatting van de risico’s van PGDT, een weloverwogen patiëntenselectie, afstemming van het algoritme op de individuele patiënt, kennis van de gebruikte monitoringsapparatuur en betrokkenheid van ketenpartners als de snijdende specialismen en intensive care.
Zoeken en selecteren
Er is geen literatuuronderzoek verricht om de vraag te beantwoorden. Na discussie binnen de werkgroep zijn de overwegingen en aanbevelingen opgesteld. Daarnaast is gebruik gemaakt van de literatuur die gevonden is voor de module over effectiviteit van PGDT.
Referenties
- Kaufmann, T., Clement, R. P., Scheeren, T. W., Saugel, B., Keus, F., & van der Horst, I. C. (2018). Perioperative goal‐directed therapy: A systematic review without meta‐analysis. Acta Anaesthesiologica Scandinavica, 62(10), 1340-1355.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-10-2020
Beoordeeld op geldigheid : 31-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Aanbevelingen in de uitvoering van PGDT |
NVA |
2020 |
2022 |
Eens in 2 jaar |
NVA |
Lopend onderzoek zoals de te verwachten resultaten van drie lopende studies (OPTIMISE II studie (www.optimiseii.org), FLO-ELA-studie (www.floela.org), en Montenij (2014)) |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Prof. dr. T.W.L. Scheeren, anesthesioloog, werkzaam in het Universitair Medisch Centrum te Groningen, NVA
- Dr. L.J. Montenij, anesthesioloog-intensivist, werkzaam in het Catharina Ziekenhuis te Eindhoven, NVA
- Dr. J.P. Hering, anesthesioloog, werkzaam in het Dijklander ziekenhuis te Hoorn, NVA
- Dr. I.C.C. van der Horst, cardioloog-intensivist, werkzaam in het Maastricht UMC+ te Maastricht, NVVC NVIC
- Dr. F. Daams, chirurg, werkzaam in het Amsterdam UMC te Amsterdam, NVvH
Met ondersteuning van
- T. Kaufmann, arts-onderzoeker anesthesiologie, werkzaam in het Universitair Medisch Centrum te Groningen
- Dr. M.A. Pols, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- A.L.J. Kortlever - van der Spek, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hering |
Anesthesioloog 100% Westfriesgasthuis |
Geen |
Extern gefinancierd onderzoek: (1) Trace studie zonmw (Principal investigator – de TRACE-studie bekijkt of een postoperatieve visite door de anesthesioloog de kans op complicaties kan verminderen en kosten kan besparen gesponsord door ZonMW; (2) Jens-Peter werkt ook mee aan de EPOCH-studie (AMC) naar het toepassen van GDF (EPOCH-studie). Hij voert binnen dit onderzoek alleen de ‘opdrachten’ uit die hij krijgt. Hij krijgt hiervoor geen vergoeding (en is geen principal investigator). (3) In 2015 heeft hij nog een presentatie gegeven voor Edwards (betaald) (4) Rondetafelgesprek met Edwards (initiator) waarin GDFT wordt besproken (geen vergoeding) |
Niet van toepassing. (We gaan geen aanbevelingen opstellen over het type monitor dat gebruikt moet worden tijdens GDFT) |
|
Scheeren |
Hoogleraar Anesthesiologie |
Chair Cardiovascular Dynamics Section European society of Intensive Care Medicine (ESICM) onbetaald |
Research grants form Edwards Lifesciences (Irvine, CA, USA) and Masimo Inc. (Irvine, CA, USA) (vergoeding wordt uitbetaald aan het ziekenhuis) |
Niet van toepassing. (We gaan geen aanbevelingen opstellen over het type monitor dat gebruikt moet worden tijdens GDFT) |
|
Daams |
Chirurg UMCA |
Voorzitter taskforce naadlekkage |
Gesponsord onderzoek naar de ontwikkeling van robot geassisteerde slokdarmanastomose. |
Niet van toepassing |
|
Horst |
Intensivist-cardioloog, Universitair Medisch Centrum Maastricht |
Geen |
Geen |
Niet van toepassing |
|
Montenij |
Anesthesioloog-intensivist (Catharina Ziekenhuis Eindhoven) |
Geen |
Onderzoek naar monitoring (breed) dat gesponsord wordt door Phillips |
Niet van toepassing. (We gaan geen aanbevelingen opstellen over het type monitor dat gebruikt moet worden tijdens GDFT) |
|
Overige leden |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Kaufmann |
Arts-onderzoeker (1 FTE) Afdeling Anesthesiologie – Universitair Medisch Centrum Groningen |
Geen |
Geen |
Niet van toepassing |
Inbreng patiëntenperspectief
De werkgroep heeft de conceptrichtlijn tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze modules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
De NVA beschouwt de internationale richtlijn “2014 ESC/ESA Guidelines on non-cardiac surgery: cadiovascular assessment and management” als een goede vervanger van de richtlijn “Preventie van perioperatieve cardiale complicaties bij niet-cardiale-chirurgie” uit 2009. Deze internationale richtlijn besteedt echter weinig aandacht aan perioperative goal directed therapy (PGDT). De werkgroep heeft binnen het onderwerp van PGDT de belangrijkste knelpunten benoemd voor dit onderwerp.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming) en belangrijk (maar niet kritiek).
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de modules met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabel. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze modules het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules werden aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
