PPC perioperatieve medicamenteuze behandeling
Uitgangsvraag
Welke perioperatieve medicamenteuze behandeling dient te worden gegeven aan de pulmonaal belaste patiënt om de kans op postoperatieve pulmonale complicaties te verkleinen?
Aanbeveling
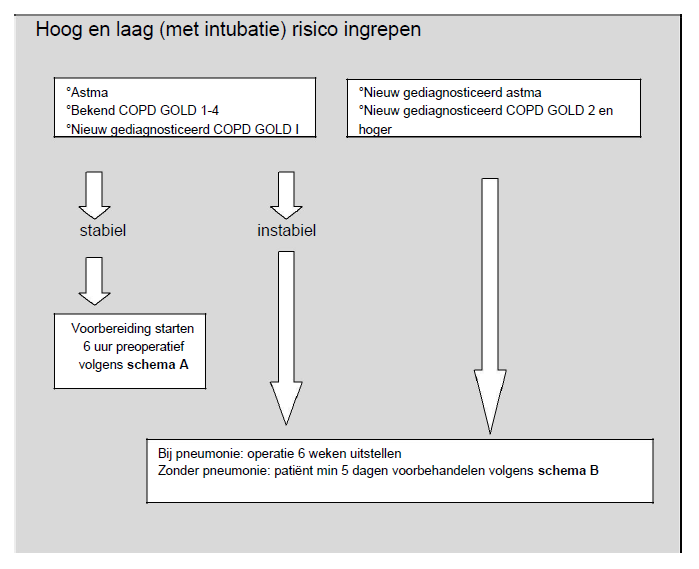
Geadviseerd wordt om patiënten met astma of COPD in de perioperatieve fase medicamenteus te ondersteunen. De mate van medicamenteuze ondersteuning hangt af van het risico van de ingreep en de ernst van de astma of COPD. Zie behandelingsschema’s.
De werkgroep is van mening dat ongeacht de aard van de ingreep (hoog of laag risico) patiënten met een instabiel astma of COPD medicamenteus geoptimaliseerd dienen te worden.
Laag risico ingrepen onder lokaal anesthesie (door de behandelaar) behoeven geen voorbereiding.
De werkgroep is van mening dat na het staken van de perioperatieve medicamenteuze pulmonale voorbereiding de eigen inhalatie medicatie weer hervat moet worden.
In de postoperatieve fase geeft de werkgroep ten aanzien van de toedieningswijze van beta-2-agonisten en anticholinergica de voorkeur aan verneveling boven dosisaërosol.
Aanbevelingen voor verder onderzoek: naar effectiviteit van verneveling vs dosisaërosol specifiek in de postoperatieve periode.
Overwegingen
In de meta-analyse van Sauerland (2000) bij electieve en traumachirurgie werden zeer hoge doses corticosteroïden intraveneus toegediend. Dit is niet vergeleken met een lagere, in de praktijk meer gangbare dosis. De werkgroep geeft het advies om deze hoge dosering niet toe te dienen omdat zij van mening is dat dit gepaard kan gaan met ernstige bijwerkingen en adviseert om 0,5-1 mg prednison/kg te geven.
In de behandelschema's behorende bij deze uitgangsvraag wordt afhankelijk van de ernst van het longlijden en de aard van ingreep een algemeen perioperatief medicamenteus behandeladvies gegeven. Uiteraard moeten bij de keuze van de behandeling individuele factoren van de patiënt mee worden gewogen.
Hoewel geen sterk bewijs is, vindt de werkgroep dat ook niet eerder behandelde patiënten met COPD of astma die een operatie moeten ondergaan eerst medicamenteus ge-optimaliseerd moeten worden middels schema B.
De werkgroep is van mening dat in geval van een pneumonie de chirurgische ingreep indien mogelijk, 6 weken uitgesteld dient te worden. Ook in geval van een exacerbatie astma danwel COPD is het raadzaam de ingreep uit te stellen totdat patiënt weer is hersteld. Dit is mede afhankelijk van het beloop gedurende minimaal één week gevolgd door opnieuw evaluatie van klinische en/of longfunctieparameters.
De werkgroep is van mening dat in geval van een stabiel astma of COPD ongeacht of de patiënt een hoog of laag risico ingreep ondergaat de medicamenteuze voorbereiding over het algemeen kort voor aanvang van de operatie kan worden aangevangen volgens schema A. Bij patiënten met een ernstig COPD (GOLD 3-4) die een hoog risico ingreep dienen te ondergaan kan in overleg met de behandelend longarts eventueel worden gekozen voor een langere voorbereiding.
Onderbouwing
Achtergrond
In deze module wordt de samenvatting van de literatuur ter beantwoording van de uitgangsvraag uiteengezet. Door ontbreken van goede gerandomiseerde klinische studies is veelal een advies geformuleerd dat gebaseerd is op klinische ervaring en gewoonte.
De rol van medicamenteuze behandeling bij pulmonaal belaste patiënten ter voorkoming van het optreden van perioperatieve pulmonale complicaties wordt hier besproken. Elke patiënt met astma of COPD dient perioperatief medicamenteus behandeld te worden, ook als er geen klachten zijn. De duur en uitgebreidheid van de medicamenteuze behandeling is afhankelijk van patiënt en operatie gerelateerde risicofactoren en de actuele klinische toestand van de patiënt (Dekhuijzen, 1999).
Het is van belang onderscheid te maken tussen stabiel danwel instabiel astma of COPD. Van instabiel astma spreekt men als de patiënt meer dan twee keer per week klachten heeft of gebruik maakt van rescue bronchusverwijders, er een beperking is in activiteiten of nachtelijke dyspnoeklachten zijn, de piekflow of FEV1 minder dan 80% van voorspeld (of personal best) is. (Global Initiative for asthma. Global strategy for asthma management and prevention; revised 2006; www.ginaastma.org).
Instabiel COPD uit zich in toename van klachten (dyspnoe, hoest, toename sputum danwel verandering van het aspect), een grotere behoefte aan bronchusverwijdende medicatie en verslechterde longfunctie waarden. De ernst van COPD wordt uitgedrukt volgens de Global Inititiative for Chronic Obstructive Lung Disease (GOLD) richtlijn in FEV1 als percentage van voorspeld bij een FEV1/VC kleiner dan 70% (zie aanverwant 'GOLD Classificatie') (Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease; updated 2003; www.goldcopd.com).
Conclusies / Summary of Findings
|
Niveau 3 |
Bij patiënten met een niet eerder onderkend danwel onderbehandeld COPD en die een CABG moeten ondergaan, zijn er aanwijzingen dat preoperatieve voorbehandeling met systemische corticosteroïden zinvol is om PPC’s te voorkomen.
B Bingol 2005 |
|
Niveau 1 |
Het is aangetoond dat een eenmalige hoge dosis corticosteroïden (15-30 mg/kg) het risico op PPC’s vermindert. Het is niet onderzocht of een lagere dosis even effectief zou kunnen zijn.
A1 Sauerland 2000 |
|
Niveau 1 |
Het is aangetoond dat er bij patiënten met een exacerbatie van COPD of astma, geen verschil is in effectiviteit van verneveling versus dosisaërosol met voorzetkamer, mits zij hiervoor goed geïnstrueerd zijn. Echter dit is niet onderzocht bij patiënten die een operatie moeten ondergaan.
A1 Brocklebank 2001, Cates 2000 en updates tot 2006 Cochrane library, Dolovich 2005 |
|
Niveau 3 |
Voor patiënten met myasthenia gravis zijn er aanwijzingen dat gebruik van preoperatieve corticosteroïden leidt tot minder respiratoire insufficiëntie.
C Zielinski 2004 |
|
Niveau 1 |
Het is aangetoond dat intubatie het risico op bronchusobstructie verhoogt bij patiënten met astma of bronchiale hyperactiviteit.
A1 Groeben 2004 |
Samenvatting literatuur
COPD
Een retrospectieve studie bij patiënten met COPD (n=48) die electieve abdominale en thoracale chirurgie onder algehele anesthesie ondergingen, beschreef een lagere incidentie van PPC’s bij patiënten die enige vorm van medicamenteuze voorbereiding en fysiotherapie kregen versus geen voorbereiding, respectievelijk 21% vs 60% (Stein en Cassara 1970). In een studie met 40 onbehandelde patiënten met COPD die een electieve CABG ondergingen, bleek dat oraal prednison (20 mg gedurende 10 dagen preoperatief en daarna een 3 dagelijks afbouwschema) een duidelijke verkorting gaf van de intubatietijd (6.8 vs 14.9 uur), het IC verblijf (1.4 vs 5.2 dagen) en de opnameduur in het ziekenhuis (8.3 vs 12.95 dagen). Er werd geen uitspraak gedaan over de aard van de complicaties (Bingol et al. 252-56). Er zijn geen grote RCT’s bij patiënten met COPD waaruit een advies kan worden geformuleerd. Op grond van kleinere studies en klinische ervaring is het toch zinvol om patiënten met COPD pulmonaal te optimaliseren. Voor het optimaliseren van COPD symptomen wordt geadviseerd te behandelen volgens de vigerende richtlijn (Global Initiative for Chronic Obstructed Lung Disease Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease; updated 2003; www.goldcopd.com) welke in het aanverwante product Classificaties is vermeld specifiek voor de perioperatieve fase (Behr 65-69).
Astma
Patiënten met instabiel astma hebben een verhoogd risico op PPC’s, echter patiënten met stabiel astma hebben weinig additioneel risico (Kabalin et al 1995, Tirumalasetty 2006, Mitsuta 2001). Maar in een review wordt gerefereerd aan een studie met patiënten met licht astma: dit betrof asymptomatische vrijwilligers (n=10) die onder lokaal anesthesie een intubatie ondergingen en vooraf én met de tube in situ longfunctieonderzoek ondergingen. Zonder medicamenteuze voorbereiding bleek 50% reductie in de FEV1 op te treden. Met gebruik van beta2agonisten en topisch lidocaine was dit nog slechts 20%. Derhalve lijkt het zinvol om patiënten met astma of bronchiale hyperactiviteit voor te behandelen met een combinatie van corticosteroïden (0,5-1 mg/kg prednison) en beta2agonisten. Er zijn geen studies gedaan naar de duur van deze voorbereiding. Wel is aangetoond dat kortdurende systemische corticosteroiden niet tot een verhoogde incidentie van postoperatieve infecties bij patiënten met astma leiden (Groeben, 2004).
Overige patiëntengroepen
Thymectomie bij myasthenia gravis: in een observationele retrospectieve studie van 1973 tot 2002 met 620 patiënten bleek dat het geven van perioperatieve corticosteroïden leidde tot minder respiratoire insufficiëntie (6.8 vs 9.1%). In de loop van de tijd nam het verschil in complicaties af waarbij het gebruik van corticosteroïden ook meer geïmplementeerd was (tot 1980 kreeg 7% van de patiënten steroïden versus 25% vanaf 1991) (Zielingski, 2004).
Medicatie
Corticosteroïden, beta2agonisten en anticholinergica
Systemische corticosteroïden verbeteren de functie van beta2 adrenerge en M2 receptoren (en daardoor vermindering van de parasympatische activiteit en dus vermindering van reflexbronchusobstructie). Beta2agonisten en anticholinergica verminderen de bronchus-obstructie. Er is slechts één systematische review uitgevoerd naar de effecten van een eenmalige preoperatieve hoge dosis corticosteroïden (15-30 mg/kg methylprednisolon) ter preventie van pulmonale complicaties en de nadelige effecten van deze behandeling in de postoperatieve fase, waarbij geen melding wordt gedaan van de aanwezigheid van pre-existent longlijden. Het betrof zowel hoog als laag risico electieve operaties en traumachirurgie. De auteurs vonden voor alle studies samen (51 studies met in totaal bijna 2500 patiënten) een daling in het risico op pulmonale complicaties (risico reductie -3,5% CI - 1.0 tot -6.1) waarbij de reductie het grootst was in geval van traumachirurgie. Er werd niet vermeld hoeveel reductie dit betrof. Er was geen significante stijging van bijwerkingen (Sauerland et al. 2000).
Toedieningswijze
Er zijn geen studies die orale corticosteroïden vergeleken met intraveneuze toediening in de perioperatieve fase.
Er is wel onderzoek gedaan bij patiënten met ernstig COPD die in het ziekenhuis behandeld werden voor een exacerbatie. Het betrof een gerandomiseerde studie met twee groepen. De eerste groep kreeg een intraveneuze behandeling met methylprednisolon 40 mg gedurende 10 dagen waarna een afbouwschema gecombineerd met verneveling met een beta2agonist en anticholinergicum. De tweede groep ontving methylprednisolon oraal 32 mg gedurende een week gevolgd door een afbouwschema gecombineerd met een dosisaërosol (combinatiepreparaat met beta2agonist en anticholinergicum) met voorzetkamer. Beide therapeutische regimes bleken in de behandeling van exacerbaties even effectief. Patiënten die niet in staat waren om de dosisaërosol met voorzetkamer op juiste wijze te inhaleren werden geëxcludeerd (Willaert et al. 2002).
Er zijn veel studies en meta-analyses verricht die aantonen dat bij behandeling van exacerbaties bij astma of COPD geen verschil in effect optreedt bij toediening van een beta2agonist en anticholinergicum via een dosisaërosol met voorzetkamer of via verneveling. (Brocklebank et al. 2001, Cates et al. 2003, Cates and Rowe 2000, Cates Crilly and Rowe 2006, Celli 1993). Het is niet in de perioperatieve fase getoetst. Tevens betreft het in de studies goed geïnstrueerde patiënten: In de perioperatieve fase bestaat afhankelijk van de patiënt en de aard van de ingreep een risico op sputumstase en atelectase vorming. Dit risico is groter na een operatie onder algehele anesthesie Bij er een verminderd bewustzijn zullen patiënten minder goed actief inhaleren. Op grond van klinische ervaring lijkt verneveling in de postoperatieve periode een toegevoegde waarde te hebben boven dosisaërosol met voorzetkamer. In de preoperatieve periode lijkt er op grond van klinische ervaring en extrapolatie van bovengenoemde meta-analyse bij astma en COPD patiënten geen voorkeur te benoemen indien er sprake is van een goede inhalatietechniek.
Duur van de behandeling
Er zijn slechts twee studies bij patiënten met COPD waarbij respectievelijk vijf en tien dagen medicamenteuze voorbereiding werd gegeven. Eén van deze studies betrof een kleine groep COPD patiënten met een partieel reversibele longfunctie (n=41): Behandeling met prednison en salbutamol leidde tot een verbetering in de longfunctie na één dag en gaf minder piepen na intubatie in vergelijking met salbutamol alleen (Silvanus, 2004). De andere studie betrof electieve CABG chirurgie bij onbehandelde COPD patiënten waarbij medicamenteuze voorbereiding met systemische corticosteroïden gedurende 10 dagen gevolgd door een postoperatief afbouwschema, leidde tot minder bronchospasme en een korter IC en ziekenhuisverblijf (Bingol 2005). Er werd evenwel geen melding gedaan van andere pulmonale complicaties dan bronchospasme
Er zijn geen RCT’s verricht die een antwoord kunnen geven op de duur van medicamenteuze ondersteuning in de postoperatieve periode bij patiënten met astma en COPD.
Overige medicatie
N-acetylcysteine: er zijn geen RCT’s naar het effect van N-acetylcysteine op PPC’s gedaan. Theophylline: er werden geen studies gevonden naar het effect van theophylline op het verminderen van pulmonale complicaties. Gezien de potentiële bijwerkingen en het feit dat er geen bewijs is voor een additief effect in de perioperatieve fase, lijkt dit medicament geen plaats meer te hebben.
Eigen medicatie
Er is geen literatuur op grond waarvan een uitspraak gedaan kan worden over het beleid ten aanzien van de eigen medicatie van de pulmonaal belaste patiënt in de perioperatieve periode. Algemeen gebruik is om na het staken van de perioperatieve medicamenteuze voorbereiding de eigen inhalatiemedicatie te hervatten.

Referenties
- Behr, J. "Optimizing preoperative lung function." Curr.Opin.Anaesthesiol. 14.1 (2001): 65-69.
- Bingol, H. et al. "The effect of oral prednisolone with chronic obstructive pulmonary disease undergoing coronary artery bypass surgery." J.Card Surg. 20.3 (2005): 252-56.
- Brocklebank, D. et al. "Comparison of the effectiveness of inhaler devices in asthma and chronic obstructive airways disease: a systematic review of the literature." Health Technol.Assess. 5.26 (2001): 1-149.
- Cates, C. C. et al. "Holding chambers versus nebulisers for beta-agonist treatment of acute asthma." Cochrane.Database.Syst.Rev.3 (2003): CD000052.
- Cates, C. J., J. A. Crilly, and B. H. Rowe. "Holding chambers (spacers) versus nebulisers for beta-agonist treatment of acute asthma." Cochrane.Database.Syst.Rev.2 (2006): CD000052.
- Cates, C. J. and B. H. Rowe. "Holding chambers versus nebulisers for beta-agonist treatment of acute asthma." Cochrane.Database.Syst.Rev.2 (2000): CD000052.
- Celli, B. R. "Perioperative respiratory care of the patient undergoing upper abdominal surgery." Clin.Chest Med. 14.2 (1993): 253-61.
- Dekhuijzen PNR and Joos G. "Perioperatieve Beoordeling En Zorg." Ed. Demedts M et al. 4 ed. Assen: Van Gorcum & Comp BV, 1999. 311-18.
- Groeben, H. "Strategies in the patient with compromised respiratory function." Best.Pract.Res.Clin.Anaesthesiol. 18.4 (2004): 579-94.
- Kabalin, C. S., P. R. Yarnold, and L. C. Grammer. "Low complication rate of corticosteroid-treated asthmatics undergoing surgical procedures." Arch.Intern.Med. 155.13 (1995): 1379-84.
- Sauerland, S. et al. "Risks and benefits of preoperative high dose methylprednisolone in surgical patients: a systematic review." Drug Saf 23.5 (2000): 449-61.
- Schuurbiers, O. C. et al. "[Tiotropium, a long-acting bronchodilating agent for the treatment of COPD]." Ned.Tijdschr.Geneeskd. 150.22 (2006): 1227-32.
- Silvanus, M. T., H. Groeben, and J. Peters. "Corticosteroids and inhaled salbutamol in patients with reversible airway obstruction markedly decrease the incidence of bronchospasm after tracheal intubation." Anesthesiology 100.5 (2004): 1052-57.
- Stein, M. and E. L. Cassara. "Preoperative pulmonary evaluation and therapy for surgery patients." JAMA 211.5 (1970): 787-90.
- Tashkin, D. P. and C. B. Cooper. "The role of long-acting bronchodilators in the management of stable COPD." Chest 125.1 (2004): 249-59.
- Tsukada, K. et al. "Effect of perioperative steroid therapy on the postoperative course of patients with oesophageal cancer." Dig.Liver Dis. 38.4 (2006): 240-44.
- Willaert, W. et al. "What is the optimal treatment strategy for chronic obstructive pulmonary disease exacerbations?" Eur.Respir.J. 19.5 (2002): 928-35.
Evidence tabellen
|
Bibliografische referentie |
Mate van bewijs |
Studie type |
Aantal patiënten |
Inclusie criteria |
Interventie (incl. duur, dosering) |
Controle/vergelijking (incl. duur, dosering) |
Lengte follow-up |
Resultaten |
Overige opmerkingen |
|
Sauerland 2000 |
A1 |
MA |
? (51 RCT) |
Elective and trauma surgery (welke?) |
Perioperative single-shot high dose methylprednisolone (15-30 mg/kg) |
? |
? |
Significant reduction in pulmonary complications delta -3.5% (95% -1.0 to -6.1). Alleen indien multiple fracturen?? Hoe zat het met longfunctie? Nazoeken. |
Not associated with increase in incidence adverse effects.
Nog opvragen en lezen. |
|
Chaney 1998 |
|
RCT |
N=60 |
CABG and early tracheal extubation.
Only elective CABG.
PTS with preoperative steroids or previous lung surgery excluded |
Methylprednisonole 30 mg/kg i.v. during sternotomy and during initiation of cardiopulmonary bypass |
Placebo (same two times) |
? |
MP group: significant larger increase in AaDO2 and shunt. Compliance and dead space not sign. MP group time to tracheal extubation was prolonged 769 +/- 294 vs 604 +/- 315 min p=0.0.5 Klinische relevantie? |
AaDO2, compliance, shunt, dead space 4 times perioperatively first 10 min after intubation and last 60 min after arrival ICU.
In MP group more midazolam perioperative, while on ICU though not significant…
Never smokers 25-30%, only 2/30 used bronchodilators, no information on COPD.
Negative study. |
|
Mitsuta 2001 |
B |
CT |
N=10, astma n=5, no astma n=5 |
Surgery for lung cancer |
In vivo: Prednisonole 20 mg orally 2 days prior to surgery and 80 mg methylprednisonole iv before and after surgery in astma patients.
In vitro: lung tissue passively sensitized with serum atopic patient. |
In vivo: no steroids in non-astmatics. In vitro: lung tissue passively sensitized with serum atopic patient. In vitro treatment with dexamethasone. |
- |
Production of IL-5 and TNF-alpha was significantly suppressed by corticosteroid treatment in astma patients and sensitized tissue of non-astmatics with in vitro treatment.
Concl: corticosteroid treatment reduces airway hyperresponsiveness by suppressing the production of inflammatory cytokines. |
Slechts kleine aantallen, hoge dosis steroiden preoperatief, geen controlegroep met astma patiënten zonder corticosteroiden preOK: vonden auteurs niet ethisch.
Obv eerdere ervaringen van astma aanval tijdens chirurgie bij niet voorbereide stabiele astma patiënten. |
|
Nou 1998 |
B |
CT |
N=24 |
Advanced MS schedule for MVR. |
Salbutamol inhalation preoperatively and 6 months postoperatively. |
Placebo inhalation |
|
Salbutamol inhalation improves obstructive impairment in patients with MVR pre- and postoperatively. |
Nog opvragen en lezen. |
|
Schulse 1997 |
A2 |
RCT |
N=30 colonic surgery, 6 excluded (why?) --> n=24 |
Open colonic resection |
Methylprednisonole 90 min before induction of anaesthesia and epidural analgesia n =12. |
Placebo same time n=12 |
|
Single high dose MP may improve pulmonary function and reduce inflammatory response. |
Nog opvragen en lezen. |
|
Silvanus |
A2 |
RCT |
N=41, 3 armen |
Partially reversible airway obstruction (FEV1<70% p red and >10% rev., naive to antiobstructive treatment for at least 1 month). Surgery. |
Daily 5 days 3x2 puffs (0.2 mg) salbutamol n=16 or daily salbutamol combined with methylprednisonole 40 mg orally n=15. |
Two puffs of salbutamol 10 min before anesthesia n=10. |
|
Pre-treatment with salbutamol or salbutamol and MP improves LF within 1 day (FEV1 23-29% and VC 15-18%) Wheezing after tracheal intubation: 1/8 S/MP vs 7/9 S5 days vs 8/10 S single dose (p<0.05). |
In beide 5 dagen groepen 7 patiënten uit (kortere voorbereiding). Geen uitspraak te doen over lengte voorbereiding met steroiden obv deze studie. |
|
Su 2004 |
B |
Retrospective cohort design |
N=172 patients, 249 surgical procedures |
astma |
‘astma patients undergoing surgery’ |
‘General surgical population’ |
Between 1986 and 2002 |
240 procedures: preoperative corticosteroids: low incidence of perioperative complications |
Nog opvragen en lezen. |
|
Takeda 2003 |
B |
CT |
N=17 |
Subtotal esophagectomy, no circulatory, respiratory of ass metabolic diseases |
Methylprednisolone 10 mg/kg iv before surgery |
Saline iv before surgery |
Till POD3 |
BAL and plasma levels IL-6 ad IL-8 after operation and POD 1 Concl: preoperative MP may attenuate postoperative reduction of arterial oxygen saturation by suppressing release of cytokines. |
No information about diff in extubation (planned from POD3 in case of PF ratio>250, couch reflex and no rapid shallow breathing |
|
Tsukada 2005 |
|
|
N=37: n=21 2003-2004 with steroid vs n=15 2—2 historical control |
Oesophagal cancer surgery All japanese |
Methylprednisolone 250 mg 60 min before surgery = routine since 2003 |
No steroids = routine before 2003: historical control |
|
Days of intubation and systemic inflammatory response were sign shorter for steroid group: 3.9 MP vs 7.1 days CG, SIRS 0% MP vs 33% (5/15) CG. No diff in organ system/ surg complications. Mortality rate 0% both groups. |
Wederom kleine aantallen, historische controle. |
|
Vichitvejpaisal 1996 |
A2 |
RCT |
N=30 N=10 CG N=10 albuterol N=10 metaproterenol |
Males with COPD |
Nebulized albuterol 2,5 mg in 3 ml (10) Or nebulized metaproteronol 15 mg in 3 ml (10) 20 min after tracheal intubation |
Nebulized saline 3 ml = CG (10) 20 min after tracheal intubation |
|
|
Nog opvragen en lezen.
Geen Nederlandse toepassing |
|
Waller 1996 |
A2 |
RCT |
N=22 |
Elective CABG |
Terbutaline 0,5 mg sc 6 hourly for 48 hours following detubation n =11 |
N=11 nothing |
Till 5 days after extubation |
Spirometric variables decreased in both groups with 50% after extubation and increased in 5 days in similar fashion. No difference between groups. A-a DO2 gradient increased sign in both groups after extubation. In terbutaline group after 6 hours this change was eliminated (?) Nog nakijken wat hier precise bedoeld wordt. |
Betere oxygenatie echter geen info over tijd extubatie of complicaties?
Nog opvragen en lezen. |
|
Zielinski 2004 |
C |
Observationeel/ retrospectief |
N=620 (46 thymoma and 17 re-OK’s) |
Transsternal thymectomies for MG |
N=117 preoperatively steroids (more severe MG) |
N=503 no steroids |
1973-2002 |
Resp insuff needing ventilator: 46/503 9.1% no steroids vs 8/117 6.8% steroids p=0.4260.
Overall complication rates and wound healing sign better for steroid group 11.1% vs 30.6% CG. Welke comlicaties: wond heling/ dehiscentie en beademing bij elkaar geven sign meer complicaties in no steroid group. (tracheostoma vergelijkbaar in beide groepen). In loop vd tijd duidelijk afname complicaties vanaf 1991 ongeveer 7 % beide groepen, gebruik steroiden 7% tot 1980 en 25 % vanaf 1991. Mortality 0.8% all-in no-steroid group |
Selecte patiëntengroep! |
– Postoperatief –
|
Bibliografische referentie |
Mate van bewijs |
Studie type |
Aantal patiënten |
Inclusie criteria |
Interventie (incl. duur, dosering) |
Controle/vergelijking (incl. duur, dosering) |
Lengte follow-up |
Resultaten |
Overige opmerkingen |
|
Chaney 2001 |
|
RCT |
N=90 |
Elective cardiac surgery |
Methylprednisolone 30 mg/kg iv during sternotomy and same initiating cardiopulmonary bypass (30 MP) Same but 15 mg/kg MP (15MP) |
Saline same times |
|
|
Negative study |
|
Eren 2003 |
|
RCT |
N=20 2 armen |
Elective CABG and early tracheal extubation |
100 mg/kg NAC 1 hour before cardiopulmonary bypass and 40 mg/kg 24 hours after CPB iv n=10 |
Psychiologic salt solution continu iv 1 hour before and 24 hours after CPB n=10 |
- |
Both groups significant postoperative increases in A-a DO2, in NAC group lower increases (p<0.006) No significant diff in extubation time or other hemodynamic and pulmonary parameters |
Ander iv protocol?
Nog opvragen en lezen. |
|
Behr 2001 |
|
review |
|
|
|
|
|
Zie tekst, verwijzingen naar oudere studies: COPD preoperatief bronchodilatatie 1979! Rest herleid uit resultaten bij h=behandeling COPD/exacebaties en geen perioperatief onderzoek. Astma complicaties bij anesthesie 1963 en 1996. |
Stop roken als behandeling, 2 studies 1989 en 1998 (en ook in 1994). |
|
Groeben 2004 |
|
review |
|
|
|
|
|
Zie tekst ook verwijzing na eerder uitgewerkte studies en oudere publicaties. |
|
– Preoperatieve timing –
|
Bibliografische referentie |
Mate van bewijs |
Studie type |
Aantal patiënten |
Inclusie criteria |
Interventie (incl. duur, dosering) |
Controle/vergelijking (incl. duur, dosering) |
Lengte follow-up |
Resultaten |
Overige opmerkingen |
|
Bingol 2005 |
|
RCT |
N=40, 2 armen |
COPD pts (FEV1 57% pred beide groepen) undergoing elective CABG. Exclusie oa fam.atopie, pneumonie, pH<7.30, COPD treatment, IDDM, HF, concommitta nt valv.OK |
1dd20 mg oral prednisolone 10 days before surgery till dischager (every third day postop reduction dose0 n=20 |
1 dd oral placebo idem n=20 |
Between 2000 and 2003, 10 days preop till discharge |
After 10 days FEV1 63.2 pred vs 57.9 plac p 0.0001 (klinisch relevant?) In pred group sign shorter intubation time 6.8 vs 14.9, ICU stay 1.4 vs 5.2 and hospital stay 8.3 vs 12.95, no reintubation vs 4. |
|
|
Escolana 1996 |
|
CT |
N=138 |
Surgical patients |
Ranitidine 150 mg single dose orally 5 different groups in time of administration and 1 control group |
CG: geen ranitidine |
- |
Single oral dose of ranitidine 150 mg is effective against acid aspiration syndrome 60 min after administration |
Herkenbaar?
Nog opvragen en lezen.
Ref 3 editorial en 4 Duits review artikel?? |
- Opzet alle studies betreffen geen OK’s! -
|
Bibliografische referentie |
Mate van bewijs |
Studie type |
Aantal patiënten |
Inclusie criteria |
Interventie (incl. duur, dosering) |
Controle/vergelijking (incl. duur, dosering) |
Lengte follow-up |
Resultaten |
Overige opmerkingen |
|
Brocklebank 2001 |
A1 |
SR |
|
Astma/COPD |
|
|
|
Astma: pMDI for corticosteroid delivery (other devices not better) 21 studies. Beta-agonisten: geen verschil pMDI of DPI of autohaler. 70 studies nebulisers: geen verschil met andere devices COPD: Beta-agonist: geen verschil tussen MDI 2 studies. Bronchodilatator: nebuliser vs MDI; equivalence and no difference. Economisch: pMDI meest kosteneffectief bij astma. |
|
|
Cates 2000 and updates till jan 2006 |
A1 |
SR |
|
Acute astma |
Beta-agonisten |
|
|
MDI with holding chamber equally effective to nebuliser delivery. |
|
|
Dolovich 2005 |
A1 |
SR |
|
Astma/COPD |
Beta-agonisten/ anticholinergica/ ICS |
|
|
Nebulisers/ pMDI/ DPI equally effective |
ACCP guideline |
|
Ram 2003 |
A1 |
SR |
|
Stable astma |
Beta-agonisten |
|
|
No difference in effectiveness between devices |
|
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-03-2012
Een levende richtlijn is een richtlijn waarvan het onderhoud op continue basis plaatsvindt, op grond van systematische monitoring van zowel de medisch wetenschappelijke literatuur als praktijkgegevens en door gebruikers van de richtlijn aangeleverde commentaren. Voor deze richtlijn is de volgende procedure voor het actueel houden opgesteld.
De richtlijn preventie van perioperatieve pulmonale complicaties bij niet pulmonale chirurgie zal ten minste iedere 3 jaar worden getoetst aan de wetenschappelijke ontwikkelingen door een in 2008 samen te stellen multidisciplinaire commissie. De multidisciplinaire commissie bestaat uit een kerngroep en een werkgroep. De kerngroep draagt de verantwoordelijkheid om tussentijdse peilingen bij de beroepsgroepen te verrichten naar behoefte voor herziening(en) van de huidige richtlijn. Aangezien de richtlijn een evidence-based richtlijn is, waarvan de searches goed zijn gedaan en bekend zijn is afgesproken één keer per jaar de searches te ‘updaten’ om nieuwe ontwikkelingen te volgen. Bij essentiële ontwikkelingen kan besloten worden om de gehele richtlijnwerkgroep bij elkaar te roepen en tussentijdse elektronische amendementen te maken en deze onder de verschillende beroepsgroepen te verspreiden. Uiterlijk in 2012 zal de Nederlandse Vereniging van Anesthesiologie na raadpleging van of op advies van andere aan de richtlijn participerende verenigingen, bepalen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen als nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
- V&VN afdeling longverpleegkundigen
Deze richtlijn is tot stand gekomen in samenwerking met het Kwaliteitsinstituut voor de Gezondheidszorg CBO en met financiële steun van ZonMw.
Doel en doelgroep
Doelstelling
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen over de diagnostiek van risicofactoren en preventie van perioperatieve pulmonale complicaties bij niet-pulmonale chirurgie. De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en het maken van locale protocollen.
Een richtlijn is geen leerboek. De richtlijn richt zich alleen op de knelpunten die bij aanvang van het project zijn vastgesteld middels een knelpuntanalyse. De richtlijn beoogt dus niet volledig te zijn.
Doelgroep
De richtlijn is bestemd voor leden van de medische beroepsgroep, zoals anesthesiologen, intensivisten, chirurgen, thoraxchirurgen, vaatchirurgen, longartsen en huisartsen. Daarnaast is de richtlijn ook bedoeld voor fysiotherapeuten, anesthesiemedewerkers, (long/IC)verpleegkundigen en ziekenhuisapothekers.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordiging van anesthesiologen, intensivisten, chirurgen, thoraxchirurgen, longartsen, fysiotherapeuten, longverpleegkundigen en ziekenhuisapothekers.
Bij het samenstellen van de werkgroep werd rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de diverse betrokken verenigingen en instanties, alsmede met een spreiding al dan niet met academische achtergrond. De werkgroepleden waren gemandateerd door hun vereniging.
- Mw. dr. A. De Roode, anesthesioloog, Nederlandse Vereniging voor Anesthesiologie (voorzitter werkgroep)
- Mw. drs. A. Hagemeijer, adviseur, Kwaliteitsinstituut voor de Gezondheidszorg CBO
- Dr.R.H.H. van Balkom, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Drs. M. Beukema, internist, Nederlandsche Internisten Vereniging
- Mw. dr. C.A. Boot, thoraxchirurg, Nederlandse Vereniging voor Thoraxchirurgie
- Mw. dr. A.A. Broekema, anesthesioloog, Nederlandse Vereniging voor Anesthesiologie
- Dhr. R.A.H. van Duurling, verpleegkundig specialist longziekten, V&VN Longverpleegkundigen
- Dr. A.J. van ’t Hul, fysiotherapeut, Koninklijke Nederlandse Genootschap voor Fysiotherapie
- Dr. P.W.A. Kunst, longarts Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. D. Reis Miranda, intensive care arts, Nederlandse Vereniging voor Intensive Care
- Mw. drs. S.M. Mulder, anesthesioloog, Nederlandse Vereniging voor Anesthesiologie
- Dr. J.W.A. Oosterhuis, chirurg, Nederlandse Vereniging voor Heelkunde
- Mw. drs. O.C.J. Schuurbiers, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. E.W.G. Weber, anesthesioloog, Nederlandse Vereniging voor Anesthesiologie
Inbreng patiëntenperspectief
Er is een patiëntenversie van de richtlijn ontwikkeld. Deze is te vinden bij de aanverwante producten.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen.
De richtlijn wordt verspreid naar alle relevante beroepsgroepen en ziekenhuizen. Ook wordt een samenvatting van de richtlijn gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde, en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Ook is de richtlijn te downloaden vanaf de website van het CBO.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zijn aanbevelingen geformuleerd. Ook zijn indicatoren aangegeven aan de hand waarvan de implementatie kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren.
Werkwijze
De werkgroep werkte gedurende één jaar (8 vergaderingen) aan een conceptrichtlijntekst. In de voorbereidingsfase werd een knelpuntanalyse uitgevoerd. Aan 10 experts, vanuit verschillende specialismen (universitair en niet-universitair), werd een enquête voorgelegd, waarbij de respondenten uitgebreid in de gelegenheid werden gesteld zelf onderwerpen aan te dragen. De werkgroep destilleerde uit de reacties de in de richtlijn vermelde uitgangsvragen. Er werd besloten de werkgroep in vier subgroepen te verdelen, te weten preoperatief, perioperatief, peroperatief en postoperatief. Via systematische zoekopdrachten en reference checking is bruikbare literatuur verzameld. De werkgroepleden hebben de literatuur beoordeeld op inhoud en kwaliteit. Vervolgens werden teksten geschreven, waarin de beoordeelde literatuur werd verwerkt, die tijdens vergaderingen werden besproken en na verwerking van de commentaren werden geaccordeerd.
De uiteindelijke teksten vormden samen de conceptrichtlijn, die in november 2007 aan alle betrokken wetenschappelijke verenigingen werd aangeboden. Tevens werd men in staat gesteld om via de website van het Kwaliteitsinstituut voor de Gezondheidszorg CBO commentaar op de richtlijn te geven. De commentaren zijn in de definitieve versie van de richtlijn verwerkt.
Wetenschappelijke onderbouwing
De aanbevelingen in deze richtlijn zijn voor zover mogelijk gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht door het verrichten van systematische zoekacties. Er werd gezocht vanaf 1996 in Medline en de Cochrane database en vanaf 1997 in Embase tot maart 2007.
Voor alle uitgangsvragen werd de patiëntenpopulatie afgebakend met behulp van MeSH termen (Medical Subject Headings). Hierna is gevolgd inperking tot talen (meestal Duits, Nederlands, Engels en Frans). En tenslotte tot relevante studietypen. Dit laatste is gerealiseerd via zoekfilters voor systematische reviews, meta-analyses, randomized controlled trials en observatie studies. Omdat een aantal relevante publicaties review-artikelen of tijdschriftartikelen waren, is bij sommige zoekacties ook hierop ingeperkt.
Onder aanverwanten staat een overzicht van de belangrijkste specifieke trefwoorden die per uitgangsvraag gebruikt zijn. Op verzoek zijn de volledige zoekstrategieën beschikbaar.
Waar nodig werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur. Ook werden andere richtlijnen over dit onderwerp geraadpleegd.
Na selectie door de werkgroepleden bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De geselecteerde artikelen zijn vervolgens door de werkgroepleden beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is onderstaande indeling gebruikt. De meest belangrijke literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld, inclusief de mate van bewijs.
Om te komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs vaak nog andere aspecten van belang, bijvoorbeeld patiëntenvoorkeuren, kosten, beschikbaarheid (in verschillende echelons) of organisatorische aspecten. In de overige overwegingen speelt dus de ervaring en de mening van de werkgroepleden een rol. De ‘aanbeveling’ is het resultaat van de integratie van het beschikbare bewijs met de weergegeven overige overwegingen.
Indeling van methodologische kwaliteit van individuele studies.
|
|
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematisch review van tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau. |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang. |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad. |
Prospectief cohort onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controle onderzoek, cohort-onderzoek). |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd. |
Prospectief cohort onderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohort onderzoek of patiënt-controle onderzoek. |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
*Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Niveau van conclusies
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2. |
|
2 |
1 onderzoek van niveau A2 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B. |
|
3 |
1 onderzoek van niveau B of C. |
|
4 |
Mening van deskundigen. |
Het toepassen van deze tekstprincipes verhoogt de transparantie van de (aanbevelingen in) de richtlijn voor de lezer. Het bood daarnaast ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen door het gescheiden weergeven van ‘feiten’ naast ‘meningen’.
Noot
Deze richtlijn is opgesteld aan de hand van het “Appraisal of Guidelines for Research & Evaluation” (AGREE) instrument. Dit instrument is in een Europees verband opgesteld om de procedurele kwaliteit van richtlijnen te kunnen beoordelen. Door de aspecten van AGREE te verwerken in de inleiding van de richtlijn, wordt duidelijk aan welke kwaliteitseisen is voldaan.
Literatuur
- Kips JC. Preoperative pulmonary evaluation. Acta Clin. Belg. 1997;52:301-305
- Smetana GW, Conde MV. Pulmonary evaluation. In: Perioperative medicine, just the facts. p135-140. ed Cohn Sl, Smetana GW, Weed HG. McGraw-Hill, New York, 2006
- Eagle KA, Berger PB, Calkins RC et al. ACC/AHA guidelines update on perioperative cardiovascular evaluation for noncardiac surgery. A report of the American College of Cardiology/American Heart Association task force on practice guidelines (committee to update the 1996 guidelines on perioperative cardiovascular evaluation for noncardiac surgery) 2002. American College of Cardiology web site: http://www.acc.org/qualityandscience/clinical/guidelines/perio/clean/perio_index.htm
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
